1.本发明涉及茶制备技术领域,具体而言,涉及小叶苦丁乳杆菌发酵茶及其制备方法。
背景技术:
2.目前已有较多的专利公开了小叶苦丁茶的制备方法,其中也包括了采用发酵的方式处理小叶苦丁叶制备发酵茶,这些方法仍存在一些不足。例如申请号201911067434.2的一种发酵苦丁茶的生产方法,其公开了一种发酵苦丁茶的生产方法;包括以下步骤:采摘清洗、杀青、一次发酵、茶叶清理、二次发酵和筛选烘干,使加工成的发酵苦丁茶不仅保留了苦丁茶入口苦涩、量少味浓、耐冲泡的传统特点,还具备了红茶的醇和温润,帮助肠胃消化、促进食欲,有养胃护胃的功效,改善了传统加工方法不易将苦丁茶加工成发酵红茶的现状,且改变了传统苦丁茶寒凉的性质,使脾胃虚寒或患风寒感冒的人也适宜饮用苦丁茶。该方法采用三种生物学特性相差较大的真菌进行小叶苦丁的混菌发酵,一方面很难实现发酵过程的控制以及发酵终点的判断,导致工艺不稳定,每批次产品质量不一致;另一方面,该专利技术中未陈述具体的用于接种小叶苦丁叶发酵的种子状态(是液态种子还是固态种子,是孢子还是菌丝段或是菌丝球等)以及具体的发酵工艺,因此该技术实际并不成立,技术工艺的可执行性更无从提及。此外,上述相关专利未涉及细菌益生菌应用于小叶苦丁的发酵技术、工艺等的构建内容。
3.鉴于此,特提出本发明。
技术实现要素:
4.本发明的目的在于提供小叶苦丁乳杆菌发酵茶的制备方法和小叶苦丁乳杆菌发酵茶。
5.本发明是这样实现的:
6.第一方面,本发明提供一种小叶苦丁乳杆菌发酵茶的制备方法,包括:向杀青后的小叶苦丁叶上接种乳杆菌进行发酵,每克所述杀青后的小叶苦丁叶上接种大于或等于5
×
107cfu的乳杆菌,接种的乳杆菌是在培养时向培养基中添加有小叶苦丁提取物驯化后的乳杆菌;
7.将发酵后得到的小叶苦丁叶烘干。
8.在可选的实施方式中,所述用于驯化的乳杆菌为专利号为zl201610278215.9的专利菌株。
9.在可选的实施方式中,发酵温度为30~45℃,发酵时间为10~12h。
10.在可选的实施方式中,每克所述杀青后的小叶苦丁叶上接种(5~10)
×
107cfu乳杆菌;
11.优选地,接种所述乳杆菌的方式是向所述杀青后的小叶苦丁叶上接种乳杆菌种子液,所述乳杆菌种子液浓度为1(108cfu/ml,接种量为0.05~0.80ml/g。
12.在可选的实施方式中,在向杀青后的小叶苦丁叶上接种乳杆菌之前还包括培养驯化乳杆菌,培养驯化方式为:
13.将乳杆菌株活化,制成菌悬液,按照每100ml培养基接种(5~15)
×
108cfu乳杆菌的量将所述菌悬液接种至液体培养基中,所述液体培养基中含有占所述液体培养基体积1~2%的小叶苦丁叶提取液。
14.在可选的实施方式中,所述液体培养基的成分为:0.8~1.5wt%的葡萄糖、0.8~1.2wt%的蛋白胨、0.8~1.2wt%的牛肉膏、0.35~0.45wt%的酵母膏、0.45~0.55wt%的乙酸钠、1~2vt%的所述苦丁叶提取液以及余量的水。
15.在可选的实施方式中,培养温度为28~32℃,培养初始ph为5.8~6.3,培养时间为18~20h。
16.在可选的实施方式中,烘干是先在90~130℃下烘干至水分含量为25~40%,然后在60~95℃下烘干至水分不大于10%。
17.在可选的实施方式中,在向杀青后的小叶苦丁叶上接种乳杆菌之前还包括对鲜小叶苦丁叶进行杀青,杀青方式为:100~130℃,蒸汽杀青20~50min。
18.第二方面,本发明提供一种小叶苦丁乳杆菌发酵茶,采用如前述实施方式任一项所述的制备方法制得。
19.本发明具有以下有益效果:
20.通过上述设计的小叶苦丁乳杆菌发酵茶的制备方法,由于采用乳杆菌对小叶苦丁叶进行发酵,发酵后改变小叶苦丁茶的物质构成,乳杆菌代谢产物与小叶苦丁叶有效成分叠加,对人体生理功效产生叠加效果;最重要的是采用乳杆菌发酵小叶苦丁茶后可明显改善小叶苦丁茶的苦涩味,增强饮用性;而本技术提供的方法采用在小叶苦丁提取物环境下驯化后的乳杆菌,这样的乳杆菌接种至小叶苦丁叶上能够更好适应小叶苦丁叶发酵环境,实现高效、高质发酵。通过本技术提供的方法发酵制得的小叶苦丁茶冲泡后,汤色清亮,带有茶清香略带鲜香味,口感好。并且该方法简单、操作方便,还没有乙酸乙酯、乙醚等有机溶剂浸提过程,可避免有机溶剂引入导致的产品安全问题。
附图说明
21.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
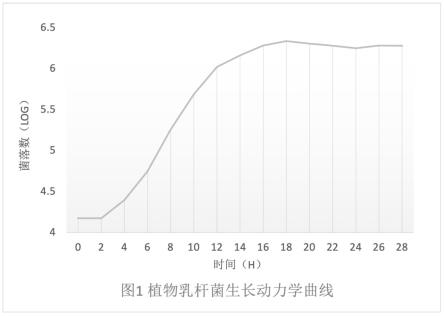
22.图1为本技术使用的乳杆菌的生长动力学曲线。
具体实施方式
23.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
24.下面对本发明实施例提供的小叶苦丁乳杆菌发酵茶及其制备方法进行具体说明。
25.本发明实施例提供的小叶苦丁乳杆菌发酵茶的制备方法,包括:
26.向杀青后的小叶苦丁叶上接种乳杆菌进行发酵,每克所述杀青后的小叶苦丁叶上接种大于或等于5
×
107cfu的乳杆菌,接种的乳杆菌是在培养时向培养基中添加有小叶苦丁提取物驯化后的乳杆菌;
27.将发酵后得到的小叶苦丁叶烘干。
28.本技术采用乳杆菌对小叶苦丁叶进行发酵,发酵后改变小叶苦丁茶的物质构成,乳杆菌代谢产物与小叶苦丁叶有效成分叠加,对人体生理功效产生叠加效果;最重要的是采用乳杆菌发酵小叶苦丁茶后可明显改善小叶苦丁茶的苦涩味,增强饮用性;而本技术提供的方法采用在小叶苦丁提取物环境下驯化后的乳杆菌,这样的乳杆菌接种至小叶苦丁叶上能够更好适应小叶苦丁叶发酵环境,实现高效、高质发酵。通过本技术提供的方法发酵制得的小叶苦丁茶冲泡后,汤色清亮,带有茶清香略带鲜香味,口感好。并且该方法简单、操作方便,还没有乙酸乙酯、乙醚等有机溶剂浸提过程,可避免有机溶剂引入导致的产品安全问题。
29.具体地,制备方法为:
30.s1、制备乳杆菌种子液
31.1)制备菌株
32.菌株:植物乳杆菌分类命名为:lactobacillus plantarum,保藏于中国典型培养物保藏中心cctcc,保藏编号为cctcc m 2016037,保藏日期为2016年1月14日。专利号为:zl201610278215.9。
33.在本技术优选的实施方式中选择上述乳杆菌作为发酵菌株,主要原因在于,这种乳杆菌是一种产酸能力强、耐酸性高、生长速率快的优质乳杆菌,采用这一乳杆菌进行发酵,发酵效率高,获得的小叶苦丁发酵茶口感改善明显。
34.2)确定培养时间过程所用的培养基:葡萄糖1.5~2wt%、蛋白胨1wt%、牛肉膏1wt%、酵母膏0.4wt%、柠檬酸三铵0.2wt%、乙酸钠0.5wt%、硫酸锰0.025wt%、硫酸镁0.058wt%、磷酸氢二钾0.2wt%、吐温0.1wt%、琼脂1.5%-2wt%、1l水,ph:4.5-6.5。固体培养基加琼脂,液体培养基不加琼脂。
35.3)种子液液体培养基:0.8~1.5wt%的葡萄糖、0.8~1.2wt%的蛋白胨、0.8~1.2wt%的牛肉膏、0.35~0.45wt%的酵母膏、0.45~0.55wt%的乙酸钠、1~2vt%的所述苦丁叶提取液以及余量的水。
36.例如可以是:0.8wt%的葡萄糖、1.2wt%的蛋白胨、0.8wt%的牛肉膏、0.45wt%的酵母膏、0.45wt%的乙酸钠、10ml小叶苦丁叶提取液以及990ml的水;
37.还可以是:1.5wt%的葡萄糖、0.8wt%的蛋白胨、1.2wt%的牛肉膏、0.35wt%的酵母膏、0.55wt%的乙酸钠、20ml小叶苦丁叶提取液以及980ml的水;
38.还可以是:1wt%的葡萄糖、1wt%的蛋白胨、1wt%的牛肉膏、0.4wt%的酵母膏、0.5wt%的乙酸钠、15ml小叶苦丁叶提取液以及985ml的水。
39.4)将植物乳杆菌斜面培养菌种用无菌水洗下,并调整至终浓度至2
×
108cfu备用。
40.5)确定种子液培养时间
41.将制备好的菌悬液按照每100ml培养基接种(5~15)
×
108cfu乳杆菌的量将菌悬液接种至上述2)中涉及到的液体培养基中,28~32℃培养28h,每2h取1次样,以时间与活菌
数的对数绘制植物乳杆菌的生长动力学曲线。如图1所示,0-2h为植物乳杆菌的潜伏期,2-18h为对数生长期,18h后为平稳期。因此,确定培养时间为超过18h,考虑到效率以及成本,确定培养时间为18~20h。
42.6)确定种子液的制备参数
43.采用添加小叶苦丁叶片提取物的种子培养基,选用l9(34)正交表进行4因素3水平的正交试验,研究植物乳杆菌菌株种子液制备条件。试验因子和水平如表1,实验方案如表2。按正交试验设计,将一级种子液分别按需要接种至种子液培养基,按试验设计的条件分别培养16h,取出,活菌计数,结果如表3所示。
44.表1植物乳杆菌菌株发酵正交实验表
[0045][0046]
表2植物乳杆菌菌株发酵正交实验方案
[0047][0048][0049]
表3植物乳杆菌菌株发酵正交实验结果
[0050][0051]
从上表可看出,四个因子对结果影响由大到小为c》b》a》d,即溶氧量》温度》初始ph》接种量。最优组合为c3b1a3d2,即当摇床转速为0rpm,培养温度为30℃,初始ph为6.0,接种量为8
×
108cfu时乳杆菌生长情况最好。由此确定培养温度为28~32℃,培养初始ph为5.8~6.3,接种量为(5~15)
×
108cfu。
[0052]
7)制备种子液
[0053]
将制备好的菌悬液按照每100ml培养基接种(5~15)
×
108cfu乳杆菌的量将菌悬液接种至上述3)中涉及到的液体培养基中,培养温度为28~32℃,培养初始ph为5.8~6.3,摇床转速为0的条件下,培养18~20h得到乳杆菌种子液。
[0054]
s2、小叶苦丁叶处理
[0055]
采摘4~9月的小叶苦丁叶片,或带叶枝条,通过机械取叶、弃枝条,叶片经清洗设备清洗、滤干,转至蒸汽杀青斧中在100~130℃(例如100℃、110℃或120℃)下,杀青20~50min(例如20min、30min或50min),然后从杀青斧转至输送带,冷却至30~45℃左右备用。
[0056]
s3、接种乳杆菌种子液
[0057]
在接种乳杆菌种子液之前先通过实验确定乳杆菌种子液的接种量:
[0058]
将植物乳杆菌种子液(1
×
109cfu/ml)按1%、2%、3%、4%、5%、6%、7%(ml/g)的接种量分别与杀青后的小叶苦丁叶片混匀,于30~35℃发酵,考察接种量对小叶苦丁叶片起酵快慢的影响,以刚能闻到香味计时,同时测定活菌数。每试验3个重复。结果见表4。
[0059]
表4不同接种量对起酵时间与活菌数的影响
[0060][0061]
通过上表可看出,接种量较低起酵时间也较长,但也存在接种量阈值,达到阈值后起酵时间基本保持稳定。根据实际生产的工艺与技术控制程度,接种量≥5%即能达到要求,因此,实际生产中可控制乳杆菌种子液接种量为5~10%。
[0062]
故此步骤的具体做法为:
[0063]
向杀青后的小叶苦丁叶上接种乳杆菌进行发酵,每克所述杀青后的小叶苦丁叶上接种大于或等于5
×
107cfu的乳杆菌,可采用浓度为1
×
109cfu/ml的乳杆菌种子液接种,接种量5~10%(ml/g)。
[0064]
s4、发酵
[0065]
种混匀后,将接种乳杆菌的小叶苦丁叶输送至发酵器或发酵槽中,在温度30~45℃(例如30℃、35℃或45℃)下发酵10~12h(例如10h、11h或12h)。
[0066]
在此温度和时间下发酵,可获得冲泡后汤色清亮,带有茶清香略带鲜香味的发酵茶。
[0067]
s5、烘干
[0068]
发酵结束后得到发酵小叶苦丁叶,将发酵小叶苦丁叶转移至烘干器中,先在90~130℃(例如90℃、110℃或120℃)下烘1~3min,至水分含量为25~40%,然后在60~95℃(例如60℃、80℃或95℃)下烘6~15h(例如6h、10h或15h),至水分不大于10%得到小叶苦丁发酵茶。
[0069]
本技术实施例提供一种小叶苦丁乳杆菌发酵茶,采用本发明实施例提供的制备方法制得,该发酵茶冲泡后汤色清亮,带有茶清香略带鲜香味,口感好。
[0070]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0071]
实施例
[0072]
采摘4~9月的小叶苦丁叶片,或带叶枝条,通过机械取叶、弃枝条,叶片经清洗设备清洗、滤干,转至蒸汽杀青斧中在100℃下蒸汽杀青20min,从杀青斧转至输送带,冷却至30~45℃备用。
[0073]
采用zl201610278215.9的专利菌株制备菌悬液,将制备好的菌悬液按照每100ml培养基接种1
×
109cfu乳杆菌的量将菌悬液接种至液体培养基中,培养温度为28~32℃,培养初始ph为5.8~6.3,摇床转速为0的条件下,培养18h得到乳杆菌种子液,此步骤中涉及到的液体培养基的成分为1.5wt%的葡萄糖、0.8wt%的蛋白胨、1.2wt%的牛肉膏、0.35wt%
的酵母膏、0.55wt%的乙酸钠、20ml小叶苦丁叶提取液以及980ml的水。
[0074]
向杀青后的小叶苦丁叶上接种乳杆菌种子液,每克杀青后的小叶苦丁叶上接种浓度为1
×
109cfu/ml的乳杆菌种子液,每克小叶苦丁叶接种0.05ml。
[0075]
接种混匀后,将接种酵母菌的小叶苦丁叶输送至发酵器中,在温度40℃下发酵12h。
[0076]
发酵结束后得到发酵小叶苦丁叶,将发酵小叶苦丁叶转移至烘干器中,先在100℃下烘2min,至水分含量为35%左右,然后在60℃下烘10h,至水分不大于10%得到小叶苦丁乳杆菌发酵茶。
[0077]
实验例1
[0078]
本实验例的目的在于验证小叶苦丁叶提取物对于乳杆菌种子液的培养是否有影响,以及乳杆菌驯化前后对于接种后活菌数的影响。
[0079]
根据植物乳杆菌的生长动力学曲线数据,以活菌数为指标,33
±
2℃培养,探讨在种子培养基中添加小叶苦丁叶片提取物对种子液培养16h时的活菌数与培养16h的种子液接种小叶苦丁发酵基质后培养33
±
2℃培养4h活菌数的影响。结果见表5。
[0080]
表5乳杆菌在不同种子培养基中的活菌数
[0081][0082]
注:1#:种子液培养基中未添加小叶苦丁叶片提取物,33
±
2℃培养16h的种子液;2#:种子液培养基中添加小叶苦丁叶片提取物,33
±
2℃培养16h的种子液;3#:种子液培养基中未添加小叶苦丁叶片提取物,33
±
2℃培养16h的种子液接种小叶苦丁发酵基质后培养33
±
2℃培养4h;4#:种子液培养基中添加小叶苦丁叶片提取物,33
±
2℃培养16h的种子液接种小叶苦丁发酵基质后培养33
±
2℃培养4h。
[0083]
从上表可看出,添加小叶苦丁叶片提取物到种子培养中对植物乳杆菌种子液活菌数没有显著影响(p》0.05)。但添加小叶苦丁叶片提取物的种子液接种小叶苦丁发酵基质后33
±
2℃再培养4h的活菌数显著高于(p《0.01)未添加的,是未添加的2倍多。这一结果表明,种子液培养基中添加小叶苦丁叶片提取物有利于菌种适应小叶苦丁发酵基质,缩短在新的生长环境中的适应时间。
[0084]
实验例2
[0085]
本实验例的目的在于验证发酵时间对于小叶苦丁酵母发酵茶口感的影响。
[0086]
提供多个实验组,这些实验组基本按照实施例提供的方法制备小叶苦丁乳杆菌发酵茶,与实施例唯一不同的地方在于发酵时间分别为:0h、4h、8h、10h、12h以及14h。分别称取各实验组制得的发酵茶3g沸水冲泡3min,观汤色,闻香气,品尝滋味。将结果记录至表6中。
[0087]
表6不同发酵时间的小叶苦丁茶感官差异
[0088][0089][0090]
注:1、“0”小时是指未接种的小叶苦丁基质;2、
“‑”
表示肉眼观测清亮,不浑浊。
[0091]
通过上表可看出,发酵10h~12h的小叶苦丁茶,无论是汤色、香气,还是苦、涩、回甘都明显优于未发酵的。但,发酵时间在14h~16h,汤色出现浑浊,且是发酵时间增长浊度增大。由以上实验结果表明,具有较佳感官指标的小叶苦丁叶片茶是通过乳杆菌发酵10~12h左右较好。
[0092]
实验例3
[0093]
本实验例的目的在于验证不同发酵时间对于abts清除率、dpph清除率以及抗脂质过氧化率的影响。
[0094]
提供多个实验组,这些实验组基本按照实施例提供的方法制备小叶苦丁乳杆菌发酵茶,与实施例唯一不同的地方在于发酵时间分别为:0h、4h、8h、10h、12h以及14h。取这些实验组制得的发酵茶为样品进行实验。
[0095]
1、abts自由基清除试验方法
[0096]
将2.5ml的abts(7mmol/l)与44μl的k2s2o8(140mmol/l)溶液充分混合均匀,于室温、避光条件下静置过夜(12h-16h),制备得到abts 的储备液。将abts 储备液用pbs缓冲液(20mmol/l,ph=7.4)稀释,再用紫外分光光度计进行测定,使其于紫外波长为734nm处的吸光度值为0.700 0.002,制备得到abts 工作液。分别取30ul各组待测样品与3.0mlabts 工作液混合,充分反应6min后,于波长734nm处常温条件下测定吸光度值。
[0097]
计算公式为:清除率=(a
空白-a
样品
)/a
空白
×
100%;
[0098]
式中:a空白为3.0mlabts 工作液加30ulpbs,测得的吸光度值:检测vc对照品时,将a样品换成a对照品即可。
[0099]
2、dpph自由基清除实验
[0100]
取不同样品0.5m l,加入浓度为0.2mmol/l的dpph
·
无水乙醇溶液1m l,混匀后在
室温下避光反应30min,并在6 000r/min下离心10min,取上清液在517nm下测定吸光度,平行测定3次,取平均值。空白组以等体积pbs缓冲液代替样品溶液,清除率为:
[0101]
清除率(%)=(a
空白-a
样品
)/a
空白
×
100%。
[0102]
3、脂质过氧化抑制实验
[0103]
在新鲜的鸡蛋黄中1︰1加入pbs,磁力搅拌10min后用pbs稀释成1:25的蛋黄悬液。取1ml蛋黄悬液,0.5ml样品,1ml pbs和1ml feso4(25mmol/l)溶液混匀,37℃保温1.5h。然后加入1ml三氯乙酸(tca,质量分数为2.5%),室温静置10min,3500r/min离心10min。取上清液加入2ml的硫代巴比妥酸(tba,质量分数为0.8%),充分混匀后沸水浴10min;冷却后于532nm处测定吸光度a1。a0用等量的样品溶剂(即pbs)代替样品(孙震,杨静秋.)其表达式为:
[0104]
脂质过氧化抑制率=(a
0-a1)/a0×
100%。
[0105]
4、发酵时间对小叶苦丁体外抗氧化活性的影响
[0106]
按照1-3中记载的方法进行实验,将实验结果记录至表7中。
[0107]
表7发酵时间对体外抗氧化活性的影响
[0108][0109]
通过体外抗氧化试验表明,发酵时间对小叶苦丁叶abts清除率影响不大,但dpph清除率与抗脂质过氧化随发酵时间的增长呈现上升趋势,10-12小时时显著高于未发酵组(p≤0.05),此时也是感官评价较好的时间,故发酵终点时间在为10-12h(见表6)。
[0110]
实验例4
[0111]
本实验例的目的在于验证发酵前后川皮苷、橄榄苦苷、异毛蕊花糖苷的含量变化。
[0112]
提供多个实验组,这些实验组基本按照实施例提供的方法制备小叶苦丁乳杆菌发酵茶,与实施例唯一不同的地方在于发酵时间分别为:0h、4h、8h、10h、12h以及14h。取这些实验组制得的发酵茶为样品进行实验。
[0113]
测各实验组川皮苷、橄榄苦苷、异毛蕊花糖苷的含量。将结果记录至表8中。
[0114]
表8川皮苷、橄榄苦苷以及异毛蕊花糖苷的含量
[0115][0116]
从表8可看出,乳杆菌可以转化合成川皮苷、橄榄苦苷、异毛蕊花糖苷,并随着发酵时间的增长其含量逐渐增高,尤其是4h之后至10h增长速率较快,之后增长速率减缓。
[0117]
因此,综合实验例2-4的实验结果可看出,本技术选择发酵时间为10-12可明显保证发酵茶的口感,以及其中活性物质具有较高含量。
[0118]
实验例5
[0119]
分别以普通酵母菌和普通乳杆菌在发酵制茶作为对比例,这两个对比例的其他操作条件与实施例完全相同。
[0120]
分别称取实施例和对比例制得的发酵茶3g沸水冲泡3min,观汤色,闻香气,品尝滋味。将结果记录至表9中。
[0121]
表9不同发酵菌株发酵的小叶苦丁茶感官差异
[0122][0123]
从表9可看出,采用普通酵母菌发酵制得的小叶苦丁茶,其冲泡后汤色浑浊度高,苦丁茶味里带有腐败味和淡淡的酒味口感较差;采用普通乳杆菌发酵制得的酵母茶,其汤色略微浑浊,苦丁茶清香中带淡淡的鲜香味,口感好;采用专利乳杆菌发酵制得的酵母茶,汤色清亮不浑浊,口感也好;由此可见,采用乳杆菌发酵可获得品质好的小叶苦丁酵母茶,特别是采用本技术特点的专利乳杆菌,可获得品质更好的小叶苦丁酵母茶。
[0124]
综上所述,本技术提供的小叶苦丁乳杆菌发酵茶的制备方法,由于采用乳杆菌对小叶苦丁叶进行发酵,发酵后改变小叶苦丁茶的物质构成,乳杆菌代谢产物与小叶苦丁叶有效成分叠加,对人体生理功效产生叠加效果;最重要的是采用乳杆菌发酵小叶苦丁茶后可明显改善小叶苦丁茶的苦涩味,增强饮用性;而本技术提供的方法采用在小叶苦丁提取物环境下驯化后的乳杆菌,这样的乳杆菌接种至小叶苦丁叶上能够更好适应小叶苦丁叶发酵环境,实现高效、高质发酵。通过本技术提供的方法发酵制得的小叶苦丁茶冲泡后,汤色清亮,带有茶清香略带鲜香味,口感好。
[0125]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技
术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。