1.本发明属于有机电致发光材料与器件技术领域,涉及一种有机荧光发光材料组合物及其应用;具体涉及一种基于室温有机磷光材料敏化荧光材料的组合物及其应用。
背景技术:
2.由于在智能手机、电视、可穿戴等显示及固态照明领域的广阔应用前景,近几十年来,有机电致发光二极管(oled:organic light emitting diodes)在科学界和产业界得到了广泛的研究和关注。根据量子自旋统计规则,基于(经典)有机荧光化合物制备的oled器件最多能利用25%电激发产生的单重态激子,在器件光输出效率为20-30%时,最大外量子效率为5.0-7.5%(假设荧光材料的光致发光效率为100%)。为了提高oled器件效率,如何有效利用其余75%的非辐射跃迁的三重态激子成为研究者关注的重点。其中,磷光电致发光器件的发现是oled发展史上一个里程碑式的成果,使得实现100%的器件内量子效率成为可能。目前,采用铱(ir)、铂(pt)等重金属配合物的磷光材料器件已实现了接近100%的内量子效率。但是,由于ir、pt等贵金属磷光材料资源有限,成本较高,因此开发基于廉价纯有机材料的三重态激子利用机制的oled器件成为目前研发的热点。近年来,基于热活化延迟荧光(tadf:thermally activated delayed fluorescence)机制的oled材料及器件引起了研究者的广泛关注。其利用具有较小单重激发态和三重激发态能级差(δest)的有机小分子材料,在环境热能作用下,三重态激子可以通过逆系间窜越(risc)过程上转换为单重态激子,进而发出延迟荧光。这一机制由于采用不含贵金属的纯有机小分子材料,使荧光型器件能有效地利用三重态激子的能量,器件外量子效率接近甚至达到了磷光器件的水平,对于有效节约资源、保护环境、降低生产成本和实现产业化具有重要意义。
3.与含有基于贵金属的磷光配合物及有机tadf材料的电致发光器件相比,基于不含有贵金属的纯有机室温磷光材料的电致发光器件发展严重滞后。人们早已经达成共识,有机室温磷光材料的研发是有机电致发光材料研发领域的重要方向,与传统的有机荧光材料相比,纯有机磷光材料能够通过单重激发态和三重激发态间的系间窜越及电子的自旋与轨道间的耦合实现磷光发射,由于磷光材料可以同时利用单重和三重激发态,因此以高发光效率磷光材料作为发光层的有机电致发光器件内量子效率可达100%。目前,纯的有机小分子呈现出的室温磷光行为还比较少见,发光效率也普遍较低,而且均局限于光致磷光发射的范围,限制了其进一步应用。唐本忠等人最早证明了,在晶体状态下,分子的振动和转动将受到抑制,进而降低了三线态激子的淬灭,使得磷光得以发射(w.z.yuan,x.y.shen,et al.j.phys.chem.c 2010,114,6090
–
6099);之后kim等人通过晶体设计以及直接的重原子效应,实现了蓝、绿、黄、橙等多种颜色的室温磷光发射(o.bolton,k.lee,et al.nature chemistry 2011,3,207
–
212);adachi等人通过将有机小分子重氢化后掺杂到无定型的主体分子中来实现有机小分子室温磷光发射(s.hirata,k.totani,et al.adv.funct.mater.2013,23,3386-3397)。最近,一些研究人员又相继报道了一些具有室温磷光发射特性的结晶材料体系(b.zhou,d.yan,adv.funct.mater.2019,29,1807599;
k.narushima,y.kiyota et al.,adv.mater.2019,1807268;s.tian,h.ma et al.,angew.chem.int.ed.2019,58,6645.)和无定型材料体系(z.lin,r.kabe et al.,adv.mater.2018,1803713;h.wu,w.chi et al.,adv.funct.mater.2019,29,1807243.)。上述无论是结晶型室温有机磷光材料和是无定型有机磷光材料均无法实现电致发光,主要原因在于:(1)结晶型室温有机磷光材料不适合制备有机电致发光器件,因为有机电致发光器件属于薄膜结构器件,有机材料形成薄膜是主要是采用无定型状态,或者是结晶度很低的状态,这事就体现不出室温磷光特性或者体现出效率很低的磷光特性;(2)已经发现的无定型室温有机磷光材料均是将有机发光分子掺杂在无定型有机或者聚合物主体材料中才能显示磷光特性,但是所用的无定型主体材料均属于不具有半导体导电特性的惰性材料,这种材料不适合制备有机电致发光材料的发光层,因为无法实现载流子的注入及传输,也就无法实现电致发光。2019年,王悦等报道了基于室温有机磷光薄膜材料的有机电致发光器件(j.wang,j.liang,y.xu,b.liang,j.wei,c.li,x.mu,k.ye,y.wang,j.phys.chem.lett.2019,10,5983),其电致磷光外量子效率达到11.5%。如何设计合成及制备具有室温磷光特性的纯有机化合物并使其适合制备电致磷光器件,有待于进一步突破。另外,如何基于室温有机材料通过优化材料组合获得高效率有机电致发光器件,是另一个有待于解决的重要技术问题,这属于性能由较低到较高、直至有应用前景的技术提升与完善性的过程。
4.在范围广大的有机发光材料家族中(经典)有机荧光化合物(不包括tadf材料)占有非常重要的地位且种类繁多,很多(经典)有机荧光化合物具有激发态寿命短(几纳秒至几十纳秒)、浓度较稀的状态下光致发光效率高(80-100%)等优点,这些性质对于制备高性能有机电致发光器件有利。但是,由于(经典)有机荧光化合物单重激发态的光物理本质(直接利用荧光材料通过简单的主/客体掺杂制备发光层时,器件的理论内量子效率极限值是25%)制备的电致)严重限制了其在有机电致发光技术领域中的应用。如何通过创造一些技术方法和方案使(经典)有机荧光化合物实现高效率电致发光是一个尚未被解决的重要技术难题。
技术实现要素:
5.本发明所要解决的问题是现有的(经典)有机荧光化合物电致发光效率偏低的技术难题,而提供了一种基于室温纯有机磷光材料敏化经典有机磷光材料来提高电致荧光效率的方法,并提供了一种由三嗪类有机主体材料、吩噻嗪类有机磷光化合物和(经典)有机荧光化合物形成的发光组合物及其应用。本发明涉及的基于三嗪类有机主体材料、吩噻嗪类有机磷光化合物和(经典)有机荧光化合物形成的发光组合物用于制备有机电致发光器件的发光层,由此制备的有机电致发光器件实现了高效率有机电致荧光器件的发现。
6.本发明是通过下述技术方案来解决上述技术问题的。
7.本发明提供了一种有机荧光发光组合物,其包括以下以质量份数计的各组分:3.0-15.0份吩噻嗪类有机磷光化合物,0.3-5.0份(经典)有机荧光化合物,96.7-80.0份三嗪类有机主体材料;所述的(经典)有机荧光化合物的发光峰位于550-580nm之间。
8.在本发明一实施方案中,所述有机荧光发光组合物中,其包括以下以质量份数计的各组分:10份所述吩噻嗪类有机磷光化合物;0.3-1.0份所述(经典)有机荧光化合物,
89.0-89.7份所述的三嗪类有机主体材料;
9.例如,10份所述的吩噻嗪类有机磷光化合物;0.5份所述的(经典)有机荧光化合物,89.5份所述的三嗪类有机主体材料;
10.或,10份所述的吩噻嗪类有机磷光化合物;0.3份所述的(经典)有机荧光化合物,89.7份所述的三嗪类有机主体材料;
11.或,10份所述的吩噻嗪类有机磷光化合物;1.0份所述的(经典)有机荧光化合物,89.0份所述的三嗪类有机主体材料。
12.在本发明一实施方案中,所述有机荧光发光组合物由所述的吩噻嗪类有机磷光化合物、所述的(经典)有机荧光化合物和所述的三嗪类有机主体材料组成。
13.在本发明一实施方案中,所述的有机荧光发光组合物中,所述的吩噻嗪类有机磷光化合物含量为3.0-15.0wt%(重量百分比浓度)、所述的(经典)有机荧光化合物含量为0.3-5.0wt%、其余成分为所述的三嗪类有机主体材料(含量:96.7-80.0wt%);
14.例如,所述的吩噻嗪类有机磷光化合物含量为10.0wt%(重量百分比浓度)、所述的(经典)有机荧光化合物含量为0.5wt%、其余成分为所述的三嗪类有机主体材料(含量:89.5wt%);
15.或,所述的吩噻嗪类有机磷光化合物含量为10.0wt%(重量百分比浓度)、所述的(经典)有机荧光化合物含量为0.3wt%、其余成分为所述的三嗪类有机主体材料(含量:89.7wt%);
16.或,所述的吩噻嗪类有机磷光化合物含量为10.0wt%(重量百分比浓度)、所述的(经典)有机荧光化合物含量为1.0wt%、其余成分为所述的三嗪类有机主体材料(含量:89.0wt%)。
17.在本发明的某一实施方案中,所述有机荧光发光组合物中,含有1-2种所述的三嗪类有机主体材料;当含有两种所述的三嗪类有机主体材料时,其相对重量比可为1:5-5:1。
18.在本发明的某一实施方案中,所述有机荧光发光组合物中,含有1-2种所述的吩噻嗪类有机磷光化合物;当含有两种所述的吩噻嗪类有机磷光化合物时,其相对重量比可为1:5-5:1。
19.在本发明的某一实施方案中,所述有机荧光发光组合物中,含有1种(经典)所述的有机荧光化合物。
20.在本发明的某一实施方案中,所述有机荧光发光组合物中,含有1-2种所述的三嗪类有机主体材料(含量:96.7-80.0wt%,当含有两种所述的三嗪类有机主体材料时,其相对重量比为1:5-5:1)、1-2种所述的吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,当含有两种所述的吩噻嗪类有机磷光化合物时,其相对重量比为1:5-5:1)及1种(经典)所述的有机荧光化合物(含量:0.3-5.0wt%)。
21.所述有机荧光发光组合物中,所述的三嗪类有机主体材料可为本领域常规的三嗪类有机主体材料;在本发明的某一实施方案中,所述的三嗪类有机主体材料的分子结构为如下所示通式trz-i、trz-ii或trz-iii所示,
[0022][0023]r4a
、r
5a
各自相同或者不同,r
4a
和r
5a
独立地为氢、氘、f、cn、c
1-c8烷基、c
1-c8烷基-o-、c
6-c
18
芳基、c
1-c8烷基取代的c
6-c
18
芳基或c
1-c8烷基-o-取代的c
6-c
18
的芳基;
[0024]r1a
、r
1b
、r
2a
和r
3a
中的1个或2个独立地为r
tz
;
[0025]r1a
、r
1b
、r
2a
和r
3a
中余者独立地为氢、氘、f、cn、c
1-c8烷基、c
1-c8烷基-o-、c
6-c
18
芳基、c
1-c8烷基取代的c
6-c
18
芳基或c
1-c8烷基-o-取代的c
6-c
18
的芳基;
[0026]rtz
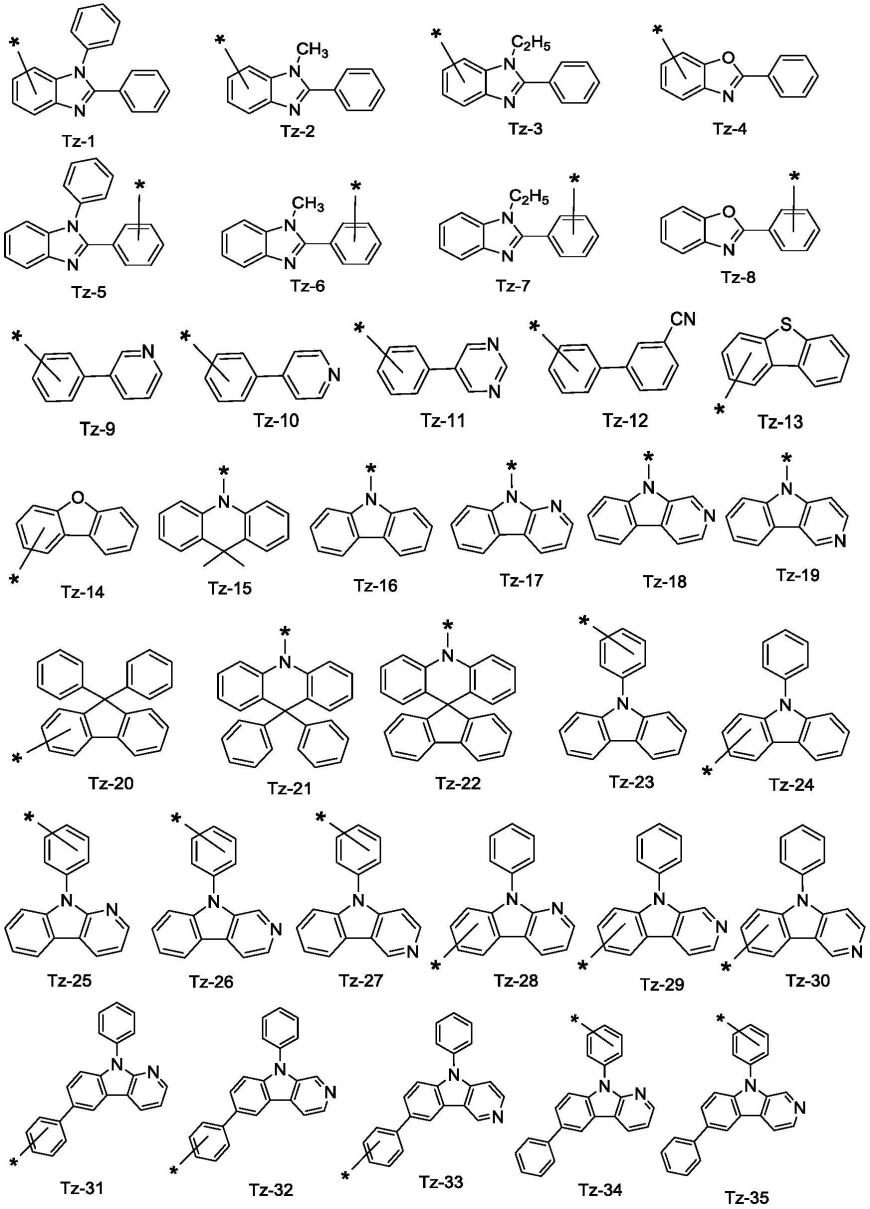
独立地为如下式所示的基团tz-n(n=1-68)中的任何一种:
[0027]
[0028]
[0029][0030]
所述有机荧光发光组合物中,所述的吩噻嗪类有机磷光化合物可为本领域常规的基于吩噻嗪取代萘的室温磷光化合物;在本发明的某一实施方案中,所述的吩噻嗪类有机磷光化合物的分子结构为如下通式pht-i或pht-ii所示,
[0031][0032]
其中,r1、r2、r3各自相同或不同,r1、r2和r3独立地为氢、氘、c
1-c8烷基、c
1-c8烷基-o-、c
1-c4烷基-o-c
1-c4亚烷基、c
6-c
24
芳基或被1-3个c
1-c8烷基取代的c
6-c
24
芳基;
[0033]r11
各自相同或者不同、r
11
独立地为h、氘、c
1-c8烷基、c
1-c8烷基-o-。
[0034]
所述有机荧光发光组合物中,所述的(经典)有机荧光化合物可为本领域常规的(经典)有机荧光化合物,例如并四苯类有机荧光化合物(例如分子结构通式如下f-i所示)、荧蒽类有机荧光化合物(例如分子结构通式如下f-ii所示)、咔唑类有机荧光化合物(例如分子结构通式如下f-iii、f-iv所示)、罗丹明类有机荧光化合物(例如分子结构通式如下f-v所示)、丙二腈类有机荧光化合物(例如分子结构通式如下f-vi所示)、香豆素类有机荧光化合物(例如分子结构通式如下f-vii所示)、二氟化硼类有机荧光化合物(例如分子结构通式如下f-viii所示);
[0035]
在本发明的某一实施方案中,所述的(经典)有机荧光化合物分子结构通式如下f-i、f-ii、f-iii、f-iv、f-v、f-vi、f-vii或f-viii所示:
[0036][0037]
f-i中,r
1r
、r
2r
、r
3r
各自相同或者不同,r
1r
、r
2r
和r
3r
独立地为氢、氘、f、cf3、c
1-c8烷基、c
1-c8烷基-o-或c
6-c
14
芳基;
[0038]
f-ii中,r
1f
、r
2f
、r
3f
各自相同或者不同,r
1f
、r
2f
和r
3f
独立地为h、f、cf3、c
1-c8烷基、c
1-c8烷基-o-、3-7元环烷基、c
6-c
18
芳基或c
6-c
18
芳基-c
1-c4亚烷基;
[0039]
f-iii、f-iv中,r
ph1
、r
ph2
各自相同或者不同,r
ph1
和r
ph2
独立地为c
6-c
24
的芳基、c
1-c8烷基取代的c
6-c
24
的芳基、3-7元环烷基取代的c
6-c
24
的芳基或当r
ph1
和r
ph2
独立地为c
6-c
24
的芳基、c
1-c8烷基取代的c
6-c
24
的芳基、3-7元环烷基取代的c
6-c
24
的芳基时,与所连接的苯环通过单键或者并环连接;
[0040]
f-iii、f-iv中,r
en1
、r
en2
、r
en3
各自相同或者不同,r
en1
、r
en2
和r
en3
独立地为h、c
1-c8烷基、c
6-c
18
的芳基;
[0041]
或者,r
en2
和所连接的苯环共同形成
[0042]
f-v中,r
q1
独立地为c
1-c
12
烷基;
[0043]rq2
、r
q3
各自相同或者不同,r
q2
和r
q3
独立地为h、f或cf3;
[0044]
f-vi中,r
al
为:*-ch3、
[0045]rdc
为下列基团中的任一种:
[0046][0047]
f-vii中,rg为或*-cn;
[0048]r1d
、r
2d
各自相同或不同,r
1d
和r
2d
独立地为h、f、cf3、c
1-c8烷基、c
1-c8烷基-o-或c
6-c
18
芳基;
[0049]
f-viii中,r
h1
、r
h2
、r
h3
各自相同或者不同,r
h1
、r
h2
和r
h3
独立地为c
1-c6烷基、c
6-c
18
芳基或
[0050]
在本发明某些优选实施方案中,所述的如式trz-i、trz-ii、trz-iii、pht-i、pht-ii、f-i、f-ii、f-iii、f-iv、f-v、f-vi、f-vii和f-viii所示的化合物中的某些基团如下定义,未提及的基团同本技术任一方案所述(以下简称“在本发明的某一实施方案中”)。
[0051]
在本发明的某一实施方案中,
[0052]r1a
、r
1b
、r
2a
和r
3a
中的1个或2个独立地为r
tz
;
[0053]r1a
、r
1b
、r
2a
和r
3a
中余者独立地为氢、cn、c
6-c
18
芳基;
[0054]
例如氢、cn、苯基或联苯(例如)。
[0055]
在本发明的某一实施方案中,
[0056]r4a
和r
5a
独立地为氢、cn、c
6-c
18
芳基;
[0057]
例如氢、苯基。
[0058]
在本发明的某一实施方案中,r
tz
独立地为如下式所示的基团中的任何一种:
[0059]
(例如),(例如),
(例如),(例如),),(例如),(例如),(例如),(例如),(例如),(例如),(例如),(例如))(例如),(例如),(例如);例如
[0060]
在本发明的某一实施方案中,
[0061]
r1、r2和r3独立地为氢、c
1-c8烷基、c
1-c4烷基-o-c
1-c4亚烷基、c
6-c
24
芳基或被1-3个c
1-c8烷基取代的c
6-c
24
芳基;
[0062]
例如氢、c
1-c4烷基、c
1-c4烷基-o-c
1-c4亚烷基、c
6-c
10
芳基或被1-3个c
1-c8烷基取代的c
6-c
10
芳基;
[0063]
又例如氢、甲基、正丙基、异丙基、正丁基、ch
3-o-ch
2-、ch
3-o-ch
2-ch
2-、苯基、间甲基苯基或间二甲基苯基。
[0064]
在本发明的某一实施方案中,
[0065]r11
独立地为氢、c
1-c8烷基;
[0066]
例如氢、甲基、乙基、正丙基、异丙基、正丁基、叔丁基。
[0067]
在本发明的某一实施方案中,
[0068]r1r
、r
2r
和r
3r
独立地为氢、f、cf3、c
1-c8烷基或c
6-c
14
芳基;
[0069]
例如氢、f、甲基、叔丁基、cf3、苯基。
[0070]
在本发明的某一实施方案中,
[0071]r1f
、r
2f
和r
3f
独立地为氢、c
1-c8烷基、3-7元环烷基、c
6-c
18
芳基或c
6-c
18
芳基-c
1-c4亚烷基;
[0072]
例如氢、甲基、异丙基、叔丁基、环己基、苯基或
[0073]
在本发明的某一实施方案中,
[0074]rph1
和r
ph2
独立地为c
6-c
24
的芳基、c
1-c8烷基取代的c
6-c
24
的芳基、3-7元环烷基取代的c
6-c
24
的芳基或
[0075]
例如苯基、萘基(例如)、联苯(例如)、)、
[0076]
在本发明的某一实施方案中,
[0077]ren1
、r
en2
和r
en3
独立地为h、c
1-c8烷基、c
6-c
18
的芳基;或者,r
en2
和所连接的苯环共同形成
[0078]
例如r
en1
、r
en2
和r
en3
独立地为h、叔丁基、苯基、萘基(例如)、联苯(例如)、联苯(例如;或者,r
en2
和所连接的苯环共同形成在本发明的某一实施方案中,
[0079]rq1
独立地为c
1-c
12
烷基;例如甲基、正丁基。
[0080]
在本发明的某一实施方案中,
[0081]rq2
和r
q3
独立地为氢、f、cf3。
[0082]
在本发明的某一实施方案中,
[0083]ral
为*-ch3或
[0084]
在本发明的某一实施方案中,
[0085]r1d
和r
2d
独立地为h。
[0086]
在本发明的某一实施方案中,
[0087]rdc
为例如在本发明的某一实施方案中,
[0088]
rg为或*-cn;例如*-cn。
[0089]
在本发明的某一实施方案中,
[0090]rh1
、r
h2
和r
h3
独立地为c
1-c6烷基或c
6-c
18
芳基;例如甲基、苯基或
[0091]
在本发明的某一实施方案中,
[0092]
所述的吩噻嗪类有机磷光化合物为通式pht-i所示。
[0093]
在本发明的某一实施方案中,
[0094]
所述的三嗪类有机主体材料如通式trz-i、trz-ii、trz-iii所示,其中,r
tz
独立地为
[0095]
在本发明的某一实施方案中,
[0096]
所述的(经典)有机荧光化合物分子结构可为如通式f-i所示。
[0097]
在本发明的某一实施方案中,
[0098]
当r
1a
、r
1b
、r
2a
和r
3a
独立地为c
1-c8烷基、c
1-c8烷基-o-、c
1-c8烷基取代的c
6-c
18
芳基或c
1-c8烷基-o-取代的c
6-c
18
的芳基时,所述的c
1-c8烷基、c
1-c8烷基-o-、c
1-c8烷基取代的c
6-c
18
芳基和c
1-c8烷基-o-取代的c
6-c
18
的芳基里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0099]
在本发明的某一实施方案中,
[0100]
当r
1a
、r
1b
、r
2a
和r
3a
独立地为c
6-c
18
芳基、c
1-c8烷基取代的c
6-c
18
芳基或c
1-c8烷氧基
取代的c
6-c
18
的芳基时,所述的c
6-c
18
芳基、c
1-c8烷基取代的c
6-c
18
芳基和c
1-c8烷氧基取代的c
6-c
18
的芳基里的c
6-c
18
的芳基为苯基、萘基(例如)或联苯(例如)或联苯(例如)。
[0101]
在本发明的某一实施方案中,
[0102]
当r
4a
和r
5a
独立地为c
1-c8烷基、c
1-c8烷基-o-、c
1-c8烷基取代的c
6-c
18
芳基或c
1-c8烷基-o-取代的c
6-c
18
的芳基时,所述的c
1-c8烷基、c
1-c8烷基-o-、c
1-c8烷基取代的c
6-c
18
芳基和c
1-c8烷基-o-取代的c
6-c
18
的芳基里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0103]
在本发明的某一实施方案中,
[0104]
当r
4a
和r
5a
独立地为c
6-c
18
芳基、c
1-c8烷基取代的c
6-c
18
芳基或c
1-c8烷氧基取代的c
6-c
18
的芳基时,所述的c
6-c
18
芳基、c
1-c8烷基取代的c
6-c
18
芳基和c
1-c8烷氧基取代的c
6-c
18
的芳基里的c
6-c
18
的芳基为苯基、萘基(例如)或联苯(例如)。
[0105]
在本发明的某一实施方案中,
[0106]
当r1、r2和r3独立地为c
1-c8烷基、c
1-c8烷基-o-或被1-3个c
1-c8烷基取代的c
6-c
24
芳基时,所述的c
1-c8烷基、c
1-c8烷基-o-和被1-3个c
1-c8烷基取代的c
6-c
24
芳基里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0107]
在本发明的某一实施方案中,
[0108]
当r1、r2和r3独立地为c
1-c4烷基-o-c
1-c4亚烷基时,其中的c
1-c4烷基为甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基,例如甲基、乙基、正丙基、异丙基或正丁基。
[0109]
在本发明的某一实施方案中,
[0110]
当r1、r2和r3独立地为c
1-c4烷基-o-c
1-c4亚烷基时,其中的c
1-c4亚烷基为-ch
2-、-ch2ch
2-、-ch(ch3)-、ch(ch3)ch
2-或-c(ch3)
2-;例如-ch
2-。
[0111]
在本发明的某一实施方案中,
[0112]
当r1、r2和r3独立地为c
6-c
24
芳基或被1-3个c
1-c8烷基取代的c
6-c
24
芳基时,所述的c
6-c
24
芳基和被1-3个c
1-c8烷基取代的c
6-c
24
芳基里的c
6-c
24
芳基为苯基、萘基(例如)或联苯(例如)。
[0113]
在本发明的某一实施方案中,
[0114]
当r
11
独立地为c
1-c8烷基、c
1-c8烷基-o-时,所述的c
1-c8烷基、c
1-c8烷基-o-里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0115]
在本发明的某一实施方案中,
[0116]
当r
1r
、r
2r
和r
3r
独立地为c
1-c8烷基、c
1-c8烷基-o-时,所述的c
1-c8烷基、c
1-c8烷基-o-里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0117]
在本发明的某一实施方案中,
[0118]
当r
1r
、r
2r
和r
3r
独立地为c
6-c
14
芳基时,所述的c
6-c
14
芳基为苯基、萘基(例如)或联苯(例如)。
[0119]
在本发明的某一实施方案中,
[0120]
当r
1f
、r
2f
和r
3f
独立地为c
1-c8烷基、c
1-c8烷基-o-时,所述的c
1-c8烷基、c
1-c8烷基-o-里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如为c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0121]
在本发明的某一实施方案中,
[0122]
当r
1f
、r
2f
和r
3f
独立地为3-7元环烷基时,所述的3-7元环烷基独立地为环丙基、环丁基、环戊基、环己基或环庚基;例如环己基。
[0123]
在本发明的某一实施方案中,
[0124]
当r
1f
、r
2f
和r
3f
独立地为c
6-c
18
芳基、c
6-c
18
芳基-c
1-c4亚烷基时,所述的c
6-c
18
芳基和c
6-c
18
芳基-c
1-c4亚烷基里的c
6-c
24
的芳基独立地为苯基、萘基(例如)或联苯(例如)。
[0125]
在本发明的某一实施方案中,
[0126]
当r
1f
、r
2f
和r
3f
独立地为c
6-c
18
芳基-c
1-c4亚烷基时,其中的c
1-c4亚烷基独立地为-ch
2-、-ch2ch
2-、-ch(ch3)-、ch(ch3)ch
2-或-c(ch3)
2-;例如-c(ch3)
2-。
[0127]
在本发明的某一实施方案中,
[0128]
当r
ph1
和r
ph2
独立地为c
6-c
24
的芳基、c
1-c8烷基取代的c
6-c
24
的芳基、3-7元环烷基取代的c
6-c
24
的芳基时,所述的c
6-c
24
的芳基、c
1-c8烷基取代的c
6-c
24
的芳基和3-7元环烷基取代的c
6-c
24
的芳基里的c
6-c
24
芳基为苯基、萘基(例如)或联苯(例如
)。
[0129]
在本发明的某一实施方案中,
[0130]
当r
ph1
和r
ph2
独立地为c
1-c8烷基取代的c
6-c
24
的芳基时,其中c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如为c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0131]
在本发明的某一实施方案中,
[0132]
当r
ph1
和r
ph2
独立地为3-7元环烷基取代的c
6-c
24
的芳基时,其中3-7元环烷基独立地为环丙基、环丁基、环戊基、环己基或环庚基;例如环己基。
[0133]
在本发明的某一实施方案中,
[0134]
当r
en1
、r
en2
和r
en3
独立地为c
1-c8烷基时,所述的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如为c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0135]
在本发明的某一实施方案中,
[0136]
当r
en1
、r
en2
和r
en3
独立地为c
6-c
18
的芳基时,所述的c
6-c
18
的芳基为苯基、萘基(例如)或联苯(例如)。
[0137]
在本发明的某一实施方案中,
[0138]
当r
q1
独立地为c
1-c
12
烷基时,所述的c
1-c
12
烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0139]
在本发明的某一实施方案中,
[0140]
当r
1d
和r
2d
独立地为c
1-c8烷基、c
1-c8烷基-o-时,所述的c
1-c8烷基和c
1-c8烷基-o-里的c
1-c8烷基独立地为c1~c6烷基(例如甲基、乙基、正丙基、异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基),例如为c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),又例如甲基、乙基、正丙基、异丙基或正丁基。
[0141]
在本发明的某一实施方案中,
[0142]
当r
1d
和r
2d
独立地为c
6-c
18
芳基时,所述的c
6-c
18
的芳基为苯基、萘基(例如)或联苯(例如)。
[0143]
在本发明的某一实施方案中,
[0144]
当r
h1
、r
h2
和r
h3
独立地为c
1-c6烷基时,所述的c1~c6烷基(例如甲基、乙基、正丙基、
异丙基、正丁基、叔丁基、仲丁基、异丁基、戊基或己基)为c1~c4的烷基(例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基或叔丁基),例如甲基、乙基、正丙基、异丙基或正丁基。
[0145]
在本发明的某一实施方案中,
[0146]
当r
h1
、r
h2
和r
h3
独立地为c
6-c
18
的芳基时,所述的c
6-c
18
芳基为苯基、萘基(例如或联苯(例如)。
[0147]
在本发明的某一实施方案中,
[0148]
当r1、r2和r3独立地为c
1-c4烷基-o-c
1-c4亚烷基时,可独立地为ch
3-o-ch
2-、ch
3-o-ch
2-ch
2-。
[0149]
在本发明的某一实施方案中,
[0150]
当r1、r2和r3独立地为被1-3个c
1-c8烷基取代的c
6-c
24
芳基时,可独立地为被1-2个c
1-c4烷基取代的苯基,例如间甲基苯基、间二甲基苯基。
[0151]
在本发明的某一实施方案中,
[0152]
当r
1f
、r
2f
和r
3f
独立地为c
6-c
18
芳基-c
1-c4亚烷基时,可独立地为
[0153]
在本发明的某一实施方案中,
[0154]
当r
ph1
和r
ph2
独立地为c
1-c8烷基取代的c
6-c
24
的芳基时,可独立地为
[0155]
在本发明的某一实施方案中,
[0156]
当r
ph1
和r
ph2
独立地为3-7元环烷基取代的c
6-c
24
的芳基时,可独立地为
[0157]
在本发明的某一实施方案中,
[0158]
所述的三嗪类有机主体材料分子为如下任一结构所示:
[0159]
[0160]
[0161]
[0162][0163]
在本发明的某一实施方案中,
[0164]
所述的吩噻嗪类有机磷光化合物为如下任一结构所示:
[0165]
[0166]
[0167]
[0168]
[0169]
[0170]
[0171][0172]
在本发明的某一实施方案中,
[0173]
所述的(经典)有机荧光化合物为如下任一结构所示:
[0174]
[0175]
[0176]
5:1)、1-2种吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,当含有两种吩噻嗪类有机磷光化合物时,其相对重量比为1:5-5:1)及1种(经典)有机荧光化合物(含量:0.3-5.0wt%),其中,所述的三嗪类有机主体材料分子结构为如通式trz-1至trz-24所示,所述的吩噻嗪类有机磷光化合物的分子结构为如通式pht-i和pht-ii所示,所述的(经典)有机荧光化合物分子结构如通式f-i、f-ii和f-iii所示。
[0185]
在本发明的某一实施方案中,所述的有机荧光发光组合物含有1-2种三嗪类有机主体材料(含量:96.7-80.0wt%,当含有两种三嗪类有机主体材料时,其相对重量比为1:5-5:1)、1-2种吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,当含有两种吩噻嗪类有机磷光化合物时,其相对重量比为1:5-5:1)及1种(经典)有机荧光化合物(含量:0.3-5.0wt%),其中,所述的三嗪类有机主体材料分子结构为如式trz-1至trz-24所示,所述的吩噻嗪类有机磷光化合物的分子结构为如式1-122所示,所述的(经典)有机荧光化合物分子结构如式f-1至f-15所示。
[0186]
在本发明的某一实施方案中,所述的有机荧光发光组合物含有1-2种三嗪类有机主体材料(含量:96.7-80.0wt%,当含有两种三嗪类有机主体材料时,其相对重量比为1:5-5:1)、1-2种吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,当含有两种吩噻嗪类有机磷光化合物时,其相对重量比为1:5-5:1)及1种(经典)有机荧光化合物(含量:0.3-5.0wt%),其中,所述的三嗪类有机主体材料分子结构为如式trz-1至trz-24所示,所述的吩噻嗪类有机磷光化合物的分子结构如式1-122所示,所述的(经典)有机荧光化合物分子结构如式f-1至f-7所示。
[0187]
在本发明的某一实施方案中,所述的有机荧光发光组合物含有1-2种三嗪类有机主体材料(含量:96.7-80.0wt%,当含有两种三嗪类有机主体材料时,其相对重量比为1:5-5:1)、1-2种吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,当含有两种吩噻嗪类有机磷光化合物时,其相对重量比为1:5-5:1)及1种(经典)有机荧光化合物(含量:0.3-5.0wt%),其中,所述的三嗪类有机主体材料分子结构为如式trz-1至trz-24所示,所述的吩噻嗪类有机磷光化合物的分子结构如式1和75所示,所述的(经典)有机荧光化合物分子结构如式f-1至f-7所示。
[0188]
本发明提供了一种如上所述的吩噻嗪类有机磷光化合物、或含如上所述的吩噻嗪类有机磷光化合物的有机室温磷光组合物在制备有机荧光发光组合物中的应用,所述的吩噻嗪类有机磷光化合物作为有机磷光敏化剂;例如敏化(经典)有机荧光化合物的能量转移;
[0189]
其中,所述的有机荧光发光组合物或有机室温磷光组合物中的主体材料的定义可为本发明中任一方案中所述的三嗪类有机主体材料所示;
[0190]
所述的有机荧光发光组合物中的有机荧光化合物的定义可为本发明中任一方案中所述的(经典)有机荧光化合物所示。
[0191]
本发明提供了一种如上所述的有机荧光发光组合物作为有机电致发光材料的应用。
[0192]
在本发明的某一实施方案中,所述的有机荧光发光组合物用于制备有机电致发光器件中的发光层。
[0193]
本发明还提供一种有机电致发光器件,其包含阳极、发光层、任选的空穴注入层、
任选的空穴传输层、任选的电子传输层、任选的电子注入层和阴极,其中发光层、电子注入层、电子传输层、空穴传输层、空穴注入层中的至少一层包含如上所述的有机荧光发光组合物。
[0194]
在一种优选的实施方案中,有机电致发光器件的发光层包含如上所述的有机荧光发光组合物。
[0195]
在本发明的某一实施方案中,所述的有机荧光发光组合物为发光层,发光层的发光原理是基于吩噻嗪类有机磷光化合物敏化经典荧光分子的能量转移。
[0196]
在本发明的某一实施方案中,所述的有机荧光发光组合物为发光层,有机荧光发光组合物由三嗪类有机主体材料、吩噻嗪类有机磷光化合物和(经典)有机荧光化合物形成,吩噻嗪类有机磷光化合物在三嗪类有机主体材料存在下能够形成具有敏化(经典)有机荧光化合物特性的三重激发态(即磷光材料特有的激发态),而且(经典)有机荧光化合物经过这种三重激发态敏化后可以实现高效率电致荧光发射。所述有机荧光发光组合物中吩噻嗪类有机磷光化合物含量为3.0-15.0wt%(重量百分比浓度)、发光峰位处于550-580nm之间的(经典)有机荧光化合物含量为0.3-5.0wt%、其余成分为三嗪类有机主体材料(含量:96.7-80.0wt%)。
[0197]
在本发明的某一实施方案中,所述的有机荧光发光组合物为发光层,有机荧光发光组合物含有1-2种三嗪类有机主体材料(含量:96.7-80.0wt%,当含有两种三嗪类有机主体材料时,两种化合物的重量比为1:5至5:1)、1-2种吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,当含有两种吩噻嗪类有机磷光化合物时,两种化合物的重量比为1:5至5:1)及1种(经典)有机荧光化合物(含量:0.3-5.0wt%,当含有两种吩噻嗪类有机磷光化合物时,两种化合物的重量比为1:5至5:1),所述三嗪类有机主体材料分子结构为通式trz-i、trz-ii和trz-iii所示,所述吩噻嗪类有机磷光化合物的分子结构为通式pht-i和pht-ii所示,所述(经典)有机荧光化合物分子结构如通式f-i至f-viii所示。
[0198]
在本发明的某一实施方案中,所述的有机荧光发光组合物为发光层,有机荧光发光组合物含有1-2种三嗪类有机主体材料(含量:96.7-80.0wt%,当含有两种三嗪类有机主体材料时,两种化合物的重量比为1:5至5:1)、1-2种吩噻嗪类有机磷光化合物(含量:3.0-15.0wt%,)及1种(经典)有机荧光化合物(含量:0.3-5.0wt%,当含有两种吩噻嗪类有机磷光化合物时,两种化合物的重量比为1:5至5:1),所述三嗪类有机主体材料分子结构为如下式trz-1至trz-56所示,所述吩噻嗪类有机磷光化合物的分子结构为如下式1-122所示,所述(经典)有机荧光化合物分子结构如式f-1至f-73所示。
[0199]
在本发明的某一实施方案中,所述有机电致发光器件中还包括基板,以及依次形成在基板上的阳极层、有机发光功能层和阴极层;所述的有机发光功能层中,包括含如上所述的有机荧光发光组合物的发光层,还可包括空穴注入层、空穴传输层、电子阻挡层、空穴阻挡层、电子传输层和电子注入层中的任意一种或者多种的组合。
[0200]
本发明提供了一种所述的有机电致发光器件在有机电致发光显示器或有机电致发光照明光源中的应用。
[0201]
本领域技术人员可以理解,根据本领域中使用的惯例,本技术描述基团的结构式中所使用的标志是指,相应的基团上的某一个原子(例如c原子、n原子)通过单键与式某一化合物的某一片段、基团进行连接。
[0202]
术语说明
[0203]
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。
[0204]
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
[0205]
基团定义
[0206]
在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。
[0207]
本说明书所用的章节标题仅用于组织文章的目的,而不应被解释为对所述主题的限制。本技术中引用的所有文献或文献部分包括但不限于专利、专利申请、文章、书籍、操作手册和论文,均通过引用方式整体并入本文。
[0208]
除非另有规定,本文使用的所有技术术语和科学术语具有要求保护主题所属领域的标准含义。倘若对于某术语存在多个定义,则以本文定义为准。
[0209]
应该理解,在本发明中使用的单数形式,如“一种”,包括复数指代,除非另有规定。此外,术语“包括”是开放性限定并非封闭式,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0210]
除非另有说明,本发明采用质谱、元素分析的传统方法,各步骤和条件可参照本领域常规的操作步骤和条件。
[0211]
除非另有指明,本发明采用分析化学、有机合成化学和光学的标准命名及标准实验室步骤和技术。在某些情况下,标准技术被用于化学合成、化学分析、发光器件性能检测。
[0212]
本发明的化合物可以在一个或多个构成该化合物的原子上包含非天然比例的原子同位素。例如,可用放射性同位素标记化合物,比如氘(2h)。本发明的化合物的所有同位素组成的变换,无论放射性与否,都包括在本发明的范围之内。
[0213]
本发明所述的“氘”是指单一氘原子,符号为2h或d。以氢原子为例,其天然丰度的形式是指其中约99.985%为氕、约0.015%为氘;氘的非天然丰度约95%为氘。
[0214]
除非另外说明,应当应用本文所使用的下列定义。出于本发明的目的,化学元素与元素周期表cas版,和《化学和物理手册》,第75版,1994一致。此外,有机化学一般原理可参考"organic chemistry",thomas sorrell,university science books,sausalito:1999,和"march's advanced organic chemistry”by michael b.smith and jerry march,john wiley&sons,new york:2007中的描述,其全部内容通过引用并入本文。
[0215]
在本说明书中,可由本领域技术人员选择基团及其取代基以提供稳定的结构部分和化合物。当通过从左向右书写的常规化学式描述取代基时,该取代基也同样包括从右向左书写结构式时所得到的在化学上等同的取代基。
[0216]
在本文中定义的某些化学基团前面通过简化符号来表示该基团中存在的碳原子总数。例如,c
1-c6烷基是指具有总共1、2、3、4、5或6个碳原子的如下文所定义的烷基。简化符号中的碳原子总数不包括可能存在于所述基团的取代基中的碳。
[0217]
在本文中,取代基中定义的数值范围如0至4、1-4、1至3等表明该范围内的整数,如1-6为1、2、3、4、5、6。
~c4烷基”。
[0232]
在本发明的各部分,描述了连接取代基。当该结构清楚地需要连接基团时,针对该基团所列举的马库什变量应理解为连接基团。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”,则应该理解,该“烷基”代表连接的亚烷基基团。
[0233]
在一些具体的结构中,当烷基基团清楚地表示为连接基团时,则该烷基基团代表连接的亚烷基基团,例如,基团“卤代-c1~c6烷基”中的c
1-c6烷基应当理解为c1~c6亚烷基。
[0234]
术语“亚烷基”表示从饱和的直链或支链烃基中去掉两个氢原子所得到的饱和的二价烃基基团。亚烷基基团的实例包括亚甲基(-ch
2-),亚乙基{包括-ch2ch
2-或-ch(ch3)-},亚异丙基{包括-ch(ch3)ch
2-或-c(ch3)
2-}等等。
[0235]
在本技术中,作为基团或是其它基团的一部分(例如用在卤素取代的烷基等基团中),术语“烷基”意指包括具有指定碳原子数目的支链和直链的饱和脂族烃基;比如含有1至16个碳原子的直链或支链饱和烃链;又例如,c
1-c6的烷基。如在“c1~c6烷基”中定义为包括在直链或者支链结构中具有1、2、3、4、5、或者6个碳原子的基团。其中,丙基为c3烷基(包括同分异构体,例如正丙基或异丙基);丁基为c4烷基(包括同分异构体,例如正丁基、仲丁基、异丁基或叔丁基);戊基为c5烷基(包括同分异构体,例如正戊基、1-甲基-丁基、1-乙基-丙基、2-甲基-1-丁基、3-甲基-1-丁基、异戊基、叔戊基或新戊基);己基为c6烷基(包括同分异构体,例如正己基、1-乙基-2-甲基丙基、1,1,2-三甲基丙基、1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3-二甲基丁基、2-乙基丁基、2-甲基戊基、3-甲基戊基、4-甲基戊基、2,3-二甲基丁基)。
[0236]
除非另有规定,本文使用的所有技术术语和科学术语具有要求保护主题所属领域的标准含义。倘若对于某术语存在多个定义,则以本文定义为准。
[0237]
应该理解,在本发明中使用的单数形式,如“一种”,包括复数指代,除非另有规定。此外,术语“包括”是开放性限定并非封闭式,即包括本发明所指明的内容,但并不排除其他方面的内容。
[0238]
除非另有说明,本发明采用质谱、元素分析的传统方法,各步骤和条件可参照本领域常规的操作步骤和条件。
[0239]
除非另有指明,本发明采用分析化学、有机合成化学和光学的标准命名及标准实验室步骤和技术。在某些情况下,标准技术被用于化学合成、化学分析、发光器件性能检测。
[0240]
另外,需要说明的是,除非以其他方式明确指出,在本发明中所采用的描述方式
“…
独立地为”应做广义理解,是指所描述的各个个体之间是相互独立的,可以独立地为相同或不同的具体基团。更详细地,描述方式
“…
独立地为”既可以是指在不同基团中,相同符号之间所表达的具体选项之间互相不影响;也可以表示在相同的基团中,相同符号之间所表达的具体选项之间互相不影响。
[0241]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0242]
本发明所用试剂和原料均市售可得。
[0243]
本发明的积极进步效果在于:本发明提供了一种构造和制备有机荧光发光组合物和高效率有机电致发光器件的技术方案,其优势在于:将三嗪类有机主体材料、吩噻嗪类有机磷光化合物及(经典)有机荧光化合物合理组合在一起后,利用吩噻嗪类有机磷光化合物
形成的三重激发态来敏化(经典)有机荧光化合物,这种有机荧光发光组合物可以制备有机电致发光器件的发光层,其利用可以使荧光材料的电致发光效率大幅度提升。
附图说明
[0244]
图1为效果实施例2-3所采用的器件结构示意图;其中,1为ito,2为空穴传输层1,3为空穴传输层2,4为发光层,5为电子传输层,6为电子注入层,7为金属阴极。
[0245]
图2为[89.5wt%trz-1:10wt%1:0.5wt%f-1]薄膜(厚度100nm)的光致发光光谱。
[0246]
图3为[89.5wt%trz-1:10wt%1:0.5wt%f-1]薄膜(厚度100nm)的变温时间分辨光致发光光谱。
[0247]
图4为[89.5wt%trz-1:10wt%1:0.5wt%f-1]薄膜(厚度100nm)的电致发光光谱。
[0248]
图5为[89.5wt%trz-1:10wt%76:0.5wt%f-1]薄膜(厚度100nm)的光致发光光谱。
[0249]
图6为[89.5wt%trz-1:10wt%76:0.5wt%f-1]薄膜(厚度100nm)的电致发光光谱。
具体实施方式
[0250]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0251]
组合物制备实施例1
[0252]
方法1:采用真空蒸镀的方法将trz-1作为主体材料、式1-122所示的任一化合物分别作为磷光敏化剂(式1-122具体分子结构如前面所示)、荧光材料f-1作为荧光掺杂剂制备成组合物掺杂薄膜(厚度为50nm),在薄膜中trz-1含量为89.0wt%(重量百分比浓度)、化合物1-122的含量为10.0wt%、f-1的含量为1.0wt%。
[0253]
方法2:采用溶液旋涂或者打印的方法将trz-1作为主体材料、式1-122所示的任一化合物分别作为磷光敏化剂(式1-122具体分子结构如前面所示)、荧光材料f-1作为荧光掺杂剂制备成组合物掺杂薄膜(厚度为50nm),在薄膜中trz-1含量为89.0wt%(重量百分比浓度)、化合物1-122的含量为10.0wt%、f-1的含量为1.0wt%。
[0254]
组合物效果实施例1
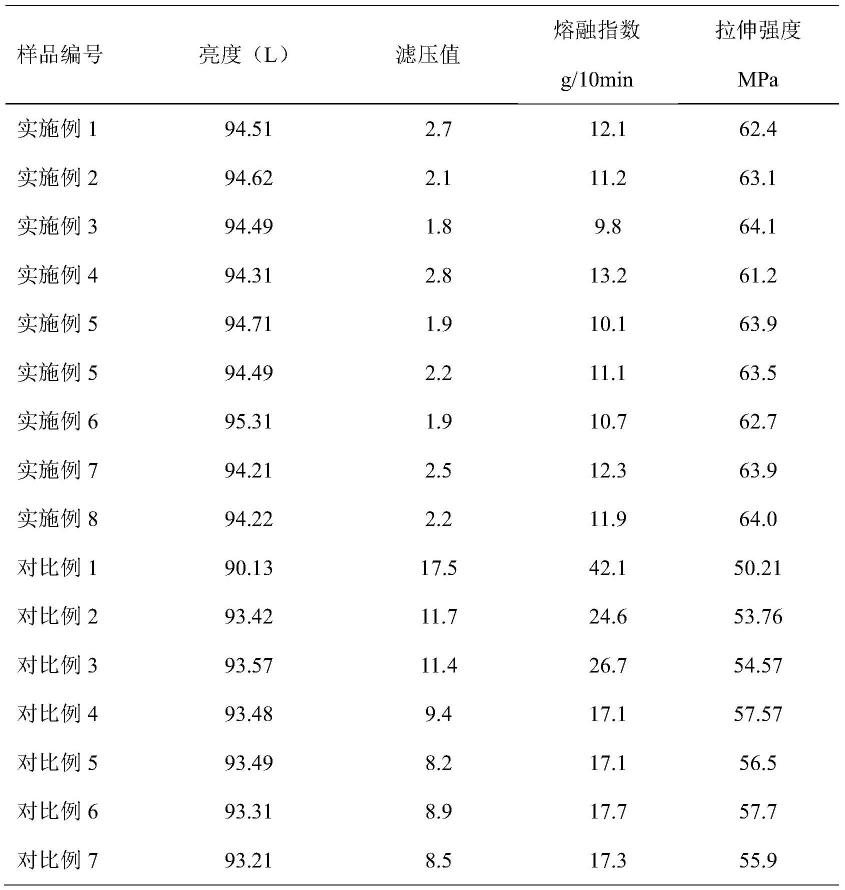
[0255]
以下利用本发明公开的材料制备电致发光器件实施例,具体的器件制备工艺如下:透明ito玻璃作为制备器件的基底材料,后先以5%ito洗液超声处理30min,之后依次以蒸馏水(2次)、丙酮(2次)、异丙醇(2次)超声洗涤,最后将ito玻璃保存在异丙醇中。每次使用前,先用丙酮棉球和异丙醇棉球小心擦拭ito玻璃表面,待异丙醇冲洗后烘干,之后用等离子体处理5min。器件的制备利用真空镀膜设备采用真空蒸镀工艺完成,当真空蒸镀系统的真空度达到5 10-4pa以下时开始蒸镀,沉积速率由赛恩斯膜厚仪,利用真空蒸镀工艺在ito玻璃上依次沉积各种有机层及lif电子注入层和金属al电极(具体器件结构见如下效果实施例),其中,有机材料的沉积速率为lif的沉积速率为al的沉积速率为器件的电流、电压、亮度、发光光谱等特性采用photo research pr 655光谱扫描亮度计和keithley k 2400数字源表系统同步测试。器件的性能测试在室温、环境气氛下进行。
器件的外量子效率(eqe)是按照发光为朗勃分布的情况下,由电流密度、亮度和电致光谱结合视见函数计算得出。
[0256]
效果实施例的有机电致发光器件中,npb被作为第1空穴传输层使用,tcta被作为第2空穴传输层使用,发光层采用的组合物包含trz-1(89.5wt%)、式1-122中任一种分子作为磷光敏化剂(10.0wt%)和荧光分子f-1(0.5wt%),tpbi作为电子传输层、lif作为电子注入层使用。效果实施例有机电致发光器件结构为[ito/npb(30nm)/tcta(10nm)/eml(30nm)/tpbi(40nm)/lif(1nm)/al(100nm)],eml代表发光层。效果实施例器件d-n(n=1-122)结果见表1。
[0257]
通过实验证明当磷光敏化剂含量为10.0wt%时敏化效果最佳。
[0258]
对比实施例的有机电致发光器件中,npb被作为第1空穴传输层使用,tcta被作为第2空穴传输层使用,发光层采用的组合物包含trz-1(99.5wt%)和荧光分子f-1(0.5wt%),tpbi作为电子传输层、lif作为电子注入层使用。效果实施例有机电致发光器件结构为[ito/npb(30nm)/tcta(10nm)/eml(30nm)/tpbi(40nm)/lif(1nm)/al(100nm)],eml代表发光层。对比器件d-r1结果见表1。
[0259]
器件效果实施例所涉及的一些材料分子结构如下:
[0260][0261]
表1.效果实施例所提供的电致发光器件数据参数(d-r为对比器件,d1-1至d1-122为效果实施例器件)。
[0262]
[0263]
[0264]
[0265]
[0266][0267]
通过表1中效果实施例器件(d1-1至d1-122)的外量子效率(在15.1至15.8)为对比器件(dr)外量子效率(3.8)的4倍,表明当引入本发明中的有机磷光敏化剂后电致发光器件的效率可以大幅度提升。
[0268]
组合物效果实施例2
[0269]
器件制备工艺及器件测试方法与“组合物效果实施例1”相同。
[0270]
效果实施例的有机电致发光器件中,npb被作为第1空穴传输层使用,tcta被作为第2空穴传输层使用,发光层采用的组合物包含trz-1(89.7wt%)、式1-122中任一种分子作为磷光敏化剂(10.0wt%)和荧光分子f-1(0.3wt%),tpbi作为电子传输层、lif作为电子注入层使用。效果实施例有机电致发光器件结构为[ito/npb(30nm)/tcta(10nm)/eml(30nm)/tpbi(40nm)/lif(1nm)/al(100nm)],eml代表发光层。效果实施例器件d-n(n=1-122)结果见表2。
[0271]
对比实施例的有机电致发光器件中,npb被作为第1空穴传输层使用,tcta被作为第2空穴传输层使用,发光层采用的组合物包含trz-1(99.7wt%)和荧光分子f-1(0.3wt%),tpbi作为电子传输层、lif作为电子注入层使用。效果实施例有机电致发光器件结构为[ito/npb(30nm)/tcta(10nm)/eml(30nm)/tpbi(40nm)/lif(1nm)/al(100nm)],eml代表发光层。对比器件d-r2结果见表2。
[0272]
表2.效果实施例所提供的电致发光器件数据参数(d-r2为对比器件,d2-1至d2-122为效果实施例器件)。
[0273]
[0274]
[0275]
[0276]
[0277][0278]
通过表2中效果实施例器件(d2-1至d2-122)的外量子效率(在15.3至15.7)为对比器件(dr)外量子效率(3.7)的4.1倍,表明当引入本发明中的有机磷光敏化剂后电致发光器件的效率可以大幅度提升。
[0279]
组合物效果实施例3
[0280]
器件制备工艺及器件测试方法与“组合物效果实施例1”相同。
[0281]
效果实施例的有机电致发光器件中,npb被作为第1空穴传输层使用,tcta被作为第2空穴传输层使用,发光层采用的组合物包含trz-1(89.0wt%)、式1-122中任一种分子作为磷光敏化剂(10.0wt%)和荧光分子f-1(1.0wt%),tpbi作为电子传输层、lif作为电子注入层使用。效果实施例有机电致发光器件结构为[ito/npb(30nm)/tcta(10nm)/eml(30nm)/tpbi(40nm)/lif(1nm)/al(100nm)],eml代表发光层。效果实施例器件d-n(n=1-122)结果见表2。
[0282]
对比实施例的有机电致发光器件中,npb被作为第1空穴传输层使用,tcta被作为第2空穴传输层使用,发光层采用的组合物包含trz-1(99.0wt%)和荧光分子f-1(1.0wt%),tpbi作为电子传输层、lif作为电子注入层使用。效果实施例有机电致发光器件结构为[ito/npb(30nm)/tcta(10nm)/eml(30nm)/tpbi(40nm)/lif(1nm)/al(100nm)],eml代表发光层。对比器件d-r3结果见表3。
[0283]
表3.效果实施例所提供的电致发光器件数据参数(d-r3为对比器件,d3-1至d3-122为效果实施例器件)。
[0284]
[0285]
[0286]
[0287]
[0288][0289]
通过表3中效果实施例器件(d3-1至d3-122)的外量子效率(在14.4至14.7)为对比器件(dr)外量子效率(3.2)的4.5倍,表明当引入本发明中的有机磷光敏化剂后电致发光器件的效率可以大幅度提升。
[0290]
现有技术中已公开了三嗪类有机主体材料作为主体材料,与(经典)有机荧光化合物(作为荧光掺杂剂,例如dph2aan)以及电子给体材料的发光组合物技术方案。而现有技术中,吩噻嗪类有机磷光化合物分子一般作为电子给体的敏化剂。
[0291]
而本发明中吩噻嗪类有机磷光化合物分子在组合物中不是作为电子给体存在,而是作为磷光敏化剂存在,其原因在于系统的研究结果充分表明(j.phys.chem.lett.2019,10,5983-5988),即该体系中可以形成有机磷光激发态,三嗪类有机主体材料与吩噻嗪类有机磷光化合物分子复合在一起时会诱导吩噻嗪类有机磷光化合物分子室温磷光的发射而不是基于电子给体与电子受体间的基激复合物(exciplex)发射即分子间电荷转移激发态发射。
[0292]
按照有机发光材料基本光物理原理上考虑,纯有机磷光材料敏化荧光材料存在以下两个问题:(1)由于无重原子效应,纯有机材料自身很难实现高效率室温磷光发射;(2)三重激发态(即磷光材料的激发态)到单重激发态的能量转移(敏化)较难高效率地发生,主要原因在于自旋多重度不同的能量给体和受体之间能量转移要克服电子自旋反转势垒。因此,从光物理原理上讲,用纯有机发磷光材料敏化荧光材料很难获得理想预期的策略。
[0293]
目前已有技术公开的磷光敏华敏化剂由于在薄膜态无法实现室温磷光发射或者在薄膜状态下不具有载流子传输特性,因此无法作为电致发光器件发光层使用。
[0294]
而本发明是首次提出的纯有机发磷光和荧光发光材料组合。本发明的技术方案提供了一个具有较高效率且在薄膜状态下具有室温磷光特性的复合材料体系。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。