1.本发明属于药物纳米载体技术领域,具体涉及一种乙肝病毒样颗粒纳米载体及递药系统。
背景技术:
2.在目前的临床医学中,纳米技术取得了相当大的进步,越来越多地被应用在医学、材料科学、生物学等众多领域,并且在各个领域发挥着举足轻重的作用。纳米技术的应用反映了一种新的疾病治疗模式的普及,并且在许多学术研究和临床实践中取得了很好的成就。以纳米颗粒为载体运送肿瘤治疗药物的方法克服了传统化疗药物的弊端,为提高化疗药物的疗效、降低其副作用提供了可能。
3.在目前存在的各种类型的vlps中,以乙肝病毒核心蛋白(hbc)为基础的病毒样颗粒是最为灵活载体模型。乙肝病毒样颗粒来源简单,可自我组装,因此避免了复杂的化学合成步骤。它们形态均一、大小合适;具有单分散结构、在较大范围的ph和温度条件下可稳定存在;表面和内部具有多个反应的位点,可自我组装成35nm左右的正二十面体结构。另外,乙肝病毒样颗粒作为一种蛋白类的载体,其通用性好,在原核、真核以及哺乳动物等表达系统中均可以正确组装成完整的球形颗粒结构,可用作疫苗、抗原载体或佐剂使用。
4.有研究证实将抗传统肿瘤药物装载进入hbc-vlp内部,将dox靶向运输至肿瘤细胞,能够延长药物在体内的循环时间,降低药物对正常组织的毒副作用,在抗肿瘤药物载体方面有较好的应用,未来在成药方面有较大的潜力。但是hbc-vlp目前仍存在一些问题待解决,如形成包封复合物的载药量较低,稳定性较差等。
5.有研究证明,乙肝病毒核心蛋白全长由183-185个氨基酸构成,而前144个氨基酸为正确组装成衣壳二聚体结构所必须的部分。:n-末端自组装域(sa,aa 1~150)和c-末端聚精氨酸域(ctd,aa 151~183).sa主要执行自组装功能,且其二级结构主要由α螺旋构成.ctd是一段无规则序列,对hbc的组装无影响的hbc-vlp的第145~183氨基酸序列富含精氨酸。
6.中国专利文献cn109529044a公开了一种肿瘤靶向药物及其制备方法,该肿瘤靶向药物是通过采用靶向纳米载体包封阿霉素制备得到的,其中靶向纳米载体具有如下所述的氨基酸序列:hbc-144的第72-82位氨基酸用rgd序列替代,rgd序列两端分别通过连接肽与hbc-144的第77和83位氨基酸相连;还可在hbc-144的c端末尾连接聚组氨酸多肽。该专利文献说明书第[0075]段及说明书附图图3记载了采用该靶向纳米载体包封阿霉素后制备得到的肿瘤靶向药物在ph=5-8的磷酸盐缓冲液共孵育4-48h,于不同时间点取样计算释放效率。实验结果表明,在ph=7-8(接近生理ph)的条件下,在4-48h药物释放效率逐渐升高;在4h时药物释放效率即达10%左右;与ph=7和8的磷酸盐缓冲液共孵育24h时,药物的释放效率均已达30%左右。该专利文献cn109529044a公开的靶向纳米载体对药物的包封稳定性在接近生理ph的条件下稳定性较差,有待进一步改进。
技术实现要素:
[0007]
本发明提供一种乙肝病毒样颗粒纳米载体,该乙肝病毒样颗粒纳米载体是以hbc-170为主体构建得到的,该乙肝病毒样颗粒纳米载体可显著提高其包封药物后制备得到的包封复合物在生理条件下的包封稳定性,减少包封药物在生理条件下的释放率。
[0008]
本发明的第二目的在于提供一种递药系统。
[0009]
本发明的第三目的在于提供如上所述的递药系统的制备方法。
[0010]
本发明的第四目的在于提供如上所述的递药系统的纯化方法。
[0011]
本发明的第五目的在于提供如上所述的递药系统的纯度检测方法。
[0012]
本发明的目的还在于提供如上所述的递药系统的浓度检测方法。
[0013]
本发明的乙肝病毒样颗粒纳米载体采用如下技术方案:一种乙肝病毒样颗粒纳米载体,所述载体具有如下所述的的氨基酸序列:将乙肝核心蛋白hbc-170的第79-81位氨基酸替换为rgd序列,并采用连接肽使所述rgd的两端分别与所述hbc-170的第78和82位氨基酸相连构建得到。
[0014]
作为进一步优选的技术方案,所述载体的c端末尾还连接有聚组氨酸多肽。
[0015]
作为进一步优选的技术方案,所述连接肽的氨基酸序列为gtsgtsgssgsggt和/或ggsgssgstg。
[0016]
本发明的递药系统采用如下技术方案:一种递药系统,所述递药系统包括如上述任意一项所述的载体和包封于所述载体内部的药物。
[0017]
作为进一步优选的技术方案,所述药物包括但不限于抗肿瘤药;所述抗肿瘤药为蒽环霉类药物,选自阿霉素、柔红霉素、吡柔比星、表阿霉素和阿克拉霉素及其药用衍生物中的任意一种或几种的组合。
[0018]
本发明的递药系统的制备方法采用如下技术方案:包括下述步骤:(1)使所述乙肝假病毒颗粒纳米载体与解离液在25℃下孵育2h;(2)向步骤(1)所得混合溶液中加入药物,轻微震荡,4℃孵育30min;(3)向步骤(2)所得混合溶液转移至分子量为3500da的透析袋中,首先置于10%的聚合液中4℃过夜透析;(4)12h后将透析袋置于新的10%聚合液中继续透析2h;(5)将透析袋置于0%的聚合液中,4℃透析,透析过程中根据需要更换0%的聚合液,直至透析液澄清透明不再变为红色后停止透析,即得所述递药系统;所述解离液按照下述方法配制得到:27g nacl,30g甘氨酸,480g尿素,150ml 1m tris-hcl(ph=8.0),加去离子水搅拌溶解定容至1l;所述10%聚合液按照下述方法配制得到:9g nacl,10g甘氨酸,100ml丙三醇,1m tris-hcl(ph=8.0)50ml,加去离子水搅拌溶解定容至1l;所述0%聚合液按照下述方法配制得到:称量nacl 9g,甘氨酸10g,加入1m tris-hcl(ph=8.0)50ml,加去离子水搅拌溶解定容至1l。
[0019]
作为进一步优选的技术方案,所述药物的用量为所述乙肝病毒样颗粒纳米载体的质量的75%。
[0020]
本发明的递药系统的纯化方法采用如下技术方案:采用deae离子交换层析对制备得到的所述递药系统进行纯化,包括如下步骤:
[0021]
(1)缓冲液液平衡柱子:用10倍柱体积含20mm tris-hcl ph8.0的基液冲洗柱子,至流出液的ph与基液ph一致;
[0022]
(2)上样:待紫外检测仪数值调零,将制备得到的递药系统以4ml/min的流速上样;
[0023]
(3)洗脱液ⅰ洗脱:用5倍柱体积的洗脱液ⅰ冲洗柱子,收集洗脱峰即得纯化后的所述递药系统;所述洗脱液i含20mm tris-cl ph8.0。
[0024]
作为进一步优选的技术方案,所述纯化方法在洗脱液i洗脱后还包括下述步骤:
[0025]
(4)洗脱液ⅱ洗脱:用5倍柱体积的洗脱液ⅱ冲洗柱子,收集洗脱峰;所述洗脱液ⅱ含20mm tris-cl ph8.0、400mm nacl;
[0026]
(5)洗脱液ⅲ洗脱:用5倍柱体积的洗脱液ⅲ冲洗柱子;所述洗脱液ⅲ为0.5m naoh;
[0027]
(6)洗脱液ⅰ洗脱:用5倍柱体积的所述洗脱液ⅰ将ph平衡至ph8.0。
[0028]
本发明的递药系统的纯度检测方法采用如下技术方案:采用hplc进行检测,色谱柱为ultrahydrogel 2000色谱柱;流动相为:20mmol/l pbs和150mmol/l nacl;所述色谱柱的柱长为300nm,柱内径为7.8mm,柱温为25℃,流动相流速为0.6ml/min;检测波长为280nm和480nm。
[0029]
本发明的递药系统的纯度检测方法采用如下技术方案:采用hplc进行检测,色谱柱为c18柱。
[0030]
作为进一步优选的技术方案,所述色谱柱为waters tnature c18柱,柱长为250mm,柱内径为4.6mm,填料的粒径为5mm,柱温为25℃,检测器的检测波长为480nm。
[0031]
本发明的有益效果是:本发明通过选用hbc-170为主体构建得到的乙肝病毒样颗粒纳米载体对药物的包封稳定性显著优于以hbc-144为主体构建得到的靶向纳米载体。即本发明通过增加hbc-vlp氨基酸序列的方式构建得到的乙肝病毒样颗粒纳米载体的包封稳定性更好,可用于包封阿霉素等多种化疗药物。
[0032]
本发明的的乙肝病毒样颗粒纳米载体可大批量制备,并且具有较高的纯度,因为载体颗粒有更多的精氨酸序列,所以该靶向药物的包封量较高且稳定性更好,药物在体内随血液循环时不易发生泄漏。该乙肝病毒样颗粒纳米载体包封率高且稳定性好,生产工艺简单,可大批量制备,在未来成药方面有较大的潜力。
[0033]
本发明的乙肝病毒样颗粒纳米载体包封阿霉素后制备得到的包封复合物在ph7.4的磷酸缓冲液(生理ph)中,24h内的释放效率小于10%,包封稳定性高(中国专利文献cn109529044a公开的靶向纳米载体对药物的包封稳定性在接近生理ph的条件下稳定性较差,在ph7-8磷酸缓冲液中24h的释放效率为30%左右)。
[0034]
本发明的乙肝病毒样颗粒纳米载体对阿霉素的包封量最高可达250μg/ml(乙肝病毒样颗粒纳米的浓度为0.5mg/ml)。
[0035]
本发明的递药系统可实现药物在体内的靶向运输,且稳定性好。
[0036]
本发明的包封阿霉素的递药系统相对于游离的阿霉素,其稳定性更好,生物利用度更高,副作用小,且可进行大批量制备。
[0037]
本发明的递药系统的纯化方法纯化效果好、得率高,且适用于大批量样品的纯化。
[0038]
本发明的递药系统的纯度检测方法和浓度检测方法可为递药系统的浓度和纯度检测提供可靠保障,便于对递药系统的制备效果进行定量。
附图说明
[0039]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现
有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0040]
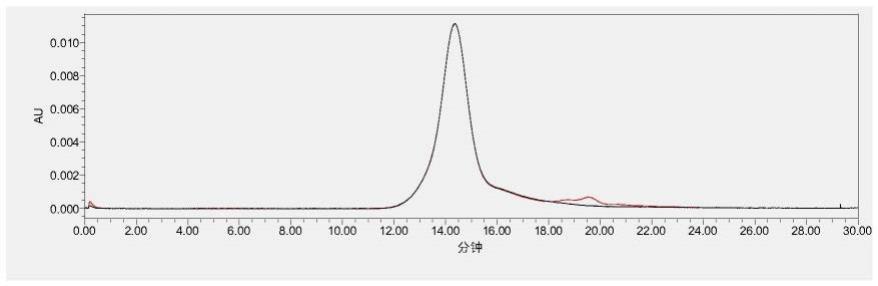
图1为本发明的递药系统的hplc纯度检测图谱;
[0041]
图2为本发明的递药系统的hplc浓度检测图谱;
[0042]
图3为本发明的递药系统中包封的dox标准曲线回归方程;
[0043]
图4为动态透析法检测本发明的递药系统在生理环境下的稳定性的检测结果曲线图;
[0044]
图5为对比例1递药系统hplc纯度检测图谱。
具体实施方式
[0045]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0046]
实施例1本发明的乙肝病毒样颗粒纳米载体的制备
[0047]
包括下述步骤:
[0048]
(1)按照本发明的乙肝病毒样颗粒纳米载体的氨基酸序列通过基因合成法获得编码乙肝病毒样颗粒纳米载体的核苷酸序列,通过xho i/nde i酶切位点构建到表达载体质粒pet43.1(a)中——将rgd序列插入到hbc-170蛋白的第78和82位氨基酸之间(剔除第79-81位氨基酸),并在第78位氨基酸和rgd序列之间插入连接肽gtsgtsgssgsggt,在rgd和第82位氨基酸之间插入连接肽ggsgssgstg,获得rgd-hbc-170蛋白的氨基酸序列(如seq id no.1所示);在rgd-hbc-170蛋白的c端末尾加上聚组氨酸多肽(hhhhhh);根据上述说明,合成编码本发明的乙肝病毒样颗粒纳米载体的核苷酸序列;将合成的核苷酸序列连接于质粒(pet21a)。
[0049]
(2)获取含有目的基因的质粒后按照下述步骤操作:向大肠杆菌感受态细胞悬液中加入购买得到的含有目的基因的质粒(100μl的感受态细胞加入1ng质粒),置于42℃水浴放置60-90s,之后转移至冰上,冷却2-3min,转化结束后,加入lb培养基37℃培养。
[0050]
(3)活化:从重组菌平板上挑取单克隆菌落,加入5ml培养基中,恒温摇床培养,温度37℃,培养时间4小时后加入新的液扩瓶培养。
[0051]
(4)诱导:摇床温度降为26℃,使其降至设定温度,每瓶菌液加入50mg/ml iptg 300μl诱导,恒温摇床培养,摇床转速200rpm/min,温度26℃,培养时间12小时。
[0052]
(5)收菌破碎粗提:诱导好的菌液倒入离心管中4℃离心,转速4000rpm/min,4min,弃上清。离心好的菌体沉淀中加入高盐裂解液,用吸管吹起沉淀后进行超声破碎。
[0053]
(6)硫酸铵沉淀:将上述悬液进行离心,12000rpm/min,10min,上清倒入试管中量其体积加入等体积预冷的纯水冰浴搅拌,量取1.2倍体积饱和硫酸铵缓慢加入,搅拌5min后离心,10min离心后的沉淀用20ml 20mmtris重悬,超声破碎后继续离心,最后弃沉淀,留上清
[0054]
(7)分子筛纯化:分子筛提前用平衡液(20mmph8.0tris-hcl 300mmnacl)平衡ph至
8.0后上样。收集:上样约1h后紫外检测仪读数开始上升,读数上升至20以上开始收集流出蛋白,50ml无菌试管收集,每管50ml,管体写上编号及od值,收集好的蛋白放于冰上。收集到第二个峰完即可,待第三个峰完全下降后关闭蠕动泵。
[0055]
经分子筛纯化后得到纯化后的本发明的乙肝病毒样颗粒纳米载体。
[0056]
实施例2构建本发明的递药系统
[0057]
2.1药物装载
[0058]
取100ml的目的蛋白(0.5mg/ml)与预先配制好的解离液50ml在25℃下孵育2h,溶液总体积为150ml。此时向上述混合溶液中加入37.5mg阿霉素,所得混合溶液于4℃继续摇晃孵育30min。之后,将其移至分子量为3500da的透析袋中,首先置于10%的聚合液(1l)中并在4℃下过夜透析,12h后更换为10%的聚合液并在4℃下透析,2h后更换为0%的聚合液在4℃继续透析,期间更换聚合液5次,直至透析液澄清透明,不再变为红色即可停止透析,即初步形成包封复合物(本发明的递药系统)。
[0059]
其中,上述解离液按照下述方法配制得到:27g nacl,30g甘氨酸,480g尿素,150ml 1m tris-hcl(ph=8.0),加去离子水搅拌溶解定容至1l;
[0060]
10%聚合液按照下述方法配制得到:9g nacl,10g甘氨酸,100ml丙三醇,1m tris-hcl(ph=8.0)50ml,加去离子水搅拌溶解定容至1l;
[0061]
0%聚合液按照下述方法配制得到:称量nacl 9g,甘氨酸10g,加入1m tris-hcl(ph=8.0)50ml,加去离子水搅拌溶解定容至1l。
[0062]
2.2复合物纯化——deae离子交换层析
[0063]
(1)缓冲液液平衡柱子:用10倍柱体积含20mm tris-hcl(ph8.0)的基液冲洗柱子,至流出液的ph与基液ph一致。
[0064]
(2)上样:待紫外检测仪数值调零,将上述的包封复合物以4ml/min的流速上样。
[0065]
(3)洗脱液ⅰ洗脱:用5倍柱体积的洗脱液ⅰ(含20mm tris-cl(ph8.0))冲洗柱子,收集洗脱峰(即为纯化后的包封复合物)。
[0066]
(5)洗脱液ⅱ洗脱:用5倍柱体积的洗脱液ⅱ(含20mm tris-cl(ph8.0)、400mm nacl)冲洗柱子,收集洗脱峰。
[0067]
(6)洗脱液ⅲ洗脱:用5倍柱体积的洗脱液ⅲ(0.5m naoh)冲洗柱子。
[0068]
(7)洗脱液ⅰ洗脱:用5倍柱体积的洗脱液ⅰ(含20mm tris-cl(ph8.0))将ph平衡至ph8.0。
[0069]
2.3复合物浓缩
[0070]
(1)将洗脱液ⅰ洗脱的样品装入3500da的透析袋中,外面附着干燥的聚乙二醇(peg20000)粉末,将其置于4℃冰箱中进行浓缩;
[0071]
(2)在浓缩过程中,少量多次加入干燥的聚乙二醇粉末,以增加浓缩速度,聚乙二醇被水饱和后要更换新的直至达到所需要的浓缩体积;
[0072]
(3)浓缩结束后,用蒸馏水将透析袋冲洗干净,将浓缩的蛋白溶液取出,即得纯化后的复合物(本发明的递药系统)。根据需要可用hplc定量测定蛋白浓度,用电子显微镜观察所得到的复合物(本发明的递药系统)的形态结构。
[0073]
实施例3:通过hplc的方式验证复合物(本发明的递药系统)的纯度
[0074]
(1)所述高效液相色谱仪的检测器的检测波长为280nm(本发明的乙肝病毒样颗粒
纳米载体吸收峰)、480nm(dox吸收峰);
75.(2)所述色谱柱为ultrahydrogel 2000色谱柱;
[0076]
(3)所述色谱柱的柱长为300mm
[0077]
(4)所述色谱柱的柱内径为7.8mm
[0078]
(5)所述色谱柱的柱温为25℃
[0079]
(6)所述色谱柱流动相为:20mmol/l pbs,150mmol/l nacl;
[0080]
(7)所述色谱柱流速:0.6ml/min;
[0081]
(8)通过检测复合物280nm、480nm处的紫外吸收值可以看到在14min左右出现一条单一的吸收峰,没有其他杂峰,且280nm和480nm的峰型几乎完全重合,说明复合物(实施例2制备得到)制备成功,且纯度较高(如图1所示)。
[0082]
实施例4:通过hplc的方式验证复合物(实施例2制备得到)的浓度
[0083]
(1)所述高效液相色谱仪的检测器的检测波长为480nm;
[0084]
(2)所述色谱柱为c18柱;
[0085]
(3)所述c18柱的柱长为250mm;
[0086]
(4)所述c18柱的柱内径为4.6mm;
[0087]
(5)所述c18柱填料的粒径为5mm;
[0088]
(6)所述色谱柱是waters tnature c18柱;
[0089]
(7)所述色谱柱的柱温为25℃;
[0090]
(8)通过检测复合物在480nm处的紫外吸收值,可以看到在6min左右出现一条单一的吸收峰(如图2),通过计算峰面积代入回归方程(如图3所示,y(峰面积)=8874.4x-19973,r2=0.9981)计算出dox的浓度(x)。
[0091]
经计算,本发明的乙肝病毒样颗粒纳米载体对阿霉素的包封量可达:
[0092]
(2196708 19973)/8874.4=250μg/ml(本发明的乙肝病毒样颗粒纳米载体的浓度为0.5mg/ml)。
[0093]
实施例5:通过动态透析法验证复合物在生理环境下的稳定性
[0094]
通过hplc检测包封药物在pbs(7.4)中随着时间的推进dox是否会发生泄漏。将装载dox的病毒样颗粒(3ml,dox的浓度为250μg/ml)转移至透析袋中(截留分子量:3500datons)并投入到ph7.4的磷酸盐缓冲液中(30ml)在37℃温和且恒定的搅拌条件下。间隔3h收集1ml释放介质并用相同体积的新鲜释放介质重新补充。通过hplc检测不同时间段游离dox的含量可以看出复合物在生理环境下有较好的稳定性,药物基本上不发生泄露(如图4所示)。
[0095]
由图4可知,在ph7.4的磷酸盐缓冲液中,包封药物在9-24h基本不发生泄漏,dox的最大释放效率在10%以下,本发明的乙肝病毒样颗粒纳米复合物有较好的稳定性。
[0096]
对比例1
[0097]
与实施例2的区别仅在于:省略“2.2复合物纯化——deae离子交换层析”的步骤(其余各步骤均与实施例2保持一致),制备得到的复合物(递药系统)按照实施例3的纯度检测方法检测纯度。检测结果如图5所示的hplc图谱所示。
[0098]
结合图1和图5可知,本发明的递药系统的纯化方法对制备得到的复合物(递药系统)的纯化效果好。
[0099]
对比例2考察本发明的递药系统的纯化方法对收率的影响
[0100]
1、样品预处理:纯化前将上述2.1部分制得的包封复合物浓缩至蛋白浓度为1mg/ml,dox的浓度为440μg/ml,备用。
[0101]
2、分别采用超速离心法、分子筛和本发明的deae离子交换层析法对经上述样品预处理得到的备用样品进行纯化。
[0102]
(1)超速离心法纯化的具体步骤为:设置不同的蔗糖浓度梯度(10%、20%、40%、60%),以29000/r,3h离心,获得的目的包封复合物在40%蔗糖梯度,测定纯化后的目的包封物的浓度和体积,计算目的包封复合物(本发明的递药系统的得率)。
[0103]
纯化后样品浓度的测定:先将纯化后的目的包封复合物的蛋白浓度调至0.5mg/ml,再用液相对目的包封复合物中的dox进行检测,将480nm处峰面积代入的回归方程:y(峰面积)=8874.4x-19973算出dox的浓度。
[0104]
实验结果:上样体积为35ml,超离后当蛋白浓度为0.5mg/ml时,复合物的体积为12ml,dox浓度为130ug/ml。
[0105]
(2)琼脂糖凝胶层析柱(分子筛)纯化:流速为3.5ml/min,上样体积为20ml,紫外仪数值上升至20开始接样,接取第一个洗脱峰(洗脱液为20mm tris-hcl ph8.0),目的包封复合物在第一个洗脱峰。
[0106]
纯化后样品浓度的测定:先将目的复合物的蛋白浓度调至0.5mg/ml,再用液相对目的复合物中的dox进行检测,将480nm处峰面积代入的回归方程:y(峰面积)=8874.4x-19973算出dox的浓度。
[0107]
纯化结果:上样体积为20ml;分子筛纯化后当蛋白浓度为0.5mg/ml时,复合物的体积为7ml,dox的浓度为114ug/ml。
[0108]
(3)deae纯化:流速为4ml/min,上样体积为100ml,紫外仪数值上升至20开始接样,接取第一个洗脱峰,目的包封复合物在第一个洗脱峰(按照上述2.2“复合物纯化——deae离子交换层析”部分的方法进行deae纯化,“步骤(3)洗脱液洗脱”步骤收集得到的样品即为纯化后的样品)
[0109]
纯化后样品浓度的测定:先将目的复合物的蛋白浓度调至0.5mg/ml,再用液相对目的复合物中的dox进行检测,将480nm处峰面积代入的回归方程:y(峰面积)=8874.4x-19973算出dox的浓度。
[0110]
纯化结果:上样体积为100ml,deae纯化后当蛋白浓度为0.5mg/ml时,复合物的体积为105ml,dox浓度为250ug/ml。
[0111]
(4)按照下述公式分别计算上述(1)-(3)的纯化方法纯化后本发明的包封复合物的得率:
[0112]
得率=(纯化后dox浓度
×
样品体积)
÷
(纯化前dox浓度
×
样品体积)
×
100%
[0113]
经计算,超速离心法纯化的得率为10%;分子筛纯化法的得率为9%;本发明的deae纯化法的得率为60%。
[0114]
(5)实验结论:本发明的递药系统的纯化方法的纯化效果好,且得率显著优于本领域其他纯化方法;此外,本发明的deae柱离子交换层析的纯化方法可适用于大批量的样品的纯化,可有效提高纯化的效率,用于大批量生产。
[0115]
备注:上述(1)-(3)的3种纯化法均可使纯化后的包封复合物(递药系统)达到纯度
要求;上述(1)中记载的超速离心纯化法的得率为经多次实验中得率最高的情况,在采用超速离心法进行纯化时,通过调整实验参数也未能取得更好的得率;上述(2)中记载的分子筛纯化法为多次实验中得率最高的情况,在采用分子筛进行纯化时,通过改进实验参数也未能取得更好的得率。
[0116]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。