一种fad为辅基的葡萄糖脱氢酶的高产发酵方法
技术领域
1.本发明属于生物工程技术领域,尤其涉及一种fad为辅基的葡萄糖脱氢酶的高产发酵方法。
背景技术:
2.葡萄糖脱氢酶(glucose dehydrogenase,gdh)属于gmc氧化还原酶(glucose methanol choline oxidoreductase)家族,它和辅基一起能够在nad(p) 等存在的情况下催化β
‑
d
‑
葡萄糖形成d
‑
葡萄糖酸
‑
δ
‑
内酯,d
‑
葡萄糖酸
‑
δ
‑
内酯自发形成葡萄糖酸。葡萄糖脱氢酶催化的葡萄糖氧化过程中不像葡萄糖氧化酶(glucose oxidase,god)那样需要利用氧气作为电子受体,因而检测结果不会受到样品中溶氧的影响,所以在血糖检测、生物燃料电池、植入式心脏起搏器和工业葡萄糖含量监测等领域有着广泛的应用。葡萄糖脱氢酶根据其所结合的辅基不同可分为三种类型:烟酰胺腺嘌呤二核苷酸依赖的葡萄糖脱氢酶(β
‑
nicotinamide adenine dinucleotide
‑
dependent gdh,nad
‑
gdh)、吡咯喹啉醌依赖的葡萄糖脱氢酶(pyrroloquinoline quinine
‑
dependent gdh,pqq
‑
gdh)和黄素腺嘌呤二核苷酸依赖的葡萄糖脱氢酶(flavin adenine dinucleotide
‑
dependent gdh,fad
‑
gdh)。三种gdh中nad
‑
gdh的热稳定性较差,pqq
‑
gdh底物专一和热稳定性都比较差,影响了它们的应用,而fad
‑
gdh催化效率高、稳定性好、底物专一性好,已经越来越多的用于血糖试纸和葡萄糖生物传感器的生产。
3.中国专利(cn201810301960.x)公开了一种fad为辅基的葡萄糖脱氢酶的生产、纯化方法,属于生物工程领域。本发明以大肠杆菌为宿主,表达来源于洋葱伯克霍尔德菌的葡萄糖脱氢酶,过分批补料,分阶段温度控制,进行葡萄糖脱氢酶表达。
4.目前,以fad为辅基的葡萄糖脱氢酶(即fad
‑
gdh,ec 1.1.99.10)主要来源于丝状真菌,目前为止已经发现和鉴定的fad
‑
gdh主要来自米曲霉、黄曲霉、土曲霉、黑曲霉、碳黑曲霉、青霉和杉木炭疽病菌等,唯一一种原核来源的fad
‑
gdh来源于洋葱伯克氏细菌。fad
‑
gdh的重组表达比较困难,大部分的fad
‑
gdh主要从生产菌株中分离得到。大肠杆菌作为最简单方便和有效的表达宿主,在表达fad
‑
gdh时效果不佳,要么表达量很低要么形成包涵体,上清中检测到的酶活较低。
技术实现要素:
5.本发明的目的在于提供一种发酵诱导时间短、酶活得率高、便于工业化放大生产的fad为辅基的葡萄糖脱氢酶的高产发酵方法。
6.为了实现上述目的,本发明采用了如下方法:一种fad为辅基的葡萄糖脱氢酶的高产发酵方法,其包括如下步骤:
7.1)取
‑
80℃冻存的表达菌种,无菌操作条件下接种至种子培养基中,种子培养基为bmgy培养基或者为ypd培养基,种子培养使用500ml或者1l三刺三角摇瓶,装液量250ml~500ml,接种量0.5
‰
~1.5
‰
,接种后在摇床中30℃250rpm培养16~24小时至od600达到6~
10;
8.2)10l发酵罐发酵需配制3.5l~4l发酵培养基,发酵培养基为bsm基础盐培养基,发酵培养基灭菌后使用28%氨水将ph值调至5.0~6.0;
9.3)将发酵罐中发酵培养基升温至30℃,搅拌转速度设置为650rpm,空气通气速度设置为10l/min,标定溶氧电极100%,然后将搅拌速度设置为250~350rpm,空气通气速度设置为2~3l/min,然后无菌操作条件下往发酵培养基中加入15ml ptm1微量元素溶液,并将种子液接种至发酵培养基,接种量为5~15%;
10.4)发酵开始进入甘油分批培养阶段,通过调节搅拌转速300~650rpm和空气通气量2.5~10l/min,控制溶氧不低于20%,此发酵阶段持续24~26小时,后期溶氧会缓慢上升,待溶氧上升至70~90%,开始甘油补料培养,甘油补料培养基为50%(w/v)无菌甘油,每升甘油补料培养基添加了12ml ptm1微量元素溶液;
11.5)甘油补料培养阶段,设置甘油补料速度60~70ml/hr,连续补料培养4~8小时至菌体湿重200~220g/l,期间通过调节转速和空气通气量使溶氧保持在20%以上,如调节转速和空气通气量不能使溶氧保持在20%以上则停止补料使溶氧上升至20%以上,菌体湿重达到200g/l后停止补料,等溶氧逐渐上升至85%~95%开始将发酵培养基降温至28℃开始甲醇补料培养,每升甲醇补料培养基为988ml100%甲醇加入12ml ptm1微量元素溶液;
12.6)甲醇补料培养阶段开始的2小时,补料速度设置为12~16ml/hr,补料开始后溶氧下降,期间溶氧可能有波动,注意使用暂停补料观察溶氧是否快速上升的方法判断菌体是否已适应甲醇作为碳源,甲醇补料开始阶段,严格控制甲醇不能超量,以免甲醇积累造成菌体中毒死亡;
13.7)甲醇补料培养开始2小时后,暂停补料可观察到溶氧迅速上升,即可将补料速度提高至24~28ml/hr,26ml/hr的补料速度维持2小时后,补料速度提高至38~42ml/hr,保持该补料速度至发酵结束;
14.8)甲醇补料培养开始后约4~5个小时,650rpm的搅拌速度和10l/min空气通气速度也无法将溶氧维持在20%以上,此时将搅拌桨转速降至550~650rpm,将空气通气速度降低至1.5~2.5l/min,开始将氧气通入发酵罐,氧气通气速度0.5~1.5l/min,可保持发酵培养基溶氧不低于20%至诱导培养开始后45~50小时,诱导培养最后10小时保持空气通气速度不变,将氧气通气速度提高至1~2l/min,可以维持发酵培养基溶氧不低于20%至发酵结束;
15.9)甲醇诱导培养时间55~65小时,菌体湿重280~290g/l,更长的诱导时间得到的培养基上清中目的蛋白表达量和酶活都无明显增加;
16.10)将60小时发酵上清透析至ph6.3的pb缓冲液中后检测酶活为115000u/l以上,完成发酵。
17.作为上述技术方案的进一步描述:
18.所述步骤1)中,种子培养基为bmgy培养基,种子培养使用1l三刺三角摇瓶,装液量250ml,接种量1
‰
,od600=8。
19.作为上述技术方案的进一步描述:
20.所述步骤2)中,发酵培养基的体积为3.5l,bsm基础盐培养基灭菌后加入28%氨水110ml,调节ph值至5.0。
21.作为上述技术方案的进一步描述:
22.所述步骤3)中,搅拌速度为300rpm,空气通气速度为2.5l/min,接种量为10%。
23.作为上述技术方案的进一步描述:
24.所述步骤4)中,溶氧上升至80%时,开始甘油补料培养。
25.作为上述技术方案的进一步描述:
26.所述步骤5)中,设置甘油补料速度65ml/hr。
27.作为上述技术方案的进一步描述:
28.所述步骤6)中,补料速度设置为14ml/hr。
29.作为上述技术方案的进一步描述:
30.所述步骤7)中,第一次将补料速度提高至26ml/hr,第二次将补料速度提高至40ml/hr。
31.作为上述技术方案的进一步描述:
32.所述步骤8)中,拌桨转速降至600rpm,空气通气速度降低至2l/min,氧气通气速度1l/min,氧气通气速度提高至1.5l/min。
33.作为上述技术方案的进一步描述:
34.所述步骤9)中,甲醇诱导培养时间60小时。
35.综上所述,由于采用了上述技术方案,本发明的有益效果是:
36.本发明中,通过使用重组毕赤酵母菌在10l发酵罐中培养时经过60小时的诱导,培养基上清中表达的葡萄糖脱氢酶酶活达到1150000u/l(dcpip比色法测定值),酶活得率提高了4.4~4.5倍,并且诱导时间仅需60小时,比现有技术所使用的诱导时间缩短了三分之一甚至近一半,解决了现有技术发酵时间长、酶活得率低、不利于大规模工业化放大生产的问题。
附图说明
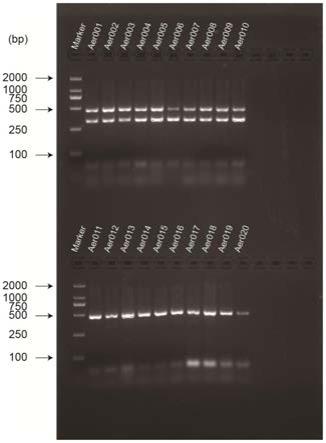
37.图1为一种fad为辅基的葡萄糖脱氢酶的高产发酵方法的框图。
38.图2为一种fad为辅基的葡萄糖脱氢酶的高产发酵方法中不同诱导时间发酵上清sds
‑
page电泳图。
具体实施方式
39.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
40.实施例1:
41.s01:取
‑
80℃冻存的表达菌种,无菌操作条件下接种至种子培养基中,种子培养基为bmgy培养基,种子培养使用500ml三刺三角摇瓶,装液量250ml,接种量0.5
‰
,接种后在摇床中30℃250rpm培养16小时至od600达到6;
42.s02:10l发酵罐发酵需配制3.5l发酵培养基,发酵培养基为bsm基础盐培养基,发酵培养基灭菌后使用28%氨水将ph值调至5.0;
43.s03:将发酵罐中发酵培养基升温至30℃,搅拌转速度设置为650rpm,空气通气速度设置为10l/min,标定溶氧电极100%,然后将搅拌速度设置为250rpm,空气通气速度设置为2l/min,然后无菌操作条件下往发酵培养基中加入15ml ptm1微量元素溶液,并将种子液接种至发酵培养基,接种量为5%;
44.s04:发酵开始进入甘油分批培养阶段,通过调节搅拌转速300rpm和空气通气量2.5l/min,控制溶氧不低于20%,此发酵阶段持续24小时,后期溶氧会缓慢上升,待溶氧上升至70%,开始甘油补料培养,甘油补料培养基为50%(w/v)无菌甘油,每升甘油补料培养基添加了12ml ptm1微量元素溶液;
45.s05:甘油补料培养阶段,设置甘油补料速度60ml/hr,连续补料培养4小时至菌体湿重200g/l,期间通过调节转速和空气通气量使溶氧保持在20%以上,如调节转速和空气通气量不能使溶氧保持在20%以上则停止补料使溶氧上升至20%以上,菌体湿重达到200g/l后停止补料,等溶氧逐渐上升至85%开始将发酵培养基降温至28℃开始甲醇补料培养,每升甲醇补料培养基为988ml 100%甲醇加入12ml ptm1微量元素溶液;
46.s06:甲醇补料培养阶段开始的2小时,补料速度设置为12ml/hr,补料开始后溶氧下降,期间溶氧可能有波动,注意使用暂停补料观察溶氧是否快速上升的方法判断菌体是否已适应甲醇作为碳源,甲醇补料开始阶段,严格控制甲醇不能超量,以免甲醇积累造成菌体中毒死亡;
47.s07:甲醇补料培养开始2小时后,暂停补料可观察到溶氧迅速上升,即可将补料速度提高至24ml/hr,24ml/hr的补料速度维持2小时后,补料速度提高至38ml/hr,保持38ml/hr补料速度至发酵结束;
48.s08:甲醇补料培养开始后约4个小时,650rpm的搅拌速度和10l/min空气通气速度也无法将溶氧维持在20%以上,此时将搅拌桨转速降至550rpm,将空气通气速度降低至1.5l/min,开始将氧气通入发酵罐,氧气通气速度0.5l/min,可保持发酵培养基溶氧不低于20%至诱导培养开始后45小时,诱导培养最后10小时保持空气通气速度不变,将氧气通气速度提高至1l/min,可以维持发酵培养基溶氧不低于20%至发酵结束;
49.s09:甲醇诱导培养时间55小时,菌体湿重280g/l,更长的诱导时间得到的培养基上清中目的蛋白表达量和酶活都无明显增加;
50.s10:将60小时发酵上清透析至ph6.3的pb缓冲液中后检测酶活为115000u/l(dcpip比色法测定值)以上,完成发酵。
51.实施例2:
52.s01:取
‑
80℃冻存的表达菌种,无菌操作条件下接种至种子培养基中,种子培养基为ypd培养基,种子培养使用1l三刺三角摇瓶,装液量500ml,接种量1.5
‰
,接种后在摇床中30℃250rpm培养24小时至od600达到10;
53.s02:10l发酵罐发酵需配制4l发酵培养基,发酵培养基为bsm基础盐培养基,发酵培养基灭菌后使用28%氨水将ph值调至6.0;
54.s03:将发酵罐中发酵培养基升温至30℃,搅拌转速度设置为650rpm,空气通气速度设置为10l/min,标定溶氧电极100%,然后将搅拌速度设置为350rpm,空气通气速度设置为3l/min,然后无菌操作条件下往发酵培养基中加入15ml ptm1微量元素溶液,并将种子液接种至发酵培养基,接种量为15%;
55.s04:发酵开始进入甘油分批培养阶段,通过调节搅拌转速650rpm和空气通气量10l/min,控制溶氧不低于20%,此发酵阶段持续26小时,后期溶氧会缓慢上升,待溶氧上升至90%,开始甘油补料培养,甘油补料培养基为50%(w/v)无菌甘油,每升甘油补料培养基添加了12ml ptm1微量元素溶液;
56.s05:甘油补料培养阶段,设置甘油补料速度70ml/hr,连续补料培养8小时至菌体湿重220g/l,期间通过调节转速和空气通气量使溶氧保持在20%以上,如调节转速和空气通气量不能使溶氧保持在20%以上则停止补料使溶氧上升至20%以上,菌体湿重达到200g/l后停止补料,等溶氧逐渐上升至95%开始将发酵培养基降温至28℃开始甲醇补料培养,每升甲醇补料培养基为988ml 100%甲醇加入12ml ptm1微量元素溶液;
57.s06:甲醇补料培养阶段开始的2小时,补料速度设置为16ml/hr,补料开始后溶氧下降,期间溶氧可能有波动,注意使用暂停补料观察溶氧是否快速上升的方法判断菌体是否已适应甲醇作为碳源,甲醇补料开始阶段,严格控制甲醇不能超量,以免甲醇积累造成菌体中毒死亡;
58.s07:甲醇补料培养开始2小时后,暂停补料可观察到溶氧迅速上升,即可将补料速度提高至28ml/hr,26ml/hr的补料速度维持2小时后,补料速度提高至42ml/hr,保持该补料速度至发酵结束;
59.s08:甲醇补料培养开始后约5个小时,650rpm的搅拌速度和10l/min空气通气速度也无法将溶氧维持在20%以上,此时将搅拌桨转速降至650rpm,将空气通气速度降低至2.5l/min,开始将氧气通入发酵罐,氧气通气速度1.5l/min,可保持发酵培养基溶氧不低于20%至诱导培养开始后50小时,诱导培养最后10小时保持空气通气速度不变,将氧气通气速度提高至2l/min,可以维持发酵培养基溶氧不低于20%至发酵结束;
60.s09:甲醇诱导培养时间65小时,菌体湿重290g/l,更长的诱导时间得到的培养基上清中目的蛋白表达量和酶活都无明显增加;
61.s10:将60小时发酵上清透析至ph6.3的pb缓冲液中后检测酶活为115000u/l(dcpip比色法测定值)以上,完成发酵。
62.实施例3:
63.s01:取
‑
80℃冻存的表达菌种,无菌操作条件下接种至种子培养基中,种子培养基为bmgy培养基,种子培养使用1l三刺三角摇瓶,装液量250ml,接种量1
‰
,接种后在摇床中30℃250rpm培养20小时至od600达到8;
64.s02:10l发酵罐发酵需配制3.5l发酵培养基,发酵培养基为bsm基础盐培养基,发酵培养基灭菌后加入28%氨水110ml,调节ph值至5.0;
65.s03:将发酵罐中发酵培养基升温至30℃,搅拌转速度设置为650rpm,空气通气速度设置为10l/min,标定溶氧电极100%,然后将搅拌速度设置为300rpm,空气通气速度设置为2.5l/min,然后无菌操作条件下往发酵培养基中加入15ml ptm1微量元素溶液,并将种子液接种至发酵培养基,接种量为10%;
66.s04:发酵开始进入甘油分批培养阶段,通过调节搅拌转速500rpm和空气通气量5l/min,控制溶氧不低于20%,此发酵阶段持续25小时,后期溶氧会缓慢上升,待溶氧上升至80%,开始甘油补料培养,甘油补料培养基为50%(w/v)无菌甘油,每升甘油补料培养基添加了12ml ptm1微量元素溶液;
67.s05:甘油补料培养阶段,设置甘油补料速度65ml/hr,连续补料培养6小时至菌体湿重210g/l,期间通过调节转速和空气通气量使溶氧保持在20%以上,如调节转速和空气通气量不能使溶氧保持在20%以上则停止补料使溶氧上升至20%以上,菌体湿重达到200g/l后停止补料,等溶氧逐渐上升至90%开始将发酵培养基降温至28℃开始甲醇补料培养,每升甲醇补料培养基为988ml 100%甲醇加入12ml ptm1微量元素溶液;
68.s06:甲醇补料培养阶段开始的2小时,补料速度设置为14ml/hr,补料开始后溶氧下降,期间溶氧可能有波动,注意使用暂停补料观察溶氧是否快速上升的方法判断菌体是否已适应甲醇作为碳源,甲醇补料开始阶段,严格控制甲醇不能超量,以免甲醇积累造成菌体中毒死亡;
69.s07:甲醇补料培养开始2小时后,暂停补料可观察到溶氧迅速上升,即可将补料速度提高至26ml/hr,26ml/hr的补料速度维持2小时后,补料速度提高至40ml/hr,保持40ml/hr补料速度至发酵结束;
70.s08:甲醇补料培养开始后约4~5个小时,650rpm的搅拌速度和10l/min空气通气速度也无法将溶氧维持在20%以上,此时将搅拌桨转速降至600rpm,将空气通气速度降低至2l/min,开始将氧气通入发酵罐,氧气通气速度1l/min,可保持发酵培养基溶氧不低于20%至诱导培养开始后48小时,诱导培养最后10小时保持空气通气速度不变,将氧气通气速度提高至1.5l/min,可以维持发酵培养基溶氧不低于20%至发酵结束;
71.s09:甲醇诱导培养时间60小时,菌体湿重285g/l,更长的诱导时间得到的培养基上清中目的蛋白表达量和酶活都无明显增加;
72.s10:将60小时发酵上清透析至ph6.3的pb缓冲液中后检测酶活为115000u/l(dcpip比色法测定值)以上,完成发酵。
73.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。