1.本发明属于有机光电材料技术领域,具体涉及一类含有星型结构柔性链段的有机光伏器件活性层材料及其制备和应用。
背景技术:
2.近年来,由于全球能源的需求量不断增加,能源短缺问题逐步凸显,光伏器件开始进入人们的视野。和无机太阳电池相比,有机太阳电池具有柔性可拉伸的特点,在制造下一代可穿戴和可拉伸电子产品上具有巨大的潜力和优势。这引起了人们的广泛关注,使之在近十年的发展过程中成为各种光电器件中最有前途的一类材料。在实际应用中,有机光伏器件暴露在热氧和拉伸应力环境中,会加速器件的老化,使器件光伏性能下降。
3.由应变引起的活性层断裂是效率下降的最重要因素之一。作为柔性和可拉伸器件的关键部件,具备优异的可拉伸性能和光电性能的聚合物活性层在提高器件的应变耐受性和变形能力方面具有较大优势,但其进一步发展仍然存在巨大的挑战性。由于现阶段所流行的共轭聚合物具有刚性的π-π共轭部分以及聚合物链较强的结晶性,导致共轭聚合物膜与橡胶和塑料等传统聚合物相比,可拉伸性能较为有限且易失效,限制了柔性和可拉伸光电器件的应变稳定性。所以要实现较强的应变稳定性,采用向共轭聚合物体系中引入柔性链段单元的方法制备含柔性单元的三元无规共聚物就显得十分重要了。
技术实现要素:
4.为了赋予有机光伏器件本征可拉伸性能,发展新的活性层材料,本发明的首要目的在于提供一类含有星型结构柔性链段的有机光伏器件活性层材料。本发明的活性层材料由萘[1,2-c:5,6-c']双([1,2,5]五元环)单元衍生物、星型结构柔性链段单元、给电子单元构成,引入星型结构柔性链段,增强材料形变性能,从而获得高性能可拉伸有机光伏器件。
[0005]
本发明的再一目的在于提供一种上述含有星型结构柔性链段的有机光伏器件活性层材料的制备方法。
[0006]
本发明另一目的在于提供上述含有星型结构柔性链段的有机光伏器件活性层材料在制备有机光伏器件中的应用。
[0007]
本发明的目的通过以下技术方案实现:
[0008]
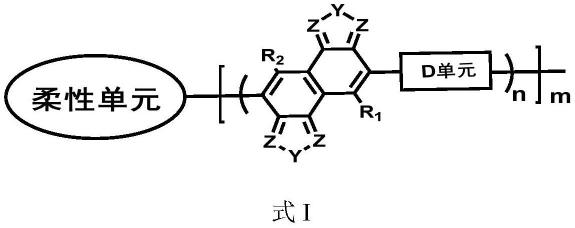
一类含星型结构柔性链段的有机光伏器件的活性层材料,其结构为式i:
[0009][0010]
式i中,m代表星型臂的数目,m包括但不限于2-10条;聚合度n的范围为5-300;
[0011]
式i中,y相对独立的选自o,s,se,或n-r1中的一种;
[0012]
式i以及y中,r1和r2每次出现时相对独立的为氢原子、具有1~20个碳原子的直链烷基、具有3~20个碳原子的支化烷基、具有1~20个碳原子的烷氧基、具有1~20个碳原子的烷硫基,具有2~20个碳原子的直链烯基、具有3~20个碳原子的支化或者环状的烯基、具有2~20个碳原子的烯氧基、具有2~20个碳原子的烯硫基,具有2~20个碳原子的直链炔基、具有3~20个碳原子的支化或者环状的炔基,具有2~20个碳原子的直链烷基羰基、具有3~20个碳原子的支化或者环状的烷基羰基,具有4~20个碳原子的芳基,具有4~20个碳原子的杂芳基,具有4~20个碳原子的芳烷基,具有4~20个碳原子的杂芳基烷基,具有4~20个碳原子的芳氧基,具有4~20个碳原子的杂芳氧基,具有4~20个碳原子的芳基烷氧基,或者是具有4~20个碳原子的杂芳基烷氧基中的一种,其中r1和r2可相同,可不相同;
[0013]
z在每次出现时相同或不同地为ch或n;
[0014]
d单元为电子给体单元,为如下结构式中的一种:
[0015][0016]
其中,r4和r5相对独立的为取代的或未取代的以下基团中的一种:具有1-20个碳原子数的烷基,具有4~20个碳原子的芳基,具有4~20个碳原子的杂芳基,具有4~20个碳原子的芳烷基,具有4~20个碳原子的杂芳基烷基,具有4~20个碳原子的芳氧基,具有4~20个碳原子的杂芳氧基,具有4~20个碳原子的芳基烷氧基,以及具有4~20个碳原子的杂芳基烷氧基。其中取代是指一个或多个氢原子被支链烷基、氧原子、烯基、炔基、芳基等中的至少一种取代后形成的基团;
[0017]
式i中,柔性单元的结构为ar1(cn-ar)m*,其中-(cn-ar)-为星型结构链中的一部分,m与式i中的m的定义相同,均代表星型单元链的数量,星型单元的数量m包括但不限于2-10条。
[0018]
柔性单元的结构中,cn柔性链为具有2~20个碳原子的直链烷基、具有2~20个碳原子的支化烷基、具有2~20个碳原子的烷氧基、具有2~20个碳原子的烷硫基,具有3~20个碳原子的直链烯基、具有3~20个碳原子的支化的烯基、具有3~20个碳原子的环状的烯基、具有3~20个碳原子的烯氧基、具有3~20个碳原子的烯硫基,具有3~20个碳原子的直链炔基、具有3~20个碳原子的支化的炔基、具有3~20个碳原子的环状的炔基,具有3~20
个碳原子的直链烷基羰基、具有3~20个碳原子的支化的烷基羰基、具有3~20个碳原子的环状的烷基羰基、具有一个碳氮双键的3~20个碳原子的亚胺基中的一种。
[0019]
柔性单元的结构中,ar为如下结构中的一种或多种偶联结构:
[0020][0021]
其中,r3和r6相对独立的为氢原子、取代的或未取代的具有1-20个碳原子数的烷基、取代的或未取代的具有1-20个碳原子数的烷氧基中的一种,其中取代是指一个或多个氢原子被氧原子、烯基、炔基、芳基等中的至少一种取代后形成的基团;
[0022]
柔性单元的结构中,ar1为如下结构中的一种或多种偶联结构:
[0023][0024]
一种上述的含星型结构柔性链段的有机光伏器件的活性层材料的制备方法,包括
以下步骤:
[0025]
在惰性气体或氮气氛围和有机溶剂中,将含星型结构柔性单元的单体、含给电子单元的单体与含萘[1,2-c:5,6-c']双([1,2,5]五元环)单元衍生物的单体混合,然后在催化剂的催化下进行聚合反应,纯化后得到所述含柔性链段的聚合物活性层材料。
[0026]
其中,含萘[1,2-c:5,6-c']双([1,2,5]五元环)单元衍生物的单体优选为如下结构式中的一种:
[0027][0028]
其中,r1、r2的定义如前所述。
[0029]
所述的含星型结构柔性单元的单体优选为每个星型单元链均由三甲基锡封端的
单体,如优选为ar1(cn-ar-(snme3))m;所述的含给电子单元的单体优选为由三甲基锡双封端的单体,如
[0030]
所述有机溶剂可以为氯苯、二氯苯、甲苯、二甲苯中的一种;所述催化剂包括钯催化剂,可以为四三苯基膦钯、醋酸钯、三(二亚苄丙酮)二钯中的一种;所述含星型结构柔性单元单体与含给电子单元单体反应官能团的物质的量之和与含萘[1,2-c:5,6-c']双([1,2,5]五元环)单元单体反应官能团的物质的量相等。
[0031]
所述聚合反应的反应温度为130~140℃,反应的时间为40~48h,搅拌速率为600~1000rpm。
[0032]
所述混合的方式为物理混合;上述纯化的方式包括沉析、过滤、柱层析及抽提中的一种以上。
[0033]
本发明的含星型结构柔性链段的聚合物光伏器件活性层材料通过stille偶联反应制备,其反应方程式为:
[0034][0035]
本发明的合成特点是:在钯催化剂的催化下,萘[1,2-c:5,6-c']双([1,2,5]五元环)单元、星型结构柔性链段单元、给电子单元及其衍生物通过stille偶联反应进行三元无规共聚反应,从而向聚合物体系中引入星型结构柔性单元。
[0036]
本发明的含星型结构柔性链段的有机光伏器件的活性层材料在有机光伏器件中应用。
[0037]
与现有技术相比,本发明的有益效果是:
[0038]
(1)本发明的含星型结构柔性链段的聚合单体材料,制备方法简单,提纯容易,可大规模生产;
[0039]
(2)本发明可通过选择不同的星型结构柔性单元调控聚合物结构性能,满足不同场景需求;
[0040]
(3)本发明的含星型结构柔性链段的聚合物活性层材料有利于增强材料形变性能,从而获得高效的可拉伸有机光伏器件。
[0041]
(4)本发明采用向共轭聚合物体系中引入柔性链段单元的方法制备含柔性单元的三元无规共聚物,实现较强的应变稳定性。
附图说明
[0042]
图1是含星型结构柔性链段的聚合物活性层材料p1的紫外-可见光吸收曲线;
[0043]
图2是含星型结构柔性链段的聚合物活性层材料p1的循环伏安特性曲线;
[0044]
图3是含星型结构柔性链段的聚合物活性层材料p2和p3分别与n2200为活性层的聚合物太阳电池的电压-电流密度曲线;
[0045]
图4是含星型结构柔性链段的聚合物活性层材料p2和p3分别与n2200为活性层的聚合物太阳电池的波长-外量子效率曲线;
[0046]
图5是含星型结构柔性链段的聚合物活性层材料p4、p5和p6分别与n2200为活性层的聚合物光探测器的电压-暗电流密度曲线。
[0047]
图6是含星型结构柔性链段的聚合物活性层材料p1、p2、p3和p4分别与n2200为活性层材料以及不含星型结构柔性链段的聚合物p1-1与n2200作为活性层材料的应力-应变曲线。
具体实施方式
[0048]
下面结合具体实施例和附图对本发明作进一步详细描述,但本发明的实施方式不限于此。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
[0049]
实施例中所用试剂如无特殊说明均可从市场常规购得。
[0050]
一、材料单体(m1)的制备
[0051]
(1)1,3,5-三(3-(苄氧基)丙-1-烯-1-基)苯的合成(m1-1):在500ml的两口圆底烧瓶内,称取1,3,5-三溴苯(31.18g,100mmol),加入乙腈150ml及三乙胺32ml,抽换气3次,称取醋酸钯(1.12g,5mmol)和三苯基膦(2.24g,10mmol)。在氮气保护下,迅速加至反应液中,搅拌30分钟后逐滴加入烯丙基苄基醚(51.84g,350mmol)升高温度,在90℃下反应20小时。反应后处理:加入20ml盐酸溶液淬灭反应,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂。进一步的提纯使用硅胶层析柱进行分离,石油醚/乙酸乙酯(8:1)作为淋洗剂,通过柱层析得到褐色油状液体(m1-1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.34(m,3h),7.31(d,6h),7.28(m,6h),6.65(d,3h),6.55(s,3h),6.25(t,3h),4.88(s,6h),4.04(s,6h)。制备过程化学反应方程式如下。
[0052][0053]
(2)1,3,5-苯丙三醇的合成(m1-2):向250ml的两口圆底烧瓶内通氮气,迅速称取氢化铝锂(3.80g,100mmol),放入0℃的冷却循环装置内。逐滴滴加30ml无水四氢呋喃,搅拌反应30分钟。称取1,3,5-三(3-(苄氧基)丙-1-烯-1-基)苯(m1-1)(1.63g,30mmol),溶解于10ml无水四氢呋喃中,分3次逐滴滴入反应瓶中,每次间隔20分钟,待全部滴完后继续反应1
小时,然后移至室温反应2小时。反应后处理:加入20ml冰水淬灭反应,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂。用少量四氢呋喃溶解初产物,使用正己烷重结晶进一步的提纯使用硅胶层析柱进行分离,二氯甲烷/甲醇(30:1)作为淋洗剂,通过柱层析得到无色油状液体(m1-2)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):6.82(s,3h),4.42(t,3h),3.47-3.38(m,6h),2.61-2.49(m,6h),1.73(m,6h)。制备过程化学反应方程式如下。
[0054][0055]
(3)1,3,5-三(3-碘丙基)苯(m1-3)的合成:在500ml的两口圆底烧瓶内,称取三苯基膦(23.61g,90mmol)和碘(22.83g,90mmol),加入二氯甲烷200ml,在氮气氛围保护下,置于25℃下搅拌,反应30分钟后,向混合物中加入咪唑(7.48g,110mmol),加完后继续反应30分钟。然后向反应瓶中加入1,3,5-苯丙三醇(m1-2)(6.30g,25mmol),升高温度至60℃下反应10小时。反应后处理:加入90ml饱和焦亚硫酸钠溶液淬灭反应,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂。进一步的提纯使用硅胶层析柱进行分离,石油醚/乙酸乙酯(8:1)作为淋洗剂,通过柱层析得到黄色油状液体(m1-3)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):6.89(s,3h),3.43(t,6h),2.63(t,6h),2.20(m,6h)。制备过程化学反应方程式如下。
[0056][0057]
(4)1,3,5-三(3-(噻吩-2-基)丙基)苯(m1-4)的合成:向100ml的圆底烧瓶中加入20ml无水四氢呋喃,然后加入镁屑(2.2g,90mmol)搅拌。将2-溴噻吩(70mmol,11.4g)溶解在20ml无水四氢呋喃中,温度保持在60℃,在氮气气氛下,逐滴加入镁屑的四氢呋喃混合液中,反应2小时后,使用注射器将格氏试剂溶液与剩余的mg分离待用。在100ml两口圆底烧瓶内,加入化合物m1-3(1.16g,20mmol)和上述反应液,20ml无水四氢呋喃,在氮气保护下,置于-10℃的冷却循环装置内,冷却30分钟后,向反应瓶中逐滴加入0.1m四氯合铜酸二锂(7.5ml,0.75mmol),在此温度下反应5小时。反应后处理:加入20ml饱和氯化铵溶液淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用乙醚进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪除去溶剂。进一步的提纯使用硅胶层析柱进行分离,纯石油醚作为淋洗剂,通过柱层析得到无色油状液体(m1-4)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,dmso),δ(ppm):7.39(d,3h),7.09-6.85
(m,9h),2.83-2.57(m,12h),1.86(m,6h)。制备过程化学反应方程式如下。
[0058][0059]
(5)1,3,5-三(3-(5-(三甲基锡基)噻吩-2-基)丙基)苯(m1)的合成:在250ml两口圆底烧瓶内,称取化合物m1-4(2.50g,5.55mmol),加入40ml无水四氢呋喃,在氮气保护下,放入-78℃的冷却循环装置内,冷却30分钟后,向反应瓶中逐滴加入2.5m正丁基锂溶液(10.68ml,26.70mmol),在此温度下反应2小时,再向反应体系内逐滴加入1.0m三甲基氯化锡溶液(35.10ml,35.10mmol),加完之后恢复室温,反应3小时。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物,再用乙醇反复重结晶三次,将得到的产物放入真空烘箱中干燥,最终得到白色片状固体(m1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.09-7.06(m,6h),6.85(d,3h),2.87-2.74(m,6h),2.63-2.58(m,6h),1.86-1.82(m,6h),0.27(s,27h)。制备过程化学反应方程式如下。
[0060][0061]
二、材料单体(m2)的制备
[0062]
(1)2-(4-溴丁基)噻吩(m2-1)的合成:在100ml两口圆底烧瓶内,称取噻吩(8.42g,100mmol),加入40ml无水四氢呋喃,在氮气保护下,放入-78℃的冷却循环装置内,冷却30分钟后,向反应瓶中逐滴加入2.5m正丁基锂溶液(36.00ml,90mmol),在此温度下反应2小时,再向反应体系内加入1,4-二溴丁烷(21.60g,100mmol),加完之后恢复室温,反应6小时。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用石油醚进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物。进一步的提纯使用硅胶层析柱进行分离,纯石油醚作为淋洗剂,通过柱层析得到无色油状液体(m2-1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.31(d,1h),6.98(m,1h),6.85(d,1h),3.52(t,2h),2.85(t,2h),1.81(m,2h),1.50(m,2h)。制备过程化学反应方程式如下。
[0063][0064]
(2)三(4-(4-(噻吩-2-基)丁氧基)苯基)甲烷(m2-2)的合成:在250ml的两口圆底
烧瓶内,称取4,4',4
”‑
亚甲基三苯酚(5.00g,10.27mmol)和2-(4-溴丁基)噻吩(m2-1)(7.83g,35.94mmol)及碳酸钾(5.53g,40.00mmol),加入二甲基甲酰胺100ml,抽换气三次后,在氮气氛围保护下,加热至100℃,反应6小时。反应后处理:加入少量去离子水淬灭反应,将其倒入装有200ml饱和氯化钠水溶液的烧杯中,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(4:1)作为淋洗剂,通过柱层析得到白色固体物质(m2-2)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.38(d,3h),7.13(s,6h),7.01-6.85(m,12h),5.41(s,1h),4.11(t,6h),2.81(t,6h),1.73-1.50(m,12h)。制备过程化学反应方程式如下。
[0065][0066]
(2)三(4-(4-(5-(三甲基锡基)噻吩-2-基)丁氧基)苯基)甲烷(m2)的合成:在100ml两口圆底烧瓶内,称取化合物m2-2(2.50g,3.54mmol),加入40ml无水四氢呋喃,在氮气保护下,放入-78℃的冷却循环装置内,冷却30分钟后,向反应瓶中逐滴加入2.5m正丁基锂溶液(5.10ml,12.75mmol),在此温度下反应2小时,再向反应体系内逐滴加入1m三甲基氯化锡溶液(15.20ml,15.20mmol),加完之后恢复室温,反应过夜。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物,再用乙醇反复重结晶三次,将得到的产物放入真空烘箱中干燥,最终得到白色固体物质(m2)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,制备过程化学反应方程式如下。1h nmr(400mhz,cdcl3),δ(ppm):7.11(s,6h),7.06-6.85(m,12h),5.41(s,1h),4.15(t,6h),2.82(t,6h),1.73-1.50(m,12h),0.27(s,27h)。
[0067][0068]
三、材料单体(m3)的制备
[0069]
(1)n,n',n
”‑
(苯-1,3,5-三酰基)三(6-溴代己烷-1-亚胺)(m3-1)的合成:在250ml的两口圆底烧瓶内,称取6-羟基己醛(16.50g,142.18mmol),加入甲苯60ml搅拌,在氮气氛围保护下,分三次加入1,3,5-三氨基苯(5.04g,40.62mmol),在30℃下搅拌半小时至完全溶解,升高温度至100℃下搅拌反应,反应6小时。反应后处理:反应液冷却至室温,加入30ml去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用
无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪除去溶剂。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(4:1)作为淋洗剂,通过柱层析得到黄色油状液体(m3-1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):8.52(t,3h),6.65(s,3h),4.73(s,3h),3.65(t,6h),2.21(m,6h),1.58-1.53(m,12h),1.31(m,6h)。制备过程化学反应方程式如下。
[0070][0071]
(2)n,n',n
”‑
(苯-1,3,5-三酰基)三(5-(噻吩-2-氧基)戊烷-1-亚胺)(m3-2)的合成:向250ml的圆底烧瓶中称取化合物m3-1(7.51g,20mmol)、2-溴噻吩(10.52g,65mmol)和四丁基溴铵(0.64g,2mmol),加入60ml甲苯抽换气3次,在氮气氛围下,升高温度至100℃,搅拌反应6小时。将反应液温度降低至60℃,向反应体系中逐滴加入naoh水溶液(质量分数40%,20ml),然后在80℃下搅拌6h。反应后处理:反应液冷却至室温,加入30ml去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪除去溶剂。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(4:1)作为淋洗剂,通过柱层析得到黄色油状液体(m3-2)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):8.52(t,3h),6.73-6.69(m,6h),6.56(m,3h),6.21(d,3h),4.25(t,6h),2.24(m,6h),1.86(m,6h),1.54(m,6h)。制备过程化学反应方程式如下。
[0072][0073]
(3)n,n',n'-(苯-1,3,5-三酰基)三(5-((5-(三甲基锡基)噻吩-2-基)氧基)戊烷-1-亚胺)(m3)的合成:在100ml两口圆底烧瓶内,称取化合物m3-2(2.48g,4.00mmol),加入30ml无水四氢呋喃,在氮气氛围下,置于-78℃的冷却循环装置内,冷却30分钟后,向反应瓶中逐滴加入2.5m正丁基锂溶液(5.40ml,13.50mmol),在此温度下反应2小时,再向反应体系内逐滴加入1.0m三甲基氯化锡溶液(15.60ml,15.60mmol),加完之后恢复室温,反应3小时。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得
到初产物,再用乙醇反复重结晶三次,将得到的产物放入真空烘箱中干燥,最终得到黄色固体(m3)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):8.50(t,3h),6.73-6.69(m,6h),6.24(d,3h),4.25(t,6h),2.24(m,6h),1.86(m,6h),1.54(m,6h),0.27(s,27h)。制备过程化学反应方程式如下。
[0074][0075]
四、材料单体(m4)的制备
[0076]
(1)1,5-二十一烷基萘(m4-1)的合成:在250ml的两口圆底烧瓶内,称取萘(6.4g,50mmol)和十一烷酰氯(20.5g,100mmol)溶于70ml二氯甲烷中,抽换气2次,在30分钟内分3次向反应液中加完三氯化铝(14.6g,110mmol),升高温度至65℃,反应6小时。反应后处理:向反应液中缓慢加入50ml冰水淬灭反应,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂待使用。将得到的无色油状物质用浓盐酸溶解,加入锌粉(6.5g,100mmol),在65℃下搅拌,反应4小时。反应后处理:加入100ml饱和的碳酸氢钠溶液淬灭反应,过滤除去未反应的锌粉。用二氯甲烷反复萃取滤液三次,然后用无水硫酸镁干燥,过滤后使用减压旋转蒸发仪除去溶剂后得到初产物。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(5:1)作为淋洗剂,通过柱层析得到无色油状液体(m4-1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.95(d,2h),7.61(t,2h),6.96(d,2h),3.21(t,4h),1.63(m,4h),1.28-1.24(m,32h),0.86(m,6h)。制备过程化学反应方程式如下。
[0077][0078]
(2)2,6-二溴-4,8-二十一烷基萘(m4-2)的合成:在250ml两口圆底烧瓶内,称取化合物m4-1(6.50g,14.89mmol)和n-溴代琥珀酰亚胺(5.83g,32.74mmol),加入60ml三氯甲烷,在氮气保护下,升高温度至65℃,搅拌反应8小时。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(6:1)作为淋洗剂,通过柱层析得到白色固体粉末(m4-2)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):8.15(d,2h),6.85(d,2h),3.21(t,4h),1.63(m,4h),1.28-1.24(m,32h),0.86(m,6h)。制备过程化学反应方程式如下。
[0079][0080]
(3)2,6-二溴-1,5-二硝基-4,8-二十一烷基萘(m4-3)的合成:在250ml两口圆底烧瓶内,称取化合物m4-2(3.76g,10.00mmol),加入50ml冰醋酸,在氮气保护下搅拌溶解,逐滴加入浓硝酸(10.22ml,23.00mmol)升高温度至65℃,搅拌反应8小时。反应后处理:加入50ml饱和的碳酸氢钠溶液淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(6:1)作为淋洗剂,通过柱层析得到棕色固体粉末(m4-3)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.67(s,2h),3.11(t,4h),1.63(m,4h),1.28-1.24(m,32h),0.87(m,6h)。制备过程化学反应方程式如下。
[0081][0082]
(4)n,n'-(1,5-二硝基-4,8-二十一烷基萘-2,6-二酰基)双(1,1-二苯基甲亚胺)(m4-4)的合成:在100ml两口圆底烧瓶内,称取叔丁基醇钠(1.92g,20.00mmol),溶解于30ml甲苯,抽换气3次,迅速向反应液中加入三二亚苄基丙酮二钯(0.17g,0.18mmol)和,2'-双(二苯基膦)-1,1'-联萘(0.23g,0.36mmol)。在室温下搅拌10分钟后反应液变为深红色溶液。然后将2,6-二溴-1,5-二硝基-4,8-二十一烷基萘(m4-3)(2.50g,3.67mmol)分3次添加到反应混合物中,升高反应温度至85℃,继续搅拌反应液30分钟。向反应液中滴加二苯甲亚胺(1.85ml,11.05mmol),出现棕色固体物质,继续反应2小时。反应后处理:停止加热,待反应液温度冷却至室温,进行过滤,得到的黑色固体物质为初产物(m4-4)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.95(d,4h),7.64-7.58(m,10h),7.41-7.38(m,8h),3.13(t,4h),1.61(m,4h),1.28-1.24(m,32h),0.85(m,6h)。制备过程化学反应方程式如下。
[0083][0084]
(5)4,8-二十一烷基-1,2,5,6-四氢萘-1,2,5,6-四胺(m4-5)的合成:在100ml两口圆底烧瓶内,称取n,n'-(1,5-二硝基-4,8-二十一烷基萘-2,6-二酰基)双(1,1-二苯基甲亚胺)(m4-4)(2.10g,2.37mmol)和二氯亚锡(1.35g,7.11mmol),溶解于35ml盐酸。升高温度至70℃,反应5小时。然后停止加热,待冷却至室温后移至0℃的冷阱中搅拌30分钟,有红棕色
固体物质出现。反应后处理:过滤得到红棕色固体,用无水乙醇冲洗固体直至滤液变为无色,所得到的固体为初产物(m4-5)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):6.85(s,2h),4.83(d,8h),3.13(t,4h),1.59(m,4h),1.28-1.26(m,32h),0.85(m,6h)。制备过程化学反应方程式如下。
[0085][0086]
(6)4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]噻二唑)(m4-6)的合成:在250ml的两口圆底烧瓶内,称取4,8-二十一烷基-1,2,5,6-四氢萘-1,2,5,6-四胺(m4-5)(5.00g,10.00mmol)溶于100ml无水吡啶,抽换气三次后,在氮气氛围保护下,逐滴加入氯化亚砜(3.27ml,45.00mmol),加热至80℃,反应3小时。反应后处理:加入20ml饱和碳酸氢钠水溶液淬灭反应,将其倒入装有200ml饱和氯化钠水溶液的烧杯中,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂。采用热的二氧六环溶液重结晶,得到橙色固体物质(m4-6)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):8.22(d,2h),3.07(t,4h),1.64(m,4h),1.29-1.15(m,32h),0.88(m,6h)。制备过程化学反应方程式如下。
[0087][0088]
(7)5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]噻二唑)(m4)的合成:在100ml两口圆底烧瓶内,称取化合物m4-6(2.50g,4.53mmol)和n-溴代琥珀酰亚胺(1.73g,9.96mmol),加入30ml三氯甲烷,在氮气保护下,升高温度至65℃,逐滴加入冰醋酸(2ml),搅拌反应5小时。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(6:1)作为淋洗剂,通过柱层析得到橙色固体物质(m4)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):3.07(t,4h),1.64(m,4h),1.29-1.15(m,32h),0.88(m,6h)。制备过程化学反应方程式如下。
[0089][0090]
五、材料单体(m5)的制备
[0091]
(1)4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]硒二唑)(m5-1)的合成:在250ml的两口圆底烧瓶内,称取4,8-二十一烷基-1,2,5,6-四氢萘-1,2,5,6-四胺(5.00g,10.00mmol)溶于100ml无水吡啶,抽换气三次后,在氮气氛围保护下,将反应液冷却到0℃,逐滴加入二氯氧硒(7.46g,45.00mmol),加热至80℃,反应3小时。反应后处理:加入20ml饱和碳酸氢钠水溶液淬灭反应,将其倒入装有200ml饱和氯化钠水溶液的烧杯中,然后用二氯甲烷进行萃取,去离子水清洗,反复萃取3次后,用无水硫酸镁干燥,过滤之后使用减压旋转蒸发仪除去溶剂。采用热的二氧六环溶液重结晶,得到褐色固体物质(m5-1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):5.98(d,2h),2.41(t,4h),1.64(m,4h),1.29-1.15(m,32h),0.88(m,6h)。制备过程化学反应方程式如下。
[0092][0093]
(2)5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]硒二唑)(m5)的合成:在100ml两口圆底烧瓶内,称取化合物m5-1(3.00g,4.62mmol)和n-溴代琥珀酰亚胺(1.81g,10.18mmol),加入40ml三氯甲烷,在氮气保护下,升高温度至65℃,逐滴加入冰醋酸(2.10ml),搅拌反应5小时。反应后处理:加入少量去离子水淬灭反应,然后将其倒入装有200ml去离子水的烧杯中,用二氯甲烷进行萃取,使用无水硫酸镁进行干燥,过滤之后使用减压旋转蒸发仪移除溶剂,得到初产物。进一步的提纯使用硅胶层析柱进行分离,石油醚/二氯甲烷(5:1)作为淋洗剂,通过柱层析得到褐色固体物质(m5)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):2.43(t,4h),1.62(m,4h),1.29-1.15(m,32h),0.88(m,6h)。制备过程化学反应方程式如下。
[0094][0095]
实施例1含星型结构柔性链段的聚合物活性层材料p1的合成
[0096]
称取m4单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]噻二唑)(70.82mg,0.10mmol)、2,6-二(三甲基锡)-4,8-二(5-(2-乙基己基)噻吩基-2-)-苯并二噻吩(77.02mg,0.085mmol)和m1单体1,3,5-三(3-(5-(三甲基锡基)噻吩-2-基)丙基)苯(9.42mg,0.01mmol)和pd(pph3)4(6.9mg)于15ml的耐压管中,在氮气氛围下加入1.20ml的超干氯苯。反应体系加热至140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到紫黑色固体(p1)。1hnmr、
13
cnmr、ms
和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.74(s,3h),7.36(s,3h),7.31(s,9h),7.24(s,3h),6.78(d,9h),3.32(s,6h),3.07(s,6h),2.97(s,9h),2.77(s,3h),2.63(s,3h),2.44(s,9h),2.27(s,18h),2.01(s,3h),1.90(s,3h),1.61(s,12h),1.55(s,6h),1.38(s,6h),1.35
–
1.13(m,123h),0.91(d,48h)。高温gpc:mn=37.6kda;mw=56.5kda。制备过程化学反应方程式如下:
[0097][0098]
与p1相对应的不含星型结构柔性链段的聚合物活性层材料p1-1的合成:称取m4单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]噻二唑)(70.82mg,0.10mmol)和2,6-二(三甲基锡)-4,8-二(5-(2-乙基己基)噻吩基-2-)-苯并二噻吩(90.61mg,0.10mmol)和pd(pph3)4(6.9mg)于15ml的耐压管中,在氮气氛围下加入1.20ml的超干氯苯。反应体系加热至140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到紫褐色固体(p1-1)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.76(s,2h),7.42(s,2h),7.31(d,6h),6.80(s,4h),3.60(s,3h),3.07(s,4h),2.77(s,3h),1.77(s,2h),1.58(d,11h),1.38(s,4h),1.32
–
1.23(m,81h),0.93(s,12h),0.89(s,19h)。高温gpc:mn=31.5kda;mw=49.3kda。
[0099]
含星型结构柔性链段的聚合物活性层材料p1的紫外-可见光吸收曲线如图1所示,该聚合物的主要吸收峰峰值约在593nm处,吸收边约在684nm处。与不引入柔性链段的该体系聚合物相比,吸收峰产生一定程度的红移,分子内电荷转移效应增强。
[0100]
含星型结构柔性链段的聚合物活性层材料p1的循环伏安特性曲线如图2所示,该聚合物的起始氧化电位为1.09v,起始还原电位为-0.77v。通过公式e
homo
=-e[e
ox-e(
fc/fc
) 4.80](ev);e
lumo
=-e[e
red-e(
fc/fc
) 4.80](ev)计算聚合物的lumo和homo能级为-3.63ev/-5.48ev。
[0101]
实施例2含星型结构柔性链段的聚合物活性层材料p2的合成
[0102]
称取m4单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6c']双([1,2,5]噻二唑)(70.82mg,0.10mmol)、5,5'-双(三甲基甲锡烷基)-2,2'-联噻吩(41.98mg,0.085mmol)和m2单体三(4-(4-(5-(三甲基锡基)噻吩-2-基)丁氧基)苯基)甲烷(11.99mg,0.01mmol)和pd(pph3)4(6.90mg)于15ml的耐压管中,在氮气氛围下加入1.2ml的超干氯苯。反应体系加热至
140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到蓝黑色固体(p2)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.50(s,3h),7.50(s,3h),7.39(dd,12h),7.11(s,12h),6.94(s,6h),6.77(dd,24h),6.72(d,15h),6.72(d,45h),5.41(s,1h),4.11(s,3h),3.07(s,6h),2.81(s,3h),2.44(s,9h),1.80(s,3h),1.61(s,6h),1.50(s,3h),1.26(s,93h),0.89(s,15h)。高温gpc:mn=43.0kda;mw=68.7kda。
[0103]
制备过程化学反应方程式如下:
[0104][0105]
实施例3含星型结构柔性链段的聚合物活性层材料p3的合成
[0106]
称取m5单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6c']双([1,2,5]硒二唑)(80.40mg,0.10mmol)、5,5'-双(三甲基甲锡烷基)-2,2'-联噻吩(41.98mg,0.085mmol)和m2单体三(4-(4-(5-(三甲基锡基)噻吩-2-基)丁氧基)苯基)甲烷(11.99mg,0.01mmol)和pd(pph3)4(6.90mg)于15ml的耐压管中,在氮气氛围下加入1.2ml的超干氯苯。反应体系加热至140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到紫黑色固体(p3)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.50(s,3h),7.50(s,3h),7.39(dd,12h),7.11(s,12h),6.94(s,6h),6.77(dd,24h),6.72(d,15h),6.72(d,45h),5.41(s,1h),4.11(s,3h),3.07(s,6h),2.81(s,3h),2.44(s,9h),1.80(s,3h),1.61(s,6h),1.50(s,3h),1.26(s,93h),0.89(s,15h)。高温gpc:mn=38.7kda;mw=62.8kda。
[0107]
制备过程化学反应方程式如下:
[0108][0109]
实施例4含星型结构柔性链段的聚合物活性层材料p4的合成
[0110]
称取m4单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]噻二唑)(70.82mg,0.10mmol)、2,6-二(三甲基锡)-4,8-二(5-(2-乙基己基)噻吩基-2-)-苯并二噻吩(63.43mg,0.07mmol)和m3单体n,n',n'-(苯-1,3,5-三酰基)三(5-((5-(三甲基锡基)噻吩-2-基)氧基)戊烷-1-亚胺)(22.26mg,0.02mmol)和pd(pph3)4(6.9mg)于15ml的耐压管中,在氮气氛围下加入1.20ml的超干氯苯。反应体系加热至140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到黑色固体(p4)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.78(s,6h),7.65(s,3h),7.56(d,9h),7.33(d,6h),6.87(s,6h),6.80(s,12h),6.70(s,12h),6.25(s,6h),4.11(s,6h),3.38(s,9h),3.07(s,12h),2.94(s,9h),2.44(s,18h),2.25(d,21h),2.15(d,3h),1.82(t,42h),1.75-1.68(m,3h),1.64-1.48(m,54h),1.52-1.48(m,6h),1.38(s,12h),1.31-1.23(m,210h),1.01(s,9h),0.93(s,36h)。高温gpc:mn=35.5kda;mw=51.7kda。
[0111]
制备过程化学反应方程式如下:
[0112][0113]
实施例5含星型结构柔性链段的聚合物活性层材料p5的合成
[0114]
称取m5单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]硒二唑)(80.40mg,0.10mmol)、2,6-二(三甲基锡)-4,8-二(5-(2-乙基己基)噻吩基-2-)-苯并二噻吩(77.02mg,0.085mmol)和m1单体1,3,5-三(3-(5-(三甲基锡基)噻吩-2-基)丙基)苯(9.42mg,0.01mmol)和pd(pph3)4(6.9mg)于15ml的耐压管中,在氮气氛围下加入1.20ml的超干氯苯。反应体系加热至140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到黑色固体(p5)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.78(s,3h),7.31(d,15h),6.75(d,15h),3.70(s,6h),3.06(s,6h),2.74(d,9h),2.62(s,3h),2.43(s,9h),2.26(s,18h),1.97(d,9h),1.39(s,6h),1.30(s,6h),1.28-1.23(m,114h),0.91(d,42h)。高温gpc:mn=37.2kda;mw=48.8kda。
[0115]
制备过程化学反应方程式如下:
[0116]
[0117]
实施例6含星型结构柔性链段的聚合物活性层材料p6的合成
[0118]
称取m5单体5,10-二溴-4,9-二十一烷基萘[1,2-c:5,6-c']双([1,2,5]硒二唑)(81.40mg,0.10mmol)、2,6-二(三甲基锡)-4,8-二(5-(2-乙基己基)噻吩基-2-)-苯并二噻吩(77.02mg,0.085mmol)和m3单体n,n',n'-(苯-1,3,5-三酰基)三(5-((5-(三甲基锡基)噻吩-2-基)氧基)戊烷-1-亚胺)(11.13mg,0.01mmol)和pd(pph3)4(6.9mg)于15ml的耐压管中,在氮气氛围下加入1.20ml的超干氯苯。反应体系加热至140℃,维持该温度反应48小时。反应后处理:反应温度冷却至室温后,将反应液滴至无水甲醇中,采用过滤得到粗产物。使用索氏抽提装置处理粗产物,依次使用无水甲醇、丙酮、正己烷和三氯甲烷进行抽提,最后将三氯甲烷组分的溶液进行浓缩,然后再次将其沉降至无水甲醇中,过滤,烘干,最终得到黑色固体(p6)。1hnmr、
13
cnmr、ms和元素分析结果表明所得到的化合物为目标产物,1h nmr(400mhz,cdcl3),δ(ppm):7.78(s,9h),7.55(s,3h),7.49(d,18h),7.41(dd,36h),6.87(s,6h),6.80(s,12h),6.70(s,18h),6.23(s,6h),4.11(s,6h),3.38(s,9h),3.07(s,12h),2.94(s,9h),2.44(s,18h),2.21(d,45h),1.79(d,15h),1.63-1.53(m,42h),1.53-1.52(m,6h),1.38(s,12h),1.31-1.23(m,204h),0.93(s,36h),0.89(s,57h)。高温gpc:mn=35.8kda;mw=51.6kda。
[0119]
制备过程化学反应方程式如下:
[0120][0121]
实施例7有机光伏器件的制备
[0122]
分别以上述所举实例1中的含星型结构柔性链段的聚合物活性层材料p1、所举实例2中的含星型结构柔性链段的聚合物活性层材料p2、所举实例3中的含星型结构柔性链段的聚合物活性层材料p3、所举实例4中的含星型结构柔性链段的聚合物活性层材料p4、所举实例5中的含星型结构柔性链段的聚合物活性层材料p5和所举实例6中的含星型结构柔性链段的聚合物活性层材料p6作为给体材料,n2200作为受体材料来制备有机光伏器件,器件结构为:ito/pedot:pss/活性层/pfn-br(甲醇0.5mg ml-1
)/ag。n2200的结构为式iii:
[0123][0124]
具体制备该有机光伏器件的步骤如下:
[0125]
(1)导电玻璃ito衬底的清洗:将ito玻璃基片依次置于丙酮、异丙醇、清洗液、去离子水和异丙醇中进行超声清洗,除掉ito玻璃基片表面可能残留的污渍(如光刻胶等)以及改善界面接触,清洗完后放入真空烘箱中干燥;
[0126]
(2)将ito置于氧等离子体刻蚀仪中,使用氧气等离子体进行二十分钟的轰击,彻底清除ito玻璃基片表面可能残存的有机物;
[0127]
(3)在ito上旋涂约30nm厚的空穴传输界面pedot:pss,然后在100℃下热退火20分钟;
[0128]
(4)在氮气氛围的手套箱中,分别将含柔性链段的聚合物活性层材料p1、p2、p3、p4、p5和p6与n2200以2:1的质量比共混,溶解在甲基四氢呋喃中,配制浓度为5mg/ml的溶液,在pedot:pss层上旋涂一层厚度为120nm的活性层后,在加热台上120℃下加热退火20分钟,以除去残留溶剂及改善活性层膜的形貌;
[0129]
(5)在氮气氛围的手套箱中,在活性层材料上旋涂一层厚度为20nm电子传输材料,使用的为0.5mg/ml聚[(9,9-二(3'-(n,n-二甲氨基)丙基)芴基-2,7-二基)-alt-[(9,9-二正辛基芴基2,7-二基)-溴(pfn-br);
[0130]
(6)最后将制备好的器件放置在蒸镀仓内,在真空环境下蒸镀厚度为100nmag电极。
[0131]
(7)在am 1.5g模拟太阳光灯测试聚合物太阳电池器件的光电转换效率、电流-电压特性曲线和暗电流-电压特性曲线。
[0132]
对制备的有机太阳电池器件分别进行光电性能测试,测试结果如表1所示。
[0133]
表1有机太阳电池的器件参数
[0134][0135]
表1中数据可知,以p1作为活性层给体材料,n2200作为活性层受体材料的有机太阳电池器件具有优异的光电性能。器件的短路电流密度为18.53毫安/平方厘米,开路电压为0.87伏,填充因子为68.52%,最终的器件效率为10.06%;以p2作为活性层给体材料,n2200作为活性层受体材料的有机太阳电池器件具有优异的光电性能。器件的短路电流密
度为18.04毫安/平方厘米,开路电压为0.93伏,填充因子为65.43%,最终的器件效率为10.92%;以p3作为活性层给体材料,n2200作为活性层受体材料的有机太阳电池器件具有优异的光电性能。器件的短路电流密度为19.56毫安/平方厘米,开路电压为0.91伏,填充因子为71.40%,最终的器件效率为12.64%。其中图3和图4分别为以p2和p3为给体,n2200为受体的有机太阳电池的电压-电流密度曲线和波长-外量子效率曲线,所对应的电流分别为17.23毫安/平方厘米和18.55毫安/平方厘米。图5为分别以含星型结构柔性链段的聚合物活性层材料p4、p5、p6作为给体与n2200作为受体所制备的有机光伏器件测试得到的暗态电压-电流密度曲线,器件表现出了明显的二极管特性,即电流的单向导通性,正向暗电流明显高于反向暗电流,这对提高探测器的探测率以及改善探测器对弱光的探测能力具有重要作用。
[0136]
图6是含星型结构柔性链段的聚合物活性层材料p1、p2、p3和p4分别与n2200为活性层以及不含星型结构柔性链段的聚合物p1-1与n2200作为活性层材料的应力-应变曲线。从图6可知,不含星型结构柔性链段的聚合物p1-1:n2200活性层的断裂伸长率仅为1.6%,而含星型结构柔性链段的聚合物活性层材料p1:n2200、p2:n2200、p3:n2200、p4:n2200活性层的断裂伸长率分别为10.7%、13.0%、21.9%和23.1%,均比不含星型结构柔性链段的聚合物活性层高。因而向共轭聚合物主链中引入柔性链段后在不会使器件效率降低的情况下可以提升器件的可拉伸性能。
[0137]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他任何未背离本发明精神实质与原理下所作的改变、修饰、替代、组合、简化均应为等效的置换方式,都含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。