嵌合多肽及其用途
1.一些疗法是基于治疗性多肽的施用或表达治疗性多肽的基因治疗载体的施用。所述多肽可以预期在血流中循环以到达靶组织。在这种情况下,需要改进治疗性肽的性质以增强其活性。例如,改进治疗性多肽在血浆隔室中的稳定性或促进循环多肽被预期在其中发挥所述循环多肽的治疗活性的靶组织摄取可能是有利的。
2.此类循环多肽包括溶酶体酶酸性α-葡糖苷酶(gaa)多肽。特别地,在庞贝病(pompe disease)的情形下,需要改进为治疗目的施用的gaa多肽的活性。庞贝病,也称为ii型糖原贮积病(gsd)和酸性麦芽糖酶缺乏症,是一种由溶酶体酶酸性α-葡糖苷酶缺乏引起的常染色体隐性代谢性肌病。gaa是一种外切-1,4和1,6-α-葡糖苷酶,其在溶酶体中将糖原水解为葡萄糖。gaa缺乏导致糖原在溶酶体中积累,并引起呼吸肌、心肌和骨骼肌的进行性损伤。所述疾病的范围从快速进展性婴儿病程(通常在1-2岁时致命)到较缓慢进展性和异质性病程(在儿童和成人中引起显著发病率和早期死亡率)。hirschhorn rr,the metabolic and molecular bases of inherited disease,3:3389-3420(2001,mcgraw-hill);van der ploeg和reuser,lancet 372:1342-1351(2008)。
3.目前用于治疗庞贝病的人类疗法包括施用重组人类gaa,也称为酶替代疗法(ert)。ert已展示对严重的婴儿gsd ii的功效。然而,酶疗法的益处受限于外周静脉递送后蛋白质的不良生物分布、若干组织的摄取不足以及需要频繁输注。
4.作为ert的替代或辅助,已经研究了治疗gsd-ii的基因治疗方法的可行性(amalfitano,a.等人,(1999)proc.natl.acad.sci.usa 96:8861-8866;ding,e.等人,(2002)mol.ther.5:436-446;fraites,t.j.等人,(2002)mol.ther.5:571-578;tsujino,s.等人,(1998)hum.gene ther.9:1609-1616)。
5.过去也提出了修饰的gaa蛋白来改善溶酶体贮积病治疗。特别地,申请wo2004064750和sun等人,2006公开了一种嵌合gaa多肽,其包含与gaa可操作地连接的信号肽,作为增强蛋白质靶向分泌途径的一种方式。在wo2018/046772、wo2018/046775和wo2018/046774专利申请中,提供了gaa变体以改进当前针对庞贝病的基因替代疗法。所述专利申请公开了gaa变体,已显示所述gaa变体是高度可分泌的并且比其野生型对应物的免疫原性更低。
6.本文描述了gaa的进一步改进。
技术实现要素:
7.本发明涉及一种编码嵌合多肽的核酸分子,所述嵌合多肽包含与一个或多个异源部分融合的目标肽,其中所述异源部分中的至少一者是分拣蛋白(sortilin)受体的配体。
8.在一个特定实施方式中,所述嵌合多肽包含与一个异源部分融合的目标肽,所述异源部分是分拣蛋白受体的配体。
9.在一个特定实施方式中,所述分拣蛋白受体的配体选自:
[0010]-由seq id no:14的核苷酸序列或由与seq id no:14的核苷酸序列具有至少85%同一性、优选至少90%同一性的核苷酸序列编码的spadin肽;
[0011]-由seq id no:15的核苷酸序列或由与seq id no:15的核苷酸序列具有至少85%同一性、优选至少90%同一性的核苷酸序列编码的神经紧张素(neurotensin)肽;或
[0012]-由seq id no:16的核苷酸序列或由与seq id no:16的核苷酸序列具有至少85%同一性、优选至少90%同一性的核苷酸序列编码的神经紧张素肽的片段。
[0013]
在一个特定实施方式中,所述分拣蛋白受体的配体是由包含seq id no:14或由seq id no:14组成的核苷酸序列编码的spadin肽。
[0014]
在一个特定实施方式中,所述目标肽是功能性gaa多肽,其可由选自seq id no:1-3的核苷酸序列或由与选自seq id no:1-3的核苷酸序列具有至少85%同一性、优选至少90%同一性的核苷酸序列编码。
[0015]
在一个特定实施方式中,所述目标肽是对应于gaa的截短形式的功能性gaa多肽。特别地,与gaa相比,所述功能性gaa多肽可以在其n末端截短42个连续氨基酸。在一个特定实施方式中,所述截短的gaa由seq id no:10的核苷酸序列或由与seq id no:10的核苷酸序列具有至少85%同一性、优选至少90%同一性的核苷酸序列编码。
[0016]
在一个特定实施方式中,如上所述的异源部分融合在所述目标肽的n末端。
[0017]
在一个特定实施方式中,本发明的核酸分子还包含具有选自seq id no:18-22、优选seq id no:21的氨基酸序列的信号肽。
[0018]
本发明还涉及一种核酸构建体,其包含可操作地连接至启动子的如上所述的核酸分子,其中所述核酸构建体还可以任选地包含内含子。在一个特定实施方式中,所述核酸构建体可以优选地以如下顺序包含:启动子;内含子;如上所述的核酸分子;和多聚腺苷酸化信号。
[0019]
本发明还涉及一种包含本发明的核酸分子或核酸构建体的载体,例如病毒载体,优选地逆转录病毒载体,例如慢病毒载体,或aav载体。特别地,所述载体可以是单链或双链自互补aav载体,优选地具有以下的aav载体:aav衍生衣壳,例如aav1衣壳、aav2衣壳、变体aav2衣壳、aav3衣壳、变体aav3衣壳、aav3b衣壳、变体aav3b衣壳、aav4衣壳、aav5衣壳、aav6衣壳、变体aav6衣壳、aav7衣壳、aav8衣壳、aav9衣壳、aav10衣壳如aavcy10衣壳和aavrh10衣壳、aavrh74衣壳、aavdj衣壳、aavanc80衣壳、aav-lk03衣壳、aav2i8衣壳,和猪aav衣壳如aavpo4衣壳和aavpo6衣壳;或嵌合衣壳。在一个特定实施方式中,所述aav载体具有aav8、aav9、aavrh74或aav2i8衣壳,特别是aav8、aav9或aavrh74衣壳,更特别是aav8衣壳。
[0020]
本发明还涉及一种用如上所述的核酸分子、核酸构建体或载体转化的分离的细胞。
[0021]
此外,本文描述了由本发明的核酸分子编码的嵌合多肽。
[0022]
本发明还涉及一种药物组合物,其在药学上可接受的载剂中包含如上所述的核酸分子、核酸构建体、载体、分离的细胞或嵌合多肽。
[0023]
还描述了如上所述的核酸分子、核酸构建体、载体、分离的细胞或嵌合多肽,其用作药物。在一个特定实施方式中,如上所述的核酸分子、核酸构建体、载体、分离的细胞或嵌合多肽被用在用于治疗溶酶体贮积病如糖原贮积病(gsd)、i型黏多糖贮积症(mpsi)、ii型黏多糖贮积症(mpsii)、异染性脑白质营养不良(mld)或vi型黏多糖贮积症(mps vi),特别是用于治疗gsdii(庞贝病)的方法中。
附图说明
[0024]
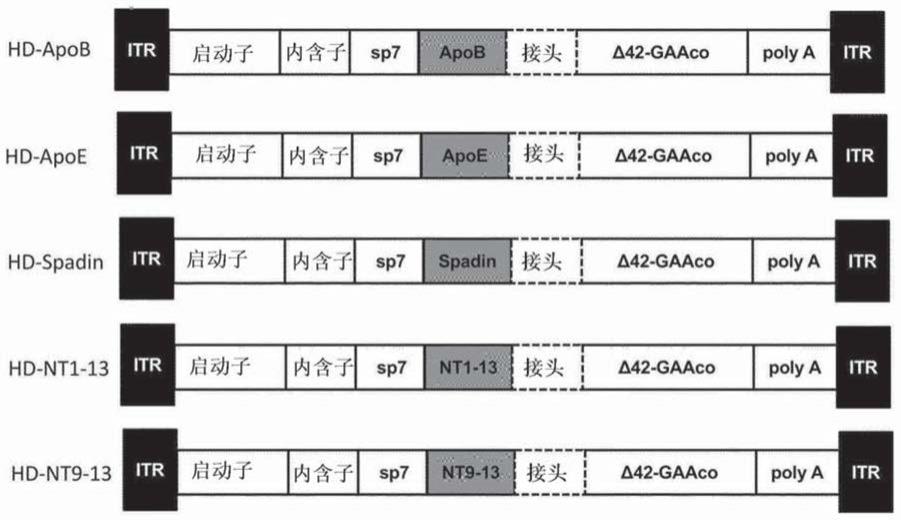
图1.编码本发明的嵌合gaa变体的表达盒的示意图。在gaa n末端克隆异源结构域(hd)。itr:来自aav2的反向末端重复序列;启动子:apoe增强子(apoe)和肝细胞特异性人α1-抗胰蛋白酶启动子(haat);内含子:优化的人血红蛋白β-亚基合成内含子(hbb2.1);来自人胰凝乳蛋白酶原(sp7)的信号肽;hd:异源结构域;gaaco:密码子优化的gaa;polya:人牛生长激素多聚腺苷酸化序列;apob:载脂蛋白b结构域;apoe:载脂蛋白e结构域;spadin:spadin肽;nt1-13:神经紧张素氨基酸1-13;nt9-13:神经紧张素氨基酸9-13;接头:3个氨基酸的接头。
[0025]
图2.本发明的嵌合gaa变体在人肝细胞培养物中的表达。用编码嵌合gaa变体sp7-apob-δ42-gaaco(hd-apob)、sp7-apoe-δ42-gaaco(hd-apoe)、sp7-spadin-δ42-gaaco(hd-spadin)、sp7-神经紧张素1-13-δ42-gaaco(hd-nt1-13)、sp7-神经紧张素9-13-δ42-gaaco(hd-nt1-9-13)的质粒转染后72小时分析huh7裂解物。没有异源结构域的gaa变体sp7-δ42-gaaco(hd0)用作比较。ctrl:用编码增强型绿色荧光蛋白的质粒转染并用作阴性对照的对照细胞。在3个独立实验中重复转染。对于每个重复物,gaa数据表示为与hd0相比的相对量(hd0=100%)。数据显示为3个独立实验的平均值
±
平均值的标准偏差(sd)。统计分析:具有tukey事后检验的单因素方差分析(one-way anova)。*p《0.05。
[0026]
图3.aav肝基因转移后本发明的gaa变体在gaa-/-小鼠血浆中的活性。在静脉内施用编码嵌合gaa变体的aav8载体(aav,n=6只小鼠/组;载体剂量:5
×
10
11
vg/kg)后4个月测量的gaa-/-小鼠血浆中的gaa活性分析;用pbs处理的小鼠用作阴性对照(ctrl n=6只小鼠);hd-apob:sp7-apob-δ42-gaaco,hd-spadin:sp7-spadin-δ42-gaaco,hd0:sp7-δ42-gaaco。数据显示为平均值
±
sd。统计分析:具有tukey事后检验的单因素方差分析,多重比较“所有组相对于所有,与时间点无关”。星号(*)和井号(#)指示图例中指定的显著差异。*p《0.05。
[0027]
图4.aav肝基因转移后gaa-/-小鼠血浆中本发明的gaa变体的分泌。在静脉内施用编码嵌合gaa变体的aav8载体(aav,n=6只小鼠/组别;载体剂量:5
×
10
11
vg/kg)后4个月测量的gaa-/-小鼠血浆中gaa分泌的分析;hd-apob:sp7-apob-δ42-gaaco,hd-spadin:sp7-spadin-δ42-gaaco,hd0:sp7-δ42-gaaco。(a)用抗hgaa抗体在血浆中的蛋白质印迹,重组人类gaa(rhgaa)用作阳性对照;描绘了分子量标志物。(b)图a中描绘的蛋白质印迹中gaa蛋白条带的量化,非特异性的较低条带用于上样量归一化。数据显示为平均值
±
sd。统计分析:具有tukey事后检验的单因素方差分析,多重比较“所有组相对于所有,与时间点无关”,*p《0.05。
[0028]
图5.aav肝基因转移后gaa-/-小鼠大脑中糖原含量的分析。用编码嵌合gaa变体的aav8载体(aav,n=6/组别;剂量:5
×
10
11
vg/kg)治疗4个月后,分析gaa-/-小鼠大脑中的糖原含量;用pbs处理的小鼠用作阴性对照(ctrl,n=6);gaa / (n=6)用作未受影响的对照。数据显示为平均值
±
sd。星号(*)和井号(#)指示与图例中所示的组相比的显著差异;描绘了大脑中的糖原含量。统计分析:具有tukey事后检验的单因素方差分析,多重比较“所有组相对于所有”,*p《0.05,#p《0.05。
[0029]
图6.aav肝基因转移后gaa-/-小鼠组织中糖原含量的分析。用编码嵌合gaa变体的aav8载体(aav,n=6/组别;剂量:5
×
10
11
vg/kg)治疗4个月后gaa-/-小鼠组织中的糖原含量
的分析;用pbs处理的小鼠用作阴性对照(ctrl,n=6);gaa / (n=6)用作未受影响的对照。数据显示为平均值
±
sd。星号(*)和井号(#)指示与图例中所示的组相比的显著差异;描绘了心脏(a)、三头肌(b)、脊髓(c)中的糖原含量。统计分析:具有tukey事后检验的单因素方差分析,多重比较“所有组相对于所有”。*p《0.05,#p《0.05。
[0030]
图7.aav肝基因转移后gaa-/-小鼠血浆中的gaa免疫原性分析。施用编码嵌合gaa变体的aav8载体(aav,n=6/组别;剂量:5
×
10
11
vg/kg)1个月和4个月后,gaa-/-小鼠血浆中的抗gaa igg分析;用pbs处理的小鼠用作阴性对照(ctrl,n=6);gaa / (n=6)用作未受影响的对照。数据显示为平均值
±
sd。统计分析:具有tukey事后检验的单因素方差分析,多重比较“所有组相对于所有”。
具体实施方式
[0031]
本发明人对通过将异源部分与目标肽融合来增强目标肽的体内活性的新方法进行了充分的研究。特别地,酸性α-葡糖苷酶多肽用作模型肽。结果,本发明人已经表明,gaa与分拣蛋白受体的配体的融合蛋白,特别是与spadin肽的融合蛋白,具有改进的特性,包括改进的中枢神经系统(cns)摄取和更好的在组织如大脑中的活性。值得注意的是,将配体添加到gaa肽不会引起针对嵌合gaa多肽的免疫原性反应增加。
[0032]
因此,本发明大体涉及一种嵌合多肽,其包含与一个或多个异源部分融合的目标肽,其中所述异源部分中的至少一者是分拣蛋白受体的配体。
[0033]
1-核酸分子
[0034]
本发明的第一方面涉及编码嵌合多肽的核酸分子,所述嵌合多肽包含与一个或多个异源部分融合的目标肽,其中所述异源部分中的至少一者是分拣蛋白受体的配体。
[0035]“嵌合蛋白”或“融合蛋白”是指通过连接两个或更多个最初编码单独蛋白质的基因而产生的蛋白质。
[0036]
本发明的嵌合多肽是指以下的融合物:
[0037]-目标肽,与
[0038]-一个或多个衍生自与目标肽不同的多肽的“异源部分”[0039]
目标肽
[0040]
目标肽可以是寻求改进的体内活性的任何肽。特别地,目标肽是循环肽。“循环肽”是指在血液循环中发现的任何肽、多肽或其片段。目标肽可以是分泌肽。“分泌的蛋白质”是指任何肽、多肽或其片段,其被细胞内加工以分泌到细胞外环境中。特别地,目标肽是寻求改进的在血浆中的活性和/或稳定性或者寻求更好的溶酶体靶向和/或穿过血脑屏障以有效到达cns的循环肽。目标肽可以是寻求改进的在靶组织中的摄取和/或活性的任何循环肽。靶组织可以是例如cns如大脑或脊髓、肌肉如骨骼肌、或肝脏。特别地,肽是寻求在包括大脑或脊髓的cns中改进的摄取和/或活性的肽或多肽,特别是寻求在大脑中改进的摄取和/或活性的肽或多肽。特别地,目标肽可以是靶向溶酶体的任何肽。
[0041]
在一个特定实施方式中,目标肽是治疗性肽,即为治疗目的而递送的肽,例如用于治疗、预防或改善疾病或病理状态的肽。特别地,治疗性肽通过肽的输注或通过使用基因治疗载体的表达来施用。
[0042]
在一个特定实施方式中,目标肽是已知在与神经学表现相关的溶酶体病症中缺乏
的肽。
[0043]
在一个特定实施方式中,目标肽选自溶酶体酸性α-葡糖苷酶(gaa)、α-艾杜糖醛酸酶(idua)、溶酶体水解酶艾杜糖醛酸2-硫酸酯酶(ids)、芳基硫酸酯酶a(arsa)、α-半乳糖苷酶a(gla)、葡糖神经酰胺酶、β-半乳糖苷酶、β-己糖胺酶a、β-己糖胺酶b、β-半乳糖基-神经酰胺酶、酸性鞘磷脂酶、乙酰肝素磺酰胺酶、乙酰辅酶a:α-氨基葡糖苷n-乙酰转移酶、n-乙酰葡糖胺-6-硫酸酯酶、β-葡萄糖醛酸酶、酸性神经酰胺酶、α-甘露糖苷酶、β-甘露糖苷酶、n-乙酰半乳糖胺酶、α-神经氨酸酶、棕榈酰基-蛋白硫酯酶1、羧肽酶、多种硫酸酯酶、n-乙酰葡糖胺磷酸转移酶、保护性蛋白组织蛋白酶a、神经氨酸酶、npc2、gm2激活蛋白、lamp2、npc1、唾液酸转运蛋白(sialin)、cln3和黏脂蛋白(mucolipin)。
[0044]
在一个特定实施方式中,目标肽是溶酶体酸性α-葡糖苷酶或“gaa”。在该实施方式中,本发明的核酸分子编码嵌合gaa多肽,其包含:
[0045]-功能性gaa多肽,其融合到
[0046]-一个或多个异源部分,其中所述异源部分中的至少一者是分拣蛋白受体的配体。
[0047]
溶酶体酸性α-葡糖苷酶或“gaa”(e.c.3.2.1.20)(1,4-α-d-葡聚糖葡糖水解酶)是一种外切-1,4-α-d-葡糖苷酶,其可水解寡糖的α-1,4和α-1,6键以释放葡萄糖。gaa缺乏会导致ii型糖原贮积病(gsdii),也称为庞贝病(尽管该术语正式指的是所述疾病的婴儿期发病形式)。gaa催化糖原的完全降解,在分支点减慢。17号染色体上的28kb人类酸性α-葡糖苷酶基因编码3.6kb mrna,其产生951个氨基酸的多肽(hoefsloot等人,(1988)embo j.7:1697;martiniuk等人,(1990)dna and cell biology 9:85)。所述酶在内质网中接受共翻译n连接糖基化。它被合成为110-kda前体形式,其通过广泛的糖基化修饰、磷酸化以及通过经由大约90-kda内体中间体进行蛋白水解加工形成最终溶酶体76和67kda形式而成熟(hoefsloot,(1988)embo j.7:1697;hoefsloot等人,(1990)biochem.j.272:485;wisselaar等人,(1993)j.biol.chem.268:2223;hermans等人,(1993)biochem.j.289:681)。
[0048]
在gsd ii患者中,酸性α-葡糖苷酶的缺乏会引起溶酶体中糖原的大量积累,从而破坏细胞功能(hirschhorn,r.和reuser,a.j.(2001),the metabolic and molecular basis for inherited disease,(scriver,c.r.等人编辑)第3389-3419页(mcgraw-hill,new york)。在最常见的婴儿形式中,患者表现出进行性肌肉退化和心肌病,并在两岁前死亡。在青少年和成人发病形式中存在严重的衰弱。
[0049]
如本文所用,术语“gaa”或“gaa多肽”涵盖成熟的(~76或~67kda)和前体(例如,~110kda)gaa,特别是前体形式,以及修饰或突变的(通过插入、缺失和/或替换)gaa蛋白或其片段,其为gaa的功能性衍生物,即保留gaa的生物学功能(即,具有天然gaa蛋白的至少一种生物学活性,例如,可以水解糖原,如上文所定义)和gaa变体(例如,gaa ii,如kunita等人,(1997)biochemica et biophysica acta1362:269所述;gaa多态性和snp描述于hirschhorn,r.和reuser,a.j.(2001)in the metabolic and molecular basis for inherited disease(scriver,c.r.,beaudet,a.l.,sly,w.s.和valle,d.编辑),第3389-3419页.mcgraw-hill,new york,参见第3403-3405页)。可以使用本领域已知的任何gaa编码序列,例如,参见seq id no:1;genbank登录号nm_00152,以及hoefsloot等人,(1988)embo j.7:1697和van hove等人,(1996)proc.natl.acad.sci.usa 93:65(人类),genbank
登录号nm_008064(小鼠),和kunita等人,(1997)biochemica et biophysica acta 1362:269(鹌鹑)。
[0050]
编码嵌合gaa多肽的核酸分子包含任何“功能性gaa多肽”,即它编码的gaa蛋白在表达时具有野生型gaa蛋白的功能。如上文所定义,野生型gaa的功能是水解寡糖和多糖、更特别是糖原的α-1,4和α-1,6键,以释放葡萄糖。与由seq id no:1至3的核酸序列编码的野生型gaa蛋白相比,例如与具有seq id no:4的氨基酸序列的gaa多肽相比,由所述核酸分子编码的功能性gaa蛋白可以具有至少50%、60%、70%、80%、90%、95%、99%或至少100%的糖原水解活性。由所述核酸分子编码的功能性gaa多肽的活性甚至可以是由seq id no:1至3的核酸序列编码的野生型gaa蛋白的活性的100%以上,例如110%、120%、130%、140%以上或甚至150%以上,例如与具有seq id no:4的氨基酸序列的gaa多肽相比。
[0051]
技术人员能够容易地确定核酸分子是否表达功能性gaa蛋白。例如,一种合适的体外方法包括将核酸插入载体,例如质粒或病毒载体中,用所述载体转染或转导宿主细胞,例如293t或hela细胞,或其他细胞如huh7,以及测定gaa活性。或者,合适的体内方法包括将含有核酸的载体转导至庞贝病或另一种糖原贮积病的小鼠模型中,以及测定小鼠血浆中的功能性gaa和组织中gaa的存在。在下面的实验部分中更详细地描述了合适的方法。
[0052]
编码功能性gaa多肽的核酸分子的序列优选与seq id no:1至3的核苷酸序列具有至少85%、更优选至少90%并且甚至更优选至少92%的同一性,特别是至少95%同一性,例如至少98%、99%或100%同一性。
[0053]
术语“同一”及其变化形式是指两个核酸分子或两个氨基酸分子之间的序列同一性。当两个比较序列两者中的位置被相同的碱基或氨基酸占据时,则所述分子在该位置是同一的。两个序列之间的同一性百分比是两个序列共有的匹配位置数除以比较位置数
×
100的函数。例如,如果两个序列的10个位置中有6个匹配,则两个序列具有60%同一性。通常,比较在当两个序列以给出最大同一性的方式进行比对时进行。本领域技术人员已知的各种生物信息学工具可用于比对核酸序列,例如blast或fasta。
[0054]
在一个特定实施方式中,由如本文所述的核酸分子编码的功能性gaa多肽是功能性、截短形式的gaa。“截短形式”或“截短gaa”是指包含从亲本gaa多肽的n末端部分缺失一个或几个连续氨基酸的gaa多肽。根据本发明,“亲本gaa多肽”是功能性的前体gaa序列,但没有其信号肽。例如,关于典型的野生型人类gaa多肽,完整的野生型gaa多肽(即gaa的前体形式)在seq id no:5中或在seq id no:6中表示并且具有信号肽(对应于seq id no:5或seq id no:6的氨基酸1-27),而作为这些野生型人类gaa多肽的截短gaa形式的基础的亲本gaa多肽分别在seq id no:7和seq id no:8中表示并且没有信号肽。在该实例中,对应于seq id no:5的氨基酸28-952和seq id no:6的氨基酸28-952的后者被称为亲本gaa多肽。
[0055]
根据本发明,截短gaa多肽是功能性gaa多肽,即它具有如上定义的野生型gaa多肽的功能性。
[0056]
亲本gaa多肽的氨基酸序列或其编码序列可以来源于任何来源,包括禽类和哺乳动物物种。如本文所用,术语“禽类”包括但不限于鸡、鸭、鹅、鹌鹑、火鸡和野鸡。如本文所用的术语“哺乳动物”包括但不限于人类、猿猴和其他非人类灵长类动物、牛科动物、绵羊、山羊、马科动物、猫科动物、犬科动物、兔类动物等。在本发明的实施方式中,亲本gaa多肽是人类、小鼠或鹌鹑gaa多肽,特别是人类gaa多肽。
no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0062]
在另一个特定实施方式中,本发明的截短gaa多肽是δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42、δ43或δ44gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0063]
在另一个特定实施方式中,本发明的截短gaa多肽是δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0064]
在另一个特定实施方式中,本发明的截短gaa多肽是δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0065]
在另一个特定实施方式中,本发明的截短gaa多肽是δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0066]
在另一个特定实施方式中,本发明的截短gaa多肽是δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0067]
在另一个特定实施方式中,本发明的截短gaa多肽是δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0068]
在另一个特定实施方式中,本发明的截短gaa多肽是δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0069]
在另一个特定实施方式中,本发明的截短gaa多肽是δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ
41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0070]
在另一个特定实施方式中,本发明的截短gaa多肽是δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0071]
在另一个特定实施方式中,本发明的截短gaa多肽是δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的亲本hgaa蛋白的截短形式)。
[0072]
在另一个特定实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ6、δ7、δ8、δ9或δ10截短形式,特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ7、δ8或δ9截短形式,更特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ8截短形式。
[0073]
在另一个特定实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ27、δ28、δ29、δ30或δ31截短形式,特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ28、δ29或δ30截短形式,更特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ29截短形式。
[0074]
在另一个特定实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ40、δ41、δ42、δ43或δ44截短形式,特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ41、δ42或δ43截短形式,更特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ42截短形式。
[0075]
在另一个特定实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7所示的hgaa蛋白)的δ41、δ42、δ43、δ44或δ45截短形式,特别是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ42、δ43或δ44截短形式,更特别是gaa(特别是seq id no:7所示的hgaa蛋白)的δ43截短形式。
[0076]
在另一个实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ6、δ7、δ8、δ9、δ10、δ27、δ28、δ29、δ30、δ31、δ40、δ41、δ42、δ43、δ44、δ45、δ46或δ47截短形式。
[0077]
在另一个实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ7、δ8、δ9、δ28、δ29、δ30、δ41、δ42、δ43或δ44截短形式。
[0078]
在另一个实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ6、δ7、δ8、δ9、δ10、δ40、δ41、δ42、δ
43或δ44截短形式。
[0079]
在另一个实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ8、δ29、δ42、δ43或δ47截短形式。
[0080]
在另一个实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ8、δ29、δ42或δ43截短形式。
[0081]
在另一个实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ8或δ42截短形式。
[0082]
在本发明的一个特定实施方式中,本发明的截短gaa多肽是功能性人类gaa多肽的截短形式。在另一个特定实施方式中,亲本hgaa多肽是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽。在此实施方式的一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42、δ43、δ44、δ45、δ46、δ47、δ48、δ49、δ50、δ51、δ52、δ53、δ54、δ55、δ56、δ57、δ58、δ59、δ60、δ61、δ62、δ63、δ64、δ65、δ66、δ67、δ68、δ69、δ70、δ71、δ72、δ73、δ74或δ75gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0083]
在此实施方式的一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42、δ43、δ44、δ45、δ46或δ47gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0084]
在此实施方式的一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42、δ43、δ44、δ45或δ46gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0085]
在此实施方式的一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、
δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42、δ43、δ44或δ45gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0086]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42、δ43或δ44gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0087]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0088]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ1、δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0089]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0090]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0091]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0092]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0093]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0094]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、
95%、96%、97%、98%或99%同一性。
[0095]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41或δ42gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0096]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ2、δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0097]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ3、δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0098]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ4、δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0099]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ5、δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与
seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0100]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ6、δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0101]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ7、δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0102]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ8、δ9、δ10、δ11、δ12、δ13、δ14、δ15、δ16、δ17、δ18、δ19、δ20、δ21、δ22、δ23、δ24、δ25、δ26、δ27、δ28、δ29、δ30、δ31、δ32、δ33、δ34、δ35、δ36、δ37、δ38、δ39、δ40、δ41、δ42或δ43gaa截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、甚至更特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性。
[0103]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ6、δ7、δ8、δ9或δ10,特别是δ7、δ8或δ9,更特别是δ8截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0104]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ27、δ28、δ29、δ30或δ31,特别是δ28、δ29或δ30,更特别是δ29截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0105]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ40、δ41、
δ42、δ43或δ44,特别是δ41、δ42或δ43,更特别是δ42截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0106]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ41、δ42、δ43、δ44或δ45,特别是δ42、δ43或δ44,更特别是δ43截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0107]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ6、δ7、δ8、δ9、δ10、δ27、δ28、δ29、δ30、δ31、δ40、δ41、δ42、δ43、δ44或δ45,特别是δ7、δ8、δ9、δ28、δ29、δ30、δ41、δ42、δ43或δ44,特别是δ8、δ29、δ42或δ43截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0108]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ6、δ7、δ8、δ9、δ10、δ40、δ41、δ42、δ43或δ44,特别是δ8或δ42截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0109]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ8、δ29、δ42、δ43或δ47截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0110]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ8、δ29、δ42或δ43截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0111]
在此实施方式的另一个变体中,本发明的截短gaa多肽是hgaa多肽的δ8或δ42截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。
[0112]
在一个特定实施方式中,本发明的截短gaa多肽是gaa(特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa蛋白)的δ42截短形式。
[0113]
在一个特定实施方式中,所述截短gaa多肽是hgaa多肽的δ42截短形式,所述hgaa多肽更特别是seq id no:7或seq id no:8、特别是seq id no:7所示的hgaa多肽,或其功能性变体,所述功能性变体在seq id no:7或seq id no:8、特别是seq id no:7所示的序列中包含氨基酸替换,并且与seq id no:7或seq id no:8、特别是seq id no:7具有至少80%、85%、90%、95%、96%、97%、98%或99%同一性。在一个特定实施方式中,除上文定义的截短之外,gaa多肽的功能性变体相比于亲本gaa多肽、例如seq id no:7或seq id no:8、特别是seq id no:7所示的亲本gaa多肽可以具有0至50个、0至30个、0至20个、0至15个、0至10个、或0至5个氨基酸变化。
[0114]
在一个具体实施方式中,本发明的截短hgaa多肽具有由seq id no:66、seq id no:9、seq id no:67、seq id no:68或seq id no:69所示序列或其功能性变体组成的氨基酸序列,所述功能性变体相比于seq id no:66、seq id no:9、seq id no:67、seq id no:68或seq id no:69所示的序列包含1至5个氨基、特别是1至4个、特别是1至3个、更特别是1至2个、特别是1个氨基酸替换。在另一个具体实施方式中,本发明的截短hgaa多肽具有由seq id no:66、seq id no:9、seq id no:67或seq id no:68所示序列或其功能性变体组成的氨基酸序列,所述功能性变体相比于seq id no:66、seq id no:9、seq id no:67或seq id no:68所示的序列包含1至5个氨基酸替换。在一个具体实施方式中,本发明的截短hgaa多肽具有由seq id no:66或seq id no:9所示序列或其功能性变体组成的氨基酸序列,所述功能性变体相比于seq id no:66或seq id no:9所示的序列包含1至5个氨基、特别是1至4个、特别是1至3个、更特别是1至2个、特别是1个氨基酸替换。
[0115]
在一个具体实施方式中,本发明的截短hgaa多肽具有由seq id no:9所示序列或其功能性变体组成的氨基酸序列,所述功能性变体相比于seq id no:9所示的序列包含1至5个、特别是1至4个、特别是1至3个、更特别是1至2个、特别是1个氨基酸替换。
[0116]
编码功能性gaa多肽、特别是截短gaa多肽的核酸序列可以针对gaa多肽的体内表达进行优化。序列优化可以包括核酸序列中的许多变化,包括密码子优化、gc含量增加、cpg岛数量减少、替代开放阅读框(arf)数量减少以及剪接供体和剪接受体位点的数量减少。由于遗传密码的简并性,不同的核酸分子可能编码相同的蛋白质。此外众所周知,不同生物体的遗传密码通常偏好于使用编码相同氨基酸的几种密码子中的一种而非其他密码子。通过密码子优化,在核苷酸序列中引入改变,其利用给定细胞环境中存在的密码子偏好,使得所得密码子优化的核苷酸序列相比于非密码子优化序列更有可能在这种给定细胞环境中以相对高的水平表达。在本发明的一个优选实施方式中,这种编码截短gaa的序列优化的核苷酸序列是经密码子优化的,例如通过利用人类特定密码子使用偏好,以与编码相同截短gaa蛋白的非密码子优化核苷酸序列相比提高其在人类细胞中的表达。
[0117]
在一个特定实施方式中,与seq id no:1的野生型hgaa编码序列的核苷酸82-2859相比,优化的gaa编码序列是经密码子优化的,和/或具有增加的gc含量和/或具有减少的替代开放阅读框数量,和/或具有减少的剪接供体和/或剪接受体位点数量。例如,与野生型gaa序列的序列相比,本发明的核酸序列导致gaa序列中的gc含量增加至少2%、3%、4%、5%或10%。在一个特定实施方式中,与野生型gaa核苷酸序列的序列相比,本发明的核酸序
列导致gaa序列中的gc含量增加2%、3%、4%或更特别是5%或10%(特别是5%)。在一个特定实施方式中,编码功能性gaa多肽的本发明的核酸序列与seq id no:1所示序列的核苷酸82-2859是“基本上同一的”,即具有约70%同一性,更优选约80%同一性,甚至更优选约90%同一性,甚至更优选约95%同一性,甚至更优选约97%、98%或甚至99%同一性。如上所述,除了gc含量和/或arf数量之外,序列优化还可以包括减少序列中cpg岛的数量和/或减少剪接供体和受体位点的数量。当然,正如本领域技术人员所熟知的,序列优化是所有这些参数之间的平衡,这意味着如果上述参数中的至少一者得到改进,而其他参数中的一者或多者未得到改进,则可以认为序列是优化的,只要优化的序列导致转基因的改进,例如改进的表达和/或减少的体内对转基因的免疫反应即可。
[0118]
此外,编码功能性gaa的核苷酸序列对人类细胞密码子使用的适应性可以表示为密码子适应指数(cai)。密码子适应指数在本文中定义为基因的密码子使用对高度表达的人类基因的密码子使用的相对适应性的测量。每个密码子的相对适应性(w)是每个密码子的使用率与相同氨基酸的最常用密码子使用率之比。cai被定义为这些相对适应性值的几何平均值。不包括非同义密码子和终止密码子(取决于遗传密码)。cai值范围为0至1,值越高表示最常用密码子的比例越高(参见sharp和li,1987,nucleic acids research 15:1281-1295;也参见:kim等人,gene.1997,199:293-301;zur megede等人,journal of virology,2000,74:2628-2635)。优选地,编码gaa的核酸分子具有至少0.75(特别是0.77)、0.8、0.85、0.90、0.92或0.94的cai。
[0119]
术语“核酸序列”(或核酸分子)是指单链或双链形式的dna或rna分子,特别是编码根据本发明的功能性gaa多肽的dna。
[0120]
在本发明的另一个实施方式中,编码截短gaa多肽的本发明核酸分子的部分与核苷酸序列seq id no:2或3(其为序列优化的序列)的相应部分具有至少85%、更优选至少90%并且甚至更优选至少92%的同一性,特别是至少95%的同一性,例如至少98%、99%或100%的同一性。
[0121]
在一个优选的实施方式中,编码截短gaa多肽的本发明核酸分子的部分与编码具有seq id no:9所示氨基酸序列的多肽的seq id no:10或seq id no:11、优选seq id no:10具有至少85%、更优选至少90%并且甚至更优选至少92%的同一性,特别是至少95%的同一性,例如至少98%、99%或100%的同一性。在一个特定实施方式中,编码截短gaa多肽的核酸序列由编码具有seq id no:9所示氨基酸序列的多肽的seq id no:10或seq id no:11、优选seq id no:10所示的序列组成。
[0122]
此外,功能性gaa多肽可以是wo2018/046772、wo2018/046775和wo2018/046774专利申请中描述的任何功能性gaa多肽。
[0123]
异源部分
[0124]
本发明人的目的是提高体内循环肽的活性。本发明人研究了通过将如上定义的gaa多肽与一个或多个异源部分融合来提高gaa活性的可能性。“异源部分”是指从与目标肽不同、特别是与gaa不同的肽或多肽产生的肽部分。在本发明的上下文中,“异源部分”是指能够提高体内目标肽活性的任何肽部分,例如改进血浆稳定性、血浆活性、溶酶体靶向、靶组织如cns或骨骼肌的摄取和/或穿过血脑屏障的任何肽部分。
[0125]
特别地,本发明的核酸分子编码嵌合多肽,其包含:
no:33的氨基酸序列具有至少80%同一性、至少85%同一性、至少90%同一性、至少92%同一性、至少95%同一性、至少98%同一性、至少99%同一性或者可以具有100%同一性。例如,当与如seq id no:33所示的神经紧张素肽的片段相比时,神经紧张素肽可以具有1、2或3个氨基酸变化。在一个特定实施方式中,神经紧张素肽的片段具有如seq id no:33所示的氨基酸序列。
[0137]
特别地,神经紧张素肽的片段由seq id no:16的核苷酸序列或由与seq id no:16的核苷酸序列具有至少85%同一性、至少90%同一性、至少92%同一性、至少95%同一性、至少98%同一性、至少99%同一性或者具有100%同一性的核苷酸序列编码。
[0138]
在一个特定实施方式中,目标肽,特别是功能性gaa多肽,融合到至少1、2、3、4或至少5个异源部分,其中所述异源部分中的至少一者是如上定义的分拣蛋白受体的配体。特别地,目标肽可以融合到1、2、3、4或5个异源部分。除分拣蛋白受体的配体之外的异源部分可以是任何能够提高目标肽、特别是gaa的活性的异源部分。特别地,可以使用改进血浆稳定性、血浆活性、溶酶体靶向、靶组织的摄取和/或穿过血脑屏障的任何异源部分。
[0139]
在一个特定实施方式中,目标肽与1、2、3、4或5个异源部分融合,其中每个异源部分是如上定义的分拣蛋白受体的配体。在一个特定实施方式中,目标肽与1、2、3、4或5个异源部分融合,其中每个异源部分是spadin肽。因此,在此实施方式中,目标肽与相同异源部分的重复融合,所述异源部分是如上定义的spadin肽。
[0140]
在一个特定实施方式中,目标肽、特别是如上定义的功能性gaa肽与一个(即一个且仅一个)异源部分融合,其中所述异源部分是如上定义的分拣蛋白受体的配体,特别是如上定义的spadin肽、神经紧张素肽或其任何片段。在一个特定实施方式中,目标肽、特别是如上定义的功能性gaa肽与一个(即一个且仅一个)异源部分融合,所述异源部分是如上定义的spadin肽。
[0141]
在一个特定实施方式中,目标肽与至少2个异源部分融合,其中所述异源部分中的至少一者是如上定义的分拣蛋白受体的配体,并且所述异源部分中的至少一者是人绒毛膜促性腺激素β-亚基(hcgβ)的羧基末端肽(ctp)。
[0142]
如本文所述的人绒毛膜促性腺激素β-亚基(hcgβ)的羧基末端肽(ctp)包含人绒毛膜促性腺激素β亚基的第137位至第165位的氨基酸序列,如seq id no:34所示。在一些实施方式中,ctp序列肽的长度为28、29、30、31、32、33或34个氨基酸。优选地,hcgβ的ctp的长度为28个氨基酸。
[0143]
在一个特定实施方式中,hcgβ的ctp是与天然ctp相差1-5个氨基酸替换的功能性变体。“功能性变体”是指任何能够提高体内gaa的活性的hcgβ的ctp。特别地,hcgβ的ctp的氨基酸序列可以与seq id no:12的氨基酸序列具有至少85%同一性、至少90%同一性、至少92%同一性、至少95%同一性、至少98%同一性、至少99%同一性或者可以具有100%同一性。在一个特定实施方式中,hcgβ的ctp的氨基酸序列包含seq id no:12或由seq id no:12组成。
[0144]
在一个特定实施方式中,hcgβ的ctp由seq id no:13的核苷酸序列或由与seq id no:13的核苷酸序列具有至少85%同一性、至少90%同一性、至少92%同一性、至少95%同一性、至少98%同一性、至少99%同一性或者具有100%同一性的核苷酸序列编码。
[0145]
在一个特定实施方式中,目标肽、特别是功能性gaa多肽与两个异源部分融合,一
个是如上定义的hcgβ的ctp,而另一个是如上定义的spadin肽。
[0146]
在一个特定实施方式中,一个或多个异源部分融合到目标肽、特别是功能性gaa多肽的n末端和/或c末端。在一个特定实施方式中,一个异源部分融合在n末端,并且相同或不同的异源部分融合到目标肽的c末端。在一个优选的实施方式中,一个或多个异源部分融合到目标肽的n末端。
[0147]
在一个优选的实施方式中,一个异源部分,即如上定义的spadin肽,融合在目标肽、特别是功能性gaa多肽的n末端。
[0148]
在一个特定实施方式中,一个或多个异源部分经由接头附接到目标肽。将一个或多个异源部分连接到目标肽序列的接头可以是共价键或肽键。可以使用导致嵌合多肽正确折叠的任何常规接头。特别地,可以使用能够在多肽的连接结构域之间引入柔性的任何接头。在一个特定实施方式中,接头是富含甘氨酸的接头。
[0149]
根据一个特定实施方式,接头可以是chichili等人,protein sci.2013年2月;22(2):153-67中描述的任何接头。
[0150]
在一个特定实施方式中,接头具有选自以下的氨基酸序列:“gap”(seq id no:65)、“ggggslvprgsggggs”(seq id no:48)、“gsgsgs”(seq id no:49)、“ggggslvprgsgggg”(seq id no:50)、“ggsgghmgsgg”(seq id no:51)、“ggsggsggsgg”(seq id no:52)、“ggsgg”(seq id no:53)、“ggsggggg”(seq id no:54)、“gsgsgsgs”(seq id no:55)、“gggsegggsegggseggg”(seq id no:56)、“aagaataa”(seq id no:57)、“ggggg”(seq id no:58)、“ggssg”(seq id no:59)、“gsgggtgggsg”(seq id no:60)、“gsgsgsgsggsg”(seq id no:61)、“gsggsggsggsggs”(seq id no:62)、“gsggsgsggsggsg”(seq id no:63)或“gt”(seq id no:64)。
[0151]
在一个优选的实施方式中,异源部分经由具有氨基酸序列“gap”(seq id no:65)的肽接头与目标肽融合。
[0152]
特别地,肽接头由seq id no:17的核苷酸序列或由与seq id no:17的核苷酸序列具有至少85%同一性、至少90%同一性、至少92%同一性、至少95%同一性、至少98%同一性、至少99%同一性或至少100%同一性的核苷酸序列编码。
[0153]
信号肽
[0154]
本发明的嵌合多肽还可以包含信号肽。特别地,由本发明的核酸分子编码的嵌合gaa多肽还可以包含信号肽,例如gaa的天然信号肽,或衍生自另一种分泌蛋白的替代信号肽。在本发明的上下文中,信号肽不是如上定义的“异源部分”。
[0155]
因此,本发明的核酸分子编码嵌合多肽,其包含:
[0156]-如上定义的目标肽,特别是如上定义的功能性gaa多肽,其融合到:
[0157]-一个或多个如上定义的异源部分,其中所述异源部分中的至少一者是分拣蛋白受体的配体,
[0158]-和任选的信号肽。
[0159]
此类信号肽的非限制性实例包括在wo2018/046775专利申请中描述的那些。特别地,信号肽可以选自seq id no:18至22。因此,本发明提供了嵌合gaa多肽,其包含信号部分、一个或多个异源部分和目标肽,例如如上定义的功能性gaa多肽。在一个特定实施方式中,信号肽是gaa的天然信号肽,例如seq id no:18所示的hgaa的信号肽。在另一个实施方
式中,信号肽是衍生自不同于gaa的蛋白质的外源(或替代)信号肽。在一个特定实施方式中,替代信号肽选自seq id no:19、20、21和22,或其如下定义的功能性衍生物。特别地,信号肽选自seq id no:20、21和22,或其如下定义的功能性衍生物。
[0160]
可用于本发明的特定外源信号肽包括来自胰凝乳蛋白酶原b2的氨基酸1-20(seq id no:21)、人α-1-抗胰蛋白酶的信号肽(seq id no:19)、来自艾杜糖醛酸-2-硫酸酯酶的氨基酸1-25(seq id no:20)和来自蛋白酶c1抑制剂的氨基酸1-23(seq id no:22)。当与包含其天然信号肽的嵌合gaa相比时,seq id no:18和seq id no:19至seq id no:22的信号肽允许嵌合gaa多肽在体外和体内的更高分泌。在一个特定实施方式中,信号肽具有seq id no:18至22所示的序列,或者是其功能性衍生物,即相比于seq id no:18至22所示的序列包含1至5个、特别是1至4个、特别是1至3个、更特别是1至2、特别是1个氨基酸缺失、插入或替换的序列,只要所得序列对应于功能性信号肽,即允许gaa蛋白分泌的信号肽即可。
[0161]
在一个特定实施方式中,信号肽序列与选自seq id no:18至22的序列相比,优选地与选自seq id no:19至22的序列相比,更优选地与选自seq id no:20至22的序列相比,甚至更优选地与seq id no:21的序列相比,具有至少85%、更优选至少90%并且甚至更优选至少92%的同一性,特别是至少95%的同一性,例如至少98%、99%同一性或者具有100%同一性。在一个特定实施方式中,信号肽序列由选自seq id no:18至22的序列组成。优选地,信号肽序列由选自seq id no:19至22的序列组成,更优选地信号肽序列由选自seq id no:20至22的序列组成。根据一个优选实施方式,信号肽序列由seq id no:21所示的序列组成。
[0162]
在一个特定实施方式中,核酸分子编码嵌合gaa多肽,其优选地以如下顺序包含:如上定义的信号肽、如上定义的异源部分、任选的如上定义的接头和如上定义的功能性gaa多肽。特别地,嵌合gaa多肽优选地以如下顺序包含:由如seq id no:21所示序列组成的信号肽,由如seq id no:31-33所示序列组成的异源部分,任选的序列“gap”的接头,以及由如seq id no:9所示的序列组成的功能性gaa多肽。
[0163]
在一个特定实施方式中,核酸分子编码嵌合gaa多肽,其包含以下或由以下组成:seq id no:35-37,或其与seq id no:35-37所示的序列具有至少90%同一性,特别是至少95%、至少96%、至少97%、至少98%或至少99%同一性的功能性衍生物。
[0164]
在一个特定实施方式中,本发明的核酸分子包含以下或由以下组成:seq id no:38至40,或与seq id no:38-40所示序列具有至少90%同一性、特别是至少95%、至少96%、至少97%、至少98%或至少99%同一性的序列。
[0165]
2-核酸构建体
[0166]
本发明还涉及包含本发明核酸分子的核酸构建体。所述核酸构建体可以对应于表达盒,其包含本发明的核酸序列,所述核酸序列可操作地连接到一个或多个表达控制序列和/或改进转基因表达的其他序列和/或增强编码蛋白质的分泌的序列和/或增强编码蛋白质的摄取的序列。如本文所用,术语“可操作地连接”是指多核苷酸元件在功能关系中的连接。当核酸与另一个核酸序列形成功能关系时,所述核酸是“可操作地连接”的。例如,如果启动子或另一转录调控序列影响编码序列的转录,则它与编码序列可操作地连接。此类表达控制序列是本领域中已知的,例如启动子、增强子(例如顺式调控模块(crm))、内含子、polya信号等。
[0167]
特别地,表达盒可以包括启动子。所述启动子可以是广泛性或组织特异性的启动子,特别是能够促进在细胞或组织中表达的启动子,在这些细胞或组织中,需要表达目标肽,例如在需要表达目标肽的细胞或组织中。当目标肽是gaa时,启动子可以是任何能够促进gaa在细胞或组织中表达的启动子,其中在gaa缺陷患者中需要表达目标肽。在一个特定实施方式中,启动子是对cns、特别是对大脑有特异性的启动子。在一个特定实施方式中,启动子是肝脏特异性启动子,例如α-1抗胰蛋白酶启动子(haat)(seq id no:23)、转甲状腺素蛋白启动子、白蛋白启动子、甲状腺素结合球蛋白(tbg)启动子、lsp启动子(包含甲状腺激素结合球蛋白启动子序列、两个拷贝的α1-微球蛋白/bikunin增强子序列和前导序列-34.ill,c.r.等人,(1997).用于血友病a基因治疗的人因子viii互补dna表达质粒的优化(optimization of the human factor viii complementary dna expression plasmid for gene therapy of hemophilia a).blood coag.fibrinol.8:s23-s30.)等。其他有用的肝脏特异性启动子是本领域中已知的,例如肝脏特异性基因启动子数据库中列出的那些,cold spring harbor laboratory编译(http://rulai.cshl.edu/lspd/)。在一个特定实施方式中,启动子是haat启动子。在另一个实施方式中,启动子是指导在一种目标组织或细胞(例如在肌细胞中)和肝细胞中表达的启动子。例如,在一定程度上,肌细胞特异性启动子如结蛋白(desmin)、spc5-12和mck启动子可能会出现一些表达泄漏到肝细胞中,这可能有利于诱导受试者对从核酸分子表达的嵌合gaa蛋白的免疫耐受。
[0168]
其他组织特异性或非组织特异性启动子可用于本发明的实践。例如,表达盒可以包括组织特异性启动子,所述启动子是不同于肝脏特异性启动子的启动子。例如,启动子可以是肌肉特异性的,例如结蛋白启动子(和结蛋白启动子变体,例如结蛋白启动子,包括天然或人工增强子)、spc5-12或mck启动子。在另一个实施方式中,启动子是其他细胞谱系特异性的启动子,例如促红细胞生成素启动子,用于从红细胞谱系的细胞表达嵌合多肽。
[0169]
在另一个实施方式中,启动子是广泛性启动子。代表性的广泛性启动子包括巨细胞病毒增强子/鸡β肌动蛋白(cag)启动子、巨细胞病毒增强子/启动子(cmv)、pgk启动子、sv40早期启动子等。此外,启动子还可以是内源性启动子,例如白蛋白启动子或gaa启动子。在一个特定实施方式中,启动子是如专利申请pct/ep2019/053061中描述的任何杂合调控元件,包括称为“limp”和“lineup”的特定启动子。
[0170]
在一个特定实施方式中,启动子是如通过引用并入本文的专利申请ep19 305455.8中描述的任何杂合启动子,其中所述杂合启动子包含一种或多种与肌肉选择性启动子可操作地连接的肝脏选择性增强子。特别地,启动子可以是专利申请ep19 305455.8中称为ep1、ep2、ep3或ep4的特定启动子,特别是称为ep4的启动子。
[0171]
在一个特定实施方式中,启动子与增强子序列例如顺式调控模块(crm)或人工增强子序列结合。例如,启动子可以与增强子序列如人apoe控制区(或人载脂蛋白e/c-i基因座,肝控制区hcr-1
–
genbank登录号u32510,seq id no:24所示)结合。在一个特定实施方式中,增强子序列如apoe序列与肝脏特异性启动子如上面列出的那些并且特别是例如haat启动子结合。可用于本发明的实践中的其他crm包括rincon等人,mol ther.2015年1月;23(1):43-52;chuah等人,mol ther.2014年9月;22(9):1605-13或nair等人,blood.2014年5月15日;123(20):3195-9中描述的那些。
[0172]
在另一个特定实施方式中,核酸构建体包含内含子,特别是置于启动子和编码嵌
86;lai y.等人,mol ther.,2010,18(1):75-79;wang y.等人,hum gene ther methods,2012,23(4):225-33)。因此,本领域技术人员在实施本发明时应注意选择本发明的核酸构建体的组分,使得所得核酸序列,包括编码aav 5'-和3'-itr的序列优选不超过所使用的aav载体的110%的装载物容量,特别是优选不超过5.5kb。
[0178]
3-载体
[0179]
本发明还涉及包含如本文公开的核酸分子或构建体的载体。特别地,本发明的载体是适用于蛋白质表达,优选用于基因治疗的载体。在一个实施方式中,载体是质粒载体。在另一个实施方式中,载体是含有本发明核酸分子、特别是编码本发明嵌合多肽的信使rna的纳米颗粒。在另一个实施方式中,载体是基于转座子的系统,其允许将本发明的核酸分子或构建体整合到靶细胞的基因组中,例如过度活跃的睡美人(sb100x)转座子系统(mates等人,2009)。在另一个实施方式中,载体是适合基因治疗的病毒载体,其靶向任何目标细胞,例如肝组织或细胞、肌细胞、cns细胞(例如脑细胞),或造血干细胞例如红细胞系细胞(如红细胞)。在这种情况下,本发明的核酸构建体还含有适用于产生有效病毒载体的序列,如本领域所熟知的。在一个特定实施方式中,病毒载体来源于整合病毒。特别地,病毒载体可以来源于逆转录病毒或慢病毒。在另一个特定实施方式中,病毒载体是aav载体,例如适合转导肝组织或细胞的aav载体,更特别是aav-1、-2和aav-2变体(例如包含具有y44 500 730f t491v变化的工程化衣壳的四重突变衣壳优化的aav-2,公开于ling等人,2016年7月18日,hum gene ther methods.[印刷前的电子公开版]),-3和aav-3变体(例如包含具有两个氨基酸变化s663v t492v的工程化aav3衣壳的aav3-st变体,公开于vercauteren等人,2016,mol.ther.第24(6)卷,第1042页),-3b和aav-3b变体,-4、-5、-6和aav-6变体(例如包含三重突变aav6衣壳y731f/y705f/t492v形式的aav6变体,公开于rosario等人,2016,mol ther methods clin dev.3,第16026页),-7、-8、-9、-10如-cy10和-rh10、-rh74、-dj、anc80、lk03、aav2i8、猪aav血清型如aavpo4和aavpo6等,载体或逆转录病毒载体如慢病毒载体和α-逆转录病毒。如本领域中已知,根据考虑使用的具体病毒载体,在本发明的核酸构建体中引入额外的合适序列以获得功能性病毒载体。合适的序列包括用于aav载体的aav itr,或用于慢病毒载体的ltr。因此,本发明还涉及如上所述的表达盒,其在每一侧上侧接itr或ltr。
[0180]
在本公开的以下部分中讨论了病毒载体的优点。病毒载体优选用于递送本发明的核酸分子或构建体,例如逆转录病毒载体,例如慢病毒载体,或非致病性细小病毒,更优选aav载体。人类细小病毒腺相关病毒(aav)是一种天然存在复制缺陷的依赖病毒,其能够整合到受感染细胞的基因组中以建立潜伏感染。最后一个特性在哺乳动物病毒中似乎是独一无二的,因为整合发生在人类基因组中的特定位点,称为aavs1,位于19号染色体上(19q13.3-qter)。
[0181]
因此,aav载体作为人类基因治疗的潜在载体引起了相当大的关注。所述病毒的有利特性是它与任何人类疾病都没有关联,它能够感染分裂细胞和非分裂细胞,以及源自可以感染的不同组织的广泛细胞系。
[0182]
在从人类或非人类灵长类动物(nhp)分离并充分表征的aav血清型中,人类血清型2是第一个被开发为基因转移载体的aav。其他目前使用的aav血清型包括aav-1、aav-2变体(例如包含具有y44 500 730f t491v变化的工程化衣壳的四重突变衣壳优化的aav-2,公开
于ling等人,2016年7月18日,hum gene ther methods.[印刷前的电子公开版]),-3和aav-3变体(例如包含具有两个氨基酸变化s663v t492v的工程化aav3衣壳的aav3-st变体,公开于vercauteren等人,2016,mol.ther.第24(6)卷,第1042页),-3b和aav-3b变体,-4、-5、-6和aav-6变体(例如包含三重突变aav6衣壳y731f/y705f/t492v形式的aav6变体,公开于rosario等人,2016,mol ther methods clin dev.3,第16026页),-7、-8、-9、-10如-cy10和-rh10、-rh74、-dj、anc80、lk03、aav2i8、猪aav血清型如aavpo4和aavpo6,以及aav血清型的酪氨酸、赖氨酸和丝氨酸衣壳突变体等。此外,其他非天然工程变体和嵌合aav也可以是有用的。
[0183]
aav病毒可以使用常规分子生物学技术进行工程改造,从而可以优化这些颗粒以用于核酸序列的细胞特异性递送,用于最小化免疫原性,用于调节稳定性和颗粒寿命,用于有效降解,用于准确递送至细胞核。
[0184]
用于组装成载体的理想aav片段包括帽蛋白,包括vp1、vp2、vp3和高变区,rep蛋白,包括rep 78、rep 68、rep 52和rep 40,以及编码这些蛋白的序列。这些片段可以容易地用于各种载体系统和宿主细胞。
[0185]
缺乏rep蛋白的基于aav的重组载体以低功效整合到宿主的基因组中,并且主要以稳定的环状附加体形式存在,可以在靶细胞中持续数年。
[0186]
作为使用aav天然血清型的替代方案,人工aav血清型可用于本发明的情形中,包括但不限于具有非天然存在的衣壳蛋白的aav。这样的人工衣壳可以通过任何合适的技术,使用选择的aav序列(例如,vp1衣壳蛋白的片段)与异源序列的组合来产生,所述异源序列可以获自不同选择的aav血清型、相同的aav血清型的非连续部分,获自非aav病毒来源,或获自非病毒来源。人工aav血清型可以是但不限于嵌合aav衣壳、重组aav衣壳或“人源化”aav衣壳。
[0187]
因此,本发明涉及包含本发明的核酸分子或构建体的aav载体。在本发明的上下文中,aav载体包含能够转导目标靶细胞、特别是肝细胞的aav衣壳。根据一个特定实施方式,aav载体是aav-1、-2、aav-2变体(例如包含具有y44 500 730f t491v变化的工程化衣壳的四重突变衣壳优化的aav-2,公开于ling等人,2016年7月18日,hum gene ther methods.[印刷前的电子公开版]),-3和aav-3变体(例如包含具有两个氨基酸变化s663v t492v的工程化aav3衣壳的aav3-st变体,公开于vercauteren等人,2016,mol.ther.第24(6)卷,第1042页),-3b和aav-3b变体,-4、-5、-6和aav-6变体(例如包含三重突变aav6衣壳y731f/y705f/t492v形式的aav6变体,公开于rosario等人,2016,mol ther methods clin dev.3,第16026页),-7、-8、-9、-10如-cy10和-rh10、-rh74、-dj、anc80、lk03、aav2i8、猪aav如aavpo4和aavpo6,以及aav血清型的酪氨酸、赖氨酸和丝氨酸衣壳突变体等血清型。在一个特定实施方式中,aav载体是aav8、aav9、aavrh74或aav2i8血清型(即aav载体具有aav8、aav9、aavrh74或aav2i8血清型的衣壳)。在另一个特定实施方式中,aav载体是假型载体,即其基因组和衣壳衍生自不同血清型的aav。例如,假型aav载体可以是其基因组来源于上述aav血清型之一而其衣壳来源于另一血清型的载体。例如,假型载体的基因组可以具有来源于aav8、aav9、aavrh74或aav2i8血清型的衣壳,并且其基因组可以来源于不同的血清型。在一个特定实施方式中,aav载体具有aav8、aav9或aavrh74血清型,特别是aav8或aav9血清型,更特别是aav8血清型的衣壳。
[0188]
在一个具体实施方式中,其中载体用于将转基因递送至肌细胞,aav载体可以选自aav8、aav9和aavrh74。
[0189]
在另一个具体实施方式中,其中载体用于将转基因递送至肝细胞,aav载体可以选自aav5、aav8、aav9、aav-lk03、aav-anc80和aav3b。
[0190]
在另一个实施方式中,衣壳是修饰衣壳。在本发明的情形中,“修饰衣壳”可以是嵌合衣壳或包含衍生自一种或多种野生型aav vp衣壳蛋白的一种或多种变体vp衣壳蛋白的衣壳。
[0191]
在一个特定实施方式中,aav载体是嵌合载体,即其衣壳包含源自至少两种不同aav血清型的vp衣壳蛋白,或包含结合源自至少两种aav血清型的vp蛋白区域或结构域的至少一种嵌合vp蛋白。可用于转导肝细胞的此类嵌合aav载体的实例描述于shen等人,molecular therapy,2007;和tenney等人,virology,2014中。例如,嵌合aav载体可源自aav8衣壳序列与不同于aav8血清型的aav血清型序列(例如上面具体提及的任一种)的组合。在另一个实施方式中,aav载体的衣壳包含一种或多种变体vp衣壳蛋白,例如wo2015013313中描述的那些,特别是rhm4-1、rhm15-1、rhm15-2、rhm15-3/rhm15-5、rhm15-4和rhm15-6衣壳变体,其呈现高肝向性。
[0192]
在另一个实施方式中,修饰衣壳也可以源自通过易错pcr和/或肽插入而插入的衣壳修饰(例如,如bartel等人,2011中所述)。此外,衣壳变体可能包括单个氨基酸变化,例如酪氨酸突变体(例如,如zhong等人,2008中所述)。
[0193]
此外,aav载体的基因组可以是单链或自互补双链基因组(mccarty等人,gene therapy,2003)。通过从aav末端重复序列之一中缺失末端解离位点(trs)来生成自互补双链aav载体。这些修饰的载体,其复制基因组是野生型aav基因组长度的一半,具有包装dna二聚体的趋势。在一个优选的实施方式中,在本发明的实践中使用的aav载体具有单链基因组,并且进一步优选包含aav8、aav9、aavrh74或aav2i8衣壳,特别是aav8、aav9或aavrh74衣壳,例如aav8或aav9衣壳,更特别是aav8衣壳。
[0194]
在一个特定实施方式中,本发明涉及一种aav载体,其在单链或双链自互补基因组(例如单链基因组)中包含本发明的核酸构建体。在一个实施方式中,aav载体包含aav8、aav9、aavrh74或aav2i8衣壳,特别是aav8、aav9或aavrh74衣壳,例如aav8或aav9衣壳,更特别是aav8衣壳。在另一个特定实施方式中,所述核酸可操作地连接至启动子,尤其是广泛性或肝脏特异性启动子。根据一个具体的变体实施方式,启动子是广泛性启动子,例如巨细胞病毒增强子/鸡β肌动蛋白(cag)启动子、巨细胞病毒增强子/启动子(cmv)、pgk启动子和sv40早期启动子。在一个特定的变体中,广泛性启动子是cag启动子。根据另一个变体,启动子是肝脏特异性启动子,例如α-1抗胰蛋白酶启动子(haat)、转甲状腺素蛋白启动子、白蛋白启动子和甲状腺素结合球蛋白(tbg)启动子。在一个具体变体中,肝脏特异性启动子是seq id no:23的haat肝脏特异性启动子。在另一个特定实施方式中,包含在本发明的aav载体基因组中的核酸构建体还包含如上所述的内含子,例如置于启动子和编码本发明嵌合多肽的核酸序列之间的内含子。可包括在引入aav载体基因组内的核酸构建体中的代表性内含子包括但不限于人β珠蛋白b2(或hbb2)内含子、fix内含子和鸡β-珠蛋白内含子。aav载体基因组内的所述内含子可以是经典的(或未修饰的)内含子或经设计以减少或甚至完全去除所述内含子内的替代开放阅读框(arf)的数量的修饰内含子。上面详细描述了可以在此
实施方式的实践中使用的修饰和未修饰的内含子,其中本发明的核酸被引入aav载体中。在一个特定实施方式中,本发明的aav载体,特别是包含aav8、aav9、aavrh74或aav2i8衣壳,特别是aav8、aav9或aavrh74衣壳,例如aav8或aav9衣壳,更特别是aav8衣壳的aav载体,在其基因组内包括修饰的(或优化的)内含子,例如seq id no:26的修饰的hbb2内含子、seq id no:28的修饰的fix内含子和seq id no:30的修饰的鸡β-珠蛋白内含子。在另一个特定实施方式中,本发明的载体是aav载体,其包含aav8、aav9、aavrh74或aav2i8衣壳,特别是aav8、aav9或aavrh74衣壳,例如aav8或aav9衣壳,更特别是aav8衣壳,所述aav载体包含这样的基因组,其在5'至3'方向上含有:aav 5'-itr(例如aav25'-itr);apoe控制区;haat-肝脏特异性启动子;hbb2内含子(特别是如上定义的修饰的hbb2内含子);本发明的编码嵌合多肽、特别是嵌合gaa多肽的核酸分子;牛生长激素多聚腺苷酸化信号;和aav3'-itr(例如aav2 3'-itr),所述基因组例如包含侧接aav 5'-itr(例如aav2 5'-itr)和aav 3'-itr(例如aav2 3'-itr)的seq id no:41-43-z所示的核酸构建体的基因组。
[0195]
在本发明的一个特定实施方式中,本发明的核酸构建体包含如上所述的肝脏特异性启动子,并且载体是能够转导如上所述的肝组织或细胞的病毒载体。由于该实施方式,有利地实现了肝脏的原致耐受性和代谢特性,以开发高效和优化的载体,以在肝细胞中表达可分泌形式的gaa并诱导对蛋白质的免疫耐受。
[0196]
此外,在另一个特定的实施方式中,本发明提供了两种载体例如两种病毒载体、特别是两种aav载体的组合,用于改善目标细胞中的基因递送和治疗功效。例如,所述两种载体可以携带在这两种载体的每一者中的一个不同启动子的控制下编码本发明嵌合多肽的本发明核酸分子。在一个特定实施方式中,一个载体包含启动子,所述启动子是肝脏特异性启动子(如上文所述的启动子之一),并且另一个载体包含对用于治疗糖原贮积病的另一种目标组织具有特异性的启动子,例如肌肉特异性启动子,例如结蛋白启动子。在该实施方式的一个特定变体中,该载体组合对应于如wo2015196179中所述产生的多个共同包装的aav载体。
[0197]
4-嵌合gaa多肽
[0198]
在另一方面,本发明提供了一种嵌合多肽,其由如上所述的本发明的核酸分子编码。特别地,嵌合多肽是嵌合gaa多肽,其包含与一个或多个异源结构域融合的功能性gaa多肽,其中所述异源结构域中的至少一者是如上定义的分拣蛋白受体的配体。在一个特定实施方式中,嵌合gaa多肽具有seq id no:35-37所示的序列,或者是其与seq id no:35-37所示的序列具有至少90%同一性、特别是至少95%、至少96%、至少97%、至少98%或至少99%同一性的功能性衍生物。
[0199]
在一个特定实施方式中,嵌合多肽,特别是嵌合gaa多肽,能够降低cns(例如脊髓和大脑)中、特别是大脑中的糖原含量。在一个特定实施方式中,当与未融合到一个或多个如上所述的异源结构域的非嵌合多肽、特别是非嵌合gaa多肽相比时,嵌合多肽、特别是嵌合gaa多肽导致cns(例如脊髓和大脑)中、特别是大脑中糖原含量的降低得以改善。
[0200]
5-细胞
[0201]
本发明还涉及一种分离的细胞,例如肝细胞,其被本发明的核酸分子或构建体转化,如用于离体基因治疗的情况。因此,本发明涉及一种包含本发明的核酸分子、核酸构建体或载体的分离的细胞,例如肝细胞。
[0202]
本发明的细胞可以通过任何适当的施用途径,例如经由注射到所述受试者的肝脏或血流中,递送至有需要的受试者,例如gaa缺陷患者。在一个特定实施方式中,本发明涉及将本发明的核酸引入肝细胞,特别是引入待治疗的受试者的肝细胞中,以及将已经引入核酸的所述转化肝细胞施用于受试者。有利地,此实施方式可用于从所述细胞分泌gaa。在一个特定实施方式中,肝细胞是来自待治疗患者的肝细胞,或者是进一步转化并在体外分化成肝细胞以随后施用于患者的肝脏干细胞。
[0203]
本发明还涉及一种在基因组中包含编码根据本发明的嵌合多肽的本发明的核酸分子或构建体的转基因非人类动物。在一个特定实施方式中,动物是小鼠。
[0204]
除了下文实施例中实施的具体递送系统之外,各种递送系统是已知的并且可以用于施用本发明的核酸分子或构建体,例如封装在脂质体、微粒、微囊、能够表达本发明核酸序列、受体介导的内吞作用、构建治疗性核酸作为逆转录病毒或其他载体的一部分的重组细胞中,等。
[0205]
根据一个实施方式,可能需要通过任何合适的途径将本发明的嵌合多肽、核酸分子、核酸构建体或分离的细胞引入受试者的肝脏中。此外,裸dna如微环和转座子或慢病毒载体可以用于递送。此外,例如锌指核酸酶、大范围核酸酶、talen和crispr的基因编辑技术也可以用于递送本发明的编码序列。
[0206]
6-药物组合物
[0207]
本发明还提供了包含本发明的核酸分子、核酸构建体、载体、嵌合多肽或分离的细胞的药物组合物。此类组合物包含治疗有效量的治疗剂(本发明的核酸分子、核酸构建体、载体、嵌合多肽或细胞)和药学上可接受的载剂。在一个具体实施方式中,术语“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国或欧洲药典或其他公认的用于动物和人类的药典中列出。术语“载剂”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或媒介物。此类药物载剂可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物经静脉内施用时,水是优选的载剂。盐水溶液和右旋糖和甘油水溶液也可以用作液体载剂,特别是用于可注射溶液。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、硬脂酸钠、单硬脂酸甘油酯、滑石粉、氯化钠、干脱脂奶粉、甘油、丙二醇、水、乙醇等。
[0208]
如果需要,所述组合物还可以含有少量的润湿剂或乳化剂,或ph缓冲剂。这些组合物可以采取溶液、悬浮液、乳液、片剂、丸剂、胶囊剂、散剂、持续释放制剂等形式。口服制剂可以包括标准载剂,例如药物级的甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药物载剂的实例描述于e.w.martin的"remington's pharmaceutical sciences"中。此类组合物含有治疗有效量的治疗剂,优选呈纯化形式的治疗剂,以及合适量的载剂,以提供适合施用于受试者的形式。在一个特定实施方式中,本发明的核酸、载体或细胞被配制在包含磷酸盐缓冲盐水并补充有0.25%人血清白蛋白的组合物中。在另一个特定实施方式中,将本发明的核酸、载体或细胞配制在包含林格氏乳酸盐溶液(ringer lactate)和非离子表面活性剂如按总组合物的重量计最终浓度为0.01-0.0001%,例如浓度为0.001%pluronic f68的组合物中。所述制剂还可以包含血清白蛋白,特别是人血清白蛋白,例如0.25%的人血清白蛋白。用于储存或施用的其他适当的制剂在本领域中是已知的,特别是来自wo 2005/118792或allay等人,2011。
[0209]
在一个优选的实施方式中,所述组合物根据常规程序配制为适于静脉内施用于人类的药物组合物。通常,用于静脉内施用的组合物是无菌等渗水性缓冲液中的溶液。必要时,所述组合物还可以包括增溶剂和局部麻醉剂如利多卡因,以减轻注射部位的疼痛。
[0210]
7-施用和用途
[0211]
在一个实施方式中,本发明的核酸分子、核酸构建体、载体、嵌合多肽或细胞可以在囊泡、特别是脂质体中递送。在又一个实施方式中,本发明的核酸分子、核酸构建体、载体、嵌合多肽或细胞可以在控释系统中递送。
[0212]
本发明的核酸分子、核酸构建体、载体、嵌合多肽或细胞的施用方法包括但不限于皮内、肌肉内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。在一个特定实施方式中,施用经由静脉内或肌肉内途径。本发明的核酸分子、核酸构建体、载体、嵌合多肽或细胞,无论是否被载体化,都可以通过任何适宜途径施用,例如通过输注或快速浓注,通过经由上皮或皮肤黏膜内层(例如口腔黏膜、直肠和肠黏膜等)吸收,并且可以与其他生物活性剂一起施用。施用可以是全身的或局部的。
[0213]
在一个具体实施方式中,可能需要将本发明的药物组合物局部施用到需要治疗的区域,例如肝脏。这可以例如通过植入物来实现,所述植入物是多孔的、无孔的或凝胶状材料,包括膜,例如sialastic膜,或纤维。
[0214]
本发明的治疗剂(即本发明的核酸分子、核酸构建体、载体、嵌合多肽或分离的细胞)会有效治疗疾病、特别是糖原贮积病的量可以通过标准临床技术来确定。此外,可任选地采用体内和/或体外测定来帮助预测最佳剂量范围。制剂中使用的精确剂量还取决于施用途径和疾病的严重程度,并且应根据从业者的判断和每个患者的情况来决定。向有需要的受试者施用的本发明的核酸分子、核酸构建体、载体、嵌合多肽或细胞的剂量将基于若干因素而变化,所述因素包括但不限于施用途径、所治疗的具体疾病、受试者的年龄或获得治疗效果所需的表达水平。本领域技术人员可以基于其在本领域中的知识容易地确定基于这些因素和其他因素所需的剂量范围。在包括向受试者施用病毒载体例如aav载体的治疗的情况下,载体的典型剂量是至少1
×
108个载体基因组/千克体重(vg/kg),例如至少1
×
109vg/kg、至少1
×
10
10
vg/kg、至少1
×
10
11
vg/kg、至少1
×
10
12
vg/kg、至少1
×
10
13
vg/kg或至少1
×
10
14
vg/kg。
[0215]
本发明还涉及一种治疗溶酶体贮积病的方法,所述方法包括将治疗有效量的本发明的核酸、载体、嵌合多肽、药物组合物或细胞递送至有需要的受试者的步骤。
[0216]
在一个特定实施方式中,溶酶体疾病与神经学表现相关。
[0217]
特别地,溶酶体疾病可以是糖原贮积病(gsd),例如庞贝病、i型黏多糖贮积症(mpsi)、ii型黏多糖贮积症(mpsii)、iiia型黏多糖贮积症(mpsiiia)、iiib型黏多糖贮积症(mpsiiib)、iiic型黏多糖贮积症(mpsiiic)、iiid型黏多糖贮积症(mpsiiid)、vii型黏多糖贮积症(mpsvii)、异染性脑白质营养不良(mld)、2型戈谢病(gaucher's disease)、3型戈谢病、gm1神经节苷脂沉积病、泰-萨克斯病(tay-sachs disease)、桑德霍夫病(sandhoff's disease)、法布里病(fabry's disease)、克拉伯病(krabbe's disease)、a型尼曼-匹克病(niemann-pick)、异染性脑白质营养不良、法伯病(farber's disease)、α-甘露糖苷贮积症、β-甘露糖苷贮积症、辛德勒病(schindler disease)、唾液酸中毒贮积症、1型神经元蜡样脂褐质沉积症(ncl1)、2型神经元蜡样脂褐质沉积症(ncl2)、多发性硫酸酯酶缺乏症
(msd)、ii型黏脂贮积症、iiia型黏脂贮积症、半乳糖唾液酸沉积症、c型尼曼-匹克病、gm2激活蛋白缺乏症、达农病(danon disease)、萨拉病(salla disease)、ncl3病或iv型黏脂贮积症。
[0218]
在一个特定实施方式中,所述疾病是糖原贮积病,特别是gsdii(庞贝病)。
[0219]
本发明还涉及一种用于降低cns中(例如脊髓和/或大脑中),特别是大脑中的糖原含量的方法,其包括将治疗有效量的本发明的核酸、载体、嵌合多肽、药物组合物或细胞递送至有需要的受试者的步骤。
[0220]
在一个特定实施方式中,本发明涉及一种用于治疗糖原贮积病的方法,其包括将治疗有效量的本发明的核酸、载体、嵌合gaa多肽、药物组合物或细胞递送至有需要的受试者的步骤。
[0221]
本发明还涉及一种治疗糖原贮积病的方法,所述方法不诱导对转基因(即嵌合gaa多肽)的免疫反应,或诱导降低的对转基因的免疫反应,所述方法包括将治疗有效量的本发明的核酸分子、核酸构建体、嵌合多肽、载体、药物组合物或细胞递送至有需要的受试者的步骤。本发明还涉及一种治疗糖原贮积病的方法,所述方法包括向有需要的受试者重复施用治疗有效量的本发明的核酸分子、核酸构建体、嵌合多肽、载体、药物组合物或细胞。在这方面,本发明的核酸分子或核酸构建体包含在肝细胞中起作用的启动子,从而允许对由肝细胞产生的表达的嵌合gaa多肽产生免疫耐受。同样,在这方面,用于该方面的药物组合物包含核酸分子或核酸构建体,其包含在肝细胞中起作用的启动子。在递送肝细胞的情况下,所述细胞可以是先前从需要治疗的受试者收集并且通过在其中引入本发明的核酸分子或核酸构建体进行工程改造以进而使它们能够产生本发明的嵌合gaa多肽的细胞。根据一个实施方式,在包括重复施用的方面,所述施用可以重复至少一次或多次,并且甚至可以被认为是根据周期性时间表进行的,例如每周、每月或每年一次。周期性时间表还可以包括每2、3、4、5、6、7、8、9或10年或超过10年施用一次。在另一个特定实施方式中,本发明的病毒载体的每次施用的施用是在每次连续施用时使用不同的病毒进行的,从而避免由于针对先前施用的病毒载体的可能的免疫反应而导致功效降低。例如,可以首先施用包含aav8衣壳的病毒载体,接着施用包含aav9衣壳的载体,或者甚至施用与aav无关的病毒,例如逆转录病毒或慢病毒载体。
[0222]
本发明还涉及一种治疗糖原贮积病的方法,其包括将治疗有效量的本发明的核酸分子、核酸构建体、载体、嵌合gaa多肽、药物组合物或细胞递送至有需要的受试者的步骤。转基因可用于产生高水平的gaa蛋白,并提供治疗益处,例如提高血浆和/或组织如骨骼肌中的gaa活性。本发明还涉及一种治疗糖原贮积病的方法,所述方法包括向有需要的受试者重复施用治疗有效量的本发明的核酸分子、核酸构建体、载体、嵌合gaa多肽、药物组合物或细胞。在这方面,本发明的核酸分子或核酸构建体包含在肝细胞中起作用的启动子,从而允许对由肝细胞产生的表达的嵌合gaa多肽产生免疫耐受。同样,在这方面,用于该方面的药物组合物包含核酸分子或核酸构建体,其包含在肝细胞中起作用的启动子。在递送肝细胞的情况下,所述细胞可以是先前从需要治疗的受试者收集并且通过在其中引入本发明的核酸分子或核酸构建体进行工程改造以进而使它们能够产生本发明的嵌合gaa多肽的细胞。根据一个实施方式,在包括重复施用的方面,所述施用可以重复至少一次或多次,并且甚至可以被认为是根据周期性时间表进行的,例如每周、每月或每年一次。周期性时间表还可以
包括每2、3、4、5、6、7、8、9或10年或超过10年施用一次。在另一个特定实施方式中,本发明的病毒载体的每次施用的施用是对于每次连续施用使用不同的病毒进行的,从而避免由于针对先前施用的病毒载体的可能的免疫反应而导致功效降低。例如,可以首先施用包含aav8衣壳的病毒载体,接着施用包含aav9衣壳的载体,或者甚至施用与aav无关的病毒,例如逆转录病毒或慢病毒载体。
[0223]
根据本发明,治疗可以包括治愈、缓解或预防作用。因此,治疗性和预防性治疗包括改善特定糖原贮积病的症状或者预防或以其他方式降低发生特定糖原贮积病的风险。术语“预防性”可以被认为是降低特定病状的严重程度或发作。“预防性”还包括防止先前诊断患有特定病状的患者中所述病状的再次发生。“治疗性”还可以降低现有病状的严重程度。术语
‘
治疗’在本文中用于指可以使动物、特别是哺乳动物、更特别是人类受试者受益的任何方案。
[0224]
本发明还涉及用于治疗糖原贮积病的离体基因治疗方法,其包括将本发明的核酸分子或核酸构建体引入有需要的患者的分离的细胞,例如分离的造血干细胞中,以及将所述细胞引入所述有需要的患者中。在该方面的一个特定实施方式中,将核酸分子或构建体与如上定义的载体一起引入细胞中。在一个特定实施方式中,载体是整合病毒载体。在另一个特定实施方式中,病毒载体是逆转录病毒载体,例如慢病毒载体。例如,如van til等人,2010,blood,115(26),第5329页中公开的慢病毒载体可用于本发明方法的实践中。
[0225]
本发明还涉及用作药物的本发明的核酸分子、核酸构建体、载体、嵌合gaa多肽或细胞。
[0226]
本发明还涉及本发明的核酸分子、核酸构建体、载体、嵌合gaa多肽或细胞,其用在用于治疗由gaa基因突变引起的疾病的方法中,特别是用在用于治疗庞贝病的方法中。本发明还涉及本发明的核酸分子、核酸构建体、载体、嵌合gaa多肽或细胞,其用在用于治疗糖原贮积病例如gsdi(冯吉尔克病(von gierke's disease))、gsdii(庞贝病)、gsdiii(科里病(cori disease))、gsdiv、gsdv、gsdvi、gsdvii、gsdviii和致死性心脏先天性糖原贮积病,更特别是gsdi、gsdii或gsdiii,甚至更特别是gsdii和gsdiii并且最特别是gsdii的方法中。本发明的嵌合gaa多肽可以施用于有需要的患者,用于酶替代疗法(ert),例如用于糖原贮积病如gsdiii(科里病)以及gsd-iv、-vi、-ix、-xi和由于amp活化蛋白激酶γ亚基2缺乏引起的心脏糖原贮积病之一的酶替代疗法。
[0227]
本发明还涉及本发明的核酸分子、核酸构建体、载体、嵌合gaa多肽或细胞在制造可用于治疗糖原贮积病的药物中的用途,所述糖原贮积病例如gsdi(冯吉尔克病)、gsdii(庞贝病)、gsdiii(科里病)、gsdiv、gsdv、gsdvi、gsdvii、gsdviii和致死性先天性心脏糖原贮积病,更特别是gsdi、gsdii或gsdiii,甚至更特别是gsdii和gsdiii,并且最特别是gsdii。
[0228]
实施例
[0229]
材料和方法
[0230]
gaa表达盒和aav载体
[0231]
本研究中使用的gaa转基因表达盒含有密码子优化的人类gaa(hgaa)编码序列[puzzo f.等人,sci transl med.2017年11月29日;9(418)]。使用商业算法(thermo fisher scientific)进行密码子优化[puzzo f.等人,sci transl med.2017年11月29日;9
(418)]。如图1所描绘,异源结构域(spadin、apoe、apob)被克隆到gaa转基因的n末端。转基因序列被克隆到在载脂蛋白e(肝细胞控制区增强子)和人α1-抗胰蛋白酶(haat)启动子的转录控制下的aav载体骨架中。研究中使用的所有dna序列均由genecust或thermo fisher scientific合成。
[0232]
本研究中使用的aav载体是使用hek293细胞的无腺病毒瞬时转染方法生产的,如[puzzo f等人,sci transl med.2017年11月29日;9(418)]所述。使用定量实时pcr(qpcr)和sds-page,接着使用sypro ruby蛋白凝胶染色和条带光密度测定法确定aav载体储用液的滴度。研究中使用的所有载体制剂在使用前都进行了并排量化。用于对aav基因组进行qpcr的引物与以下各物退火:bgh polya(正向:tctagttgccagccatctgttgt(seq id no:44);反向:tgggagtggcaccttcca(seq id no:45)和密码子优化的hgaa(正向:agatacgccggacattggactg(seq id no:46);反向:gcacgcccagcagattgaac(seq id no:47)。使用的aav血清型是aav8(zincarelli等人,mol ther.2008年6月;16(6):1073-80)。
[0233]
体外实验
[0234]
将人肝细胞瘤细胞(huh7)接种在6孔板(5
×
105个细胞/孔)中,并根据制造商的说明使用lipofectamine 3000(thermo fisher scientific)进行转染。转染后72小时,收获细胞并分析gaa活性和蛋白质印迹分析。
[0235]
对于酶摄取实验,将huh7细胞接种在t75孔板(1
×
107个细胞/孔)中,并根据制造商的说明使用lipofectamine 3000(thermo fisher scientific)进行转染。转染后72小时,收获huh7条件培养基并用于培养源自庞贝病患者的成纤维细胞(gmo 20124gsdii 3p)。培养72小时后,用pbs洗涤成纤维细胞3次,收获并进行蛋白质印迹分析。
[0236]
小鼠研究
[0237]
野生型c57bl/6小鼠购自charles river(charles river,france)。gaa-/-小鼠是通过外显子6的靶向破坏产生的(raben n.等人,j biol chem.1998年7月24日;273(30):19086-92)。使用c57bl/6j/129x1/svj背景中的gaa-/-小鼠。使用雄性同窝受影响的gaa-/-和未受影响的gaa / 小鼠。aav载体以0.2ml的体积经由尾静脉递送至:1.成年小鼠。实验组的大小允许进行统计分析;所有动物都包括在分析中,没有排除任何异常值。小鼠被随机分配到实验组,并且进行载体递送和功能分析的操作员对群组身份不知情。
[0238]
gaa活性
[0239]
在小鼠血浆(1/1000-1/2000稀释度)和组织中测量gaa活性。速冻组织在di ultrapure
tm
无dna酶/rna酶蒸馏水(thermo fisher scientific)中匀浆化。将50-100mg组织称重并匀浆化,然后以10000x g离心20分钟以收集上清液。在96孔板中使用10μl样品(血浆或组织匀浆)和20μl底物-4mu-α-d-葡萄糖苷进行酶促反应。将反应混合物在37℃下温育一小时,然后通过加入150μl的ph 10.5的碳酸钠缓冲液停止反应。使用enspireα读板器(perkin-elmer)在449nm(发射)和360nm(激发)下,使用标准曲线(0-2500pmol/μl的4mu)测量个别反应混合物中释放的荧光4mu。通过bca(thermo fisher scientific)对澄清上清液的蛋白质浓度进行定量。为了计算gaa活性,将所释放的4mu浓度除以样品蛋白质浓度,并且活性报告为nmol/h/mg蛋白质。
[0240]
蛋白质印迹分析
[0241]
使用含有1%triton-x100和蛋白酶抑制剂(roche diagnosis)的10mm pbs
(ph7.4)制备huh7和成纤维细胞裂解物。对在蒸馏水中以1:4稀释的样品进行小鼠血浆的蛋白质印迹分析。按照gaa活性的指示制备小鼠组织。使用bca蛋白质测定(thermo fisher scientific)测定蛋白质浓度。sds-page电泳在4-12%聚丙烯酰胺凝胶中进行。转移后,膜用odyssey缓冲液(li-cor biosciences)封闭,并与抗gaa抗体(兔单克隆抗体,abcam)或抗纽蛋白(anti-vinculin)(小鼠单克隆抗体,sigma aldrich)一起温育。用适当的二抗(li-cor biosciences)洗涤和温育膜,并通过odyssey成像系统(li-cor biosciences)进行可视化。
[0242]
抗gaa抗体检测
[0243]
根据公布的方案进行抗gaa抗体测量。简而言之,用1μg/ml rhgaa包被maxisorp 96孔板(thermo fisher scientific)。igg标准曲线是通过商业小鼠(sigma aldrich)重组igg的连续1至2次稀释制成的,所述重组igg一式两份直接包被在孔上。使用抗小鼠(southern biotech)igg二抗作为二抗。
[0244]
结果
[0245]
1.aav质粒中gaa变体的克隆
[0246]
我们最初选择了五个异源结构域来改进gaa的cns靶向:1.载脂蛋白b结构域(apob),2.载脂蛋白e结构域(apoe),3.spadin,4.神经紧张素氨基酸1-13(nt1-13);神经紧张素氨基酸9-13(nt9-13)。apob和apoe结构域是ldl受体的配体并且之前已被描述为在与蛋白质缀合时增强cns靶向(bockenhoff a.等人,j.neurosci.,2014,第34卷,第9期,第3122
–
3129页;sorrentino n.c.等人,embo mol.med.,2013,第5卷,第5期,第675
–
690页;spencer等人,pnas 2007;第104卷,第18期,第7594
–
7599页;gleitz h.f.e.等人,embo mol med.2018)。spadin肽、nt1-13和nt9-13是分拣蛋白配体,但其从未与其他蛋白质缀合和/或利用它们靶向cns。
[0247]
将apob、apoe、spadin、nt1-13和nt9-13肽插入在sp7-δ42-gaaco变体[puzzo f.等人,sci transl med.2017年11月29日;9(418),专利申请wo2018/046774)]的n末端,以生成:sp7-apob-δ42-gaaco变体(缩写为hd-apob)、sp7-apoe-δ42-gaaco变体(缩写为hd-apoe)、sp7-spadin-δ42-gaaco变体(缩写为hd-spadin)、sp7-nt1-13-δ42-gaaco变体(缩写为hd-nt1-13)spadin)、sp7-nt9-13-δ42-gaaco变体(缩写为hd-nt9-13)(图1)。将氨基酸接头(3个氨基酸,maga ja等人,j biol chem.2013;288(3):1428
–
1438)放置在稳定性结构域和gaa之间以确保适当的酶折叠(图1)。
[0248]
为了在肝脏中实现有效表达,将所有sp7-δ42-gaaco变体克隆到在人α-1抗胰蛋白酶(haat)启动子以及肝细胞限制性载脂蛋白(apoe)增强子的控制下的表达盒中。编码sp7-δ42-gaaco变体的所有转基因表达盒含有相同的先前描述的调控元件[puzzo f.等人,sci transl med.2017年11月29日;9(418);图1):
[0249]-含有来自aav2的两个itr序列的aav顺式包装骨架,是包装病毒基因组所必需的,
[0250]-载脂蛋白e(apoe)肝细胞控制区增强子
[0251]-肝细胞特异性人α1-抗胰蛋白酶(haat)启动子
[0252]-人血红蛋白β-亚基合成内含子(hbb2.1)以稳定mrna并增强蛋白质表达,
[0253]-不含内源性信号肽的gaa编码序列的密码子优化版本
[0254]-允许gaa分泌的异源信号肽(sp7)
[0255]-牛生长激素(bgh)多聚腺苷酸化信号。
[0256]
2.人类肝细胞培养物中gaa变体的分析
[0257]
具有异源结构域的gaa变体[sp7-apob-δ42-gaaco(hd-apob)、sp7-apoe-δ42-gaaco(hd-apoe)、sp7-spadin-δ42-gaaco(hd-spadin)、sp7-nt1-13-δ42-gaaco(hd-nt1-13)、sp7-nt9-13-δ42-gaaco变体(hd-nt9-13)]的产生和酶活性首先在瞬时转染相应的paav质粒的人肝细胞系(huh7)培养物中进行了测试。没有异源结构域的变体(sp7-δ42-gaaco,缩写为hd0)用作阳性对照。进行了三个独立的huh7细胞瞬时转染(图2)。转染后72小时收获细胞,并在细胞裂解物中测量gaa酶活性(图2)。与hd0相比,只有hd-spadin、hd-nt1-13和hd-nt9-13变体在细胞裂解物中显示出保留的酶活性,表明适当的酶产生和成熟(图2)。未进一步分析导致细胞中无法检测的gaa活性的hd-apoe(图2)。
[0258]
3.aav介导的肝基因转移后gaa敲除(gaa-/-)小鼠庞贝病模型中的gaa变体分析
[0259]
我们在aav肝基因转移后的gaa-/-小鼠庞贝病模型中测试了嵌合hd-apob和hd-spadin gaa变体的治疗功效。生成了编码以下每个变体的aav8载体:sp7-apob-δ42-gaaco(hd-apob)和sp7-spadin-δ42-gaaco(hd-spadin)。编码不含异源结构域的gaa变体sp7-δ42-gaaco(hd0)的aav8载体用作阳性对照。aav8载体是由于它们有效地转导小鼠肝细胞而产生的。两月龄gaa-/-小鼠(n=6/组)经静脉内注射编码hd-apob、hd-spadin或hd0的aav8载体作为比较(载体剂量:5
×
10
11
vg/kg)。用pbs处理的同窝gaa-/-小鼠(n=6)用作受影响的对照(ctrl)。同窝gaa / 小鼠(n=5)用作未受影响的对照。研究随访时间为4个月。
[0260]
在治疗后4个月收集和分析血浆样品,以测量循环gaa活性(图3)和蛋白质量(图4)。hd-spadin和hd0之间的循环gaa活性没有显著差异,而hd-apob治疗组的活性显著较低(图3)。在研究结束时(治疗后4个月),通过用抗gaa抗体进行的蛋白质印迹分析,在所有用aav载体治疗的小鼠的血浆中很容易地证实循环中gaa的分泌(图4a)。gaa条带定量(图4b)显示hd-spadin和hd0之间没有显著差异,而hd-apob治疗组中酶量显著较低(图4b),证实了活性数据(图3)。总体而言,这些数据表明嵌合hd-spadin变体在aav肝基因转移后由肝细胞有效产生和分泌,并保留了酶活性。
[0261]
然后,为了评估嵌合gaa变体的治疗功效,我们测量了大脑中的糖原含量(图5)。值得注意的是,在大脑中,与hd-apob和hd0载体相比,用hd-spadin载体处理的gaa-/-小鼠的糖原清除显著改善(图5)。这些结果证实了hd-spadin嵌合多肽在大脑摄取和大脑中gaa活性方面的优越性。
[0262]
还测量了肌肉(心脏、三头肌)和脊髓中的糖原含量(图6)。正如预期的那样,与gaa / 相比,pbs处理的gaa-/-小鼠的所有组织中的糖原含量都增加(图6)。在所有aav治疗组别的肌肉和cns中观察到显著的糖原清除(图6)。然而,aav处理的gaa-/-小鼠的cns中的糖原含量仍高于在gaa / 中测量的糖原含量。值得注意的是,与hd-apob载体相比,用hd-spadin载体处理的gaa-/-小鼠脊髓中的糖原清除显著改善(图6c)。
[0263]
最后,我们通过在载体施用后1个月和4个月测量小鼠血浆中的抗gaa免疫球蛋白g(igg)来评估hd-spadin变体的免疫原性(图7)。与hd0相比,在用hd-spadin变体治疗的小鼠中未观察到显著的抗gaa体液免疫反应(图7)。在1个月时检测到低(《1μg/ml)和零星的抗gaa igg,但在研究结束时它们又回到0(图7),正如之前在用可分泌gaa进行的aav肝基因转移研究中所观察到的那样[puzzo f.等人,sci transl med.2017年11月29日;9(418)]。
[0264]
此外,评估了在培养的庞贝病成纤维细胞中对嵌合gaa变体的摄取。已表明,hd-spadin变体很容易内化并在细胞内成熟(数据未示出)。
[0265]
总之,在小鼠庞贝病模型中不存在免疫反应的情况下,含有spadin异源结构域的嵌合gaa变体(缩写为hd-spadin)导致gaa酶分泌和酶活性得以保留,并改善了对cns中、特别是大脑中糖原病理积累的纠正。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
