一种人原代t细胞体外耗竭模型的构建方法
技术领域
1.本发明涉及生物技术领域,特别是涉及一种人原代t细胞体外耗竭模型的构建方法。
背景技术:
2.car-t细胞治疗是应用于肿瘤治疗领域的一类免疫治疗方案,但car-t细胞在回输到患者体内之前,常常会出现不同程度的t细胞耗竭及功能丧失,严重影响治疗效果。虽然目前已经能够通过cas9基因编辑的方式对car-t细胞的耗竭相关基因进行编辑,然而领域内尚缺乏能够用于检测和评估人来源t细胞耗竭的体外功能模型。因此,该模型的构建为以t细胞为主要治疗方案的car-t细胞治疗提供了重要的体外研究体系,能够有效并准确地检测基因编辑后的car-t细胞耗竭状态,为高效逆转car-t细胞耗竭,恢复car-t细胞肿瘤杀伤功能提供重要的科学支持。
3.car-t疗法——嵌合抗原受体t细胞免疫疗法,英文全称chimeric antigen receptor t-cell immunotherapy。通过基因工程技术,给患者来源的t细胞装上定位导航装置car(肿瘤嵌合抗原受体),t细胞将利用其“定位导航装置”car,专门识别体内肿瘤细胞,并通过免疫作用释放大量的多种效应因子,它们能高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。这是一种靶向治疗肿瘤的新型免疫疗法,近几年通过优化改良后,在临床治疗上取得了良好的效果,是一种非常有前景的,能够精准、快速、高效,且有可能治愈癌症的新型肿瘤免疫治疗方法。
4.然而,由于car-t细胞在体外需要经历长期的培养(一般大于2周)扩增后才能回输到人体内,而进入人体肿瘤后的car-t细胞由于长期反复受到肿瘤抗原的刺激,car-t细胞常常出现功能耗竭的情况,即由于长期暴露于持续性抗原或慢性炎症,疲惫的t细胞逐渐失去效应功能,记忆t细胞特征也开始缺失。这种耗竭可以通过基因编辑技术进行逆转,领域内已有研究人员在小鼠car-t细胞所构建的耗竭模型上研究如何逆转耗竭t细胞,但由于样本难以获得,制备时间较长,且存在无法构建转基因模型等技术瓶颈,尚无高效的用于研究人来源car-t细胞的耗竭模型。因此,我们自主研发并建立了这套体外人来源car-t细胞耗竭模型,将为该领域的研发及应用提供重要的工具。
5.目前,全球范围内报道的主流体外人来源t细胞耗竭模型如下(lynne s.dunsford,et.al.,a human in vitro t cell exhaustion model for assessing immuno-oncology therapies,immuno-oncology,doi:10.1007/978-1-0716-0171-6_6):
6.主要方案及流程:
7.首先将1-3
×
106t细胞重悬到aim-v培养基中(life technologies),添加1
–
5%热激后的血清(sigma),铺到12孔板或24孔板中。用t-activator cd3/cd28(life technologies)刺激细胞。每48小时,对细胞进行计数、洗涤并用一批新鲜的重新刺激。三或四次刺激后,dynabeads被移除,t细胞用于进行细胞毒性分析和耗竭分子检测。
8.上述现有技术主要将人来源的t细胞进行体外反复刺激,刺激物为anti-cd3/cd28磁珠,主要原理是通过反复激活tcr信号和其共刺激信号从而达到诱导t细胞耗竭的目的。存在的不足:
9.1)该方案主要利用t-activator cd3/cd28 dynabeads对人来源t细胞进行刺激,与实际情况中,肿瘤患者体内t细胞因不断受到肿瘤抗原刺激而耗竭的形式存在差异,无法更真实地模拟肿瘤患者的肿瘤微环境中t细胞刺激和耗竭状态。
10.2)由于缺乏抗原特异性刺激,该模型中所生成的耗竭t细胞无法对其特异性肿瘤杀伤活性进行检测,因为无法用于评估t细胞肿瘤特异性杀伤功能是否受到耗竭的影响。
11.目前尚无car-t细胞耗竭模型见报道。
技术实现要素:
12.本发明针对现有技术中存在的上述不足,提供了一种能够在体外基于抗原特异性刺激的原理建立car-t细胞耗竭模型,用于对car-t细胞功能的评估和科学研究。
13.一种人原代t细胞体外耗竭模型的构建方法,包括以下步骤:
14.(1)从健康人外周血中分离获得cd3 t细胞;
15.(2)转染能特异性识别肝癌细胞表面抗原gpc3的car嵌合抗原受体到步骤(1)获得的cd3 t细胞中构建获得gpc3-car-t细胞;
16.(3)将步骤(2)构建获得的gpc3-car-t细胞与表达gpc3的肝癌细胞在体外共培养,获得人原代t细胞体外耗竭模型,
17.其中,gpc3-car-t细胞与肝癌细胞在体外共培养时细胞数量比例为1∶5。
18.步骤(3)中,gpc3-car-t细胞与肝癌细胞在体外共培养3天后收集悬浮的gpc3-car-t细胞,清洗后重新铺到提前包被的肝癌细胞培养皿中,仍然以1∶5的比例继续培养3天,总共反复共同培养操作四次。
19.优选的,步骤(1)中具体步骤为:
20.(1.1)第零天,用抗人cd3抗体和抗人cd28抗体包被细胞培养板;
21.(1.2)第一天,从健康人外周血中分离人外周血单核细胞,再从人外周血单核细胞中分离获得cd3 t细胞,加入到步骤(1.1)中包被好的细胞培养板中进行培养;
22.(1.3)第二天至第三天,向步骤(1.2)培养的cd3 t细胞中加入il-2。
23.更优选的,步骤(1.3)中il-2的使用浓度为500iu/ml培养液。
24.更优选的,步骤(2)中具体步骤为:
25.(2.1)第四天,向步骤(1.3)培养的cd3 t细胞中加入retronectin;
26.(2.2)第五天,使用gpc3-car慢病毒感染步骤(2.1)培养的cd3 t细胞获得表达gpc3-car的gpc-car-t细胞。
27.进一步优选的,步骤(2.1)中retronectin的使用浓度为7μg/ml。
28.优选的,各步骤细胞培养时使用的基础培养基为:每500μl rpmi-1640对应加入500μl x-vivo15培养基、2mm谷氨酰胺、100μl fbs、p/s双抗每种50u/ml。
29.优选的,步骤(3)中肝癌细胞为huh-7肝癌细胞或hepg2肝癌细胞。huh-7肝癌细胞或hepg2肝癌细胞均是gpc3高表达的细胞。但是对于gpc3表达量太高的肝癌细胞,有可能肝癌细胞在较短的时间内就被car-t细胞杀死,从而无法实现体外足够长时间的共同培养,造
成最终构建失败。
30.本发明还提供了所述构建方法构建得到的人原代t细胞体外耗竭模型。
31.本发明人原代t细胞体外耗竭模型的构建方法通过抗原特异性刺激来更加真实地模拟肿瘤患者的肿瘤微环境中t细胞刺激和耗竭状态,成功构建了人原代t细胞体外耗竭模型,并且,该模型中所生成的耗竭t细胞能够对其特异性肿瘤杀伤活性进行检测。将为该领域的研发及应用提供重要的工具。
附图说明
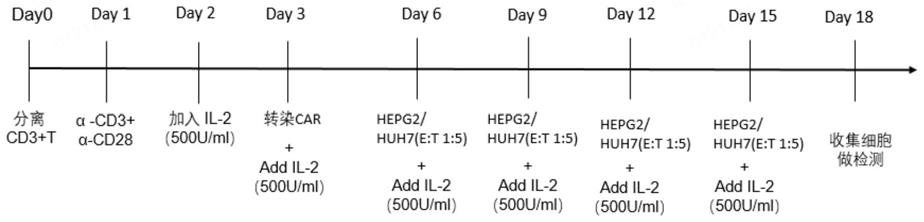
32.图1为体外car-t细胞诱导耗竭的模型构建流程示意图。
33.图2为流式检测gpc3-car的表达情况结果图。
34.图3为采用结晶紫实验对共培养后剩余的肿瘤细胞进行结晶紫染色的检测结果图。
35.图4为体内证明已构建的car-t细胞能够特异性抑制小鼠肝癌生长。
36.图5为流式细胞术检测pd-1在t细胞表面表达水平检测结果图。
具体实施方式
37.科研用血审批:经浙江大学医学院附属第一医院、浙江省血液中心和浙江省卫生健康委员会医政医管与药物政策处审批通过。
38.实施例1
39.本发明体外car-t细胞诱导耗竭的模型总体制备和检测流程见图1,具体的,制备gpc3-car-t细胞步骤如下:
40.一、从健康人外周血中分离cd3 t细胞:
41.第零天(day0,包被抗体):
42.1、将1μg/ml anti-human cd3(tonbo,#40-0038)和1μg/ml anti-human cd28(tonbo,#40-0289)加入1
×
pbs中混匀,按500μl/孔加到24孔板中,4℃静置过夜。
43.第一天(day1,分离cd3 t细胞):
44.1、使用ficoll-paque plus密度梯度分离液(cytiva,17144002)从健康人外周血中分离pbmc人外周血单核细胞(peripheral blood mononuclear cells,pbmc)。
45.2、弃掉步骤1中包被的24孔板中的pbs,每孔中加入1ml培养基(培养基配方如下:每500μl rpmi-1640对应加入500μl x-vivo15培养基 glutamine(2mm谷氨酰胺,gibico:35050061) 100μl fbs p/s双抗(青霉素加链霉素,每种50u/ml)),放入37度预热。
46.3、使用human cd3 t细胞分离试剂盒(biolegend,480131)从pbmc中分离cd3 t细胞,取少许细胞与台盼蓝混匀后计数。
47.4、按细胞每孔(1-5)
×
106细胞铺入24孔板。
48.第二天(day2,培养cd3 t细胞):
49.1、向每孔细胞中加入il-2(500iu/ml)后用移液器轻柔的吹匀细胞。
50.第三天(day3,培养cd3 t细胞):
51.1、观察细胞,早晚各轻柔的吹匀细胞一次,若孔中的培养基变黄,则将孔中的细胞平均的挪到24孔板其他未包被的孔中。按需加入含500iu/ml il-2的培养基(培养基主体成
分与第一天步骤2中相同)。
52.二、转染能特异性识别肝癌细胞表面抗原gpc3的car嵌合抗原受体到增殖的cd3 t细胞中构建car-t细胞:
53.第四天(day4,培养cd3 t细胞及包被retronectin):
54.1、步骤同day3。
55.2、将终浓度7μg/ml retronectin(重组人成纤维连接蛋白片段(human fibronectin fragment),购自takara,货号t100a)加入1
×
pbs中混匀,按250μl/孔加到未处理过的(non-treated)48孔板(thermo,150787)中,4℃静置过夜。
56.第五天(day5,感染gpc3-car):
57.1、回收retronectin,冻于-20℃,向孔中加入1ml 2%bsa的1
×
pbs后于室温封闭30min。
58.2、弃掉封闭液,pbs洗涤2次后向孔中加入125μl浓缩100倍的gpc3-car慢病毒溶液(使用慢病毒作为介质来向cd3 t细胞中导入gpc3-car序列)和225μl培养基(培养基主体成分与第一天步骤2中相同),常温2000g离心1.5h。
59.gpc3高度表达于胎儿肝脏,而不表达于正常成年人的肝组织,但在肝细胞肝癌中恢复表达,与肝癌的发生发展有十分密切的关系,不仅在肝癌发生的早期检出率较高,而且随着肝癌的发展,其检出率也随之增高。而gpc3的表达在肝腺癌,胆管细胞癌,肝转移癌和12种常见实体瘤和21种非肝癌细胞系中均未检测出。考虑到gpc3在肝细胞肝癌,黑色素瘤等肿瘤中特异性的高表达,其被认为是肿瘤免疫治疗的一个候选靶标。当t淋巴细胞特异性表达gpc3嵌合抗原受体蛋白的核酸,其表达的嵌合抗原受体蛋白使得表达该受体的t淋巴细胞针对高表达gpc3的肿瘤细胞具有高度特异性的细胞毒性作用,因此被称为gpc3-car-t细胞。该gpc3嵌合抗原受体蛋白包含顺序连接的胞外结合区,跨膜区和胞内信号区,其中所述胞外结合区包含特异性识别gpc3的c末端表位的单链抗体scfv(gpc3)。上述嵌合抗原受体蛋白的胞外结合区通过cd8铰链区与cd8或者cd28的跨膜区相连接,跨膜区后紧接胞内信号区。本项目中使用的car序列来自文献(wu x,luo h,shi b,di s,sun r,su j,liu y,li h,jiang h,li z:combined antitumor effects of sorafenib and gpc3-car-t cells in mouse models of hepatocellular carcinoma.mol ther 2019,27(8):1483-1494.),dna序列如seq id no.1所示。
60.3、步骤2离心过程中,将所有孔中的细胞全部收集到15ml离心管中,1200rpm
×
3min。
61.4、取适量培养基重悬细胞后,取少许细胞与台盼蓝混匀后计数。
62.5、离心完后弃掉病毒液,按1
×
106细胞/250μl/孔铺到板中,加入il-2(500iu/ml)常温1000g离心10min。37℃培养5h后,向感染孔中加入含500iu/ml il-2的500μl培养基(250ml rpmi-1640 250ml x-vivo15培养基 5ml glutamine(谷氨酰胺,35050061) 100μl fbs 5ml p/s双抗(青霉素加链霉素))。
63.第六天(day6):
64.1、观察细胞,早晚各轻柔的吹匀细胞一次,若孔中的培养基变黄,则将孔中的细胞平均地挪到24孔板其他未包被的孔中。
65.第七天(day7):
66.1、流式检测gpc3-car的表达情况如图2。采用流式细胞分析计数对感染后的car-t细胞进行体外染色,抗体孵育浓度为每106个细胞/5μl抗体,在4℃孵育30分钟(抗体货号acro gpc3-hf2h1),pbs洗两次后流式分析仪器上面可检测,结果如图2,当我们用gpc3荧光蛋白去检测car的表达量后发现,cd19-car作为阴性对照的确没有gpc-car的表达,而当gpc3-car的样本染色后,我们发现的确有20%~35%的t细胞表达了gpc3-car,这一结果证明,我们成功构建了gpc-car-t细胞。
67.其中,cd19是b淋巴细胞瘤患者淋巴细胞表面高表达的肿瘤抗原,cd19-car是针对该抗原所设计的特异抗体序列,相对应的序列来自addgene网站上的cd19-car载体序列pslcar-cd19-cd3z(plasmid#135993),该质粒因缺乏对gpc3的特异性识别功能在我们的系统中主要用来作为对照。
68.三、体外证明e∶t比例1∶5是诱导gpc3-car-t细胞耗竭的最佳条件
69.将已构建好的gpc3-car-t细胞与高表达gpc3的huh-7肝癌细胞在体外以不同效靶比(e∶t表示效应细胞∶肿瘤细胞)共同培养3天后(因每个三天需要更换新的肿瘤细胞,防治肿瘤细胞被全部杀死后无法持续诱导car-t细胞耗竭)。对肿瘤细胞存活比例进行结晶紫染色,目的主要为:1.确定在体外诱导car-t细胞耗竭过程中的最佳e∶t比;2.证明已构建的car-t细胞能够特异性杀伤gpc3高表达的靶细胞。图3为采用结晶紫实验对共培养后剩余的肿瘤细胞进行结晶紫染色的检测结果图,染色的强度代表细胞的浓度。该结果显示,e∶t比为1∶5时,肿瘤细胞在第三天还有>50%细胞剩余,因此为最适的耗竭模型共培养e∶t比例,而其他e∶t比例培养后,肿瘤细胞全部被杀伤,无法持续诱导car-t细胞耗竭。同时,当使用cd19 car-t(过表达只能特异性识别cd19阳性的靶细胞)细胞与huh7细胞(不表达cd19)进行共培养的时候,可以非常明显地看到,培养三天后,cd19 car-t在e∶t比例为1∶1,5∶1,10∶1时都无法有效杀伤靶细胞,而同样条件下,gpc3-car-t能够完全杀伤靶细胞,这也再次证明了我们构建的gpc3-car-t细胞的确具有特异性识别和杀伤靶细胞的功能。因此,我们选择e∶t比例1∶5进行体外car-t细胞耗竭模型的构建。
70.四、体内证明已构建的car-t细胞能够特异性抑制小鼠肝癌生长。
71.为了证明已构建的gpc3-car-t细胞能够在体内特异性抑制小鼠肝肿瘤的发生发展,我们首先对小鼠进行皮下成瘤实验,皮下注射1
×
106个huh7细胞/小鼠,待肿瘤长到400mm3大小时,尾静脉注射gpc3-car-t细胞和cd19-car t细胞(1
×
107细胞/小鼠),注射后每隔两到三天测量小鼠肿瘤大小。结果发现,肿瘤在cd19-car t治疗组继续发展,而在gpc3-car-t治疗组明显受到抑制(图4)。以上实验证明,我们构建的gpc3-car-t细胞确实是具有体内抑制肝癌发展的功能细胞。
72.五、检测car-t细胞耗竭模型是否成功构建的重要指标
73.将上述第七天构建成功的gpc3-car-t细胞与以上huh7肝癌细胞以1∶5(数量比)比例共同培养3天后收集悬浮的car-t细胞(即gpc3-car-t细胞),清洗后重新铺到提前包被的肝癌细胞培养皿中,仍然以1∶5的比例继续培养3天,总共反复共同培养操作(与huh7肝癌细胞共同培养)四次后,收集已诱导耗竭的悬浮car-t细胞,即得构建完成的car-t细胞耗竭模型。
74.由于耗竭的t细胞会逐渐上调细胞表面pd-1分子的表达,pd-1分子被公认为代表t细胞耗竭的金标准。因此我们采用流式检测方法测试car-t细胞表面重要耗竭分子pd-1的
表达情况,结果发现,随着体外多次肿瘤抗原的刺激,代表耗竭状态的t细胞表面分子pd-1的水平逐渐增加,结果如图5所示,刚分离的 t细胞表面耗竭分子pd-1的表达水平较低(d0,<10%,当car-t细胞在体外收到来自肿瘤细胞的反复刺激后,pd-1分子表达水平逐渐升高,到第十天,pd-1分子水平表达~45%到第十八天,pd-1分子水平表达~70%。这一结果证明我们的体外模型成功诱导并构建了car-t细胞耗竭模型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。