用于治疗claudin相关疾病的抗体和方法
发明领域
1.本发明涉及用于预防、治疗和/或诊断cldn-18相关疾病的抗体、药物组合物和方法。
背景技术:
2.claudin(cldn)是一个整合膜蛋白家族,其包含上皮或内皮细胞片等极化细胞类型中紧密连接的主要结构蛋白,并被发现是各种肿瘤的生物标志物。
3.cldn会经历内吞作用,相对于其他膜蛋白,一些cldn的周转时间很短(van raffle等人,2004,pmid:15366421)。癌细胞中cldn的表达失调,肿瘤细胞间的紧密连接结构在癌细胞中被破坏。这些特性使抗体能够选择性地结合肿瘤组织而非正常组织中的claudin蛋白。虽然特异性针对个别claudin的抗体是有用的,但多反应性claudin抗体或抗泛claudin抗体也有可能更有利于向更广泛的患者群体递送有效载荷,因为更高的聚合抗原密度降低了任何个别claudin的抗原表达水平低的肿瘤细胞逃逸的可能性。
4.cldn18.1是cldn18的同工型1,具有肺部特异性,在肺腺癌中明显减少。cldn18.2是cldn18的同工型2,在生理上局限于胃粘膜紧密连接处,其表位在恶性转化时将暴露在癌细胞表面,并在相当一部分胃腺癌和胰腺癌中高度表达,这使其成为治疗胃腺癌和胰腺癌的潜在药物目标。已研究开发靶向cldn18.2的单抗、双特异性抗体和抗体药物缀合物等(zhu等人,targeting cldn18.2 by cd3 bispecific and adc modalitiesfor the treatments of gastric and pancreatic cancer;tureci等人,characterizatio of zolbetuximab in pancreatic cancer models,oncoimmunology 2019,第8卷,第1期,e1523096))。特别是针对cldn18.2产生的单克隆抗体zolbetuximab(原名imab362)在2016年6月获得了ii期
‘
fast’试验的初步结果,这表明它对晚期胃癌有帮助。
5.然而,抗体依赖性细胞毒性(adcc)和补体依赖性细胞毒性(cdc)的幅度与细胞表面cldn18.2水平直接相关(tureci等人,characterizatio of zolbetuximab in pancreatic cancer models,oncoimmunology 2019,第8卷,第1期,e1523096)。因此,对于cldn18.2低表达的癌细胞,如乳腺癌,抗cldn18.2抗体的治疗效果不佳。
6.因此,需要一种对癌细胞,可选的cldn18.2表面低表达的癌细胞具有增强的adcc和/或cdc的抗cldn18.2抗体。
技术实现要素:
7.本文提供了抗体和抗原结合片段及其修饰,以及用于治疗/预防/诊断与cldn18相关的病况,特别是与cldn18.2相关的病况的药物组合物和使用方法。
8.在一个方面,本公开提供了一种与claudin-18(cldn 18)特异性结合的抗体或抗原结合片段,其中所述抗体或抗原结合片段包含至少一个重链或轻链互补决定区(cdr),其氨基酸序列选自由以下组成的组:gdy、seq id no:18、20、22、27、29、31、36、38、40、45、47、49、54、56、58、63、65、67、72、74、81、83、85、90、92、94、99、101、103、108、110、112、117、119、
121、126、128、130、135、137、139、144、146、148、153、155、157、163、165、167、172、174、176、181、183、185、190、192、194、198、200、202、207、209、211、216、218、220、225、227、229、234、236、238、243、245、247、252、254、256、261、263、265、270、272、274、279、281、283、288、290、292、297、299、301、306、308、310、315、317、319、324、326、328、333、335、337、342、344、346、351、353、355、360、362、364、369、371、373、378、380、382、387、389、391、396、398、400、405、407、409、414、416、418、423、425、427、432、434、436、441、443、445、450、452、454、459、461、463、468、470、472、477、479、481、486、488、490、495、497、499、504、506、508、513、515、517、522、524、526、531、533、535、540、542、544、549、551、553、558、560、562、567、569、571、576、578、580、585、587、589、594、596、598、603、605、607、612、614、616、621、623、625、630、632、634、639、641、643、648、650、652、657、659、661、666、668、670、675、677、679、684、686、688、693、695、726、727、728和697。
9.在一些实施方式中,本文提供的抗体或抗原结合片段包含:重链可变(vh)区,所述vh区包含1、2或3个vh-cdr,其氨基酸序列选自由以下组成的组:gdy、seq id no:18、20、22、36、38、40、54、56、58、72、74、90、92、94、108、110、112、126、128、130、144、146、148、163、165、167、181、183、185、198、200、202、216、218、220、234、236、238、252、254、256、270、272、274、288、290、292、206、308、310、324、326、328、342、344、346、360、362、364、378、380、382、396、398、400、414、416、418、432、434、436、450、452、454、468、470、472、486、488、490、504、506、508、522、524、526、540、542、544、558、560、562、576、578、580、594、596、598、612、614、616、630、632、634、648、650、652、666、668、670、684、686、726、727和688。
10.在一些实施方式中,本文提供的抗体或抗原结合片段进一步包含轻链可变(vl)区,所述vl区包含1、2或3个vl-cdr,其氨基酸序列选自由以下组成的组:seq id no:27、29、31、45、47、49、63、65、67、81、83、85、99、101、103、117、119、121、135、137、139、153、155、157、172、174、176、190、192、194、207、209、211、225、227、229、243、245、247、261、263、265、279、281、283、297、299、301、315、317、319、333、335、337、351、353、355、369、371、373、387、389、391、405、407、409、423、425、427、441、443、445、459、461、463、477、479、481、495、497、499、513、515、517、531、533、535、549、551、553、567、569、571、585、587、589、603、605、607、621、623、625、639、641、643、657、659、661、675、677、679、693、695、728和697。
11.在一些实施方式中,本文提供的抗体或抗原结合片段包含:
12.i.vh-cdr 1,其氨基酸序列选自由以下组成的组:gdy、seq id no:18、36、54、72、90、108、126、144、163、181、198、216、234、252、270、288、206、324、342、360、378、396、414、432、450、468、486、504、522、540、558、576、594、612、630、648、666和684;
13.ii.vh-cdr2,其氨基酸序列选自由以下组成的组:seq id no:20、38、56、74、92、110、128、146、165、183、200、218、236、254、272、290、308、326、344、362、380、398、416、434、452、470、488、506、524、542、560、578、596、614、632、650、668、726、727和686;和
14.iii.vh-cdr3,其氨基酸序列选自由以下组成的组:gdy和seq id no:22、40、58、94、112、130、148、167、185、202、220、238、256、274、292、310、328、346、364、382、400、418、436、454、472、490、508、526、544、562、580、598、616、634、652、670和688。
15.在一些实施方式中,本文提供的抗体或抗原结合片段包含:
16.i.vl-cdr 1,其氨基酸序列选自由以下组成的组:seq id no:27、45、63、81、99、
117、135、153、172、190、207、225、243、261、279、297、315、333、351、369、387、405、423、441、459、477、495、513、531、549、567、585、603、621、639、657、675、728和693;
17.ii.vl-cdr2,其氨基酸序列选自由以下组成的组:seq id no:29、47、65、83、101、119、137、155、174、192、209、227、245、263、281、299、317、335、353、371、389、407、425、443、461、479、497、515、533、551、569、587、605、623、641、659、677和695;和
18.iii.vl-cdr3,其氨基酸序列选自由以下组成的组:seq id no:31、49、67、85、103、121、139、157、176、194、211、229、247、265、283、301、319、337、355、373、391、409、427、445、463、481、499、517、535、553、571、589、607、625、643、661、679和697。
19.在一些实施方式中,本文提供的抗体或抗原结合片段包含:
20.i.具有seq id no:18的氨基酸序列的vh-cdr 1,具有seq id no:20的氨基酸序列的vh-cdr 2,以及具有seq id no:22的氨基酸序列的vh-cdr 3;
21.ii.具有seq id no:36的氨基酸序列的vh-cdr 1,具有seq id no:38的氨基酸序列的vh-cdr 2,以及具有seq id no:40的氨基酸序列的vh-cdr 3;
22.iii.具有seq id no:54的氨基酸序列的vh-cdr 1,具有seq id no:56的氨基酸序列的vh-cdr 2,以及具有seq id no:58的氨基酸序列的vh-cdr 3;
23.iv.具有seq id no:72的氨基酸序列的vh-cdr 1,具有seq id no:74的氨基酸序列的vh-cdr 2,以及具有gdy的氨基酸序列的vh-cdr 3;
24.v.具有seq id no:90的氨基酸序列的vh-cdr 1,具有seq id no:92的氨基酸序列的vh-cdr 2,以及具有seq id no:94的氨基酸序列的vh-cdr 3;
25.vi.具有seq id no:108的氨基酸序列的vh-cdr 1,具有seq id no:110的氨基酸序列的vh-cdr 2,以及具有seq id no:112的氨基酸序列的vh-cdr 3;
26.vii.具有seq id no:126的氨基酸序列的vh-cdr 1,具有seq id no:128的氨基酸序列的vh-cdr 2,以及具有seq id no:130的氨基酸序列的vh-cdr 3;
27.viii.具有seq id no:144的氨基酸序列的vh-cdr 1,具有seq id no:146的氨基酸序列的vh-cdr 2,以及具有seq id no:148的氨基酸序列的vh-cdr 3;
28.ix.具有seq id no:163的氨基酸序列的vh-cdr 1,具有seq id no:165的氨基酸序列的vh-cdr 2,以及具有seq id no:167的氨基酸序列的vh-cdr 3;
29.x.具有seq id no:181的氨基酸序列的vh-cdr 1,具有seq id no:183的氨基酸序列的vh-cdr 2,以及具有seq id no:185的氨基酸序列的vh-cdr 3;
30.xi.具有seq id no:198的氨基酸序列的vh-cdr 1,具有seq id no:200的氨基酸序列的vh-cdr 2,以及具有seq id no:202的氨基酸序列的vh-cdr 3;
31.xii.具有seq id no:216的氨基酸序列的vh-cdr 1,具有seq id no:218的氨基酸序列的vh-cdr 2,以及具有seq id no:220的氨基酸序列的vh-cdr 3;
32.xiii.具有seq id no:234的氨基酸序列的vh-cdr 1,具有seq id no:236的氨基酸序列的vh-cdr 2,以及具有seq id no:238的氨基酸序列的vh-cdr 3;
33.xiv.具有seq id no:252的氨基酸序列的vh-cdr 1,具有seq id no:254的氨基酸序列的vh-cdr 2,以及具有seq id no:256的氨基酸序列的vh-cdr 3;
34.xv.具有seq id no:270的氨基酸序列的vh-cdr 1,具有seq id no:272的氨基酸序列的vh-cdr 2,以及具有seq id no:274的氨基酸序列的vh-cdr 3;
35.xvi.具有seq id no:288的氨基酸序列的vh-cdr 1,具有seq id no:290的氨基酸序列的vh-cdr 2,以及具有seq id no:292的氨基酸序列的vh-cdr 3;
36.xvii.具有seq id no:306的氨基酸序列的vh-cdr 1,具有seq id no:308的氨基酸序列的vh-cdr 2,以及具有seq id no:310的氨基酸序列的vh-cdr 3;
37.xviii.具有seq id no:324的氨基酸序列的vh-cdr 1,具有seq id no:326的氨基酸序列的vh-cdr 2,以及具有seq id no:328的氨基酸序列的vh-cdr 3;
38.xix.具有seq id no:342的氨基酸序列的vh-cdr 1,具有选自由seq id no:344、726和727组成的组的氨基酸序列的vh-cdr 2,以及具有seq id no:346的氨基酸序列的vh-cdr 3;
39.xx.具有seq id no:360的氨基酸序列的vh-cdr 1,具有seq id no:362的氨基酸序列的vh-cdr 2,以及具有seq id no:364的氨基酸序列的vh-cdr 3;
40.xxi.具有seq id no:378的氨基酸序列的vh-cdr 1,具有seq id no:380的氨基酸序列的vh-cdr 2,以及具有seq id no:382的氨基酸序列的vh-cdr 3;
41.xxii.具有seq id no:396的氨基酸序列的vh-cdr 1,具有seq id no:398的氨基酸序列的vh-cdr 2,以及具有seq id no:400的氨基酸序列的vh-cdr 3;
42.xxiii.具有seq id no:414的氨基酸序列的vh-cdr 1,具有seq id no:416的氨基酸序列的vh-cdr 2,以及具有seq id no:418的氨基酸序列的vh-cdr 3;
43.xxiv.具有seq id no:432的氨基酸序列的vh-cdr 1,具有seq id no:434的氨基酸序列的vh-cdr 2,以及具有seq id no:436的氨基酸序列的vh-cdr 3;
44.xxv.具有seq id no:450的氨基酸序列的vh-cdr 1,具有seq id no:452的氨基酸序列的vh-cdr 2,以及具有seq id no:454的氨基酸序列的vh-cdr 3;
45.xxvi.具有seq id no:468的氨基酸序列的vh-cdr 1,具有seq id no:470的氨基酸序列的vh-cdr 2,以及具有seq id no:472的氨基酸序列的vh-cdr 3;
46.xxvii.具有seq id no:486的氨基酸序列的vh-cdr 1,具有seq id no:488的氨基酸序列的vh-cdr 2,以及具有seq id no:490的氨基酸序列的vh-cdr 3;
47.xxviii.具有seq id no:504的氨基酸序列的vh-cdr 1,具有seq id no:506的氨基酸序列的vh-cdr 2,以及具有seq id no:508的氨基酸序列的vh-cdr 3;
48.xxix.具有seq id no:522的氨基酸序列的vh-cdr 1,具有seq id no:524的氨基酸序列的vh-cdr 2,以及具有seq id no:526的氨基酸序列的vh-cdr 3;
49.xxx.具有seq id no:540的氨基酸序列的vh-cdr 1,具有seq id no:542的氨基酸序列的vh-cdr 2,以及具有seq id no:544的氨基酸序列的vh-cdr 3;
50.xxxi.具有seq id no:558的氨基酸序列的vh-cdr 1,具有seq id no:560的氨基酸序列的vh-cdr 2,以及具有seq id no:562的氨基酸序列的vh-cdr 3;
51.xxxii.具有seq id no:576的氨基酸序列的vh-cdr 1,具有seq id no:578的氨基酸序列的vh-cdr 2,以及具有seq id no:580的氨基酸序列的vh-cdr 3;
52.xxxiii.具有seq id no:594的氨基酸序列的vh-cdr 1,具有seq id no:596的氨基酸序列的vh-cdr 2,以及具有seq id no:598的氨基酸序列的vh-cdr 3;
53.xxxiv.具有seq id no:612的氨基酸序列的vh-cdr 1,具有seq id no:614的氨基酸序列的vh-cdr 2,以及具有seq id no:616的氨基酸序列的vh-cdr 3;
54.xxxv.具有seq id no:630的氨基酸序列的vh-cdr 1,具有seq id no:632的氨基酸序列的vh-cdr 2,以及具有seq id no:634的氨基酸序列的vh-cdr 3;
55.xxxvi.具有seq id no:648的氨基酸序列的vh-cdr 1,具有seq id no:650的氨基酸序列的vh-cdr 2,以及具有seq id no:652的氨基酸序列的vh-cdr 3;
56.xxxvii.具有seq id no:666的氨基酸序列的vh-cdr 1,具有seq id no:668的氨基酸序列的vh-cdr 2,以及具有seq id no:670的氨基酸序列的vh-cdr 3;或
57.xxxviii.具有seq id no:684的氨基酸序列的vh-cdr 1,具有seq id no:686的氨基酸序列的vh-cdr 2,以及具有seq id no:688的氨基酸序列的vh-cdr 3。
58.在一些实施方式中,本文提供的抗体或抗原结合片段进一步包含:
59.i.具有seq id no:27的氨基酸序列的vl-cdr 1,具有seq id no:29的氨基酸序列的vl-cdr 2,以及具有seq id no:31的氨基酸序列的vl-cdr 3;
60.ii.具有seq id no:45的氨基酸序列的vl-cdr 1,具有seq id no:47的氨基酸序列的vl-cdr 2,以及具有seq id no:49的氨基酸序列的vl-cdr 3;
61.iii.具有seq id no:63的氨基酸序列的vl-cdr 1,具有seq id no:65的氨基酸序列的vl-cdr 2,以及具有seq id no:67的氨基酸序列的vl-cdr 3;
62.iv.具有seq id no:81的氨基酸序列的vl-cdr 1,具有seq id no:83的氨基酸序列的vl-cdr 2,以及具有seq id no:85的氨基酸序列的vl-cdr 3;或
63.v.具有seq id no:99的氨基酸序列的vl-cdr 1,具有seq id no:101的氨基酸序列的vl-cdr 2,以及具有seq id no:103的氨基酸序列的vl-cdr 3;
64.vi.具有seq id no:117的氨基酸序列的vl-cdr 1,具有seq id no:119的氨基酸序列的vl-cdr 2,以及具有seq id no:121的氨基酸序列的vl-cdr 3;
65.vii.具有seq id no:135的氨基酸序列的vl-cdr 1,具有seq id no:137的氨基酸序列的vl-cdr 2,以及具有seq id no:139的氨基酸序列的vl-cdr 3;
66.viii.具有seq id no:153的氨基酸序列的vl-cdr 1,具有seq id no:155的氨基酸序列的vl-cdr 2,以及具有seq id no:157的氨基酸序列的vl-cdr 3;
67.ix.具有seq id no:172的氨基酸序列的vl-cdr 1,具有seq id no:174的氨基酸序列的vl-cdr 2,以及具有seq id no:176的氨基酸序列的vl-cdr 3;
68.x.具有seq id no:190的氨基酸序列的vl-cdr 1,具有seq id no:192的氨基酸序列的vl-cdr 2,以及具有seq id no:194的氨基酸序列的vl-cdr 3;
69.xi.具有seq id no:207的氨基酸序列的vl-cdr 1,具有seq id no:209的氨基酸序列的vl-cdr 2,以及具有seq id no:211的氨基酸序列的vl-cdr 3;
70.xii.具有seq id no:225的氨基酸序列的vl-cdr 1,具有seq id no:227的氨基酸序列的vl-cdr 2,以及具有seq id no:229的氨基酸序列的vl-cdr 3;
71.xiii.具有seq id no:243的氨基酸序列的vl-cdr 1,具有seq id no:245的氨基酸序列的vl-cdr 2,以及具有seq id no:247的氨基酸序列的vl-cdr 3;
72.xiv.具有seq id no:261的氨基酸序列的vl-cdr 1,具有seq id no:263的氨基酸序列的vl-cdr 2,以及具有seq id no:265的氨基酸序列的vl-cdr 3;
73.xv.具有seq id no:279的氨基酸序列的vl-cdr 1,具有seq id no:281的氨基酸序列的vl-cdr 2,以及具有seq id no:283的氨基酸序列的vl-cdr 3;
74.xvi.具有seq id no:297的氨基酸序列的vl-cdr 1,具有seq id no:299的氨基酸序列的vl-cdr 2,以及具有seq id no:301的氨基酸序列的vl-cdr 3;
75.xvii.具有seq id no:315的氨基酸序列的vl-cdr 1,具有seq id no:317的氨基酸序列的vl-cdr 2,以及具有seq id no:319的氨基酸序列的vl-cdr 3;
76.xviii.具有seq id no:333的氨基酸序列的vl-cdr 1,具有seq id no:335的氨基酸序列的vl-cdr 2,以及具有seq id no:337的氨基酸序列的vl-cdr 3;
77.xix.具有seq id no:351或seq id no:728的氨基酸序列的vl-cdr 1,具有seq id no:353的氨基酸序列的vl-cdr 2,以及具有seq id no:355的氨基酸序列的vl-cdr 3;
78.xx.具有seq id no:369的氨基酸序列的vl-cdr 1,具有seq id no:371的氨基酸序列的vl-cdr 2,以及具有seq id no:373的氨基酸序列的vl-cdr 3;
79.xxi.具有seq id no:387的氨基酸序列的vl-cdr 1,具有seq id no:389的氨基酸序列的vl-cdr 2,以及具有seq id no:391的氨基酸序列的vl-cdr 3;
80.xxii.具有seq id no:405的氨基酸序列的vl-cdr 1,具有seq id no:407的氨基酸序列的vl-cdr 2,以及具有seq id no:409的氨基酸序列的vl-cdr 3;或
81.xxiii.具有seq id no:423的氨基酸序列的vl-cdr 1,具有seq id no:425的氨基酸序列的vl-cdr 2,以及具有seq id no:427的氨基酸序列的vl-cdr 3;
82.xxiv.具有seq id no:441的氨基酸序列的vl-cdr 1,具有seq id no:443的氨基酸序列的vl-cdr 2,以及具有seq id no:445的氨基酸序列的vl-cdr 3;
83.xxv.具有seq id no:459的氨基酸序列的vl-cdr 1,具有seq id no:461的氨基酸序列的vl-cdr 2,以及具有seq id no:463的氨基酸序列的vl-cdr 3;
84.xxvi.具有seq id no:477的氨基酸序列的vl-cdr 1,具有seq id no:479的氨基酸序列的vl-cdr 2,以及具有seq id no:481的氨基酸序列的vl-cdr 3;
85.xxvii.具有seq id no:495的氨基酸序列的vl-cdr 1,具有seq id no:497的氨基酸序列的vl-cdr 2,以及具有seq id no:499的氨基酸序列的vl-cdr 3;
86.xxviii.具有seq id no:513的氨基酸序列的vl-cdr 1,具有seq id no:515的氨基酸序列的vl-cdr 2,以及具有seq id no:517的氨基酸序列的vl-cdr 3;
87.xxix.具有seq id no:531的氨基酸序列的vl-cdr 1,具有seq id no:533的氨基酸序列的vl-cdr 2,以及具有seq id no:535的氨基酸序列的vl-cdr 3;
88.xxx.具有seq id no:549的氨基酸序列的vl-cdr 1,具有seq id no:551的氨基酸序列的vl-cdr 2,以及具有seq id no:553的氨基酸序列的vl-cdr 3;
89.xxxi.具有seq id no:567的氨基酸序列的vl-cdr 1,具有seq id no:569的氨基酸序列的vl-cdr 2,以及具有seq id no:571的氨基酸序列的vl-cdr 3;
90.xxxii.具有seq id no:585的氨基酸序列的vl-cdr 1,具有seq id no:587的氨基酸序列的vl-cdr 2,以及具有seq id no:589的氨基酸序列的vl-cdr 3;
91.xxxiii.具有seq id no:603的氨基酸序列的vl-cdr 1,具有seq id no:605的氨基酸序列的vl-cdr 2,以及具有seq id no:607的氨基酸序列的vl-cdr 3;
92.xxxiv.具有seq id no:621的氨基酸序列的vl-cdr 1,具有seq id no:623的氨基酸序列的vl-cdr 2,以及具有seq id no:625的氨基酸序列的vl-cdr 3;
93.xxxv.具有seq id no:639的氨基酸序列的vl-cdr 1,具有seq id no:641的氨基
id no:157的氨基酸序列的vl-cdr 3;
106.ix.具有seq id no:163的氨基酸序列的vh-cdr 1,具有seq id no:165的氨基酸序列的vh-cdr 2,以及具有seq id no:167的氨基酸序列的vh-cdr 3,具有seq id no:172的氨基酸序列的vl-cdr 1,具有seq id no:174的氨基酸序列的vl-cdr 2,以及具有seq id no:176的氨基酸序列的vl-cdr 3;
107.x.具有seq id no:181的氨基酸序列的vh-cdr 1,具有seq id no:183的氨基酸序列的vh-cdr 2,以及具有seq id no:185的氨基酸序列的vh-cdr 3,具有seq id no:190的氨基酸序列的vl-cdr 1,具有seq id no:192的氨基酸序列的vl-cdr 2,以及具有seq id no:194的氨基酸序列的vl-cdr 3;
108.xi.具有seq id no:198的氨基酸序列的vh-cdr 1,具有seq id no:200的氨基酸序列的vh-cdr 2,以及具有seq id no:202的氨基酸序列的vh-cdr 3,具有seq id no:207的氨基酸序列的vl-cdr 1,具有seq id no:209的氨基酸序列的vl-cdr 2,以及具有seq id no:211的氨基酸序列的vl-cdr 3;
109.xii.具有seq id no:216的氨基酸序列的vh-cdr 1,具有seq id no:218的氨基酸序列的vh-cdr 2,以及具有seq id no:220的氨基酸序列的vh-cdr 3,具有seq id no:225的氨基酸序列的vl-cdr 1,具有seq id no:227的氨基酸序列的vl-cdr 2,以及具有seq id no:229的氨基酸序列的vl-cdr 3;
110.xiii.具有seq id no:234的氨基酸序列的vh-cdr 1,具有seq id no:236的氨基酸序列的vh-cdr 2,以及具有seq id no:238的氨基酸序列的vh-cdr 3,具有seq id no:243的氨基酸序列的vl-cdr 1,具有seq id no:245的氨基酸序列的vl-cdr 2,以及具有seq id no:247的氨基酸序列的vl-cdr 3;
111.xiv.具有seq id no:252的氨基酸序列的vh-cdr 1,具有seq id no:254的氨基酸序列的vh-cdr 2,以及具有seq id no:256的氨基酸序列的vh-cdr 3,具有seq id no:261的氨基酸序列的vl-cdr 1,具有seq id no:263的氨基酸序列的vl-cdr 2,以及具有seq id no:265的氨基酸序列的vl-cdr 3;
112.xv.具有seq id no:270的氨基酸序列的vh-cdr 1,具有seq id no:272的氨基酸序列的vh-cdr 2,以及具有seq id no:274的氨基酸序列的vh-cdr 3,具有seq id no:279的氨基酸序列的vl-cdr 1,具有seq id no:281的氨基酸序列的vl-cdr 2,以及具有seq id no:283的氨基酸序列的vl-cdr 3;
113.xvi.具有seq id no:288的氨基酸序列的vh-cdr 1,具有seq id no:290的氨基酸序列的vh-cdr 2,以及具有seq id no:292的氨基酸序列的vh-cdr 3,具有seq id no:297的氨基酸序列的vl-cdr 1,具有seq id no:299的氨基酸序列的vl-cdr 2,以及具有seq id no:301的氨基酸序列的vl-cdr 3;
114.xvii.具有seq id no:306的氨基酸序列的vh-cdr 1,具有seq id no:308的氨基酸序列的vh-cdr 2,以及具有seq id no:310的氨基酸序列的vh-cdr 3,具有seq id no:315的氨基酸序列的vl-cdr 1,具有seq id no:317的氨基酸序列的vl-cdr 2,以及具有seq id no:319的氨基酸序列的vl-cdr 3;
115.xviii.具有seq id no:324的氨基酸序列的vh-cdr 1,具有选自由seq id no:326、726和727组成的组的氨基酸序列的vh-cdr 2,以及具有seq id no:328的氨基酸序列
的vh-cdr 3,具有seq id no:333或728的氨基酸序列的vl-cdr 1,具有seq id no:335的氨基酸序列的vl-cdr 2,以及具有seq id no:337的氨基酸序列的vl-cdr 3;
116.xix.具有seq id no:342的氨基酸序列的vh-cdr 1,具有seq id no:344的氨基酸序列的vh-cdr 2,以及具有seq id no:346的氨基酸序列的vh-cdr 3,具有seq id no:351的氨基酸序列的vl-cdr 1,具有seq id no:353的氨基酸序列的vl-cdr 2,以及具有seq id no:355的氨基酸序列的vl-cdr 3;
117.xx.具有seq id no:360的氨基酸序列的vh-cdr 1,具有seq id no:362的氨基酸序列的vh-cdr 2,以及具有seq id no:364的氨基酸序列的vh-cdr 3,具有seq id no:369的氨基酸序列的vl-cdr 1,具有seq id no:371的氨基酸序列的vl-cdr 2,以及具有seq id no:373的氨基酸序列的vl-cdr 3;
118.xxi.具有seq id no:378的氨基酸序列的vh-cdr 1,具有seq id no:380的氨基酸序列的vh-cdr 2,以及具有seq id no:382的氨基酸序列的vh-cdr 3,具有seq id no:387的氨基酸序列的vl-cdr 1,具有seq id no:389的氨基酸序列的vl-cdr 2,以及具有seq id no:391的氨基酸序列的vl-cdr 3;
119.xxii.具有seq id no:396的氨基酸序列的vh-cdr 1,具有seq id no:398的氨基酸序列的vh-cdr 2,以及具有seq id no:400的氨基酸序列的vh-cdr 3,具有seq id no:405的氨基酸序列的vl-cdr 1,具有seq id no:407的氨基酸序列的vl-cdr 2,以及具有seq id no:409的氨基酸序列的vl-cdr 3;
120.xxiii.具有seq id no:414的氨基酸序列的vh-cdr 1,具有seq id no:416的氨基酸序列的vh-cdr 2,以及具有seq id no:418的氨基酸序列的vh-cdr 3,具有seq id no:423的氨基酸序列的vl-cdr 1,具有seq id no:425的氨基酸序列的vl-cdr 2,以及具有seq id no:427的氨基酸序列的vl-cdr 3;
121.xxiv.具有seq id no:432的氨基酸序列的vh-cdr 1,具有seq id no:434的氨基酸序列的vh-cdr 2,以及具有seq id no:436的氨基酸序列的vh-cdr 3,具有seq id no:441的氨基酸序列的vl-cdr 1,具有seq id no:443的氨基酸序列的vl-cdr 2,以及具有seq id no:445的氨基酸序列的vl-cdr 3;
122.xxv.具有seq id no:450的氨基酸序列的vh-cdr 1,具有seq id no:452的氨基酸序列的vh-cdr 2,以及具有seq id no:454的氨基酸序列的vh-cdr 3,具有seq id no:459的氨基酸序列的vl-cdr 1,具有seq id no:461的氨基酸序列的vl-cdr 2,以及具有seq id no:463的氨基酸序列的vl-cdr 3;
123.xxvi.具有seq id no:468的氨基酸序列的vh-cdr 1,具有seq id no:470的氨基酸序列的vh-cdr 2,以及具有seq id no:472的氨基酸序列的vh-cdr 3,具有seq id no:477的氨基酸序列的vl-cdr 1,具有seq id no:479的氨基酸序列的vl-cdr 2,以及具有seq id no:481的氨基酸序列的vl-cdr 3;
124.xxvii.具有seq id no:486的氨基酸序列的vh-cdr 1,具有seq id no:488的氨基酸序列的vh-cdr 2,以及具有seq id no:490的氨基酸序列的vh-cdr 3,具有seq id no:495的氨基酸序列的vl-cdr 1,具有seq id no:497的氨基酸序列的vl-cdr 2,以及具有seq id no:499的氨基酸序列的vl-cdr 3;
125.xxviii.具有seq id no:504的氨基酸序列的vh-cdr 1,具有seq id no:506的氨
基酸序列的vh-cdr 2,以及具有seq id no:508的氨基酸序列的vh-cdr 3,具有seq id no:513的氨基酸序列的vl-cdr 1,具有seq id no:515的氨基酸序列的vl-cdr 2,以及具有seq id no:517的氨基酸序列的vl-cdr 3;
126.xxix.具有seq id no:522的氨基酸序列的vh-cdr 1,具有seq id no:524的氨基酸序列的vh-cdr 2,以及具有seq id no:526的氨基酸序列的vh-cdr 3,具有seq id no:531的氨基酸序列的vl-cdr 1,具有seq id no:533的氨基酸序列的vl-cdr 2,以及具有seq id no:535的氨基酸序列的vl-cdr 3;
127.xxx.具有seq id no:540的氨基酸序列的vh-cdr 1,具有seq id no:542的氨基酸序列的vh-cdr 2,以及具有seq id no:544的氨基酸序列的vh-cdr 3,具有seq id no:549的氨基酸序列的vl-cdr 1,具有seq id no:551的氨基酸序列的vl-cdr 2,以及具有seq id no:553的氨基酸序列的vl-cdr 3;
128.xxxi.具有seq id no:558的氨基酸序列的vh-cdr 1,具有seq id no:560的氨基酸序列的vh-cdr 2,以及具有seq id no:562的氨基酸序列的vh-cdr 3,具有seq id no:567的氨基酸序列的vl-cdr 1,具有seq id no:569的氨基酸序列的vl-cdr 2,以及具有seq id no:571的氨基酸序列的vl-cdr 3;
129.xxxii.具有seq id no:576的氨基酸序列的vh-cdr 1,具有seq id no:578的氨基酸序列的vh-cdr 2,以及具有seq id no:580的氨基酸序列的vh-cdr 3,具有seq id no:585的氨基酸序列的vl-cdr 1,具有seq id no:587的氨基酸序列的vl-cdr 2,以及具有seq id no:589的氨基酸序列的vl-cdr 3;
130.xxxiii.具有seq id no:594的氨基酸序列的vh-cdr 1,具有seq id no:596的氨基酸序列的vh-cdr 2,以及具有seq id no:598的氨基酸序列的vh-cdr 3,具有seq id no:603的氨基酸序列的vl-cdr 1,具有seq id no:605的氨基酸序列的vl-cdr 2,以及具有seq id no:607的氨基酸序列的vl-cdr 3;
131.xxxiv.具有seq id no:612的氨基酸序列的vh-cdr 1,具有seq id no:614的氨基酸序列的vh-cdr 2,以及具有seq id no:616的氨基酸序列的vh-cdr 3,具有seq id no:621的氨基酸序列的vl-cdr 1,具有seq id no:623的氨基酸序列的vl-cdr 2,以及具有seq id no:625的氨基酸序列的vl-cdr 3;
132.xxxv.具有seq id no:630的氨基酸序列的vh-cdr 1,具有seq id no:632的氨基酸序列的vh-cdr 2,以及具有seq id no:634的氨基酸序列的vh-cdr 3,具有seq id no:639的氨基酸序列的vl-cdr 1,具有seq id no:641的氨基酸序列的vl-cdr 2,以及具有seq id no:643的氨基酸序列的vl-cdr 3;
133.xxxvi.具有seq id no:648的氨基酸序列的vh-cdr 1,具有seq id no:650的氨基酸序列的vh-cdr 2,以及具有seq id no:652的氨基酸序列的vh-cdr 3,具有seq id no:657的氨基酸序列的vl-cdr 1,具有seq id no:659的氨基酸序列的vl-cdr 2,以及具有seq id no:661的氨基酸序列的vl-cdr 3;
134.xxxvii.具有seq id no:666的氨基酸序列的vh-cdr 1,具有seq id no:668的氨基酸序列的vh-cdr 2,以及具有seq id no:670的氨基酸序列的vh-cdr 3,具有seq id no:675的氨基酸序列的vl-cdr 1,具有seq id no:677的氨基酸序列的vl-cdr 2,以及具有seq id no:679的氨基酸序列的vl-cdr 3;或
135.xxxviii.具有seq id no:684的氨基酸序列的vh-cdr 1,具有seq id no:686的氨基酸序列的vh-cdr 2,以及具有seq id no:688的氨基酸序列的vh-cdr 3,具有seq id no:693的氨基酸序列的vl-cdr 1,具有seq id no:695的氨基酸序列的vl-cdr 2,以及具有seq id no:697的氨基酸序列的vl-cdr 3。
136.在一些实施方式中,本文提供的抗体或抗原结合片段包含:一对选自由以下组成的组的重链可变区和轻链可变区序列:seq id no:25/34、seq id no:43/52、seq id no:61/70、seq id no:79/88、seq id no:97/106、seq id no:115/124、seq id no:133/142、seq id no:151/160、seq id no:205/214、seq id no:223/232、seq id no:241/250、seq id no:259/268、seq id no:277/286、seq id no:295/304、seq id no:313/322、seq id no:331/340、seq id no:349/358、seq id no:367/376、seq id no:385/394、seq id no:403/412、seq id no:421/430、seq id no:439/448、seq id no:457/466、seq id no:475/484、seq id no:493/502、seq id no:511/520、seq id no:529/538、seq id no:547/556、seq id no:565/574、seq id no:583/592、seq id no:601/610、seq id no:619/628、seq id no:637/646、seq id no:655/664、seq id no:673/682、seq id no:691/161、seq id no:170/179、seq id no:188/76或其一对具有至少80%、85%、90%、95%、97%、98%或99%的序列同一性,但保留对cldn 18的特异性结合亲和力的同源序列。
137.在一些实施方式中,本文提供的抗体或抗原结合片段包含:
138.a)重链可变区,其包含选自由seq id no:704、seq id no:705、seq id no:706和seq id no:707组成的组的氨基酸序列;以及轻链可变区,其包含选自由seq id no:708、seq id no:709和seq id no:710组成的组的氨基酸序列;或
139.b)重链可变区,其包含选自由seq id no:711、seq id no:712、seq id no:713和seq id no:714组成的组的氨基酸序列;以及轻链可变区,其包含选自由seq id no:715、seq id no:716和seq id no:717组成的组的氨基酸序列;或
140.c)重链可变区,其包含选自由seq id no:718、seq id no:719、seq id no:720、seq id no:721和seq id no:722组成的组的氨基酸序列;以及轻链可变区,其包含选自由seq id no:723、seq id no:724和seq id no:725组成的组的氨基酸序列。
141.在一些实施方式中,本文提供的抗体或抗原结合片段进一步包含一个或多个氨基酸残基取代或修饰,但仍保留对cldn 18的特异性结合亲和力。在一些实施方式中,至少一个取代或修饰在一个或多个cdr序列中,和/或在重链可变区或轻链可变区的一个或多个非cdr序列中。
142.在一些实施方式中,本文提供的抗体或抗原结合片段进一步包含一个或多个非天然氨基酸(nnaa)取代。
143.在一些实施方式中,本文提供的抗体或抗原结合片段是单克隆抗体或其抗原结合片段、多克隆抗体或其抗原结合片段、双特异性抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、人源化抗体或其抗原结合片段、重组抗体或其抗原结合片段、人类抗体或其抗原结合片段、标记抗体或其抗原结合片段、二价抗体或其抗原结合片段或抗独特型抗体或其抗原结合片段。
144.在一些实施方式中,本文提供的抗体或抗原结合片段是骆驼化单结构域抗体、双功能抗体、scfv、scfv二聚体、dsfv、(dsfv)2、dsfv-dsfv'、fv片段、fab、fab'、f(ab')2、ds-双
功能抗体、纳米抗体、结构域抗体或二价结构域抗体。
145.在一些实施方式中,本文提供的抗体或抗原结合片段进一步包含免疫球蛋白恒定区。
146.在一些实施方式中,免疫球蛋白恒定区是λ轻链、κ轻链、γ1重链、γ2重链、γ3重链或γ4重链恒定区。在一些实施方式中,本文提供的抗体或抗原结合片段是人类igg1同型。
147.在一些实施方式中,免疫球蛋白恒定区包含fc区,其氨基酸序列选自由seq id no:700-703组成的组。
148.在一些实施方式中,本文提供的抗体或抗原结合片段与cldn 18.2蛋白特异性结合。在一些实施方式中,本文提供的抗体或抗原结合片段与cldn 18.1蛋白和cldn 18.2蛋白结合。
149.在一些实施方式中,本文提供的抗体或抗原结合片段与表达cldn18.2的细胞的结合亲和力高于或与参考抗体相当。
150.在一些实施方式中,本文提供的抗体或抗原结合片段对表达cldn 18.2的细胞的最大mfi高于参考抗体。
151.在一些实施方式中,参考抗体是imab362。
152.在一些实施方式中,cldn 18.2在细胞上的表面表达低。
153.在一些实施方式中,结合亲和力是通过facs或elisa确定。
154.在一些实施方式中,本文提供的抗体或抗原结合片段与cldn 18.2蛋白结合的ec
50
小于约10nm、小于约8nm、小于约6nm、小于约4nm或小于约2nm。
155.在一些实施方式中,本文提供的抗体或抗原结合片段与一个或多个缀合物部分连接。在一些实施方式中,缀合物部分包含活性剂、放射性同位素、可检测标记、药代动力学修饰部分或纯化部分。在一些实施方式中,缀合物部分直接或通过连接子共价连接。
156.在另一个方面,本公开还包括识别与本文提供的抗体或抗原结合片段相同的抗原决定簇位点的抗体或抗原结合片段作为实施例。
157.在另一个方面,本公开提供了一种嵌合抗原受体,其包含本文提供的抗体或抗原结合片段、跨膜区和细胞内信号区。
158.在一些实施方式中,细胞内信号区选自由以下组成的组:cd3、fccri、cd27、cd28、cd137、cd134、myd88、cd40、cd278、tlr的细胞内信号区序列,或其组合。
159.在一些实施方式中,跨膜区包含cd3、cd4、cd8或cd28的跨膜区。
160.在另一个方面,本公开提供了一种分离的多核苷酸,其编码本文提供的抗体或抗原结合片段或嵌合抗原受体。
161.在一些实施方式中,本文提供的分离的多核苷酸包含选自由以下组成的组的核苷酸序列:seq id no:24、42、60、78、96、114、132、150、204、222、240、258、276、294、312、330、348、366、384、402、420、438、456、474、492、510、528、546、564、582、600、618、636、654、672、690、169、187或其具有至少80%序列同一性的同源序列。
162.在一些实施方式中,本文提供的分离的多核苷酸进一步包含选自由以下组成的组的核苷酸序列:seq id no:33、51、69、87、105、123、141、159、213、231、249、267、285、303、321、339、357、375、393、411、429、447、465、483、501、519、537、555、573、591、609、627、645、
663、681、699、178、196或其具有至少80%序列同一性的同源序列。
163.在另一个方面,本公开提供了一种载体,其包含本文提供的多核苷酸。
164.在另一个方面,本公开提供了一种宿主表达系统,其包含本文提供的载体或具有整合至其基因组中的本文提供的多核苷酸。在一些实施方式中,本文提供的宿主表达系统是微生物、酵母或哺乳动物细胞,其中所述微生物选自由大肠杆菌和枯草杆菌组成的组,其中所述酵母是酵母属,并且其中所述哺乳动物细胞选自由cos、cho-s、cho-k1、hek-293和3t3细胞组成的组。
165.在另一个方面,本公开提供了一种病毒,其包含本文提供的载体。
166.在另一个方面,本公开提供了一种表达本文提供的抗体或抗原结合片段或本文提供的嵌合抗原受体的方法,其包括在表达所述抗体或抗原结合片段或所述嵌合抗原受体条件下,培养本文提供的宿主表达系统。
167.在另一个方面,本公开提供了一种抗体-药物缀合物,其包含本文提供的抗体或抗原结合片段,直接或通过连接子与一种或多种治疗剂连接。
168.在另一个方面,本公开提供了一种靶向表达cldn 18.2的细胞的修饰的免疫细胞,其包含本文提供的抗体或其抗原结合片段或本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体或本文提供的病毒。
169.在一些实施方式中,表达cldn 18.2的细胞选自由以下组成的组:胃癌细胞、胰腺癌细胞、食管癌细胞、肺癌细胞、胆囊癌细胞、结肠直肠癌细胞和肝癌细胞。
170.在一些实施方式中,免疫细胞是t淋巴细胞、nk细胞、单核细胞、巨噬细胞或nkt淋巴细胞。
171.在一些实施方式中,本文提供的修饰的免疫细胞进一步具有一个或多个选自由以下组成的组的特征:
172.i.携带外源性细胞因子的编码序列,
173.ii.表达另一种嵌合抗原受体或其组合,
174.iii.表达趋化因子受体
175.iv.表达减少免疫检查点抑制剂表达的sirna或阻断免疫检查点抑制剂的蛋白质,
176.v.已敲除内源性免疫检查点抑制剂
177.vi.表达可分泌抗体sc-fv
178.vii.表达共刺激蛋白
179.viii.表达安全开关。
180.在一些实施方式中,免疫检查点抑制剂选自由pd-1、ctla-4、lag-3、tim-3组成的组。
181.在另一个方面,本公开提供了一种药物组合物,其包含本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒或本文提供的修饰的免疫细胞,以及一种或多种药学上可接受的载体。
182.在一些实施方式中,一种或多种药学上可接受的载体选自由以下组成的组:药学上可接受的液体、凝胶、固体载体、水性媒剂、非水性媒剂、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、麻醉剂、悬浮剂/分散剂、螯合剂、稀释剂、佐剂、赋形剂和无毒辅助物质。
183.在一些实施方式中,本文提供的药物组合物进一步包含一种或多种治疗剂。
184.在一些实施方式中,一种或多种治疗剂选自由以下组成的组:氨柔比星(amrubicin)、甲磺酸阿帕替尼(apatinib mesylate)、阿曲生坦巴他布林(atrasentan batabulin)、骨化三醇(calcitriol)、卡培他滨(capecitabine)、西仑吉肽(cilengitide)、达沙替尼(dasatinib)、地卡他尼(decatanib)、艾多卡林(edotecarin)、恩扎妥林(enzastaurin)、埃罗替尼(erlotinib)、依维莫司(everolimus)、吉马替康(gimatecan)、棉籽酚伊匹单抗(gossypol ipilimumab)、洛那法尼(lonafarnib)、硫蒽酮(lucanthone)、纽拉迪(neuradiab)、诺拉曲特(nolatrexed)、奥利默森(oblimersen)、奥拉帕尼(olaparib)、奥法木单抗(ofatumumab)、奥戈伏单抗(oregovomab)、帕尼单抗(panitumumab)、帕唑帕尼鲁比替康(pazopanibrubitecan)、瑞格非尼他仑帕奈(regorafenib talampanel)、喃氟啶(tegafur)、坦罗莫司(temsirolimus)、替米利芬(tesmilifene)、粉防己碱(tetrandrine)、替西木单抗(ticilimumab)、曲美替尼(trametinib)、曲贝替定(trabectedin)、凡德他尼(vandetanib)、维特斯潘(vitespan)、扎木单抗(zanolimumab)、唑仑膦酸盐(zolendronate)、组氨瑞林(histrelin)、阿扎胞苷(azacitidine)、右雷佐生(dexrazoxane)、阿仑单抗(alemtuzumab)、来那度胺(lenalidomide)、吉妥珠单抗(gemtuzumab)、酮康唑(ketoconazole)、氮芥(nitrogen mustard)、替伊莫单抗(ibritumomab tiuxetan)、地西他滨(decitabine)、六甲蜜胺(hexamethylmelamine)、贝沙罗汀(bexarotene)、托西莫单抗(tositumomab)、三氧化二砷、依替膦酸盐(editronate)、环孢素(cyclosporine)、欧文氏菌天冬酰胺酶(edwina-asparaginase)、表柔比星(epirubicin)、奥沙利铂(oxaliplatin)、抗pd1抗体、抗pdl1抗体、抗her2抗体、抗her2 adc、5-氟尿嘧啶和锶89。
185.在另一个方面,本公开提供了一种试剂盒,其包括:容器和本文提供的药物组合物;或容器和本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒或本文提供的修饰的免疫细胞。
186.在另一个方面,本公开提供了一种用于治疗或预防受试者的cldn相关病况的方法,其包括向所述受试者施用治疗有效量的本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒或本文提供的修饰的免疫细胞。
187.在一些实施方式中,cldn相关病况是癌性病况。
188.在一些实施方式中,癌性病况选自由以下组成的组:肺癌(例如小细胞肺癌、非小细胞肺癌(nsclc)、肺腺癌或肺鳞状细胞癌)、胃癌(例如胃肠癌)、胰腺癌、食道癌、肝癌(例如肝细胞癌/肝细胞瘤)、鳞状细胞癌、腹膜癌、脑瘤(例如胶质母细胞瘤/多形性胶质母细胞瘤(gbm)、非胶质母细胞瘤脑瘤或脑膜瘤)、胶质瘤(例如室管膜瘤、星形细胞瘤、间变性星形细胞瘤、少突胶质瘤或混合胶质瘤,如少突星形细胞瘤)、宫颈癌、卵巢癌、肝癌(例如肝母细胞瘤、肝细胞癌/肝细胞瘤、肝癌)、膀胱癌(例如尿路上皮癌)、乳腺癌、结肠癌、结肠直肠癌、直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌(例如肾横纹肌瘤)、前列腺癌、外阴癌、阴茎癌、肛门癌(例如肛门鳞状细胞癌)、甲状腺癌、头颈癌(例如鼻咽癌)、皮肤癌(例如黑色素瘤或鳞状细胞癌)、骨肉瘤、尤文氏肉瘤、软骨肉瘤、软组织肉瘤(例如横纹肌肉瘤、纤维肉瘤、卡波西氏肉瘤)、类癌、眼癌(例如视网膜母细胞瘤)、间皮瘤、淋巴细胞性/淋巴母细胞性白血病(例如t细胞谱系和b细胞前体谱系的急性淋巴细胞性/淋巴母细胞性白血病(all)、慢
性淋巴母细胞性/淋巴细胞性白血病(cll)、急性骨髓性/成髓细胞性白血病(aml),包括肥大细胞白血病、慢性骨髓性/髓细胞性/成髓细胞性白血病(cml)、毛细胞白血病(hcl)、霍奇金氏病、非霍奇金氏淋巴瘤、慢性骨髓单核细胞性白血病(cmml)、滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlcl)、套细胞淋巴瘤(mcl)、伯基特氏淋巴瘤(bl)、蕈样肉芽肿、塞扎里综合征、皮肤t细胞淋巴瘤、肥大细胞瘤、髓母细胞瘤、肾胚细胞瘤、孤立性浆细胞瘤、骨髓增生异常综合征、慢性和非慢性骨髓增生性病症、中枢神经系统肿瘤、垂体腺瘤、前庭神经鞘瘤、原始神经外胚层肿瘤、室管膜瘤、脉络丛乳头状瘤、真性红细胞增多症、血小板增多症、胆囊癌、特发性骨髓纤维化以及小儿癌症,如小儿肉瘤(例如神经母细胞瘤、横纹肌肉瘤和骨肉瘤)。
189.在一些实施方式中,施用是通过肠胃外途径,包括皮下、腹膜内、静脉内、肌肉内或皮内注射;或非肠胃外途径,包括经皮、口服、鼻内、眼内、舌下、直肠或局部。
190.在一些实施方式中,本文提供的方法进一步包括向有需要的受试者施用额外治疗剂。
191.在一些实施方式中,额外治疗剂选自由以下组成的组:活性剂、成像剂、细胞毒性剂、血管生成抑制剂、激酶抑制剂、共刺激分子激动剂、共抑制分子阻断剂、粘附分子阻断剂、抗细胞因子抗体或其功能片段、可检测标记或报道分子、抗微生物剂、基因编辑剂、β激动剂、病毒rna抑制剂、聚合酶抑制剂、干扰素和微rna。
192.在一些实施方式中,额外治疗剂是在施用本文提供的组合物之前、在施用本文提供的组合物之后和/或与本文提供的组合物同时施用于有需要的受试者。
193.在另一个方面,本公开提供了一种用于诊断cldn相关病况的方法,其包括通过使用本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒来检测cldn。
194.在一些实施方式中,cldn是cldn 18.2或cldn 18.1。
195.在一些实施方式中,病况选自由以下组成的组:胃癌、胰腺癌、食道癌、肺癌、胆囊癌、结肠直肠癌和肝癌。
196.在另一个方面,本公开提供了一种用于诱导表达cldn 18.2的细胞死亡的方法,其包括使表达cldn 18.2的细胞与本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒接触。
197.在一些实施方式中,细胞与本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒在体外或体内接触。
198.在一些实施方式中,细胞是癌细胞。在一些实施方式中,细胞是实体瘤细胞。
199.在另一个方面,本公开提供了本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒在制备用于治疗有需要的受试者的cldn相关病况的药物中的用途。
200.在另一个方面,本公开提供了本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒在制备用于检测cldn相关病况的诊断试剂中的用途。
201.在另一个方面,本公开提供了本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒,其用于治疗有需要的受试者的cldn相关病况的方法中。
202.在另一个方面,本公开提供了本文提供的抗体或抗原结合片段、本文提供的嵌合抗原受体、本文提供的多核苷酸、本文提供的载体、本文提供的病毒、本文提供的修饰的免疫细胞、本文提供的抗体-药物缀合物、本文提供的药物组合物或本文提供的试剂盒,其用于检测cldn相关病况的方法中。
附图说明
203.图1a和1b显示facs分析,表明ab10与人、猴和小鼠claudine18.2结合,但不与人claudine18.1结合。
204.图2显示,与imab362相比,chab10对claudin18.2低表达的细胞(即gaxc031细胞)更敏感。一些gaxc031细胞用imab362进行了阴性染色,而chab10对所有gaxc031细胞进行了染色。
205.图3显示facs分析,表明所选抗体对chok1-18.2和gaxc031的结合亲和力高于或与基准抗体imab362(tab1)相当,最大mfi更高。dle是指包含seq id no:702的氨基酸序列的增强的人类igg1 fc,这是具有s122d、a213l和i215e突变的人类igg1重链fc。2b1是专利申请第pct/cn2017/092381号中所包括的抗体2b1;2c3是专利申请第pct/us2019/020872号中所包括的抗体2-c3;3e12是专利申请第pct/cn2017/092381号中所包括的抗体3e12。
206.图4显示,与imab362相比,chab08对gaxc031细胞显示出更有效的adcc作用。
207.图5显示,与imab362(tab1)相比,我们的抗体对gaxc031细胞显示出更有效的adcc作用。
208.图6显示,chab10和chab15对gaxc031细胞显示出有效的间接adc细胞毒性。
209.图7a和7b显示,一些人源化抗体对gaxc031细胞显示出同等的、明显下降的亲和力。
210.图8a-8c显示抗体,尤其是mab ab15,对表达非常低水平的claudin 18.2的katoiii和snu620细胞表现出可检测的结合亲和力,基准抗体imab362几乎无法检测到。
211.图9a-9g显示六种人源化抗体与vlp-claudin 18.2的结合动力学。
212.图10a-10f显示人源化抗claudin 18.2抗体对过度表达人类claudin 18.2的chok1细胞或gaxc031细胞的adc细胞毒性活性。
213.图11a和11b显示mab ab15、ab10、ab17、ab06、ab08和ab20的体内功效和毒性。
214.图12a-12j显示ab10-vc-mmaf对gaxc03细胞的体内adc功效和毒性,图12k显示用ab10-vc-mmaf处理的小鼠的生存曲线。
215.图13a-13l显示人源化或嵌合抗体对gaxc03细胞的体内adc功效和毒性,图13m显
示用人源化或嵌合抗体的adc处理的小鼠的生存曲线。
具体实施方式
216.以下对本公开的描述仅旨在说明本公开的各种实施方式。因此,所讨论的具体修改不应理解为对本公开的范围的限制。对本领域的技术人员将显而易见的是,可以在不脱离本公开范围的情况下作出各种等效物、变化和修改,并且应理解,这些等效实施方式将包括在本文中。本文引用的所有参考文献,包括出版物、专利和专利申请,均以全文引用的方式并入本文中。
217.定义
218.如本文所用,术语“抗体”是指任何免疫球蛋白、单克隆抗体、多克隆抗体、双功能抗体、纳米抗体、线性抗体、单链抗体、多价抗体、二价抗体、单价抗体、多特异性抗体、双特异性抗体、其与特定抗原结合的抗原结合片段、其突变体或免疫球蛋白分子的任何包含所需特异性抗原结合位点的其他修饰构型,包括抗体的糖基化变体、抗体的氨基酸序列变体和共价修饰的抗体。“单克隆抗体”是指同质的抗体群体,“多克隆抗体”是指异质的抗体群体。这两个术语并不限制抗体的来源或其制备方式。
219.典型的完整抗体包含两条重链和两条轻链。每条重链由可变区和第一、第二和第三恒定区组成,而每条轻链由可变区和恒定区组成。哺乳动物的重链被分类为α、δ、ε、γ或μ,哺乳动物的轻链被分类为λ或κ。抗体呈“y”形,其中y的茎部由通过二硫键结合在一起的两条重链的第二和第三恒定区组成。y的每个臂包括与单条轻链的可变区和恒定区结合的单条重链的可变区和第一恒定区。轻链和重链的可变区负责抗原结合。两条链中的可变区通常含有三个高变环,称为互补决定区(cdr)。特别地,轻链中的轻链可变(vl)区包含vl-cdr1、vl-cdr2和vl-cdr3,而重链中的重链可变(vh)区包含vh-cdr1、vh-cdr2和vh-cdr3。轻链或重链的三个cdr穿插在称为框架区(fr)的侧翼链段之间,框架区比cdr更高度保守并形成支架以支持高变环。fr和cdr的边界可以使用本领域已知的方法来定义或鉴定,例如通过kabat定义、chothia定义、abm定义、imgt(参见例如kabat,e.a.等人,(1991)sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242;chothia,c.等人,j mol biol.dec 5;186(3):651-63(1985);chothia等人,(1989)nature 342:877;chothia,c.等人(1987)j.mol.biol.196:901-917;al-lazikani等人(1997)j.molec.biol.273:927-948;almagro,j.mol.recognit.17:132-143(2004);marie-paule lefranc等人,developmental and comparative immunology,27:55-77(2003);marie-paule lefranc等人,immunome research,1(3),(2005);和marie-paule lefranc,molecular biology of b cells(second edition),chapter 26,481-514,(2015),hgmp.mrc.ac.uk and bioinf.org.uk/abs)。重链和轻链的恒定区不参与抗原结合,但是表现出各种效应功能。抗体根据其重链恒定区的氨基酸序列进行分类。抗体的五个主要类别或同型是iga、igd、ige、igg和igm,其特征在于分别存在α、δ、ε、γ和μ重链。数个主要的抗体类别被分为亚类,如igg1(γ1重链)、igg2(γ2重链)、igg3(γ3重链)、igg4(γ4重链)、iga1(α1重链)或iga2(α2重链)。
220.如本文所用,术语“二价”是指具有两个抗原结合位点的抗体或抗原结合片段。两个抗原结合位点可以与相同的抗原结合,或者它们可以各自与不同的抗原结合,在这种情
况下,抗体或抗原结合片段被表征为“双特异性”。
221.术语“单价”是指抗体或抗原结合片段仅具有一个单一的抗原结合位点;而术语“多价”是指抗体或抗原结合片段具有多个(即,多于两个)抗原结合位点。
222.如本文所用,术语“抗原结合片段”是指由完整抗体的一部分形成的包含一个或多个cdr的抗体片段,或任何其他可以与抗原结合但不包含完整的原生抗体结构的抗体片段。抗原结合片段的实例包括但不限于骆驼化单结构域抗体、双功能抗体、单链抗体分子(scfv)、scfv二聚体(二价双功能抗体)、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、fv片段、fab、fab'、f(ab')2、纳米抗体、结构域抗体、二价结构域抗体、二硫键稳定的双功能抗体(ds双功能抗体)、双特异性ds双功能抗体、由抗体的一部分形成的包含一个或多个cdr的多特异性抗体,或任何其他与抗原结合但不包含完整抗体结构的抗体片段。抗原结合片段能够与亲本抗体或亲本抗体片段(例如亲本scfv)所结合的相同抗原结合。
223.关于抗体的“fab”是指由单条轻链(可变区和恒定区)通过二硫键与单条重链的可变区和第一恒定区结合组成的抗体部分。
[0224]“fab'”是指包括铰链区的一部分的fab片段。
[0225]“f(ab')
2”是指fab'的二聚体。
[0226]
关于抗体的“fv”是指抗体的带有完整抗原结合位点的最小片段。fv片段由单条轻链的可变区与单条重链的可变区结合组成。
[0227]“dsfv”是指二硫键稳定的fv片段,其中单条轻链的可变区和单条重链的可变区之间的连接是二硫键。在一些实施方式中,“(dsfv)
2”或“(dsfv-dsfv')”包含三条肽链:两个vh部分通过肽连接子(例如长柔性连接子)连接并通过二硫桥键分别与两个v
l
部分结合。在一些实施方式中,dsfv-dsfv'是双特异性的,其中每个二硫键配对的重链和轻链具有不同的抗原特异性。
[0228]“单链fv抗体”或“scfv”是指由轻链可变区和重链可变区直接或通过肽连接子序列相互连接组成的工程化抗体(huston js等人proc natl acad sci usa,85:5879(1988))。
[0229]“骆驼化单结构域抗体”可与“重链抗体”或“hcab”互换使用,是指包含两个vh结构域而没有轻链的抗体(riechmann l.和muyldermans s.,j immunol methods.dec10;231(1-2):25-38(1999);muyldermans s.,j biotechnol.jun;74(4):277-302(2001);wo94/04678;wo94/25591;美国专利第6,005,079号)。重链抗体最初来源于骆驼科(骆驼、单峰骆驼和美洲驼)。尽管没有轻链,但骆驼化抗体具有真实的抗原结合库(hamers-casterman c.等人,nature.jun 3;363(6428):446-8(1993);nguyen vk.等人“heavy-chain antibodies in camelidae;a case of evolutionary innovation,”immunogenetics.apr;54(1):39-47(2002);nguyen vk.等人immunology.may;109(1):93-101(2003))。重链抗体的可变结构域代表由适应性免疫反应产生的最小的已知抗原结合单元(koch-nolte f.等人,faseb j.nov;21(13):3490-8.epub 2007jun 15(2007))。
[0230]“纳米抗体”是指由常规igg的重链抗体的一个vh结构域和两个重链恒定结构域(例如ch2和ch3)组成的抗体片段。
[0231]“双功能抗体”是指具有两个抗原结合位点的小抗体片段,其中该片段包含vh结构
域与同一多肽链中的v
l
结构域连接(v
h-v
l
或v
h-v
l
)(参见例如holliger p.等人,proc natl acad sci u s a.jul 15;90(14):6444-8(1993);ep404097;wo93/11161)。通过使用太短而无法使同一链上的两个结构域之间配对的连接子,结构域被迫与另一条链的互补结构域配对,从而产生两个抗原结合位点。抗原结合位点可以靶向相同或不同的抗原(或表位)。
[0232]“结构域抗体”是指仅含有重链可变区或轻链可变区的抗体片段。在某些情况下,两个或更多个vh结构域用肽连接子共价连接,以产生二价或多价结构域抗体。二价结构域抗体的两个vh结构域可以靶向相同或不同的抗原。
[0233]
在某些实施方式中,“双特异性ds双功能抗体”是靶向两种不同抗原(或表位)的双功能抗体。在某些实施方式中,“双特异性ds双功能抗体”包含通过v
h1
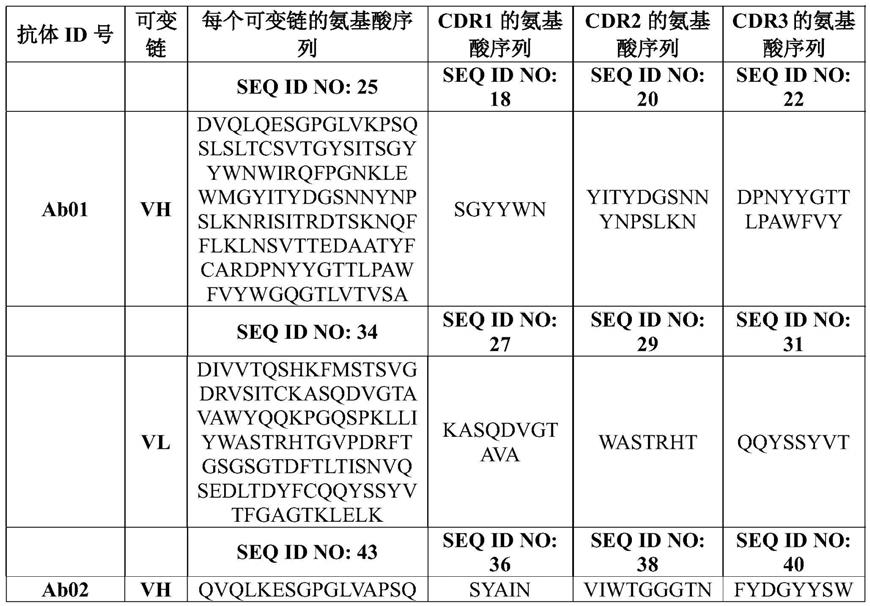
与v
l1
之间的二硫桥键结合的v
h1-v
l2
(由肽连接子连接)与v
l1-v
h2
(也由肽连接子连接)。
[0234]
在某些实施方式中,“双特异性dsfv”或“dsfv-dsfv”包含三条肽链:v
h1-v
h2
部分,其中重链通过肽连接子(例如长柔性连接子)连接并通过二硫桥键分别与v
l1
和v
l2
部分结合,其中每个二硫键配对的重链和轻链具有不同的抗原特异性。
[0235]
在某些实施方式中,“scfv二聚体”是二价双功能抗体或二价scfv(bsfv),其包含v
h-v
l
(由肽连接子连接)与另一个v
h-v
l
部分二聚,使得一个部分的vh与另一个部分的v
l
配位并形成可靶向相同抗原(或表位)或不同抗原(或表位)的两个结合位点。在特定实施方式中,“scfv二聚体”是双特异性双功能抗体,其包含v
h1-v
l2
(由肽连接子连接)与v
l1-v
h2
(也由肽连接子连接)缔合,使得v
h1
与v
l1
配位且v
h2
与v
l2
配位并且每个配位对具有不同的抗原特异性。
[0236]
关于抗体的“fc”是指由第一重链的第二和第三恒定区通过二硫键与第二重链的第二和第三恒定区结合组成的抗体部分。抗体的fc部分负责各种效应功能,如adcc和cdc,但在抗原结合中不起作用。
[0237]
如本文所用,术语“嵌合”是指抗体或抗原结合片段的重链和/或轻链的一部分来源于一个物种,而重链和/或轻链的其余部分来源于不同的物种。在说明性实施例中,嵌合抗体可以包含来源于人类的恒定区和来源于非人类动物如小鼠的可变区。在一些实施方式中,非人类动物是哺乳动物,例如小鼠、大鼠、兔子、山羊、绵羊、豚鼠或仓鼠。
[0238]
如本文所用,术语“人源化”是指抗体或抗原结合片段包含来源于非人类动物的cdr、来源于人类的fr区,并且在适用时,恒定区来源于人类。
[0239]
除非另外规定,否则如本文所用的术语“claudin”或“cldn”涵盖在上皮细胞和内皮细胞中表达并形成决定紧密连接渗透性的细胞旁屏障和孔隙的任何或所有紧密连接膜蛋白,并旨在涵盖任何形式的cldn,例如,1)原生未加工的cldn分子、“全长”cldn链或天然存在的cldn变体,包括例如等位基因变体;2)在细胞内加工产生的任何形式的cldn,例如不同的剪接形式,例如claudin 18的剪接变体1(cldn18.1)、claudin 18的剪接变体2(cldn18.2)等;或3)通过重组方法产生的cldn亚基的片段(例如截短的形式、细胞外/跨膜结构域)或修饰的形式(例如突变的形式、糖基化/peg化的形式、his标签/免疫荧光融合的形式)。如本文所用,“cldn”可以来源于任何脊椎动物来源,包括哺乳动物,如灵长类动物(例如人类、猴子)和啮齿动物(例如小鼠和大鼠)。
[0240]
术语“claudin 18”或“cldn 18”是指cldn的一个家族成员,分子量约为27.9kd,包括如上所述的两种剪接形式,即cldn18.1(由智人cldn18.1的ncbi参考序列:np_057453.1
和/或登录号:nm_016369.4鉴定)和cldn18.2(由智人cldn18.2的ncbi参考序列:np_001002026.1和/或登录号:nm_001002026.3鉴定)。
[0241]
术语“抗cldn18抗体”是指能够与cldn18特异性结合的抗体。在一些实施方式中,本文提供的抗cldn18抗体能够与cldn18.2和cldn18.1结合。在一些实施方式中,本文提供的抗cldn18抗体能够与cldn18.2特异性结合,但不与cldn18.1结合或与cldn18.1结合较差(例如,对cldn18.1的结合亲和力比对cldn18.2至少低10倍,或至少低50倍,或至少低100倍,或至少低200倍)。在一些实施方式中,本文提供的抗cldn18抗体对cldn18.1没有可检测的结合亲和力。在一些实施方式中,结合亲和力由facs确定。在一些实施方式中,结合亲和力由facs检测的mfi确定。
[0242]
如本文所用,术语“特异性结合(specific binding/specifically binds)”是指两个分子之间,例如抗体和抗原之间的非随机结合反应。与抗原或表位“特异性结合”的抗体是本领域内众所周知的术语。如果分子与特定目标抗原的反应比它与其他目标的反应更频繁、更迅速、持续时间更长和/或具有更大的亲和力,则该分子就被称为表现出“特异性结合”。如果抗体与目标抗原或表位的结合比它与其他物质的结合具有更大的亲和力、亲合力、更容易和/或更长的持续时间,则该抗体与目标抗原或表位“特异性结合”。例如,与抗原(cldn18.2)或其中的抗原表位特异性(或优先)结合的抗体是以比它与其他抗原或同一抗原中的其他表位的结合更大的亲和力、亲合力、更容易和/或更长的持续时间结合该目标抗原的抗体。通过这个定义也可以理解,例如,与第一目标抗原特异性结合的抗体可能或可能不与第二目标抗原特异性或优先结合。因此,“特异性结合”或“优先结合”不一定需要(尽管它可以包括)排他性结合。在一些实施例中,与目标抗原或其表位“特异性结合”的抗体可能不会与其他抗原或同一抗原中的其他表位结合(即在常规方法中仅可检测到基线结合活性)。或者或另外,本文所述的抗cldn18抗体可以相对于人类cldn18.1特异性结合人类、小鼠或恒河猴cldn18.2或其片段(例如,如在相同的分析条件下在相同的分析中所确定,对一种抗原的结合亲和力比另一种至少高10倍)。
[0243]
如本文所用,“保守氨基酸取代”是指不改变进行氨基酸取代的蛋白质的相对电荷或大小特征的氨基酸取代。例如,可以在具有疏水性侧链的氨基酸残基(例如met、ala、val、leu和ile)中,在具有中性亲水性侧链的残基(例如cys、ser、thr、asn和gln)中,在具有酸性侧链的残基(例如asp、glu)中,在具有碱性侧链的氨基酸(例如his、lys和arg)中,或在具有芳香族侧链的残基(例如trp、tyr和phe)中进行保守取代。如本领域中已知,保守取代通常不会引起蛋白质构象结构的显著变化,因此可以保留蛋白质的生物活性。
[0244]
关于氨基酸序列(或核酸序列)的“序列同一性百分比(%)”定义为在比对序列并在必要时引入空隙以获得最大数目的相同氨基酸(或核酸)后,候选序列中与参考序列中的氨基酸(或核酸)残基相同的氨基酸(或核酸)残基的百分比。氨基酸残基的保守取代可视为或可不视为相同残基。出于确定氨基酸(或核酸)序列同一性百分比的目的进行的比对可以例如使用可公开获得的工具实现,如blastn、blastp(可在美国国家生物技术信息中心(ncbi)的网站上获得,另参见altschul s.f.等人,j.mol.biol.,215:403-410(1990);stephen f.等人,nucleic acids res.,25:3389-3402(1997))、clustalw2(可在欧洲生物信息研究所(european bioinformatics institute)网站上获得,另参见higgins d.g.等人,methods in enzymology,266:383-402(1996);larkin m.a.等人,bioinformatics
(oxford,england),23(21):2947-8(2007))和align或megalign(dnastar)软件。本领域的技术人员可以使用所述工具提供的默认参数,或者可以自定义适合于比对的参数,例如通过选择合适的算法。
[0245]“分离的”物质已通过人工方式从天然状态改变。如果自然界中存在“分离的”组分或物质,则它已经被改变或从原始环境中移出,或两者兼而有之。例如,天然存在于活体动物中的多核苷酸或多肽不是“分离的”,但相同的多核苷酸或多肽如果已经与其天然状态的共存物质充分分离,从而以基本上纯净的状态存在,则是“分离的”。“分离的多核苷酸序列”是指分离的多核苷酸分子的序列。在某些实施方式中,“分离的抗体”是指具有至少60%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的纯度的抗体,如通过电泳法(如sds-page、等电聚焦、毛细电泳法)或色谱法(如离子交换色谱或反相hplc)所确定。
[0246]
如本文所用,“效应功能”是指由抗体的fc区与其效应子如c1复合体和fc受体结合引起的生物活性。示例性效应功能包括:由抗体和c1复合体上的补体成分1q(c1q)相互作用诱导的补体依赖性细胞毒性(cdc);由抗体的fc区与效应细胞上的fc受体结合诱导的抗体依赖性细胞介导的细胞毒性(adcc);和吞噬作用。
[0247]“抗体依赖性细胞介导的细胞毒性”和“adcc”是指细胞介导的反应,其中表达fc受体(fcr)的效应细胞识别目标细胞上结合的抗体或抗原结合片段并随后导致目标细胞溶解。“adcc活性”或“adcc效应”是指结合在目标细胞上的抗体或抗原结合片段引发如上所述的adcc反应的能力。
[0248]“目标细胞”是包含fc区的抗体通常通过fc区c端的蛋白质部分所特异性结合的细胞。“效应细胞”是表达一种或多种fc受体并执行效应功能的白细胞。介导adcc的人类白细胞的实例包括外周血单核细胞(pbmc)、自然杀伤(nk)细胞、单核细胞、细胞毒性t细胞和嗜中性粒细胞;其中pbmc和nk细胞是优选的。效应细胞可以从其原生来源中分离,例如从本领域中已知的血液或pbmc中分离。
[0249]
如本文所用,“载体”是指能够复制/克隆其中所含的所需核酸片段或能够表达由引入适当细胞宿主的此类所需核酸片段编码的蛋白质的多核苷酸分子。载体包括克隆载体和表达载体。如本文所用,术语“表达载体”是指其中可以可操作地插入编码蛋白质的多核苷酸以实现该蛋白质表达的媒介物。表达载体可以含有多种用于控制表达的元件,包括启动子序列、转录起始序列、增强子序列、可选元件和报道基因。另外,载体可以含有复制起点。
[0250]
如本文所用,短语“宿主细胞”是指已引入外源多核苷酸和/或载体的细胞。
[0251]
如本文所用,病况的“治疗(treating/treatment)”包括预防或缓解病况,减缓病况的发作或发展速率,降低罹患病况的风险,预防或延迟与病况相关的症状的发展,减少或结束与病况相关的症状,产生病况的完全或部分消退,治愈病状或其某种组合。
[0252]
如本文所用,“cldn相关”病况是指对用cldn调节剂治疗敏感或与cldn的表达或过度表达相关的任何疾病或病况。在一些实施方式中,cldn相关病况是cldn18.2相关病况。在某些实施方式中,cldn18.2相关病况是癌性病况。在某些实施方式中,癌性病况是cldn18.2表达阳性或表达升高。
[0253]
如本文所用,“癌性病况”是指以恶性细胞生长或肿瘤、异常增殖、浸润或转移为特
征的任何医学病况,包括实体瘤和非实体癌。如本文所用,“实体瘤”是指肿瘤细胞和/或恶性细胞的实体块。“非实体癌”是指恶性血液病,如白血病、淋巴瘤、骨髓瘤和其他恶性血液病。癌症或肿瘤的实例包括恶性血液病(例如淋巴瘤、霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤和b细胞淋巴瘤)、口腔癌(例如唇癌、舌癌或咽癌)、消化器官(例如食道、胃、小肠、结肠、大肠或直肠)、腹膜、肝脏和胆道、胰腺、呼吸系统如喉或肺(小细胞和非小细胞)、骨、结缔组织、皮肤(例如黑色素瘤)、乳房、生殖器官(输卵管、子宫、宫颈、睾丸、卵巢或前列腺)、泌尿道(例如膀胱或肾)、脑和内分泌腺如甲状腺的肿瘤。在某些实施方式中,癌症选自由以下组成的组:肺癌(例如小细胞肺癌、非小细胞肺癌(nsclc)、肺腺癌或肺鳞状细胞癌)、胃癌(例如胃肠癌)、胰腺癌、食道癌、肝癌(例如肝细胞癌/肝细胞瘤)、鳞状细胞癌、腹膜癌、脑瘤(例如胶质母细胞瘤/多形性胶质母细胞瘤(gbm)、非胶质母细胞瘤脑瘤或脑膜瘤)、胶质瘤(例如室管膜瘤、星形细胞瘤、间变性星形细胞瘤、少突胶质瘤或混合胶质瘤,如少突星形细胞瘤)、宫颈癌、卵巢癌、肝癌(例如肝母细胞瘤、肝细胞癌/肝细胞瘤或肝癌)、膀胱癌(例如尿路上皮癌)、乳腺癌、结肠癌、结肠直肠癌、直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌(例如肾横纹肌瘤)、前列腺癌、外阴癌、阴茎癌、肛门癌(例如肛门鳞状细胞癌)、甲状腺癌、头颈癌(例如鼻咽癌)、皮肤癌(例如黑色素瘤或鳞状细胞癌)、骨肉瘤、尤文氏肉瘤、软骨肉瘤、软组织肉瘤(例如横纹肌肉瘤、纤维肉瘤、卡波西氏肉瘤)、类癌、眼癌(例如视网膜母细胞瘤)、间皮瘤、淋巴细胞性/淋巴母细胞性白血病(例如t细胞谱系和b细胞前体谱系的急性淋巴细胞性/淋巴母细胞性白血病(all)、慢性淋巴母细胞性/淋巴细胞性白血病(cll)、急性骨髓性/成髓细胞性白血病(aml),包括肥大细胞白血病、慢性骨髓性/髓细胞性/成髓细胞性白血病(cml)、毛细胞白血病(hcl)、霍奇金氏病、非霍奇金氏淋巴瘤、慢性骨髓单核细胞性白血病(cmml)、滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlcl)、套细胞淋巴瘤(mcl)、伯基特氏淋巴瘤(bl)、蕈样肉芽肿、塞扎里综合征、皮肤t细胞淋巴瘤、肥大细胞瘤、髓母细胞瘤、肾胚细胞瘤、孤立性浆细胞瘤、骨髓增生异常综合征、慢性和非慢性骨髓增生性病症、中枢神经系统肿瘤、垂体腺瘤、前庭神经鞘瘤、原始神经外胚层肿瘤、室管膜瘤、脉络丛乳头状瘤、真性红细胞增多症、血小板增多症、胆囊癌、特发性骨髓纤维化以及小儿癌症,如小儿肉瘤(例如神经母细胞瘤、横纹肌肉瘤和骨肉瘤)。
[0254]
术语“药学上可接受的”表示指定的载体、媒剂、稀释剂、赋形剂和/或盐通常与构成制剂的其他成分在化学上和/或物理上相容,并与其接受者在生理上相容。
[0255]
如本文所用,“有效量”是指单独或与一种或多种其他活性剂组合赋予受试者治疗效果所需的每种活性剂的量。确定一定量的抗体是否达到治疗效果对本领域的技术人员来说是显而易见的。如本领域技术人员所认识到的,有效量的变化取决于所治疗的具体病况、病况的严重程度、个别患者的参数,包括年龄、身体状况、体型、性别和体重、治疗的持续时间、并行疗法(如果存在)的性质、特定的给药途径以及健康从业者知识和专长范围内的类似因素。这些因素对于本领域的普通技术人员来说是众所周知的,只需进行常规实验就可以解决。
[0256]
抗cldn18抗体
[0257]
本公开提供了抗cldn18抗体,每个抗体包含如表1所示的示例性抗体ab01-ab38中每一个的一个或多个(例如1、2、3、4、5或6个)cdr序列。如本文所用,术语“ab01-ab38”是指38个小鼠单克隆抗体,其具有如表1所示的一对重链可变区和轻链可变区序列。在一个特定
方面,本公开提供了与cldn18.2蛋白和cldn18.1蛋白特异性结合的抗cldn18抗体,如各自包含如表1所示的示例性抗体ab01、ab04和ab36-ab38中每一个的一个或多个(例如1、2、3、4、5或6个)cdr序列的抗体。在另一个特定方面,本公开提供了对cldn18.2蛋白显示出比cldn18.1蛋白更高的结合亲和力的抗cldn18抗体,如各自包含如表1所示的示例性抗体ab02、ab03和ab05-ab35中每一个的一个或多个(例如1、2、3、4、5或6个)cdr序列的抗体。
[0258]
表1.本公开的示例性抗体的可变区的氨基酸序列
[0259]
[0260]
[0261]
[0262]
[0263]
[0264]
[0265]
[0266]
[0267]
[0268]
[0269]
[0270]
[0271]
[0272]
[0273]
[0274][0275]
如本文例如表1中所公开的任何一种示例性抗cldn18抗体的功能变体也在本公开的范围内。此类功能变体在结构上和功能上都与示例性抗体基本上相似。功能变体包含与示例性抗体基本上相同的vh-cdr和vl-cdr。例如,它可以在抗体的总cdr区中仅包含至多3个(例如2个或1个)氨基酸残基变异,并以基本上相似的亲和力结合cldn18.2的相同表位(例如,具有相同顺序的平均荧光强度(mfi)值)。或者或另外,氨基酸残基变异是保守氨基酸残基取代。
[0276]
可以根据本领域普通技术人员已知的改变多肽序列的方法来制备变体,如在汇编此类方法的参考文献中所发现的,例如molecular cloning:a laboratory manual,j.sambrook等人编,第二版,cold spring harbor laboratory press,cold spring harbor,new york,1989或current protocols in molecular biology,f.m.ausubel等人编,john wiley&sons,inc.,new york。氨基酸的保守取代包括在以下组内的氨基酸之间进行的取代:(a)m、i、l、v;(b)f、y、w;(c)k、r、h;(d)a、g;(e)s、t;(f)q、n;和(g)e、d。
[0277]
已知cdr负责抗原结合,然而,已发现并非所有6个cdr都是必不可少的或不可改变的。换句话说,有可能替换或改变或修饰ab01-ab38中的一个或多个cdr,但基本上保留对cldn,特别是对cldn18.2的特异性结合亲和力。
[0278]
在某些实施方式中,本文提供的抗cldn18抗体包含vh-cdr 1,其氨基酸序列选自由以下组成的组:gdy、seq id no:18、36、54、72、90、108、126、144、163、181、198、216、234、252、270、288、206、324、342、360、378、396、414、432、450、468、486、504、522、540、558、576、594、612、630、648、666和684;vh-cdr2,其氨基酸序列选自由以下组成的组:seq id no:20、
38、56、74、92、110、128、146、165、183、200、218、236、254、272、290、308、326、344、362、380、398、416、434、452、470、488、506、524、542、560、578、596、614、632、650、668和686;vh-cdr3,其氨基酸序列选自由以下组成的组:gdy和seq id no:22、40、58、94、112、130、148、167、185、202、220、238、256、274、292、310、328、346、364、382、400、418、436、454、472、490、508、526、544、562、580、598、616、634、652、670和688;和可选的vl-cdr1,其氨基酸序列选自由以下组成的组:seq id no:27、45、63、81、99、117、135、153、172、190、207、225、243、261、279、297、315、333、351、369、387、405、423、441、459、477、495、513、531、549、567、585、603、621、639、657、675和693;vl-cdr2,其氨基酸序列选自由以下组成的组:seq id no:29、47、65、83、101、119、137、155、174、192、209、227、245、263、281、299、317、335、353、371、389、407、425、443、461、479、497、515、533、551、569、587、605、623、641、659、677和695;vl-cdr3,其氨基酸序列选自由以下组成的组:seq id no:31、49、67、85、103、121、139、157、176、194、211、229、247、265、283、301、319、337、355、373、391、409、427、445、463、481、499、517、535、553、571、589、607、625、643、661、679和697,如表1所示。
[0279]
在某些实施方式中,本文提供的抗cldn18抗体进一步包含合适的框架区(fr)序列,只要该抗体可以与cldn18.2特异性结合。表1中提供的cdr序列是从小鼠抗体获得的,但它们可以使用本领域中已知的合适方法如重组技术,移植到任何合适的物种如小鼠、人类、大鼠、兔子等的任何合适的fr序列。
[0280]
在某些实施方式中,本文提供的抗cldn18抗体进一步包含一个轻链恒定结构域和/或一个或多个重链恒定结构域。当需要时,如本文所述的抗cldn18抗体可以包含修饰的恒定区。例如,它可以包含可增强抗体依赖性细胞介导的细胞毒性(adcc)的修饰的恒定区。adcc活性可以使用美国专利第5,500,362号中公开的方法来评估。在某些实施方式中,修饰的恒定区包含如表2所示的seq id no:701-702的氨基酸序列,其中s122d、a213l和i215e被加粗和加下划线。
[0281]
表2.fc区的氨基酸序列.
[0282][0283][0284]
抗体重链和轻链恒定区是本领域众所周知的,例如imgt数据库(www.imgt.org)或www.vbase2.org/vbstat.php.中提供的那些,这两个数据库以引用的方式并入本文中。
[0285]
在一个实施例中,本文所述的抗体是人源化抗体。人源化抗体是指非人类(例如鼠类)抗体的形式,它是含有来源于非人类免疫球蛋白的最小序列的特异性嵌合免疫球蛋白、
免疫球蛋白链或其抗原结合片段。在大多数情况下,人源化抗体是人类免疫球蛋白(受体抗体),其中受体的cdr的残基被具有所需特异性、亲和力和能力的非人类物种如小鼠、大鼠或兔子(供体抗体)的cdr的残基替换。在一些情况下,人类免疫球蛋白的fv框架区(fr)残基被相应的非人类残基替换。此外,人源化抗体可以包含既不在受体抗体中也不在导入的cdr或框架序列中发现的残基,但包括这些残基是为了进一步完善和优化抗体性能。一般来说,人源化抗体将包含基本上所有的至少一个,通常是两个可变结构域,其中所有或基本上所有的cdr区对应于非人类免疫球蛋白的cdr区,所有或基本上所有的fr区是人类免疫球蛋白共有序列的fr区。人源化抗体最佳还包含免疫球蛋白恒定区或结构域(fc),通常是人类免疫球蛋白恒定区或结构域的至少一部分。
[0286]
构建人源化抗体的方法也是本领域众所周知的(参见例如queen等人,proc.natl.acad.sci.usa,86:10029-10033(1989))。在一个实施例中,亲本非人类抗体的vh和v
l
可变区按照本领域已知的方法进行三维分子建模分析。接下来,使用相同的分子建模分析鉴定被预测为对形成正确cdr结构很重要的框架氨基酸残基。同时,使用亲本vh和v
l
序列作为搜索查询从任何抗体基因数据库中鉴定具有与亲本非人类抗体的氨基酸序列同源的氨基酸序列的人类vh和v
l
链。然后选择人类vh和v
l
受体基因。
[0287]
在另一个实施例中,本文所述的抗体是嵌合抗体,其可以包括来自人类抗体的重链恒定区或其一部分和/或轻链恒定区或其一部分。嵌合抗体是指具有来自第一物种的可变区或部分可变区和来自第二物种的恒定区的抗体。通常,在这些嵌合抗体中,轻链和重链的可变区均模拟来源于一种哺乳动物(例如非人类哺乳动物,如小鼠、兔子和大鼠)的抗体的可变区,而恒定部分与来源于另一种哺乳动物如人类的抗体中的序列同源。在一些实施方式中,可以在可变区和/或恒定区中进行氨基酸修饰。
[0288]
如本文所用,“chab01-chab38”是指基于ab01-ab38的嵌合抗体,其中每个抗体包含如表1所示的小鼠重链可变区和如表1所示的小鼠轻链可变区,分别与人类重链恒定区和人类轻链恒定区融合。在某些实施方式中,人类重链恒定区和人类轻链恒定区来自人类igg1。在某些实施方式中,人类重链恒定区和人类轻链恒定区来自野生型人类igg1,其氨基酸序列为seq id no:700,如表2所示。
[0289]
在某些实施方式中,本文提供的抗cldn18抗体可以在本文提供的一个或多个可变区序列中含有一个或多个修饰或取代,但保留对cldn18的特异性结合亲和力。在某些实施方式中,cdr序列、fr序列或可变区序列中的至少一个(或所有)取代是保守取代。
[0290]
可以使用本领域中已知的各种方法来实现这一目的。例如,可以用噬菌体展示技术生成和表达抗体变体(如fab或scfv变体)库,然后针对于对人类cldn18的结合亲和力进行筛选。又例如,计算机软件可用于虚拟模拟抗体与cldn18的结合,并鉴定抗体上形成结合界面的氨基酸残基。此类残基可以在取代中避免,以防止结合亲和力降低,或有针对性地进行取代,以提供更强的结合。
[0291]
在一些实施方式中,抗cldn18抗体可以包含与本文所述和如表1所示的示例性抗体的vh-cdr相比,单独地或共同地具有至少80%(例如85%、90%、95%或98%)序列同一性的重链cdr。或者或另外,抗cldn18抗体可以包含与本文所述和如表1所示的示例性抗体的vl-cdr相比,单独地或共同地具有至少80%(例如85%、90%、95%或98%)序列同一性的轻链cdr。
inc.,mountain view,ca);和非放射性细胞毒性分析(promega,madison,wi))。此外,感兴趣的分子的adcc活性可以在体内评估,例如在如clynes等人,pnas(usa)95:652-656(1998)中所公开的动物模型中。
[0302]
抗体的adcc活性可以通过工程改造抗体的糖基化形式来增强。已报道许多糖基化形式通过增强抗体与效应细胞的fc受体的结合来增强抗体的adcc活性。不同的糖基化形式包括连接至抗体的数种聚糖形式中的任何一种,具有不同的糖类(例如缺乏一种类型的糖,如岩藻糖,或具有高水平的一种类型的糖,如甘露糖),或具有不同的结构(例如各种分支结构,如双触角(两个分支)、三触角(三个分支)或四触角(四个分支)结构)。
[0303]
在某些实施方式中,本文提供的抗cldn18抗体是糖工程化的。“糖工程化”抗体或抗原结合片段与其非糖工程化对应物相比,可能具有增加或减少的糖基化水平、糖基化形式的改变或两者都有。在某些实施方式中,糖工程化抗体比其非工程化对应物表现出增强的adcc活性。在一些实施方式中,增强的adcc活性的特征在于至少10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、65%、70%或75%以上的cldn18.2表达细胞溶解。
[0304]
抗体可以通过本领域已知的方法进行糖工程化,包括对肽主链的任何操作(例如对氨基酸序列的修饰和/或对个别氨基酸的侧链基团的修饰)和/或通过宿主细胞系对翻译后修饰的操作(例如对糖基化模式的修饰)。本领域还描述了通过抗体的糖基化工程改变adcc活性的方法,参见例如weikert等人(1999)nature biotech.,17:116-121;shields r.l.等人(2002),j.biol.chem.,277:26733-26740;shinkawa等人(2003),j biol chem.,278,3466-3473;ferrara等人(2006),biotech.bioeng.,93,851-861;yamane-ohnuki等人(2004),biotech bioeng.,87,614-622;niwa等人(2006),j immunol methods 306,151-160;shinkawa t.等人,j.biol.chem,(2003),278:3466-3473。
[0305]
在一些实施方式中,本文提供的糖基工程化抗体是无岩藻糖基化的(即,不含岩藻糖)。数项研究表明,无岩藻糖基化(即缺乏岩藻糖或非岩藻糖基化)抗体表现出与cldn18.2的结合增加,从而激起更高的adcc活性(shields等人(2002)j.biol.chem.,277:26733-26740;shinkawa等人(2003)j.biol.chem.,278:3466-3473;和欧洲专利申请公开第1176195号)。在一些实施方式中,本文提供的无岩藻糖基化抗体在重链的天冬酰胺297(asn297)处缺少岩藻糖(基于kabat编号)。asn297是在抗体igg1同型的fc区的每个ch2域中发现的保守n-连接糖基化位点(arnold等人,glycobiology and medicine,564:27-43,2005)。
[0306]
在一些实施方式中,本文提供的糖基工程化抗体以高甘露糖糖基化形式(例如甘露糖e5、甘露糖7、8、9聚糖)为特征。已证明高甘露糖糖基化形式可增强adcc活性(yu等人(2012),landes bioscience,mabs 4:4,475-487)。
[0307]
在一些实施方式中,本文提供的抗体在其恒定区内进一步包含一个或多个修饰,所述修饰:a)引入或去除糖基化位点,b)引入游离半胱氨酸残基,c)增强与活化fc受体的结合,和/或d)增强adcc。
[0308]
抗原结合片段
[0309]
本公开还提供了可与cldn18特异性结合的抗原结合片段。各种类型的抗原结合片段是本领域已知的,并且可以基于本文提供的抗cldn18抗体开发,包括例如cdr和可变序列显示在表1中的示例性抗体及其含有修饰或取代的不同变体。
[0310]
在某些实施方式中,本文提供的抗cldn18抗原结合片段是骆驼化单结构域抗体、双功能抗体、单链fv片段(scfv)、scfv二聚体、dsfv、(dsfv)2、dsfv-dsfv'、fv片段、fab、fab'、f(ab')2、ds-双功能抗体、纳米抗体、结构域抗体或二价结构域抗体。
[0311]
可以使用各种技术来生产此类抗原结合片段。说明性方法包括完整抗体的酶促消化(参见例如morimoto等人,journal of biochemical and biophysical methods 24:107-117(1992);和brennan等人,science,229:81(1985))、由宿主细胞如大肠杆菌重组表达(例如对于fab、fv和scfv抗体片段)、如上所述从噬菌体展示库筛选(例如对于scfv)以及将两个fab'-sh片段化学偶联以形成f(ab')2片段(carter等人,bio/technology 10:163-167(1992))。其他生产抗体片段的技术对于熟练的从业者来说是显而易见的。
[0312]
在某些实施方式中,抗原结合片段是scfv。scfv的生成描述于例如wo 93/16185;美国专利第5,571,894号和第5,587,458号中。scfv可以在氨基或羧基端与效应蛋白融合以提供融合蛋白(参见例如antibody engineering,ed.borrebaeck)。
[0313]
缀合物
[0314]
在一些实施方式中,抗cldn18抗体进一步包含缀合物部分。缀合物部分可以与本文提供的抗体连接。缀合物部分是可连接至抗体的非蛋白质或肽部分。考虑可将多种缀合物部分连接至本文提供的抗体(参见例如“conjugate vaccines”,contributions to microbiology and immunology,j.m.cruse和r.e.lewis,jr.(编),carger press,new york,(1989))。缀合物部分可以通过共价结合、亲和力结合、嵌入、配位结合、复合、缔合、掺合或添加等方法连接至抗体。
[0315]
在某些实施方式中,抗cldn18抗体通过连接子与一个或多个缀合物连接。在某些实施方式中,连接子是肼连接子、二硫化物连接子、双官能连接子、二肽连接子、葡萄糖苷酸连接子或硫醚连接子。在某些实施方式中,连接子是溶酶体可裂解的二肽,例如缬氨酸-瓜氨酸(vc)。
[0316]
缀合物部分可以是治疗剂(例如细胞毒性剂)、放射性同位素、可检测标记(例如镧系元素、发光标记、荧光标记或酶-底物标记)、药代动力学修饰部分或纯化部分(如磁珠或纳米粒子)。
[0317]
可检测标记的实施例可以包括荧光标记(例如荧光素、罗丹明(rhodamine)、丹酰(dansyl)、藻红蛋白(phycoerythrin)或德克萨斯红(texas red))、酶-底物标记(例如辣根过氧化物酶、碱性磷酸酶、荧光素酶、葡糖淀粉酶、溶菌酶、糖氧化酶或β-d-半乳糖苷酶)、放射性同位素、发光标记、发色部分、地高辛(digoxigenin)、生物素/抗生物素蛋白、dna分子或检测用金。
[0318]
放射性同位素的实例可以包括
123
i、
124
i、
125
i、
131
i、
35
s、3h、
111
in、
112
in、
14
c、
64
cu、
67
cu、
86
y、
88
y、
90
y、
177
lu、
211
at、
186
re、
188
re、
153
sm、
212
bi、
32
p和其他镧系元素。放射性同位素标记的抗体可用于受体靶向成像实验。
[0319]
在某些实施方式中,药代动力学修饰部分可以是有助于增加抗体半衰期的清除修饰剂。说明性实例包括水溶性聚合物,如peg、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、乙二醇/丙二醇的共聚物等。聚合物可以具有任何分子量,并且可以是支链或非支链的。连接至抗体的聚合物的数量可以变化,并且如果连接超过一个聚合物,它们可以是相同或不同的分子。
[0320]
在某些实施方式中,缀合物部分可以是纯化部分,如磁珠或纳米粒子。
[0321]
抗体-药物缀合物
[0322]
在某些实施方式中,本文提供的缀合物是抗体-药物缀合物(adc),其包含与细胞毒性剂缀合的任何上述抗cldn18抗体。换句话说,缀合物部分包含细胞毒性剂。
[0323]
adc可用于局部递送细胞毒性剂,例如以治疗癌症。这允许将细胞毒性剂靶向递送至肿瘤并在其中进行细胞内积累,这在全身施用这些未缀合的细胞毒性剂可能导致对正常细胞以及试图消除的肿瘤细胞的不可接受的毒性水平的情况下特别有用(baldwin等人,(1986),lancet,603-05;thorpe,(1985),monoclonal antibodies,84;pinchera等人(编),biological and clinical applications,475-506;syrigos和epenetos(1999),anticancer research19:605-614;niculescu-duvaz和springer(1997)adv.drg del.rev.26:151-172;和美国专利第4,975,278号)。
[0324]“细胞毒性剂”可以是任何对癌细胞不利或可以损害或杀死癌细胞的药剂。在某些实施方式中,细胞毒性剂任选地是化学治疗剂(如生长抑制剂、dna烷基化剂、拓扑异构酶抑制剂、微管蛋白结合剂或其他抗癌药物)、毒素或高反应性放射性同位素。
[0325]
细胞毒性剂的实例包括大分子细菌毒素和植物毒素,如白喉毒素、外毒素a链(来自绿脓杆菌)、蓖麻毒素、相思子毒素、莫迪素(modeccin)、α-八叠球菌素(alpha-sarcin)、油桐蛋白质、香石竹毒蛋白质(dianthin proteins)、洋商陆蛋白质(phytolaca americana proteins)(pari、papii和pap-s)、苦瓜抑制剂、麻疯树毒蛋白、巴豆毒素、肥阜草抑制剂、白树素、局限曲菌素、酚霉素(phenomycin)、伊诺霉素(enomycin)和单端孢霉烯(参见例如wo 93/21232)。此类大分子毒素可以使用本领域已知的方法与本文提供的抗体缀合,如vitetta等人(1987)science,238:1098中所述。
[0326]
细胞毒性剂也可以是小分子毒素和化学治疗药物,如格尔德霉素(geldanamycin)(mandler等人(2000)jour.of the nat.cancer inst.92(19):1573-1581;mandler等人(2002)bioconjugate chem.13:786-791)、类美登素(maytansinoids)(ep 1391213;liu等人,(1996)proc.natl.acad.sci.usa 93:8618-8623)、卡奇霉素(calicheamicin)(lode等人(1998)cancer res.58:2928;hinman等人(1993)cancer res.53:3336-3342)、紫杉醇(taxol)、细胞松弛素b(cytochalasin b)、短杆菌肽d(gramicidin d)、溴化乙锭(ethidium bromide)、吐根素(emetine)、丝裂霉素(mitomycin)、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱(vincristine)、长春花碱(vinblastine)、长春地辛(vindesine)、秋水仙碱(colchicin)、阿霉素(doxorubicin)、柔红霉素(daunorubicin)、二羟基炭疽菌素二酮(dihydroxy anthracin dione)、米托蒽醌(mitoxantrone)、光神霉素(mithramycin)、放线菌素d(actinomycin d)、1-去氢睪固酮、糖皮质激素、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)、嘌呤霉素(puromycin)及其类似物、抗代谢物(例如甲氨蝶呤(methotrexate)、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷(cytarabine)、5-氟尿嘧啶、达卡巴嗪(decarbazine))、烷基化剂(例如甲氮芥(mechlorethamine)、塞替哌(thioepa)苯丁酸氮芥(chlorambucil)、美法仑(melphalan)、卡莫司汀(carmustine)(bsnu)和洛莫司汀(lomustine)(ccnu)、环硫磷酰胺、白消安(busulfan)、二溴甘露醇(dibromomannitol)、链佐霉素(streptozotocin)、丝裂霉素c(mitomycin c)和顺二氯二胺铂(ii)(ddp)(顺铂(cisplatin))、蒽环霉素
chemicals,molecular probes,inc.;brinkley,1992,bioconjugate chem.3:2;garman,1997,non-radioactive labelling:a practical approach,academic press,london;means(1990)bioconjugate chem.1:2;hermanson,g.in bioconjugate techniques(1996)academic press,san diego,pp.40-55,643-671)。
[0333]
细胞毒性剂或抗体可以在缀合形成adc之前与连接试剂反应。例如,细胞毒性剂的n-羟基琥珀酰亚胺基酯(nhs)可执行、分离、纯化和/或表征,或其可原位形成并与抗体的亲核基团反应。
[0334]
在一些实施方式中,细胞毒性剂和抗体可以通过原位活化和反应连接以在一个步骤中形成adc。在另一个实施例中,抗体可以与生物素缀合,然后与第二缀合物间接缀合,该第二缀合物与抗生物素蛋白缀合。
[0335]
在某些实施方式中,缀合物部分随机地连接至抗体中特定类型的表面暴露的氨基酸残基,例如半胱氨酸残基或赖氨酸残基。
[0336]
在某些实施方式中,缀合物部分连接至具体定义的位点,以提供在药物与抗体比(dar)和连接位点方面具有高同质性和批次间一致性的adc群体。在某些实施方式中,缀合物部分通过天然氨基酸、非天然氨基酸、短肽标签或asn297聚糖连接至抗体分子中具体定义的位点。例如,缀合可以在表位结合部分以外的特定位点。
[0337]
位点特异性连接可通过用药物部分可缀合的氨基酸如半胱氨酸取代抗体特定位点处的原生氨基酸,或在抗体特定位点之前/之后引入药物部分可缀合的氨基酸来实现(参见stimmel等人(2000),jbc,275(39):30445-30450;junutula等人(2008),nature biotechnology,26(8):925-932;以及wo2006/065533)。或者,位点特异性缀合可以如axup等人((2012),proc natl acad sci usa.109(40):16101-16116)所描述,通过将抗体工程改造成在其重链和/或轻链中的特定位点处含有非天然氨基酸(例如对乙酰基苯丙氨酸(pacf)、n6-((2-叠氮基乙氧基)羰基)-l-赖氨酸、对叠氮基甲基-l-苯丙氨酸(pamf)和硒半胱氨酸(sec))来实现,其中所述非天然氨基酸提供可以设计正交化学以连接连接子试剂和药物的额外优势。可用于两种上述位点特异性缀合方法中的示例性特定位点(例如轻链v205、重链a114、s239、h274、q295、s396等)在许多现有技术中有描述,例如strop等人(2013),chemistry&biology,20,161-167;qun zhou(2017),biomedicines,5,64;dimasi等人(2017),mol.pharm.,14,1501-1516;wo2013/093809和wo2011/005481。另一种位点特异性adc缀合方法是聚糖介导的缀合,其中药物-连接子可以与位于ch2结构域中的asn297聚糖(如岩藻糖、半乳糖、n-乙酰半乳糖胺、n-乙酰葡糖胺、唾液酸)缀合,而非将相对疏水的细胞毒性剂偶联至抗体的氨基酸主链中。也曾尝试通过特定位点(例如n末端或c末端区域中的位点)将独特短肽标签(如llqg、lpetg、lcxpxr)引入抗体中,接着使肽标签中的特定氨基酸官能化并与药物-连接子偶联(strop等人(2013),chemistry&biology,20,161-167;beerli等人(2015),plos one,10,e0131177;wu等人(2009),proc.natl.acad.sci.106,3000-3005;rabuka(2012),nat.protoc.7,1052-1067)。
[0338]
多核苷酸和重组方法
[0339]
本公开提供了分离的多核苷酸,其编码本文提供的抗cldn18抗体。
[0340]
如本文所用,术语“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非特别限定,否则该术语涵盖含有天然核苷酸的已知类似物的多
核苷酸,其具有与参考核酸类似的结合特性,并以类似于天然存在的核苷酸的方式进行代谢。除非另有说明,否则特定的多核苷酸序列还隐含地涵盖其保守修饰的变体(例如简并密码子取代)、等位基因、直系同源物、snp和互补序列以及明确指出的序列。具体而言,简并密码子取代可以通过产生一个或多个选定(或所有)密码子的第三位被混合碱基和/或脱氧肌苷残基取代的序列来实现(参见batzer等人,nucleic acid res.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);和rossolini等人,mol.cell.probes 8:91-98(1994))。
[0341]
在某些实施方式中,分离的多核苷酸包含一个或多个如表3所示的核苷酸序列,和/或其具有至少80%(例如至少85%、88%、90%、92%、93%、94%、95%、96%、97%、98%或99%)序列同一性的同源序列,和/或其仅具有简并取代的变体,并编码本文提供的示例性抗体的可变区。编码单克隆抗体的dna易于使用常规程序分离和测序(例如,通过使用能够与编码抗体重链和轻链的基因特异性结合的寡核苷酸探针)。编码dna也可以通过合成方法获得。
[0342]
表3.示例性抗体的可变区的多核苷酸
[0343]
[0344]
[0345]
[0346]
[0347]
[0348]
[0349]
[0350]
[0351]
[0352]
[0353]
[0354]
[0355]
[0356]
[0357]
[0358]
[0359]
[0360][0361]
编码抗cldn18抗体的分离的多核苷酸(例如包括如表3所示的序列)可以使用本领域已知的重组技术插入载体中,用于进一步克隆(dna的扩增)或表达。许多载体是可用的。载体组分一般包括但不限于以下一种或多种:信号序列、复制起点、一个或多个标记基因、增强子元件、启动子(例如sv40、cmv、ef-1α)和转录终止序列。载体还可以包括有助于其进入细胞的材料,包括但不限于病毒颗粒、脂质体或蛋白质包膜。
[0362]
本公开提供了载体(例如克隆载体或表达载体),其含有本文提供的编码抗体的核酸序列、可操作地连接至核酸序列的至少一个启动子(例如sv40、cmv、ef-1α)以及至少一个选择标记。载体的实例包括但不限于质粒;噬菌粒;粘粒和人工染色体,如酵母人工染色体(yac)、细菌人工染色体(bac)或p1衍生的人工染色体(pac);噬菌体,如λ噬菌体或m13噬菌体;和动物病毒。用作载体的动物病毒的类别包括逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如单纯疱疹病毒)、痘病毒、杆状病毒、乳头状瘤病毒和乳多空病毒(例如sv40)。示例性质粒包括pcdna3.3、pmd18-t、poptivec、pcmv、pegfp、pires、pqd-hyg-gseu、palter、pbad、pcdna、pcal、pl、pet、pgemex、pgex、pci、pegft、psv2、pfuse、pvitro、pvivo、pmal、pmono、pselect、puno、pduo、psg5l、pbabe、pwpxl、pbi、p15tv-l、ppro18、ptd、prs10、plexa、pact2.2、pcmv-script.rtm.、pcdm8、pcdna1.1/amp、pcdna3.1、prc/rsv、pcr 2.1、pef-1、pfb、psg5、pxt1、pcdef3、psvsport和pef-bos等。
[0363]
包含编码抗体或抗原结合片段的多核苷酸序列的载体可以被引入宿主细胞中进行克隆或基因表达。用于克隆或表达本文载体中的dna的合适宿主细胞是上述原核生物、酵母或高等真核生物细胞。用于此目的的合适原核生物包括真细菌,如革兰氏阴性(gram-negative)或革兰氏阳性(gram-positive)生物,例如肠内菌科(enterobacteriaceae),如埃希氏菌属(escherichia),例如大肠杆菌;肠杆菌属(enterobacter);欧文氏菌属(erwinia);克雷伯氏菌属(klebsiella);变形杆菌属(proteus);沙门氏菌属
(salmonella),例如鼠伤寒沙门氏菌(salmonella typhimurium);沙雷氏菌属(serratia),例如粘质沙雷氏菌(serratia marcescans);和志贺杆菌属(shigella),以及芽孢杆菌属(bacilli),如枯草芽孢杆菌(b.subtilis)和地衣芽孢杆菌(b.licheniformis);假单胞菌属(pseudomonas),如绿脓杆菌;和链霉菌属(streptomyces)。
[0364]
除原核生物外,真核微生物如丝状真菌或酵母也是抗cldn18抗体编码载体的合适克隆或表达宿主。在低等真核宿主微生物中,酿酒酵母(saccharomyces cerevisiae)或普通面包酵母是最常用的。然而,多种其他属、种和菌株在本文中是常用且有用的,如粟酒裂殖酵母(schizosaccharomyces pombe);克鲁维酵母属(kluyveromyces)宿主,例如乳酸克鲁维酵母(k.lactis)、脆壁克鲁维酵母(k.fragilis)(atcc 12,424)、保加利亚克鲁维酵母(k.bulgaricus)(atcc 16,045)、威克克鲁维酵母(k.wickeramii)(atcc 24,178)、克鲁维雄酵母(k.waltii)(atcc 56,500)、果蝇克鲁维酵母(k.drosophilarum)(atcc 36,906)、耐热克鲁维酵母(k.thermotolerans)和马克斯克鲁维酵母(k.marxianus);耶氏酵母属(yarrowia)(ep 402,226);毕赤酵母(pichia pastoris)(ep 183,070);假丝酵母属(candida);瑞氏木霉(trichoderma reesia)(ep 244,234);粗糙脉孢菌(neurospora crassa);许旺酵母属(schwanniomyces),如西方许旺酵母(schwanniomyces occidentalis);和丝状真菌,例如脉孢菌属(neurospora)、青霉菌属(penicillium)、弯颈霉属(tolypocladium)和曲霉属(aspergillus)宿主,如构巢曲霉(a.nidulans)和黑曲霉(a.niger)。
[0365]
这里提供的用于表达抗体或抗原片段的合适宿主细胞来源于多细胞生物。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定出多种杆状病毒株和变体以及来自如下宿主的相应容许的昆虫宿主细胞:草地贪夜蛾(spodoptera frugiperda)(毛虫)、埃及伊蚊(aedes aegypti)(蚊子)、白纹伊蚊(aedes albopictus)(蚊子)、黑腹果蝇(drosophila melanogaster)(果蝇)和家蚕(bombyx mori)。多种用于转染的病毒株是可公开获得的,例如苜蓿银纹夜蛾(autographa californica)npv的l-1变体和家蚕npv的bm-5病毒株,并且此类病毒可以根据本发明用作本文中的病毒,特别是用于转染草地贪夜蛾细胞。棉花、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的植物细胞培养物也可以用作宿主。
[0366]
然而,人们对脊椎动物细胞的兴趣最大,脊椎动物细胞的培养繁殖(组织培养)已成为常规程序。有用的哺乳动物宿主细胞系的实例是sv40转化的猴肾cv1细胞系(cos-7,atcc crl 1651);人胚肾细胞系(293或293细胞亚克隆以在悬浮培养中生长,graham等人,j.gen virol.36:59(1977));幼仓鼠肾细胞(bhk,atcc ccl 10);小鼠骨髓瘤细胞系(ns0,galfr
è
和milstein(1981),methods in enzymology,73:3-46;sp2/0-ag14,atcc crl-1581);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等人,proc.natl.acad.sci.usa77:4216(1980));小鼠支持细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1 atcc ccl 70);非洲绿猴肾细胞(vero-76,atcc crl-1587);人子宫颈癌细胞(hela,atcc ccl 2);犬肾细胞(mdck,atcc ccl 34);布法罗大鼠肝细胞(brl3a,atcc crl 1442);人肺细胞(w138,atcc ccl 75);人肝细胞(hep g2,hb 8065);小鼠乳腺肿瘤(mmt 060562,atcc ccl51);tri细胞(mather等人,annals n.y.acad.sci.383:44-68(1982));mrc 5细胞;fs4细胞;以及人肝癌细胞系(hep g2)。在一些优选的实施方式中,宿主细胞是哺乳动物的培养细胞,如cho细胞、bhk细胞或ns0细胞。
[0367]
在一些实施方式中,宿主细胞能够产生糖工程化抗体。例如,宿主细胞系可在翻译后修饰期间提供所需的糖基化机制。此类宿主细胞系的实例包括但不限于天然或通过基因工程改变(增加或减小)糖基化相关酶的活性的细胞系,所述糖基化相关酶如氨基葡萄糖转移酶(例如β(1,4)-n-乙酰氨基葡萄糖转移酶iii(gntiii))、糖基转移酶(例如β(1,4)-半乳糖基转移酶(gt))、唾液酸转移酶(例如α(2,3)-唾液酸转移酶(st))、甘露糖苷酶(例如α-甘露糖苷酶ii(manii)、岩藻糖基转移酶(例如α-1,6-岩藻糖基转移酶基因(fut8)、(l,3)岩藻糖基转移酶)、原核gdp-6-脱氧-d-来苏-4-己酮糖还原酶(rmd)、gdp-岩藻糖转运蛋白(gft)。
[0368]
在一些实施方式中,宿主细胞的特征在于缺乏功能性fut8、过度表达异源gntiii、表达原核gdp-6-脱氧-d-来苏-4-己酮糖还原酶(rmd)或缺乏功能性gft。fut8基因敲除的宿主细胞系缺乏岩藻糖基化,并产生无岩藻糖基化抗体。宿主细胞系中gntiii的过度表达(参见例如roche的glycart technology)使得形成等分、非岩藻糖基化的抗体糖基化形式。rmd的表达(例如在来自probiogen ag的系统中)抑制岩藻糖从头生物合成,因此,由此类宿主细胞系产生的抗体也表现出减少的岩藻糖基化。cho细胞系中的gft基因敲除(参见例如beijing mabworks biotech的技术)阻断岩藻糖从头合成和岩藻糖补救生物合成路径,导致岩藻糖基化减少。
[0369]
用上述表达或克隆载体转化宿主细胞以产生抗cldn18抗体,并在常规营养培养基中进行培养,所述培养基经适当修饰以诱导启动子、选择转化体或扩增编码所需序列的基因。在另一个实施方式中,抗体可通过本领域中已知的同源重组产生。
[0370]
用于产生本文提供的抗体的宿主细胞可以在多种培养基中培养。市售培养基,如ham's f10(sigma)、最小必需培养基(mem)(sigma)、rpmi-1640(sigma)以及达尔伯克氏改良伊格尔氏培养基(dulbecco's modified eagle's medium,dmem,sigma)适用于培养宿主细胞。另外,ham等人,meth.enz.58:44(1979);barnes等人,anal.biochem.102:255(1980);美国专利第4,767,704号、第4,657,866号、第4,927,762号、第4,560,655号或第5,122,469号;wo 90/03430;wo 87/00195;或美国再颁专利30,985中所述的任何培养基都可以用作宿主细胞的培养基。这些培养基中的任何一种都可以根据需要补充激素和/或其他生长因子(如胰岛素、转铁蛋白或表皮生长因子)、盐类(如氯化钠、钙盐、镁盐和磷酸盐)、缓冲液(如hepes)、核苷酸(如腺苷和胸苷)、抗生素(如gentamycin
tm
药物)、微量元素(定义为通常以微摩尔范围内的最终浓度存在的无机化合物)和葡萄糖或等效能量源。也可包括本领域技术人员已知的适当浓度的任何其他必需的补充剂。培养条件,如温度、ph等,是先前与选择用于表达的宿主细胞一起使用的条件,并且对普通技术人员来说将是显而易见的。
[0371]
当使用重组技术时,抗体可以在细胞内、在周质空间中产生,或直接分泌至培养基中。如果抗体在细胞内产生,则作为第一步,例如通过离心或超滤去除颗粒碎片(宿主细胞或溶解的片段)。carter等人,bio/technology 10:163-167(1992)描述了一种用于分离分泌到大肠杆菌周质空间的抗体的程序。简而言之,在乙酸钠(ph 3.5)、edta和苯甲基磺酰氟(pmsf)的存在下,在约30分钟内将细胞糊解冻。细胞碎片可以通过离心去除。当抗体分泌到培养基中时,来自此类表达系统的上清液一般首先使用市售的蛋白质浓缩过滤器,例如amicon或millipore pellicon超滤装置进行浓缩。蛋白酶抑制剂如pmsf可以包括在任何前述步骤中,以抑制蛋白水解,并且可以包括抗生素以防止外来污染物的生长。
[0372]
由细胞制备的抗cldn18抗体可以使用例如羟基磷灰石色谱、凝胶电泳、透析、deae-纤维素离子交换色谱、硫酸铵沉淀、盐析以及亲和色谱纯化,其中亲和色谱是优选的纯化技术。
[0373]
药物组合物
[0374]
本公开进一步提供了药物组合物,其包含本文提供的抗cldn18抗体或其抗原结合片段、嵌合抗原受体、多核苷酸、载体或修饰的免疫细胞以及一种或多种药学上可接受的载体。
[0375]
用于本文公开的药物组合物的药学上可接受的载体可包括例如药学上可接受的液体、凝胶或固体载体、水性媒剂、非水性媒剂、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、麻醉剂、悬浮/分散剂、螯合剂(sequestering/chelating agents)、稀释剂、佐剂、赋形剂或无毒辅助物质、本领域中已知的其他组分或其各种组合。合适的组分可包括例如抗氧化剂、填充剂、粘合剂、崩解剂、缓冲剂、防腐剂、润滑剂、调味剂、增稠剂、着色剂、乳化剂或稳定剂如糖和环糊精。合适的抗氧化剂可包括例如甲硫氨酸、抗坏血酸、edta、硫代硫酸钠、铂、过氧化氢酶、柠檬酸、半胱氨酸、硫代甘油、硫代乙醇酸、硫代山梨糖醇、丁基化羟基苯甲醚、丁基化羟基甲苯和/或没食子酸丙酯。如本文所公开,在包含如本文所提供的抗体或抗原结合片段和缀合物的组合物中包含一种或多种抗氧化剂如甲硫氨酸,降低抗体或抗原结合片段的氧化。这种氧化的减少防止或减少结合亲和力的损失,从而提高抗体的稳定性并最大限度地延长保质期。因此,在某些实施方式中,提供了包含一种或多种如本文所公开的抗体和一种或多种抗氧化剂如甲硫氨酸的组合物。进一步提供了通过将抗体或抗原结合片段与一种或多种抗氧化剂如甲硫氨酸混合来防止如本文所提供的抗体或抗原结合片段的氧化、延长其保质期和/或提高其功效的方法。
[0376]
药物组合物可以是液体溶液、悬浮液、乳液、丸剂、胶囊、片剂、持续释放制剂或粉末。口服制剂可包括标准载体,如药用级甘露糖醇、乳糖、淀粉、硬脂酸镁、聚乙烯吡咯烷酮、糖精钠、纤维素、碳酸镁等。
[0377]
在某些实施方式中,药物组合物被配制成可注射组合物。可注射的药物组合物可以任何常规形式制备,例如液体溶液、悬浮液、乳液或适合生成液体溶液、悬浮液或乳液的固体形式。注射用制剂可包括准备用于注射的无菌和/或无热原质溶液;准备在临使用前与溶剂组合的无菌干燥可溶性产品,如冻干粉,包括皮下注射片剂;准备用于注射的无菌悬浮液;准备在临使用前与媒剂组合的无菌干燥不溶性产品;以及无菌和/或无热原质乳液。溶液可以是水性或非水性的。
[0378]
在某些实施方式中,单位剂量的肠胃外制剂被包装在安瓿、小瓶或带针头的注射器中。所有用于肠胃外施用的制剂都应该是无菌且无热原质的,正如本领域中已知和实践的那样。
[0379]
在某些实施方式中,无菌冻干粉是通过将如本文所公开的抗体或抗原结合片段溶解于合适的溶剂中来制备。溶剂可含有改善粉末或由粉末制备的重构溶液的稳定性或其他药理学组分的赋形剂。可使用的赋形剂包括但不限于水、右旋糖、山梨糖醇、果糖、玉米糖浆、木糖醇、甘油、葡萄糖、蔗糖或其他合适的试剂。溶剂可含有缓冲剂,如柠檬酸盐、磷酸钠或磷酸钾或本领域技术人员已知的其他此类缓冲剂,在一个实施方式中,约为中性ph。随后在本领域技术人员已知的标准条件下对溶液进行无菌过滤,然后进行冻干,得到所需制剂。
在一个实施方式中,将所得溶液分配到小瓶中进行冻干。每个小瓶可以含有单剂量或多剂量的抗cldn18抗体或其组合物。用高于一个剂量或一组剂量所需的少量(例如约10%)过量填充小瓶是可以接受的,以便于准确地抽取样品和准确地给药。冻干粉可以在适当的条件下储存,例如在约4℃至室温下储存。
[0380]
用注射用水重构冻干粉提供了用于肠胃外施用的制剂。在一个实施方式中,为了重构,将无菌和/或无热原质水或其他合适的液体载体添加至冻干粉中。精确的量取决于给定的所选治疗方法,并且可以凭经验确定。如本文所述的抗体以及编码核酸或核酸组、包含此类的载体或包含所述载体的宿主细胞可以与药学上可接受的载体(赋形剂)混合,形成用于治疗目标疾病的药物组合物。“可接受的”意指载体必须与组合物的活性成分相容(并且优选地,能够稳定活性成分)并且对待治疗受试者无害。药学上可接受的赋形剂(载体)包括缓冲剂,这在本领域是众所周知的。参见例如remington:the science and practice of pharmacy 20th ed.(2000)lippincott williams and wilkins,ed.k.e.hoover。
[0381]
在一些实施例中,本文所述的药物组合物包含含有抗体(或编码核酸)的脂质体,其可以通过本领域已知的方法制备,如epstein等人,proc.natl.acad.sci.usa 82:3688(1985);hwang等人,proc.natl.acad.sci.usa 77:4030(1980);以及美国专利第4,485,045号和第4,544,545号中所述。具有增强循环时间的脂质体公开于美国专利第5,013,556号中。特别有用的脂质体可以通过反相蒸发法用包含磷脂酰胆碱、胆固醇和peg衍生的磷脂酰乙醇胺(peg-pe)的脂质组合物产生。脂质体通过规定孔径的过滤器被挤出,产生具有所需直径的脂质体。
[0382]
抗体或编码核酸也可以包埋在例如通过凝聚技术或界面聚合技术制备的微胶囊中,例如羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊,分别在胶体药物递送系统(例如脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊)或粗乳液中。此类技术在本领域中是已知的,参见例如remington,the science and practice of pharmacy 20th ed.mack publishing(2000)。
[0383]
在其他实施例中,本文所述的药物组合物可以配制成持续释放的形式。持续释放制剂的合适实例包括含有抗体的固体疏水聚合物的半透性基质,所述基质是成型制品的形式,例如薄膜或微胶囊。持续释放基质的实例包括聚酯、水凝胶(例如聚(甲基丙烯酸2-羟乙酯)或聚(乙烯醇))、聚丙交酯(美国专利第3,773,919号)、l-谷氨酸和7乙基-l-谷氨酸的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物如lupron depot
tm
(由乳酸-乙醇酸共聚物和乙酸亮丙瑞林构成的可注射微球)、乙酸异丁酸蔗糖酯以及聚d-(-)-3-羟基丁酸。
[0384]
用于体内施用的药物组合物必须是无菌的。这很容易通过例如通过无菌过滤膜过滤来实现。治疗性抗体组合物通常放置在具有无菌进入端口的容器中,例如静脉输液袋或具有可被皮下注射针刺穿的塞子的小瓶。
[0385]
本文所述的药物组合物可以是用于口服、肠胃外或直肠施用或通过吸入或吹入施用的单位剂型,如片剂、丸剂、胶囊、散剂、颗粒、溶液或悬浮液或栓剂。
[0386]
在某些实施方式中,本公开的药物组合物进一步包含一种或多种治疗剂。在某些实施方式中,一种或多种治疗剂选自由以下组成的组:氨柔比星、甲磺酸阿帕替尼、阿曲生坦巴他布林、骨化三醇、卡培他滨、西仑吉肽、达沙替尼、地卡他尼、艾多卡林、恩扎妥林、埃
罗替尼、依维莫司、吉马替康、棉籽酚伊匹单抗、洛那法尼、硫蒽酮、纽拉迪、诺拉曲特、奥利默森、奥拉帕尼、奥法木单抗、奥戈伏单抗、帕尼单抗、帕唑帕尼鲁比替康、瑞格非尼他仑帕奈、喃氟啶、坦罗莫司、替米利芬、粉防己碱、替西木单抗、曲美替尼、曲贝替定、凡德他尼、维特斯潘、扎木单抗、唑仑膦酸盐、组氨瑞林、阿扎胞苷、右雷佐生、阿仑单抗、来那度胺、吉妥珠单抗、酮康唑、氮芥、替伊莫单抗、地西他滨、六甲蜜胺、贝沙罗汀、托西莫单抗、三氧化二砷、依替膦酸盐、环孢素、欧文氏菌天冬酰胺酶、表柔比星、奥沙利铂、抗pd1抗体、抗pdl1抗体、抗her2抗体、抗her2 adc、5-氟尿嘧啶和锶89。
[0387]
治疗性应用
[0388]
本公开还提供了治疗方法,其包括:向有需要的受试者施用治疗有效量的本文提供的抗体或其抗原结合片段、嵌合抗原受体、多核苷酸、载体或修饰的免疫细胞,从而治疗或预防cldn18.2相关病况或病症。在一些实施方式中,cldn18.2相关病况或病症是癌症,任选地,所述癌症的特征在于表达或过度表达cldn18.2。表达或过度表达可以在诊断或预后分析中通过评估来自受试者的生物样品(如来源于癌细胞或组织的样品,或肿瘤浸润性免疫细胞)中cldn18.2的增加水平来确定。可以使用各种方法。例如,诊断或预后分析可用于评估存在于细胞表面上的cldn18.2的表达水平(例如通过免疫组织化学分析;ihc)。或者或另外,可以测量细胞中cldn编码核酸的水平,例如通过荧光原位杂交(fish;参见1998年10月公开的wo98/45479)、dna印迹或聚合酶链反应(pcr)技术,如实时定量pcr(rt-pcr)methods 132:73-80(1990))。除了上述分析之外,熟练的从业人员还可以使用各种体内分析。例如,可以将患者体内的细胞暴露于抗体,所述抗体任选地用可检测标记(例如放射性同位素)标记,并且可以评估抗体与患者体内细胞的结合,例如通过外部扫描放射性或通过分析从先前暴露于抗体的患者取得的活组织检查。在一些实施方式中,cldn18.2相关病况或病症是癌症,其中所述癌症的特征在于表达cldn18.2的水平低于每个细胞10000个抗体结合位点,低于每个细胞9000个抗体结合位点,低于每个细胞8000个抗体结合位点,低于每个细胞7000个抗体结合位点,低于每个细胞6000个抗体结合位点,低于每个细胞5000个抗体结合位点,或低于每个细胞4000个抗体结合位点。
[0389]
在一些实施方式中,cldn18.2相关病况或病症是癌症,其中所述癌症选自由以下组成的组:肺癌(例如小细胞肺癌、非小细胞肺癌(nsclc)、肺腺癌或肺鳞状细胞癌)、胃癌(例如胃肠癌)、胰腺癌、食道癌、肝癌(例如肝细胞癌/肝细胞瘤)、鳞状细胞癌、腹膜癌、脑瘤(例如胶质母细胞瘤/多形性胶质母细胞瘤(gbm)、非胶质母细胞瘤脑瘤或脑膜瘤)、胶质瘤(例如室管膜瘤、星形细胞瘤、间变性星形细胞瘤、少突胶质瘤或混合胶质瘤,如少突星形细胞瘤)、宫颈癌、卵巢癌、肝癌(例如肝母细胞瘤、肝细胞癌/肝细胞瘤或肝癌)、膀胱癌(例如尿路上皮癌)、乳腺癌、结肠癌、结肠直肠癌、直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌(例如肾横纹肌瘤)、前列腺癌、外阴癌、阴茎癌、肛门癌(例如肛门鳞状细胞癌)、甲状腺癌、头颈癌(例如鼻咽癌)、皮肤癌(例如黑色素瘤或鳞状细胞癌)、骨肉瘤、尤文氏肉瘤、软骨肉瘤、软组织肉瘤(例如横纹肌肉瘤、纤维肉瘤、卡波西氏肉瘤)、类癌、眼癌(例如视网膜母细胞瘤)、间皮瘤、淋巴细胞性/淋巴母细胞性白血病(例如t细胞谱系和b细胞前体谱系的急性淋巴细胞性/淋巴母细胞性白血病(all)、慢性淋巴母细胞性/淋巴细胞性白血病(cll)、急性骨髓性/成髓细胞性白血病(aml),包括肥大细胞白血病、慢性骨髓性/髓细胞性/成髓细胞性白血病(cml)、毛细胞白血病(hcl)、霍奇金氏病、非霍奇金氏淋巴瘤、慢性骨髓单核细
胞性白血病(cmml)、滤泡性淋巴瘤(fl)、弥漫性大b细胞淋巴瘤(dlcl)、套细胞淋巴瘤(mcl)、伯基特氏淋巴瘤(bl)、蕈样肉芽肿、塞扎里综合征、皮肤t细胞淋巴瘤、肥大细胞瘤、髓母细胞瘤、肾胚细胞瘤、孤立性浆细胞瘤、骨髓增生异常综合征、慢性和非慢性骨髓增生性病症、中枢神经系统肿瘤、垂体腺瘤、前庭神经鞘瘤、原始神经外胚层肿瘤、室管膜瘤、脉络丛乳头状瘤、真性红细胞增多症、血小板增多症、胆囊癌、特发性骨髓纤维化以及小儿癌症,如小儿肉瘤(例如神经母细胞瘤、横纹肌肉瘤和骨肉瘤)。在某些实施方式中,癌症选自由以下组成的组:胃癌、胰腺癌、食道癌、肺癌、胆囊癌、结肠直肠癌和肝癌。
[0390]
本文提供的抗体或其抗原结合片段、嵌合抗原受体、多核苷酸、载体或修饰的免疫细胞的治疗有效量将取决于本领域已知的各种因素,例如受试者的体重、年龄、既往病史、目前用药、健康状况和交叉反应、过敏、敏感和不良副作用的可能性,以及施用途径和疾病发展的程度。本领域普通技术人员(例如医生或兽医)可如这些和其他情况或要求所指示按比例减少或增加剂量。
[0391]
本文公开的抗体可通过本领域已知的任何途径施用,例如肠胃外(例如皮下、腹膜内、静脉内(包括静脉内输注)、肌肉内或皮内注射)或非肠胃外(例如口服、鼻内、眼内、舌下、直肠或局部)途径。
[0392]
本公开进一步提供了使用抗cldn18抗体的方法。
[0393]
在一些实施方式中,本公开提供了检测样品中cldn18.2的存在或量的方法,其包括使样品与抗体接触,并确定样品中cldn18.2的存在或量。
[0394]
在一些实施方式中,本公开提供了诊断受试者的cldn18.2相关疾病或病况的方法,其包括:a)使从受试者获得的样品与本文提供的抗体接触;b)确定样品中cldn18.2的存在或量;c)将cldn18.2的存在或量与受试者的cldn18.2相关疾病或病况的存在或状态相关联。
[0395]
在一些实施方式中,本公开提供了试剂盒,其包含本文提供的抗体,该抗体任选地与可检测部分缀合。试剂盒可用于检测cldn18.2或诊断cldn18.2相关疾病。
[0396]
在一些实施方式中,本公开还提供了本文提供的抗体在制备用于治疗将受益于调节受试者cldn18.2表达的疾病或病况的药物中的用途,在制备用于诊断/预示cldn18.2相关疾病或病况的诊断/预后试剂中的用途。为了实施本文公开的方法,可以通过合适的途径向需要治疗的受试者(例如人类)施用有效量的本文所述的药物组合物,如静脉内施用,例如推注或在一段时间内连续输注,通过肌肉内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、口服、吸入或局部途径。用于液体制剂的市售雾化器,包括喷射式雾化器和超声波雾化器可用于给药。液体制剂可以直接雾化,冻干粉可以在重构后雾化。或者,如本文所述的抗体可以使用碳氟化合物制剂和计量吸入器气溶胶化,或以冻干和研磨的粉末形式吸入。
[0397]
待通过本文所述的方法治疗的受试者可以是哺乳动物,更优选地是人。哺乳动物包括但不限于农场动物、竞技动物、宠物、灵长类动物、马、狗、猫、小鼠和大鼠。需要治疗的人类受试者可以是患有、有风险罹患或怀疑患有目标疾病/病症(如癌症或免疫病症,如自身免疫性疾病)的人类患者。
[0398]
患有目标癌症的受试者可以通过常规医学检查,如实验室测试、器官功能测试、ct扫描或超声波检查来鉴定。在一些实施方式中,待通过本文所述的方法治疗的受试者可以是已经或正在接受抗癌疗法(例如化学疗法、放射疗法、免疫疗法或手术)的人类癌症患者。
[0399]
对目标疾病/病症的治疗功效可以通过本领域中众所周知的方法进行评估。
[0400]
组合疗法
[0401]
本文所述的抗cldn18抗体可以与针对目标疾病如癌症的其他类型的疗法结合使用。本文所述的抗cldn18抗体可以与抗癌疗法,例如本领域已知的那些抗癌疗法组合。其他抗癌疗法包括化学疗法、手术、放射线、免疫疗法、基因疗法等。
[0402]
或者,本公开的治疗可以与化疗剂组合,例如嘧啶类似物(5-氟尿嘧啶、氟尿苷、卡培他滨、吉西他滨和阿糖胞苷)、嘌呤类似物、叶酸拮抗剂和相关抑制剂(巯基嘌呤、硫鸟嘌呤、喷司他丁和2-氯脱氧腺苷(克拉屈滨));抗增殖/抗有丝分裂剂,包括天然产物,如长春花生物碱(长春花碱、长春新碱和长春瑞滨);微管破坏剂,如紫杉烷(紫杉醇、多西他赛)、长春新碱、长春花碱、诺考达唑、埃博霉素和诺维本;表鬼臼毒素(依托泊苷、替尼泊苷)、dna损伤剂(放线菌素、安吖啶、蒽环霉素、博来霉素、白消安、喜树碱、卡铂、苯丁酸氮芥、顺铂、环磷酰胺、环磷氮芥、更生霉素、道诺霉素、阿霉素、表柔比星、己二胺奥沙利铂、异磷酰胺、美法仑、二氯甲基二乙胺、丝裂霉素、米托蒽醌、亚硝基脲、普卡霉素、丙卡巴肼、紫杉醇、泰索帝、替尼泊苷、三亚乙基硫代磷酰胺和依托泊苷(vp16));抗生素,如更生霉素(放线菌素d)、道诺霉素、阿霉素、伊达比星、蒽环霉素、米托蒽醌、博来霉素、普卡霉素(光神霉素)和丝裂霉素;酶(l-天冬酰胺酶,其全身性代谢l-天冬酰胺并剥夺没有能力合成自身天冬酰胺的细胞);抗血小板剂;抗增殖/抗有丝分裂烷化剂,如氮芥(二氯甲基二乙胺、环磷酰胺和类似物、美法仑、苯丁酸氮芥)、乙烯亚胺和甲基蜜胺(六甲蜜胺和噻替派)、烷基磺酸盐-白消安、亚硝基脲(卡莫司汀(bcnu)和类似物、链佐星)、三氮烯-达卡巴嗪(dtic);抗增殖/抗有丝分裂抗代谢物,如叶酸类似物(甲氨蝶呤);铂配位络合物(顺铂、卡铂)、丙卡巴肼、羟基脲、米托坦、氨鲁米特;激素、激素类似物(雌激素、他莫昔芬、戈舍瑞林、比卡鲁胺、尼鲁胺)和芳香酶抑制剂(来曲唑、阿那曲唑);抗凝剂(肝素、合成肝素盐和其他凝血酶抑制剂);纤维蛋白溶解剂(如组织纤溶酶原激活剂、链激酶和尿激酶)、阿司匹林、双嘧达莫、噻氯匹定、氯吡格雷、阿昔单抗;抗迁移剂;抗分泌剂(布雷非德菌素);免疫抑制剂(环孢素、他克莫司(fk-506)、西罗莫司(雷帕霉素)、硫唑嘌呤、霉酚酸酯);抗血管生成化合物(例如tnp-470、染料木黄酮、贝伐单抗)和生长因子抑制剂(例如成纤维细胞生长因子(fgf)抑制剂);血管紧张素受体阻断剂;一氧化氮供体;反义寡核苷酸;抗体(曲妥珠单抗);细胞周期抑制剂和分化诱导剂(维甲酸);mtor抑制剂、拓扑异构酶抑制剂(多柔比星(阿霉素)、安吖啶、喜树碱、道诺霉素、更生霉素、依尼泊苷、表柔比星、依托泊苷、伊达比星和米托蒽醌、拓扑替康、伊立替康)、皮质类固醇(可的松、地塞米松、氢化可的松、甲基泼尼松龙、泼尼松和泼尼松龙);生长因子信号转导激酶抑制剂;线粒体功能障碍诱导剂和半胱天冬酶激活剂;和染色质破坏剂。在某些实施方式中,本公开的治疗可以与一种或多种治疗剂组合,所述治疗剂选自由以下组成的组:氨柔比星、甲磺酸阿帕替尼、阿曲生坦巴他布林、骨化三醇、卡培他滨、西仑吉肽、达沙替尼、地卡他尼、艾多卡林、恩扎妥林、埃罗替尼、依维莫司、吉马替康、棉籽酚伊匹单抗、洛那法尼、硫蒽酮、纽拉迪、诺拉曲特、奥利默森、奥拉帕尼、奥法木单抗、奥戈伏单抗、帕尼单抗、帕唑帕尼鲁比替康、瑞格非尼他仑帕奈、喃氟啶、坦罗莫司、替米利芬、粉防己碱、替西木单抗、曲美替尼、曲贝替定、凡德他尼、维特斯潘、扎木单抗、唑仑膦酸盐、组氨瑞林、阿扎胞苷、右雷佐生、阿仑单抗、来那度胺、吉妥珠单抗、酮康唑、氮芥、替伊莫单抗、地西他滨、六甲蜜胺、贝沙罗汀、托西莫单抗、三氧化二砷、依替膦酸盐、环孢素、欧文氏菌天冬酰胺酶、
表柔比星、奥沙利铂、抗pd1抗体、抗pdl1抗体、抗her2抗体、抗her2 adc、5-氟尿嘧啶和锶89。
[0403]
当使用第二治疗剂时,这种药剂可以与本文所述的治疗剂同时或依次(以任何顺序)施用。当与另一种治疗剂共同施用时,由于相加作用或协同作用,每种药剂的合适治疗有效剂量可能会降低。
[0404]
用于治疗性用途的试剂盒
[0405]
本公开还提供了用于治疗或缓解目标疾病(如本文所述的癌症和免疫病症)的试剂盒。此类试剂盒可包括一个或多个容器,其包含抗cldn18抗体,例如本文所述的任何抗体,以及任选地与抗cldn18抗体共同使用的第二治疗剂,这在本文中也有所描述。
[0406]
在一些实施方式中,试剂盒可以包括根据本文所述的任何方法的使用说明书。所包括的说明书可以包括对施用抗cldn18抗体和任选的第二治疗剂以治疗、延迟发作或缓解本文所述的目标疾病的描述。试剂盒可进一步包括基于鉴定个体是否患有目标疾病,例如应用如本文所述的诊断方法,选择适合治疗的个体的描述。在其他实施方式中,说明书包括对向有目标疾病风险的个体施用抗体的描述。
[0407]
关于使用抗cldn18抗体的说明书一般包括有关预期治疗的剂量、给药时程和施用途径的信息。容器可以是单位剂量、批量包装(例如多剂量包装)或亚单位剂量。本公开的试剂盒中提供的说明书通常是标签或包装插页(例如,试剂盒中包括的纸张)上的书面说明书,但机器可读说明书(例如,磁性或光学存储盘上携带的说明书)也是可接受的。
[0408]
标签或包装插页表明该组合物用于治疗、延缓发作和/或缓解疾病,如癌症或免疫病症(例如自身免疫性疾病)。可提供用于实践本文所述任何方法的说明书。
[0409]
本公开的试剂盒采用合适的包装。合适的包装包括但不限于小瓶、瓶子、罐子、软包装(例如密封的聚酯薄膜或塑料袋)等。还考虑了与特定装置结合使用的包装,所述特定装置如吸入器、鼻腔施用装置(例如雾化器)或输液装置,如微型泵。试剂盒可以具有无菌进入端口(例如,容器可以是静脉输液袋或具有可被皮下注射针刺穿的塞子的小瓶)。容器也可以具有无菌进入端口(例如,容器可以是静脉输液袋或具有可被皮下注射针刺穿的塞子的小瓶)。组合物中至少一种活性剂是本文所述的抗cldn18抗体。
[0410]
试剂盒可以任选地提供如缓冲剂等额外组分和解释信息。通常,试剂盒包括容器和在容器上或与容器相关联的标签或包装插页。在一些实施方式中,本公开提供了包含上述试剂盒内容物的制品。
[0411]
提供以下实施例是为了更好地说明所要求的发明,而不是解释为限制本发明的范围。下面描述的所有具体组合物、材料和方法,全部或部分地落入本发明的范围内。这些具体组合物、材料和方法并非旨在限制本发明,而仅为了说明落入本发明范围内的具体实施方式。本领域的技术人员可以开发出等效的组合物、材料和方法,而无需行使发明能力且不脱离本发明的范围。应理解,可以在本文所述的程序中进行许多变化,同时仍保持在本发明的范围内。本发明人的意图是这些变化都包括在本发明的范围内。
[0412]
实施例
[0413]
实施例1:杂交瘤开发
[0414]
1.方法
[0415]
1.1.免疫和血清滴度测定
[0416]
本公开中应用的免疫原和免疫策略包括细胞免疫(人类claudin18.2(cldn18.2)过度表达细胞,例如hek293f-hcldn18.2)、基因免疫(全长人类cldn18.2表达构建体)和蛋白免疫(重组人类cldn18.2蛋白)。
[0417]
将balb/c或sjl小鼠分为5组,每组5只小鼠。每组小鼠用人类claudin18.2(cldn18.2)过度表达细胞(claudin18.2细胞,例如hek293f-hcldn18.2)、全长人类cldn18.2表达构建体(claudin18.2表达构建体)或重组人类cldn18.2蛋白(重组claudin18.2蛋白)进行免疫。表4概述了免疫策略的概要。初次免疫后进行了数次加强免疫,直到动物出现适合杂交瘤开发的令人满意的抗血清滴度。所有的免疫策略平行进行,以便比较血清水平中的性能和免疫反应。
[0418]
表4.免疫策略的概要。
[0419]
组免疫原途径动物/品系组大小剂量1claudin18.2细胞i.p.sjl50.5-1
×
107个细胞2claudin18.2细胞i.p.balb/c50.5-1
×
107个细胞3claudin18.2表达构建体基因枪sjl54μg4claudin18.2表达构建体基因枪balb/c54μg5重组claudin18.2蛋白i.psjl525-50μg
[0420]
1.1.2.免疫时间表
[0421]
细胞免疫的详细免疫时间表如下表5所示。
[0422]
表5.免疫时间表(细胞免疫)
[0423][0424]
基因免疫的详细免疫时间表如下表6所示。
[0425]
表6.免疫时间表(基因免疫)
[0426][0427]
蛋白免疫的详细免疫时间表如下表7所示。
[0428]
表7.免疫时间表(蛋白免疫)
[0429][0430][0431]
1.1.3.测试采血抗血清分析
[0432]
进行测试采血,并通过使用facs对稳定过度表达人类claudine18.2的cho-k1细胞系(即chok1-18.2)进行测试来评估。
[0433]
1.2.杂交瘤的产生和筛选
[0434]
1.2.1.细胞融合和筛选
[0435]
融合:对通过测试采血facs确定的对免疫表现出最佳反应的小鼠进行脾细胞融合。使用优化的电融合方案,将来自脾脏和淋巴结的淋巴细胞与sp2/0-ag14细胞系融合。进行了多次融合以确保项目的成功。
[0436]
筛选和扩增:将融合物接种(每孔104至105)至一堆96孔板中。监测板的生长并每周进料。通过在10-14天内用acumen(hci488nm)的初步筛选分析和/或其他可行的分析来筛选具有细胞生长的孔。对每个靶向抗原进行多次融合,并通过acumen进行筛选。将初步筛选的与chok1-18.2结合呈阳性的阳性亲本克隆扩增至24孔板进行二次筛选。
[0437]
额外的抗体筛选:在初步筛选后,通过下面1.2.2节杂交瘤筛选漏斗中描述的分析,再次对扩增至24孔板中的阳性亲本克隆进行筛选。
[0438]
选择感兴趣的杂交瘤继续进行亚克隆。
[0439]
1.2.2.杂交瘤亚克隆、筛选和冷冻保存
[0440]
亚克隆:然后通过多轮有限稀释或单细胞分选对来自上述筛选漏斗的具有所需反
应性和同型的亲本杂交瘤进行亚克隆,直到获得单克隆。
[0441]
筛选和扩增:通过acumen分析对亚克隆板进行筛选,并将具有良好结合能力的亚克隆扩增至24孔进行确认测试。这些亚克隆的特异性和交叉反应性通过facs分析得到确认。简而言之,将亲本cho-k1细胞、chok1-18.2、稳定过度表达人类claudine18.1的cho-k1细胞系(chok1-18.1)、稳定过度表达恒河猴claudine18.2的cho-k1细胞系(chok1-rh18.2)和稳定过度表达小鼠claudine18.2的cho-k1细胞系(chok1-m18.2)分别与各亚克隆产生的抗体进行培育。荧光染料缀合的二级抗体用于检测初级抗体与细胞的结合。通过facs分析测量中值荧光强度(mfi)。
[0442]
冷冻保存:对所需的亚克隆细胞系进行测序,并进一步扩增至培养瓶中进行冷冻保存。最初冷冻保存每个细胞系4-6个小瓶,0.5-1.0
×
107个细胞/小瓶。如果需要,可以为选定的最有价值的细胞系建立主细胞库和工作细胞库。
[0443]
2.结果
[0444]
我们发现了38种具有独特序列的抗体与稳定过度表达人类claudine18.2蛋白的cho-k1细胞(chok1-18.2)的结合呈阳性。其中,33种抗体没有与稳定过度表达人类claudine18.1蛋白的cho-k1细胞系(chok1-18.1)结合,这表明这些抗体特异性地识别claudine 18.2。五种抗体与chok1-18.2和chok1-18.1的结合均呈阳性,但没有与亲本chok1细胞结合,表明这些抗体是泛claudine 18识别抗体。所有38种抗体均可与猴和小鼠claudin18.2蛋白结合。通过facs检测到的抗体染色chok1-18.2、chok1-18.1、chok1-rh18.2、chok1-m18.2的mfi总结在下表8中。抗泛claudine18抗体加下划线。
[0445]
表8.抗体与不同细胞系结合的mfi
[0446]
[0447]
[0448]
[0449]
[0450][0451]
实施例2:抗体表征:亲和力
[0452]
1.方法
[0453]
从表8中选择了15种小鼠抗体的序列来生成和产生人类igg1嵌合抗体。这些抗体和基准抗体(即imab362(佐妥昔单抗))与chok1-18.2细胞和人类患者衍生的胃癌细胞系(即gaxc031)的结合亲和力通过facs分析确定。facs分析的方案描述如下:
[0454]
a.使用tryple
tm
express酶(1x)消化细胞,然后将收获的细胞在400g下离心5分钟
并弃去上清液。
[0455]
b.通过在400g下离心5分钟,用冷的facs缓冲液洗涤细胞两次并弃去上清液。
[0456]
c.使细胞再悬浮并以2*105个细胞/孔接种至分析板的50μl facs缓冲液中,然后添加50μl初级抗体(初级抗体最终浓度:50.00、16.67、5.56、1.85、0.62、0.21、0.07、0.02、0.01、0.00μg/ml)并在40℃下培育1小时。
[0457]
d.通过使用步骤b中的条件洗涤细胞两次,然后用100微升/孔稀释的二级抗体(即alexafluor488-抗人igg)再悬浮细胞,并在4℃下黑暗中培育1小时。
[0458]
e.使用步骤b中的条件洗涤细胞两次,然后用100微升/孔的冷facs缓冲液再悬浮细胞。将细胞保持在黑暗中进行facs分析。
[0459]
2.结果
[0460]
所选抗体对chok1-18.2的结合亲和力高于或与基准抗体imab362相当(参见表9和图3)。
[0461]
与imab362相比,所选抗体对claudin18.2低表达细胞gaxc031和chok1-18.2的最大mfi(初级抗体浓度为50μg/ml)要高得多(参见表9)。
[0462]
与imab362相比,所选抗体对claudin18.2低表达细胞gaxc031更敏感(参见图2),具有更高的最大mfi和更高或相当的ec
50
(参见表9和图3)。
[0463]
表9.抗体对gaxc031和chok1-18.2的结合亲和力(“ch”是指嵌合)
[0464]
[0465][0466]
实施例3:抗体表征:adcc
[0467]
1.方法
[0468]
根据操作手稿,用荧光增强配体(delfia batda试剂,perkin elmer,ad0116)标记gaxc031细胞(即1*106/ml的细胞用2μl/ml荧光增强配体(delfia batda试剂)标记,并在37℃的细胞培育箱中培育20分钟),将100μl的10,000个细胞/孔接种到96孔v形底无菌板(corning,目录号:3894)。之后,添加50μl表9中列出的连续稀释的抗体(浓度梯度为100nm、20nm、4nm、0.8nm、0.16nm、0.032nm、0.0064nm、0.00128nm、0.000256nm和0nm)到每个孔中,并将板在37℃、5%co2下培育5-10分钟,同时收获nk-92cd16a 176v细胞并将其再悬浮于无酚红rpmi1640培养基(gibco,目录号#11835-030) 10%fbs中至1*106/ml。将所提及的50μl nk92/cd16a细胞供应到分析板的每个孔中。在37℃、5%co2中培育2小时后,将25μl上清液转移到新的平底检测板(perkin elmer,目录号#aaand-0001)。添加200μl铕溶液(perkin elmer,envision2105,ad0116-b,批号2610848),在室温下以250rpm摇动板15分钟并通过envision(perkin elmer,envision 2105)检测值。
[0469]
2.结果
[0470]
我们所有的抗体都对gaxc031细胞显示出有效的adcc效应。与基准抗体(即imab362)相比,我们的抗体对gaxc031细胞显示出更高的最大adcc诱导的细胞杀伤和更低的ec
50
(参见表10和图4)。
[0471]
表10.抗体诱导的adcc效应的最大gaxc031杀伤百分比和ec
50
[0472][0473][0474]
实施例4:抗体表征:cdc
[0475]
1.方法
[0476]
gaxc031细胞在l-15培养基(ge hyclone,目录号#sh30525.01)中调整至1e5/ml,然后将50μl细胞接种至96孔平板(corning,目录号#3903)中,每孔添加25μl连续稀释的抗体(浓度梯度为1000nm、333.33nm、111.11nm、37.04nm、12.35nm、4.12nm、1.37nm、0.46nm、0.15nm和0nm)。将板在37℃、5%co2下培育30分钟后,将25μl正常人血清补体(quidel公司,目录号a113)(最终浓度为20%)供应至每个孔中并培育过夜。第2天,向孔中添加50μl cell titer-glo发光缓冲液(promega,目录号#g7572),摇动板2分钟,并将板放在室温下10分钟。通过spectra max m5测量信号。
[0477]
2.结果
[0478]
我们所有的抗体都对gaxc031细胞显示出有效的cdc效应。与基准抗体(即imab362)相比,我们的抗体对gaxc031细胞显示出更高的最大cdc诱导的细胞杀伤和更低的ec
50
(参见表11和图3)。
[0479]
表11.抗体诱导的cdc效应的最大gaxc031杀伤百分比和ec
50
[0480][0481][0482]
实施例5:抗体表征:间接adc细胞毒性
[0483]
1.方法
[0484]
将gaxc031细胞与选定的嵌合抗体(初级抗体)和vc-mmaf缀合的抗人igg(二级抗体)一起培育,以评估抗体-药物缀合诱导的抗体的细胞毒性功效。该方法描述如下:
[0485]
a.gaxc031细胞以2000个细胞/孔接种于65μl分析培养基中;
[0486]
b.次日,按照设计布局用在25μl分析培养基中进行连续稀释的初级抗体处理细胞(最终起始工作浓度100nm,1:5连续稀释),然后添加10μl二级抗体(最终工作浓度:2μg/ml);
[0487]
c.继续培养120小时;以及
[0488]
d.根据celltiter glo手册,在120小时的时间点测量细胞活力。
[0489]
2.结果
[0490]
我们所有的抗体都对gaxc031细胞显示出有效的间接adc效应,与基准抗体(即imab362)相比,具有更高的最大细胞杀伤(最大生长抑制)和更低的ic
50
(参见表12和图6)。
[0491]
表12.间接adc细胞毒性的最大gaxc031生长抑制%和ic
50
[0492][0493]
实施例6:抗体人源化
[0494]
选择先导候选ab15、ab10和ab17进行抗体人源化。简而言之,对小鼠抗体序列进行分析,然后
[0495]
1)对小鼠抗体vh和vl结构域进行建模;
[0496]
2)与一系列优选的人类种系序列进行比对;
[0497]
3)评估非人类cdr和人类fr之间的冲突,设计回复突变以防止最终产品的亲和力损失;
[0498]
4)将cdr移植至优选种系主链上;
[0499]
5)产生~5个不同的人源化序列,在哺乳动物表达系统中克隆并小规模生产所有的人源化变体和嵌合体;
[0500]
最终获得的人源化序列的重链和轻链如下所示(红色的氨基酸是指cdr的氨基酸):
[0501]
》ab15 hm-vh1
[0502][0503]
》ab15 hm-vh2
[0504][0505]
》ab15 hm-vh3
[0506][0507]
》ab15-hm-vh-n1
[0508][0509]
》ab15 hm-vl1
[0510][0511][0512]
》ab15 hm-vl2
[0513][0514]
》ab15-hm-vl-n1
[0515][0516]
》ab10-hm-vh2
[0517][0518]
》ab10-hm-vh3
[0519][0520]
》ab10-hm-vh4
[0521][0522]
》ab10-hm-vh-n1
[0523][0524]
》ab10 hm-vl1
[0525][0526]
》ab10 hm-vl2
[0527][0528]
》ab10-hm-vl-n1
[0529][0530]
》ab17 hm-vh1
[0531][0532]
》ab17 hm-vh2
[0533][0534]
》ab17 hm-vh3
[0535][0536]
》ab17 hm-vh3-cdr2
[0537][0538]
》ab17 hm-vh5
[0539][0540]
》ab17 hm-vh1-n1
[0541][0542][0543]
》ab17 hm-vh1-n1-cdr2
[0544][0545]
》ab17 hm-vl1
[0546][0547]
》ab17 hm-vl2
[0548][0549]
》ab17 hm-vl1-n
[0550][0551]
》ab17 hm-vl1-n-cdr1
[0552][0553]
1.基于细胞的结合亲和力(gaxc031)
[0554]
表达了具有不同轻链和重链组合的人源化抗体。使用gaxc031细胞测试基于细胞的亲和力。如图7所示,一些人源化抗体对gaxc031细胞显示出相同或轻微下降的亲和力。
[0555]
2.基于细胞的结合亲和力(katoiii和snu620)
[0556]
测试表达极低水平claudin 18.2的katoiii和snu620细胞与ab15、ab10和ab17的结合亲和力。简而言之,收集这些胃癌细胞,用1
×
pbs缓冲液洗两次,然后用本公开的mab以一系列浓度培育1小时。将样品洗涤两次并与fitc标记的二级抗体一起培育,以进行随后的
流式细胞术分析。
[0557]
这两个胃癌细胞系实际上表达了相对较低水平的claudin 18.2,本公开的抗体可以检测到,而参考抗体imab362几乎检测不到该信号(参见图8)。同样,mab ab15显示出最高的亲和力。
[0558]
3.先导候选的spr分析
[0559]
抗体与vlp-claudin 18.2-生物素的亲和力通过biacore 8k(ge healthcare)测定。200μg/ml vlp-claudin 18.2-生物素以10μl/min的流动速率固定在s系列传感器芯片sa(series s sensor chip sa)上120秒,以达到1200ru左右的固定化水平。在室温下以30μl/min的流速注入抗体,浓度梯度为1.56~50nm。接触时间设置为180秒,解离时间为400秒。在每个循环结束时,注入10mm甘氨酸ph=1.5以从表面去除测试抗体。最后,使用biacore insight评估软件计算结合动力学,并使用1:1结合模型进行曲线拟合。
[0560]
如图9所示,人源化ab15(vh3xvln1)、人源化ab15(vhn1xvl2)、人源化ab10(vhn1xvln1)、人源化ab10(vh3xvln1)、人源化ab17(vh5xvln1)和人源化ab17(vh1xvln1)的kd值分别为7.07
×
10-13
、9.40
×
10-12
、1.39
×
10-10
、4.41
×
10-10
、4.60
×
10-10
和4.95
×
10-10
。
[0561]
实施例7:抗体药物缀合物的功效分析
[0562]
1.体外功效分析(包括adc功效)
[0563]
将目标肿瘤细胞以2000个细胞/孔接种于75μl分析培养基中,然后按照次日的设计布局,用在25μl分析培养基中进行连续稀释的抗体-vc-mmae形式的抗体药物缀合物(adc)处理(最终起始工作浓度100nm,1:5连续稀释)。细胞继续培养120小时,并根据celltiter glo手册在120小时的时间点测量细胞活力。
[0564]
过度表达hclaudin18.2的chok1细胞(hok1-hclaudin18.2)和gaxc031细胞用衍生自ab15、ab10和ab17嵌合抗体(或其人源化序列)的adc和人igg1-vc-mmae处理。培育120小时后测量存活百分比。
[0565]
当目标细胞与本公开的抗体缀合vc-mmae衍生的adc一起培育时,可以检测到细胞毒性。对于体外细胞毒性分析,可以观察到亚纳摩尔或纳摩尔的功效(参见图10)。
[0566]
2.体内功效评估:
[0567]
1)mab的体内研究
[0568]
简而言之,将mc38-hclaudin18.2细胞接种至c57bl/6小鼠体内。当肿瘤体积为约100mm3时,将小鼠随机分为10组。将具有migg2a fc的抗体(ab15、ab10、ab17、6e8a2、25g1f4、51e3h5和参考抗体imab362)以5mg/kg的剂量施用于小鼠。
[0569]
与pbs对照组相比,大部分施用的抗体都表现出对肿瘤生长的抑制。肿瘤生长抑制(tgi)在15.3%至38.6%范围内,其中ab15显示出最佳的单药疗法功效(参见图11a)。所有施用的抗体都没有显示出对小鼠的毒性,因为体重没有下降(参见图11b)。
[0570]
2)adc的体内功效研究
[0571]
首先,测试ab10-vc-mmaf的体内功效研究。简而言之,将gaxc031细胞接种至babl/c裸鼠(雌性,6-8周)。当平均肿瘤体积达到约120mm3时,通过静脉内注射以每2周(q2w)的频率递送两次的质量施用adc药物(ab10-vc-mmaf和imab362-vc-mmaf)以及对照(pbs媒剂和higg-vc-mmaf)。每周测量两次肿瘤体积,持续3周。
[0572]
检测了tgi和体重以及存活比例。
[0573]
与对照和参考抗体adc相比,ab10-vc-mmaf显示出更好的功效,并且高剂量组(10mg/kg)显示总肿瘤消退(参见图12a和12c-12j)。存活曲线显示,adc给药组小鼠的存活时间更长(参见图12k)。同样,adc药物没有显示出任何毒性,因为体重没有下降(参见图12b)。
[0574]
3)人源化抗体adc(vc-mmae作为连接子-有效载荷)的体内功效研究.
[0575]
将gaxc031细胞接种至babl/c裸鼠(雌性,6-8周)。当平均肿瘤体积达到约120mm3时,通过静脉内注射施用adc药物(vc-mmae缀合的ab15、ab10、ab17及其人源化抗体)以及pbs媒剂对照,仅一次,剂量为3mg/kg。每周测量两次肿瘤体积,持续3周。检测了tgi和体重以及存活比例。
[0576]
所有的adc对gaxc031模型都相当有效。在大多数adc处理组中可以观察到肿瘤消退(参见图13)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
