一种表达tim-3阻断物的多能干细胞或其衍生物及应用
技术领域
1.本发明属于基因工程技术领域,更具体地,涉及一种表达tim-3阻断物的多能干细胞或其衍生物及应用。
背景技术:
2.干细胞是一类具备自我更新能力及向特定功能体细胞分化能力的“种子”细胞,具有再生为各种组织器官和人体的潜力,在免疫应答、衰老、肿瘤发生等重大生物学活动中发挥着核心且不可替代的作用。依据干细胞特性的程度差异,主要将干细胞分为:全能干细胞(totipotent stem cells)、多能干细胞(pluripotent stem cells,pscs)和成体干细胞(adult stem cell)。其中,多能干细胞pscs具备几近无限的自我更新能力,以及在正常发育条件下向胚内所有胚层的器官、组织、细胞发育分化的潜能,典型的pscs主要包括胚胎干细胞(embryonic stem cells,escs)、胚胎生殖细胞(embryonic germ cells,egcs)、胚胎癌细胞(embryonic carcinoma cells,eccs),以及诱导多能干细胞(induced pluripotent stem cells,ipscs)等,这类细胞由于其强大的功能,并且可以一定程度地通过伦理限制,因此具有十分深远和广泛的应用前景。
3.tim-3(t cell immunoglobulin domain and mucin domain-3)是一类t细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中t细胞的衰竭。哈佛大学医学院richard s.blumberg课题组在nature上发表的研究成果展现了tim-3介导免疫耐受的现象。作者最初预测tim-3能够与t细胞表面与ceacam-1蛋白相互作用,并通过体外刺激实验证实了这一猜想,随后通过一系列遗传学与免疫学手段证明ceacam-1与tim-3联合作用会产生抑制t细胞对癌细胞的免疫反应,从而导致t细胞对各类疾病产生免疫耐受现象。目前的研究表明,tim-3高表达于辅助型t细胞(th1细胞)和细胞毒性t细胞中(tc1细胞),通过产生抑制信号导致th1细胞和tc1细胞的凋亡。tim-3的配体是一种广泛表达的可溶分子——半乳凝素9(gal-9),其可与tim-3分子可变区的寡聚糖结合进而对th1驱动的免疫反应进行负调控。有研究报道tim-3高表达于人类神经胶质瘤(gbm)细胞,及用抗pd-1治疗产生耐药性的动物的t细胞中,在免疫耐受和清除凋亡细胞过程中发挥重要作用。
4.因此,开发一种可以在人体中表达tim-3阻断物的多能干细胞或其衍生物具有重要意义。
5.但是,无论是自体ipscs细胞库,还是免疫配型pscs细胞库的构思或建立都需要花费极大的财力、物力和人力。同种异基因供受体的器官、组织或细胞移植的分子免疫学基础主要是基于经典的主要组织相容性复合体mhc-i和mhc-ii(人又作hla-i、hla-ii)的配型。截至2019年6月,已鉴定和命名的hla系统等位基因已超过20000个,仅经典的hla-a、b、c的等位基因数分别都超过5000个,这些经典的hla-i/ii型等位基因各种可能的随机组合将是天文数字,并且随着新的等位基因的发现组合数随之增加,给器官、组织、细胞移植前的组织配型及供体选择带来极大的障碍,也给构建覆盖人群免疫配型pscs细胞库带来巨大的困难。
6.于是,构建同种异体免疫兼容的通用型pscs迫在眉睫。近年已有许多报道通过敲除b2m、ciita等基因,实现hla-i和hla-ii细胞表面或本身基因的缺失表达,进而使细胞具备免疫耐受或逃逸t/b细胞特异性免疫应答,产生免疫兼容的通用型pscs,为更广泛的通用型pscs源细胞、组织、器官应用奠定了重要的基础。也有报道细胞过表达ctla4-ig、pd-l1从而抑制同种异的免疫排斥。最近又有报道,在敲除b2m、ciita的同时,敲入cd47,从而使细胞获得了逃逸除特异性免疫应答外,还具备免疫耐受或逃逸nk等细胞的固有免疫应答,从而使细胞具备了更加全面更强的免疫兼容特性。然而,这些方案要么免疫兼容不彻底,仍有通过其他途径发生同种异体的免疫排斥;要么彻底消除同种异体免疫排斥应答,但使供体源移植物的细胞本身同时丧失了抗原提呈的能力,这给受体带来了极大的致瘤性和病毒感染等疾病的风险。
7.为此,也有报道,不直接敲除b2m,而敲除hla-a、hla-b或一并敲除ciita的同时,保留hla-c,并构建12个覆盖人群超过90%的hla-c免疫配型抗原,以此达到移植物的细胞仍具备一定程度的抗原提呈功能,并且同时能够通过hla-c抑制nk细胞的固有免疫应答。但这类细胞,一来,hla-i类抗原提呈的抗原类型缩小了三分之二以上,能够提呈的抗原完整性极大地不可逆的缩小,对于各种肿瘤、病毒以及其他疾病抗原的提呈具有极大的偏向性,仍然保留了相当程度的致瘤和病毒感染等疾病的风险,在ciita同时敲除的情况下其致病风险更高;二来,12种高频率免疫配型的hla-c抗原种族差异很大,通过我们核实计算部分地区仅能占到70%的比例,而中国、印度等人口大国目前尚未有权威的大样本量的hla数据展示,这样制备出来的通用型pscs使用仍受到巨大的配型空缺考验;第三,这种方法会经历数次反复的基因编辑工作,按每次基因编辑至少两轮单细胞分离培养计,整个过程至少需要六轮以上的单细胞分离培养,这些流程不可避免且极大概率地因多次基因编辑脱靶或染色质不稳定或因大量单细胞传代增殖造成细胞各种不可预测的突变,进而诱发致癌、代谢疾病等各种问题。由此可见,这类免疫兼容方案亦为“过渡时期”的权宜之计,仍有许多问题没有更好的解决。
8.此外,还有人设计通过诱导自杀基因在供体组织、细胞致病后诱导杀死,这样做的后果将产生严重的组织坏死、细胞因子风暴等不可预知的疾病风险问题,并且这类设计的细胞杀死后将不复存在合适的供体细胞、组织和器官又是一大难题。
技术实现要素:
9.本发明第一个方面的目的,在于提供一种多能干细胞或其衍生物。
10.本发明第二个方面的目的,在于提供上述多能干细胞或其衍生物在制备tim-3高表达肿瘤治疗药物中的应用。
11.本发明第三个方面的目的,在于提供一种制剂,包含上述的多能干细胞或其衍生物。
12.本发明所采取的技术方案是:
13.本发明的第一个方面,提供一种多能干细胞或其衍生物,包含tim-3阻断物的表达序列,所述tim-3阻断物为tim-3抗体。
14.优选地,所述tim-3阻断物的表达序列插入于所述多能干细胞或其衍生物的基因组中。
15.更优选地,所述tim-3阻断物的表达序列插入于所述多能干细胞或其衍生物基因组的安全位点。
16.进一步优选地,所述基因组安全位点包括aavs1安全位点、egsh安全位点、h11安全位点中的一种或多种。
17.本发明的第二个方面,提供一种多能干细胞或其衍生物,包含tim-3阻断物的表达序列,所述tim-3阻断物为tim-3抗体;所述多能干细胞或其衍生物基因组的b2m基因和/或ciita基因被敲除。
18.优选地,所述tim-3阻断物的表达序列插入于所述多能干细胞或其衍生物的基因组中。
19.更优选地,所述tim-3阻断物的表达序列插入于所述多能干细胞或其衍生物基因组的安全位点。
20.进一步优选地,所述基因组安全位点包括aavs1安全位点、egsh安全位点、h11安全位点中的一种或多种。
21.本发明的第三个方面,提供一种多能干细胞或其衍生物,包含tim-3阻断物的表达序列,所述tim-3阻断物为tim-3抗体;
22.所述多能干细胞或其衍生物中还包含免疫兼容分子表达序列,所述免疫兼容分子用于调控多能干细胞细胞或其衍生物中与免疫应答相关的基因的表达。
23.优选地,所述tim-3阻断物的表达序列、免疫兼容分子表达序列插入于所述多能干细胞或其衍生物的基因组中。
24.更优选地,所述tim-3阻断物的表达序列、免疫兼容分子表达序列插入于所述多能干细胞或其衍生物的基因组的安全位点。
25.进一步优选地,所述基因组安全位点包括aavs1安全位点、egsh安全位点、h11安全位点中的一种或多种。
26.本发明的第四个方面,提供一种多能干细胞或其衍生物,包含tim-3阻断物的表达序列,所述tim-3阻断物为tim-3抗体;
27.所述多能干细胞或其衍生物中还包含免疫兼容分子表达序列,所述免疫兼容分子用于调控多能干细胞细胞或其衍生物中与免疫应答相关的基因的表达;
28.所述多能干细胞或其衍生物中还包含诱导型基因表达系统。
29.优选地,所述诱导型基因表达系统为tet-off系统、二聚体诱导表达系统中的至少一种。
30.优选地,所述tim-3阻断物的表达序列、免疫兼容分子表达序列和诱导型基因表达系统插入于所述多能干细胞或其衍生物的基因组中。
31.更优选地,所述tim-3阻断物的表达序列、免疫兼容分子表达序列和诱导型基因表达系统插入于所述多能干细胞或其衍生物的基因组的安全位点。
32.进一步优选地,所述基因组安全位点包括aavs1安全位点、egsh安全位点、h11安全位点中的一种或多种。
33.根据本发明第三个方面或第四个方面所述的多能干细胞或其衍生物,进一步地,所述免疫兼容分子包括以下的一种或多种:
34.(ⅰ)免疫耐受相关基因,包括cd47或hla-g;
35.(ⅱ)hla-c类分子,包括人群中比例合计超过90%的hla-c复等位基因,或者超过90%的hla-c复等位基因与b2m构成的融合蛋白基因;
36.(ⅲ)靶向所述与免疫应答相关的基因的shrna和/或shrna-mir。
37.根据本发明第三个方面或第四个方面所述的多能干细胞或其衍生物,进一步地,所述与免疫应答相关的基因包括:
38.(ⅰ)主要组织相容性复合体基因,包括hla-a、hla-b、hla-c、hla-dra、hla-drb1、hla-drb3、hla-drb4、hla-drb5、hla-dqa1、hla-dqb1、hla-dpa1和hla-dpb1中的至少一种;
39.(ⅱ)主要组织相容性复合体相关基因,包括b2m和ciita中的至少一种。
40.优选地,根据权利要求6所述的多能干细胞或其衍生物,其特征在于,
41.靶向b2m的shrna和/或shrna-mir的靶序列选自seq id no.3~seq id no.5中的一种;
42.靶向ciita的shrna和/或shrna-mir的靶序列选自seq id no.6~seq id no.15中的一种;
43.靶向hla-a的shrna和/或shrna-mir的靶序列选自seq id no.16~seq id no.18中的一种;
44.靶向hla-b的shrna和/或shrna-mir的靶序列选自seq id no.19~seq id no.24中的一种;
45.靶向hla-c的shrna和/或shrna-mir的靶序列选自seq id no.25~seq id no.30中的一种;
46.靶向hla-dra的shrna和/或shrna-mir的靶序列选自seq id no.31~seq id no.40中的一种;
47.靶向hla-drb1的shrna和/或shrna-mir的靶序列选自seq id no.41~seq id no.45中的一种;
48.靶向hla-drb3的shrna和/或shrna-mir的靶序列选自seq id no.46~seq id no.47中的一种;
49.靶向hla-drb4的shrna和/或shrna-mir的靶序列选自seq id no.48~seq id no.57中的一种;
50.靶向hla-drb5的shrna和/或shrna-mir的靶序列选自seq id no.58~seq id no.66中的一种;
51.靶向hla-dqa1的shrna和/或shrna-mir的靶序列选自seq id no.67~seq id no.73中的一种;
52.靶向hla-dqb1的shrna和/或shrna-mir的靶序列选自seq id no.74~seq id no.83中的一种;
53.靶向hla-dpa1的shrna和/或shrna-mir的靶序列选自seq id no.84~seq id no.93中的一种;
54.靶向hla-dpb1的shrna和/或shrna-mir的靶序列选自seq id no.94~seq id no.103中的一种。
55.根据本发明第三个方面或第四个方面所述的多能干细胞或其衍生物,进一步地,所述多能干细胞或其衍生物的基因组中还导入shrna加工复合体相关基因、mirna加工复合
体相关基因和抗干扰素效应分子中的至少一种。
56.优选地,所述shrna加工复合体相关基因、mirna加工复合体相关基因包括drosha、ago1、ago2、dicer1、exportin-5、trbp(tarbp2)、pact(prkra)、dgcr8中的至少一种;
57.所述抗干扰素效应分子优选为靶向pkr、2-5as、irf-3和irf-7中至少一种的shrna和/或shrna-mir。
58.更优选地,靶向pkr的shrna和/或shrna-mir的靶序列选自seq id no.104~seq id no.113中的一种;
59.靶向2-5as的shrna和/或shrna-mir的靶序列选自seq id no.114~seq id no.143中的一种;
60.靶向irf-3的shrna和/或shrna-mir的靶序列选自seq id no.144~seq id no.153中的一种;
61.靶向irf-7的shrna和/或shrna-mir的靶序列选自seq id no.154~seq id no.163中的一种。
62.根据本发明第三个方面或第四个方面所述的多能干细胞或其衍生物,更进一步地,所述shrna表达框架:自5’到3’依次包括shrna靶序列、茎环序列、shrna靶序列的反向互补序列、poly t;
63.其中,所述shrna靶序、茎环序列与所述shrna靶序列的反向互补序列形成发夹结构;
64.poly t为rna聚合酶iii的转录终止子;
65.shrna-mir表达框架:使用shrna-mir靶序列替换microrna-30或microrna-155中的靶序列得到。
66.更优选地,所述shrna表达框架中的茎环序列长度为3~9个碱基;所述poly t长度为5~6个碱基。
67.根据本发明第一个方面至第四个方面所述的多能干细胞或其衍生物,进一步地,所述多能干细胞包括胚胎干细胞、胚胎生殖细胞、胚胎癌细胞、或者诱导多能干细胞。
68.根据本发明第一个方面至第四个方面所述的多能干细胞或其衍生物,进一步地,所述多能干细胞衍生物包括多能干细胞所分化的成体干细胞、各胚层细胞或组织;
69.所述成体干细胞包括间充质干细胞或者神经干细胞。
70.根据本发明第一个方面至第四个方面所述的多能干细胞或其衍生物,进一步地,所述tim-3抗体的重链序列如seq id no.1所示,轻链序列如seq id no.2所示。
71.本领域技术人员可以理解,采用其他的tim-3抗体表达序列同样可以实现本发明的目的。
72.本发明的第五个方面,提供本发明第一个方面至第四个方面任一所述的多能干细胞或其衍生物在制备tim-3高表达肿瘤治疗药物中的应用。
73.本发明的第六个方面,提供一种制剂,包含第一个方面至第四个方面任一所述的多能干细胞或其衍生物。
74.本发明的有益效果是:
75.本发明提供了一种的表达tim-3阻断物的多能干细胞或其衍生物,可用于自体细胞诱导ipscs或分化成mscs这类低免疫源性细胞进行运用,其可在体内持续表达tim-3阻断
物,用于治疗tim-3高表达肿瘤及相关疾病。
76.本发明还提供了一种表达tim-3阻断物的免疫兼容的多能干细胞或其衍生物,由于多能干细胞或其衍生物中的b2m、ciita基因被敲除,或者其基因组中导入了免疫兼容分子表达序列,因而此类多能干细胞或其衍生物的免疫源性低,将其移植到受体中时,可以克服供体细胞和受体之间的同种异体免疫排斥问题,使得供体细胞能够在受体内长时间持续表达tim-3阻断物。
77.本发明还提供了一种表达tim-3阻断物的免疫兼容可逆的多能干细胞或其衍生物的基因组中导入诱导型基因表达系统以及免疫兼容分子表达序列。诱导型基因表达系统受外源诱导物的调控,通过调整外源诱导物的添加量、持续作用时间、种类来控制诱导型基因表达系统的开启与关闭,从而控制疫兼容分子表达序列的表达量。而免疫兼容分子可调控多能干细胞细胞或其衍生物中与免疫应答相关的基因的表达。当免疫兼容分子正常表达时,多能干细胞或其衍生物中与免疫应答相关的基因的表达被抑制或过表达,可以消除或降低供体细胞和受体之间的同种异体免疫排斥应答,使得供体细胞能够长时间在受体中持续表达tim-3阻断物。而当供体细胞发生病变时,可通过外源诱导物诱导关闭免疫兼容分子的表达,从而可逆地使供体细胞表面重新表达hla
ꢀⅰ
类分子,恢复供体细胞的抗原提呈能力,使受体能够清除病变的细胞,从而提高了这类通用型多能干细胞或其衍生物的临床安全性,极大地扩展其在临床应用的价值。
78.此外,还可以通过调整外源诱导物的添加量、持续作用时间,让移植物逐步表达低浓度的hla分子来刺激受体,使得受体对移植物逐步产生耐受,最终达到稳定的耐受。此时,即使移植物细胞表面表达不匹配的hla
ꢀⅰ
类分子,也能够被受体免疫系统兼容,这样可以使得在诱导关闭移植物细胞中免疫兼容分子的表达后,受体免疫系统一方面能够重新识别移植物中hla
ꢀⅰ
类分子提呈的有基因突变的细胞,清除病变细胞;另一方面,未发生突变的部分由于被上述诱导物训练产生同种异体hla
ꢀⅰ
类分子耐受而不会被受体免疫系统清除。从而使受体免疫系统仅清除有害突变的移植物,保留正常功能的移植物,当有害的移植物清除后,又可以转入移植物细胞表面hla
ꢀⅰ
类分子沉默的模式。由外源诱导物介导的移植物免疫耐受程序还可以在受体彻底耐受后,植入无诱导或其他方式诱导开启或关闭hla
ꢀⅰ
类分子表面表达的移植物。
附图说明
79.图1 aavs1ki vector(shrna,组成型)质粒图谱。
80.图2 aavs1ki vector(shrna,诱导型)质粒图谱。
81.图3 aavs1ki vector(shrna-mir,组成型)质粒图谱。
82.图4 aavs1ki vector(shrna-mir,诱导型)质粒图谱。
83.图5 sgrna clone b2m-1质粒图谱。
84.图6 sgrna clone b2m-2质粒图谱。
85.图7 sgrna clone ciita-1质粒图谱。
86.图8 sgrna clone ciita-2质粒图谱。
87.图9 cas9(d10a)质粒图谱。
88.图10 sgrna clone aavs1-1质粒图谱。
89.图11 sgrna clone aavs1-2质粒图谱。
具体实施方式
90.以下结合具体的实施例及附图对本发明的内容作进一步详细的说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
91.下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
92.1实验材料与方法
93.1.1 tim-3抗体
94.tim-3抗体的重链(hc)序列如seq id no.1所示,轻链(lc)序列如seq id no.2所示。
95.caggtgcagctggtgcagagcggcgccgaggtgaagaagcccggcgccagcgtgaaggtgagctgcaaggccagcggctacaccttcaccagctacaacatgcactgggtgaggcaggcccccggccagggcctggagtggatcggcgacatctaccccggcaacggcgacaccagctacaaccagaagttcaagggcagggccaccatgaccgccgacaagagcaccagcaccgtgtacatggagctgagcagcctgaggagcgaggacaccgccgtgtactactgcgccagggtgggcggcgccttccccatggactactggggccagggcaccctggtgaccgtgagcagcgccagcaccaagggccccagcgtgttccccctggccccctgcagcaggagcaccagcgagagcaccgccgccctgggctgcctggtgaaggactacgagcccgagcccgtgaccgtgagctggaacagcggcgccctgaccagcggcgtgcacaccttccccgccgtgctgcagagcagcggcctgtacagcctgagcagctgggtgaccgtgcccagcagcagcctgggcaccaagacctacacctgcaacgtggaccacaagcccagcaacaccaaggtggacaagagggtggagagcaagtacggccccccctgccccccctgccccgcccccgagttcctgggcggccccagcgtgttcctgttcccccccaagcccaaggacaccctgatgatcagcaggacccccgaggtgacctgcgtggtggtggacgtgagccaggaggaccccgaggtgcagttcaactggtacgtggacggcgtggaggtgcacaacgccaagaccaagcccagggaggagcagttcaacagcacctacagggtggtgagcgtgctgaccgtgctgcaccaggactggctgaacggcaaggagtacaagtgcaaggtgagcaacaagggcctgcccagcagcatcgagaagaccatcagcaaggccaagggccagcccagggagccccaggtgtacaccctgccccccagccaggaggagatgaccaagaaccaggtgagcctgacctgcctggtgaagggcttctaccccagcgacatcgccgtggagtgggagagcaacggccagcccgagaacaactacaagaccaccccccccgtgctggacagcgacggcagcttcttcctgtacagcaggctgaccgtggacaagagcaggtggcaggagggcaacgtgttcagctgcagcgtgatgcacgaggccctgcacaaccactacacccagaagagcctgagcctgagcctgggc(seq id no.1)。
96.gacatcgtgctgacccagagccccgacagcctggccgtgagcctgggcgagagggccaccatcaactgcagggccagcgagagcgtggagtactacggcaccagcctgatgcagtggtaccagcagaagcccggccagccccccaagctgctgatctacgccgccagcaacgtggagagcggcgtgcccgacaggttcagcggcagcggcagcggcaccgacttcaccctgaccatcagcagcctgcaggccgaggacgtggccgtgtactactgccagcagagcaggaaggaccccagcaccttcggcggcggcaccaaggtggagatcaagaggaccgtggccgcccccagcgtgttcatcttcccccccagcgacgagcagctgaagagcggcaccgccagcgtggtgtgcctgctgaacaacttctaccccagggaggccaaggtgcagtggaaggtggacaacgccctgcagagcggcaacagccaggagagcgtgaccgagcaggacagcaaggacagcacctacagcctgagcagcaccctgaccctgagcaaggccgactacgagaagcacaaggtgtacgcctgcgaggtg
acccaccagggcctgagcagccccgtgaccaagagcttcaacaggggcgagtgc(seq id no.2)。
97.本领域技术人员可以理解,采用其他的tim-3抗体表达序列同样可以实现本发明的目的。
98.1.2多能干细胞或其衍生物
99.多能干细胞可选自胚胎干细胞(escs)、诱导多能干细胞(ipscs)以及其他形式的多能干细胞,例如hpscs-mscs、nscs、ebs细胞。其中:
100.escs:可选用hn4细胞,购自上海中科院。
101.ipscs:使用我们所建立的第三代高效安全的episomal-ipscs诱导系统(6f/bm1-4c),pe3.1-og
--
ks和pe3.1-l-myc
--
hmir302 cluster经电转进入体细胞中,rm1培养2天,含2um parnate的biociso-bm1培养2天,含2um parnate、0.25mm sodium butyrate、3um chir99021和0.5um pd03254901的biociso-bm1培养2天,在用干细胞培养基biociso培养到17天左右即可挑取ipscs克隆,所挑取的ipscs克隆经纯化、消化、传代以获得稳定的ipscs。具体构建方法参见:stem cell res ther.2017nov 2;8(1):245。
102.hpscs-mscs:将ipscs使用干细胞培养基(biociso,含10um tgfβ抑制剂sb431542)培养25天,期间80-90汇合度进行消化传代(2mg/ml dispase消化),1:3传代到matrigel包被的培养板中,接着esc-msc培养基(knockout dmem培养基,含10%ksr、neaa、双抗、谷氨酰胺、β-巯基乙醇、10ng/ml bfgf和sb-431542)进行培养,每天换液,80-90汇合度进行传代(1:3传代),连续培养20天即可。具体构建方法参见:proc natl acad sci u s a.2015;112(2):530-535。
103.nscs:将ipscs使用诱导培养基(knockout dmem培养基,含10%ksr,含tgf-β抑制剂,bmp4抑制剂)培养14天,挑取玫瑰花环状的神经细胞到低粘附培养板中进行培养,培养基使用比例为1:1的dmem/f12(含1%n2,invitrogen)和neurobasal培养基(含2%b27,invitrogen),还含有20ng/ml bfgf和20ng/ml egf,进行培养,消化使用accutase进行消化传代即可。具体构建方法参见:faseb j.2014;28(11):4642-4656。
104.ebs细胞:将汇合度达到95%的ipscs使用bioc-pde1消化6min后使用机械刮传法将细胞刮成块状,沉降降细胞团块,沉降的细胞团块转移到低粘附培养板中使用biociso-eb1培养7天,隔天换液。7天后转移到matrigel包被的培养板中继续使用biociso进行贴壁培养,7天后即可获得具有内、中、外三胚层结构的拟胚体(ebs)。具体构建方法参见:stem cell res ther.2017nov 2;8(1):245。
105.所述多能干细胞衍生物还包括多能干细胞所分化的成体干细胞、各胚层细胞或组织、器官;所述成体干细胞包括间充质干细胞或者神经干细胞。
106.1.3基因组安全位点
107.作为更优选的方案,为保证敲入基因/表达结构的稳定表达,可将基因/表达结构敲入基因组安全位点中,基因组安全位点可选自aavs1安全位点、egsh安全位点,或者其它安全位点:
108.(1)aavs1安全位点
109.aavs1位点(别名“ppp1r2c位点”)位于人类基因组第19号染色体上,是一个经过验证、能够确保转入dna片段预期功能的“安全港”位点。该位点是一个开放的染色体结构,能保证转入基因能被正常转录,且该位点插入外源目的片段对细胞无已知的副作用。
110.(2)egsh安全位点
111.egsh安全位点位于人类基因组第1号染色体上,是一个经过论文验证、能够确保转入dna片段预期功能的另一个“安全港”位点。
112.(3)其它安全位点
113.h11安全位点(也叫hipp11),位于人的22号染色体,是eif4enif1与drg1这两个基因之间的一个位点,由simon hippenmeyer于2010年发现并命名,由于h11位点位于两个基因之间,故外源基因插入后影响內源基因表达的风险很小。h11位点被验证是一个基因间的安全的转录激活区域,是aavs1、egsh位点之外的一个新的“安全港”位点。
114.1.4诱导型基因表达系统
115.诱导型基因表达系统选自:tet-off系统或者二聚体关闭表达系统:
116.(1)tet-off系统
117.在没有四环素存在时,tta蛋白持续作用在tet启动子上,使基因持续表达。在需要转基因保持在一个持续表达状态下,该系统是非常有用。加入四环素时,四环素可使tta蛋白的结构变化,使其不能与启动子结合,从而使其驱动的基因表达水平下降。为了使该系统保持“关闭”状态,必须连续添加四环素。
118.将tet-off系统以及一种或多种免疫兼容分子的序列敲入多能干细胞的基因组安全位点处,通过四环素的添加与否精准开启或关闭免疫兼容分子的表达,从而可逆调控多能干细胞或其衍生物中主要组织相容性复合体相关基因的表达。
119.(2)二聚体关闭表达系统
120.二聚体介导的基因表达调控系统:化学调控靶基因转录的方法有很多种,最常见的是利用影响转录因子活性的别构调节物进行调控。其中的一个方法是运用二聚化的诱导剂或者二聚体在无活性的融合蛋白上重组有活性的转录因子。最常用的体系是将天然产物雷帕霉素(rapamydn)或者无生物活性的类似物作为二聚化的药物。雷帕霉素(或类似物)同胞质蛋白fkbp12(fkbp与fk506结合的蛋白)和一种大的丝-苏氨酸蛋白激酶,称为frap【frbp-雷帕霉素相关蛋白,即mtor(哺乳动物的雷帕霉素靶点)】有高度亲和性,又与这两种蛋白质相结合的功能,因此作为异源性二聚体将这两种蛋白质聚到一起。为调控靶基因转录,将dna结合区域融合到一个或多个fkbp结构域,将转录抑制域融合到frap的93位氨基酸部位,称为frb,这样足以结合fkbp-雷帕霉素复合物。只有在雷帕霉素存在的情况下,这两种融合蛋白才能发生二聚化。因而抑制具有与dna结合区域相结合的位点的基因进行转录。
121.1.5免疫兼容分子
122.所述免疫兼容分子可以调控多能干细胞或其衍生物中同种异体免疫排斥相关基因的表达。
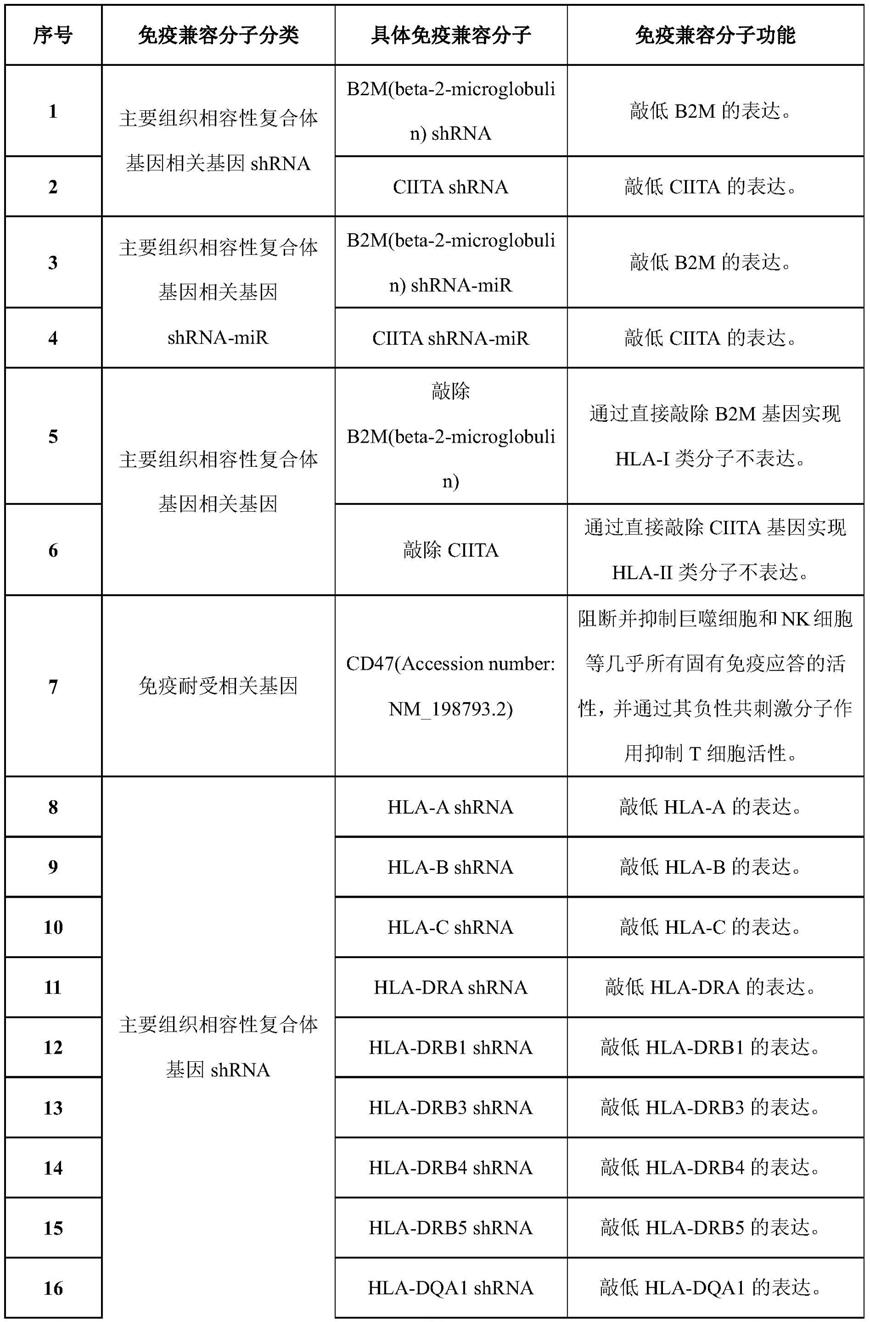
123.具体免疫兼容分子的种类及序列如表1所示。
124.表1免疫兼容分子
125.[0126][0127]
以上shrna或shrna-mir免疫兼容分子的靶序列如表2所示。
[0128]
表2 shrna或shrna-mir的靶序列
[0129]
[0130]
[0131]
[0132]
[0133]
[0134][0135]
后续实验中免疫兼容分子敲入的方案中,各实验组别的shrna或shrna-mir序列均为采用表2中的靶序列1构建得到的shrna或shrna-mir免疫兼容分子。本领域的技术人员可以理解:以其他靶序列构建得到的shrna或shrna-mir免疫兼容分子同样可以实现本发明的技术效果,均落入本发明权利要求的保护范围。
[0136]
1.6shrna/mirna加工复合体基因和抗干扰素效应分子
[0137]
在细胞核内的初级mirna(pri-mirna)经过复合物drosha-dgcr8进行微处理,将pri-mirna裂解成前体mirna(pre-mirna),这时会形成发夹结构。接着,经exportin-5-ran-gtp复合物将pre-mirna转运出核。在胞浆中与双链rna结合蛋白trbp(tarbp2)结合的rnase dicer酶将pre-mirna分解成成熟的长度,mirna在这时还处于双链状态。最后被转运进ago2,形成risc(rna诱导沉默复合体)。最终mirna双链的一条链保留在risc复合物中,另外一条则排出被迅速降解掉。而dgcr8作为drosha的主要结合蛋白,可以通过其c末端的两个双链rna结合区域与pri-mirna结合,招募并指导drosha在pri-mirna的正确位置剪切,生产pre-mirna,pre-mirna进一步被dicer和trbp/pact加工剪切,形成成熟的mirna。dgcr8的缺失或异常表达会影响drosha的剪切活性,进而影响mirna的活性,导致疾病的发生。trbp能够招募dicer复合体mirna形成risc ago2。
[0138]
利用基因敲入技术,在基因组安全位点敲入可诱导关闭表达的针对hla i类分子和hla ii类分子等的shrna-mir表达序列时,优选同时敲入可诱导关闭表达的shrna和/或mirna加工机器包括drosha(accession number:nm_001100412)、ago1(accession number:nm_012199)、ago2(accession number:nm_001164623)、dicer1(accession number:nm_001195573)、exportin-5(accession number:nm_020750)、trbp(accession number:nm_134323)、pact(accession number:nm_003690)和dgcr8(accession number:nm_022720),
以便细胞不占用其他mirna的加工,影响细胞功能。
[0139]
此外,在ifn诱生的过程中,双链rna所依赖的蛋白激酶(double-stranded rna-dependent protein kinase,pkr),它是整个细胞信号转导通路的关键因子,同时还有2’,5’寡腺苷酸合成酶(2,5-oligoadenylate synthetase,2-5as),这两种酶与dsrna诱生ifn密切相关。pkr能通过磷酸化真核细胞转录因子,从而抑制蛋白质合成,使细胞停滞于g0/g1和g2/m期,并诱导凋亡,而dsrna可以促进2-5as合成,结果导致rnase即rnasel的非特异性活化,降解细胞内所有的mrna,致细胞死亡。i型干扰素的诱导特异性是通过irf转录因子家族成员实现的,在细胞缺乏irf-3和irf-7的表达下,在很多病毒感染情况下i型干扰素是不能被诱导分泌的。缺乏ifn的应答,要使其恢复,需要上述两种蛋白质的共表达才行。
[0140]
利用基因敲入技术,在基因组安全位点处敲入免疫兼容分子shrna-mir表达序列时,优选同时敲入可诱导关闭表达的针对抑制pkr、2-5as、irf-3和irf-7基因的shrna和/或shrna-mir表达序列,降低dsrna诱发的干扰素反应,从而避免产生细胞毒性。
[0141]
shrna/mirna加工复合体相关基因、抗干扰素效应分子、免疫兼容分子在基因组安全位点的插入位置顺序没有限定,它们之间可以以任何次序排列,而不会相互干扰或者影响基因组其它基因的结构和功能。
[0142]
具体的抗干扰素效应分子的靶序列如表3所示。
[0143]
表3抗干扰素效应分子的靶序列
[0144]
[0145]
[0146][0147]
后续实验包括抗干扰素效应分子敲入的方案中,各实验组别的抗干扰素效应分子的靶序列均为采用表3中的靶序列1构建得到的抗干扰素效应分子。本领域的技术人员可以理解:以其他靶序列构建得到的抗干扰素效应分子同样可以实现本发明的技术效果,均落入本发明权利要求的保护范围。
[0148]
1.7免疫兼容分子、抗干扰素效应分子的shrna或shrna-mir的通用框架
[0149]
免疫兼容分子、抗干扰素效应分子的shrna或shrna-mir的通用框架序列如下所示:
[0150]
(1)shrna组成型表达框架为:
[0151]
gagggcctatttcccatgattccttcatatttgcatatacgatacaaggctgttagagagataattggaattaatttgactgtaaacacaaagatattagtacaaaatacgtgacgtagaaagtaataatttcttgggtagtttgcagttttaaaattatgttttaaaatggactatcatatgcttaccgtaacttgaaagtatttcgatttcttggctttatatatcttgtggaaaggacgctagcgccacc(seq id no.164)n1...n
21
ttcaagaga(seq id no.165)n
22
...n
42
tttttt;
[0152]
其中:
[0153]
a、n1...n
21
为对应基因的shrna靶序列,n
22
...n
42
为对应基因的shrna靶序列的反向互补序列;
[0154]
b、如果质粒需要表达多个基因的shrna,则每个基因分对应一个shrna表达框架,然后无缝连接起来;
[0155]
c、带不同抗性基因的组成型shrna质粒,只有抗性基因不同,其它序列一样;
[0156]
d、n表示a、t、g、c碱基;
[0157]
e、seq id no.164为u6启动子序列;
[0158]
f、seq id no.165为茎环序列。
[0159]
(2)shrna诱导型表达框架为:
[0160]
gagggcctatttcccatgattccttcatatttgcatatacgatacaaggctgttagagagataattggaattaatttgactgtaaacacaaagatattagtacaaaatacgtgacgtagaaagtaataatttcttgggtagtttgcagttttaaaattatgttttaaaatggactatcatatgcttaccgtaacttgaaagtatttcgatttcttggctttatatatcttgtggaaaggactttaccactccctatcagtgatagagaaaagtgaaagtcgagtttaccactccctatcagtgatagagaaaagtgaaagtcgagtttaccactccctatcagtgatagagaaaagtgaaagtcgagtttaccactccctatcagtgatagagaaaagtgaaagtcgagtttaccactccctatcagtgatagagaaaagtgaaagtcgagtttaccactccctatcagtgatagagaaaagtgaaagtcgagtttaccactccctatcagtgatagagaaaagtgaaagtcgagctcggtacccgggtcgaggtaggcgtgtacggtgggaggcctatataagcagagctcgtttagtgaaccgtcagatcgcctggagacgccatccacgctgttttgacctccatagaagacaccgggaccgatccagcctgctagcgccacc(seq id no.166)n1...n
21
ttcaagaga(seq id no.165)n
22
...n
42
tttttt;
[0161]
其中:
[0162]
a、n1...n
21
为对应基因的shrna靶序列,n
22
...n
42
为对应基因的shrna靶序列的反向互补序列;
[0163]
b、如果质粒需要表达多个基因的shrna,则每个基因分对应一个shrna表达框架,然后无缝连接起来;
[0164]
c、带不同抗性基因的组成型shrna质粒,只有抗性基因不同,其它序列一样;
[0165]
d、n表示a、t、g、c碱基;
[0166]
e、seq id no.166为h1to启动子序列;
[0167]
f、seq id no.165为茎环序列。
[0168]
(3)shrna-mir组成型或诱导型表达框架为:
[0169]
以shrna-mir靶序列替换microrna-30中的靶序列得到,具体序列如下:
[0170]
gaggcttcagtactttacagaatcgttgcctgcacatcttggaaacacttgctgggattacttcttcaggttaacccaacagaaggctaaagaaggtatattgctgttgacagtgagcg(seq id no.167)m1n1...n
21
tagtgaagccacagatgta(seq id no.168)n
22
...n
42
m2tgcctactgcctcggacttcaaggggctactttaggagcaattatcttgtttactaaaactgaataccttgctatctctttgatacatttttacaaagctgaattaaaatggtataaat(seq id no.169);
[0171]
其中:
[0172]
a、n1...n
21
为对应基因的shrna-mir靶序列,n
22
...n
42
为对应基因的shrna-mir靶序列的反向互补序列;
[0173]
b、如果质粒需要表达多个基因的shrna-mir,则每个基因分对应一个shrna-mir表达框架,然后无缝连接起来;
[0174]
c、带不同抗性基因的组成型shrna-mir质粒,只有抗性基因不同,其它序列一样;
[0175]
d、m碱基表示a或c碱基,n表示a、t、g、c碱基;
[0176]
e、如果n1为g碱基,则m1为a碱基;否则m1为c碱基;
[0177]
f、m1碱基与m2碱基互补。
[0178]
1.8基因编辑系统、基因编辑方法及检验方法
[0179]
1.8.1基因编辑系统
[0180]
基因编辑技术采用crispr-cas9基因编辑系统。发明人使用的cas 9蛋白为cas 9(d10a),cas 9(d10a)与sgrna结合,sgrna负责特异识别靶序列(基因组dna),然后cas 9(d10a)对该靶序列进行单链切割。基因组dna发生双链断裂(dna double strand break,dsb),必须有两组cas 9(d10a)/sgrna分别对基因组dna的两条链进行切割,且切割的距离不能太远。cas 9(d10a)/sgrna方案与cas 9/sgrna方案相比,优点是特异性更高,脱靶的概率更低。本基因编辑系统使用的质粒或donor片段分别为:cas9(d10a)质粒、sgrna clone质粒、donor片段。
[0181]
(1)cas9(d10a)质粒:表达cas 9(d10a)蛋白的质粒,在sgrna的引导下特异性单链切割基因组dna。
[0182]
(2)sgrna质粒:表达sgrna的质粒,sgrna(small guide rna)是向导rna(guide rna,grna),在基因编辑负责引导表达cas 9(d10a)蛋白的靶向切割。
[0183]
(3)donor片段:两头含有重组臂,分别位于基因组dna断裂位置的左右两边,中间含有需要插入的基因、片段或者表达元件。在donor片段存在的情况下,细胞在基因组断裂的位置发生同源重组(homologous recombination,hr)反应。如果不添加donor片段,细胞的基因组断裂位置发生非同源末端连接(non-homologous end joining-nhej)反应。该片段由ki(knock-in,下同)vector质粒酶切后回收获取。
[0184]
1.8.2组成型质粒和诱导型质粒
[0185]
组成型质粒:从组成型质粒获取的donor片段,敲入基因组dna后,该片段的表达功能不可以进行调控。
[0186]
诱导型质粒:从诱导型质粒获取的donor片段,敲入基因组dna后,该片段的表达功能可以通过添加诱导物的方法来调控,相当于对表达功能添加了一个开启或者关闭的开关。
matrigel不能低于0.5小时;1:200x matrigel不能低于2小时。)。
[0209]
(3)消化液:使用dpbs溶解edta至终浓度为0.5mm,ph7.4(注意:edta不能使用水稀释,否则细胞会因渗透压降低而死亡。)。
[0210]
(4)冻存液:60%biociso 30%escs级fbs 10%dmso(冻存液最好现配现用)。
[0211]
三、常规维持传代培养过程
[0212]
(1)传代的最佳时刻以及传代比例
[0213]
a.传代最佳时刻:细胞整体汇合度达80%~90%;
[0214]
b.传代最佳比例:1:4~1:7传代,次日最佳汇合度应维持在20%~30%。
[0215]
(2)传代过程
[0216]
a.事先将包被好的细胞培养瓶皿中的matrigel吸走弃掉,加入适量培养基(biociso 300μg/ml g418 0.5μg/ml puro),并放入37℃、5%co2培养箱中孵育;
[0217]
b.待细胞符合传代的要求,吸掉培养基上清,加入适量的0.5mm edta消化液到细胞瓶皿中;
[0218]
c.将细胞放入37℃、5%co2培养箱中孵育5~10分钟(消化至镜下观察到大部分细胞收缩变圆但还未漂浮即可,轻柔吹打细胞使其从壁上脱离,将细胞悬液吸到离心管内,200g离心5分钟;
[0219]
d.离心后,弃上清,用培养基重悬细胞,轻柔反复吹打细胞数次至混匀,然后将细胞转移至事先准备好包被matrigel的瓶皿中;
[0220]
e.细胞转移至细胞瓶皿后,前后左右水平摇匀,镜下观察无异常后,摇匀置于37℃、5%co2培养箱中进行培养;
[0221]
f.次日观察细胞贴壁存活状态,吸掉培养基每天正常按时换液。
[0222]
四、细胞冻存
[0223]
(1)按照常规传代的操作步骤,使用0.5mm edta消化细胞至大部分细胞收缩变圆但尚未漂浮,轻柔吹打细胞,收集细胞悬液,200g离心5分钟,弃上清,加入适量冻存液重悬细胞,将细胞转移至冻存管(建议六孔板汇合度80%冻存一支,冻存液体积为0.5ml/支);
[0224]
(2)将冻存管置于程序降温盒中,立即放入-80℃过夜(需保证冻存管每分钟温度下降1℃);
[0225]
(3)次日立即将细胞转移入液氮。
[0226]
五、细胞复苏
[0227]
(1)提前准备好matrigel包被的细胞瓶皿,复苏细胞前,吸掉matrigel,向细胞瓶皿中加入适量的biociso,置于37℃、5%co2培养箱中孵育;
[0228]
(2)将冻存管从液氮中快速取出,立即放入37℃水浴锅中快速摇晃,使细胞快速融解,仔细观察待冰晶完全消失停止摇晃,将细胞转移至生物安全柜;
[0229]
(3)提前加入10ml dmem/f12(1:1)基础培养基至15ml离心管,并平衡至室温,使用巴氏吸管吸取1ml dmem/f12(1:1)缓慢加入冻存管中,轻柔混匀,将细胞悬液转移到准备好的含有dmem/f12(1:1)的15ml离心管中,200g离心5分钟;
[0230]
(4)小心弃掉上清,加入适量biociso,轻轻混匀细胞,种到提前准备好的细胞瓶皿中,水平前后左右摇匀后,镜下观察无异常后,摇匀置于37℃、5%co2培养箱中培养;
[0231]
(5)次日观察细胞贴壁存活状态,每天正常按时换液。若贴壁良好,则biociso更换
为biociso 300μg/ml g418 0.5μg/ml puro。
[0232]
1.8.5 aavs1基因敲入检测方法
[0233]
一、单细胞克隆aavs1基因敲入检测
[0234]
(1)aavs1基因敲入检测说明
[0235]
a.试验目的:pcr检测经过基因敲入处理的细胞,测试该细胞是否为纯合子;由于两个donor片段只有抗性基因的序列具有差异性,因此要判断该细胞是否为纯合子(两条染色体分别敲入不同抗性基因的donor片段),就需要检测该细胞的基因组是否含有两种抗性基因的donor片段,只有双敲入的细胞才有可能是正确的纯合子;
[0236]
b.试验方法:首先在donor质粒内部(非重组臂部分)设计一条引物,然后在基因组ppp1r12c(非重组臂部分)设计另一条引物;如果donor片段在基因组能够正确插入,就会有目的条带出现,否则无目的条带出现);
[0237]
c.试验方案引物序列及pcr方案如表4所示。
[0238]
表4试验方案引物序列及pcr方案
[0239][0240][0241]
二、egsh基因敲入的检测方法跟aavs1基因敲入检测原理和方法一样。
[0242]
1.8.6在基因组安全位点敲入基因方法的检验方法
[0243]
(1)试验目的:pcr检测经过基因敲入处理的细胞,测试该细胞是否为纯合子。由于两个donor片段只有抗性基因的序列具有差异性,因此要判断该细胞是否为纯合子(两条染色体分别敲入不同抗性基因的donor片段),就需要检测该细胞的基因组是否含有两种抗性基因的donor片段,只有双敲入的细胞才有可能是正确的纯合子。
[0244]
(2)试验方法:首先在donor质粒内部(非重组臂部分)设计一条引物,然后在基因组(非重组臂部分)设计另一条引物。如果donor片段在基因组能够正确插入,就会有目的条带出现,否则无目的条带出现。
[0245]
1.9多能干细胞表达tim-3抗体的测定方法
[0246]
利用流式细胞计量测定法对多能干细胞表达的tim-3抗体进行测试。将表达tim-3的cho细胞悬浮于培养表达抗tim-3抗体的多能干细胞的培养基上清中,37℃温育30分钟。pbs洗涤细胞2次并将fitc标记的tim-3抗体融合蛋白加入到试管中,37℃温育30分钟。使用流式细胞仪进行流式细胞计量分析。根据染色的平均荧光强度(mfi),测量出多能干细胞表达的抗tim-3抗体与人tim-3转染的cho细胞的结合。即可表明表达tim-3阻断物的多能干细胞所表达的抗tim-3抗体能阻断抑制tim-3的功能。
[0247]
1.10 cfse检测tim-3细胞杀伤肿瘤的影响(
51
cr释放法检测tim-3抗体对t细胞杀伤肿瘤的影响)
[0248]
(1)效应细胞的准备:
[0249]
t细胞分离:使用ficoll密度梯度离心法(ficoll-hypaque density gradient centrifugation)分离人外周血单个核细胞(peripheral blood mononuclear cell,pbmc),再使用dynabeads
tm
cd3(invitrogen
tm
,货号:11151d)试剂盒分离出t细胞。将细胞重悬在含10%fbs的rpmi1640培养基中,通过台盼蓝染色计数细胞,并浓缩至1
×
107细胞/ml。
[0250]
(2)靶细胞的准备
[0251]
肿瘤(rcc肾癌)细胞,将其消化重悬,通过台盼蓝染色计数细胞,配成1
×
107细胞/ml的细胞悬液。
[0252]
(3)cfse测试试验
[0253]
荧光染料cfse,也可称为cfda se(5,6-carboxyfluorescein diacetate,succinimidyl ester,羟基荧光素二醋酸盐琥铂酰亚胺酯),是一种可穿透细胞膜的荧光染料,可通过流式细胞仪进行检测。pi(propidium iodide,碘化丙锭),可以与细胞内dna和rna结合,但不能通过活细胞的细胞膜。
[0254]
t细胞先用表达tim-3抗体的多能干细胞的培养基上清孵育30min,再与肿瘤细胞接触时,t就会攻击肿瘤细胞造成肿瘤细胞死亡。而未经表达tim-3阻断物的多能干细胞的培养基上清培育的会发生肿瘤细胞不被t细胞所识别,会发生免疫逃逸。所以通过检测cfse pi 细胞(死亡的靶细胞),即可反应出t细胞杀伤肿瘤的能力。
[0255]
a.在靶细胞中加入cfse工作液(终浓度为5μmol/l cfse),于37℃,5%co2培养孵育10min,洗涤2次。台盼蓝染色计数后用培养基重悬,配成1
×
106细胞/ml备用。
[0256]
b.将靶细胞及效应细胞加入5ml流式管中,每管加100μl靶细胞(1
×
105ml-1
)及效应细胞(e/t=1:2、1:5、1:10,e/t为靶细胞与效应细胞t的比),并以只加靶细胞作为对照。将流式管中的效应细胞与靶细胞轻轻混匀。加入pi,放置37℃,5%co2培养孵育4h。流式细胞检测cfse pi 细胞(死亡的靶细胞)的百分率。
[0257]
靶细胞死亡率(%)=加t细胞刺激的靶细胞死亡率(%)-靶细胞自然死亡率(%)
[0258]
1.11小鼠肿瘤治疗方法
[0259]
在人源化nsg小鼠(the jackson laboratory(jax))中,对其右腋下皮下注射5
×
106肿瘤细胞(rcc肾癌,nic肺癌,acc大肠癌)细胞,待肿瘤长到60mm3大小时,进行尾静脉注射200ulpbs(含人免疫细胞和1
×
106的表达tim-3阻断物的多能干细胞衍生物)进行肿瘤治疗,其中只注射含人免疫细胞的组作为对照组。20天后处死小鼠,然后比较各组之间肿瘤大小,并进行差异性统计分析。
[0260]
2.实验方案
[0261]
首先,将表达tim-3阻断物(抗tim-3抗体)的基因敲入基因组安全位点(safe harbour)以实现多能干细胞衍生物表达tim-3阻断物。从而使多能干细胞衍生物能在肿瘤治疗上进行应用。接着,我们还可以通过基因编辑技术对其(表达tim-3阻断物的多能干细胞衍生物)进行改造,改造成组成型免疫兼容的通用型多能干细胞衍生物和免疫兼容可逆的通用型多能干细胞衍生物,进而能在同种异体中进行肿瘤治疗。
[0262]
具体来说:将表达tim-3阻断物的基因、一个或多个免疫兼容分子、shrna和/或mirna加工复合体相关基因、抗干扰素效应分子敲入到多能干细胞基因组安全位点的实验方案如表5、表6所示,其中,“ ”号表示基因或核酸序列的敲入,“-”号表示基因敲除。
[0263]
按照1.8.3中质粒构建方法分别构建以下载体:
[0264]
表5组成型表达实验方案
[0265][0266]
选取的质粒以及具体的敲入位置情况如下:
[0267]
tim-3抗体为分泌型抗体,抗体结构:信号肽 轻链(含终止密码子) ireswt(seq id no.178) 信号肽 重链(含终止密码子),终止密码子一般选用tga。
[0268]
其中,信号肽的序列为:atgtacaggatgcaactcctgtcttgcattgcactaagtcttgcacttgtcacgaattcg(seq id no.183)。
[0269]
总体原则:tim-3抗体序列放入对应质粒的mcs2的位置(注:抗体的lc轻链、hc重链的前面均添加信号肽,如上所示),shrna放入对应质粒的shrna表达框架内,shrna-mir放入对应质粒的shrna-mir表达框架内,其它基因放入对应质粒的mcs的位置。各质粒的图谱如图1至图11所示。
[0270]
其中,sgrna clone b2m质粒包含sgrna clone b2m-1和sgrna clone b2m-2质粒。sgrna clone ciita质粒包含sgrnaclone ciita-1和sgrnaclone ciita-2质粒。
[0271]
(1)a1分组(tim-3抗体)
[0272]
aavs1ki vector(shrna,组成型)质粒的mcs2放入tim-3抗体序列(抗体的lc轻链和hc重链序列中间使用emcv ireswt连接起来,排序顺序如下:lc轻链,emcv ireswt,hc重链,下同)。
[0273]
(2)a2分组(tim-3抗体、shrna、基因)
[0274]
aavs1ki vector(shrna,组成型)质粒的mcs2放入tim-3抗体序列。shrna表达框架放入shrna靶序列(若存在多个shrna则无缝连接起来)。mcs1放入基因序列(若存在多个基因则使用emcv ireswt连接起来)。
[0275]
(3)a3分组(tim-3抗体、shrna-mir、基因)
[0276]
aavs1ki vector(shrna-mir,组成型)质粒的mcs2放入tim-3抗体序列。shrna-mir表达框架放入shrna靶序列(若存在多个shrna-mir则无缝连接起来)。mcs1放入基因序列(若存在多个基因则使用emcv ireswt连接起来)。
[0277]
(4)a4分组(tim-3抗体、b2m和ciita双敲除、基因)
[0278]
aavs1ki vector(shrna,组成型)质粒的mcs2放入tim-3抗体序列。mcs1放入基因序列(若存在多个基因则使用emcv ireswt连接起来)。
[0279]
sgrnaclone b2m质粒的靶序列放入b2m的sgrna靶序列(seq id no.179和seq id no.180),sgrnaclone ciita质粒的靶序列放入ciita的sgrna靶序列(seq id no.181和seq id no.182)。
[0280]
(5)a5分组(tim-3抗体、shrna、基因)
[0281]
同a2分组的方法。
[0282]
(6)a6分组(tim-3抗体、shrna-mir、基因)
[0283]
同a3分组的方法。
[0284]
表6诱导型表达(免疫兼容可逆)实验方案
[0285][0286]
[0287]
(1)b1分组(tim-3抗体、shrna、基因)
[0288]
aavs1ki vector(shrna,诱导型)质粒的mcs2放入tim-3抗体序列。shrna表达框架放入shrna靶序列(若存在多个shrna则无缝连接起来)。mcs1放入基因序列(若存在多个基因则使用emcv ireswt连接起来)。
[0289]
(2)b2分组(tim-3抗体、shrna-mir、基因)
[0290]
aavs1ki vector(shrna-mir,诱导型)质粒的mcs2放入tim-3抗体序列。shrna-mir表达框架放入shrna靶序列(若存在多个shrna-mir则无缝连接起来)。mcs1放入基因序列(若存在多个基因则使用emcv ireswt连接起来)。
[0291]
(3)b3分组(tim-3抗体、shrna、基因)
[0292]
同b1分组的方法。
[0293]
(4)b4分组(tim-3抗体、shrna-mir、基因)
[0294]
同b2分组的方法。
[0295]
实施例1多能干细胞或其衍生物表达的tim-3抗体的阻断效果检测
[0296]
将表5和表6各实验组方案敲入mscs细胞的基因组安全位点,37℃,0.5%co2培养箱培养,收集培养基上清,重悬表达tim-3的cho细胞,37℃温育30分钟。pbs洗涤细胞2次并将fitc标记的tim-3抗体融合蛋白加入到试管中,37℃温育30分钟。使用流式细胞仪进行流式细胞计量分析。各实验组的检测结果如表7所示。
[0297]
n(对照)是指未经处理的表达tim-3的cho细胞,37℃温育30分钟,pbs洗涤细胞2次并将fitc标记的tim-3抗体融合蛋白加入到试管中,37℃温育30分钟。
[0298]
表7各实验组表达的tim-3抗体对tim-3的阻断效果
[0299]
分组相对mfi值偏差(
±
)独立样本t检验(*p《0.01)n(对照)1.0360.073-a10.3920.004*a20.3710.028*a30.3830.033*a40.3790.019*a50.3580.008*a60.4070.011*b10.3880.034*b20.3780.010*b30.4130.011*b40.4130.015*
[0300]
从上表可以看出,本发明的多能干细胞或其衍生物所表达的抗tim-3抗体能够有效结合tim-3。而且其表达量在各组中表达相对恒定,所以多能干细胞衍生物所表达的tim-3抗体不受细胞分化形态及其他外源基因(免疫兼容改造)所影响。
[0301]
实施例2表达tim-3阻断物的多能干细胞或其衍生物的抗肿瘤效果
[0302]
将表5和表6各实验组方案敲入mscs细胞的基因组安全位点,得到表达tim-3阻断物细胞。使用cfse测试试验检验其抗肿瘤效果,结果见表8。
[0303]
表8各实验组表达的tim-3阻断物对t细胞杀伤肿瘤细胞的影响
[0304]
分组靶细胞死亡率平均值(%)偏差(
±
)独立样本t检验(*p《0.01)n(对照)31.1730.479-a152.0483.108*a256.4762.416*a351.8661.801*a455.1833.821*a552.6401.020*a656.2992.761*b154.6842.162*b254.8364.208*b352.7371.130*b457.7492.102*
[0305]
通过以上实验,可以证明本发明制备的多能干细胞或其衍生物所表达的被外泌体包裹的tim-3阻断物起到抗肿瘤作用。
[0306]
实施例3表达tim-3阻断物的多能干细胞或其衍生物的抗肿瘤效果
[0307]
在人源化nsg小鼠肿瘤模型中,我们对其进行注射能够表达tim-3抗体的hpscs源衍生物(hpscs-mscs),观察其rcc肾癌,nic肺癌,acc大肠癌的肿瘤治疗的效果。注:为避免免疫兼容问题,我们所使用的免疫细胞与hpscs及hpscs源衍生物均来源于同一人的,且采用b2m和ciita基因敲除的免疫兼容方案。实验结果见表9。
[0308]
n(对照)组是指未注射实验细胞的nsg小鼠肿瘤模型。
[0309]
表9表达抗tim-3抗体的多能干细胞或其衍生物的肿瘤治疗
[0310][0311]
通过以上实验,可以证明本发明制备的表达tim-3阻断物的干细胞或其衍生物能有效阻断tim-3而起到抗肿瘤作用。
[0312]
实施例4免疫兼容分子诱导型表达组的可逆性表达测试
[0313]
通过上述实施例,表达tim-3阻断物的hpscs及hpscs源衍生物能有效阻断tim-3而起到抗肿瘤作用,还必须考虑hpscs及hpscs源衍生物的免疫兼容问题。因此发明人选取了一个合适的组合对免疫兼容进行测试。
[0314]
发明人利用mscs的低免疫源性的特点,在人源化nsg小鼠肿瘤模型中,对其进行注射能够表达tim-3阻断物(抗tim-3抗体)的hpscs源免疫兼容mscs,观察其肿瘤(rcc肾癌)治疗的效果。注:所使用的免疫细胞与hpscs源mscs来源于为非同一人。
[0315]
对照组是指未注射mscs细胞的nsg小鼠肿瘤模型。
[0316]
加dox组别的处理是:在小鼠饮食中添加0.5mg/ml的dox,进行饲养小鼠,从注射表
达阻断物细胞开始,一直使用,直到试验结束。
[0317]
表10免疫兼容分子诱导型表达组的可逆性表达测试结果
[0318][0319][0320]
以上实验表明:仅表达阻断物的mscs(组2),其具有低免疫源性,可以在异体内存在一定时间,所以其能够发挥一定的肿瘤治疗效果,而进行免疫兼容改造的(组3-11,包括组成型和可逆诱导型免疫兼容),其免疫兼容效果更佳,比没有经免疫兼容改造的mscs在体内存在时间更长(或能做到长期共存),其发挥肿瘤治疗效果更佳,而组5为b2m和ciita基因敲除组,其完全消除hla-i和hla-ii类分子产生的影响,因此其肿瘤治疗效果最佳。但由于其组成型免疫兼容改造(基因敲入/敲除),无法在移植物产生变异或不需要时进行清除,从而有组8-15方案设定。组12-15中在进行注射表达阻断物细胞进入小鼠的同时,对小鼠使用dox诱导剂(一直使用),注射表达阻断物细胞的小鼠的免疫兼容效果将被消除,其在体内存在时间与未经免疫兼容改造的mscs相当,其肿瘤治疗效果也与未经免疫兼容改造的mscs相当。
[0321]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。