1.本发明涉及化合物领域,具体涉及一种植物药百两金中的新单萜苷化合物及其提取分离方法和应用。
背景技术:
2.百两金(ardisia crispa)为报春花科紫金牛属植物,广泛的分布在热带及亚热带地区,其根常作为民族药一直沿用至今
1.。前期研究发现紫金牛属植物中萜类是其主要化学成分,并具有显著的抗肿瘤活性
[2-8]
。植物百两金以根入药,用于治疗咽喉肿痛、湿热黄疸、跌打损伤等
[9]
。前期对百两金的研究多集中于药理学方面,结果显示其具有广泛的药理活性,例如抗肿瘤、抗炎和抑制血管生成的作用
[10-18]
,但其化学成分却鲜有报道。为了进一步发现具有潜在抗肿瘤活性成分,本发明采用正相硅胶柱色谱、反相ods柱色谱、hplc高效液相色谱法对百两金乙醇提取物进行分离纯化,得到1个新的单萜苷成分:bornane-2,5 diol-5-o-β-d-glucopyranoside。采用mtt法考察了化合物bornane-2,5 diol-5-o-β-d-gl ucopyranoside体外抗肿瘤活性。
技术实现要素:
[0003]
本发明的目的是提供一种植物药百两金中的新单萜苷化合物bornane-2,5diol-5-o-β-d-glucopyranoside。
[0004]
本发明的目的是提供一种植物药百两金中的新单萜苷化合物bornane-2,5diol-5-o-β-d-glucopyranoside的提取分离方法
[0005]
本发明的目的是提供一种植物药百两金中的新单萜苷化合物bornane-2,5diol-5-o-β-d-glucopyranoside在制备治疗抗肿瘤药物或制剂方面的应用。
[0006]
本发明所述植物药百两金中的新单萜苷化合物为bornane-2,5diol-5-o-β-d-glucopyranoside。
[0007]
本发明所述的新单萜苷化合物结构式为:
[0008][0009]
bornane-2,5 diol-5-o-β-d-glucopyranoside
[0010]
本发明所述的新单萜苷化合物的提取分离方法为:
[0011]
取干燥的百两金根5.0-9.0kg,粉碎后经7-13倍量的60%-80%乙醇水加热回流提取2-6次,每次1-3小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取体积比1:1,每种极性溶剂萃取2-6次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,
正丁醇萃取部位以及水部位;
[0012]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9;
[0013]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8,fr6.3经hplc高效液相色谱,甲醇:水=43:57,流速3ml/min,保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside。
[0014]
优选的,本发明所述的新单萜苷化合物的提取分离方法为:
[0015]
取干燥的百两金根6.0-8.0kg,粉碎后经8-12倍量的65%-75%乙醇水加热回流提取3-5次,每次1.5-2.5小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取,体积比1:1,每种极性溶剂萃取3-5次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,正丁醇萃取部位以及水部位;
[0016]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9;
[0017]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8;fr6.3经hplc高效液相色谱,甲醇:水=43:57,流速3ml/min,保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside。
[0018]
进一步优选的,本发明所述的新单萜苷化合物的提取分离方法为:
[0019]
取干燥的百两金根7.0kg,粉碎后经10倍量的70%乙醇水加热回流提取4次,每次2小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取,体积比1:1,每种极性溶剂萃取4次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,正丁醇萃取部位以及水部位;
[0020]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9;
[0021]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8,fr6.3经hplc高效液相色谱,甲醇:水=43:57,流速3ml/min,保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside(2.2mg)。
[0022]
本发明所述新单萜苷化合物bornane-2,5 diol-5-o-β-d-glucopyranoside在制备治疗抗肿瘤药物或制剂方面的应用。
[0023]
本发明所述制剂为加入药学上可接受的辅料按常规工艺制成药学上可接受的制剂。
[0024]
本发明所述药学上可接受的制剂为固体制剂或液体制剂。
[0025]
本发明所述固体制剂为颗粒剂、丸剂、胶囊剂、片剂、散剂、冻干粉针剂。
[0026]
本发明所述液体制剂为口服液、注射制剂。
[0027]
本发明所述的辅料没有限定,药学上接受即可。
[0028]
有益效果:
[0029]
现有技术的问题:现有文献中未见从植物百两金中提取分离出新的单萜苷成分:bornane-2,5 diol-5-o-β-d-glucopyranoside。也未见该化合物在制备治疗体外抗肿瘤药
物方面应用的研究报道。
[0030]
本发明的有益效果:
[0031]
本研究采用正相硅胶柱色谱、反相ods柱色谱、hplc高效液相色谱法对百两金乙醇提取物进行分离纯化,得到1个新的单萜苷成分:bornane-2,5 diol-5-o-β-d-glucopyranoside。采用mtt法考察了化合物bornane-2,5 diol-5-o-β-d-glucopyranoside体外抗肿瘤活性,结果化合物bornane-2,5 diol-5-o-β-d-glucopyranoside在抑制hepg2细胞系增值方面优于阳性药顺铂;在抑制hela和u87mg细胞系增值方面略低于阳性药。因此化合物bornane-2,5 diol-5-o-β-d-glucopyranoside可以在制备治疗体外抗肿瘤药物方面应用。
附图说明
[0032]
图1化合物的1h-nmr谱。
[0033]
图2化合物的13c-nmr谱。
[0034]
图3化合物的hr-esi-ms谱。
具体实施方式
[0035]
下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
[0036]
实施例1
[0037]
新单萜苷化合物bornane-2,5 diol-5-o-β-d-glucopyranoside结构式为:
[0038][0039]
bornane-2,5 diol-5-o-β-d-glucopyranoside
[0040]
分子式:c
16h28
o7[0041]
hr-esi-ms m/z[m na]
355.1723
[0042]
状态:白色粉末
[0043]
比旋光度:=-14,(c=0.1,meoh)
[0044]
硅胶薄层检视:以二氯甲烷:甲醇=6:1展开,经10%浓硫酸-乙醇显色,呈现粉红色斑点。
[0045]
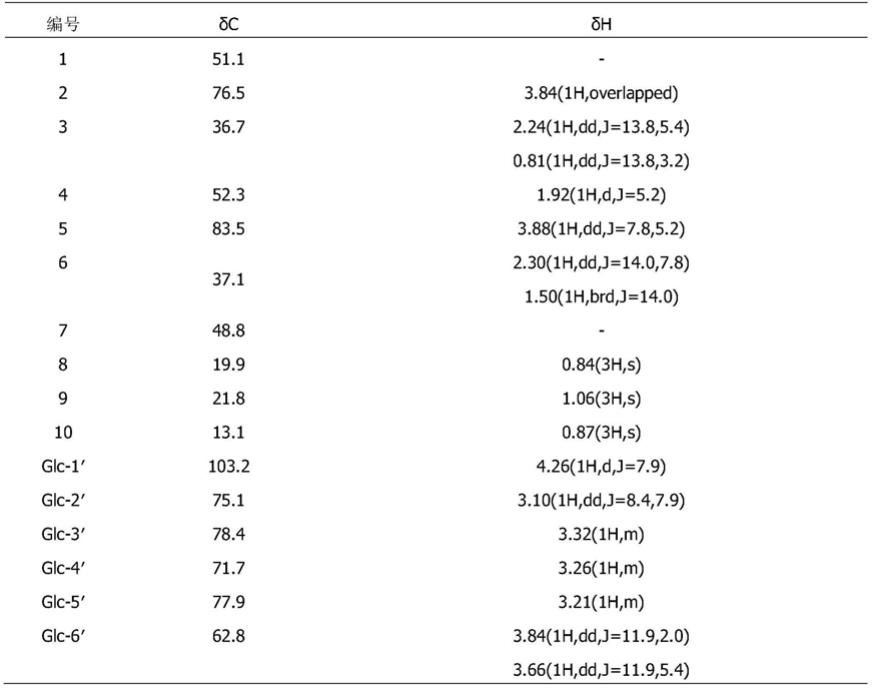
表1 1
h-nmr(400mhz,meoh)、
13
c-nmr(100mhz,meoh)
[0046][0047]
实施例2
[0048]
取干燥的百两金根7.0kg,粉碎后经10倍量的70%乙醇水加热回流提取4次,每次2小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物1923g,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取(体积比1:1),每种极性溶剂萃取4次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位7.9g,乙酸乙酯萃取部位23g,正丁醇萃取部位360g以及水部位。
[0049]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9。
[0050]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8。fr6.3经hplc高效液相色谱(甲醇:水=43:57,流速3ml/min),保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside(2.2mg)。
[0051]
实施例3
[0052]
取干燥的百两金根6.0kg,粉碎后经8倍量的65%乙醇水加热回流提取3次,每次1.5小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取(体积比1:1),每种极性溶剂萃取3次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,正丁醇萃取部位以及水部位。
[0053]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9。
[0054]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8。
fr6.3经hplc高效液相色谱(甲醇:水=43:57,流速3ml/min),保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside。
[0055]
实施例4
[0056]
取干燥的百两金根8.0kg,粉碎后经12倍量的75%乙醇水加热回流提取5次,每次2.5小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取(体积比1:1),每种极性溶剂萃取5次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,正丁醇萃取部位以及水部位。
[0057]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9。
[0058]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8。fr6.3经hplc高效液相色谱(甲醇:水=43:57,流速3ml/min),保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside。
[0059]
实施例5
[0060]
取干燥的百两金根5.0kg,粉碎后经7倍量的60%乙醇水加热回流提取2次,每次1-3小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取(体积比1:1),每种极性溶剂萃取2次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,正丁醇萃取部位以及水部位。
[0061]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9。
[0062]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8。fr6.3经hplc高效液相色谱(甲醇:水=43:57,流速3ml/min),保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside。
[0063]
实施例6
[0064]
取干燥的百两金根9.0kg,粉碎后经13倍量的80%乙醇水加热回流提取-6次,每次1小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取(体积比1:1),每种极性溶剂萃取2-6次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位,乙酸乙酯萃取部位,正丁醇萃取部位以及水部位。
[0065]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9。
[0066]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8。fr6.3经hplc高效液相色谱(甲醇:水=43:57,流速3ml/min),保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside。
[0067]
实施例7
[0068]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入13倍量的药用糊精混合均匀,压片,得片剂。
[0069]
实施例8
[0070]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入15倍量的药用糊精混合均匀,干燥,制成丸剂。
[0071]
实施例9
[0072]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入16倍量的药用糊精混合均匀,装入胶囊,得胶囊剂。
[0073]
实施例10
[0074]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入12倍量的药用糊精混合均匀,制粒,得颗粒剂。
[0075]
实施例11
[0076]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入19倍量注射用水,搅拌,过滤,灭菌,得注射剂。
[0077]
实施例12
[0078]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入16倍量的纯净水,混合均匀,过滤,灭菌,得口服液。
[0079]
实施例13
[0080]
取化合物bornane-2,5 diol-5-o-β-d-glucopyranoside作为原料药,加入10倍量的注射用水,搅拌,过滤,冻干,得冻干粉剂。
[0081]
为了进一步验证本发明的可行性及有效性,发明人进行了以下实验:
[0082]
一、活性筛选试验
[0083]
(一)仪器与试剂:
[0084]
dpx-400型核磁共振波谱仪(德国bruker公司);shimadzu lc-16d半制备型高效液相色谱仪(日本岛津公司);rid-20a示差检测器(日本岛津公司);ods色谱填料(日本ymc公司);柱层析硅胶(200-300目,300-400目,青岛海洋化工厂);提取分离所用二氯甲烷、甲醇、乙醇等有机试剂均为天津富宇精细化工有限公司生产,均为分析纯;高效液相所用甲醇为色谱纯。
[0085]
(二)实验方法
[0086]
1.化合物bornane-2,5 diol-5-o-β-d-glucopyranoside提取分离方法:
[0087]
取干燥的百两金根7.0kg,粉碎后经10倍量的70%乙醇水加热回流提取4次,每次2小时,过滤合并滤液,减压浓缩,回收溶剂,得醇提物1923g,将其按照1:1混悬于水中分散,分别用石油醚、乙酸乙酯、正丁醇依次萃取(体积比1:1),每种极性溶剂萃取4次,萃取液分别合并,经旋转蒸发仪回收溶剂,分别得到石油醚萃取部位7.9g,乙酸乙酯萃取部位23g,正丁醇萃取部位360g以及水部位。
[0088]
正丁醇部位浸膏加甲醇溶解后用80-100目硅胶拌样,湿法装柱,经硅胶柱色谱以50:1-0:1的二氯甲烷-甲醇梯度洗脱,tlc检识,合并相同部位,得到9个组分fr.1-fr.9。
[0089]
fr.6经ods柱色谱以比例1:9-10:0的甲醇-水梯度洗脱得到8个组分fr6.1-fr6.8。fr6.3经hplc高效液相色谱(甲醇:水=43:57,流速3ml/min),保留时间14.5分钟,得到化合物bornane-2,5 diol-5-o-β-d-glucopyranoside(2.2mg)。
[0090]
2.化合物表征:
[0091]
百两金新的单萜苷化合物bornane-2,5 diol-5-o-β-d-glucopyranoside:
[0092][0093]
bornane-2,5 diol-5-o-β-d-glucopyranoside
[0094]
分子式:c
16h28
o7[0095]
hr-esi-ms m/z[m na]
355.1723
[0096]
状态:白色粉末
[0097]
比旋光度:
[0098]
硅胶薄层检视:以二氯甲烷:甲醇=6:1展开,经10%浓硫酸-乙醇显色,呈现粉红色斑点。
[0099]
表1 1
h-nmr(400mhz,meoh)、
13
c-nmr(100mhz,meoh)
[0100][0101][0102]
3.活性筛选:
[0103]
本研究采用mtt法考察化合物bornane-2,5 diol-5-o-β-d-glucopyranoside对于hela、hepg2、u87mg三种肿瘤细胞系的体外抗肿瘤作用。具体方法如下:所有细胞用含有10%fbs的培养基dmem在37℃,5%co2条件下进行培养。取对数生长期的各细胞系(100μl,细胞密度1
×
105)接种于96孔板上,使其贴壁12小时,后加入浓度为1、2、5、10、20、40μm的化合物bornane-2,5 diol-5-o-β-d-glucopyranoside继续培养24小时(顺铂作为阳性对照,
每组设3个复孔)。之后各孔加入mtt(5mg/ml)20μl,37℃孵育4个小时,弃去上清液,每孔加入100μl dmso,最后用酶标仪在490nm下测定吸光度,计算ic
50
值。
[0104]
表2化合物bornane-2,5 diol-5-o-β-d-glucopyranoside对三种肿瘤细胞系的的细胞毒活性
[0105][0106]
实验结论:通过体外抗肿瘤作用研究发现,化合物bornane-2,5 diol-5-o-β-d-glucopyranoside在抑制hepg2细胞系增值方面优于阳性药顺铂;在抑制hela和u87mg细胞系增值方面略低于阳性药。因此化合物bornane-2,5 diol-5-o-β-d-glucopyranoside在开发成抗肿瘤药物方面具有一定的潜力。
[0107]
参考文献
[0108]
[1]h.kobayashi,e.mej
í
a,
′
the genus ardisia:a novel source of health-promoting compounds and phytopharmaceuticals
′
,j.ethnopharmacology 2005,96(3),347-354.
[0109]
[2]x.chang,w.li,z.jia,t.satou,s.fushiya,k.koike,
′
biologically active triterpenoid saponins from ardisia japonica
′
,j.nat.prod.2007,70(2),179-187.
[0110]
[3]y.tian,h.f.tang,f.qiu,x.j.wang,x.l.chen,a.d.wen,
′
triterpenoid saponins from ardisia pusilla and their cytotoxic activity
′
,planta med.2009,75(01),70-75.
[0111]
[4]l.h.mu,q.q.gong,h.x.zhao,p.liu,
′
triterpenoid saponins from ardisia gigantifolia
′
,chem.pharm.bull.2010,58(9),1248-1251.
[0112]
[5]l.h.mu,n.y.wei,p.liu,
′
cytotoxic triterpenoid saponins from ardisia gigantifolia
′
,planta med.2012,78(06),617-621.
[0113]
[6]z.f.zheng,j.f.xu,z.m.feng,p.c.zhang,
′
cytotoxic triterpenoid saponins from the roots of ardisia crenata
′
,j.asian nat.prod.res.2008,10(9),833-839.
[0114]
[7]q.q.gong,l.h.mu,p.liu,s.l.yang,b.wang,y.l.feng,
′
new triterpenoid sapoin from ardisia gigantifolia stapf
′
,chinese chem.lett.2010,21(4),449-452.
[0115]
[8]h.f.tang,j.yun,h.w.lin,x.l.chen,x.j.wang,g.cheng,
′
two new triterpenoid saponins cytotoxic to human glioblastoma u251mg cells from ardisia pusilla
′
,chem.biodivers.2009,6(9),1443-1452.
[0116]
[9]editorial committee of nan jing university of chinese medicine,chinese materia medica(zhong yao da ci dian),shanghai science and technology press,shanghai,china,2014,vol.1,1181.
[0117]
[10]m.l.nordin,a.a.kadir,z.a.zakaria,r.abdullah,m.abdullah,
′
in vitro investigation of cytotoxic and antioxidative activities of ardisia crispa against breast cancer cell lines,mcf-7and mda-mb-231
′
,bmc complem.altern.m.2018,18(1),1-10.
[0118]
[11]l.t.yeong,r.a.hamid,l.s.yazan,h.khaza’ai,n.mohtarrudin,
′
low dose triterpene-quinone fraction from ardisia crispa root precludes chemical-induced mouse skin tumor promotion
′
,bmc complem.altern.m.2015,15(1),1-11.
[0119]
[12]l.w.jun,c.p.foong,r.a.hamid,
′
ardisia crispa root hexane fraction suppressed angiogenesis in human umbilical vein endothelial cells(huvecs)and in vivo zebrafish embryo model
′
,biomed.pharmacother.2019,118,109221.
[0120]
[13]l.t.yeong,r.a.hamid,l.s.yazan,h.khaza'ai,d.hamsin,
′
synergistic action of compounds isolated from the hexane extract of ardisia crispa root against tumour-promoting effect,in vitro
′
,nat.prod.res.2014,28(22),2026-2030.
[0121]
[14]r.a.hamid,f.othman,j.j.anthony,y.l.ting,
′
chemopreventive effect of ardisia crispa hexane fraction on the peri-initiation phase of mouse skin tumorigenesis
′
,med.prin.pract.2013,22(4),357-361.
[0122]
[15]m.l.nordin,a.a.kadir,z.a.zakaria,f.othman,r.abdullah,m.abdullah,
′
cytotoxicity and apoptosis induction of ardisia crispa and its solvent partitions against mus musculus mammary carcinoma cell line(4t1)
′
,evid-based compl.alt.2017.
[0123]
[16]d.hamsin,r.a.hamid,l.s.yazan,c.n.taib,l.t.yeong,
′
ardisia crispa roots inhibit cyclooxygenase and suppress angiogenesis
′
,bmc complem.altern.m.2014,14(1),1-9.
[0124]
[17]d.hamsin,r.a.hamid,l.s.yazan,c.n.taib,l.t.yeong,
′
the hexane fraction of ardisia crispa thunb.a.dc.roots inhibits inflammation-induced angiogenesis
′
,bmc complem.altern.m.2013,13(1),1-9.
[0125]
[18]h.sulaiman,r.a.hamid,l.t.yeong,f.othman,
′
anti-tumor effect of ardisia crispa hexane fraction on 7,12-dimethylbenz[α]anthracene-induced mouse skin papillomagenesis
′
,j.cancer res.ther.2012,8(3),404-410.
[0126]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。