1.本发明涉及生物工程技术领域,具体涉及到一种重组转氨酶及其在制备尼拉帕利手性中间体中的应用。
背景技术:
2.尼拉帕利(niraparib,cas:1038915-60-4),其化学结构如化学式1所示,化学名:2-[4-((3s)-3-哌啶基)苯基]-2h-吲哚-7-甲酰胺,是一种聚腺苷二磷酸核糖体聚合酶抑制剂,广泛用于复发性卵巢癌的晚期维持治疗,可显著延长病人的生存期并减少复发。
[0003][0004]
尼拉帕利的化学合成路线有三种,jones p等发表的第一代合成路线,第二代合成路线同样由jones p等通过改良第一代方案得到,第三代合成路线由美国默克公司开发。
[0005]
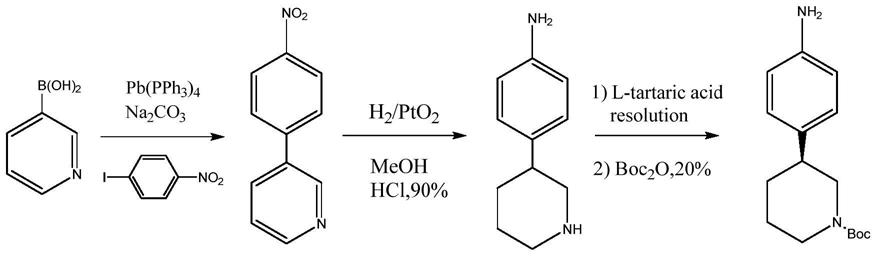
第一代合成手性中间体的方法,如图1所示,具体为:以对硝基碘苯和3-吡啶硼酸为原料,通过suzuki偶联反应,氢化还原反应,酒石酸拆分获得关键手性中间体4-(3s-哌啶-3-基)苯胺。
[0006]
第二代合成手性中间体的方法通过改良第一代得到,如图2所示,为了提高suzuki交叉偶联催化剂的稳定性,将催化剂改为负载更低的pdcl2(dppf),同时使用4-溴-1-硝基苯替代1-碘-4-硝基苯作为偶联剂,并使用色谱分离对手性中间体胺进行拆分。该工艺虽然提高了手性中间体胺的产率,但由于使用了色谱分离柱对其进行手性拆分,工艺成本高,不利于工业化放大制备。
[0007]
第三代合成手性中间体的方法由默克公司开发,采用化学-酶法合成,但仍然存在合成路线长、总收率较低的问题。
技术实现要素:
[0008]
针对上述的不足,本发明的目的是提供一种重组转氨酶及其在制备尼拉帕利手性中间体中的应用,通过选用源自节杆菌属(arthrobacter sp)knk168的编号at31转氨酶(其核苷酸序列编码如seq no.1所示)并采用本领域常规方法获得重组转氨酶,该重组转氨酶应用于尼拉帕利手性中间体的制备,具有反应条件温和、效率高、立体和区域选择性高和环境友好特点,有效避免了低效的拆分或制备规模的手性色谱和毒性较大的有机溶剂的使用。
[0009]
为达上述目的,本发明采取如下的技术方案:
[0010]
本发明提供一种重组转氨酶,其来源于分支杆菌属(arthrobacter sp)knk168的编号at31转氨酶;其中,at31转氨酶的核苷酸序列编码如seq no.1所示。
[0011]
本发明还提供上述重组转氨酶的制备方法,包括以下步骤:
[0012]
步骤(1):将包括seq no.1所示的转氨酶基因的质粒和pet28a载体用同样的限制性内切酶ndeⅰ和ecorⅰ双酶切,回收双酶切片段,经t4 dna连接酶连接,形成重组表达质粒at31-pet28a;
[0013]
步骤(2):将步骤(1)得到的重组表达质粒at31-pet28a转化大肠杆菌(e.coli)bl21(de3),即可获得基因工程菌株e.coli bl21(de3)/at31-pet28a;
[0014]
步骤(3):将步骤(2)得到的基因工程菌株e.coli bl21(de3)/at31-pet28a接种至含卡那霉素的lb培养基中培养,当培养液的光密度od600达到0.5~0.8时,加入终浓度为0.05~1.2mmol/l的异丙基-β-d-硫代吡喃半乳糖苷(iptg)进行诱导,诱导温度10~40℃,即可表达所述的重组转氨酶。
[0015]
本发明还提供上述重组转氨酶在制备尼拉帕利手性中间体(s)-5-(4-溴苯基)哌啶-2-酮中的应用。
[0016]
一种制备尼拉帕利手性中间体(s)-5-(4-溴苯基)哌啶-2-酮的方法,包括以下步骤:
[0017]
步骤(1):将溴苯与琥珀酸酐混合,冰浴降温至2-5℃;然后加入三氯化铝,室温反应3~6h,反应完毕后分离纯化,制得4-(4-溴苯基)-4-氧丁酸;其中,溴苯、琥珀酸酐和三氯化铝的质量比为180~200:15~25:45~60;
[0018]
步骤(2):将步骤(1)所得的4-(4-溴苯基)-4-氧丁酸和dmap(4-二甲氨基吡啶)加入醇类溶剂中溶解后冰浴,二环己基碳二亚胺(dcc)用醇类溶剂溶解后缓慢滴加入反应液,反应完毕后分离纯化,制得4-(4-溴苯基)-4-氧代丁酸异丙酯;其中,4-(4-溴苯基)-4-氧丁酸、二环己基碳二亚胺和4-二甲氨基吡啶的质量比为15~25:3~8:0.1~1;
[0019]
步骤(3):在惰性气体保护下,将nah置于反应容器中,加入1有机溶剂搅拌溶解;取me3soi溶解于有机溶剂中,缓慢加入至nah溶液中,制备叶立德试剂;将步骤(2)所得的4-(4-溴苯基)-4-氧代丁酸异丙酯用有机溶剂溶解后缓慢加入至上述叶立德试剂中,室温反应10~15min,升温至50~70℃反应25~55min;反应完成后分离纯化,制得4-(4-溴苯基)-5-氧代丁酸异丙酯;
[0020]
步骤(4):以步骤(3)所得的4-(4-溴苯基)-5-氧代丁酸异丙酯为反应底物,上述重组转氨酶作为生物催化酶和吡哆醛-5-磷酸酯(plp)为辅酶,i-prnh2为胺供体,酶法催化制得尼拉帕利手性中间体(s)-5-(4-溴苯基)哌啶-2-酮;其中,4-(4-溴苯基)-4-氧代丁酸异丙酯、重组转氨酶、吡哆醛-5-磷酸酯和i-prnh2的质量比为1:50~1:5~0.01~0.1:1:100。
[0021]
进一步地,步骤(1)中溴苯、琥珀酸酐和三氯化铝的质量比优选为188:20:53。
[0022]
进一步地,步骤(2)中4-(4-溴苯基)-4-氧丁酸、二环己基碳二亚胺和4-二甲氨基吡啶的质量比为的质量比优选为20:4.8:0.1。
[0023]
进一步地,步骤(2)中醇类溶剂包括乙醇、甲醇、正丙醇和异丙醇(ipa)中的至少一种,优选为异丙醇(ipa)。
[0024]
进一步地,步骤(4)中4-(4-溴苯基)-4-氧代丁酸异丙酯、重组转氨酶、吡哆醛-5-磷酸酯和i-prnh2的质量比优选为20:1:0.1:1。
[0025]
进一步地,步骤(4)中反应温度为20~50℃,反应时长为12~24小时。
[0026]
综上所述,本发明具有以下优点:
[0027]
1、本发明提供了一种重组转氨酶及其在制备尼拉帕利手性中间体中的应用,通过选用源自节杆菌属(arthrobacter sp)knk168的编号at31转氨酶(其核苷酸序列编码如seq no.1所示)并采用本领域常规方法获得重组转氨酶,该重组转氨酶应用于尼拉帕利手性中间体的制备,具有反应条件温和、效率高、立体和区域选择性高和环境友好特点,有效避免了低效的拆分或制备规模的手性色谱和毒性较大的有机溶剂的使用。
[0028]
2、相较于现有尼拉帕利前体酮4-(4-溴苯基)-5-氧化丁酸异丙酯的合成路线,如图3所示,本发明中合成4-(4-溴苯基)-4-氧化丁酸异丙酯(3-1-b)时采用用dmap(4-二甲氨基吡啶)为催化剂,dcc为缩合剂进行反应;同时采用碱性更强的nah,反应效果明显改善,产物收率提高。
附图说明
[0029]
图1为现有技术报道的第一代尼拉帕利手性中间体胺合成路线图;
[0030]
图2为现有技术报道的第二代尼拉帕利手性中间体胺合成路线图;
[0031]
图3为现有技术报道的尼拉帕利前体酮4-(4-溴苯基)-5-氧化丁酸异丙酯的合成路线图;
[0032]
图4为本发明中4-(4-溴苯基)-4-氧丁酸的质谱图;
[0033]
图5为本发明中4-(4-溴苯基)-4-氧丁酸的氢谱图;
[0034]
图6为本发明中4-(4-溴苯基)-4-氧代丁酸异丙酯的质谱图;
[0035]
图7为本发明中4-(4-溴苯基)-4-氧代丁酸异丙酯的氢谱图;
[0036]
图8为本发明中4-(4-溴苯基)-5-氧代丁酸异丙酯的质谱图;
[0037]
图9为本发明中4-(4-溴苯基)-5-氧代丁酸异丙酯的氢谱图;
[0038]
图10为本发明中(s)-5-(4-溴苯基)哌啶-2-酮标准曲线图;
[0039]
图11为本发明中(s)-5-(4-溴苯基)哌啶-2-酮的高效液相图谱一;
[0040]
图12为本发明中(s)-5-(4-溴苯基)哌啶-2-酮的高效液相图谱一;
[0041]
图13为本发明中(s)-5-(4-溴苯基)哌啶-2-酮的质谱图;
[0042]
图14为本发明中(s)-5-(4-溴苯基)哌啶-2-酮的氢谱图。
具体实施方式
[0043]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,即所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
[0044]
因此,以下对提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0045]
实施例1
[0046]
本例提供尼拉帕利前体酮4-(4-溴苯基)-5-氧化丁酸异丙酯的制备,包括以下步骤:
[0047]
4-(4-溴苯基)-4-氧丁酸(3-1-a):将溴苯125ml与琥珀酸酐20g混合,冰浴降温至2-5℃;加入三氯化铝53.34g,室温反应5h。反应完成,将反应液加入2-5℃的水(300ml)与盐酸(37%,55ml)混合液中,产物经过滤,纯水洗涤,滤饼在mtbe中浆化,饱和naoh溶液溶解后,静置分层;将水层浓盐酸酸化至ph=1,产生白色悬浮物,过滤,洗涤;滤饼干燥后的到白色粉末3-1-a,质谱及氢谱图见图4-5;
[0048]
4-(4-溴苯基)-4-氧代丁酸异丙酯(3-1-b):称取3-1-a 20g,加入100ml ipa溶解后冰浴,dcc 4.8g用ipa溶解后缓慢滴加入反应液,反应完毕后,反应液过滤浓缩,dcm溶解后4℃静置,析出白色固体,过滤(反复3次);滤液用5%的koh溶液洗涤,水洗,5%冰醋酸溶液洗涤,10%aq nacl溶液洗涤,最后分离有机相,无水na2so4干燥,浓缩得到白色粉末的3-1-b,质谱及氢谱图见图6-7;
[0049]
4-(4-溴苯基)-5-氧代丁酸异丙酯(3-1-c):将nah 3.13g置于250ml圆底烧瓶中,冲入n2保护,加入10ml的dmso搅拌溶解;取me3soi 17.16g溶解于dmso中,缓慢加入至nah溶液中,制备叶立德试剂。去中间体3-1-b 19.4g,加入25ml的dmso溶解后缓慢加入至叶立德试剂中,室温反应15min,升温至60℃反应30min;反应完成加入正己烷稀释反应液,加入冰水淬灭,10%aq nacl溶液洗涤,取有机相干燥、浓缩得到产物17.44g,产物用甲苯溶解,加入znbr
2 3.66g,室温反应1.5h。反应完成后滤液过滤,滤液用10%aq nacl溶液洗涤,采用硅胶柱(洗脱液:乙酸乙酯/石油醚=1:2)分离产物,浓缩得到3-1-c为黄色油状物,质谱及氢谱图见图8-9。
[0050]
实施例2
[0051]
本例提供转氨酶催化合成尼拉帕利手性中间体(s)-5-(4-溴苯基)哌啶-2-酮的方法,包括以下步骤:
[0052]
步骤一:重组转氨酶的基因工程菌的制备
[0053]
(1)选择来自于arthrobacter sp knk168的编号at31转氨酶序列,交由上海生工生物工程股份有限公司合成其基因片段,表达载体选择pet 28a;
[0054]
(2)从-70℃冰箱中取出已分装好的大肠杆菌bl21(de3)感受态细胞,每一管都含有100μl的感受态细胞。迅速放置到冰盒中的冰上,整个离心管埋于冰中,等待其细胞低温融解(约10min),轻拿离心管上部,切勿用手直接接触管底部,轻弹管壁,以使悬浮细胞;
[0055]
(3)用移液枪吸取2μl全合成的at31-pet28a重组质粒,直接加入到感受态细胞中,轻微摇动,使其充分混匀。然后将离心管重新放置于冰中,用冰覆盖管上部;
[0056]
(3)冰浴30分钟,迅速拿到42℃的水浴锅中,温浴60秒;
[0057]
(4)水浴完毕后立刻将离心管放置于冰上5分钟,每管加入600μl室温状态下的没有抗性的lb培养基,将离心管置于孔板中,放入摇床中。37℃,200rpm,预培养一个小时使细胞复苏;
[0058]
(5)将培养一小时后的离心管,室温,4500rpm,离心1min,倒掉部分上清,每管大约50μl的转化产物加到有卡纳青霉素抗性的lb平板中,轻轻用涂布棒均匀涂布,待其液体完全被培养基所吸收,37℃培养12h,挑取阳性克隆,即获得可以诱导表达重组转氨酶的基因工程菌;
[0059]
步骤二:重组转氨酶的制备
[0060]
将重组脂肪酶的基因工程菌接种到含有卡那霉素抗性的lb液体培养基中,于37℃
培养16h,得到种子培养液;将种子培养液接种到含有卡那霉素抗性的lb液体培养基中,接种量为含有含有卡那霉素抗性的lb液体培养基体积的1%;然后置于37℃下培养培养至od
600
值为0.6-0.8,加入终浓度为1mm的异丙基-β-d-半乳糖苷,置于18℃继续培养20-24h,于8000rmp、4℃离心收集菌体;采用ph值为7.5、100mmol/l的磷酸盐缓冲液将收集的菌体洗涤一次,重新离心后收集菌体,冷冻干燥后即为粗酶粉;
[0061]
步骤三:生物酶催化合成尼拉帕利手性中间体
[0062]
以实施例1所得尼拉帕利前体酮3-1-c为底物,取10mg上述所得转氨酶冻干粉于2ml的反应瓶中,加入100mmol/l ph 7.5的磷酸缓冲液,终浓度为为20mmol/l的3-1-c,1mmol的i-prnh2和2mmol/l的plp,10%的dmso(v/v)助溶;在温度45℃,转速300rpm的条件下催化反应24h。取500μl反应液,加入10n naoh 50μl终止反应,加入(2x 450μl)乙酸乙酯,4000rpm 90s离心分离,无水na2so4干燥浓缩,最后流动相溶解,进行液相检测:
[0063]
色谱柱:chiraipak ad-rh柱
[0064]
流动相:0.1%h3po4水溶液:mecn=2:3
[0065]
检测条件:流速0.5ml/min;检测波长210nm;柱温40℃
[0066]
(s)-5-(4-溴苯基)哌啶-2-酮标准曲线采用外标法,配置浓度分别为0、0.1、0.2、0.4、0.6、0.8、1.0mmol/l的标准溶液,通过液相检测,根据出峰面积与浓度的关系绘制标准曲线,见图10,建立回归方程y=0.3465x 1.7808,r2=0.99955
[0067]
转化率=产物实际生成量/产物理论生成量x 100%
[0068]
经检测,以4-(4-溴苯基)-5-氧代丁酸异丙酯为底物,最终产物3-2-d((s)-5-(4-溴苯基)哌啶-2-酮)的转化率为87%,ee值为99%以上,其转化率和ee值均明显由于目前背景技术中所提现有技术的工艺水平,hplc图谱、质谱和氢谱图见图11、12、13和14。
[0069]
以上内容仅仅是对本发明结构所作的举例和说明,所属本领域的技术人员不经创造性劳动即对所描述的具体实施例做的修改或补充或采用类似的方式替代仍属本专利的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。