补体c2结合蛋白及其用途
1.相关申请数据
2.本技术要求于2019年8月12日提交的题目为“补体c2结合蛋白及其用途”的澳大利亚专利申请号2019902900的优先权。该申请的全部内容通过引用并入本文。
3.序列表
4.本技术同时提交了电子形式的序列表。序列表的全部内容通过引用并入本文。
技术领域
5.本公开涉及结合补体c2(c2)的蛋白及其用途,例如,在治疗或预防补体介导病症的疗法中的用途。
背景技术:
6.补体系统是针对入侵的病原体的体液应答的重要成分。然而,补体的过度激活与病理学有关,例如,与抗体介导的移植排斥、纤维化和慢性自身免疫病症有关。补体c2(c2),也称为补体成分2,是补体系统的早期激活物。c2(732个氨基酸,~100kda)在肝脏中作为无活性酶原产生,由下列5个结构域组成:三个n-末端补体控制蛋白(“ccp”,氨基酸13-223),一个血管性血友病因子a型(von willebrand factor a-type,vwa)结构域,和一个c-末端胰蛋白酶样丝氨酸蛋白酶(sp)结构域。c2被补体组分c4b快速激活,在病原体或细胞表面处的抗体沉积(经典通路)或糖类识别(凝集素通路)后补体组分c4b本身被激活。c4bc2复合物被c1s或masp2裂解成c2a和c2b。c2a是较大的有酶活性的片段,它被掺入到c3转化酶中。较小的片段c2b被释放到液相中。
7.靶向c2提供了在不显著影响补体旁路的条件下调节经典通路和凝集素通路的机会。因此,对于可以抑制c2和/或减少循环中c2的量以便例如治疗或预防补体介导病症的药剂存在着需求。
技术实现要素:
8.本发明人已经制备了一类蛋白,所述蛋白包含结合人补体c2(c2)的抗原结合位点(例如,所述蛋白是fab和抗体)。这些蛋白在中性ph(即,大约7.3)时相对于初级内体ph(即,大约6.0)时以更大的亲和力与c2结合。本发明人认为这允许蛋白结合循环中的c2,同时在c2结合蛋白再循环前释放内体内的c2进行降解。
9.因此,本公开提供了一种包含抗原结合位点的蛋白,所述蛋白在中性ph时以比酸性ph时更大的亲和力与c2结合。在一些实例中,中性ph为在7.0-7.5范围内的ph。在一些实例中,酸性ph为在5.5-6.0范围内的ph。
10.本公开还提供了一种包含抗原结合位点的蛋白,所述蛋白在ph 7.3时以比酸性ph 6.0时更大的亲和力与c2结合。不希望受理论约束,此类蛋白可以在中性ph时结合c2,而且一旦被内化到酸性初级内体(大约ph 6.0)中则具有增加的从c2解离的倾向。与c2的此ph-依赖性结合允许蛋白与循环中的c2结合,接着是蛋白-c2复合物的内化,内体中的c2解离以
及c2运输到溶酶体进行降解,以及蛋白经新生儿fc受体(fcrn)再循环回细胞表面,由此减少了循环中c2的浓度。这些蛋白可以称作“清扫”或“清洁工”蛋白,或称作“再循环”蛋白。
11.在一些实例中,所述蛋白与被下列结合的c2中的相同表位结合:
12.(i)rf16-226g(包含重链可变区(vh)和轻链可变区(v
l
),所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:6所示的序列);
13.(ii)rf16-214g(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:7所示的序列);
14.(iii)rf16-242g(包含vh和v
l
,所述vh包含seq id no:4所示的序列,所述v
l
包含seq id no:8所示的序列);
15.(iv)rf16-226(包含vh和v
l
,所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:9所示的序列);
16.(v)rf16-214(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:10所示的序列);
17.(vi)rf16-242(包含vh和v
l
,所述vh包含seq id no:5所示的序列,所述v
l
包含seq id no:11所示的序列);
18.(vii)rf16-191(包含vh和v
l
,所述vh包含seq id no:46所示的序列,所述v
l
包含seq id no:50所示的序列);或
19.(viii)rf16-203(包含vh和v
l
,所述vh包含seq id no:47所示的序列,所述v
l
包含seq id no:51所示的序列)。
20.在一些实例中,所述蛋白与被下列结合的c2中的相同表位结合:
21.(i)rf16-226g(包含重链可变区(vh)和轻链可变区(v
l
),所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:6所示的序列);
22.(ii)rf16-214g(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:7所示的序列);或
23.(iii)rf16-242g(包含vh和v
l
,所述vh包含seq id no:4所示的序列,所述v
l
包含seq id no:8所示的序列)。
24.在一些实例中,所述蛋白结合与被下列结合的表位重叠的c2中的表位:
25.(i)rf16-226g(包含重链可变区(vh)和轻链可变区(v
l
),所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:6所示的序列);
26.(ii)rf16-214g(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:7所示的序列);
27.(iii)rf16-242g(包含vh和v
l
,所述vh包含seq id no:4所示的序列,所述v
l
包含seq id no:8所示的序列);
28.(iv)rf16-226(包含vh和v
l
,所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:9所示的序列);
29.(v)rf16-214(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:10所示的序列);
30.(vi)rf16-242(包含vh和v
l
,所述vh包含seq id no:5所示的序列,所述v
l
包含seq id no:11所示的序列);
31.(vii)rf16-191(包含vh和v
l
,所述vh包含seq id no:46所示的序列,所述v
l
包含seq id no:50所示的序列);或
32.(viii)rf16-203(包含vh和v
l
,所述vh包含seq id no:47所示的序列,所述v
l
包含seq id no:51所示的序列)。
33.在一些实例中,所述蛋白结合与被下列结合的表位重叠的c2中的表位:
34.(i)rf16-226g(包含重链可变区(vh)和轻链可变区(v
l
),所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:6所示的序列);
35.(ii)rf16-214g(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:7所示的序列);或
36.(iii)rf16-242g(包含vh和v
l
,所述vh包含seq id no:4所示的序列,所述v
l
包含seq id no:8所示的序列)。
37.在一些实例中,所述蛋白竞争性地抑制下列抗体中的任一个或多个与c2的结合:
38.(i)rf16-226g(包含重链可变区(vh)和轻链可变区(v
l
),所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:6所示的序列);
39.(ii)rf16-214g(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:7所示的序列);
40.(iii)rf16-242g(包含vh和v
l
,所述vh包含seq id no:4所示的序列,所述v
l
包含seq id no:8所示的序列);
41.(iv)rf16-226(包含vh和v
l
,所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:9所示的序列);
42.(v)rf16-214(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:10所示的序列);
43.(vi)rf16-242(包含vh和v
l
,所述vh包含seq id no:5所示的序列,所述v
l
包含seq id no:11所示的序列);
44.(vii)rf16-191(包含vh和v
l
,所述vh包含seq id no:46所示的序列,所述v
l
包含seq id no:50所示的序列);或
45.(viii)rf16-203(包含vh和v
l
,所述vh包含seq id no:47所示的序列,所述v
l
包含seq id no:51所示的序列)。
46.在一些实例中,所述蛋白竞争性地抑制下列抗体中的任一个或多个与c2的结合:
47.(i)rf16-226g(包含vh和v
l
,所述vh包含seq id no:2所示的序列,所述v
l
包含seq id no:6所示的序列);
48.(ii)rf16-214g(包含vh和v
l
,所述vh包含seq id no:3所示的序列,所述v
l
包含seq id no:7所示的序列);
49.(iii)rf16-242g(包含vh和v
l
,所述vh包含seq id no:4所示的序列,所述v
l
包含seq id no:8所示的序列)。
50.本发明人已经显示抗体rf16-226g、rf16-214g、rf16-242g、rf16-226、rf16-214、rf16-242、rf16-191和rf16-203以ph依赖的方式与c2结合,并且相对于非ph依赖抗体在独特的表位上结合c2。因此,如技术人员会理解的是,竞争性抑制这些抗体之一的结合、或与这些抗体之一在相同表位的结合的蛋白也预期具有ph依赖的性质。确定结合蛋白的表位或
确定结合的竞争性抑制的合适方法记载在本文中。
51.在一些实例中,所述蛋白在ph 7.3时与c2结合的亲和力是在ph 6.0时的亲和力的至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少11倍、或至少12倍。
52.在一个实例中,所述蛋白在ph 7.3时与c2结合的亲和力是在ph 6.0时的亲和力的至少2倍。在一个实例中,所述蛋白在ph 7.3时与c2结合的亲和力是在ph 6.0时的亲和力的至少10倍。
53.在一些实例中,所述蛋白在ph 7.3时以至少约500nm、至少约250nm、至少约100nm、至少约50nm、至少约30nm、至少约15nm、或至少约10nm的亲和力与c2结合,其中在其中所述蛋白被固定化且c2与固定化的蛋白接触的测定中测定亲和力。用于测定蛋白与c2的亲和力的合适方法记载在本文中。
54.在一个实例中,所述蛋白在ph 7.3时以至少约30nm的亲和力与c2结合,其中在其中所述蛋白被固定化且c2与固定化的蛋白接触的测定中测定亲和力。
55.在一些实例中,所述蛋白在ph6.0时以至多约20nm、至多约35nm、至多约50nm、至多约75nm、至多约100nm、或至多约120nm的亲和力与c2结合,其中在其中所述蛋白被固定化且c2与固定化的蛋白接触的测定中测定亲和力。
56.在一些实例中,所述蛋白在ph 6.0时以至多约50nm的亲和力与c2结合,其中在其中所述蛋白被固定化且c2与固定化的蛋白接触的测定中测定亲和力。
57.在一个实例中,所述蛋白在ph 7.3时以至少约30nm的亲和力与c2结合,并且所述蛋白在ph 6.0时以至多约50nm的亲和力与c2结合,其中在其中所述蛋白被固定化且c2与固定化的蛋白接触的测定中测定亲和力。
58.在一些实例中,所述蛋白对c2的亲和力对ca
2
浓度不敏感。在一个实例中,在存在约2mm ca
2
的情况下,所述蛋白对c2的亲和力类似于在缺少ca
2
时(即,0mm ca
2
)所述蛋白对c2的亲和力。在一些实例中,在存在约2mm ca
2
和缺少ca
2
的情况下所述蛋白对c2的亲和力在两种情况彼此的4倍、3倍、2倍、1.5倍或1.2倍内。在一些实例中,在存在约2mm ca
2
和缺少ca
2
的情况下在ph 7.3测定所述蛋白对c2的亲和力。在一些实例中,在存在约2mm ca
2
和缺少ca
2
的情况下在ph 6.0测定所述蛋白对c2的亲和力。
59.在一个实例中,在存在约2mm ca
2
和缺少ca
2
的情况下所述蛋白对c2的亲和力在两种情况彼此的2倍内。
60.在一些实例中,在存在约2mm ca
2
的情况下所述蛋白对c2的亲和力比在缺少ca
2
(即,0mm)的情况下所述蛋白对c2的亲和力低,或是在缺少ca
2
(即,0mm)的情况下所述蛋白对c2的亲和力的不超过4倍、3倍、2倍、1.5倍或1.2倍。
61.在一些实例中,所述蛋白例如以相似的亲和力与人和食蟹猴c2两者结合。此类蛋白是有利的,因为它们有助于在密切相关的非人哺乳动物中的临床前研究。
62.在一些实例中,所述蛋白与人和食蟹猴c2的亲和力在两者彼此的5倍内。在一些实例中,所述蛋白与人和食蟹猴c2的亲和力在两者彼此的4倍、3倍、2倍或1.5倍内。
63.在一些实例中,所述蛋白在ph 7.3时以至少约500nm、至少约250nm、至少约100nm、至少约50nm、至少约30nm、至少约15nm、或至少约10nm的亲和力与食蟹猴c2结合,其中在其中所述蛋白被固定化且食蟹猴c2与固定化的蛋白接触的测定中测定亲和力。
64.在一些实例中,所述蛋白在ph6.0时以至多约20nm、至多约35nm、至多约50nm、至多约75nm、至多约100nm、或至多约120nm的亲和力与食蟹猴c2结合,其中在其中所述蛋白被固定化且食蟹猴c2与固定化的蛋白接触的测定中测定亲和力。
65.在一些实例中,所述蛋白在ph 7.3时与食蟹猴c2结合的亲和力是在ph 6.0时的亲和力的至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少11倍、或至少12倍。
66.在一些实例中,所述蛋白与犬c2、大鼠c2、兔c2、猪c2和/或绵羊c2的结合是检测不到的。
67.在一些实例中,所述蛋白结合小鼠c2。在一些实例中,所述蛋白以至少1000nm、或至少500nm、或至少200nm的亲和力与小鼠c2结合。在一个实例中,所述蛋白以至少200nm的亲和力与小鼠c2结合。
68.在一些实例中,所述蛋白对seq id no:1中在下列之一处被丙氨酸置换的多肽的亲和力:
69.(i)seq id no:1的位置443处的赖氨酸;
70.(ii)seq id no:1的位置331处的组氨酸;或
71.(iii)seq id no:1的位置457处的赖氨酸,
72.低于所述蛋白与seq id no:1的多肽的亲和力。
73.本发明人已经显示c2中的上述氨基酸参与ph-依赖性结合蛋白的结合。
74.在一些实例中,所述蛋白对seq id no:1中位置443处赖氨酸被丙氨酸置换的多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力。在一些实例中,所述蛋白对seq id no:1中位置331处组氨酸被丙氨酸置换的多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力。在一些实例中,所述蛋白对seq id no:1中位置457处赖氨酸被丙氨酸置换的多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力。
75.在一些实例中,所述蛋白对下述多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力:
76.(i)seq id no:1中位置443处赖氨酸被丙氨酸置换的多肽;和
77.(ii)seq id no:1中位置331处组氨酸被丙氨酸置换的多肽。
78.在一些实例中,所述蛋白对下述多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力:
79.(i)seq id no:1中位置443处赖氨酸被丙氨酸置换的多肽;
80.(ii)seq id no:1中位置331处组氨酸被丙氨酸置换的seq id no:1的多肽;和
81.(iii)seq id no:1中位置457处赖氨酸被丙氨酸置换的多肽。
82.在一些实例中,所述蛋白对seq id no:1中位置274处的赖氨酸、位置437处的苯丙氨酸、位置454处的天冬氨酸、位置648处的甲硫氨酸、位置703处的天冬酰胺、位置706处的亮氨酸,或位置724处的脯氨酸被丙氨酸置换的多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力。在一些实例中,所述蛋白对seq id no:1中位置717处丙氨酸被丝氨酸置换的多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力。
83.在一些实例中,所述蛋白对下述多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力:
84.(i)seq id no:1中位置443处赖氨酸被丙氨酸置换的seq id no:1的多肽;
85.(ii)seq id no:1中位置331处组氨酸被丙氨酸置换的seq id no:1的多肽;
86.(iii)seq id no:1中位置457处赖氨酸被丙氨酸置换的seq id no:1的多肽;
87.(iv)seq id no:1中位置274处赖氨酸被丙氨酸置换的seq id no:1的多肽;
88.(v)seq id no:1中位置437处苯丙氨酸被丙氨酸置换的seq id no:1的多肽;
89.(vi)seq id no:1中位置454处天冬氨酸被丙氨酸置换的seq id no:1的多肽;
90.(vii)seq id no:1中位置648处甲硫氨酸被丙氨酸置换的多肽;
91.(viii)seq id no:1中位置703处天冬酰胺被丙氨酸置换的seq id no:1的多肽;
92.(ix)seq id no:1中位置706处亮氨酸被丙氨酸置换的seq id no:1的多肽;
93.(x)seq id no:1中位置724处脯氨酸被丙氨酸置换的seq id no:1的多肽;和
94.(xi)seq id no:1中位置717处丙氨酸被丝氨酸置换的seq id no:1的多肽。
95.在一些实例中,所述蛋白对seq id no:1中位置439处的亮氨酸、位置453处的亮氨酸、位置270处的苯丙氨酸、位置271处的异亮氨酸、位置274处的赖氨酸、位置275处的谷氨酸、位置282处的天冬氨酸、或位置320处的异亮氨酸被丙氨酸置换的多肽的亲和力低于所述蛋白对seq id no:1的多肽的亲和力。
96.在一些实例中,所述蛋白对包含所述置换的多肽的亲和力是所述蛋白对seq id no:1的多肽的亲和力的至多五分之一、十分之一、十五分之一或二十分之一。在一些实例中,所述蛋白对包含所述置换的多肽的亲和力是所述蛋白对seq id no:1的多肽的亲和力的至多十分之一。在一些实例中,所述蛋白对包含所述置换的多肽的亲和力是所述蛋白对seq id no:1的多肽的亲和力的至多二十分之一。
97.在一些实例中,所述蛋白与包含在seq id no:1的位置443处的丙氨酸置换的多肽的结合是检测不到的。在一些实例中,所述蛋白与包含在seq id no:1的位置331处的丙氨酸置换的多肽的结合是检测不到的。在一些实例中,所述蛋白与包含在seq id no:1的位置457处的丙氨酸置换的多肽的结合是检测不到的。
98.在一些实例中,所述蛋白与下列多肽的结合是检测不到的:
99.(i)seq id no:1中位置443处赖氨酸被丙氨酸置换的多肽;和
100.(ii)seq id no:1中位置331处组氨酸被丙氨酸置换的多肽。
101.在一些实例中,所述蛋白与下列多肽的结合是检测不到的:
102.(i)seq id no:1中位置443处赖氨酸被丙氨酸置换的多肽;
103.(ii)seq id no:1中位置331处组氨酸被丙氨酸置换的多肽;和
104.(iii)seq id no:1中位置457处赖氨酸被丙氨酸置换的多肽。
105.在本文中记载了包含具有或不具有其他置换的seq id no:1的氨基酸的多肽的其他形式与本公开的蛋白结合或不显著地结合或无法检测到地结合,并且被认为经适当修改后可适用于本公开的现有实例。
106.在一些实例中,所述蛋白结合包含c2的血管性血友病因子a型(vwa)结构域内的残基的表位。在一些实例中,所述蛋白结合包含c2的肽酶s1结构域内的残基的表位。在一些实例中,所述蛋白结合包含c2的vwa结构域和肽酶s1结构域内的残基的表位。在一些实例中,所述表位中至少50%、至少60%、至少70%、至少80%或至少90%的残基在c2的vwa结构域内。在一些实例中,所述表位中至少50%的残基在c2的vwa结构域内。在一些实例中,所述表
位中至少90%的残基在c2的vwa结构域内。
107.在一些实例中,所述蛋白结合包含选自seq id no:1的266-284、318-333和428-459的一个或两个或三个区域内的残基的表位。在一些实例中,所述蛋白结合包含seq id no:1的266-284、318-333和428-459区域内的残基的表位。在一些实例中,所述蛋白结合包含在seq id no:1的位置274、331、443和457处的氨基酸的表位。在一些实例中,所述蛋白结合包含在seq id no:1的位置274、331、437、443、454、457、648、703、706、717和724处的至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或全部氨基酸的表位。在一些实例中,所述蛋白结合包含在seq id no:1的位置274、331、437、443、454、457、648、703、706、717和724处的氨基酸的表位。
108.在一些实例中,所述蛋白以至少50nm或至少10nm的ic
50
抑制人经典补体通路和/或人凝集素补体通路,其中所述ic
50
通过补体测定确定。有利地是,此类蛋白除了通过它们的ph-依赖性结合减少循环中c2的浓度以外,还可以直接抑制补体活性。
109.在一些实例中,所述蛋白以至少500nm、至少250nm、至少100nm、至少50nm、至少25nm或至少10nm的ic
50
抑制人经典补体通路和/或人凝集素补体通路,其中所述ic
50
通过补体测定确定。在一些实例中,所述蛋白以至少25nm的ic
50
抑制人经典补体通路和/或人凝集素补体通路,其中所述ic
50
通过补体测定确定。
110.测定蛋白的抑制活性的方法对专业技术人员来说是显而易见的和/或记载在本文中。在一个实例中,使用体外测定确定补体抑制活性。例如,使用酶免疫测定(例如,测量补体激活的免疫测定,诸如补体测定试剂盒)测量补体活性。例如,使用对在补体激活期间产生的抗原或表位(例如,c5b-9或c5b-c9中存在的表位)特异的标记抗体测定补体抑制活性。在一个实例中,微量滴定板的孔用经典通路、凝集素通路或旁路的特异性激活物包被。在一个实例中,本公开的蛋白与正常人血清和适宜的测定稀释剂(即,包含适宜的封闭组分以确保经典通路、凝集素通路或旁路的特异性激活的稀释剂)孵育并加入至用经典通路、凝集素通路或旁路的特异性激活物包被的微量滴定板中,使用针对c5b-9的特异性碱性磷酸酶标记抗体检测形成的c5b-9复合物的量。在一个实例中,产生的补体激活产物(即,c5b-9)的量与补体通路的功能活性成比例。在一个实例中,测定半最大抑制剂浓度(即,ic
50
)。在另一个实例中,使用溶血测定(例如,经典通路(即,ch50)和旁路(aph50)抑制测定)测定补体抑制活性。
111.在一些实例中,所述蛋白以至少500nm、至少250nm、至少100nm、至少50nm、至少25nm或至少10nm的ic
50
抑制食蟹猴经典补体通路和/或食蟹猴凝集素补体通路,其中所述ic
50
通过补体测定确定。在一些实例中,所述蛋白以至少25nm的ic
50
抑制食蟹猴经典补体通路和/或食蟹猴凝集素补体通路,其中所述ic
50
通过补体测定确定。
112.在一些实例中,所述蛋白抑制c1s-介导的c2蛋白水解。因此,在一些实例中,所述蛋白能够通过阻止有酶活性的c2a片段的释放来抑制c2的激活。由本文所述的蛋白对c1s-介导的c2蛋白水解的抑制可以在体外使用实例中所述的方法,或本领域中已知的任何其他方法来测量。例如,包含c2的具有或不具有所述蛋白的混合物可以与不同浓度的c1s孵育。在与c1s孵育后,对具有和不具有所述蛋白的反应可以使用例如sds-page测量由蛋白水解
产生的c2a(c2的最大的酶活性片段)和/或c2b(较小的无活性片段)的量。如果在c2和c1s的给定浓度下发生了对c1s-介导的c2蛋白水解的抑制,则相对于缺少所述蛋白,在所述蛋白的存在下产生的c2a和/或c2b的量较少。
113.在一些实例中,所述蛋白与c2a的结合是检测不到的。在一些实例中,所述蛋白与人c2a的结合是检测不到的。
114.在一些实例中,所述蛋白与c2b的结合是检测不到的。在一些实例中,所述蛋白与人c2b的结合是检测不到的。
115.在一些实例中,所述蛋白包含vh。在一些实例中,所述蛋白包含v
l
。在一些实例中,所述蛋白包含vh和v
l
。
116.在一些实例中,所述蛋白包括:
117.(i)包含互补决定区(cdr)1、cdr2和cdr3的vh,所述cdr1包含与seq id no:12-14、54或60所示的任一序列至少约70%、80%或90%相同的序列,所述cdr2包含与seq id no:15-17、55或61所示的任一序列至少约70%、80%或90%相同的序列,所述cdr3包含与seq id no:18-20、56或62所示的任一序列至少约70%、80%或90%相同的序列;和/或
118.(ii)包含cdr1、cdr2和cdr3的v
l
,所述cdr1包含与seq id no:21-23、57或63所示的任一序列至少约70%、80%或90%相同的序列,所述cdr2包含与seq id no:24-26、58或64所示的任一序列至少约70%、80%或90%相同的序列,所述cdr3包含与seq id no:27-29、59或65所示的任一序列至少约70%、80%或90%相同的序列。
119.在一些实例中,所述蛋白包含:
120.(i)包含互补决定区(cdr)1、cdr2和cdr3的vh,所述cdr1包含与seq id no:12-14所示的任一序列至少约70%、80%或90%相同的序列,所述cdr2包含与seq id no:15-17所示的任一序列至少约70%、80%或90%相同的序列,所述cdr3包含与seq id no:18-20所示的任一序列至少约70%、80%或90%相同的序列;和/或
121.(ii)包含cdr1、cdr2和cdr3的v
l
,所述cdr1包含与seq id no:21-23所示的任一序列至少约70%、80%或90%相同的序列,所述cdr2包含与seq id no:24-26所示的任一序列至少约70%、80%或90%相同的序列,所述cdr3包含与seq id no:27-29所示的任一序列至少约70%、80%或90%相同的序列。
122.在一些实例中,所述蛋白包含分别包含seq id no:40,41和42所示的序列的cdr1、cdr2和cdr3的vh。在一些实例中,所述蛋白包括分别包含seq id no:43,44和45所示的序列的cdr1、cdr2和cdr3的v
l
。
123.在一些实例中,所述蛋白包含分别包含seq id no:40、41和42所示的序列的cdr1、cdr2和cdr3的vh和分别包含seq id no:43、44和45所示的序列的cdr1、cdr2和cdr3的v
l
。
124.在一些实例中,所述蛋白包含分别包含seq id no:66、67和68所示的序列的cdr1、cdr2和cdr3的vh。在一些实例中,所述蛋白包括分别包含seq id no:69、70和71所示的序列的cdr1、cdr2和cdr3的v
l
。
125.在一些实例中,所述蛋白包含分别包含seq id no:66、67和68所示的序列的cdr1、cdr2和cdr3的vh和分别包含seq id no:69、70和71所示的序列的cdr1、cdr2和cdr3的v
l
。
126.在一些实例中,所述蛋白包含:
127.(i)vh和v
l
,所述vh包含:包含相对于seq id no:12具有不超过2个氨基酸置换的序
列的cdr1,包含相对于seq id no:15具有不超过4个氨基酸置换的序列的cdr2,和包含相对于seq id no:18具有不超过2个氨基酸置换的序列的cdr3,所述v
l
包含:包含相对于seq id no:21具有不超过3个氨基酸置换的序列的cdr1,包含相对于seq id no:24具有不超过2个氨基酸置换的序列的cdr2,和包含相对于seq id no:27具有不超过3个氨基酸置换的序列的cdr3;
128.(ii)vh和v
l
,所述vh包含:包含相对于seq id no:13具有不超过2个氨基酸置换的序列的cdr1,包含相对于seq id no:16具有不超过4个氨基酸置换的序列的cdr2,和包含相对于seq id no:19具有不超过3个氨基酸置换的序列的cdr3,所述v
l
包含:包含相对于seq id no:22具有不超过3个氨基酸置换的序列的cdr1,包含相对于seq id no:25具有不超过2个氨基酸置换的序列的cdr2,和包含相对于seq id no:28具有不超过3个氨基酸置换的序列的cdr3;
129.(iii)vh和v
l
,所述vh包含:包含相对于seq id no:14具有不超过2个氨基酸置换的序列的cdr1,包含相对于seq id no:17具有不超过4个氨基酸置换的序列的cdr2,和包含相对于seq id no:20具有不超过3个氨基酸置换的序列的cdr3,所述v
l
包含:包含相对于seq id no:23具有不超过3个氨基酸置换的序列的cdr1,包含相对于seq id no:26具有不超过2个氨基酸置换的序列的cdr2,和包含相对于seq id no:29具有不超过3个氨基酸置换的序列的cdr3;
130.(iv)vh和v
l
,所述vh包含:包含相对于seq id no:54具有不超过2个氨基酸置换的序列的cdr1,包含相对于seq id no:55具有不超过4个氨基酸置换的序列的cdr2,和包含相对于seq id no:56具有不超过3个氨基酸置换的序列的cdr3,所述v
l
包含:包含相对于seq id no:57具有不超过3个氨基酸置换的序列的cdr1,包含相对于seq id no:58具有不超过2个氨基酸置换的序列的cdr2,和包含相对于seq id no:59具有不超过3个氨基酸置换的序列的cdr3;或
131.(v)vh和v
l
,所述vh包含:包含相对于seq id no:60具有不超过2个氨基酸置换的序列的cdr1,包含相对于seq id no:61具有不超过4个氨基酸置换的序列的cdr2,和包含相对于seq id no:62具有不超过3个氨基酸置换的序列的cdr3,所述v
l
包含:包含相对于seq id no:63具有不超过3个氨基酸置换的序列的cdr1,包含相对于seq id no:64具有不超过2个氨基酸置换的序列的cdr2,和包含相对于seq id no:65具有不超过3个氨基酸置换的序列的cdr3。
132.在一些实例中,所述氨基酸置换是保守氨基酸置换。
133.在一些实例中,所述蛋白包含:
134.(i)包含分别包含seq id no:12、15和18所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:21、24和27所示的序列的cdr1、cdr2和cdr3的v
l
;
135.(ii)包含分别包含seq id no:13、16和19所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:22、25和28所示的序列的cdr1、cdr2和cdr3的v
l
;
136.(iii)包含分别包含seq id no:14、17和20所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:23、26和29所示的序列的cdr1、cdr2和cdr3的v
l
;
137.(iv)包含分别包含seq id no:54、55和56所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:57、58和59所示的序列的cdr1、cdr2和cdr3的v
l
;或
138.(v)包含分别包含seq id no:60、61和62所示的序列的cdr1、cdr2和cdr3的vh和包括分别包含seq id no:63、64和65所示的序列的cdr1、cdr2和cdr3的v
l
。
139.在一些实例中,所述蛋白包含:
140.(i)包含分别包含seq id no:12、15和18所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:21、24和27所示的序列的cdr1、cdr2和cdr3的v
l
;
141.(ii)包含分别包含seq id no:13、16和19所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:22、25和28所示的序列的cdr1、cdr2和cdr3的v
l
;或
142.(iii)包含分别包含seq id no:14、17和20所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:23、26和29所示的序列的cdr1、cdr2和cdr3的v
l
。
143.在一些实例中,所述蛋白包含:
144.(i)包含分别由seq id no:12、15和18所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:21、24和27所示的序列组成的cdr1、cdr2和cdr3的v
l
;
145.(ii)包含分别由seq id no:13、16和19所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:22、25和28所示的序列组成的cdr1、cdr2和cdr3的v
l
;
146.(iii)包含分别由seq id no:14、17和20所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:23、26和29所示的序列组成的cdr1、cdr2和cdr3的v
l
;
147.(iv)包含分别由seq id no:54、55和56所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:57、58和59所示的序列组成的cdr1、cdr2和cdr3的v
l
;或
148.(v)包含分别由seq id no:60、61和62所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:63、64和65所示的序列组成的cdr1、cdr2和cdr3的v
l
。
149.在一些实例中,所述蛋白包含:
150.(i)包含分别由seq id no:12、15和18所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:21、24和27所示的序列组成的cdr1、cdr2和cdr3的v
l
;
151.(ii)包含分别由seq id no:13、16和19所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:22、25和28所示的序列组成的cdr1、cdr2和cdr3的v
l
;
152.(iii)包含分别由seq id no:14、17和20所示的序列组成的cdr1、cdr2和cdr3的vh和包含分别由seq id no:23、26和29所示的序列组成的cdr1、cdr2和cdr3的v
l
。
153.在一些实例中,所述蛋白包含:包含cdr1、cdr2和cdr3的vh,所述cdr1、cdr2和cdr3分别包含与seq id no:12、15和18所示的序列至少70%、80%或90%相同的序列。在一些实例中,所述蛋白包含:包含cdr1、cdr2和cdr3的v
l
,所述cdr1、cdr2和cdr3分别包含与seq id no:21、24和27所示的序列至少70%、80%或90%相同的序列。
154.在一些实例中,所述蛋白包含分别包含seq id no:12、15和18所示的序列的cdr1、cdr2和cdr3的vh。在一些实例中,所述蛋白包含分别包含seq id no:21、24和27所示的序列的cdr1、cdr2和cdr3的v
l
。
155.在一些实例中,所述蛋白包含vh和v
l
,所述vh包含分别包含seq id no:12、15和18所示的序列的cdr1、cdr2和cdr3,所述v
l
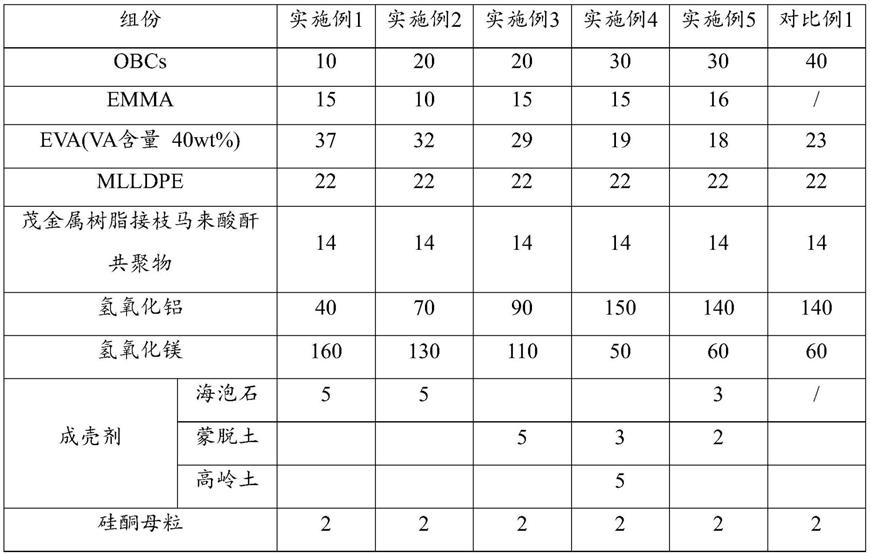
包含分别包含seq id no:21、24和27所示的序列的cdr1、cdr2和cdr3。
156.在一些实例中,所述蛋白包含:
157.(i)包含与seq id no:2-5、46或47所示的任一序列至少约70%、80%、90%或95%
相同的序列的vh;和/或
158.(ii)包含与seq id no:6-11、50或51所示的任一序列至少约70%、80%、90%或95%相同的序列的v
l
。
159.在一些实例中,所述蛋白包含:
160.(i)包含与seq id no:2-5所示的任一序列至少约70%、80%、90%或95%相同的序列的vh;和/或
161.(ii)包含与seq id no:6-11所示的任一序列至少约70%、80%、90%或95%相同的序列的v
l
。
162.在一些实例中,所述蛋白包含:
163.(i)包含与seq id no:2所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:5或9所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
164.(ii)包含与seq id no:3所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:7或10所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
165.(iii)包含与seq id no:4所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:8所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
166.(iv)包含与seq id no:5所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:11所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
167.(v)包含与seq id no:46所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:50所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;或
168.(vi)包含与seq id no:47所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:51所示的序列至少约70%、80%、90%或95%相同的序列的v
l
。
169.在一些实例中,所述蛋白包含:
170.(i)包含与seq id no:2所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:5或9所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
171.(ii)包含与seq id no:3所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:7或10所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
172.(iii)包含与seq id no:4所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:8所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;或
173.(iv)包含与seq id no:5所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:11所示的序列至少约70%、80%、90%或95%相同的序列的v
l
。
174.在一些实例中,所述蛋白包含:
175.(i)包含seq id no:2所示的序列的vh和包含seq id no:5或9所示的序列的v
l
;
176.(ii)包含seq id no:3所示的序列的vh和包含seq id no:7或10所示的序列的v
l
;
177.(iii)包含seq id no:4所示的序列的vh和包含seq id no:8所示的序列的v
l
;
178.(iv)包含seq id no:5所示的序列的vh和包含seq id no:11所示的序列的v
l
;
179.(v)包含seq id no:46所示的序列的vh和包含seq id no:50所示的序列的v
l
;或
180.(vi)包含seq id no:47所示的序列的vh和包含seq id no:51所示的序列的v
l
。
181.在一些实例中,所述蛋白包含:
182.(i)包含seq id no:2所示的序列的vh和包含seq id no:5或9所示的序列的v
l
;
183.(ii)包含seq id no:3所示的序列的vh和包含seq id no:7或10所示的序列的v
l
;
184.(iii)包含seq id no:4所示的序列的vh和包含seq id no:8所示的序列的v
l
;或
185.(iv)包含seq id no:5所示的序列的vh和包含seq id no:11所示的序列的v
l
。
186.在一些实例中,所述蛋白包含:
187.(i)包含与seq id no:46所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:50所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
188.(ii)包含与seq id no:47所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:51所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;
189.(iii)包含与seq id no:48所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:52所示的序列至少约70%、80%、90%或95%相同的序列的v
l
;或
190.(iv)包含与seq id no:49所示的序列至少约70%、80%、90%或95%相同的序列的vh和包含与seq id no:53所示的序列至少约70%、80%、90%或95%相同的序列的v
l
。
191.在一些实例中,所述蛋白包含:
192.(i)包含seq id no:46所示的序列的vh和包含seq id no:50所示的序列的v
l
;
193.(ii)包含seq id no:47所示的序列的vh和包含seq id no:51所示的序列的v
l
;
194.(iii)包含seq id no:48所示的序列的vh和包含seq id no:52所示的序列的v
l
;或
195.(iv)包含seq id no:49所示的序列的vh和包含seq id no:53所示的序列的v
l
。
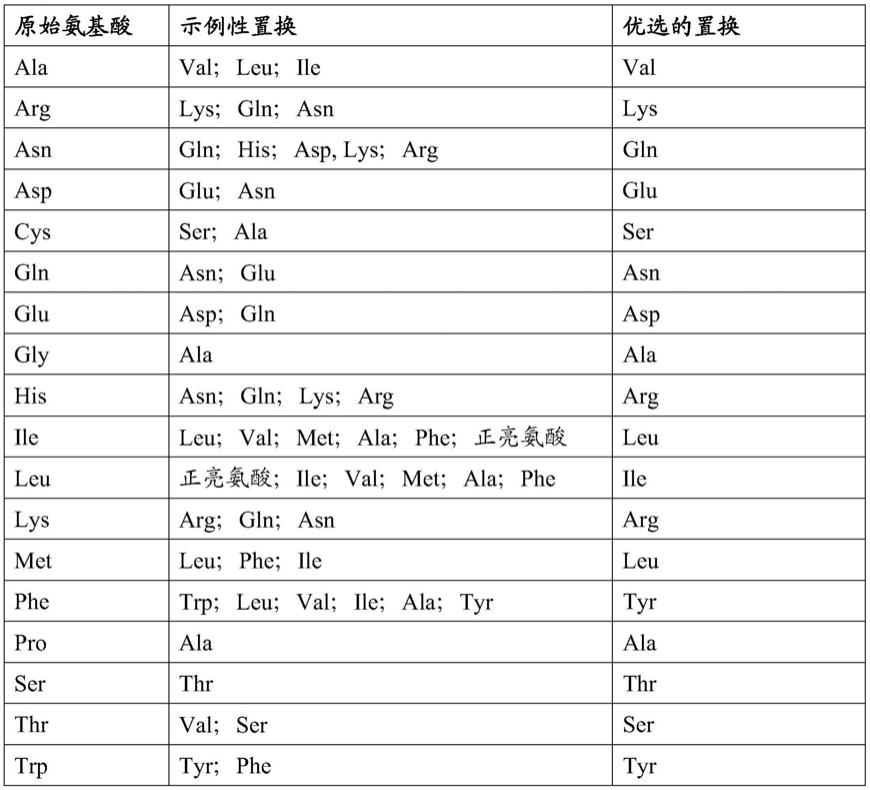
196.在一些实例中,所述蛋白包含:
197.(i)包含分别包含seq id no:54、55和56所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:57、58和59所示的序列的cdr1、cdr2和cdr3的v
l
;或
198.(ii)包含分别包含seq id no:60、61和62所示的序列的cdr1、cdr2和cdr3的vh和包含分别包含seq id no:63、64和65所示的序列的cdr1、cdr2和cdr3的v
l
。
199.在一些实例中,所述蛋白包含vh和v
l
,其中vh和v
l
结合形成包含抗原结合位点的fv。
200.在一些实例中,vh和v
l
在单条多肽链上。在一些实例中,所述蛋白是:
201.(i)单链fv片段(scfv);
202.(ii)二聚scfv(di-scfv);或
203.(iii)与抗体的恒定区、可结晶片段(fc)区或重链恒定结构域(ch)2和/或ch3连接的(i)和/或(ii)中的至少一个。
204.在一些实例中,所述v
l
和所述vh在分开的多肽链中。在一些实例中,所述蛋白是:
205.(i)双链抗体(diabody);
206.(ii)三链抗体(triabody);
207.(iii)四链抗体(tetrabody);
208.(iv)fab;
209.(v)f(ab’)2;
210.(vi)fv;或
211.(vii)与抗体的恒定区、fc区或ch2和/或ch3连接的(i)至(vi)中的一个。
212.在一些实例中,所述蛋白包含fc区。在一些实例中,所述蛋白是抗体。在一些实例中,所述蛋白是裸抗体。
213.在一些实例中,所述蛋白包含在fc区中的一个或多个氨基酸置换,所述氨基酸置换增加所述蛋白对新生儿fc受体(fcrn)的亲和力。不希望受理论约束,此类氨基酸置换可以通过增加在蛋白与fcrn结合后再循环至循环中的蛋白的比例来增强蛋白“清扫”能力。在一些实例中,所述一个或多个氨基酸置换增加在ph 6.0时所述蛋白对fcrn的亲和力。
214.在一些实例中,根据kabat的eu编号系统,所述一个或多个氨基酸置换选自m252y,s254t,t256e,v308p,n286e,m428l,n434a,和n434y。在一些实例中,所述蛋白包括在其fc区中的下列氨基酸置换:
215.(i)m252y,
216.(ii)n286e或v308p,和
217.(iii)n434y。
218.在一些实例中,所述蛋白是包含重链和轻链的抗体,所述重链包含与seq id no:30-33中任一个所示的序列至少约70%、80%、90%、95%或98%相同的氨基酸序列,所述轻链包含与seq id no:34-39中任一个所示的序列至少约70%、80%、90%、95%或98%相同的氨基酸序列。
219.在一些实例中,所述蛋白是包含重链和轻链的抗体,所述重链包含seq id no:30-33中任一个所示的氨基酸序列,所述轻链包含seq id no:34-39中任一个所示的氨基酸序列。
220.在一些实例中,所述蛋白是包含下列的抗体:
221.(i)重链和轻链,所述重链包含与seq id no:30所示的序列至少约70%、80%、90%或95%相同的序列,所述轻链包含与seq id no:34或37所示的序列至少约70%、80%、90%或95%相同的序列;
222.(ii)重链和轻链,所述重链包含与seq id no:31所示的序列至少约70%、80%、90%或95%相同的序列,所述轻链包含与seq id no:35或38所示的序列至少约70%、80%、90%或95%相同的序列;
223.(iii)重链和轻链,所述重链包含与seq id no:32所示的序列至少约70%、80%、90%或95%相同的序列,所述轻链包含与seq id no:36所示的序列至少约70%、80%、90%或95%相同的序列;或
224.(iv)重链和轻链,所述重链包含与seq id no:33所示的序列至少约70%、80%、90%或95%相同的序列,所述轻链包含与seq id no:39所示的序列至少约70%、80%、90%或95%相同的序列。
225.在一些实例中,所述蛋白包含:
226.(i)包含seq id no:30所示的序列的重链和包含seq id no:34或37所示的序列的轻链;
227.(ii)包含seq id no:31所示的序列的重链和包含seq id no:35或38所示的序列的轻链;
228.(iii)包含seq id no:32所示的序列的重链和包含seq id no:36所示的序列的轻链;或
229.(iv)包含seq id no:33所示的序列的重链和包含seq id no:39所示的序列的轻链。
230.在一些实例中,所述蛋白是包括包含seq id no:30所示的氨基酸序列的重链的抗体。在一些实例中,所述蛋白是包括包含seq id no:34所示的氨基酸序列的轻链的抗体。
231.在一些实例中,所述蛋白是包括包含seq id no:30所示的氨基酸序列的重链和包含seq id no:34所示的氨基酸序列的轻链的抗体。
232.在一些实例中,所述蛋白是嵌合的、去免疫化的、人源化的、人的或灵长类化的。在一些实例中,所述蛋白是人蛋白。
233.在一些实例中,所述蛋白与另一化合物缀合。在一个实例中,所述另一化合物是延长半衰期的部分。在一个实例中,所述另一化合物是免疫调节剂。在一个实例中,所述另一化合物是免疫抑制剂。在一个实例中,所述另一化合物是可检测标记。在一个实例中,所述另一化合物是已知抑制补体活性和/或用来治疗或预防补体介导病症的化合物。
234.本文提到“结合”c2的蛋白或抗体提供了对“特异性结合”c2的蛋白或抗体的字面支持。
235.本公开还提供了前述蛋白或抗体的抗原结合结构域或抗原结合片段。
236.在一个实例中,如本文所述的蛋白或抗体包括igg4抗体的恒定区或igg4抗体的稳定化恒定区。在一个实例中,所述蛋白或抗体包括位置241处(根据kabat编号系统(kabat等人,sequences of proteins of immunological interest washington dc united states department of health and human services,1987和/或1991))具有脯氨酸的igg4恒定区。
237.本公开的全抗体的重链恒定区的c-末端赖氨酸可以被移除,例如,在抗体的生产或纯化期间,或通过重组改造编码抗体重链的核酸而移除。因此,全抗体可以包括所有c-末端赖氨酸残基被移除的抗体群,c-末端赖氨酸残基没有被移除的抗体群,和含有具有和不具有c-末端赖氨酸残基的抗体的混合物的抗体群。在一些实例中,所述抗体群可以另外地包括其中在重链恒定区之一中移除c-末端赖氨酸残基的抗体。同样地,全抗体的组合物可以包括具有或不具有c-末端赖氨酸残基的抗体群的相同或类似混合物。
238.本公开的蛋白还可以包括一个或多个其他翻译后修饰(ptm)。抗体的ptm在本领域中是众所周知的,并且包括,但不限于:糖基化,脱酰胺,异构化,氧化,和焦谷氨酰化。例如,所述蛋白可以包括一个或多个asn或gln残基,它们被脱酰胺以分别形成asp或glu残基。就此而言,提到本文的氨基酸序列(例如,seq id no)是指合成蛋白(例如,通过核糖体)时存在的氨基酸的序列。因此,作为技术人员要理解,本文提供的任何seq id no涵盖已合成的氨基酸的序列,以及其任何翻译后修饰形式。例如,包含asn残基的seq id no涵盖在该位置处具有asn以及如果asn已经被脱酰胺则具有asp或isoasp的蛋白。包含本公开的蛋白的组合物可以包含具有和不具有特定的ptm的蛋白的混合物。因此,此类组合物可以包含具有不同ptm的蛋白。
239.在一个实例中,本公开的蛋白包含与igg4恒定区或稳定化的igg4恒定区(例如,如上所述)连接或融合的本文公开的vh和与κ轻链恒定区连接或融合的v
l
。
240.在一个实例中,如本文所述的蛋白是分离的和/或重组的。
241.在一个实例中,本公开的蛋白与另一化合物缀合,例如,可检测标签或延长蛋白的半衰期的化合物,诸如聚乙二醇或白蛋白结合蛋白。在其他实例中,所述蛋白与化疗药物诸如细胞毒化合物缀合。
242.本公开还提供了编码本公开的蛋白的核酸。
243.在一个实例中,所述核酸包括在其中所述核酸可操作地连接到启动子的表达构建体中。此类表达构建体可以在载体,例如,质粒中。
244.在本公开的针对单条多肽链蛋白的实例中,所述表达构建体可以包含与编码所述多肽链的核酸连接的启动子。
245.在针对形成蛋白的多条多肽链的实例中,表达构建体包含可操作地连接到启动子的编码例如vh的多肽的核酸和可操作地连接到启动子的编码例如v
l
的多肽的核酸。
246.在另一实例中,表达构建体是双顺反子表达构建体,例如,包含下列以5’至3’顺序的可操作连接的成分:
247.(i)启动子;
248.(ii)编码第一多肽的核酸;
249.(iii)内部核糖体进入位点;和
250.(iv)编码第二多肽的核酸,
251.其中所述第一多肽包含vh,所述第二多肽包含v
l
,或反之亦然。
252.本公开还考虑分开的表达构建体,其中一个编码包含vh的第一多肽,另一个编码包含v
l
的第二多肽。例如,本公开还提供了包含下列的组合物:
253.(i)第一表达构建体,所述第一表达构建体包含可操作地连接到启动子的编码包含vh的多肽的核酸;和
254.(ii)第二表达构建体,所述第二表达构建体包含可操作地连接到启动子的编码包含v
l
的多肽的核酸。
255.本公开还提供了表达本公开的蛋白的分离的或重组的细胞。
256.在一个实例中,所述细胞包含本公开的表达构建体或:
257.(i)包含可操作地连接到启动子的编码包含vh的多肽的核酸的第一表达构建体;和
258.(ii)包含可操作地连接到启动子的编码包含v
l
的多肽的核酸的第二表达构建体。
259.本公开的细胞的实例包括细菌细胞,酵母细胞,昆虫细胞或哺乳动物细胞。
260.本公开另外地提供了制备本公开的蛋白或抗体的方法。例如,此类方法涉及在足以制备所述蛋白的条件下维持本公开的一种或多种表达构建体。
261.在一个实例中,制备本公开的蛋白或抗体的方法包括在足以制备和任选地分泌所述蛋白的条件下培养本公开的细胞。
262.在一个实例中,制备本公开的蛋白的方法另外地包括分离所述蛋白,以及任选地,将所述蛋白或抗体配制成药物组合物。
263.本公开另外提供了包含本公开的蛋白和药学上可接受的载剂的组合物。
264.本公开另外提供了抑制受试者中的补体活性的方法,所述方法包括将本公开的蛋白或本公开的组合物施用于所述受试者。
265.本公开另外提供了治疗或预防受试者中的补体介导病症的方法,所述方法包括将本公开的蛋白或本公开的组合物施用于所述受试者。
266.本公开另外提供了本公开的蛋白用于治疗或预防受试者中的补体介导病症的用途。
267.本公开另外提供了本公开的蛋白在制备用于治疗或预防补体介导病症的药物中的用途。
268.在一个实例中,所述受试者患有补体介导病症。在一个实例中,所述受试者已经诊断患有补体介导病症。在一个实例中,所述受试者正在接受对补体介导病症的治疗。
269.在本文所述的任意方法的一个实例中,本公开的蛋白或包含所述蛋白的组合物在发生补体介导病症之前或之后施用。在本文所述的任意方法的一个实例中,本公开的蛋白或包含所述蛋白的组合物在发生补体介导病症之前施用。在本文所述的任意方法的一个实例中,本公开的蛋白或包含所述蛋白的组合物在发生补体介导病症后施用。
270.在一个实例中,所述受试者处于发生补体介导病症的风险中。
271.在一个实例中,所述蛋白或包含所述蛋白的组合物在补体介导病症的症状发作之前或之后施用。在一个实例中,所述蛋白或包含所述蛋白的组合物在补体介导病症的症状发作之前施用。在一个实例中,所述蛋白或包含所述蛋白的组合物在补体介导病症的症状发作之后施用。在一个实例中,本公开的蛋白或包含所述蛋白的组合物以缓解或减少补体介导病症的一个或多个症状的剂量施用。补体介导病症的症状记载在本文中。
272.在一个实例中,补体介导病症由补体系统的原发性失调、自身免疫病症、急性损伤和/或炎性病况导致。在一些实例中,补体介导病症是慢性病症。在一些实例中,补体介导病症是急性病症。
273.在一些实例中,补体介导病症选自由下列各项组成的组:遗传性血管水肿,阵发性睡眠性血红蛋白尿(pnh),非典型性溶血性尿毒症综合征(ahus),血小板减少性紫癜(ttp),血栓性微血管病,c3肾小球病,膜性增生性肾小球肾炎(包括抗-thy 1肾小球肾炎,抗-cona弥漫性增生性肾小球肾炎和/或被动型海曼氏肾炎),移植排斥(包括肺移植(包括移植物挽救或抗体介导排斥)和/或肾移植(包括抗体介导排斥)),视神经脊髓炎,多发性硬化症,格林-巴利综合征,重症肌无力(包括自身免疫性重症肌无力,脱髓鞘性过敏性脑脊髓炎,igg免疫复合物肺泡炎,逆转被动阿尔图斯反应),狼疮性肾炎(包括急性狼疮性肾炎或慢性狼疮性肾炎),系统性红斑狼疮(sle),iga肾病,类风湿性关节炎,克罗恩病,溃疡性结肠炎,自身免疫性溶血性贫血,天疱疮(包括寻常型天疱疮),类天疱疮(包括大疱性类天疱疮),抗磷脂综合征,多发伤,神经损伤,血液透析,感染后hus,黄斑变性,葡萄膜炎,anca-相关性血管炎,动脉粥样硬化,情感障碍,哮喘,慢性阻塞性肺病(copd),慢性炎性脱髓鞘多发性神经病(cidp),过敏反应,脓毒症,脑型疟,牛皮癣性关节病,皮肌炎,骨关节炎,痴呆,青光眼,糖尿病性血管病,心肌梗死,缺血性卒中(具有或不具有再灌注),出血性卒中,搭桥手术后,抗肾小球基底膜(gbm)肾炎(或古德帕斯丘综合征(goodpasture’s syndrome)),自身免疫性癫痫,疱疹样皮炎,嗜酸性肉芽肿性多血管炎(egpa;或churg-strauss综合征),创伤性脑损伤,躯体创伤,化脓性汗腺炎,斯耶格伦综合征(syndrome),斯耶格伦综合征血管炎,创伤(包括糖原诱发腹膜炎,热创伤,神经挤压和/或闭合性头部损伤),缺血再灌注损伤(iri;包括心肌iri,肠iri,肝iri和/或胰腺iri)和急性呼吸窘迫综合征(或急性肺损伤)。
274.在一个实例中,补体介导病症选自由下列各项组成的组:移植排斥(例如,抗体介导排斥),在移植(包括肺移植和/或肾移植)之前、期间或之后的缺血再灌注损伤,移植物功能延迟恢复(包括肺移植和/或肾移植),视神经脊髓炎,重症肌无力,肾小球病变,狼疮性肾
炎,iga肾病,大疱性类天疱疮,抗磷脂综合征,葡萄膜炎,神经系统病症,帕金森病,亨廷顿病,脑梗死,运动神经元病,自身免疫性溶血性贫血,anca-相关性血管炎,慢性炎性脱髓鞘多发性神经病(cidp)和抗肾小球基底膜(gbm)肾炎。在一个实例中,所述受试者患有需要预防性治疗的病况。
275.在一个实例中,补体介导病症选自由下列各项组成的组:移植排斥(包括移植物功能延迟恢复,移植物挽救和抗体介导排斥),肾病,缺血再灌注损伤,视神经脊髓炎,重症肌无力,肾小球病变,狼疮性肾炎(急性和慢性),iga肾病,大疱性类天疱疮,抗磷脂综合征,葡萄膜炎,神经系统病症,帕金森病,亨廷顿病,脑梗死,运动神经元病,自身免疫性溶血性贫血,anca-相关性血管炎慢性炎性脱髓鞘多发性神经病,缺血性卒中(具有和没有再灌注),创伤性脑损伤,躯体创伤和抗肾小球基底膜(gbm)肾炎。
276.在一个实例中,补体介导病症与器官移植相关(例如,移植排斥)。在一个实例中,器官移植是实体器官移植。
277.在一个实例中,补体介导病症是移植排斥(例如,抗体介导排斥)。在一个实例中,移植是实体器官移植。
278.在一个实例中,补体介导病症是移植(包括肺移植和/或肾移植)之前、期间或之后的缺血再灌注损伤。在一个实例中,移植是实体器官移植。
279.在一个实例中,补体介导病症是移植物功能延迟恢复(包括肺移植和/或肾移植)。在一个实例中,移植物功能延迟恢复与实体器官移植相关。
280.在一个实例中,补体介导病症是视神经脊髓炎。
281.在一个实例中,补体介导病症是重症肌无力。例如,重症肌无力是自身免疫性重症肌无力、脱髓鞘性过敏性脑脊髓炎、igg免疫复合物肺泡炎或逆转被动阿尔图斯反应。
282.在一个实例中,补体介导病症是肾小球病变。
283.在一个实例中,补体介导病症是狼疮性肾炎。例如,狼疮性肾炎是急性狼疮性肾炎或慢性狼疮性肾炎。
284.在一个实例中,补体介导病症是系统性红斑狼疮(sle)。
285.在一个实例中,是补体介导病症是iga肾病。
286.在一个实例中,补体介导病症是类天疱疮。例如,类天疱疮是大疱性类天疱疮。
287.在一个实例中,补体介导病症是抗磷脂综合征。
288.在一个实例中,补体介导病症是葡萄膜炎。
289.在一个实例中,补体介导病症是神经系统病症。
290.在一个实例中,补体介导病症是帕金森病。
291.在一个实例中,补体介导病症是亨廷顿病。
292.在一个实例中,补体介导病症是脑梗死。
293.在一个实例中,补体介导病症是运动神经元病。
294.在一个实例中,补体介导病症是自身免疫性溶血性贫血。
295.在一个实例中,补体介导病症是anca-相关性血管炎。
296.在一个实例中,补体介导病症是慢性炎性脱髓鞘多发性神经病。
297.在一个实例中,补体介导病症是遗传性血管水肿。
298.在一个实例中,补体介导病症是阵发性睡眠性血红蛋白尿(pnh)。
299.在一个实例中,补体介导病症是非典型性溶血性尿毒症综合征(ahus)。
300.在一个实例中,补体介导病症是血小板减少性紫癜(ttp)。
301.在一个实例中,补体介导病症是血栓性微血管病。
302.在一个实例中,补体介导病症是c3肾小球病。
303.在一个实例中,补体介导病症是膜性增生性肾小球肾炎。例如,肾小球肾炎是抗-thy 1肾小球肾炎、抗-cona弥漫性增生性肾小球肾炎和/或被动型海曼氏肾炎。
304.在一个实例中,补体介导病症是移植排斥。例如,移植是实体器官移植诸如肺移植(包括移植物挽救或抗体介导排斥)和/或肾移植(包括抗体介导排斥)。
305.在一个实例中,补体介导病症是多发性硬化症。
306.在一个实例中,补体介导病症是格林-巴利综合征。
307.在一个实例中,补体介导病症是类风湿性关节炎。
308.在一个实例中,补体介导病症是炎症性肠病。例如,炎症性肠病是克罗恩病或溃疡性结肠炎。
309.在一个实例中,补体介导病症是天疱疮。例如,天疱疮是寻常型天疱疮。
310.在一个实例中,补体介导病症是多发伤。
311.在一个实例中,补体介导病症是神经损伤。
312.在一个实例中,补体介导病症是血液透析。
313.在一个实例中,补体介导病症是感染后hus。
314.在一个实例中,补体介导病症是黄斑变性。
315.在一个实例中,补体介导病症是动脉粥样硬化。
316.在一个实例中,补体介导病症是情绪障碍。
317.在一个实例中,补体介导病症是哮喘。
318.在一个实例中,补体介导病症是慢性阻塞性肺病(copd)。
319.在一个实例中,补体介导病症是慢性炎性脱髓鞘多发性神经病(cidp)。
320.在一个实例中,补体介导病症是过敏反应。
321.在一个实例中,补体介导病症是脓毒症。
322.在一个实例中,补体介导病症是脑型疟。
323.在一个实例中,补体介导病症是牛皮癣性关节病。
324.在一个实例中,补体介导病症是皮肌炎。
325.在一个实例中,补体介导病症是骨关节炎。
326.在一个实例中,补体介导病症是痴呆。
327.在一个实例中,补体介导病症是青光眼。
328.在一个实例中,补体介导病症是糖尿病性血管病。
329.在一个实例中,补体介导病症是心肌炎。
330.在一个实例中,补体介导病症是心肌梗死。
331.在一个实例中,补体介导病症是卒中。例如,卒中是缺血性卒中(具有或不具有再灌注)。在另一个实例中,卒中是出血性卒中。
332.在一个实例中,补体介导病症是搭桥手术后。
333.在一个实例中,补体介导病症是抗肾小球基底膜(gbm)肾炎(或古德帕斯丘综合
征)。
334.在一个实例中,补体介导病症是自身免疫性癫痫。
335.在一个实例中,补体介导病症是疱疹样皮炎。
336.在一个实例中,补体介导病症是嗜酸性肉芽肿性多血管炎(egpa;或churg-strauss综合征)。
337.在一个实例中,补体介导病症是创伤性脑损伤。
338.在一个实例中,补体介导病症是创伤。例如,创伤是躯体创伤。在一个实例中,创伤是糖原诱发腹膜炎。在另一个实例中,创伤是热创伤。在进一步的实例中,创伤是神经挤压和/或闭合性头部损伤。
339.在一个实例中,补体介导病症是化脓性汗腺炎。
340.在一个实例中,补体介导病症是斯耶格伦综合征。例如,斯耶格伦综合征是斯耶格伦综合征血管炎。
341.在一个实例中,补体介导病症是缺血再灌注损伤(iri)。例如,iri是心肌iri、肠iri、肝ri和/或胰腺iri。在一个实例中,iri与实体器官移植相关。
342.在一个实例中,补体介导病症是急性呼吸窘迫综合征(或急性肺损伤)。
343.在一个实例中,补体介导病症是纤维化疾病。在一个实例中,补体介导病症是间质性肺病(ild)。
344.在一个实例中,本公开的蛋白或包含所述蛋白的组合物以减少受试者中的补体介导病症的严重性的量施用于所述受试者。
345.在本文所述的任意方法的一个实例中,所述受试者是哺乳动物,例如,灵长类动物,诸如人。
346.本文所述的治疗方法可以另外包括施用另一种化合物以减少、治疗或预防补体介导病症的影响。
347.本公开还提供了检测样品中的c2或表达c2的细胞的方法,所述方法包括使所述样品与根据任一实例如本文所述的蛋白接触使得形成复合物,并检测所述复合物,其中对所述复合物的检测指示样品中的c2或表达c2的细胞。
348.本公开还提供了诊断或预测补体介导病症的方法,所述方法包括执行根据任一实例如本文所述的方法以检测c2或表达c2的细胞,其中对c2或表达c2的细胞的检测诊断或预测所述病症。
349.本公开还提供了包含根据任一实例如本文所述的蛋白的试剂盒,所述试剂盒包装有用于在如本文所述的方法中使用的说明书。任选地,所述试剂盒另外包含其他的治疗活性化合物或药物。
350.本文提供的任何实例经适当修改应当适用于任何其他实例,除非另外具体指明。例如,如专业技术人员所理解的那样,本公开的蛋白的实例同样适用于本公开的方法、组合物和试剂盒,且反之亦然。
351.序列表说明
352.seq id no:1
–
人c2氨基酸序列
353.seq id no:2
–
rf16-226和rf16-226g vh氨基酸序列
354.seq id no:3
–
rf16-214和rf16-214g vh氨基酸序列
355.seq id no:4
–
rf16-242g vh氨基酸序列
356.seq id no:5
–
rf16-242 vh氨基酸序列
357.seq id no:6-rf16-226g vl氨基酸序列
358.seq id no:7-rf16-214g vl氨基酸序列
359.seq id no:8-rf16-242g vl氨基酸序列
360.seq id no:9
–
rf16-226 vl氨基酸序列
361.seq id no:10
–
rf16-214 vl氨基酸序列
362.seq id no:11
–
rf16-242 vl氨基酸序列
363.seq id no:12
–
rf16-226和rf16-226g hcdr1氨基酸序列
364.seq id no:13
–
rf16-214和rf16-214g hcdr1氨基酸序列
365.seq id no:14
–
rf16-242和rf16-242g hcdr1氨基酸序列
366.seq id no:15
–
rf16-226和rf16-226g hcdr2氨基酸序列
367.seq id no:16
–
rf16-214和rf16-214g hcdr2氨基酸序列
368.seq id no:17
–
rf16-242和rf16-242g hcdr2氨基酸序列
369.seq id no:18
–
rf16-226和rf16-226g hcdr3氨基酸序列
370.seq id no:19
–
rf16-214和rf16-214g hcdr3氨基酸序列
371.seq id no:20
–
rf16-242和rf16-242g hcdr3氨基酸序列
372.seq id no:21
–
rf16-226和rf16-226g lcdr1氨基酸序列
373.seq id no:22
–
rf16-214和rf16-214g lcdr1氨基酸序列
374.seq id no:23
–
rf16-242和rf16-242g lcdr1氨基酸序列
375.seq id no:24
–
rf16-226和rf16-226g lcdr2氨基酸序列
376.seq id no:25
–
rf16-214和rf16-214g lcdr2氨基酸序列
377.seq id no:26
–
rf16-242和rf16-242g lcdr2氨基酸序列
378.seq id no:27
–
rf16-226和rf16-226g lcdr3氨基酸序列
379.seq id no:28
–
rf16-214和rf16-214g lcdr3氨基酸序列
380.seq id no:29
–
rf16-242和rf16-242g lcdr3氨基酸序列
381.seq id no:30
–
rf16-226和rf16-226g重链氨基酸序列
382.seq id no:31
–
rf16-214和rf16-214g重链氨基酸序列
383.seq id no:32
–
rf16-242g重链氨基酸序列
384.seq id no:33
–
rf16-242重链氨基酸序列
385.seq id no:34
–
rf16-226g轻链氨基酸序列
386.seq id no:35
–
rf16-214g轻链氨基酸序列
387.seq id no:36
–
rf16-242g轻链氨基酸序列
388.seq id no:37
–
rf16-226轻链氨基酸序列
389.seq id no:38
–
rf16-214轻链氨基酸序列
390.seq id no:39
–
rf16-242轻链氨基酸序列
391.seq id no:40
–
基于rf16-226、rf16-214和rf16-242的hcdr1共有氨基酸序列
392.seq id no:41
–
基于rf16-226、rf16-214和rf16-242的hcdr2共有氨基酸序列
393.seq id no:42
–
基于rf16-226、rf16-214和rf16-242的hcdr3共有氨基酸序列
394.seq id no:43
–
基于rf16-226、rf16-214和rf16-242的lcdr1共有氨基酸序列
395.seq id no:44
–
基于rf16-226、rf16-214和rf16-242的lcdr2共有氨基酸序列
396.seq id no:45
–
基于rf16-226、rf16-214和rf16-242的lcdr3共有氨基酸序列
397.seq id no:46
–
rf16-191 vh氨基酸序列
398.seq id no:47
–
rf16-203 vh氨基酸序列
399.seq id no:48
–
rf16-191g vh氨基酸序列
400.seq id no:49
–
rf16-203g vh氨基酸序列
401.seq id no:50
–
rf16-191 vl氨基酸序列
402.seq id no:51
–
rf16-203 vl氨基酸序列
403.seq id no:52
–
rf16-191g vl氨基酸序列
404.seq id no:53
–
rf16-203g vl氨基酸序列
405.seq id no:54
–
rf16-191和rf16-191g hcdr1氨基酸序列
406.seq id no:55
–
rf16-191和rf16-191g hcdr2氨基酸序列
407.seq id no:56
–
rf16-191和rf16-191g hcdr3氨基酸序列
408.seq id no:57
–
rf16-191和rf16-191g lcdr1氨基酸序列
409.seq id no:58
–
rf16-191和rf16-191g lcdr2氨基酸序列
410.seq id no:59
–
rf16-191和rf16-191g lcdr3氨基酸序列
411.seq id no:60
–
rf16-203和rf16-203g hcdr1氨基酸序列
412.seq id no:61
–
rf16-203和rf16-203g hcdr2氨基酸序列
413.seq id no:62
–
rf16-203和rf16-203g hcdr3氨基酸序列
414.seq id no:63
–
rf16-203和rf16-203g lcdr1氨基酸序列
415.seq id no:64
–
rf16-203和rf16-203g lcdr2氨基酸序列
416.seq id no:65
–
rf16-203和rf16-203g lcdr3氨基酸序列
417.seq id no:66
–
基于rf16-226、rf16-214、rf16-242、rf16-191和rf16-203的hcdr1共有氨基酸序列
418.seq id no:67
–
基于rf16-226、rf16-214、rf16-242、rf16-191和rf16-203的hcdr2共有氨基酸序列
419.seq id no:68
–
基于rf16-226、rf16-214、rf16-242、rf16-191和rf16-203的hcdr3共有氨基酸序列
420.seq id no:69
–
基于rf16-226、rf16-214、rf16-242、rf16-191和rf16-203的lcdr1共有氨基酸序列
421.seq id no:70
–
基于rf16-226,rf16-214、rf16-242、rf16-191和rf16-203的lcdr2共有氨基酸序列
422.seq id no:71
–
基于rf16-226、rf16-214、rf16-242、rf16-191和rf16-203的lcdr3共有氨基酸序列
附图说明
423.图1是图示从噬菌体展示文库中鉴定的抗-c2抗体的结合性质的图。在滴定elisa中测试所述抗体在ph 5.5和ph 7.4时对人c2的结合。这些滴定实验一式两份地完成。将人
c2蛋白包被在maxisorp elisa平板上。将抗体连续稀释并加入到适当的elisa平板中。然后利用抗-fab-hrp抗体检测抗体结合,使用tmb/e底物使平板显色。elisa平板在吸光度450nm读数。该图显示在450nm处的吸光度相对于抗-c2抗体浓度的做图。
424.图2显示了抗体对与c2的竞争性结合。颜色指示抗体(分析物/mab2)与在生物传感器表面处被抗-c2抗体(配体/mab1)俘获的c2的定性结合(白色)或不结合(灰色)。相对于“中和”抗体rf16-207和rf16-240,“清扫”抗体rf16-191、rf16-203、rf16-214、rf16-226和rf16-242在不同的表位处结合c2但它们自己竞争(黑色)且尤其是彼此竞争对c2的结合,表明它们的表位重叠。同样,rf16-207和rf16-240结合被测试的任何清扫抗体俘获的c2,但彼此竞争对c2的结合。
425.图3是图示ph-依赖性抗-c2抗体rf16-226对c2的c1s-介导的蛋白水解降解的抑制的图。人c2与rf16-226在室温孵育30分钟,随后将不同浓度的c1s(0-1000nm)加入至混合物中,然后进一步孵育1小时。泳动4-12%sds-page凝胶以分析c1s对c2的蛋白水解裂解所产生的c2a的量。条带基于它们的强度和尺寸进行定量,将平均强度针对c1s的浓度做图,并使用graphpad prism曲线拟合为s型4-参数逻辑曲线。
426.图4是图示ph-依赖性抗-c2抗体rf16-226g对c2的c1s-介导的蛋白水解降解的抑制的图。0.2μm人c2与0.25μm rf16-226g(或对照抗体rf16-240)在室温孵育30分钟,随后将2.5nm c1s加入至混合物中,然后进一步孵育1小时。泳动4-12%sds-page凝胶以分析c1s对c2的蛋白水解裂解所产生的c2b的量。sds-page凝胶上的条带基于它们的强度和尺寸进行定量。
427.图5是显示抗-c2抗体在ph 7和ph 5.5时的清除活性的一系列图。稳定表达人fcrn和β2-微球蛋白的freestyletm 293细胞与c2-af488和抗-c2抗体(rf16-207“对照”;rf16-226g;rf16-226g ypy)在ph5.5或ph 7在存在或缺少蛋白酶抑制剂(“ pi”或
“‑
pi”)的条件下在无血清培养基(sfm)中孵育10min。细胞在pbs和c2-af488和抗-c2抗体(在含有蛋白酶抑制剂( pi)或dmso(-pi)的c-rpmi中追踪)中洗涤0min或60min。在0和60min追踪时间点时在ph 7(a,b)或ph 5.5(c,d)定量与freestyletm 293细胞中的c2(a,c)或抗-c2抗体(b,d)对应的荧光强度。显示的图代表了两次独立的实验,其中对每个时间点从5个图像(每张图像包含8个或更多个细胞)测定平均荧光强度值。误差棒表示均数 /-标准差(sem)。
428.图6显示在2mm ca
2
的存在下在中性ph时抗体对与人c2酶原的竞争性结合。颜色表示在与俘获的抗体(抗体1/配体)结合的人c2上注射的二级抗体(抗体2/分析物)的定性非竞争性结合(白色)。缺少与抗体2的结合反应表示在生物传感器表面处与抗体1的竞争(即,未结合,灰色)或其中抗体作为分析物和配体两者进行测试的组合(黑色)。
具体实施方式
429.概述
430.在本说明书中自始至终,除非另外具体说明或上下文另外需要,则提到单个步骤、物质组合物、一组多个步骤或一组物质组合物应当被解释为涵盖那些步骤、物质组合物、多组步骤或多组物质组合物中的一个或多个(即一个或多个)。
431.本领域技术人员要认识到本公开容易做出除那些具体描述之外的多种变化和改动。要理解本公开包括所有此类变化和改动。本公开还包括本说明书中单独地或共同地提
manual,cold spring harbor laboratory press(1989)中所述)。
442.本文中提到“c2”是指人c2。本文中提到c2包括c2的天然形式,以及其突变形式。
443.术语“分离的蛋白”或“分离的多肽”是这样的蛋白或多肽:由于其起源或衍生来源,与在所述蛋白或多肽的天然状态时伴随所述蛋白或多肽的天然缔合成分不缔合;基本上不含有同一来源的其他蛋白。使用本领域中已知的蛋白纯化技术,可以通过分离使蛋白基本上不含有天然缔合组分或使蛋白基本上纯化。“基本上纯化”意指蛋白基本上不含有污染剂,例如,至少约70%或75%或80%或85%或90%或95%或96%或97%或98%或99%不含污染剂。
444.术语“重组体”应当理解为意指人工遗传重组的产物。因此,在包含抗体抗原结合结构域的重组蛋白的情况下,该术语不涵盖受试者体内天然存在的抗体,所述天然存在的抗体是在b细胞成熟期间出现的天然重组产物。然而,如果此类抗体被分离,则其被认为是包含抗体抗原结合结构域的分离的蛋白。类似地,如果编码所述蛋白的核酸被分离并使用重组方式表达,则得到的蛋白是包含抗体抗原结合结构域的重组蛋白。重组蛋白还涵盖当在细胞、组织或受试者内通过人工重组体表达的蛋白(例如,所述蛋白在所述细胞、组织或受试者中表达)。
445.术语“蛋白”应当被认为包括单条多肽链(即,通过肽键连接的一系列连续氨基酸)或彼此共价或非共价连接的一系列多肽链(即,多肽复合物)。例如,所述系列多肽链可以使用例如合适的化学接头或二硫键共价连接。非共价键的实例包括氢键、离子键、范德华力和疏水相互作用。
446.术语“多肽”或“多肽链”从前面的段落理解为意指由肽键连接的一系列连续氨基酸。
447.如本文所用,术语“抗原结合位点”应当认为意指由能够结合或特异性结合抗原的蛋白形成的结构。抗原结合位点不一定是一系列连续氨基酸,或甚至是单条多肽链中的氨基酸。例如,在由两条不同的多肽链产生的fv中,抗原结合位点由v
l
和vh的一系列氨基酸构成,这些氨基酸与抗原相互作用,然而,它们通常不总是在每个可变区的一个或多个cdr中。在一些实例中,抗原结合位点包含vh或v
l
或fv。
448.专业技术人员会知晓“抗体”通常被认为是包含由多个多肽链组成的可变区的蛋白,所述多肽链例如包含v
l
的多肽和包含vh的多肽。抗体还通常包含恒定结构域,一些恒定结构域可以排列成恒定区,在重链的情况下,其包括恒定片段或可结晶片段(fc)区。vh和v
l
相互作用形成包含能够特异性结合一个或几个密切相关的抗原的抗原结合位点的fv。通常,来自哺乳动物的轻链是κ轻链或λ轻链,来自哺乳动物的重链是α、δ、ε、γ或μ。抗体可以是任何类型(例如,igg,ige,igm,igd,iga和igy)、型(例如,igg1,igg2,igg3,igg4,iga1和iga2)或亚型。术语“抗体”还涵盖人源化抗体、灵长类化抗体、人抗体和嵌合抗体。
449.术语“全长抗体”、“完整抗体”或“全抗体”可互换使用,指抗体的基本完整的形式,与抗体的抗原结合片段相反。具体来说,全抗体包括具有包含fc区的重链和轻链的抗体。恒定结构域可以是野生型序列恒定结构域(例如,人野生型序列恒定结构域)或其氨基酸序列变体。
450.如本文所用,“可变区”是指如本文所定义的抗体的轻链和/或重链的能够特异性结合抗原并且包括互补决定区(cdr:即,cdrl,cdr2和cdr3)和框架区(fr)的氨基酸序列的
部分。示例性的可变区包含三个或四个fr(例如,fr1,fr2,fr3和任选地fr4)以及三个cdr。在来源于ignar的蛋白的情况下,蛋白可以缺少cdr2。vh是指重链的可变区。v
l
是指轻链的可变区。
451.如本文所用,术语“互补决定区”(同义词cdr;即,cdr1,cdr2和cdr3)是指抗体可变区中对抗原结合是必不可少的氨基酸残基。每个可变区典型地具有3个cdr区,它们被标识为cdr1、cdr2和cdr3。在本公开的实施中,分配给cdr和fr的氨基酸位置可以根据kabat(sequences of proteins of immunological interest,national institutes of health,bethesda,md.,1987和1991)或本技术实施中的其他编号系统(例如,chothia和lesk j.mol biol.196:901-917,1987;chothia等人,nature 342,877-883,1989;和/或al-lazikani等人,j mol biol 273:927-948,1997的规范编号系统;lefranc等人,devel.and compar.immunol.,27:55-77,2003的imgt编号系统;或honnegher和pl
ü
kthun j.mol.biol.,309:657-670,2001的aho编号系统)定义。例如,依照kabat编号系统,vh框架区(fr)和cdr定位如下:残基1-30(fr1),31-35(cdr1),36-49(fr2),50-65(cdr2),66-94(fr3),95-102(cdr3)和103-113(fr4)。依照kabat编号系统,v
l fr和cdr定位如下:残基1-23(fr1),24-34(cdr1),35-49(fr2),50-56(cdr2),57-88(fr3),89-97(cdr3)和98-107(fr4)。本公开不限于由kabat编号系统定义的fr和cdr,而是包括所有编号系统,包括上面讨论的那些。在一个实例中,本文提到cdr(或fr)是关于依照kabat编号系统的那些区。
[0452]“框架区”(fr)是cdr残基以外的那些可变区残基。
[0453]
如本文所用,术语“fv”应当认为意指任何蛋白,无论包含多个多肽还是单个多肽,其中v
l
和vh缔合并形成具有抗原结合位点的复合物,即,能够特异性结合抗原。形成抗原结合位点的vh和v
l
可以在单个多肽链或在不同的多肽链中。此外,本公开的fv(以及本公开的任何蛋白)可以具有多个抗原结合位点,所述抗原结合位点可以结合相同的抗原或可以不结合相同的抗原。该术语应当理解为涵盖直接来源于抗体的片段以及对应于使用重组手段产生的此类片段的蛋白。在一些实例中,vh不连接到重链恒定结构域(ch)1和/或v
l
不连接到轻链恒定结构域(c
l
)。示例性的含有fv的多肽或蛋白包括fab片段、fab’片段、f(ab’)片段、scfv、双链抗体、三链抗体、四链抗体或更多链的复合物,或前述任一个与恒定区或其结构域(例如,ch2或ch3结构域)连接,例如,微型抗体。“fab片段”由免疫球蛋白的单价抗原结合片段组成,并且可以通过用木瓜蛋白酶消化全抗体产生,产生由完整轻链和一部分重链组成的片段,或可以使用重组手段产生。抗体的"fab'片段"可以通过用胃蛋白酶处理全抗体,接着还原,产生由完整轻链和包含vh和单个恒定结构域的一部分重链组成的分子来获得。以此方式处理的每个抗体获得两个fab'片段。fab’片段还可以通过重组手段产生。抗体的"f(ab')2片段”由通过两个二硫键连接在一起的两个fab'片段的二聚体组成,并且通过用胃蛋白酶处理全抗体分子获得,无需后续的还原。“fab
2”片段是包含使用例如亮氨酸拉链或ch3结构域连接的两个fab片段的重组片段。“单链fv”或“scfv”是包含抗体的可变区片段(fv)的重组分子,其中轻链的可变区和重链的可变区通过合适的柔性多肽接头共价连接。
[0454]
如本文所用,提到蛋白或其抗原结合位点与抗原的相互作用时,术语“结合”意指所述相互作用依赖于抗原上的特定结构(例如,抗原决定簇或表位)的存在。例如,抗体识别和结合特定的蛋白结构而不是广泛地识别和结合蛋白。如果抗体结合表位“a”,则在包含标记的“a”和所述蛋白的反应中,包含表位“a”(或游离的、未标记的“a”)的分子的存在将减少
与抗体结合的标记的“a”的量。
[0455]
如本文所用,术语“特异性地结合”或“特异性结合”应当认为意指和其与备选的抗原或细胞反应或缔合相比,本公开的蛋白与特定抗原或表达所述抗原的细胞以更长的持续时间和/或更大的亲和性更频繁地、更快速地反应或缔合。例如,蛋白以比与其他补体成分或普遍被多反应性天然抗体识别(即,被已知结合人中天然存在的各种抗原的天然抗体识别)的抗原大得多的亲和力(例如,20倍或40倍或60倍或80倍至100倍或150倍或200倍)结合c2。通常,但不是必需地,提到结合意指特异性结合,并且每个术语应当理解为提供了对其他术语的明确支持。
[0456]
如本文所用,术语“检测不到的结合”应当理解为意指蛋白,例如,抗体,以高于背景小于10%或8%或6%或5%的水平结合候选抗原。背景可以是在缺少所述蛋白的条件下和/或存在阴性对照蛋白(例如,同种型对照抗体)的条件下检测到的结合信号的水平和/或在阴性对照抗原的存在下检测到的结合水平。结合水平使用生物传感器分析(例如biacore)检测,其中蛋白被固定化并与抗原接触,或反之亦然。
[0457]
如本文所用,术语“不显著地结合”应当理解为意指本公开的蛋白与多肽结合的水平统计学上不显著高于背景,例如,背景是在缺少所述蛋白的条件下和/或存在阴性对照蛋白(例如,同种型对照抗体)的条件下检测到的结合信号的水平和/或在阴性对照多肽的存在下检测到的结合水平。结合水平使用生物传感器分析(例如biacore)检测,其中蛋白被固定化并与抗原接触,或反之亦然。
[0458]
为了说明的目的且基于本文举例说明的主题对技术人员显而易见的是,在本文中提到“亲和力”是指可以使用例如解离常数(kd)定量的水平。通常,提到本文所述的蛋白的亲和力水平是指蛋白对特定抗原的kd。因此,如本文提到的那样,对c2具有至少15nm的亲和力的蛋白的kd为至少15nm(15nm或更强),即,解离常数的数值为15nm或更低(例如,10nm或100pm)。就此而言,提到较高的亲和力是指具有较低数值的kd,且反之亦然。
[0459]
如本文所用,短语“中性ph”是指在健康人个体中血液的大致ph(即,约ph 7.0至约ph 7.5)。类似地,短语“酸性ph”是指内体的大致ph(即,约ph 4.5至约ph 6.5)。在一些实例中,酸性ph是初级内体的ph(即,约ph 5.5至约ph 6.5)。此外,本文中任何提到在特定ph(例如,ph 6.0)时的亲和力,涵盖在所述ph的0.2单位内的ph的亲和力。例如,专业技术人员会理解,在ph 7.3时以比在6.0时更大的亲和力结合c2的蛋白也将在ph 7.5时以比在5.8时更大的亲和力结合c2。
[0460]
如本文所用,关于抗原提到“减少的结合”或“以较低水平结合”或“较低的亲和力”的短语要理解为意指抗体以比针对对照表位或抗原(例如seq id no:1)小至少约1.1倍、1.5倍、2倍、3倍、4倍、5倍、10倍或20倍的亲和力结合抗原(例如,seq id no:1的在位置443、331或457中任一个处的丙氨酸点突变)。
[0461]
如本文所用,术语“相似的亲和力”要理解为意指本公开的蛋白以在彼此的约5倍或更少的范围内的亲和力结合两个抗原(例如,人c2和食蟹猴c2),例如,在彼此的约4倍、3倍、2倍或1倍的范围内,诸如,在彼此的约1.5倍范围内,或结合水平基本上相同,例如,当通过将两个抗原(例如,人c2和食蟹猴c2)固定化并使固定化的蛋白与本公开的蛋白接触来评估亲和力时。
[0462]“至少约
……
的ic
50”要理解为意指ic
50
等于列举的值或更大(即,被列举为ic
50
的
数值较低),即,2nm的ic
50
大于3nm的ic
50
,且反之亦然。
[0463]
如本文所用,术语“表位”(同义词“抗原决定簇”)应当理解为意指本公开的蛋白结合的c2的区域。此术语不一定限于蛋白接触的特定的残基或结构。例如,此术语包括跨越被所述蛋白接触的氨基酸的区域,和/或跨越此区域以外5-10或2-5或1-3个氨基酸。在一些实例中,表位包含一系列不连续氨基酸,当c2被折叠时所述氨基酸彼此靠近地定位,即,“构象表位”。专业技术人员还知晓术语“表位”不限于肽或多肽。例如,术语“表位”包括分子的化学活性表面基团诸如糖侧链、磷酰基侧链或磺酰基侧链,并且,在某些实例中,可以具有特定的三维结构特征,和/或特定的电荷特征。
[0464]
术语“竞争性地抑制”应当理解为意指本公开的蛋白(或其抗原结合位点)减少或防止所述抗体或蛋白与c2的结合。这可以归因为蛋白(或抗原结合位点)和抗体与相同的或重叠的表位结合。从前面的描述很显然蛋白不一定完全抑制抗体的结合,而是其仅减少结合达统计学显著的量,例如,达至少约10%或20%或30%或40%或50%或60%或70%或80%或90%或95%。优选地,所述蛋白减少抗体的结合达至少约30%,更优选达至少约50%,更优选达至少约70%,还更优选达至少约75%,甚至更优选达至少约80%或85%和甚至更优选达至少约90%。测定结合的竞争性抑制的方法在本领域中是已知的和/或记载在本文中。例如,在存在或缺少所述蛋白的情况下使抗体暴露于c2。如果与缺少所述蛋白的情况相比,在存在所述蛋白的情况下较少的抗体结合,则所述蛋白被认为竞争性地抑制所述抗体的结合。在一个实例中,竞争性抑制不是因空间位阻引起的。
[0465]
在两个表位的情形中,“重叠的”应当被认为意指两个表位共用足够数目的氨基酸残基以允许结合一个表位的蛋白(或其抗原结合位点)竞争性抑制结合其他表位的蛋白(或抗原结合位点)的结合。例如,“重叠的”表位共用至少1或2或3或4或5或6或7或8或9或20个氨基酸。
[0466]
如本文所用,术语“病症”是指正常功能的破坏或干扰正常功能,并且不限于任何具体的病症,并包括疾病或病况。
[0467]
如本文所用,“补体介导病症”是指由下列引起或与下列相关联的任何病症:补体活性(例如,过度的补体活性),过多的补体(例如,c2)或过多的表达c2的细胞。专业技术人员能够容易地确定此类病症。就此而言,在一些实例中,病症是炎性病症、自身免疫病症或移植排斥。
[0468]
如本文所用,术语“预防性”、“防止”或“预防”包括施用本公开的蛋白从而停止或阻碍病症的至少一个症状的发生。
[0469]
如本文所用,术语“治疗性”、“治疗”或“疗法”包括施用本文所述的蛋白从而减少或消除指定的疾病或病症的至少一个症状。
[0470]
如本文所用,术语“受试者”应当被认为意指任何动物,包括人,例如,哺乳动物。示例性的受试者包括但不限于人和非人灵长类动物。例如,所述受试者是人。
[0471]
抗体
[0472]
在一个实例中,如本文所述根据任何实例的蛋白是抗体或其片段。
[0473]
生成抗体的方法在本领域中是已知的和/或记载在harlow和lane(编辑)antibodies:a laboratory manual,cold spring harbor laboratory,(1988)中。通常,在此类方法中,c2或其区域(例如,细胞外结构域)或其免疫原性片段或表位或表达和展示这
些的细胞(即,免疫原),任选地与任何合适的或期望的载剂、辅料或药学上可接受的赋形剂一起配制,施用于非人动物,例如,小鼠、鸡、大鼠、兔、豚鼠、犬、马、牛、山羊或猪。免疫原可以经鼻内、肌肉内、皮下、静脉内、皮内、腹膜内或通过其他已知途径施用。
[0474]
多克隆抗体的生产可以通过在免疫后的多个时间点对免疫动物的血液采样来监测。如果需要达到期望的抗体滴度,可以给予一次或多次再次免疫。重复加强免疫和滴定的过程直至达到合适的滴度为止。当获得期望水平的免疫原性时,将免疫动物放血,并分离和储存血清,和/或使用该动物来生成单克隆抗体(mab)。
[0475]
单克隆抗体是本公开考虑的抗体的一种示例形式。术语“单克隆抗体”或“mab”是指能够结合相同的抗原(例如,抗原内的相同表位)的均质性抗体群。该术语不旨在限制抗体的来源或其制备的方式。
[0476]
对于mab的生产,可以使用许多已知技术中的任一种,诸如,例如,us4196265或前述的harlow和lane(1988)中举例说明的程序。
[0477]
例如,利用免疫原在足以刺激产生抗体细胞的条件下免疫合适的动物。啮齿类动物(诸如兔、小鼠和大鼠)是示例性动物。基因改造以表达人抗体且例如不表达鼠抗体的小鼠也可以用来生成本公开的抗体(例如,如wo2002/066630中所述)。
[0478]
在免疫后,具有产生抗体的潜力的体细胞,尤其是b淋巴细胞(b细胞),被选择用于mab生成实验规程中。这些细胞可以获自脾、扁桃体或淋巴结的活检,或获自外周血样品。来自免疫动物的b细胞然后与一般来源于与用免疫原免疫的动物相同的物种的永生化骨髓瘤细胞融合。
[0479]
在包含阻断组织培养基中核苷酸的从头合成的试剂的选择性培养基中通过培养扩增杂交体。示例性的试剂为氨基蝶呤、甲氨喋呤和氮杂丝氨酸。
[0480]
对扩增的杂交瘤进行抗体特异性和/或滴度的功能选择,诸如,例如,通过流式细胞术和/或免疫组织化学和/或免疫测定(例如,放射免疫测定,酶联免疫测定,细胞毒性测定,空斑测定,斑点免疫测定,等等)。
[0481]
备选地,使用abl-myc技术(neoclone,madison wi 53713,usa)来产生分泌mab的细胞系(例如,如largaespada等人,j.immunol.methods.197:85-95,1996中所述)。
[0482]
抗体还可以通过筛选展示文库,例如,噬菌体展示文库来产生或分离,例如,如us6300064和/或us5885793中所述。例如,本发明人已经从噬菌体展示文库分离了全人抗体。
[0483]
在另一实例中,用c2或其片段筛选噬菌体展示文库或免疫动物,并且筛选经鉴定的蛋白和/或抗体以鉴定与c2和/或其片段有交叉反应的那些蛋白和/或抗体。
[0484]
在进一步的实例中,c2或其片段,与rf16-226g、rf16-214g或rf16-242g接触。然后使噬菌体展示文库与c2或其片段接触,并选择表达可以与rf16-226g、rf16-214g或rf16-242g竞争结合的蛋白的噬菌体。
[0485]
在又进一步的实例中,包含例如,其中用来自人c2的感兴趣表位置换相应的小鼠序列的小鼠c2的嵌合蛋白。此嵌合蛋白然后用来免疫小鼠(其可能较少地诱发针对小鼠蛋白的免疫应答)和/或筛选噬菌体展示文库。然后得到的抗体/蛋白被筛选以鉴定结合人c2(尤其在感兴趣表位处)且不结合小鼠c2的那些。
[0486]
本公开的抗体可以是合成抗体。例如,抗体是嵌合抗体、人源化抗体、人抗体或去
免疫化的抗体。
[0487]
嵌合抗体
[0488]
在一个实例中,本文所述的抗体是嵌合抗体。术语“嵌合抗体”是指其中重链和/或轻链的一部分与来源于特定物种(例如,鼠,诸如小鼠)的抗体中的相应序列相同或同源或属于特定的抗体型或亚型,而所述链的其余部分与来源于另一物种(例如,灵长类动物,诸如人)的抗体中的相应序列相同或同源或属于另一抗体型或亚型的抗体。嵌合抗体利用非人,例如,啮齿类动物或兔的可变区和人恒定区,以便产生人结构域优势的抗体。生产嵌合抗体的方法记载在,例如,us4816567;和us5807715中。
[0489]
人源化抗体和人抗体
[0490]
本公开的蛋白或抗体可以是人源化的或人的。
[0491]
术语“人源化的抗体”应当理解为是指具有来源于非人物种的抗体的抗原结合位点或可变区且其余抗体结构基于人抗体的结构和/或序列的嵌合抗体的亚型。在人源化的抗体中,抗原结合位点通常包含接枝在人抗体的可变区中的适宜fr上的来自非人抗体的互补决定区(cdr)且其余区域来自人抗体。抗原结合位点可以是野生型的(即,与非人抗体的那些相同)或被一个或多个氨基酸置换修饰。在一些情况下,人抗体的fr残基被相应的非人残基替代。
[0492]
人源化非人抗体或其部分(例如,可变区)的方法在本领域中是已知的。人源化可以根据us5225539或us5585089的方法进行。不排除用于人源化的其他方法。
[0493]
如本文所用的术语“人抗体”是指具有来源于人中(例如,人生殖细胞或体细胞中)发现的序列的或与人中(例如,人生殖细胞或体细胞中)发现的序列对应的可变区(例如,vh,v
l
)和任选的恒定区的抗体。“人”抗体可以包括不由人序列编码的氨基酸残基,例如由体外随机或定点诱变引入的突变(尤其是涉及保守置换的突变或抗体的少量残基中的突变,例如抗体的1、2、3、4、5或6个残基的突变,例如,构成抗体的一个或多个cdr的残基中1、2、3、4、5或6个残基的突变)。这些“人抗体”实际不需要由人产生,而是,它们可以使用重组手段产生和/或从包含编码人抗体恒定区和/或可变区(例如,如上所述)的核酸的转基因动物(例如,小鼠)分离。人抗体可以使用本领域中已知的各种技术产生,包括噬菌体展示文库(例如,如us5885793中所述)。
[0494]
识别选择的表位的人抗体还可以使用称作“引导选择”的技术生成。在此方式中,使用选择的非人单克隆抗体,例如,小鼠抗体,来引导对识别相同表位的完全人抗体的选择(例如,如us5565332中所述)。
[0495]
示例性的人抗体记载在本文中,并且包括rf16-226g、rf16-214g和rf16-242g和/或其可变区。与非人抗体相比,这些人抗体提供了在人中减小免疫原性的优势。
[0496]
包含抗体结合结构域的蛋白
[0497]
单结构域抗体
[0498]
在一些实例中,本公开的蛋白是单结构域抗体或包含单结构域抗体(其与术语“结构域抗体”或“dab”可互换使用)。单结构域抗体是包含抗体的全部或部分重链可变区的单一多肽链。在某些实例中,单结构域抗体是人单结构域抗体(domantis,inc.,waltham,ma;参见,例如,us6248516)。
[0499]
双链抗体、三链抗体、四链抗体
[0500]
在一些实例中,本公开的蛋白是或包含双链抗体、三链抗体、四链抗体或更多链的蛋白复合物,诸如wo98/044001和/或wo94/007921中所述。
[0501]
例如,双链抗体是包含两个缔合的多肽链的蛋白,每个多肽链包含结构v
l-x-vh或v
h-x-v
l
,其中v
l
是抗体轻链可变区,vh是抗体重链可变区,x是包含不足以允许单一多肽链中的vh和v
l
缔合(或形成fv)的残基的接头或不存在,并且其中一个多肽链的vh结合另一多肽链的v
l
以形成抗原结合位点,即,形成能够特异性结合一个或多个抗原的fv分子。v
l
和vh可以在每个多肽链中是相同的,或v
l
和vh可以在每个多肽链中是不同的以便形成双特异性双链抗体(即,包含两个具有不同特异性的fv)。
[0502]
单链fv(scfv)
[0503]
专业技术人员将知晓scfv包含单个多肽链中的vh和v
l
区以及vh和v
l
之间的能够使scfv形成用于抗原结合的期望结构(即,用于单个多肽链的vh和v
l
彼此缔合形成fv)的多肽接头。例如,接头包含超过12个氨基酸残基,其中(gly4ser)3是对scfv较有利的接头之一。
[0504]
本公开还考虑二硫化物稳定的fv(或difv或dsfv),其中单个半胱氨酸残基被引入到vh的fr和v
l
的fr中并且通过二硫键连接所述半胱氨酸残基以形成稳定的fv。
[0505]
备选地,或另外地,本公开涵盖二聚scfv,即,包含通过非共价键或共价键连接的两个scfv分子的蛋白,例如,通过亮氨酸拉链结构域(例如,来源于fos或jun)连接。备选地,两个scfv由长度足以允许两个scfv形成并结合抗原的肽接头连接,例如,如us20060263367中所述。
[0506]
重链抗体
[0507]
重链抗体在结构上与抗体的许多其他形式不同,就此而言,它们包含重链,但不包含轻链。因此,这些抗体也称作“仅含重链的抗体”。重链抗体见于,例如,驼科动物和软骨鱼(也称为ignar)。
[0508]
存在于天然重链抗体中的可变区通常在骆驼抗体中称作“v
hh
结构域”,在ignar中称为v-nar,以便将它们与存在于常规的4链抗体中的重链可变区(称作“vh结构域”)和存在于常规的4链抗体中的轻链可变区(称作“v
l
结构域”)区分开。
[0509]
对来自驼科动物的重链抗体及其可变区以及用于它们的生产和/或分离的方法和/或用途的综述尤其参见下面的文献:wo94/04678,wo97/49805和wo 97/49805。
[0510]
对来自软骨鱼的重链抗体及其可变区以及用于它们的生产和/或分离的方法和/或用途的综述尤其参见wo2005/118629。
[0511]
其他抗体和抗体片段
[0512]
本公开还考虑其他抗体和抗体片段,诸如:
[0513]
(i)“锁孔”双特异性蛋白,如us5,731,168中所述;
[0514]
(ii)异型缀合物蛋白,例如,如us4,676,980中所述;
[0515]
(iii)使用化学交联剂制备的异型缀合物蛋白,例如,如us4,676,980中所述;和
[0516]
(iv)fab3(例如,如ep19930302894中所述)。
[0517]
去免疫化抗体和蛋白
[0518]
本公开还考虑去免疫化抗体或蛋白。去免疫化抗体和蛋白的一个或多个表位,例如,b细胞表位或t细胞表位被移除(即,突变),从而减少哺乳动物将产生针对所述抗体或蛋白的免疫应答的可能性。用于制备去免疫化抗体和蛋白的方法在本领域中是已知的,并且
记载在,例如,wo00/34317、wo2004/108158和wo2004/064724中。
[0519]
基于本文的描述,用于引入合适的突变以及表达和测定所得蛋白的方法对于专业技术人员是明显的。
[0520]
对蛋白的突变
[0521]
本公开还考虑本公开的蛋白的突变形式。就此而言,本文提出的数据指示了本公开的蛋白的cdr内除了可以做出的示例性改变以外的可以被改变的位点。在本公开的情形中,专业技术人员将理解在包含可变区的蛋白的fr内可以另外地或备选地做出改变,而不会抑制或显著地减少其功能。就此而言,氨基酸置换可以引入到本公开的蛋白中,并筛选产物的期望活性,例如,保留/提高的抗原结合,减少的免疫原性,或提高的adcc或cdc。
[0522]
例如,与本文给出的序列相比,此类突变蛋白包含一个或多个保守氨基酸置换。在一些实例中,所述蛋白包含30个或更少或20个或更少或10个或更少,例如,9个或8个或7个或6个或5个或4个或3个或2个保守氨基酸置换。“保守氨基酸置换”是其中氨基酸残基被具有相似的侧链和/或亲水性和/或疏水性的氨基酸残基替换的置换。
[0523]
在一个实例中,与天然存在蛋白相比,突变蛋白具有仅一个、或不超过一个或两个或三个或四个或五个或六个保守氨基酸改变。保守氨基酸改变的细节在下面提供。如专业技术人员将知晓的那样,例如,从本文的公开内容,此类微小改变可以合理地被预期不改变蛋白的活性。
[0524]
在一些实例中,相对于本文提供的任何一个或多个cdr氨基酸序列,所述蛋白在cdr-l1具有不超过3个、不超过2个或不超过1个氨基酸置换,在cdr-l2中不超过2个或不超过1个氨基酸置换,在cdr-l3中不超过3个、不超过2个或不超过1个氨基酸置换,在cdr-h1中不超过2个或不超过1个氨基酸置换,在cdr-h2中不超过4个、不超过3个、不超过2个或不超过1个氨基酸置换,和/或在cdr-h3中不超过3个、不超过2个或不超过1个氨基酸置换。在一些实例中,每个cdr含有不超过1个、2个、3个或4个氨基酸置换。在一些实例中,所述氨基酸置换是保守置换。在一些实例中,结合剂包含框架区中的氨基酸置换。如本领域中技术人员理解的那样,可以执行常规的定点或随机诱变技术来改变本文提供的cdr或框架序列中任一个的氨基酸序列,以便例如改变结合亲和力(例如,亲和力成熟),减少对蛋白水解或氧化的易感性,或赋予或改变蛋白的其他物理化学或功能特性。
[0525]
具有相似侧链的氨基酸残基的家族在本领域中已有定义,包括碱性侧链(例如,赖氨酸,精氨酸,组氨酸),酸性侧链(例如,天冬氨酸,谷氨酸),不带电荷的极性侧链(例如,甘氨酸,天冬酰胺,谷氨酰胺,丝氨酸,苏氨酸,酪氨酸,半胱氨酸),非极性侧链(例如,丙氨酸,缬氨酸,亮氨酸,异亮氨酸,脯氨酸,苯丙氨酸,甲硫氨酸,色氨酸),β-支链侧链(例如,苏氨酸,缬氨酸,异亮氨酸)和芳香族侧链(例如,酪氨酸,苯丙氨酸,色氨酸,组氨酸)。保守氨基酸置换的实例提供在下面的表1中。
[0526]
表1
–
示例性保守氨基酸改变
[0527][0528][0529]
本公开还考虑在本公开的蛋白(例如,在cdr中,诸如cdr3)中的非保守氨基酸改变(例如,置换)。在一个实例中,所述蛋白包含少于个6或5个或4个或3个或2个或1个非保守氨基酸置换,例如,所述非保守氨基酸置换在cdr3中,诸如在cdr3中。
[0530]
可以使用常规技术将氨基酸置换引入至cdr中,例如,以提高结合亲和力。这样的置换可以在cdr“热点”中做出,所述“热点”即为由在体细胞成熟过程期间高频地经历突变的密码子编码的残基(参见,例如,chowdhury,methods mol.biol.207:179-196(2008)),和/或接触c2的残基,测试得到的变体vh和/或v
l
的结合亲和力。备选地或另外地,可以进行亲和力成熟。通过从二级文库构建和重新选择进行的亲和力成熟记载在,例如,hoogenboom等人的methods in molecular biology 178:1-37(o'brien等人,编辑,human press,totowa,nj,(2001))中。在亲和力成熟的一些实例中,通过多种方法中的任一种(例如,易错pcr、链改组或寡核苷酸定向诱变),将多样性引入至选择用于成熟的可变区编码序列中。然后建立二级文库。然后筛选文库以鉴定具有所需亲和力的任何变体。引入多样性的另一方法涉及cdr-定向方式,其中几个cdr残基(例如,一次4-6个残基)被随机化。参与抗原结合的
cdr残基可以进行专门的鉴定,例如,使用下面描述的丙氨酸扫描诱变,或建模。尤其是cdr-h3和cdr-l3可以用于随机诱变和亲和力成熟。
[0531]
在某些实例中,置换、插入或缺失可以发生在一个或多个cdr内,只要这种改变基本上不减少蛋白以ph依赖方式结合c2的能力即可。例如,保守置换可以在cdr中做出,只要所述蛋白仍然在ph 7.3时比在ph 6.0时以更大的亲和力结合c2即可。在一些实例中,包含所述氨基酸置换的蛋白以与没有所述置换的蛋白相似的亲和力结合c2。此类置换可以,例如,在cdr中的抗原接触残基的外部。在一些实例中,包含所述氨基酸置换的蛋白以比没有所述置换的蛋白更高的亲和力结合c2。在一些实例中,包含所述氨基酸置换的蛋白以比没有所述置换的蛋白更低的亲和力结合c2。在某些实例中,每个cdr是未改变的,或包含不超过1个、2个、3个或4个氨基酸置换。在一些实例中,所述置换是保守置换。
[0532]
用于鉴定可以被靶向进行诱变的抗体的残基或区域的有用方法称为“丙氨酸扫描诱变”,如由cunningham,science 244:1081-1085(1989)描述。在此方法中,一个靶残基或一组靶残基(例如,带电荷的残基诸如arg,asp,his,lys和glu)被鉴定并被中性氨基酸诸如丙氨酸替换以确定抗体与抗原的相互作用是否受影响。进一步的置换可以在证明对初步置换有功能敏感性的氨基酸位置处引入。备选地或另外地,抗原-抗体复合物的晶体结构可以用来鉴定抗体和抗原之间的接触点。此类接触残基和邻近残基可以被靶向或去除作为用于置换的候选物。可以筛选变体以确定它们是否包含期望的特性。
[0533]
备选地或另外地,可以引入氨基酸置换以便改变该蛋白的ph-依赖性结合能力。例如,可以引入氨基酸置换以增加该蛋白在ph 7.3时对c2的亲和力和/或增加在ph 6.0时对c2的亲和力。如本领域技术人员所理解的是,氨基酸置换影响ph敏感性结合的能力要求插入的残基在与c2结合后经历pka的改变。因此,在本文所述的蛋白的cdr中纳入可电离的残基(例如,his,arg,lys)可以改变它们的ph-依赖性结合能力。就此而言,此类可电离残基可以改变蛋白在质子化或去质子化后的三维结构,引起pka的迁移。在本领域中已知用于改变ph-依赖性结合的技术包括在us20110111406a1、wo2012044831、wo2017132259和murtaugh等人,protein science,20:1619-1631(2011)中描述的那些。因此,在一些实例中,本文提供的cdr序列中的氨基酸被可电离残基置换。在一些实例中,可电离残基是组氨酸、精氨酸、赖氨酸、天冬氨酸或谷氨酸。在一些实例中,可电离残基是组氨酸。
[0534]
本公开还考虑与本文提出的序列相比的一个或多个插入或缺失。在一些实例中,所述蛋白包含10个或更少,例如,9个或8个或7个或6个或5个或4个或3个或2个插入和/或缺失。
[0535]
恒定区
[0536]
本公开涵盖本文所述的包含抗体的恒定区的蛋白。这包括与fc融合的抗体的抗原结合片段。
[0537]
可用于制备本公开的蛋白的恒定区的序列可以获自许多不同的来源。在一些实例中,蛋白的恒定区或其部分来源于人抗体。恒定区或其部分可以来源于任何抗体型,包括igm、igg、igd、iga和ige,以及任何抗体同种型,包括igg1、igg2、igg3和igg4。在一个实例中,恒定区是人同种型igg4或稳定化的igg4恒定区。
[0538]
在一个实例中,恒定区的fc区具有减小的诱导效应子功能的能力,例如,与天然或野生型人igg1或igg3 fc区相比。在一个实例中,效应子功能是抗体-依赖性细胞介导的细
胞毒性(adcc)和/或抗体-依赖性细胞介导的吞噬作用(adcp)和/或补体-依赖性细胞毒性(cdc)。评估包含fc区的蛋白的效应子功能的水平的方法在本领域中是已知的和/或记载在本文中。
[0539]
在一个实例中,fc区是igg4 fc区(即,来自igg4恒定区),例如,人igg4 fc区。合适的igg4 fc区的序列对于技术人员来说是明显的和/或可获自公共数据库(例如,可获自美国国家生物技术信息中心)。
[0540]
在一个实例中,恒定区是稳定化的igg4恒定区。术语“稳定化的igg4恒定区”要理解为意指已经被修饰以减少fab臂交换或经历fab臂交换的倾向或形成半抗体或形成半抗体的倾向的igg4恒定区。“fab臂交换”是指对人igg4的蛋白修饰的类型,其中igg4重链和附着的轻链(半分子)交换来自另一个igg4分子的重链-轻链对。因此,igg4分子可以获得识别两个不同抗原的两个不同的fab臂(产生双特异性分子)。fab臂交换在体内天然发生,并且可以在体外通过纯化的血细胞或还原剂诸如还原型谷胱甘肽来诱导。当igg4抗体解离形成各自包含单个重链和单个轻链的两个分子时形成“半抗体”。
[0541]
在一个实例中,稳定化的igg4恒定区包含依照kabat系统在铰链区的位置241处的脯氨酸(kabat等人,sequences of proteins of immunological interest washington dc united states department of health and human services,1987和/或1991)。该位置对应于依照eu编号系统的铰链区的位置228(kabat等人,sequences of proteins of immunological interest washington dc united states department of health and human services,2001和edelman等人,proc.natl.acad.usa,63,78-85,1969)。在人igg4中,此残基通常为丝氨酸。在用丝氨酸替换脯氨酸后,igg4铰链区包含序列cppc。就此而言,技术人员将知晓“铰链区”是抗体重链恒定区的富含脯氨酸部分,它连接fc和fab区,赋予抗体的两个fab臂以移动性。铰链区包括参与重链间二硫键的半胱氨酸残基。它通常定义为依照kabat编号系统从人igg1的glu226延伸到pro243。其他igg同种型的铰链区可以通过将形成重链间二硫(s-s)键的第一个和最后一个半胱氨酸残基放在相同位置来与igg1序列比对(参见例如wo2010/080538)。
[0542]
稳定化igg4抗体的其他实例为其中人igg4的重链恒定区中位置409处(依照eu编号系统)的精氨酸被赖氨酸、苏氨酸、甲硫氨酸或亮氨酸替代的抗体(例如,如wo2006/033386中所述)。恒定区的fc区可以另外地或备选地包含选自由下列各项组成的组的残基:在对应于405的位置处(依照eu编号系统)的丙氨酸、缬氨酸、甘氨酸、异亮氨酸和亮氨酸。任选地,铰链区包含位置241处的脯氨酸(即,cppc序列)(如上所述)。
[0543]
在另一实例中,fc区是被修饰具有减小的效应子功能的区,即,“非免疫刺激性fc区”。例如,fc区是包含选自由下列各项组成的组的一个或多个位置处的置换的igg1 fc区:268,309,330和331。在另一个实例中,fc区是包含下列改变e233p、l234v、l235a和g236缺失中的一个或多个和/或下列改变a327g、a330s和p331s中的一个或多个的igg1 fc区(armour等人,eur j immunol.29:2613-2624,1999;shields等人,j biol chem.276(9):6591-604,2001)。非免疫刺激性fc区的其他实例记载在,例如,dall'acqua等人,j immunol.177:1129-11382006;和/或hezareh j virol;75:12161-12168,2001)中。
[0544]
在另一实例中,fc区是嵌合fc区,例如,包含来自igg4抗体的至少一个ch2结构域和来自igg1抗体的至一个ch3结构域,其中fc区包含在选自由下列各项组成的组的一个或
多个氨基酸位置处的置换:240,262,264,266,297,299,307,309,323,399,409和427(eu编号)(例如,如wo2010/085682中所述)。示例性的置换包括240f,262l,264t,266f,297q,299a,299k,307p,309k,309m,309p,323f,399s和427f。
[0545]
其他的修饰作用
[0546]
本公开还考虑对结合c2的蛋白的其他修饰作用。
[0547]
例如,本公开的蛋白可以包含增加蛋白的半衰期的一个或多个氨基酸置换。例如,所述蛋白包括包含增加fc区针对新生儿fc受体(fcrn)的亲和力的一个或多个氨基酸置换的fc区。例如,所述fc区具有在较低ph时(例如,约ph 6.0)对fcrn增加的亲和力,以促进内体中的fc/fcrn结合。在一个实例中,与在约ph 7.3时其亲和力相比所述fc区在约ph 6时具有对fcrn增加的亲和力,这促进了在细胞再循环后fc再释放到血液中。这些氨基酸置换可用于通过减少从血液的清除而延长蛋白的半衰期。
[0548]
示例性的氨基酸置换包括依照eu编号系统t250q和/或m428l或t252a,t254s和t266f或m252y,s254t和t256e或h433k和n434f。另外的或备选的氨基酸置换记载在,例如,us20070135620或us7083784中。
[0549]
在一些实例中,一个或多个氨基酸置换选自依照eu编号系统m252y,s254t,t256e,v308p,n286e,m428l,n434a和n434y。在一些实例中,所述蛋白包括其fc区中的下列氨基酸置换:
[0550]
(i)m252y,
[0551]
(ii)n286e或v308p,和
[0552]
(iii)n434y(依照eu编号系统)。
[0553]
蛋白制备
[0554]
在一个实例中,根据任一实例的本文所述的蛋白使用本领域已知的方法制备,例如,通过在足以制备所述蛋白的条件下培养杂交瘤。
[0555]
重组表达
[0556]
在另一实例中,根据任一实例的本文所述的蛋白是重组体。
[0557]
在重组蛋白的情况下,编码所述重组蛋白的核酸可以克隆到表达构建体或载体中,然后将其转染到宿主细胞中,诸如大肠杆菌细胞、酵母细胞、昆虫细胞或哺乳动物细胞,诸如猴cos细胞、中国仓鼠卵巢(cho)细胞、人胚肾(hek)细胞、或不转染不会产生所述蛋白的骨髓瘤细胞。用于表达蛋白的示例性细胞是cho细胞、骨髓瘤细胞或hek细胞。为实现这些目的的分子克隆技术在本领域中是已知的并且记载在,例如,ausubel等人,(编辑),current protocols in molecular biology,greene pub.associates和wiley-interscience(1988,包括至今的所有更新)或sambrook等人,molecular cloning:a laboratory manual,cold spring harbor laboratory press(1989)。大量的克隆和体外扩增方法适合用于构建重组核酸。制备重组抗体的方法在本领域中也是已知的,参见,例如,us4816567或us5530101。
[0558]
在分离后,在表达构建体或表达载体中插入核酸可操作地连接启动子用于进一步克隆(扩增dna)或用于在无细胞系统中或在细胞中的表达。
[0559]
如本文所用,术语“启动子”以其最宽泛的范围理解,并且包括基因组基因的转录调控序列,包括tata盒或起始子元件,它们是准确转录起始所必需的,具有或不具有改变核
酸表达的额外调控元件(例如,上游激活序列、转录因子结合位点、增强子和沉默子),例如,响应于发育和/或外界刺激,或以组织特异性方式。在本文的情形中,术语“启动子”也用来描述重组的、合成的或融合核酸,或赋予、激活或增强其可操作连接的核酸的表达的衍生物。示例性的启动子可以包含额外拷贝的一个或多个特异性调控元件以进一步增强所述核酸的表达和/或改变所述核酸的空间表达和/或时间表达。
[0560]
如本文所用,术语“可操作地连接”意指将启动子相对于核酸定位使得核酸的表达受启动子控制。
[0561]
可获得许多用于在细胞中表达的载体。所述载体成分通常包括,但不限于,下列中的一个或多个:信号序列,编码蛋白的序列(例如,来源于本文提供的信息),增强子元件,启动子和转录终止序列。技术人员将知晓用于表达蛋白的合适序列。示例性的信号序列包括原核分泌信号(例如,pelb、碱性磷酸酶、青霉素酶、ipp或热稳定的肠毒素ii),酵母分泌信号(例如,转化酶前导序列、α因子前导序列或酸性磷酸酶前导序列)或哺乳动物分泌信号(例如,单纯疱疹gd信号)。
[0562]
在哺乳动物细胞中有活性的示例性启动子包括:巨细胞病毒即刻早期启动子(cmv-ie),人延伸因子1-α启动子(ef1),小核rna启动子(u1a和u1b),α-肌球蛋白重链启动子,猴病毒40启动子(sv40),劳氏肉瘤病毒启动子(rsv),腺病毒主要晚期启动子,β-肌动蛋白启动子;包含cmv增强子/β-肌动蛋白启动子或免疫球蛋白启动子或其活性片段的混合调控元件。有用的哺乳动物宿主细胞系的实例为被sv40转化的猴肾cv1系(cos-7,atcc crl 1651);人胚肾细胞系(293细胞或被亚克隆用于在悬浮培养中生长的293细胞);幼仓鼠肾细胞(bhk,atcc ccl 10);或中国仓鼠卵巢细胞(cho)。
[0563]
适合用于在酵母细胞(诸如例如选自由巴斯德毕赤酵母(pichia pastoris)、酿酒酵母(saccharomyces cerevisiae)和粟酒裂殖酵母(s.pombe)组成的组的酵母细胞)中表达的典型启动子包括,但不限于:adh1启动子,gal1启动子,gal4启动子,cup1启动子,pho5启动子,nmt启动子,rpr1启动子或tef1启动子。
[0564]
用于将分离的核酸或包含所述分离的核酸的表达构建体引入至细胞进行表达的手段是本领域技术人员已知的。用于给定细胞的技术取决于已知的成功技术。用于将重组dna引入至细胞中的手段包括显微注射、由deae-葡聚糖介导的转染、由脂质体介导的转染诸如通过使用lipofectamine(gibco,md,usa)和/或cellfectin(gibco,md,usa)、peg-介导的dna摄取、电穿孔和微粒轰击诸如通过使用dna-包被的钨或金粒子(agracetus inc.,wi,usa),等等。
[0565]
用来制备蛋白的宿主细胞可以培养在各种培养基中,取决于所使用的细胞类型。可商购的培养基诸如ham's fl0(sigma)、极限必需培养基((mem),(sigma)、rpml-1640(sigma)和达尔伯克改良伊戈尔培养基((dmem),sigma)适合用于培养哺乳动物细胞。用于培养本文所讨论的其他细胞类型的培养基在本领域中是已知的。
[0566]
蛋白的分离
[0567]
用于分离蛋白的方法在本领域中是已知的和/或记载在本文中。
[0568]
在蛋白分泌至培养基中的情况下,来自此类表达系统的上清液可以首先使用可商购的蛋白浓缩滤器(例如,amicon或millipore pellicon超滤装置)进行浓缩。蛋白抑制剂诸如pmsf可以包括在任一前述步骤中以抑制蛋白水解并且可以包括抗生素以防止外来污
染物的生长。备选地,或另外地,上清液可以过滤和/或与表达所述蛋白的细胞分离,例如,使用连续离心分离。
[0569]
由细胞制备的蛋白可以使用例如离子交换、羟基磷灰石层析、疏水相互作用层析、凝胶电泳、透析、亲和层析(例如,蛋白a亲和层析或蛋白g层析)、或前述方法的任意组合来纯化。这些方法在本领域中是已知的,并且记载在,例如,wo99/57134或ed harlow和david lane(编辑)antibodies:a laboratory manual,cold spring harbor laboratory,(1988)中。
[0570]
技术人员还将知晓蛋白可以被修饰为包括标签以有助于纯化或检测,所述标签例如,聚-组氨酸标签,例如,六-组氨酸标签,或流感病毒血凝素(ha)标签,或猴病毒5(v5)标签,或flag标签,或谷胱甘肽s-转移酶(gst)标签。然后使用本领域中已知的方法(诸如,亲和纯化)纯化得到的蛋白。例如,包含6-his标签的蛋白通过使包含所述蛋白的样品与特异性结合被固定化在固相或半固相载体上的6-his标签的镍-次氮基三乙酸(ni-nta)接触,洗涤所述样品以去除未结合的蛋白,随后洗脱结合的蛋白来纯化。备选地,或另外地,在亲和纯化法中使用结合标签的配体或抗体。
[0571]
测定蛋白的活性
[0572]
与c2及其突变体结合
[0573]
用于评估与蛋白结合的方法在本领域中是已知的,例如,如记载在scopes(参见:protein purification:principles and practice,third edition,springer verlag,1994)中。这样的方法通常涉及标记所述蛋白并使其与固定化的抗原接触,或反之亦然。在洗涤去除非特异性结合的蛋白后,检测标记的量,以及因此检测结合的蛋白。当然,蛋白可以被固定化并标记抗原。还可以使用淘选型测定。备选地,或另外地,可以使用表面等离子体共振测定。因此,在一个实例中,本文所述的蛋白的亲和力使用生物传感器测定。
[0574]
任选地,测定蛋白对c2的解离常数(kd)。c2结合蛋白的“kd”或“k
d”或“kd值”在一个实例中通过放射性标记的或荧光标记的c2结合测定测量。该测定在滴定系列的未标记c2的存在下用最小浓度的标记的c2平衡蛋白。在洗涤去除未结合c2后,测定标记的量,其指示蛋白的kd。
[0575]
根据另一实例,通过使用表面等离子共振测定,例如,使用biacore表面等离子共振(biacore,inc.,piscataway,nj)利用固定化的c2测量kd,或反之亦然。因此,在一个实例中,使用生物传感器(例如,通过表面等离子共振)在其中蛋白被固定化且c2与固定化的蛋白接触的测定中测定蛋白的亲和力。
[0576]
表位做图
[0577]
在另一实例中,对由本文所述的蛋白结合的表位做图。表位做图方法对于专业技术人员来说是显而易见的。例如,制备一系列跨越c2序列或其包含感兴趣表位的区域的重叠肽,例如,包含10-15个氨基酸的肽。然后使所述蛋白与每个肽接触并测定与其结合的肽。这允许测定包含与蛋白结合的表位的肽。如果多个不连续肽被蛋白结合,则该蛋白可以结合构象表位。
[0578]
备选地或另外地,如本文所举例说明的那样,将c2内的氨基酸残基突变,例如,通过丙氨酸扫描诱变,并且确定减少或阻止蛋白结合的突变。减少或阻止蛋白结合的任何突变可能在被蛋白结合的表位内。
[0579]
进一步的方法涉及使c2或其区域与本公开的固定化的蛋白结合并利用蛋白酶消化得到的复合物。然后分离并分析仍然与固定化的蛋白结合的肽,例如,使用质谱法,以确定它们的序列。
[0580]
进一步的方法涉及将c2或其区域中的氢转变为氘并使得到的蛋白与本公开的固定化蛋白结合。然后氘转变回氢,分离c2或其区域,用酶消化并分析,例如,使用质谱法来鉴定包含氘的那些区域,这些区域通过本文所述的蛋白的结合而被保护不转变为氢。
[0581]
测定竞争性结合
[0582]
用于测定蛋白是否竞争性抑制本文所述的抗体(诸如,rf16-226g,rf16-214g,rf16-242g,rf16-226,rf16-214,rf16-242,rf16-191或rf16-203)的结合的测定,对于专业技术人员来说是显而易见的。例如,抗体缀合到可检测标记,例如,荧光标记或放射性标记。标记的抗体和测试蛋白然后混合在一起并与c2或其区域(例如,包含seq id no:1的多肽)或表达c2或其区域的细胞接触。然后测定标记的抗体的水平并与当在缺少所述蛋白的情况下所述标记的抗体与c2、区域或细胞接触时测定的水平进行比较。如果在测试蛋白的存在下与在缺少所述蛋白的情况下相比标记的抗体的水平减小,则所述蛋白被认为竞争性抑制所述抗体的结合。
[0583]
任选地,测试蛋白与抗体的不同标记缀合。这种交替标记允许检测测试蛋白与c2或其区域或细胞的结合水平。
[0584]
在另一实例中,在使c2、其区域或细胞与抗体接触之前允许蛋白结合c2或其区域(例如,包含seq id no:1的多肽)或表达c2或其区域的细胞。在所述蛋白的存在下与在缺少蛋白的情况下相比结合的抗体的量的减小表明所述蛋白竞争性抑制抗体与c2的结合。还可以使用标记的蛋白进行交互测定并首先使所述抗体与c2结合。在此情况下,在存在抗体的情况下与在缺少抗体的情况下相比标记的蛋白与c2结合的量的减少表明所述蛋白竞争性抑制抗体与c2的结合。
[0585]
可以利用c2和/或seq id no:1和/或本文所述的抗体结合的c2的区域的突变体形式进行任一项前述测定,例如,如上所述。
[0586]
测量对补体活性的抑制
[0587]
在一个实例中,使用酶联免疫测定(例如,补体测定试剂盒)测量补体活性。例如,使用对在补体激活期间产生的抗原或表位(例如,c5b-9或c5b-9中存在的表位)特异的标记抗体确定补体抑制活性。在一个实例中,微量滴定板的孔用经典通路、凝集素通路或旁路的特异性激活物包被。在另一实例中,本公开的蛋白与正常人血清和适宜的测定稀释剂(即,包含适宜封闭成分以确保经典通路、凝集素通路或旁路的特异性激活的稀释剂)孵育,并加入至用经典通路、凝集素通路或旁路的特异性激活物包被的微量滴定板孔,并且使用c5b-9的特异性碱性磷酸酶标记抗体检测形成的c5b-9的量。在一个实例中,产生的补体激活产物(即,c5b-9)的量与补体通路的功能活性成正比。在一个实例中,测定半最大抑制剂浓度(即,ic
50
)。
[0588]
在另一实例中,使用溶血测定法(例如,经典通路(即,ch50)和旁路(aph50)抑制测定法)测定补体抑制活性。ch50测定法是测量血清中的总体经典补体活性的方法。该测试是裂解测定,使用抗体-敏化的红细胞作为经典补体通路的激活物,人血清作为补体来源。可以测定溶血百分比,例如,使用分光光度计测定。ch50测定法提供了对终末补体复合物
(tcc)形成的间接测量,因为tcc本身直接负责被测量的溶血作用。所述测定法在本领域中是众所周知的。简言之,为了评估经典补体通路的抑制,预先稀释的人血清在微量测定孔中与连续稀释的本公开的蛋白一起预孵育。下一步,加入抗体-敏化的红细胞(例如,用兔抗-绵羊抗体敏化的绵羊红细胞)。在离心后,使用分光光度计测量上清液中的游离血红蛋白。游离血红蛋白的减少反映了对tcc-介导的红细胞裂解的抑制。然后相对于仅与人血清孵育的红细胞(100%裂解样品)计算对补体活性的抑制。
[0589]
补体抑制还可以基于本领域中已知的任何方法评价,包括例如,体外酵母多糖测定,红细胞裂解测定,抗体或免疫复合物激活测定,旁路激活测定,以及凝集素通路激活测定。
[0590]
测定半衰期
[0591]
本公开涵盖的一些蛋白具有提高的半衰期,例如,被修饰以延长它们的半衰期或缀合到延长它们的半衰期的化合物。测定具有提高的半衰期的蛋白的方法对于技术人员来说是显而易见的。例如,评估蛋白结合新生儿fc受体(fcrn)的能力。就此而言,增加的对fcrn的结合亲和力增加了蛋白的血清半衰期(参见例如,kim等人,eur j immunol.,24:2429,1994)。
[0592]
本公开的蛋白的半衰期还可以通过药代动力学研究测量,例如,根据kim等人,eur j of immunol 24:542,1994所述的方法。根据该方法,将放射性标记的蛋白静脉内注射到小鼠中,定期测量其血浆浓度作为时间的函数,例如在注射后3分钟至72小时时。备选地,可以注射未标记的本公开的蛋白,并使用elisa定期测量其血浆浓度。由此获得的清除曲线应当是双相的,即,α相和β相。对于蛋白的体内半衰期的测定,计算β相中的清除率并与野生型或未修饰蛋白进行比较。
[0593]
待治疗的病况
[0594]
本公开提供了,例如,抑制受试者中的补体活性的方法,包括向所述受试者施用本公开的蛋白。
[0595]
本公开还提供了治疗或预防受试者中的补体介导病症的方法,所述方法包括向所述受试者施用本公开的蛋白或包含所述蛋白的组合物。
[0596]
在一个实例中,所述方法包括抑制经典通路或凝集素通路中的补体活性。例如,所述方法包括施用本公开的蛋白以抑制经典补体通路的激活。在另一实例中,所述方法包括施用本公开的蛋白以抑制凝集素通路的激活。
[0597]
补体介导病症可以是先天性的或获得性的。
[0598]
在一个实例中,补体介导病症选自由下列各项组成的组:移植排斥(包括移植物功能延迟恢复,移植物挽救和抗体介导排斥),肾病,缺血再灌注损伤,视神经脊髓炎,重症肌无力,肾小球病变,狼疮性肾炎(急性和慢性),iga肾病,大疱性类天疱疮,抗磷脂综合征,葡萄膜炎,神经系统病症,帕金森病,亨廷顿病,脑梗死,运动神经元病,自身免疫性溶血性贫血,anca-相关性血管炎,慢性炎性脱髓鞘多发性神经病,缺血性卒中(具有和不具有再灌注),创伤性脑损伤,躯体创伤和抗肾小球基底膜(gbm)肾炎。
[0599]
在一个实例中,补体介导病症是原发性失调,诸如遗传性血管水肿,阵发性睡眠性血红蛋白尿,非典型溶血性尿毒症综合征(ahus),血栓性血小板减少性紫癜(ttp),血栓性微血管病,c3肾小球病,膜性增生性肾小球肾炎或移植排斥(包括移植物功能延迟恢复,移
植物挽救和抗体介导排斥)。
[0600]
在一个实例中,补体介导病症是自身免疫病况,诸如视神经脊髓炎,多发性硬化症,重症肌无力,guillain-barre综合征,重症肌无力,狼疮性肾炎(急性和慢性),iga肾病,类风湿性关节炎,克罗恩病,溃疡性结肠炎,自身免疫性溶血性贫血,天疱疮,类天疱疮(包括大疱性类天疱疮),慢性炎性脱髓鞘多发性神经病(cidp),抗肾小球基底膜(gbm)肾炎或抗磷脂综合征。
[0601]
在一个实例中,补体介导病症是冷自身免疫性溶血性贫血(caiha),也称作冷凝集素病(cad)。在一个实例中,补体介导病症是温抗体自身免疫性溶血性贫血(waiha)。
[0602]
在一个实例中,补体介导病症是急性损伤,诸如多发伤,神经损伤,血液透析,创伤性脑损伤,躯体创伤或感染后hus。
[0603]
在一个实例中,补体介导病症是炎症病况,诸如黄斑变性,葡萄膜炎,anca-相关性血管炎,动脉粥样硬化,哮喘,copd,脓毒症,急性呼吸窘迫综合征,脑型疟,牛皮癣性关节病或皮肌炎。
[0604]
在一个实例中,补体介导病症是退行性病况,诸如骨关节炎,痴呆,青光眼,神经系统病症,帕金森病,亨廷顿病,运动神经元病或糖尿病性血管病。
[0605]
在一个实例中,补体介导病症是缺血-再灌注病况/损伤,例如,如发生在器官移植中,或手术后或在卒中或心肌梗死后。
[0606]
在一个实例中,补体介导病症是心肌炎。
[0607]
在一个实例中,补体介导病症是纤维化疾病。在一个实例中,补体介导病症是间质性肺病(ild)。在一个实例中,ild是特发性肺纤维化(ipf)。在一个实例中,ild是非-ipf ild。在一个实例中,ild是进行性纤维化ild。在一个实例中,ild是非-ipf的进行性纤维化表型。诊断补体介导病症的方法对技术人员来说是很显而易见的,并且包括,例如,总血清型溶血补体(ch-50)测试,替代溶血补体(ap-50)测试,筛选免疫复合物病,测试狼疮的抗核血清学,尿液分析和全血计数(cbc)。
[0608]
在一个实例中,所述受试者处于发生补体介导病症的风险中。受试者如果与对照群体相比具有较高的发生补体介导病症的风险,则受试者处于风险中。对照群体可以包括从一般群体中随机选择的一个或多个不患有补体介导病症或没有补体介导病症的家族史的受试者(例如,通过年龄、性别、人种和/或种族匹配)。如果发现与补体介导病症相关的“风险因子”与受试者相关联,则该受试者可以被认为处于补体介导病症的风险中。风险因子可以包括与给定病症相关联的任何活性、特征、事件或特性,例如,通过对受试者群体的统计学或或流行病学研究确定。因此,受试者可以归类为处于补体介导病症的风险中,即使鉴定基础风险因子的研究没有具体地包括所述受试者。
[0609]
在一个实例中,所述受试者处于发生补体介导病症的风险中,在补体介导病症的症状发作前或后施用所述蛋白。在一个实例中,在补体介导病症的症状发作前施用所述蛋白。在一个实例中,在补体介导病症的症状发作后施用所述蛋白。在一个实例中,本公开的蛋白以减轻或减少处于风险中的受试者中的补体介导病症的一个或多个症状的剂量施用。
[0610]
补体介导病症的症状对于技术人员来说是明显的,并且将取决于具体的病症。补体介导病症的示例性症状包括,例如:
[0611]
·
反复感染;
[0612]
·
关节炎;
[0613]
·
肌无力;
[0614]
·
皮疹或皮肤色素异常;
[0615]
·
水肿,尤其是四肢(例如,足、手、腿或臂)或眼部水肿;
[0616]
·
腹痛;
[0617]
·
呼吸困难;
[0618]
·
恶心;
[0619]
·
疲劳;
[0620]
·
血尿;
[0621]
·
局部或完全麻痹;和
[0622]
·
认知能力差。
[0623]
本公开的方法可以容易地应用于受试者中任何形式的补体介导病症。
[0624]
在一个实例中,本公开的方法减少本领域中已知的和/或本文所述的补体介导病症的任何症状。
[0625]
如对技术人员明显的是,受试者中的补体介导病症的症状的“减轻”是与也患有补体介导病症但没有接受利用本文所述的方法的治疗的另一受试者相比较的。这不一定需要两个受试者的并排比较。可以依靠相当的人群数据。例如,评估患有补体介导病症的没有接受利用本文所述的方法的治疗的受试者群体(任选地,与治疗的受试者类似的受试者群体,例如,在年龄、体重、人种方面类似),平均值与用本文所述的方法治疗的受试者或受试者群体的结果相比较。
[0626]
在补体介导病症为因器官移植引起的或与器官移植相关的缺血再灌注损伤的情况下,本公开的蛋白或包含所述蛋白的组合物可以在移植前、期间或之后施用。在一些实例中,所述蛋白或组合物施用于器官移植供者。在其他实例中,所述蛋白或组合物施用于受试者,其中所述受试者是器官移植受者。在一个实例中,所述蛋白或组合物在器官移植前施用于离体收获的器官。例如,收获的器官可以在移植前用包含所述蛋白或组合物的溶液灌注或输注。在一些实例中,器官移植是实体器官移植。
[0627]
从前面的描述对于技术人员来说明显的是,本公开提供了器官移植的方法或改善器官移植的转归的方法或改善移植器官的功能的方法或防止移植物功能延迟恢复的方法,所述方法包括在收集器官之前向器官移植供者施用蛋白或包含所述蛋白的组合物;收集器官并将所述器官移植到器官移植受者中。
[0628]
本公开还提供了从器官供者准备移植器官以改善在器官移植受者中的器官功能的方法,所述方法包括在收集器官之前向器官供者施用蛋白或组合物。
[0629]
本公开另外提供了防止器官移植排斥的方法,所述方法包括在收集器官之前向器官供者施用蛋白或组合物;收集器官并将所述器官移植到器官移植受者中。
[0630]
在一些实例中,所述器官是实体器官。在一些实例中,器官是肺、肝、胰腺、心脏或肾脏。
[0631]
在一些实例中,所述方法另外包括向器官移植受者施用所述蛋白或组合物。例如,在移植前或在移植器官的时候(即,在移植期间)将所述蛋白或组合物施用于器官移植受者。
[0632]
本公开还提供了器官移植的方法或改善器官移植的转归的方法或改善移植器官的功能的方法或防止移植物功能延迟恢复的方法,所述方法包括在移植器官之前向器官移植受者施用蛋白或组合物,然后将所述器官移植到器官移植受者中。
[0633]
在一个实例中,所述器官移植供者是脑死亡的。例如,器官供者借助于生命支持是活着的,但脑死亡。
[0634]
在本公开的一个实例中,在再灌注前施用所述蛋白或组合物,例如,在器官移植的情况下,所述蛋白或组合物在移植器官的再灌注前施用于器官移植受者(例如,所述蛋白或组合物在移植前或在移植期间但在再灌注前施用)。
[0635]
在施用于脑死亡供体的情况下,所述蛋白或组合物可以在脑死亡和器官收集之间的任何时间施用。在一些实例中,所述蛋白或组合物在器官移植前施用于离体收获的器官。例如,收获的器官可以在移植前用包含所述蛋白或组合物的溶液灌注或输注。
[0636]
组合物
[0637]
在一些实例中,如本文所述的蛋白可以经口、胃肠外、通过吸入喷雾、吸收、吸附、局部、经直肠、经鼻、经颊、经阴道、脑室内、通过包含常规无毒的药学上可接受的载剂的药物剂型的植入储存容器、或通过任何其他方便的剂型施用。术语“胃肠外”如本文所用包括皮下、静脉内、肌肉内、腹膜内、鞘内、脑室内、胸骨内和颅内注射或输注技术。
[0638]
将蛋白制备成用于施用于受试者的合适形式(例如,药物组合物)的方法在本领域中是已知的,并且包括,例如,如remington's pharmaceutical sciences(第18版,mack publishing co.,easton,pa.,1990)和u.s.pharmacopeia:national formulary(mack publishing company,easton,pa.,1984)中所述的方法。
[0639]
本公开的药物组合物特别可用于胃肠外施用,诸如静脉内施用或施用于体腔或器官腔或关节腔。用于施用的组合物通常包含溶解在药学上可接受的载剂(例如,水性载剂)中的蛋白溶液。可以使用各种各样的水性载剂,例如,缓冲盐水等。所述组合物可以包含药学上可接受的辅料物质,根据需要以接近生理条件诸如ph调节剂和缓冲剂,毒性调节剂等,例如,乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。本公开的蛋白在这些制剂中的浓度可以广泛地发生变化,并且将主要基于流体体积、粘度、体重等根据所选择的特定施用方式和患者的需求来选择。示例性的载剂包括水、盐水、林格氏溶液、右旋糖溶液和5%人血清白蛋白。还可以使用非水性媒介诸如混合油和油酸乙酯。脂质体也可以用作载剂。媒介可以包含微量的增强等渗性和化学稳定性的添加剂,例如,缓冲液和防腐剂。
[0640]
在配制中,本公开的蛋白将以与剂型配伍的方式以治疗/预防有效的量施用。制剂容易以各种剂型施用,诸如上述的可注射溶液的类型,但也考虑其他药学上可接受的剂型,例如,片剂、丸剂、胶囊剂或用于口服施用的其他固体、栓剂、阴道栓剂、滴鼻液或喷雾剂、气雾剂、吸入剂、脂质体形式等。也可以使用药物“缓释”胶囊或组合物。缓释制剂通常被设计为在延长的时期内获得恒定的药物水平,并且可以用来递送本公开的化合物。
[0641]
wo2002/080967描述了组合物和用于施用包含用于治疗例如哮喘的抗体的雾化组合物的方法,所述方法也适合用于施用本公开的蛋白。
[0642]
缀合物
[0643]
在一些实例中,本公开的蛋白与另一化合物缀合。用于缀合蛋白的方法对技术人员来说是显而易见的和/或记载在本文中。本公开考虑所有缀合(即,结合)的形式和方法,
包括,例如,如本文所述蛋白和另一化合物/部分之间的直接缀合或间接结合(例如,借助于蛋白和另一化合物/部分之间的接头)。在一个实例中,通过化学缀合(例如,通过氨键或二硫键)或通过基因融合形成缀合物。
[0644]
在一个实例中,本公开提供了包含本公开的蛋白和另一化合物的融合蛋白。例如,所述另一化合物可以定位在蛋白的n-末端、蛋白的c-末端或其任意组合。
[0645]
在一个实例中,所述蛋白经由接头与另一化合物缀合。例如,所述接头可以是肽接头。
[0646]
在一个实例中,所述接头是柔性接头。“柔性”接头是在溶液中不具有固定结构(二级或三级结构)的氨基酸序列。此类柔性接头因此易于采用各种构象。适合用于本公开中的柔性接头在本领域中是已知的。用于本发明中的柔性接头的实例是接头序列sggggs/ggggs/ggggs或(gly4ser)3。柔性接头也公开在wo1999045132中。
[0647]
所述接头可以包含不实质上妨碍结合区与其靶标的相互作用的任何氨基酸序列。用于柔性接头序列的优选氨基酸残基包括,但不限于,甘氨酸、丙氨酸、丝氨酸、苏氨酸、脯氨酸、赖氨酸、精氨酸、谷氨酰胺和谷氨酸。
[0648]
结合区之间的接头序列优选地包含5个或更多个氨基酸残基。根据本公开的柔性接头序列由5个或更多个残基,优选地5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20或25或30个或更多个残基组成。在本发明的高度优选的实施方案中,柔性接头序列由5、7、10、13或16或30个残基组成。
[0649]
在一个实例中,所述柔性接头具有根据seq id no:31的氨基酸序列,即,gsggsggsggsgs(gs13)。
[0650]
在一个实例中,所述柔性接头具有根据seq id no:35的氨基酸序列,即,sggsggsggsggsggsggsggsggsggsgs(gs30)。
[0651]
可以与本公开的蛋白缀合的示例性化合物和用于此类缀合的方法在本领域中是已知的,并记载在本文中。
[0652]
半衰期延长部分
[0653]
在一个实例中,蛋白与半衰期延长部分缀合。适合用于本公开中的半衰期延长部分对于技术人员来说是明显的,并且包括,但不限于,本文所述的那些。例如,所述半衰期延长部分选自由下列各项组成的组:人血清白蛋白或其功能片段,免疫球蛋白fc区或其功能片段,人维生素e结合糖蛋白(afamin),甲胎蛋白,维生素d结合蛋白,结合白蛋白的抗体片段和聚合物。
[0654]
在一个实例中,半衰期延长部分是人血清白蛋白或其功能片段。
[0655]
在一个实例中,半衰期延长部分是免疫球蛋白fc区或其功能片段。
[0656]
在一个实例中,半衰期延长部分是人维生素e结合糖蛋白。
[0657]
在一个实例中,半衰期延长部分是甲胎蛋白。
[0658]
在一个实例中,半衰期延长部分是维生素d结合蛋白。
[0659]
在一个实例中,半衰期延长部分是结合白蛋白的抗体片段。
[0660]
在一个实例中,半衰期延长部分是聚合物。
[0661]
在一个实例中,半衰期延长部分是聚唾液酸。因此,在一些实例中,本文公开的蛋白被聚唾液酸化。
[0662]
白蛋白及其变体
[0663]
在一个实例中,半衰期延长部分是白蛋白、或其功能片段或变体。
[0664]
血清白蛋白,或血液白蛋白,是丰度最高的血液蛋白,且其作为血液中的类固醇、脂肪酸和甲状腺激素的载体蛋白起作用,以及在稳定细胞外液体积方面具有重要作用。
[0665]
在一个实例中,白蛋白、其功能片段或变体是血清白蛋白,诸如人血清白蛋白。为了仅命名的目的且非限制,成熟人血清白蛋白的示例性序列在ncbi genbank登录id:aee60908和seq id no:32中给出。
[0666]
在一个实例中,白蛋白、其功能片段或变体包含一个或多个氨基酸置换、缺失或插入。适合用于本公开中的氨基酸置换对于技术人员来说是明显的,并且包括天然存在的置换和工程化置换诸如记载在下面的那些:例如,wo2011051489,wo2014072481,wo2011103076,wo2012112188,wo2013075066,wo2015063611和wo2014179657。
[0667]
在一个实例中,本公开提供了与白蛋白家族蛋白缀合的蛋白,例如,结构上或进化上与白蛋白相关的蛋白。例如,所述蛋白与人维生素e结合糖蛋白、甲胎蛋白或维生素d结合蛋白缀合。
[0668]
在另一实例中,所述蛋白与白蛋白家族蛋白融合,例如,作为融合蛋白表达,所述白蛋白家族蛋白例如,在结构上或进化上与白蛋白相关的蛋白。例如,所述蛋白与人维生素e结合糖蛋白、甲胎蛋白或维生素d结合蛋白融合,例如,作为融合蛋白。
[0669]
聚合物
[0670]
在一个实例中,本公开提供了与聚合物缀合的蛋白。用于本公开中的合适聚合物对于技术人员来说是明显的和/或记载在本文中。
[0671]
在一个实例中,所述蛋白与聚乙二醇(peg)缀合。例如,所述聚合物包含单-或多聚-(例如,2-4)聚乙二醇(peg)部分。例如,单-、多聚-(例如,2-4)聚乙二醇(peg)部分延长所述蛋白的体内半衰期。
[0672]
可以通过可用的任一种聚乙二醇化反应来进行聚乙二醇化。用于制备聚乙二醇化蛋白的示例性方法可以通常包括(a)使多肽与聚乙二醇(诸如peg的反应性酯或醛衍生物)在其中所述蛋白附接到一个或多个peg基团的条件下反应;和(b)获得反应产物。
[0673]
技术人员会知晓不同的peg附接法,所述方法包括,但不限于下面所述的那些:例如,ep 0 401 384;malik等人,exp.hematol.,20:1028-1035(1992);francis,focus on growth factors,3(2):4-10(1992);ep 0 154 316;ep 0 401 384;wo 92/16221;wo 95/34326;美国专利号5,252,714。
[0674]
免疫调节剂
[0675]
在一个实例中,另一化合物是免疫调节剂。在一个实例中,所述另一化合物是细胞因子、淋巴因子、趋化因子或其他免疫调节剂。此类试剂可以递送到靶细胞以调节免疫应答。术语“免疫调节剂”,如本文所用,意指调节免疫系统的物质。免疫调节剂可以将免疫应答调整至期望水平,如在免疫增强、免疫抑制或诱导免疫耐受中。用于与本公开的蛋白一起作为缀合物的免疫调节剂包括,但不限于:蛋白,肽,抗体,抗体片段,小分子,细胞因子,激素,酶,核酸,毒素,抗-血管生成药,细胞毒剂,促凋亡剂和其他已知的治疗剂。优选的免疫调节剂包括小分子(例如,r848,罗唑利宾,stat-3抑制剂,tgfβ抑制剂,雷帕霉素/fk506),细胞因子(例如,il-2,tgfβ),抗体片段(例如,ctla-4激动剂scfv),核酸(例如,cpg,
sirna)。
[0676]
在一个实例中,另一化合物是免疫抑制剂。可以使用免疫抑制剂,例如,以帮助防止器官排斥或治疗自身免疫病。合适的免疫抑制剂包括,但不限于,糖皮质激素(例如,强的松,地塞米松和氢化可的松),细胞抑制剂(例如,嘌呤类似物,烷化剂和甲氨喋呤),作用于亲免素的药物(例如,环孢素,他克莫司和西罗莫司),和其他药物诸如干扰素,阿片类药物,和tnf-结合蛋白。
[0677]
联合疗法
[0678]
在一个实例中,本公开的蛋白与可用于治疗本文所述的疾病或病况的另一化合物联合施用,作为综合或附加治疗步骤或作为治疗制剂的附加成分。
[0679]
在一个实例中,本公开的蛋白与目前使用的或正在开发用于抑制补体活性或预防或治疗补体介导病症的至少一种另外的已知化合物或治疗性蛋白联合使用。在治疗补体介导病症中目前使用的化合物在本领域中是已知的,并且包括针对c5及其激活形式(c5a)的抗体,例如,伊库珠单抗,berinert人c1酯酶抑制剂,人c1酯酶抑制剂,ruconest重组c1酯酶抑制剂,cinryze人c1酯酶抑制剂,抗人masp-2单克隆抗体,apl-2c3-抑制肽,兰帕利珠单抗,tnt009抗-c1s抗体。其他的化合物记载在reis等人,clin immunol.dec;161(2):225
–
240,2015中。
[0680]
在一些实例中,另一化合物是抗炎化合物。备选地,或另外地,所述另一化合物是免疫抑制剂。备选地,或另外地,所述另一化合物是皮质类固醇,诸如强的松和/或泼尼松龙。备选地,或另外地,所述另一化合物是甲氨喋呤。备选地,或另外地,所述另一化合物是麦考酚酸吗乙酯。备选地,或另外地,所述另一化合物是抗-cd20抗体(例如,利妥昔单抗或奥法木单抗)。备选地,或另外地,所述另一化合物是抗-cd22抗体(例如,依帕珠单抗(epratuzumab))。备选地,或另外地,所述另一化合物是抗-tnf抗体(例如,英夫利昔单抗或阿达木单抗或戈利木单抗)或可溶性tnf受体(例如,依那西普)。备选地,或另外地,所述另一化合物是ctla-4拮抗剂(例如,阿巴西普,ctla4-ig)。备选地,或另外地,所述另一化合物是抗-il-6抗体。备选地,或另外地,所述另一化合物是blys拮抗剂,诸如抗-blys抗体(例如,贝利木单抗)。备选地或另外地,所述另一化合物是组织纤溶酶原激活物(t-pa)。
[0681]
在一些实例中,所述另一化合物抑制或减少下列中的一种或多种的表达或活性:
[0682]
(i)肾损伤分子1(kim-1);
[0683]
(ii)中性粒细胞明胶酶相关载脂蛋白(ngal);
[0684]
(iii)白介素1β(il-1β);
[0685]
(iv)白介素6(il-6);
[0686]
(v)肿瘤坏死因子α(tnfα);
[0687]
(vi)补体成分5a受体1(c5ar1);
[0688]
(vii)巨噬细胞炎性蛋白2-α(mip2-α);
[0689]
(viii)细胞间粘附分子1(icam-1);
[0690]
(ix)e-选择素;
[0691]
(x)c-x-c基序趋化因子配体1(cxcl1);
[0692]
(xi)白介素8受体β(il-8rβ);和
[0693]
(xii)单核细胞趋化蛋白1(mcp-1)。
[0694]
在一些实例中,所述另一化合物是硫化氢。在一些实例中,所述另一化合物是环孢素。在一些实例中,所述另一化合物是tro40303,如le lamer等人,j transl med(2014)中所述。在一些实例中,所述另一化合物是超氧化物歧化酶。在一些实例中,所述另一化合物是大麻素或其合成类似物。
[0695]
在一些实例中,所述另一化合物是通常在移植手术中使用的一种。
[0696]
本领域技术人员清楚的是适合用于与本公开的蛋白一起使用的联合疗法的其他化合物的实例也是与本公开的蛋白缀合的化合物的合适实例,且反之亦然。
[0697]
如从前面的描述显而易见的,本公开提供了受试者的伴随治疗性治疗的方法,包括向有需要的受试者施用有效量的第一作用剂和第二作用剂,其中所述第一作用剂是本公开的蛋白,所述第二作用剂是另一化合物。
[0698]
如本文所用,如在短语“伴随治疗性治疗”中的术语“伴随”包括在第二作用剂的存在下施用第一作用剂。伴随治疗性治疗方法包括其中第一作用剂、第二作用剂、第三作用剂或其他的作用剂共同施用的方法。伴随治疗性治疗方法还包括其中在第二或其他的作用剂的存在下施用第一作用剂或其他的作用剂的方法,其中所述第二作用剂或其他的作用剂,例如,可以事先施用。伴随治疗性治疗可以由不同的行动者逐步执行。例如,一个行动者可以向受试者施用第一作用剂,第二行动者可以向所述受试者施用第二作用剂,并且所述施用步骤可以同时执行,或几乎同时执行,或相隔很长时间,只要所述第一作用剂(和/或其他的作用剂)在所述第二作用剂(和/或其他的作用剂)的施用之后即可。所述行动者和所述受试者可以是相同的实体(例如,人)。
[0699]
在一个实例中,本公开的蛋白与所述另一化合物同时施用。在一个实例中,所述蛋白在所述另一化合物之前施用。在一个实例中,所述蛋白在所述另一化合物之后施用。
[0700]
在一个实例中,本公开的蛋白包含另一个或多个结合与c2不同的抗原的抗原结合位点。因此,在一些实例中,本公开的蛋白可以包含两个或更多个不同的抗原结合位点。
[0701]
在一些实例中,所述蛋白是双特异性蛋白,诸如双特异性抗体。在一些实例中,所述另一个或多个抗原结合位点以在ph 7.3比在ph 6.0更高的亲和力结合其抗原。
[0702]
在一些实例中,所述另一个或多个抗原结合位点包括上面列举的适合用于与本公开的蛋白联合施用的抗体的任一个或多个抗原结合位点。例如,所述另一个或多个抗原结合位点可以结合补体系统的另一成分,诸如c1复合物的亚基(例如,c1s),c3,c3a,c3b,c4,c4a,c4b,c5,c5a,c5b,c6,c7,c8或c9。备选地,或另外地,所述另一个或多个抗原结合位点可以结合masp-2,cd20,cd22,tnf,ctla-4,il-6,il-6r或blys。在一些实例中,所述另一个或多个抗原结合位点包括结合c5的抗原结合位点。在一些实例中,所述另一个或多个抗原结合位点包括结合il-6r的抗原结合位点。
[0703]
剂量和施用时机
[0704]
本公开的蛋白的合适剂量将取决于具体的蛋白、待治疗的病况和/或待治疗的受试者。有经验的医生有能力确定合适的剂量,例如,通过从亚最适剂量开始并递增地改变剂量以确定最适或有益剂量。备选地,为了确定用于治疗/预防的适宜剂量,使用来自细胞培养测定或动物研究的数据,其中合适的剂量在循环浓度的范围内,所述循环浓度的范围包括活性化合物的ed
50
,有很小毒性或没有毒性。所述剂量可以在此范围内变化,取决于采用的剂型和利用的施用途径。治疗/预防有效剂量可以初步地从细胞培养测定估计。剂量可以
在动物模型中制定以实现包括如在细胞培养中确定的ic
50
(即,达到症状的半最大抑制的化合物浓度)的循环血浆浓度范围。此类信息可以用来更准确地确定人体中的有用剂量。可以测量血浆中的水平,例如,通过高效液相色谱测量。
[0705]
在一些实例中,本公开的方法包括施用预防或治疗有效量的本文所述的蛋白。
[0706]
术语“治疗有效量”是当施用于需要治疗的受试者时改善受试者的预后和/或状态和/或减少或抑制本文所述的临床病况的一个或多个症状到低于该病况的临床诊断或临床特征所观察到和公认的水平的量。待施用于受试者的量将取决于待治疗的病况的特定特征,待治疗的病况的类型和分期,施用方式和受试者的特征,诸如一般健康,其他疾病,年龄,性别,基因型和体重。本领域技术人员将能够根据这些和其他因素决定适宜的剂量。因此,该术语不应解释为将本公开限于特定的数量,例如,蛋白的重量或量,而是本公开涵盖足以在受试者中实现所述结果的任意量的所述蛋白。
[0707]
如本文所用,术语“预防有效量”应当认为意指足以防止或抑制或延缓临床病况的一个或多个可检测到的症状的发作的数量。专业技术人员将知晓这样的量将根据例如施用的具体蛋白和/或特定的受试者和/或病况的类型或严重性或水平和/或对所述病况的易患倾向(遗传因素或其他因素)而发生变化。因此,该术语不应解释为将本公开限于特定的数量的蛋白,例如,特定重量或量的蛋白,而是本公开涵盖足以在受试者中实现所述结果的任意量的蛋白。
[0708]
对于本文所述的蛋白的体内施用,正常剂量的量可以从每天个体体重的约10ng/kg变化至约300mg/kg或更高。对于几天或更长时间内的反复施用,取决于待治疗的疾病或病症的严重性,治疗可以持续直至达到对症状的期望抑制。
[0709]
剂量可以从约0.1mg/kg变化至约300mg/kg,例如,从约0.2mg/kg至约200mg/kg,诸如,从约0.5mg/kg至约20mg/kg,每天一剂或多剂施用,持续一天或几天。
[0710]
在一些实例中,在开始治疗的时候,受试者施用所述蛋白不超过连续7天或连续6天或连续5天或连续4天。
[0711]
在一些实例中,所述蛋白以高于后续剂量(维持剂量)的初始(或负荷)剂量施用。例如,所述蛋白以约10mg/kg至约30mg/kg的初始剂量施用。然后所述蛋白以约0.0001mg/kg至约30mg/kg的维持剂量施用。维持剂量可以每2-30天,诸如,每2天或3天或6天或9天或12天或15天或18天或21天或24天或27天或30天施用一次。
[0712]
在一些实例中,使用剂量递增方案,其中所述蛋白以低于在后续剂量中使用的剂量初始地施用。此用药方案可用于受试者初始患有不良事件的情况。
[0713]
在受试者对治疗响应不充分的情况下,可以给予一周内的多次剂量。备选地或另外地,可以给予递增的剂量。
[0714]
受试者可以用所述蛋白反复治疗,通过给予剂量的一次暴露或一组剂量,诸如至少约两次暴露,例如,约2至60次暴露,和更特别地,约2至40次暴露,最特别地,约2至20次暴露。
[0715]
在一个实例中,当疾病的征象或症状再次出现时可以给予任意的再次治疗。
[0716]
在另一实例中,可以以规定的间隔给予任意再次治疗。例如,后续的暴露可以以各种时间间隔施用,诸如,例如,约24-28周或48-56周或更长。例如,此类暴露以约24-26周或约38-42周或约50-54周中的每一个的时间间隔施用。
[0717]
在另一实例中,对于经历了不良反应的受试者,初始(或负荷)剂量可以分成一周内的多天或连续多天。
[0718]
根据本公开的方法的对蛋白的施用可以是连续的或间歇的,例如,取决于受者的生理状况,所述施用的目的是治疗性的还是预防性的,以及专业从业人员已知的其他因素。蛋白的施用可以在预先选择的时间段内是基本上连续的或可以是一系列间隔的剂量,例如,在病况发生期间或发生后。
[0719]
试剂盒和其他物质组合物
[0720]
本公开的另一实例提供了可用于抑制补体活性或用于治疗或预防如上所述的补体介导病症的包含本公开的蛋白的试剂盒。
[0721]
在一个实例中,所述试剂盒包括:(a)包含任选地在药学上可接受的载剂或稀释剂中的所述蛋白的容器;和(b)带有用于抑制受试者中的补体活性或用于治疗或预防受试者中的补体介导病症的说明书的包装插入物。
[0722]
在一个实例中,所述试剂盒包括:(a)任选地在药学上可接受的载剂或稀释剂中的本公开的至少一种蛋白;(b)使用所述试剂盒用于抑制受试者中的补体活性或用于治疗或预防受试者中的补体介导病症的说明书;和(c)任选地,至少一种另外的治疗活性化合物或药物。
[0723]
根据本公开的此实例,包装插入物在所述容器上或与所述容器相关联。合适的容器包括,例如,瓶子、小瓶、注射器等。所述容器可以由各种材料诸如玻璃或塑料形成。所述容器保持或容纳有效用于抑制补体活性或用于治疗或预防补体介导病症的组合物,并且可以具有无菌进入端口(例如,所述容器可以是静脉输液袋或带有可被皮下注射针刺破的塞子的小瓶)。所述组合物中的至少一种活性剂是所述蛋白。标签或包装插入物指示所述组合物用于治疗适合进行治疗的受试者,例如,患有补体介导病症或易于发生补体介导病症的受试者,所述标签或包装插入物带有关于提供的所述蛋白和任何其他药物的用药量和时间间隔的专门指导。所述试剂盒可以进一步包括附加的容器,所述附加的容器包含药学上可接受的稀释缓冲液,诸如注射用抑菌水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和/或右旋糖溶液。所述试剂盒可以进一步包括从商业和用户角度期望的其他材料,包括其他缓冲液、稀释剂、滤器、针和注射器。
[0724]
所述试剂盒任选地进一步包括包含第二药物的容器,其中本公开的蛋白是第一药物,并且所述试剂盒进一步包括包装插入物上的用于利用有效量的所述第二药物治疗受试者的说明书。所述第二药物可以是目前正在使用的或处于开发中的用于抑制补体活性或预防或治疗补体介导病症的另一化合物或治疗性蛋白,如本文上文所述。
[0725]
本公开包括下面的非限制性实施例:
[0726]
非限制性实施例
[0727]
材料和方法
[0728]
cdna c2表达质粒的生成
[0729]
人补体成分c2 cdna(genbank登录号np_000054)和人igg4fc(aa99-327;genbank登录号p01861)进行密码子优化用于人表达,并由(invitrogen
tm
,thermo fisher scientific)合成。使用标准的基于pcr的技术生成具有框内融合的c-末端8x组氨酸-标签的全长人c2,它是huigg4fc与c2的c-末端的融合体。利用在起始甲硫氨酸( 1)上游
紧接的kozak共有序列(gccacc)生成每个cdna。一旦每个cdna完成,则将其用nhei和xhoi消化并连接到pcdna3.1(invitrogen
tm
,thermo fisher scientific)。使用如上所述的标准pcr和克隆技术基于c2a的晶体结构(pdb 2i6q;milder等人,structure 141587-97(2006))对人c2序列内所选择的表面氨基酸进行诱变。
[0730]
使用qiagen plasmid giga试剂盒根据生产厂商的说明书进行质粒dna的大规模制备。所有质粒构建体的核苷酸序列通过使用bigdye
tm
terminator version 3.1容易反应循环测序(invitrogen
tm
,thermo fisher scientific)和applied biosystems 3130xl基因分析仪对两条链进行测序来验证。
[0731]
细胞培养和瞬时转染
[0732]
expi293f
tm
细胞和哺乳动物表达载体pcdna3.1获自invitrogen
tm
,thermo fisher scientific。细胞培养在expi293
tm
表达培养基(invitrogen
tm
,thermo fisher scientific.)中。所有组织培养基补充了抗生素-抗真菌剂(thermo fisher scientific),并将细胞在37℃在具有8%co2气氛的培养箱中维持。使用expi293
tm
表达系统根据生产厂商的推荐(invitrogen
tm
,thermo fisher scientific)使用expi293f
tm
细胞对表达质粒进行瞬时转染。
[0733]
c2的纯化
[0734]
组氨酸-标记的人c2蛋白通过固定化金属-亲和层析使用akta xpress系统和两步自动化法进行纯化。将30ml expi293f细胞培养上清液直接上样到用20mm nah2po4,500mm nacl,10mm咪唑(ph 7.4)预平衡的1ml hitrap excel镍-琼脂糖柱(ge healthcare)。然后用20mm nah2po4,500mm nacl,25mm咪唑(ph 7.4)洗涤柱以去除非特异性结合的蛋白,然后使用20mm nah2po4,500mm nacl,500mm咪唑(ph7.4)洗脱c2。对于缓冲液交换,将全部洗脱液自动上样至在mt-pbs(137mm nacl,27mm kcl,8.1mm na2hpo4,1.15mm kh2po4,ph 7.4)中平衡的26/10hiprep脱盐柱(ge healthcare)上。在mt-pbs中洗脱后,将含有纯化的蛋白的级分汇集并使用amicon超离心滤器(50kda mwco)浓缩至5mg/l以上。然后将浓缩的蛋白无菌过滤并在-80℃保存。
[0735]
淘选噬菌粒文库中的人c2结合剂
[0736]
使用与人igg1的fc区融合的人c2(称为“fc-huc2”)从噬菌粒文库针对人c2选择噬菌体。使用通过生物素抗-人fc俘获固定化在dynabeads m-280链霉抗生物素蛋白上的10μg fc-huc2完成3轮淘选。在每轮淘选之前,通过与dynabeads m-280链霉抗生物素蛋白和利用无关人igg1抗体通过生物素抗-人fc抗体俘获包被的珠子孵育,耗竭噬菌粒文库中的链霉抗生物素蛋白或fc的非特异性结合物。对于耗竭,每轮使用相同浓度(10μg)的无关抗体作为靶蛋白。
[0737]
人c2结合物克隆的分离
[0738]
从来自淘选工作的三轮输出中挑选95个菌落用于通过fab-噬菌体elisa筛选。通过elisa利用fc或his标签(自制蛋白)测试这些克隆的挽救噬菌粒上清液与可溶性人c2或激活的c2(c2a)蛋白的结合。为了确定这些人c2噬菌粒结合物的多样性,来自这些克隆的fab盒进行pcr扩增,然后测序。
[0739]
抗体序列生殖系分析
[0740]
抗体序列的生殖系分析首先通过使用igblast(https://www.ncbi.nlm.nih.gov/
igblast/)将抗体序列与人生殖系序列进行比对以基于kabat v结构域划分系统标识框架区。然后将与对应的生殖系框架序列不同的氨基酸残基回复突变成生殖系序列。最终由thermo fisher scientific(massachusetts,usa)合成编码突变的v序列的dna片段并克隆到哺乳动物表达载体中用于表达和分析。
[0741]
抗体的纯化
[0742]
c2结合蛋白使用akta xpress系统和两步自动化法通过蛋白a亲和纯化。将500ml expi293f细胞培养上清液直接上样到用mt-pbs(137mm nacl,27mm kcl,8.1mm na2hpo4,1.15mm kh2po4,ph7.4)预平衡的5ml hitrap mabselect sure柱(ge healthcare)。然后用500mm l-arg;10mm tris;150mm nacl(ph 7.5)洗涤柱以去除内毒素和非特异性结合的蛋白,然后使用0.1m乙酸钠(ph 3.0)洗脱mab。为了从单体mab中分离聚集的物质,将全部洗脱液自动地上样至在mt-pbs(137mm nacl,27mm kcl,8.1mm na2hpo4,1.15mm kh2po4,ph 7.4)中平衡的hiload 26/60superdex 200(制备级)尺寸排阻柱(ge healthcare)上。汇集不含聚集物的级分并使用amicon超离心滤器(50kda mwco)浓缩至10mg/ml以上。然后将浓缩的蛋白无菌过滤并在4℃保存。
[0743]
在ph 5.5相对7.4抗体与c2的结合的elisa
[0744]
在滴定elisa中在不同的ph(ph 5.5和7.4)初步测试独特的抗-人c2抗体。这些滴定实验一式两份地完成。人c2蛋白以在小鼠-渗透压磷酸盐缓冲盐水(mtpbs;ph 7.4或ph 5.5)中的2μg/ml包被在maxisorp elisa平板(100μl/孔)上在4℃过夜。在移除包被溶液后,将平板用200μl/孔的5%脱脂奶/tbs/t(tpbs,0.05%tween-20;非ph特异性)在37℃封闭2小时。抗体在2%脱脂奶/mtpbs/t(ph 7.4或ph 5.5)中从100ug/ml的起始浓度连续稀释5倍下降至1.28ng/ml。将100ul/孔的稀释抗体加入至适宜的elisa平板中。作为人c2蛋白的非特异性结合物的对照,elisa平板与无关人igg抗体(与淘选噬菌粒文库时用于耗竭的抗体相同)孵育。在室温孵育90分钟后,用tbs/t(非ph特异性)洗涤平板5次(x 5)。然后利用100μl/孔的在2%脱脂奶/mtpbs/t(ph 7.4或ph 5.5)中1:2,500稀释的抗-fab-hrp抗体在室温1小时检测抗体结合。在用tbs/t(非ph特异性)洗涤平板5次后,使用100μl/孔的tmb/e底物(es001-500ml;chemicon)使它们显色10分钟,在加入2m磷酸(50μl/孔)后终止反应。elisa平板在吸光度450nm读数。
[0745]
fc融合体的纯化
[0746]
对于fc融合的c2蛋白的纯化,将培养上清液直接上样至用mt-pbs(137mm nacl,27mm kcl,8.1mm na2hpo4,1.15mm kh2po4,ph7.4)预平衡的mabselect sure亲和树脂(ge healthcare)上。在上样全部上清液后,用mt-pbs,ph7.4洗涤树脂。用0.1m柠檬酸钠,ph 5.0封闭洗脱弱结合的非靶蛋白。用0.1m柠檬酸钠,ph 3.0封闭洗脱树脂上结合的huc2,基于在280nm的吸光度收集洗脱的蛋白。将在洗脱期间收集的蛋白上样至在mt-pbs中预平衡的hiload 26/60superdex200制备级柱(ge healthcare)以去除任何污染蛋白并缓冲液交换至期望的缓冲液中。使用具有50kda mwco的amicon超离心滤器将纯化的蛋白浓缩至期望浓度,无菌过滤并在-80℃保存。
[0747]
表面等离子共振——通用测定设计
[0748]
表面等离子共振(spr,biacore)用于全部结合亲和力分析。简言之,使用标准nhs/edc化学在ph 5将山羊抗-人igg直接固定化在cm5传感器芯片的羧甲基葡聚糖表面上至大
约12,000ru。固定化的抗体表面用以1μg/ml制备的多克隆人igg(privigen 60s)的10次注射进行预处理。如下所述在每次循环的开始时俘获配体(抗-c2 mabs)。使用其中仅多克隆igg被俘获的邻近样点或流动池作为参照表面。山羊抗-人igg fc抗体表面在100mm h3po4中再生,在每次循环结束时注射45秒。实验在37℃进行并将每次实验的流速保持恒定于30μl/min。
[0749]
传感图数据针对参照抗-igg表面(即减去抗-c2 mab)和每次实验内获得的空白缓冲液注射进行双参照。在适合时使用局部rmax和零折射指数(ri=0)将结合数据拟合为1:1(动力学或稳态)模型。在使用前过滤缓冲液和溶液(0.22μm)。
[0750]
竞争性结合实验
[0751]
设计聚类(binning)实验来测试抗体对(配体mab1相对分析物mab2)与人c2(配体抗原)的竞争性结合。以定性的方式将每个抗体作为配体或分析物进行测试。首先,在抗-igg表面处俘获抗体配体(mab1,2μg/ml)至大约350ru,接着用多克隆人igg(1μg/ml)封闭60秒。抗-c2表面用人c2配体(100nm,8.2μg/ml)饱和。最后注射抗体分析物(mab2)120秒(1μg/ml)。非竞争性结合物对被鉴定为在分析物注射结束时具有阳性结合反应的那些。中性或阴性结合反应指示竞争对,或具有快速解离速率(fast off-rate)的配体抗体(mab1),因此不能够足够长时间地俘获人c2以使分析物抗体(mab2)结合。这些抗体可以仅作为分析物(mab2)进行测试。在37℃在hbs-ep(10mm hepes,150mm nacl,3mm edta,0.05%tween 20,0.1%bsa)中在ph 7.3进行聚类实验。
[0752]
在中性和酸性ph时人和食蟹猴c2的结合动力学实验
[0753]
在每次实验开始前在含有10mm hepes,150mm nacl,3mm edta,0.05%tween,0.1%bsa,ph7.3的运行缓冲液(称作hbs-ep)中制备纯化的重组c2(wt或丙氨酸突变体),并针对俘获的抗-c2 mab(1μg/ml,250ru)测试60秒。人c2浓度范围为7.8-500nm。将每个分析物浓度以随机的次序注射并一式两份进行。分别监测分析物缔合和解离200和600秒。包括缓冲液空白循环用于参照扣除。将双参照的传感图拟合为1:1动力学模型,包括质量运输限制的项(term for mass transport limitation),或拟合为1:1稳态模型,其中将在缔合阶段结束时的反应针对各个浓度做图。在37℃并在ph 7.3和ph 6.0使用hbs-ep进行动力学实验。利用100mm h3po4的45秒注射再生抗-人igg fc抗体表面。
[0754]
作为比较,在含有硫酸铵而非氯化钠的缓冲液中进行同样的结合动力学实验。在这些实验中,运行缓冲液由10mm hepes,10mm mes,150mm(nh4)2so4,3mm edta,0.05%tween,0.1%bsa组成(称为“mha”)。
[0755]
在钙的存在下的c2-结合动力学
[0756]
通过向spr运行缓冲液中添加氯化钙来确定钙对抗体结合的作用。钙浓度范围为0(即,不加入钙,对照)至接近生理水平(0.02,0.2和2mm cacl2·
2h2o,mw 147.02da)。利用3mm edta制备对照缓冲液。在此实验中,所有4个缓冲液线(buffer line)用于特定的缓冲液组合物,线1(对照,0mm cacl2),线2(0.02mm cacl2),线3(0.2mm cacl2)和线4(2mm cacl2)。
[0757]
纯化的人c2酶原在生理条件(ph 7.3)下以1.9-500nm的浓度范围和在酸性条件(ph 6)下以3.9-2000nm的浓度范围测试。分析物样品从在运行缓冲液中制备的2mm储备液以2倍连续稀释制备。每个分析物浓度一式两份地测试。使用privigen(多克隆人igg;2μg/
ml)用于表面处理。分析物缔合和解离分别监测180和600秒。每个抗体一式三份地测试。流速设定为30μl/min。在37℃进行实验。在使用前过滤缓冲液(0.22μm)。在各种钙浓度下激活的人c2(huc2a)在中性或酸性ph时都不结合rf16-226。
[0758]
传感图使用参照表面和每次实验内获得的空白缓冲液注射数据进行双参照。使用具有局部r
max
和零折射指数(ri=0)的1:1动力学模型在中性ph计算速率常数和结合亲和力。然而,由于huc2的快速解离速率(kd)常数,在酸性(ph 6)时的结合不得不拟合为1:1稳态模型。
[0759]
补体抑制测定——wieslab测定
[0760]
为了评估补体抑制活性,在补体测定(euro diagnostica)中依照生产厂商的说明书测试抗-c2抗体。简言之,抗体在96孔板中在pbs中连续稀释。将50μl每个稀释的抗体样品或单独pbs加入至在用于每个补体通路的适宜测定稀释液中预先稀释的202.5μl人或食蟹猴血清(1:101对于经典/凝集素)(依照生产厂商的说明书)并在室温(rt)孵育30min。加入至预先稀释的血清中后,每种抗体的最终起始浓度为250或1000nm。将100μl的每个样品一式两份地转移到测定平板,并在37℃(没有co2)孵育1小时。将孔清空并用300μl/孔的1x洗涤缓冲液洗涤三次(依照生产厂商的说明书)。使用100μl/孔碱性磷酸酶缀合的抗-c5b-9特异性单克隆抗体检测c5b-9的末端复合物,在rt孵育30min。弃去未结合的抗体,用300μl/孔的1x洗涤缓冲液洗涤孔三次。使用100μl/孔碱性磷酸酶底物溶液检测结合的抗体,并在rt孵育30min。使用envision读板仪读取405nm处的吸光度。
[0761]
原始值表示为血清的c5b-9形成百分比和仅pbs对照(即100%c5b-9形成)。结果在graph pad prism中使用log(抑制剂)vs.反应
–
可变斜率(四参数)拟合来分析ic50值。底部和顶部分别约束为值0和100。
[0762]
补体抑制测定——溶血测定
[0763]
为了进一步评估抗-c2抗体对补体系统的经典通路的抑制(即,ch50),绵羊红细胞(siemens)用兔抗-绵羊抗体(ambozeptor 6000;siemens)敏化并稀释到4x108个细胞/ml gvb (明胶弗洛拿缓冲液-gvb,0.15mm cacl2,0.5mm mgcl2)。抗体在1/40稀释的正常人血清(nhs)或食蟹猴血清中预孵育(在rt 30min),随后以1/1(v/v)的比率加入至红细胞,并在37℃在微量滴定板震荡装置中孵育1小时。在加入冰冷的gvbe(gvb,10mm edta)并离心(在4℃,1250x g 5min)后,通过测量释放的血红蛋白在412nm处的吸光度测定上清液中的溶血作用。细胞与血清孵育,仅缓冲液充当100%裂解对照。相对于对照计算抗-c2抗体对裂解的抑制。
[0764]
对c2的蛋白水解加工的抑制
[0765]
浓度分别为0.5μm和0.2μm的c2和rf16-226混合在一起,并在室温孵育30min以允许复合物形成。将0μm-1μm范围的各种浓度的活性c1s加入至单独c2,以及c2-rf16-226复合物。将该混合物在37℃孵育1小时。在补充了0.15mm cacl2和0.5mm mgcl2(ph 7.4)的1x mt-pbs中进行反应。然后使用nupage 4-12%bis-tris凝胶,nupage mes sds运行缓冲液(invitrogen carlsbad,ca)通过sds-page分析蛋白,通过考马斯染色显色。条带基于它们的强度和尺寸进行定量,对平均强度做图并使用graphpad prism进行曲线拟合。
[0766]
fc突变体和fcrn亲和力测量
[0767]
使用表面等离子共振(spr)仪器来测量在中性(ph 7.3)和酸性(ph6.0)条件下人
和食蟹猴(cyno)fcrn/β2m对携带用于改善fcrn结合的fc突变的抗-人c2抗体的结合亲和力。使用标准edc/nhs化学将抗-c2 mab(1μg/ml,ph 5)固定化在羧甲基葡聚糖(cm5)传感器芯片表面上。人和cyno fcrn/β2m(40μm)在运行缓冲液(10mm hepes,150mm nacl,10mm mes,调整至ph 6或ph 7.3)中制备,并注射到在运行缓冲液中以2倍稀释制备的浓度范围为0.078-40μm的固定化的抗-c2表面上。缔合和解离阶段分别监测180和600秒。在每次循环结束时,利用两次60秒的25mm tris,150mm nacl,ph 8.0注射实现表面再生。将双参照的传感图拟合为1:1动力学模型(ph 6),包括质量运输限制的项,或拟合为1:1稳态模型(ph 7.3),其中将在缔合阶段结束时的反应针对各个浓度做图。
[0768]
c2和抗-c2抗体运输测定
[0769]
稳定表达fcrn和β2-微球蛋白的freestyle 293细胞(chia等人,2018,j biol chem 293,6363
–
6373)以0.3x10^5个细胞/孔接种在nunc lab-tek ii cc2腔室载玻片(thermo fisher,nun154534)并在37℃培养箱中在2天内允许生长至80-90%汇合。在实验当天,将单层与蛋白酶抑制剂(sigma aldrich,p1860)或载体对照(0.01%dmso)在完全生长培养基(补充了glutamax和10%胎牛血清的rpmi)中在37℃预孵育4.5小时。然后用pbs洗涤细胞单层两次,并与在pbs,ph 7或ph 5.5中稀释的1μm alexa fluor 488-标记的c2(c2-af488)和0.125μm抗-c2抗体孵育。在37℃脉冲刺激10min后,用pbs洗涤细胞3次,并加入新鲜的完全生长培养基。将细胞恢复到37℃并使内化的货物继续运输60min(追踪)。在实验过程期间细胞维持在蛋白酶抑制剂或载体对照中。在指定的时间点,将细胞在4%多聚甲醛(pfa)/pbs(novachem)中在室温固定10min,接着在室温在pbs中的50mm nh4cl中淬灭10min,并在封闭溶液(pbs中的5%fcs和0.02%叠氮化钠)中封闭至少30min以减少非特异性结合。单层与alexa fluor 568-缀合的抗-人igg(thermo fisher,a-21090:1/500稀释度)孵育以在室温检测抗-c2抗体30分钟,在pbs中洗涤3次并用hoechst 33342(molecular probes,h3570:1/5000稀释度)在室温染色10分钟。盖玻片在milli-q水中洗涤,然后在mowoil[milli-q水中的10%(w/v)hopval 5-88,25%(w/v)甘油和0.1m tris](merck millipore)中封固。使用leica sp8系统进行共聚焦显微镜观察。使用63
×
/1.4na hcx pl apo cs油浸物镜连续采集图像用于多色成像。用氩激光器的488-nm线激发alexa fluor 488,用543-nm hene激光器激发alexa fluor 568,以及用405-nm uv激光器激发hoechst 33342。以至少512
×
512的像素尺寸采集图像,使用相同的激光强度、曝光和增益设置从而允许直接比较。对于多色标记,单独采集图像。
[0770]
使用在开源软件fiji(schindelin等人,2012,nat methods 9,676
–
82)(version 1.49r)中开发的定制宏指令(custom macro)对荧光强度进行定量。简言之,利用bio-formats插件将每个文件输入至工作空间作为含有多个通道的图像堆栈。手工输入每个通道的阈值,并对所有图像保持固定。对每个图像计算平均荧光强度,并除以每个图像的总细胞核数。所有数据在prism graphpad中做图并表示为5张图像的均值 /-s.e.m(其中每张图像包含8-12个细胞)。
[0771]
实施例1
–
c2抗体的ph-依赖性结合
[0772]
为了鉴定潜在的c2“清扫”抗体,使用如上所述的elisa滴定测定测试来自噬菌体展示文库的46个抗-c2单克隆抗体的与c2的ph-依赖性结合。初步测试候选抗体在ph 7.4和ph 5.5与人c2的结合。46个抗-c2抗体中的5个显示与c2的ph-依赖性结合。
[0773]
图1显示了抗体rf16-191、rf16-203、rf16-214、rf16-226和rf16-242与c2的结合水平在ph 5.5时相对于在ph 7.4时极大地减小。而抗体rf16-207和rf216-240的结合不受ph差异的影响。
[0774]
为了最小化潜在的免疫原性,ph-依赖性抗-c2抗体的可变区框架被改变为匹配最接近的人生殖系框架。得到的抗体命名为rf16-191g,rf16-203g、rf16-214g、rf16-226g和rf16-242g。表2显示了ph-依赖性抗-c2抗体及其生殖系对应物的相应vh和v
l seq id no。
[0775]
表2
–
ph-依赖性c2结合蛋白的氨基酸序列
[0776]
蛋白vh序列seq id nov
l
序列seq id norf16-1914650rf16-191g4852rf16-2034751rf16-203g4953rf16-214310rf16-214g37rf16-22629rf16-226g26rf16-242511rf16-242g48
[0777]
使用上面所述的spr方法在hbs-ep缓冲液中测试ph依赖性抗-c2抗体及其生殖系形式在ph 7.3(中性ph)和ph 6.0(初级内体ph)时与c2的亲和力。表3显示了这些抗体中的大多数表现出与人c2的ph-依赖性结合。
[0778]
表3
–
在hbs-ep缓冲液中ph-依赖性抗-c2抗体与人c2的亲和力
[0779][0780]
[0781]
*表示稳态解离常数
[0782]“nt”表示没有检测该抗体
[0783]
为了确认与c2的ph-依赖性结合不是缓冲液特异性的,在含有10mm hepes,10mm mes,150mm(nh4)2so4,3mm edta,0.05%tween,0.1%bsa的缓冲液(称为mha)中测试了同一抗体在ph 7.3和6.0时与c2的亲和力。此缓冲液含有硫酸铵而不是氯化钠。表4显示了在mha缓冲液以及在表3中用来确定亲和力的hbs-ep缓冲液中与c2的ph-依赖性结合。表4还显示:在mha缓冲液中,当ph减小到5.8时测试的抗体对c2的亲和力进一步减小。
[0784]
表4
–
在mha缓冲液中ph-依赖性抗-c2抗体对人c2的亲和力
[0785][0786][0787]
*表示稳态解离常数
[0788]“nt”表示没有检测该抗体
[0789]
实施例2
–
物种选择性
[0790]
除了人c2以外,还使用上述的spr方法测试ph依赖性抗-c2抗体结合来自其他哺乳动物物种的c2的能力以鉴定体内测试的合适替代物种。测试抗体在中性ph时与来自食蟹猴、小鼠、犬、兔、大鼠、猪和绵羊的c2的结合。
[0791]
除了测试的蛋白的人c2结合以外,所述抗体仅可检测地结合来自食蟹猴(“cyno c2”)和小鼠的c2。所述抗体以与人c2相似的亲和力结合cyno c2,而与小鼠c2的结合非常弱。所述抗体还证明与cyno c2的ph-依赖性结合,如它们与人c2的结合那样,显示在表5中。
[0792]
表5
–
ph依赖性抗-c2抗体与食蟹猴c2和小鼠c2的亲和力
[0793][0794]“nt”表示没有检测该抗体
[0795]“vwb”表示非常弱的结合,即,不能测定kd[0796]
实施例3
–
补体抑制
[0797]
为了评估补体抑制活性,在如上所述的补体测定中测试ph-依赖性抗-c2抗体。
[0798]
如表6所示,测试的抗体除了rf16-203g以外均以低纳摩尔范围内的ic
50
抑制经典和凝集素人补体通路。
[0799]
表6
–
对人补体活性的抑制;测定
[0800][0801]
如表7所示,当使用食蟹猴血清时,所述抗体还抑制经典和凝集素补体通路中的补体活性,相对于人血清功效(表6)仅轻微减小。
[0802]
表7
–
对食蟹猴补体活性的抑制;测定
[0803][0804][0805]
为了确认通过上述测定确定的抑制活性,如上所述,还测试所述抗体抑制人和食蟹猴补体系统引起的红细胞裂解的能力。
[0806]
表8中显示的结果证实所述抗-c2抗体是体内人和食蟹猴补体系统的有效抑制剂。
[0807]
表8
–
人和食蟹猴补体活性的抑制;溶血测定
[0808][0809]“ni”表示没有检测到抑制。
[0810]“*”表示ic
50
是三次单独实验的平均值。其余的值来自单次实验。
[0811]
实施例4
–
表位做图
[0812]
关于与人c2结合评估抗-c2抗体彼此竞争的能力。
[0813]
图2中显示的定性竞争结合(“聚类”)实验证明了ph-依赖性抗-c2抗体rf16-191、rf16-203、rf16-214、rf16-226和rf16-242以竞争的方式结合c2,但不与“中和”抗-c2抗体rf16-207和rf16-240竞争,rf16-207和rf16-240与c2的结合不具有ph-依赖性(参见图1)。此结果证明了相对于非ph依赖性结合剂,ph-依赖性抗-c2抗体结合c2上的独特表位。
[0814]
为了确定ph-依赖性抗-c2抗体结合的表位,对抗-c2抗体rf16-214、rf16-226和rf16-242测试一组120个人c2蛋白(wt和119个突变体)。c2突变体被设计为测试表面暴露的残基对抗体结合的重要性。位于c的n-末端vwa结构域或c-末端蛋白酶结构域处的残基被丙氨酸或丝氨酸替换并测试对抗-c2抗体的结合。
[0815]
rf16-214、rf16-226和rf16-242对每个突变体的亲和力分别显示在表9-11中。从这些突变体获得的生物传感器数据允许对对结合重要的残基进行做图。
[0816]
表9 rf16-214与c2丙氨酸突变体的结合
[0817]
[0818]
[0819][0820]“nb”表示没有检测到结合
[0821]“pb”表示由于结合差可能无法确定亲和力
[0822]
表10 rf16-226与c2丙氨酸突变体的结合
[0823]
[0824]
[0825]
[0826][0827]“nb”表示没有检测到结合
[0828]“pb”表示由于结合差可能无法确定亲和力
[0829]
表11 rf16-242与c2丙氨酸突变体的结合
[0830]
[0831]
[0832][0833]“nb”表示没有检测到结合
[0834]“pb”表示由于结合差可能无法确定亲和力
[0835]
表9-11显示了ph-依赖性抗-c2抗体rf16-214、rf16-226和rf16-242的表位大部分限于vwa结构域(氨基酸254-452)。特别地,位置443处的赖氨酸、位置331处的组氨酸和位置457处的赖氨酸似乎对ph-依赖性抗-c2抗体与c2的结合非常重要。rf16-226也对蛋白酶结构域(氨基酸464-744)残基的突变部分敏感,提示其表位的稳定性需要两个结构域。
[0836]
位置331处的组氨酸和位置443处的赖氨酸的突变对所有三个抗体的结合亲和力具有巨大影响(》20倍的kd减小),可能解释了这些抗体对局部ph改变的敏感性。
[0837]
实施例5
–
增加对fcrn的亲和力
[0838]
为了增强ph-依赖性抗-c2抗体的再循环,这些抗体的fc区中的几个残基(它们参与了与fcrn的结合)被突变以增加它们在ph 6.0(初级内体ph)和7.3(中性ph)时与fcrn的亲和力。使用上述的spr方法测试与人和食蟹猴fcrn两者的结合。
[0839]
表12和13显示了得到的rf16-226 fc突变体分别对人和食蟹猴fcrn的亲和力。对rf16-214和rf16-242获得了类似的结果(数据未显示)。
[0840]
表12
–
rf16-226 fc突变体对人fcrn的亲和力
[0841][0842][0843]
表13
–
rf16-226 fc突变体对食蟹猴fcrn的亲和力
[0844] kd(nm),在ph 6.0kd(nm),在ph 7.3wt2100》10μmi253a》10μm》10μmm428l,n434a420》10μm
m252y,s254t,t256e450》10μmm252y,n286e,n434y192200m252y,v308p,n434y8.71100
[0845]
实施例6
–
作用的中和机制
[0846]
评估代表性的ph-依赖性抗-c2抗体rf16-226抑制c2的c1s-介导的裂解的能力,从而至少部分地确定该抗体补体抑制的作用机制。人c2与rf16-226在室温孵育30分钟,随后向混合物中加入不同浓度的c1s,然后继续孵育1小时。运行sds-page凝胶电泳以分析c1s对c2的蛋白水解裂解所产生的c2a(c2的较大的酶活性片段)的量。
[0847]
图3显示了抗体rf16-226能够抑制c1s的蛋白水解活性,导致保护c2不被激活。将数据拟合为s型四参数逻辑曲线,其中x是log(c1s的浓度)。由此拟合计算的rf16-226产生的抑制的log ic50为50.3nm。值得注意的是,rf16-226对c2激活的抑制具有c1s浓度-依赖性现象。
[0848]
图3中显示的rf16-226对c1s活性的抑制效应还对此抗体的生殖系形式rf16-226g进行测定。在此实验中,0.2μm人c2与0.25μm rf16-226g(或对照抗体rf16-240)在室温孵育30分钟,随后向混合物加入2.5nm c1s,然后继续孵育1小时。运行sds-page凝胶电泳以分析c1s对c2的蛋白水解裂解所产生的c2b(c2的较小的无活性片段)的量。
[0849]
图4显示了抗体rf16-226g抑制c1s的蛋白水解活性,如通过产生的c2b的量确定。
[0850]
实施例7
–
确认清扫活性
[0851]
利用使用稳定表达人fcrn和β
2-微球蛋白的293-f细胞的细胞测定体外评估rf16-226g和rf16-226g ypy(即,实施例5中描述的具有m252y、v308p和n434y fc突变的rf16-226g抗体)的清扫活性(chia等人,2018,j biol chem 293,6363
–
6373)。针对作为对照的非-ph依赖性c2-结合抗体rf16-207评估这些抗体的清扫活性。细胞用荧光标记的c2(c2-af488)和对照、rf16-226g或rf16-226g ypy抗-c2抗体(c2:抗体的摩尔比为8:1)在ph 7(图5a和5b)或ph 5.5(图5c和5d)同时脉冲刺激。与c2对应的荧光绘制在图5a和5c中,与各个抗-c2抗体对应的荧光绘制在图5b和5d中。
[0852]
在ph 7,当c2与对照或rf16-226g抗-c2抗体共施用时,c2或抗-c2抗体(分别为图5a和5b)没有被摄取到细胞中,反映了在中性ph时这两种抗体与fcrn的最小结合。相反,当与抗-c2 rf16-226g ypy抗体共施用(图5a和5b)时c2有效地内化,rf16-226g ypy抗体在ph 7时可以与fcrn结合。在c2和rf16-226g ypy之间明显有显著的共定位,提示这些分子作为复合物被摄取,并且在缺少抗-c2抗体的情况下c2不内化(数据未显示)。60min追踪后,在细胞中检测到非常少的c2或rf16-226g ypy(图5a和5b)。然而,在存在蛋白酶抑制剂混合物的情况下(图5中的“ pi”),其中信号的挽救将指示溶酶体降解,保留了c2的信号(图5a),但没有rf16-226g ypy的信号(图5b)。这些结果与rf16-226g ypy的清扫活性一致,据此在ph 7时c2通过fcrn受体以复合物rf16-226g ypy内化,接着在酸性内体内释放c2,随后溶酶体降解,同时rf16-226g ypy再循环回细胞表面。
[0853]
脉冲-追踪实验还在ph 5.5时进行以促进fcrn-介导的对所有抗体和复合物的摄取(图5c和5d)。在这些条件下,在10分钟脉冲刺激后c2-af488和所有各个抗体有显著摄取。在进一步的60min追踪后,c2-af488和全部抗-c2抗体的荧光几乎完全消失。当与rf16-226g和rf16-226g ypy抗体共施用时加入蛋白酶抑制剂挽救了c2-af488荧光,提示在这些条件
下c2的溶酶体降解,但当与对照抗体共施用时上述情况没有发生(图5c和5d)。添加蛋白酶抑制剂没有挽救所有抗体的荧光,提示所有抗体通过fcrn再循环。总之,这些结果提示:rf16-226g和rf16-226g ypy抗体由于它们与c2的ph-依赖性结合能够在酸性内体小室内释放c2用于后续的溶酶体降解。
[0854]
实施例8
–
与其他抗-c2抗体的比较
[0855]
本文公开的ph-依赖性抗-c2抗体的结合特性与抗体“ch13”和“ch5f2.4”(记载在wo 2014/189378中)比较。
[0856]
结合竞争
[0857]
使用人c2酶原(huc2)作为结合伴侣,在配对结合(即,聚类)实验中分析抗体rf16-226、rf16-240、ch5f2.4和ch13,以确定这些抗体是否竞争结合。结合数据以定性方式分析,因为阳性结合反应表示通过与huc2的非竞争性抗体结合产生的复合物形成(在图6中以白色指示)。同样,阴性结合反应表示抗体不能结合被固定在芯片表面处的抗-c2 mab俘获的huc2(在图6中以灰色指示)。配对分析还包括作为配体和分析物测试的相同抗体(在图6中以黑色指示)。
[0858]
在此描述的聚类实验使用与实施例4中所述相同的设计。主要的不同之处在于使用2mm氯化钙代替3mm edta,因为钙是ch5f2.4与c2的最佳结合所需要的。图6显示了抗体对rf16-226/rf16-240、rf16-226/ch5f2.4、rf16-240/ch5f2.4和ch5f2.4/ch13不竞争与huc2的结合,提示它们的表位不重叠。当以两个方向测试(即,作为配体或分析物mab)时仅抗体rf16-240和ch13显示在配对结合实验中有竞争作用,提示它们的表位重叠。
[0859]
钙对c2结合的作用
[0860]
向spr运行缓冲液添加氯化钙来测定钙对rf16-226、rf16-226yte(fc突变m252y,s254t,t256e)、rf16-226 yey(m252y,n286e,n434y)、rf16-226 ypy(m252y,v308p,n434y)、ch5f2.4和ch13的c2结合的作用。钙浓度范围为从零(即,不加入钙,对照)至接近生理水平(0.02,0.2和2mm cacl2·
2h2o,mw 147.02da)。
[0861]
如实施例1中所发现的那样,人补体c2酶原(huc2)与rf16-226的结合是ph敏感的,范围从在中性(ph 7.3)时的kd~10nm至酸性(ph6)条件中的kd~95nm(表14和15)。加入钙对huc2的结合亲和力没有显著影响(表14和15),提示该抗体的作用方式不依赖于ca
2
离子浓度。
[0862]
在存在或缺少钙的情况下激活的人c2(huc2a)都不结合rf16-226。
[0863]
表14-在中性条件(ph 7.3)下在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226抗体的结合动力学。
[0864][0865]
表15-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226抗体的稳态结合亲和力。
[0866][0867]
*稳态kd[0868]
fc突变yte(m252y,s254t,t256e)、yey(m252y,n286e,n434y)和ypy(m252y,v308p,n434y)不影响rf16-226与人c2的亲和力(表16-21)。总之,huc2以在ph7时以kd~9nm和在ph 6时以kd~80nm的亲和力结合rf16-226及其fc变体。钙不影响huc2与这些抗体中的任一个的结合(表16-21)。
[0869]
表16-在中性条件(ph 7.3)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226 yte抗体的结合动力学。
[0870][0871]
表17-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226 yte抗体的稳态结合亲和力。
[0872][0873]
*稳态kd[0874]
表18-在中性条件(ph 7.3)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226 yey抗体的结合动力学。
[0875][0876]
表19-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226 yey抗体的稳态结合亲和力。
[0877][0878]
*稳态kd[0879]
表20-在中性条件(ph 7.3)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226 ypy抗体的结合动力学。
[0880][0881]
表21-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与rf16-226 ypy抗体的稳态结合亲和力。
[0882][0883]
*稳态kd[0884]
与rf16-226相反,ch5f2.4与c2的结合对钙浓度敏感(表22和23)。当钙以接近生理水平(即,2000μm ca
2
)存在时,huc2与ch5f2.4的稳态亲和力在中性(ph 7.3,kd~14nm)和酸性(ph 6,kd~22nm)条件下相当。然而,利用3mm edta去除钙和其他二价离子将在中性ph时ch5f2.4与huc2的亲和力在ph 7.3(kd~360nm)时降低~27倍、在酸性ph 6(kd~225nm)时降低10倍。ch5f2.4对钙的敏感性提示该离子是huc2/ch5f2.4复合物形成和huc2释放至再循环内体的腔中(即,清扫)的关键决定因素。
[0885]
ch5f2.4与huc2a的结合检测不到。
[0886]
表22-在中性条件(ph 7.3)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与ch5f2.4抗体的稳态结合亲和力。
[0887][0888]
*稳态kd[0889]
表23-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与ch5f2.4抗体的稳态结合亲和力。
[0890][0891]
*稳态kd[0892]
钙对huc2与ch13在中性和酸性ph时的结合特性的影响可忽略不计(表24和25)。此外,huc2在中性(kd~4nm)和在酸性ph(kd~4nm)时以相当的亲和力结合ch13。
[0893]
不像rf16-226和ch5f2.4,ch13与人c2a(c2的较大的酶活性片段)的结合检测不到。ch13在中性ph时以约10nm的亲和力结合huc2a。在酸性ph时huc2a与ch13的结合(kd~45nm)弱~4倍(表26和27)。
[0894]
表24-在中性条件(ph 7.3)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与ch13抗体的结合动力学。
[0895][0896]
表25-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2与ch13抗体的结合动力学。
[0897][0898]
表26-在中性条件(ph 7.3)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2a与ch13抗体的结合动力学。
[0899][0900]
表27-在酸性ph(ph 6.0)时在递增浓度的氯化钙(ca
2
)的存在下测量的huc2a与ch13抗体的结合动力学。
[0901][0902]
实施例9
–
与c2a和c2b的结合
[0903]
使用与上述那些相似的表面等离子共振测定测试抗体rf16-226、rf16-226g、rf16-226g ypy和ch5f2.4与c2酶原、c2a和c2b结合的能力。纯化的人c2酶原和人c2a以1.9-500nm的浓度范围测试,而人c2b以1.9-1000nm的浓度范围测试。所有试验在补充了0.1%bsa的hbs-ep缓冲液中在37℃和ph 7.3进行。每个抗体针对人c2酶原和人c2a一式两份地测
试,针对c2b一式四份地测试。流速设定为30μl/min。每个分析物浓度一式两份地测试。涉及ch5f2.4的实验使用运行缓冲液中的2mm ca
2
进行,因为这是ch5f2.4的最佳结合所需要的。
[0904]
如表28所示,人c2酶原以8nm的kd结合rf16-226,以7nm的kd结合rf16-226g,以8nm的kd结合rf16-226g ypy,以0.6nm的kd结合ch5f2.4(亲和力为两次实验的平均值)。对rf16-226、rf16-226g、rf16-226g ypy或ch5f2.4没有检测到人c2a的结合。对rf16-226、rf16-226g或rf16-226g ypy没有检测到人c2b的结合。然而,ch5f2.4以0.25nm的kd结合人c2b。
[0905]
表28
–
ph-依赖性抗-c2抗体与人c2酶原、c2a和c2b的结合亲和力
[0906]
抗体c2亲和力(kd)c2a亲和力(kd)c2b亲和力(kd)rf16-2268nmnbnbrf16-226g7nmnbnbrf16-226g ypy8nmnbnbch5f2.40.6nmnb0.25nm
[0907]“nb”表示没有检测到结合。
[0908]
这些数据结合实施例4中描述的表位做图实验,提示rf16-226及其修饰形式的表位位于c2酶原的c2a和c2b结构域之间的界面处或附近,因为两个结构域是可检测结合所需要的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。