1.本发明属于多肽和/或蛋白质合成技术领域,具体涉及一种基于转肽酶的化学酶法的蛋白质半合成,更具体涉及一种连接多肽或蛋白的方法。
背景技术:
2.带有功能性分子修饰(比如亲和标签、荧光基团、聚乙二醇(简称peg)等)蛋白样品以及带有翻译后修饰蛋白样品的获取,对于蛋白相关的基础和应用研究具有极大的促进作用,例如带有亲和标签的蛋白能够用于蛋白富集和组学筛查,带有荧光基团的蛋白能够用于细胞成像及其抑制剂的筛选,带有翻译后修饰的蛋白能够用于研究蛋白的互作及其功能机制。
3.目前,由于化学酶法反应条件更加温和,连接效率更加高效,常用来获取修饰的蛋白样品,其中,转肽酶(又称转肽酶sortase)是目前实验室中常用的一种蛋白连接工具酶,其通过形成肽键连接两个多肽/蛋白片段,在蛋白的标记和合成方面都有丰富的应用案例。但是,转肽酶在蛋白合成过程中存在反应可逆、极度依赖识别序列的缺陷。
4.因此,转肽酶介导的多肽/蛋白连接方法有待改进或优化。
技术实现要素:
5.本发明旨在改进转肽酶连接方法的局限,发展高效的转肽酶连接策略。为此,本发明将多肽/蛋白识别序列的c末端提前构建成硫酯结构,从而发展了一种高效的蛋白半合成方法。该方法中转肽酶对识别序列依赖性低,可识别多种序列,并且,该反应不可逆,可进一步提高蛋白样品的产率。
6.本发明是基于发明人的下列发现而完成的:
7.目前,蛋白的酶促合成方法中,转肽酶存在反应可逆(酶促反应的产率仅有50%)、极度依赖识别序列(例如sortase a酶依赖l-p-x-t-g序列,l为亮氨酸、p为脯氨酸、x表示任何氨基酸、t为苏氨酸、g为甘氨酸)的缺陷。
8.针对上述反应可逆的特点,前人发展了很多方法:1)将其中一个片段加入大过量,促使反应完全进行,但是对于难获取或者难溶解的样品,该方法并不适用;2)采用透析、螯合等方式除去离去基团,促使反应完全,但是,除去离去基团过程中需要花费大量时间,极大地增加时间成本;3)通过使产物形成特殊的二级结构来抑制逆向反应,但二级结构的引入可能会影响理化特性;4)使用缩肽作为底物来克服反应的可逆性,但该方法只能获取n端修饰的蛋白。
9.针对上述依赖识别序列的特点,研究者通过定向进化的方式来拓展能够识别不同序列的转肽酶的种类,但是,这些酶的种类和数量仍然有限。目前的方法都只克服了转肽酶酶促连接反应中的可逆性和识别序列依赖性中的某一方面的局限,尚无一种策略能同时克服这两种局限。
10.发明人经过大量实验,将蛋白左边的片段(第一多肽或第一蛋白)c末端氨基酸与
带有游离巯基的化合物通过硫酯键相连,带有游离巯基的化合物可选自巯基乙酸甲酯(mtg)、巯基乙酸(tga)、n-甲基-硫代乙酰胺(mma)、巯基乙基磺酸钠(mesna)或4-巯基苯基乙酸(mpaa)等。发明人惊喜地发现,在引入硫酯结构之后,不仅能够提升转肽酶反应的转化率,还能降低对识别序列的依赖性。因此,本发明中对转肽酶介导的连接方法进行改进,能够为修饰蛋白的合成带来更多的机遇。
11.基于此,在本发明的一个方面,本发明提出了一种连接多肽或蛋白的方法。根据本发明的实施例,所述方法包含:将第一多肽或第一蛋白与第二多肽或第二蛋白在转肽酶的作用下进行连接处理,以便获得连接肽(又称多肽)或蛋白,所述第一多肽或第一蛋白的c末端与所述第二多肽或第二蛋白的n末端连接;其中,所述第一多肽或第一蛋白的c末端氨基酸p1的羧基与带有游离巯基的化合物通过硫酯键相连;所述第二多肽或第二蛋白的n末端为甘氨酸。
12.发明人通过大量实验发现,将第一多肽或第一蛋白的c末端氨基酸p1的羧基与带有游离巯基的化合物通过硫酯键相连,也能够被转肽酶识别,并能被转肽酶介导与n末端为甘氨酸的第二多肽或第二蛋白进行连接反应。该方法中转肽酶对第一多肽或第一蛋白的c末端的四个氨基酸的识别序列依赖性低;并且,该反应不可逆,可使原料完全反应,进一步提高多肽的产率。
13.示例性地,sortase a酶能够耐受大量的l-p-x-t的衍生序列。需要说明的是,l-p-x-t的衍生序列是指,氨基酸序列为l-p-x-t中的l、p和t中的至少有一个氨基酸进行替换后得到的序列,其中,t位于p1位置。
14.此外,发明人可根据目标多肽和/或蛋白的氨基酸序列,选择p1-甘氨酸序列(即为l-p-x-t-g的衍生序列)为转肽酶的识别序列,该识别序列的位置为第一多肽和第二多肽、第一多肽和第二蛋白、第一蛋白和第二多肽或者第一蛋白和第二蛋白的连接位点,基于连接位点设计并制备第一多肽和第二多肽或者第一蛋白和第二蛋白,其中,第一多肽或第一蛋白的c末端为p1,第二多肽或第二蛋白的n末端为甘氨酸。转肽酶可识别第一多肽或第一蛋白c末端带有硫酯键的序列,并使第一多肽和第二多肽之间、第一蛋白和第二蛋白之间、第一多肽和第二蛋白或第一蛋白之间或第二多肽之间发生缩合反应,将第一多肽和第二多肽、第一蛋白和第二蛋白、第一多肽和第二蛋白或第一蛋白或第二多肽之间连接。上述方法中转肽酶对识别序列依赖性低,可识别多种序列,并且,该反应不可逆,可进一步提高连接肽样品(或称多肽样品)和/或蛋白样品的产率。
15.需要说明的是,“连接位点”与连接肽或蛋白的识别序列相同,例如识别序列为l-p-x-t-g的衍生序列。
16.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
17.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
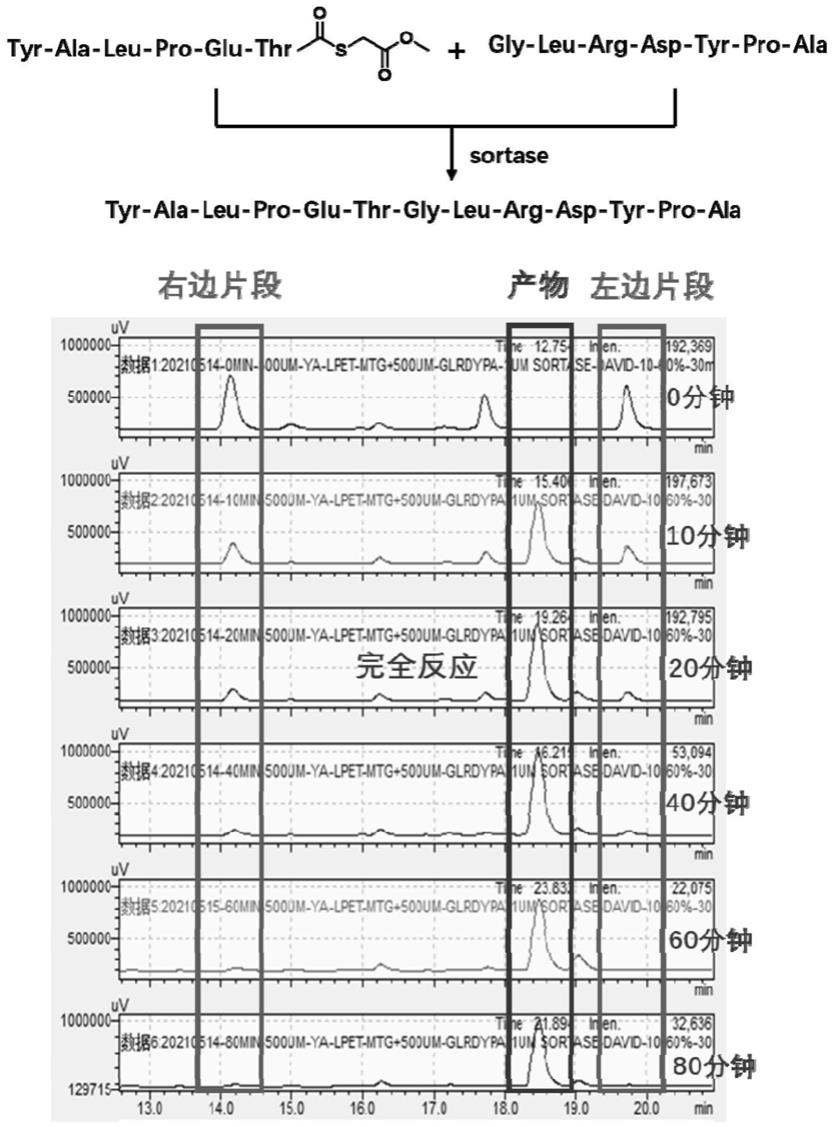
18.图1为本发明实施例1中基于mtg硫酯结构的短肽的酶连反应随时间变化的色谱图;
19.图2为本发明实施例2中基于mma硫酯结构的短肽的酶连反应随时间变化的色谱图;
20.图3为本发明实施例3中基于tga硫酯结构的短肽的酶连反应随时间变化的色谱图;
21.图4为本发明实施例4中基于mesna硫酯结构的短肽的酶连反应随时间变化的色谱图;
22.图5为本发明实施例5中基于mpaa硫酯结构的短肽的酶连反应随时间变化的色谱图;
23.图6为本发明实施例6中识别序列单位点替换的短肽硫酯的酶连反应随时间变化的色谱图;
24.图7为本发明实施例7中识别序列双位点替换的短肽硫酯的酶连反应随时间变化的色谱图;
25.图8为本发明实施例8中基于硫酯结构的酶连反应获取天然的h3;
26.图9为本发明实施例9中基于硫酯结构的酶连反应获取s139磷酸化修饰的h2ax;
27.图10为本发明对比例1中非硫酯短肽的酶连反应随时间变化的色谱图;
28.图11为本发明对比例2中识别序列单位点替换非硫酯短肽的酶连反应随时间变化的色谱图;
29.图12为本发明对比例3中识别序列双位点替换非硫酯短肽的酶连反应随时间变化的色谱图。
具体实施方式
30.下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
31.需要说明的是,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。进一步地,在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
32.本发明提出了一种连接多肽的方法及多肽和/或蛋白的合成方法,下面将分别对其进行详细描述。
33.连接多肽的方法
34.本发明提出了一种连接多肽或蛋白的方法。根据本发明的实施例,所述方法包含:将第一多肽或第一蛋白与第二多肽或第二蛋白在转肽酶的作用下进行连接处理,以便获得连接肽或蛋白,所述第一多肽或第一蛋白的c末端与所述第二多肽或第二蛋白的n末端连接;其中,所述第一多肽或第一蛋白的c末端氨基酸p1的羧基与带有游离巯基的化合物通过硫酯键相连;所述第二多肽或第二蛋白的n末端为甘氨酸。
35.发明人通过大量实验发现,将c末端氨基酸p1的羧基与带有游离巯基的化合物通过硫酯键相连,其可被转肽酶识别,并能与被转肽酶介导与n末端为甘氨酸的第二多肽或第二蛋白进行连接反应。由此,该方法中转肽酶对识别序列依赖性低,可识别多种序列;并且,该反应不可逆,可进一步提高多肽样品的产率。
36.根据本发明的实施例,所述带有游离巯基的化合物包括选自巯基乙酸甲酯、巯基乙酸、n-甲基-硫代乙酰胺、巯基乙基磺酸钠、4-巯基苯基乙酸、2,2,2-三氟乙硫醇、2-巯基乙酸乙酯、3-巯基丙酸和3-巯基丙酸甲酯中的任意一种。发明人经过试验发现,采用上述带有游离巯基的化合物和与氨基酸p1反应生产硫酯键,通过第一多肽或第一蛋白中硫酯键的加入,可降低转肽酶对识别序列依赖性,识别多种序列,并使反应不可逆,进一步提高多肽样品的产率。
37.根据本发明的实施例,所述转肽酶包括sortase a、sortase b、sortase c、sortase d、sortase e、sortase f中的至少之一,优选为sortase a。采用本发明的方法,sortase a酶能够耐受大量的l-p-x-t的衍生序列。
38.根据本发明的实施例,所述转肽酶选自sortase a,所述第一多肽或第一蛋白的c末端氨基酸前四位氨基酸序列为p4p3p2p1;其中,所述p2选自任意一种氨基酸,所述p4为亮氨酸,所述p3为脯氨酸,所述p1为苏氨酸,或所述p4、p3和p1中的至少一个氨基酸发生替换。
39.发明人经过大量实验发现,转肽酶可识别c末端含有上述序列的第一多肽或第一蛋白,并使第一多肽或第一蛋白和n末端带有甘氨酸的第二多肽或第二蛋白发生缩合反应,由此,可降低转肽酶对识别序列依赖性以及促使反应不可逆,进一步提高多肽样品的产率。
40.需要说明的是,多肽片段(例如第一多肽或第一蛋白)的c末端到n末端的顺序依次为p1、p2、p3和p4,即为n末端-p4-p3-p2-p1-c末端。
41.需要说明的是,“p4、p3和p1中的至少一个氨基酸发生替换”是指,在p4为亮氨酸、p3为脯氨酸、p1为苏氨酸的基础上,p4、p3和p1中存在其中一个氨基酸发生替换、其中两个氨基酸发生替换或者三个氨基酸都发生替换。
42.需要说明的是,“发生替换”是指p4、p3或p1中的氨基酸与其分别对应的原始氨基酸不同,即为,p4不为亮氨酸、p3不为脯氨酸或p1不为苏氨酸。其中,p4的原始氨基酸为亮氨酸,p3的原始氨基酸为脯氨酸,p1的原始氨基酸为苏氨酸。
43.根据本发明的实施例,所述p4、p3和p1中的一个氨基酸发生替换,其中,所述p2选自任意一种氨基酸,所述p4的亮氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、脯氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p3为脯氨酸,所述p1为苏氨酸;或,所述p2选自任意一种氨基酸,所述p3的脯氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p4为亮氨酸,所述p1为苏氨酸;或,所述p2选自任意一种氨基酸,所述p1的苏氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、脯氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,p4为亮氨酸,p3为脯氨酸。
44.根据本发明的实施例,所述p4、p3和p1中的一个氨基酸发生替换,其中,所述p2选自任意一种氨基酸,所述p4的亮氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、脯氨酸、苏氨酸、色氨酸或缬氨酸,所述p3为脯氨酸,所述p1为苏氨酸;或,所述p2选自任
意一种氨基酸,p3的脯氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、苏氨酸、色氨酸或缬氨酸,p4为亮氨酸,p1为苏氨酸;或,所述p2选自任意一种氨基酸,p1的苏氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、脯氨酸、色氨酸或缬氨酸,p4为亮氨酸,p3为脯氨酸。
45.根据本发明的实施例,所述p4、p3和p1中的两个氨基酸发生替换,其中,所述p2选自任意一种氨基酸,所述p4为亮氨酸,所述p3的脯氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p1的苏氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、脯氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸;或,所述p2选自任意一种氨基酸,所述p3为脯氨酸,所述p4的亮氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、脯氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p1的苏氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、脯氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸;或,所述p2选自任意一种氨基酸,所述p1为苏氨酸,所述p4的亮氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、脯氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p3的脯氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸。
46.根据本发明的实施例,所述p4、p3和p1中的两个氨基酸发生替换,其中,所述p2选自任意一种氨基酸,所述p4为亮氨酸,所述p3的脯氨酸替换为丙氨酸、甘氨酸、丝氨酸、半胱氨酸、苏氨酸、苯丙氨酸或酪氨酸,所述p1的苏氨酸替换为丙氨酸、甘氨酸、丝氨酸、半胱氨酸、苏氨酸、苯丙氨酸或酪氨酸;或,所述p2选自任意一种氨基酸,所述p3为脯氨酸,所述p4的亮氨酸替换为丙氨酸、甘氨酸、丝氨酸、半胱氨酸、苏氨酸、苯丙氨酸或酪氨酸,所述p1的苏氨酸替换为丙氨酸、甘氨酸、丝氨酸、半胱氨酸、苏氨酸、苯丙氨酸或酪氨酸;或,所述p2选自任意一种氨基酸,所述p1为苏氨酸,所述p4的亮氨酸替换为丙氨酸、甘氨酸、丝氨酸、半胱氨酸、苏氨酸、苯丙氨酸或酪氨酸,所述p3的脯氨酸替换为丙氨酸、甘氨酸、丝氨酸、半胱氨酸、苏氨酸、苯丙氨酸或酪氨酸。
47.根据本发明的实施例,所述p4、p3和p1中的三个氨基酸均发生替换,其中,所述p2选自任意一种氨基酸,所述p4的亮氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、脯氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p3的脯氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙
氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、苏氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸,所述p1的苏氨酸替换为赖氨酸、天冬氨酸、半胱氨酸、丝氨酸、甘氨酸、酪氨酸、苯丙氨酸、丙氨酸、精氨酸、天冬酰胺、谷氨酰胺、谷氨酸、组氨酸、异亮氨酸、蛋氨酸、亮氨酸、脯氨酸、色氨酸、缬氨酸、β-苯丙氨酸、2,3-二氨基丙酸、正亮氨酸或鸟氨酸。
48.需要说明的是,sortase a具体参见irwin chen,a general strategy for the evolution of bond-forming enzymes using yeast display,proc.natl.acad.sci.u.s.a.,2011,108(28):11399-404;sortase b-f具体参见alex w jacobitz,sortase transpeptidases:structural biology and catalytic mechanism,adv protein chem struct biol.,2017;109:223-264。其中,sortase a-f还可以为上述文献中提到的氨基酸序列或者具有至少80%同源性的氨基酸序列,或者说,sortase a-f可以为上述文献中提到的酶或者其可接受的变体,sortase a-f不受具体限制。
49.根据本发明的实施例,所述第一多肽或第一蛋白和所述第二多肽或第二蛋白与转肽酶混合之前,预先将所述第一多肽或第一蛋白和所述第二多肽或第二蛋白与还原剂和稳定剂进行混合处理,并调节ph值至6-8。由此,多肽连接的效果较佳。
50.根据本发明的实施例,所述还原剂包括选自氯化钠、氯化钾中的至少之一。由此,多肽连接的效果较佳。
51.根据本发明的实施例,所述稳定剂包括选自三(2-羧乙基)膦、三(3-羟丙基)膦、双(3-丙酸甲酯)苯基膦硼烷络合物、(3-丙酸甲酯)二苯基膦硼烷络合物中的至少之一。由此,可提高反应的稳定性,多肽连接的效果较佳。
52.根据本发明的实施例,所述连接处理的反应温度为20-40℃。由此,多肽连接的效果较佳。
53.根据本发明的实施例,所述第一多肽或第一蛋白和所述第二多肽或第二蛋白的摩尔比为(1-20):(1-20)。发明人经过大量实验得到上述较优配比,由此,多肽连接的效果较佳。
54.根据本发明的实施例,所述第一多肽或第一蛋白和所述第二多肽或第二蛋白的摩尔比为(1-20):(1-20)。由此,多肽连接的效果较佳。
55.根据本发明的实施例,所述第一多肽或第一蛋白和所述第二多肽或第二蛋白总摩尔数与所述转肽酶的摩尔比为(1-600):1。发明人经过大量实验得到上述较优配比,由此,多肽连接的效果较佳。
56.根据本发明的实施例,所述第一多肽或第一蛋白和所述第二多肽或第二蛋白总摩尔数与所述转肽酶的摩尔比为(1-600):1。由此,多肽连接的效果较佳。
57.根据本发明的实施例,若p4、p3和p1中氨基酸的替换个数越多,转肽酶的添加量越多。
58.根据本发明的实施例,所述连接处理后,进一步包括将所述连接肽进行纯化处理。由此,可去除多肽样品中的杂质,提高多肽的纯度。
59.根据本发明的实施例,第一多肽或第一蛋白是通过如下方式获得:将第三多肽或第三蛋白与带有所述游离巯基的化合物进行酰肼硫酯化反应,所述第三多肽或第三蛋白的c末端氨基酸具有-nhnh2,所述第三多肽或第三蛋白的氨基酸序列与第一多肽或第一蛋白
的氨基酸序列相同。由此,可制备得到c末端带有硫酯键的第一多肽或第一蛋白。
60.根据本发明的实施例,第一多肽或第一蛋白是通过如下方式获得:将第三多肽或第三蛋白与带有所述游离巯基的化合物进行转硫酯反应,所述第三多肽或第三蛋白的c末端氨基酸带有intein基团,所述第三多肽或第三蛋白的氨基酸序列与第一多肽或第一蛋白的氨基酸序列相同。由此,可制备得到c末端带有硫酯键的第一多肽或第一蛋白。
61.需要说明的是,第三片段或第三蛋白的氨基酸序列是指不包含intein基团的氨基酸序列。
62.在本文中,术语“intein基团”是指融合表达内含肽,可以通过自切割获取目标片段,具体参考n.h.shah,t.w.muir,inteins:nature's gift to protein chemists.chem.sci.2014,5,446-461。
63.根据本发明的实施例,所述多肽上携带修饰基团。发明人经过大量实验发现,该方法尤其适用于制备带有修饰基团的多肽(尤其是制备带有修饰基团的蛋白),具有降低转肽酶对识别序列依赖性、促使反应不可逆、提高修饰多肽样品的产率等优点。
64.根据本发明的实施例,第一多肽或第一蛋白和第二多肽或第二蛋白连接之前,将修饰基团添加到第一多肽或第一蛋白和/或第二多肽或第二蛋白上。发明人可根据多肽(或蛋白)的氨基酸序列,设计并制备第一多肽或第一蛋白和第二多肽或第二蛋白,然后将修饰基团添加到第一多肽或第一蛋白和/或第二多肽或第二蛋白上,进而得到带有修饰基团的多肽(或蛋白)。该方法中转肽酶可识别多个识别序列,制得的多肽样品(或蛋白样品)的产率高。
65.根据本发明的实施例,所述修饰基团的类型包括功能性分子修饰和/或翻译后修饰。由此,本发明可制备得到带有上述修饰基团的多肽(或蛋白)。
66.根据本发明的实施例,所述功能性分子修饰包括亲和标签修饰、荧光基团修饰、聚乙二醇修饰、叠氮基团或炔烃基团修饰和非天然氨基酸中的至少之一。由此,本发明可制备得到带有上述修饰基团的多肽(或蛋白)。
67.根据本发明的实施例,所述翻译后修饰包括甲基化修饰、乙酰化修饰、磷酸化修饰和泛素化修饰中的至少之一。由此,本发明可制备得到带有上述修饰基团的多肽(或蛋白)。
68.根据本发明的实施例,所述修饰基团位于所述第一多肽或第一蛋白和/或所述第二多肽或第二蛋白。发明人经过大量实验发现,本发明的方法可制备单端具有修饰基团的多肽(尤其是制备带有修饰基团的蛋白),也可制备双端具有修饰基团的样品。
69.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
70.实施例1
71.1、c末端为硫酯的第一多肽片段的制备:
72.(1)用肼树脂,通过固相多肽合成获取序列为tyr-ala-leu-pro-glu-thr-nhnh2的短肽,通过制备型色谱分离纯化,并冻干,得到短肽干粉;
73.(2)用缓冲液(6m盐酸胍,100mm磷酸二氢钠,ph=3)溶解短肽干粉,在冰盐浴(-15℃)下孵育,加入亚硝酸钠氧化20min,之后加入mtg,调节ph=5,反应30min后,用制备型色
谱分离纯化,并冻干,得到样品1。其中,亚硝酸钠的添加量为短肽摩尔量的10倍,mtg的添加量为短肽摩尔量的500倍。
74.2、n末端为甘氨酸的第二多肽片段的制备:
75.(1)用rink酰胺树脂,通过固相多肽合成获取序列为gly-leu-arg-asp-tyr-pro-ala的短肽,通过制备型色谱分离纯化,并冻干,得到样品2。
76.3、sortase介导的两片段连接
77.(1)用缓冲盐(20mm 4-羟乙基哌嗪乙磺酸(hepes),100mm氯化钠,ph=6.0)分别溶解样品1和样品2两种多肽,至终浓度为4mm,;
78.(2)将溶解后的样品1和样品2等当量混合,加入氯化钙溶液至终浓度为10mm,加入三(2-羧乙基)膦(tcep)溶液至终浓度为1mm,然后用缓冲盐调节至样品1和样品2总量的终浓度为500um,并调节ph=7.5;
79.(3)向反应液中加入sortase a蛋白溶液,至终浓度为1um;
80.(4)将反应液置于25℃水浴中进行反应,隔时取样;
81.(5)进分析型高效反相液相色谱(岛津lc-20at)监测。
82.结果如图1所示,20min后随着反应的进行,反应20min后原料峰基本消失,全都转化生成产物,继续延长反应时间,产物峰几乎不再增加,表明硫酯协助的sortase a酶连接反应不可逆,且在反应20min时几乎反应完全。
83.实施例2
84.按照实施例1的方法制备,区别在于,c末端为硫酯的第一多肽片段的制备的步骤(2)中,将mtg用mma替换。
85.结果如图2所示,20min后随着反应的进行,反应20min后原料峰基本消失,全都转化生成产物,继续延长反应时间,产物峰几乎不再增加,表明硫酯协助的sortase a酶连接反应不可逆,且在反应20min时几乎反应完全。
86.实施例3
87.按照实施例1的方法制备,区别在于,c末端为硫酯的第一多肽片段的制备的步骤(2)中,将mtg用tga。
88.结果如图3所示,60min后随着反应的进行,反应60min后原料峰基本消失,全都转化生成产物,继续延长反应时间,产物峰几乎不再增加,表明硫酯协助的sortase a酶连接反应不可逆,且在反应60min时几乎反应完全。
89.实施例4
90.按照实施例1的方法制备,区别在于,c末端为硫酯的第一多肽片段的制备的步骤(2)中,将mtg用mesna。
91.结果如图4所示,40min后随着反应的进行,反应40min后原料峰基本消失,全都转化生成产物,继续延长反应时间,产物峰几乎不再增加,表明硫酯协助的sortase a酶连接反应不可逆,且在反应40min时几乎反应完全。
92.实施例5
93.按照实施例1的方法制备,区别在于,c末端为硫酯的第一多肽片段的制备的步骤(2)中,将mtg用mpaa。
94.结果如图5所示,60min后随着反应的进行,反应60min后原料峰基本消失,全都转
化生成产物,继续延长反应时间,产物峰几乎不再增加,表明硫酯协助的sortase a酶连接反应不可逆,且在反应60min时几乎反应完全。
95.实施例6:带有单位点替换的识别序列的短肽硫酯的酶连反应
96.1、带有替换序列的c末端为硫酯的第一多肽片段的制备:
97.(1)用肼树脂,通过固相多肽合成获取序列为tyr-ala-gly-pro-glu-thr-nhnh2(其中将天然识别序列leu-pro-glu-thr中的leu替换成了gly)的短肽,通过制备型色谱分离纯化,并冻干,得到短肽干粉;
98.(2)用缓冲液(6m盐酸胍,100mm磷酸二氢钠,ph=3)溶解短肽干粉,在冰盐浴(-15℃)下孵育,加入亚硝酸钠氧化20min,之后加入mtg,调节ph=5,反应30min后,用制备型色谱分离纯化,并冻干,得到样品1。其中,亚硝酸钠的添加量为短肽摩尔量的10倍,mtg的添加量为短肽摩尔量的500倍。
99.2、n末端为g的第二多肽片段的制备:
100.(1)用rink酰胺树脂,通过固相多肽合成获取序列为gly-gly-ser-leu-tyr-ala的短肽,通过制备型色谱分离纯化,并冻干,得到样品2。
101.3、sortase介导的两片段连接
102.(1)用缓冲盐(20mm 4-羟乙基哌嗪乙磺酸(hepes),100mm氯化钠(nacl),ph=6.0)分别溶解样品1和样品2两种多肽,至终浓度为4mm;
103.(2)将溶解后的样品1和样品2等当量混合,加入氯化钙溶液至终浓度为10mm,加入三(2-羧乙基)膦(tcep)溶液至终浓度为1mm,然后用缓冲盐调节至样品1和样品2总量的终浓度为500um,并调节ph=7.5;
104.(3)向反应液中加入sortase a蛋白溶液,至终浓度为50um;
105.(4)将反应液置于25℃水浴中进行反应,隔时取样;
106.(5)进分析型色谱监测,过夜能完全反应。
107.结果如图6所示,在反应9h后的产率达到了90%以上,因此,本实施例的方法适用于单位点替换的识别序列。
108.实施例7:带有双位点替换的识别序列的短肽硫酯的酶连反应
109.1、带有替换序列的c末端为硫酯的第一多肽片段的制备:
110.(1)用肼树脂,通过固相多肽合成获取序列为tyr-ala-ala-ala-glu-thr-nhnh2(其中将天然识别序列leu-pro-glu-thr中的leu替换成了ala,pro替换成了ala)的短肽,通过制备型色谱分离纯化,并冻干,得到短肽干粉;
111.(2)用缓冲液(6m盐酸胍,100mm磷酸二氢钠,ph=3)溶解短肽干粉,在冰盐浴(-15℃)下孵育,加入亚硝酸钠氧化20min,之后加入mtg,调节ph=5,反应30min后,用制备型色谱分离纯化,并冻干,得到样品1。其中,亚硝酸钠的添加量为短肽摩尔量的10倍,mtg的添加量为短肽摩尔量的500倍。
112.2、n末端为g的第二多肽片段的制备:
113.(1)用rink酰胺树脂,通过固相多肽合成获取序列为gly-leu-arg-asp-tyr-pro-ala的短肽,通过制备型色谱分离纯化,并冻干,得到样品2。
114.3、sortase介导的两片段连接
115.(1)用缓冲盐(20mm 4-羟乙基哌嗪乙磺酸(hepes),100mm氯化钠(nacl),ph=6.0)
分别溶解样品1和样品2两种多肽,至终浓度为4mm;
116.(2)将溶解后的样品1和样品2等当量混合,加入氯化钙溶液至终浓度为10mm,加入三(2-羧乙基)膦(tcep)溶液至终浓度为1mm,然后用缓冲盐调节至样品1和样品2总量的终浓度为500um,并调节ph=7.5;
117.(3)向反应液中加入sortase a蛋白溶液,至终浓度为50um;
118.(4)将反应液置于25℃水浴中进行反应,隔时取样;
119.(5)进分析型色谱监测,过夜能完全反应。
120.结果如图7所示,与3h的反应色谱图相比,9h的产物峰明显增加,因此,本实施例的方法适用于双位点替换的识别序列。
121.实施例8:组蛋白h3的制备
122.1、c末端为硫酯的第一多肽片段的制备:
123.(1)将第一多肽片段的氨基酸序列后面加个cys,构建到pet系列载体中,通过大肠杆菌表达,纯化获取该片段;
124.(2)将蛋白浓度控制在20mg/ml,按照每1ml体积加入100mg mesna、5mg tcep和50mg盐酸肼,调节ph=7.0,然后用n2排净管中的空气,用塑封膜封口,放入摇床中,于50℃、100rpm的条件下反应60h,待完全反应后进行半制备分离,获取c末端为酰肼的片段。
125.(3)用缓冲液(6m盐酸胍,100mm磷酸二氢钠,ph=3)溶解蛋白干粉,在冰盐浴(-15℃)下孵育,加入亚硝酸钠氧化20min,之后加入mtg,调节ph=5,反应30min后,用制备型色谱分离纯化,并冻干,得到样品1。其中,亚硝酸钠的添加量为短肽摩尔量的10倍,mtg的添加量为短肽摩尔量的500倍。
126.2、n末端为g的第二多肽片段的制备:
127.(1)用rink酰胺树脂,通过固相多肽合成获取右边的带有磷酸化修饰的短肽,通过制备型色谱分离纯化,并冻干,得到样品2。
128.3、sortase介导的两片段连接
129.(1)用缓冲盐(20mm 4-羟乙基哌嗪乙磺酸(hepes),100mm氯化钠,ph=6.0)分别溶解样品1和样品2两种多肽,至终浓度为50mm;
130.(2)将溶解后的样品1和样品2溶液混合,加入氯化钙溶液至终浓度为10mm,加入三(2-羧乙基)膦(tcep)溶液至终浓度为1mm,最终至样品1的终浓度为100um、样品2的终浓度为1mm,调节ph=7.5;
131.(3)向反应液中加入sortase a蛋白溶液,至终浓度为50um;
132.(4)将反应液置于25℃水浴中进行反应;
133.(5)过夜反应,通过制备型色谱进行分离纯化。
134.结果如图8所示,最终得到了组蛋白h3(简称h3)。
135.实施例9:合成带有翻译后修饰的天然的序列的组蛋白h2ax
136.1、c末端为硫酯的第一多肽片段的制备:
137.(1)将第一多肽片段的氨基酸序列后面加个cys,构建到pet系列载体中,通过大肠杆菌表达,纯化获取该片段;
138.(2)将蛋白浓度控制在20mg/ml,按照每1ml体积加入100mg mesna、5mg tcep和50mg盐酸肼,调节ph=7.0,然后用n2排净管中的空气,用塑封膜封口,放入摇床中,于50℃、
nh2(其中将天然识别序列leu-pro-glu-thr中的leu替换成了gly)的短肽,通过制备型色谱分离纯化,并冻干,得到短肽干粉;
164.2、n末端为g的第二多肽片段的制备:
165.(1)用rink酰胺树脂,通过固相多肽合成获取序列为gly-gly-ser-leu-tyr-ala的短肽,通过制备型色谱分离纯化,并冻干,得到样品2。
166.3、sortase介导的两片段连接
167.(1)用缓冲盐(20mm 4-羟乙基哌嗪乙磺酸(hepes),100mm氯化钠(nacl),ph=6.0)分别溶解样品1和样品2两种多肽,至终浓度为4mm;
168.(2)将溶解后的样品1和样品2等当量混合,加入氯化钙溶液至终浓度为10mm,加入三(2-羧乙基)膦(tcep)溶液至终浓度为1mm,然后用缓冲盐调节至样品1和样品2总量的终浓度为500um,并调节ph=7.5;
169.(3)向反应液中加入sortase a蛋白溶液,至终浓度为50um;
170.(4)将反应液置于25℃水浴中进行反应,隔时取样;
171.(5)进分析型色谱监测,过夜能完全反应。
172.结果如图11所示,反应9h后几乎没有产物生成,因此,本对照例表明带有单位点替换的非硫酯短肽不能被sortase酶连接。
173.对比例3:带有双位点替换的识别序列的非硫酯短肽的酶连反应
174.1、带有替换序列的c末端为硫酯的第一多肽片段的制备:
175.(1)用肼树脂,通过固相多肽合成获取序列为tyr-ala-ala-ala-glu-thr-nhnh2(其中将天然识别序列leu-pro-glu-thr中的leu替换成了ala,pro替换成了ala)的短肽,通过制备型色谱分离纯化,并冻干,得到样品1。
176.2、n末端为g的第二多肽片段的制备:
177.(1)用rink酰胺树脂,通过固相多肽合成获取序列为gly-leu-arg-asp-tyr-pro-ala的短肽,通过制备型色谱分离纯化,并冻干,得到样品2。
178.3、sortase介导的两片段连接
179.(1)用缓冲盐(20mm 4-羟乙基哌嗪乙磺酸(hepes),100mm氯化钠(nacl),ph=6.0)分别溶解样品1和样品2两种多肽,至终浓度为4mm;
180.(2)将溶解后的样品1和样品2等当量混合,加入氯化钙溶液至终浓度为10mm,加入三(2-羧乙基)膦(tcep)溶液至终浓度为1mm,然后用用缓冲盐调节至终浓度为500um,并调节ph=7.5;
181.(3)向反应液中加入sortase a蛋白溶液,至终浓度为50um;
182.(4)将反应液置于25℃水浴中进行反应,隔时取样;
183.(5)进分析型色谱监测,过夜能完全反应。
184.结果如图12所示,与3h的反应色谱图相比,9h的产物峰并未发生变化,因此,该对比例的方法不适用于双位点替换的识别序列。
185.在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任
一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
186.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
