针对cd3和cd20的双特异性抗体
1.本技术是申请日为2016年1月8日的中国专利申请201680014755.4“针对cd3和cd20的双特异性抗体”的分案申请。
技术领域
2.本发明涉及针对cd3和cd20的双特异性抗体和这样的双特异性抗体的用途,特别是其在治疗其中表达cd20的细胞的特异性靶向和t细胞-介导的杀伤是需要的疾病中的用途。
背景技术:
3.已知cd3许多年,因此其已经成为许多方面的目标对象。特别是,针对cd3或t-细胞受体复合物(其一部分是cd3)产生的抗体是已知的。已经描述了五种人源化okt3效应子功能变体抗体的体外特征(xu et al., 2000, cell immunol. 200(1):16-26)。
4.在发生1型糖尿病后在缺少持续的免疫抑制药物疗法的情况下,用抗-cd3单克隆抗体hokt3gamma1(ala-ala)治疗导致c-肽反应和临床参数改善至少2年(herold et al., 2005, diabetes, 54(6):1763-9)。
5.已经描述了与食蟹猴和/或恒河猴cd3交叉反应的cd3抗体(wo2012162067, wo2008119567)。
6.一种改进靶向抗体疗法的有前景的方法是通过递送对表达抗原的癌症细胞特异性的细胞毒性细胞。这种使用t-细胞来有效杀伤肿瘤细胞的概念已描述于staerz, et. al., 1985, nature 314:628-631)。然而,初始的临床研究是相当令人失望的,主要是因为低的功效、严重的副作用(细胞因子风暴)和双特异性抗体的免疫原性(muller和kontermann, 2010, biodrugs 24: 89-98)。在设计和应用双特异性抗体中的进展已部分地克服了初始的细胞因子风暴障碍和改进了临床功效,而没有剂量限制性毒性(garber, 2014, nat. rev. drug discov. 13: 799-801;lum和thakur, 2011, biodrugs 25: 365-379)。如对于catumaxomab所述的(berek et al. 2014, int. j. gynecol. cancer 24(9): 1583-1589;mau-s
ø
rensen et al. 2015, cancer chemother. pharmacol. 75: 1065-1073),对于克服初始的细胞因子风暴障碍的关键在于缺少或沉默fc结构域。
7.cd20分子(亦称为人b-淋巴细胞-限制性分化抗原或bp35),是一种位于前-b和成熟b淋巴细胞上的疏水性跨膜蛋白,分子量为大约35 kd (valentine et al. (1989) j. biol. chem. 264(19):11282-11287;和einfield et al., (1988) embo j. 7(3):711-717)。cd20在来自外周血或淋巴器官的大于90%的b细胞的表面上发现,和在早期前-b细胞发育期间表达,和保持存在,直至浆细胞分化。cd20存在于正常b细胞以及恶性b细胞二者上。特别是,cd20在大于90%的b细胞非霍奇金氏淋巴瘤(nhl)上表达(anderson et al. (1984) blood 63(6):1424-1433),但未在造血干细胞、前-b细胞、正常浆细胞或其它正常组织上发现(tedder et al. (1985) j. immunol. 135(2):973-979)。
8.通过靶向cd20来治疗癌症以及自身免疫和免疫疾病的方法是本领域已知的。例
如,嵌合cd20抗体利妥昔单抗已用于或提议用于治疗癌症,例如非霍奇金氏淋巴瘤(nhl)、慢性淋巴细胞性白血病(cll)和小淋巴细胞性淋巴瘤(sll)。人单克隆cd20抗体奥法木单抗(ofatumumab)已尤其用于或提议用于治疗各种cll适应症、滤泡性淋巴瘤(fl)、视神经脊髓炎(nmo)、弥散性和复发缓解性多发性硬化(rrms)。人单克隆cd20抗体obinutuzumab已用于或提议用于治疗cll。此外,人源化cd20抗体ocrelizumab正开发用于rrms。
9.gall等(2005 experimental hematology 33: 452)公开了cd3xcd20双特异性抗体cd20bi,其自cd20-特异性嵌合抗体利妥昔单抗(rituxan)与抗-cd3 (orthoclone okt-3)的化学异质缀合产生。
10.stanglmaier等(2008 int. j. cancer: 123, 1181)描述了组合有cd20-特异性小鼠igg2a和cd3-特异性大鼠igg2b的三功能的双特异性抗-cd3x抗-cd20抗体bi20/fbta05。
11.wu等(2007 nat biotechnol. 25: 1290-1297)和wo2011014659描述了双-特异性(cd3和cd20)、四价免疫球蛋白g (双-可变结构域免疫球蛋白,dvd-ig)。
12.wo2011090762描述了cd3xcd20多肽异源二聚体的产生。
13.wo2011028952尤其描述了使用xencor的xmab双特异性fc结构域技术产生cd3xcd20双特异性分子。
14.wo2014047231描述了使用来自regeneron pharmaceuticals的fcδadp技术产生的regn1979和其它cd3xcd20双特异性抗体。
15.sun等(2015, science translational medicine 7, 287ra70)描述了使用“结节至孔(knobs-into-holes)”技术构建的b细胞
–
靶向的抗-cd20/cd3 t细胞
–
依赖性双特异性抗体。
16.结合cd3和cd20二者的双特异性抗体可用于其中表达cd20的细胞的特异性靶向和t细胞-介导的杀伤是需要的治疗性背景中,并且对于另外的有效cd3xcd20双特异性抗体仍存在需要。
技术实现要素:
17.本发明的目的是提供新的有效双特异性抗体,其包含源自cd3抗体的第一抗原结合区和源自cd20抗体的第二抗原结合区。
18.新的cd3xcd20双特异性抗体可用于其中表达cd20的细胞的特异性靶向和t细胞-介导的杀伤是需要的治疗性背景中。所述新的cd3xcd20双特异性抗体在杀伤表达cd20的细胞(包括具有低cd20拷贝数的细胞)中高度有效,并且已经表明在根除动物模型的肿瘤细胞中高度有效。所述新的cd3xcd20双特异性抗体通过以低剂量诱导快速和强杀伤细胞而是有利的。此外,所述新的cd3xcd20双特异性抗体能够通过cd4
t细胞和cd8
t细胞二者诱导细胞毒性,这使得它们适合于接合t细胞以杀伤cd20阳性肿瘤和涉及cd20阳性细胞的其它疾病。此外,cd3xcd20双特异性抗体有效耗尽来自淋巴结构的b细胞。因此,本发明的目的是提供双特异性cd3xcd20抗体,其能够通过cd4
t细胞和cd8
t细胞二者诱导细胞毒性。本发明的另一个目的是提供双特异性cd3xcd20抗体,其高度有效杀伤表达cd20的细胞,例如表达cd20的肿瘤细胞。本发明的另一个目的是提供双特异性cd3xcd20抗体,其高度有效杀伤表达cd20的癌症。
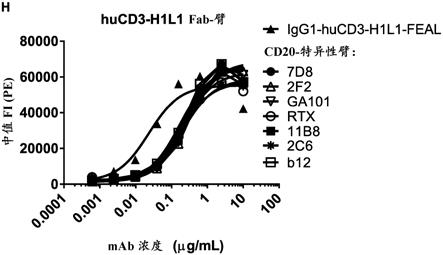
daudi细胞用基于两个不同的cd3臂(hucd3-h1l1-feal和huclb-t3/4-feal fab臂,分别通过空心和实心符号表示)和四个不同的cd20臂:7d8 (bsigg1-hucd3-h1l1-fealxcd20-7d8-fear和bsigg1-huclb-t3/4-fealxcd20-7d8-fear;[c])、11b8 (bsigg1-hucd3-h1l1-fealxcd20-11b8-fear和bsigg1-huclb-t3/4-fealxcd20-11b8-fear;[d])、ga101 (bsigg1-hucd3-h1l1-fealxcd20-ga101-fear和bsigg1-huclb-t3/4-fealxcd20-ga101-fear;[e])和2f2 (bsigg1-hucd3-h1l1-fealxcd20-2f2-fear和bsigg1-huclb-t3/4-fealxcd20-2f2-fear;[f])的cd3xcd20双特异性抗体孵育。(g-m) 不同的b-细胞系用作靶细胞和用所示的抗体孵育。cd3xcd20双特异性抗体包含所示的hucd3-h1l1-feal fab臂和不同的cd20 fab臂(7d8、11b8、2f2、ga101或rtx)。单独的cd3抗体是igg1-hucd3-h1l1。纯化的t细胞用作效应细胞。(n) daudi细胞用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear (cd3x7d8)、bsigg1-hucd3-h1l1-fealxcd20-2c6-fear (cd3x2c6)和bsigg1-hucd3-h1l1-fealxb12-fear (cd3xb12)孵育,纯化的t细胞用作效应细胞。显示的数据是一式三份孔的特异性溶胞的平均百分数
ꢀ±ꢀ
s.d,和各图的数据获自一个代表性实验。
[0023]
图4:通过bsigg1-hucd3-h1l1-fealxcd20-7d8-fear使用纯化的总t细胞(cd3
)、cd4
t细胞(cd3
cd8-)和cd8
t细胞(cd3
cd8
)作为效应细胞,剂量-依赖性体外诱导细胞毒性。daudi细胞用所示的不同t-细胞子集和bsigg1-hucd3-h1l1-fealxcd20-7d8-fear或对照抗体igg1-hucd3-h1l1-fealxb12-fear和igg1-7d8-fear (数据未显示)的稀释系列孵育。显示的数据是一式三份孔的肿瘤细胞溶胞的平均百分数
ꢀ±ꢀ
s.e.m (a, b)。
[0024]
图5:在daudi细胞中bsigg1-huclb-t3/4-fealxcd20-7d8-fear-依赖性的细胞毒性的动力学。daudi细胞用bsigg1-huclb-t3/4-fealxcd20-7d8-fear在自两个不同的供体(a和b)分离的纯化的t细胞的存在下孵育。在孵育4、12、24、48和72小时后(a)或在孵育3、16和24小时后(b)评价细胞毒性。显示的数据是对于不同的孵育时间,用bsigg1-huclb-t3/4-fealxcd20-7d8-fear孵育的细胞的一式三份孔的细胞杀伤百分数
ꢀ±ꢀ
s.d.。a和b中显示的数据来自使用自两个不同的供体分离的纯化的t细胞的两个独立的实验。
[0025]
图6:以不同的效应物:靶标比率通过cd3xcd20双特异性抗体的细胞毒性的体外诱导功效。细胞毒性测定法使用不同的cd3xcd20双特异性抗体和不同的e/t比率进行。cd3xcd20双特异性抗体包括bsigg1-hucd3-h1l1-fealxcd20-7d8-fear (a)、bsigg1-hucd3-h1l1-fealxcd20-11b8-fear (b)、bsigg1-hucd3-h1l1-fealxcd20-ga101-fear (c)、bsigg1-hucd3-h1l1-fealxcd20-rtx-fear (d)和bsigg1-hucd3-h1l1-fealxcd20-2f2-fear (e)。bsig1-huclb-t3/4-fealxb12-fear以10:1的e/t比率包括在内作为阴性对照。显示的数据是对于一个代表性实验,一式三份孔的溶胞平均百分数
±ꢀ
s.d.,如在细胞毒性测定法中所测定的。每条线表示不同的e/t比率(如所示的)。
[0026]
图7:cd3xcd20双特异性抗体在nod-scid小鼠的raji-luc共-移植模型中的细胞毒性活性。(a) 用指定剂量的溶媒(pbs)或bsigg1-hucd3-h1l1-fealxcd20-7d8-fear治疗的小鼠的平均肿瘤大小。误差棒表示s.e.m。(b) 在肿瘤接种后第21天,用pbs或bsigg1-hucd3-h1l1-fealxcd20-7d8-fear治疗后各个小鼠的肿瘤大小。第21天的数据的统计学分析使用kruskal wallis进行(dunn多重比较作为事后检验),**p《0.01。(c) kaplan-meier图,肿瘤大小截止设定在600 mm3。在bsigg1-hucd3-h1l1-fealxcd20-7d8-fear-治疗组和pbs-治疗对照组之间的存活差异的统计学显著性通过mantel cox分析评价。*p《0.05, **p
t3/4-fealxcd20-11b8-fear [huclb-t3/4x11b8], bsigg1-hucd3-h1l1-fealxcd20-ga101-fear [hucd3xga101], bsigg1-hucd3-h1l1-fealxcd20-rtx-fear [hucd3xrtx], bsigg1-hucd3-h1l1-fealxcd20-2c6-fear [hucd3x2c6])与在hek293f细胞中表达的野生型cd20 (a)和cd20突变体(cd20-axp) (b)的结合通过流式细胞术测量。显示的数据为一个代表性实验的平均荧光强度。
[0030]
图11:用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear孵育pbmc后的t细胞活化健康供体pbmc用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear或阳性和阴性对照抗体孵育,和t细胞活化通过测量t细胞群体(cd28
细胞)内的cd69表达评价。用自五个健康供体分离的pbmc进行实验。显示了两个代表性的供体的结果。
[0031]
表1
ch. 15。因此,嵌合抗体可以是基因工程改造或酶工程改造的重组抗体。产生嵌合抗体在技术人员的知识范围内,因此,本发明的嵌合抗体的产生可通过并非本文所述的其它方法进行。开发用于治疗应用的嵌合单克隆抗体以减少抗体免疫原性。它们通常可包含对目的抗原特异性的非-人(例如,鼠)可变区,和人恒定抗体重链和轻链结构域。嵌合抗体的情况下使用的术语“可变区”或“可变结构域”是指包含免疫球蛋白的重链和轻链二者的cdr和框架区的区域。
[0035]
如本文使用的术语“人源化抗体”是指基因工程改造的非-人抗体,其包含人抗体恒定结构域和非-人可变结构域,其经修饰以包含高水平的与人可变结构域的序列同源性。这可通过移植6个非-人抗体互补决定区(cdr)(它们一起形成抗原结合位点)到同源的人受体框架区(fr)上进行(参见wo92/22653和ep0629240)。为了完全重建亲本抗体的结合亲和力和特异性,可能需要将来自亲本抗体(即,非-人抗体)的框架残基置换成人框架区(回复突变)。结构同源性建模可有助于鉴定框架区中对于抗体的结合性质是重要的氨基酸残基。因此,人源化抗体可包含非-人cdr序列,主要是人框架区(任选包含一个或多个至非-人氨基酸序列的氨基酸回复突变),和全人恒定区。任选地,可应用另外的氨基酸修饰,其不一定是回复突变,以获得具有优选特征,例如亲和力和生物化学性质的人源化抗体。
[0036]
如本文使用的术语“人抗体”是指具有源自人种系免疫球蛋白序列的可变和恒定区的抗体。人抗体可包括并非由人种系免疫球蛋白序列编码的氨基酸残基(例如,由体外随机或位点-特异性诱变或由体内体细胞突变引入的突变)。然而,如本文使用的术语"人抗体"不意图包括其中源自另一哺乳动物物种(例如小鼠)的种系的cdr序列已被移植到人框架序列上的抗体。本发明的人单克隆抗体可通过各种技术产生,包括常规的单克隆抗体方法,例如,kohler和milstein, nature 256: 495 (1975)的标准的体细胞杂交技术。尽管体细胞杂交程序是优选的,在原则上,可使用用于产生单克隆抗体的其它技术,例如,b-淋巴细胞的病毒或致癌基因转化,或使用人抗体基因文库的噬菌体展示技术。
[0037]
用于制备分泌人单克隆抗体的杂交瘤的合适的动物系统是鼠系统。在小鼠中的杂交瘤产生是一个充分确立的程序。用于分离融合用的免疫脾细胞的免疫方案和技术是本领域已知的。融合配偶体(例如,鼠骨髓瘤细胞)和融合程序也是已知的。
[0038]
人单克隆抗体可使用带有部分的人免疫系统而非小鼠系统的转基因或转染色体小鼠产生。
[0039]
术语“免疫球蛋白”是指一类结构上相关的糖蛋白,其由两对多肽链组成,一对低分子量轻(l)链和一对重(h)链,所有四条链通过二硫键互相连接。免疫球蛋白的结构已被充分表征。参见例如fundamental immunology ch. 7 (paul, w., ed., 2nd ed. raven press, n.y. (1989))。简言之,每条重链通常包含重链可变区(在本文简称为vh或vh)和重链恒定区(在本文简称为ch或ch)。重链恒定区通常包含三个结构域ch1、ch2和ch3。每条轻链通常包含轻链可变区(在本文简称为v
l
或vl)和轻链恒定区(在本文简称为c
l
或cl)。轻链恒定区通常包含一个结构域c
l
。vh和v
l
区可进一步细分为高度可变的区域(或高变区,其可以在结构限定环的序列和/或形式方面是高度变化的),亦称为互补决定区(cdr),其与称为框架区(fr)的较保守的区域交替。每个vh和v
l
通常包含三个cdr和四个fr,从氨基端至羧基端按以下次序排列:fr1, cdr1, fr2, cdr2, fr3, cdr3, fr4 (亦参见chothia和lesk j. mol. biol. 196, 901-917 (1987))。除非另外说明或上下文矛盾,本文的cdr序列根据
imgt规则确定(brochet x., nucl acids res. 2008;36:w503-508和lefranc mp., nuclear acids research 1999;27:209-212;亦参见因特网http地址http://www.imgt.org/)。
[0040]
除非另外说明或上下文矛盾,在本发明中提及恒定区中的氨基酸位置是根据eu-编号进行的(edelman et al., proc natl acad sci u s a. 1969 may;63(1):78-85;kabat et al., sequences of proteins of immunological interest, fifth edition. 1991 nih publication no. 91-3242)。
[0041]
在本发明的情况下术语“抗体
”ꢀ
(ab)是指免疫球蛋白分子、免疫球蛋白分子的片段或其任一的衍生物,其具有在典型的生理条件下特异性结合抗原的能力,具有显著一段时间的半寿期,例如至少约30分钟、至少约45分钟、至少约1小时、至少约2小时、至少约4小时、至少约8小时、至少约12小时、约24小时或更多、约48小时或更多、约3、4、5、6、7或更多天等等,或任何其它相关的功能确定的时期(例如足以诱导、促进、提高和/或调节与抗体结合抗原有关的生理反应的时间,和/或抗体足以募集效应活性的时间)。免疫球蛋白分子的重链和轻链的可变区包含与抗原相互作用的结合结构域。抗体(ab)的恒定区可介导免疫球蛋白与宿主组织或因子的结合,包括免疫系统的各种细胞(例如,效应细胞)和补体系统的组分例如c1q,其为补体活化的经典途径的第一组分。如上所示,本文的术语抗体,除非另外说明或上下文明显矛盾,包括抗体的片段,其为抗原-结合片段,即保留特异性结合抗原的能力。已表明,抗体的抗原-结合功能可通过全长抗体的片段实现。在术语"抗体"内包括的抗原-结合片段的实例包括(i) fab’或fab片段,一种由v
l
, vh, c
l
和ch1结构域组成的单价片段,或wo2007059782这所述的单价抗体(genmab);(ii) f(ab')2片段,其为包含在铰链区通过二硫桥连接的两个fab片段的二价片段;(iii) fd片段,其基本上由vh和ch1结构域组成;(iv) fv片段,其基本上由抗体单臂的v
l
和vh结构域组成;(v) dab片段(ward et al., nature 341, 544-546 (1989)),其基本上由vh结构域组成和亦称为结构域抗体(holt et al;trends biotechnol. 2003 nov;21(11):484-90);(vi) 骆驼或纳米抗体(revets et al;expert opin biol ther. 2005 jan;5(1):111-24)和(vii) 分离的互补决定区(cdr)。此外,尽管fv片段的两个结构域,v
l
和vh,由单独的基因编码,但它们可使用重组方法,通过合成的接头连接,使得它们能够作为单一蛋白链产生,其中v
l
和vh区配对以形成单价分子(称为单链抗体或单链fv (scfv),参见例如bird et al., science 242, 423-426 (1988)和huston et al., pnas usa 85, 5879-5883 (1988))。这样的单链抗体包括在术语抗体的范围内,除非另外注明或上下文清楚指示。尽管这样的片段通常包括在抗体的含义内,但它们共同和各自单独地是本发明的独特特征,显示不同的生物学性质和功用。在本发明的情况下,这些和其它有用的抗体片段,以及这样的片段的双特异性形式,在本文进一步论述。还应理解,术语抗体,除非另外说明,还包括多克隆抗体、单克隆抗体(mab)、抗体-样多肽例如嵌合抗体和人源化抗体和保留特异性结合抗原的能力的抗体片段(抗原-结合片段),其通过任何已知的技术,例如酶裂解、肽合成和重组技术提供。产生的抗体可具有任何同种型。
[0042]
在本发明的情况下,术语“双特异性抗体”是指具有两个由不同的抗体序列定义的不同抗原结合区的抗体。
[0043]
当本文使用时,除非上下文矛盾,术语“fab-臂”或“臂”是指一个重链-轻链对和在
本文可与“半分子”互换使用。
[0044]
当本文使用时,除非上下文矛盾,术语“fc区”是指包含至少铰链区、ch2结构域和ch3结构域的抗体区。
[0045]
如本文使用的,术语"同种型"是指由重链恒定区基因编码的免疫球蛋白类别(例如igg1, igg2, igg3, igg4, igd, iga, ige或igm)。
[0046]
在本发明的情况下,术语“单价抗体”意指抗体分子能够结合抗原的单个分子,因此不能够进行抗原交联。
[0047]“cd20抗体”或“抗-cd20抗体”是上文所述的抗体,其特异性结合抗原cd20。
[0048]“cd3抗体”或“抗-cd3抗体”是上文所述的抗体,其特异性结合抗原cd3,特别是人cd3ε (epsilon)。
[0049]“cd3xcd20抗体”或“抗-cd3xcd20抗体”是双特异性抗体,其包含两个不同的抗原结合区,其中一个特异性结合抗原cd20和另一个特异性结合cd3。
[0050]
在优选的实施方案中,分离本发明的双特异性抗体。如本文使用的"分离的双特异性抗体"意指基本上不含具有不同的抗原特异性的其它抗体的双特异性抗体(例如,特异性结合cd20和cd3的分离的双特异性抗体基本上不含特异性结合cd20或cd3的单特异性抗体)。
[0051]
术语“表位”是指能够特异性结合抗体的蛋白决定簇。表位通常由表面簇集的分子,例如氨基酸或糖侧链组成,和通常具有特定的三维结构特征,以及特定的电荷特征。构象和非构象表位的不同之处在于与前者而非后者的结合在存在变性溶剂的情况下丢失。表位可包含直接参与结合的氨基酸残基和不直接参与结合的其它氨基酸残基,例如被特异性抗原结合肽有效封闭或覆盖的氨基酸残基(换句话说,氨基酸残基在特异性抗原结合肽的足迹内)。
[0052]
如本文使用的术语"单克隆抗体"是指具有单一分子组成的抗体分子的制备物。单克隆抗体组合物显示对特定表位的单一结合特异性和亲和力。因此,术语"人单克隆抗体"是指显示单一结合特异性的抗体,其具有源自人种系免疫球蛋白序列的可变和恒定区。人单克隆抗体可通过杂交瘤产生,所述杂交瘤包括获自具有包含人重链转基因和轻链转基因的基因组的转基因或转染色体的非-人动物、例如转基因小鼠的b细胞,其融合至永生细胞。
[0053]
如本文使用的,在抗体与预定抗原或表位结合的情况下术语"结合''通常是当在biacore 3000仪器上使用抗原作为配体和抗体作为分析物通过例如表面等离子体共振(spr)技术测定时,具有对应于k
d 约10-7 m或更小、例如约10-8 m或更小、例如约10-9 m或更小、约10-10 m或更小或约10-11 m或甚至更小的亲和力的结合,并且与其对于结合并非预定抗原或紧密相关的抗原的非-特异性抗原(例如,bsa、酪蛋白)的亲和力相比,以对应于低至少10倍、例如低至少100倍、例如低至少1,000倍、例如低至少10,000倍、例如低至少100,000倍的kd的亲和力结合预定抗原。亲和力降低的量取决于抗体的kd,使得当抗体的kd很低(即,抗体是高度特异的)时,则对抗原的亲和力低于对非-特异性抗原的亲和力的量可以是至少10,000倍。
[0054]
如本文使用的术语“kd”ꢀ
(sec-1
)是指特定抗体-抗原相互作用的离解速率常数。所述值亦称为k
off
值。
[0055]
如本文使用的术语"kd" (m)是指特定抗体-抗原相互作用的离解平衡常数。
[0056]
当本文使用时,术语“在第一和第二ch3区之间的异源二聚体相互作用
”ꢀ
是指在第一-ch3/第二-ch3异源二聚体蛋白中在第一个ch3区和第二个ch3区之间的异源二聚体相互作用。
[0057]
当本文使用时,术语“第一和第二ch3区的同源二聚体相互作用”是指在第一-ch3/第一-ch3同源二聚体蛋白中在第一个ch3区和另一个第一个ch3区之间的相互作用,和在第二-ch3/第二-ch3同源二聚体蛋白中在第二个ch3区和另一个第二个ch3区之间的相互作用。
[0058]
术语"还原条件"或"还原环境"是指其中底物,此处为抗体的铰链区中的半胱氨酸残基,更可能被还原而不是被氧化的条件或环境。
[0059]
本发明还提供了包含实施例的双特异性抗体的v
l
区、vh区或一个或多个cdr的功能性变体的双特异性抗体。用于双特异性抗体的情况下的v
l
、vh或cdr的功能性变体仍允许双特异性抗体的每个臂保留至少显著比例(至少约50%, 60%, 70%, 80%, 90%, 95%或更多)的亲本双特异性抗体的亲和力和/或特异性/选择性,和在一些情况下,这样的双特异性抗体可以比亲本双特异性抗体更大的亲和力、选择性和/或特异性缔合。
[0060]
这样的功能性变体通常保留与亲本双特异性抗体显著的序列同一性。两个序列之间的同一性百分比是序列共有的相同位置数的函数(即,%同源性 = 相同位置数/位置总数x 100),考虑空位数和每个空位的长度,其需要被引入用于两个序列的最佳比对。两个核苷酸或氨基酸序列之间的同一性百分比可例如,使用已并入align程序(版本2.0)的e. meyers和w. miller, comput. appl. biosci 4, 11-17 (1988)的算法,使用pam120权重残基表,12的空位长度罚分和4的空位罚分确定。此外,两个氨基酸序列之间的同一性百分比可使用needleman和wunsch, j. mol. biol. 48, 444-453 (1970)算法确定。
[0061]
实例性的变体包括主要通过保守置换而不同于亲本双特异性抗体序列的vh和/或vl和/或cdr区的那些;例如变体中的10,例如9, 8, 7, 6, 5, 4, 3, 2或1个置换是保守氨基酸残基置换。
[0062]
在本发明的情况下,保守置换可通过下表中反映的氨基酸类型内的置换来定义:保守置换的氨基酸残基类型在本发明的情况下,除非另外说明,以下注释用于描述突变;i) 在给定位置氨基酸置换书写为例如,k409r,其意思是位置409的赖氨酸置换为精氨酸;和ii) 对于特异性变体,使用特定的三个或一个字母代码,包括代码xaa和x以指示任何氨基酸残基。因此,位置409的赖氨酸置换为精氨酸称为:k409r,和位置409的赖氨酸置换为任何氨基酸残基称为k409x。在位置409的赖氨酸缺失的情况下,其表示为k409*。
[0063]
如本文使用的术语"重组宿主细胞"(或简称"宿主细胞")意指表达载体已引入其中的细胞,例如,编码本发明的抗体的表达载体。重组宿主细胞包括例如,转染瘤细胞,例如cho, cho-s, hek, hek293, hek-293f, expi293f, per.c6或ns0细胞和淋巴细胞。
[0064]
术语“治疗”是指为减轻、改善、停止或根除(治愈)症状或疾病状态的目的,给予有效量的本发明的治疗活性双特异性抗体。
[0065]
术语"有效量"或“治疗有效量”是指有效实现需要的治疗结果的量,实现需要的治疗结果所需要的剂量和时间。双特异性抗体的治疗有效量可根据因素例如疾病状况,个体的年龄、性别和体重,和双特异性抗体在个体中引发需要的反应的能力而改变。治疗有效量还是这样的量,其中抗体或抗体部分的任何毒性或有害作用被治疗有益作用超过。
[0066]
术语“抗-个体基因型抗体”是指识别通常与抗体的抗原-结合位点缔合的独特决定簇的抗体。
[0067]
本发明的其它方面和实施方案如上所述,本发明涉及包含两个不同的抗原结合区的双特异性抗体,其中一个具有对cd3的结合特异性和另一个具有对cd20的结合特异性。
[0068]
因此,本发明涉及双特异性抗体,其包含(i) 包含结合人cd3ε (epsilon)的第一抗原结合区的第一结合臂,其中所述第一抗原结合区包含a)分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3;b) 分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3;c)分别具有seq id no:73、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:73的x2选自m和p;d) 分别具有seq id no:74、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:74的x3是a;e)分别具有seq id no:1、75和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:75的x4是e;f)分别具有seq id no:1、2和77所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:77的x6选自f, g, i, k, l和n;g)分别具有seq id no:1、2和78所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:78的x7是p;h) 分别具有seq id no:1、2和79所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)
区cdr1、cdr2和cdr3,其中seq id no:79的x8选自a和g;i)分别具有seq id no:1、2和80所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:80的x8选自m, r和v;或j)分别具有seq id no:55、56和57所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:58所示的序列、序列dts和seq id no:59所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3;和(ii) 包含结合人cd20的第二抗原结合区的第二结合臂。
[0069]
由此提供对cd3ε具有不同的结合亲和力的双特异性抗体。在一个实施方案中,优选对cd3的结合亲和力低于对于亲本抗-cd3结合臂的亲和力。实验数据已表明,如上在c)-i)中所述的具有抗-cd3结合臂的双特异性cd3xcd20抗体(其具有降低对cd3ε的结合亲和力的置换)保持了亲本双特异性抗-cd3xcd20抗体的肿瘤杀伤功效。
[0070]
在一个实施方案中,本发明涉及双特异性抗体,其包含(i) 包含结合人cd3ε (epsilon)的第一抗原结合区的第一结合臂,其中所述第一抗原结合区包(a) 分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5或seq id no:54所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,或(b) 分别具有seq id no:55、56和57所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:58所示的序列、序列dts和seq id no:59所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3和(ii) 包含结合人cd20的第二抗原结合区的第二结合臂。
[0071]
在一个实施方案中,本发明涉及双特异性抗体,其包含包含结合人cd3ε (epsilon)的第一抗原结合区的第一结合臂,其中所述第一抗原结合区包含分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3。
[0072]
术语“包含抗原结合区的结合臂”意指包含抗原结合区的抗体分子或片段。因此,结合臂可以是例如,6个vh和vl cdr区、vh和vl序列、fab片段或半-分子抗体(即包含一条重链和一条轻链)。
[0073]
在一个实施方案中,第一抗原结合区包含第一重链可变序列(vh)和第一轻链可变序列(vl),和第二抗原结合区包含第二重链可变序列(vh)和第二轻链可变序列(vl)。
[0074]
在一个实施方案中,第一结合臂包含包含第一重链可变序列(vh)和第一重链恒定序列(ch)的第一重链和包含第一轻链可变序列(vl)和第一轻链恒定序列(cl)的第一轻链,和(ii) 第二结合臂包含包含第二重链可变序列(vh)和第二重链恒定序列(ch)的第二重链和第二轻链包含第二轻链可变序列(vl)和第二轻链恒定序列(cl)。
[0075]
在一个实施方案中,双特异性抗体是全长抗体,例如全长igg1抗体,例如,全长igg1,λ (lambda),κ (kappa)抗体或igg1,κ (kappa), κ (kappa)抗体。
[0076]
第一结合臂第一结合臂包含结合人cd3ε (epsilon)的第一抗原结合区,其中所述第一抗原结合区包含a)分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和
分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3;b) 分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3;c)分别具有seq id no:73、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:73的x2选自m和p;d) 分别具有seq id no:74、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:74的x3是a;e)分别具有seq id no:1、75和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:75的x4是e;f)分别具有seq id no:1、2和77所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:77的x6选自f, g, i, k, l和n;g)分别具有seq id no:1、2和78所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:78的x7是p;h) 分别具有seq id no:1、2和79所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:79的x8选自a和g;i)分别具有seq id no:1、2和80所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,其中seq id no:80的x8选自m, r和v;或j)分别具有seq id no:55、56和57所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:58所示的序列、序列dts和seq id no:59所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3。
[0077]
在一个实施方案中,第一结合臂包含结合人cd3ε (epsilon)的第一抗原结合区,其中所述第一抗原结合区包含(a) 分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5或seq id no:54所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,或(b) 分别具有seq id no:55、56和57所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:58所示的序列、序列dts和seq id no:59所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3。
[0078]
在一个实施方案中,第一结合臂包含结合人cd3ε (epsilon)的第一抗原结合区,其中所述第一抗原结合区包含分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3。
[0079]
上文(a)中定义的6个cdr序列源自称为sp34的小鼠抗体。该抗体的人源化形式已产生,和人源化抗体在本文称为hucd3和进一步公开于wo2015001085 (genmab)。
[0080]
上文(b)中定义的6个cdr序列源自huclb-t3/4。huclb-t3/4是鼠cd3抗体clb-t3/4的人源化形式(parren et al., res immunol. 1991, 142(9):749-63, 通过引用以其整体结合到本文中,包括序列公开内容)。简言之,使用imgt's v-quest将parren et al. (1991)中公布的clb-t3/4鼠vh和vl序列与人vh和vl库比对。发现的最接近的人种系是ighv3-21*01 (对于vh基因)和igkv3-11*01( igkj4*02) (对于vl基因)。在鼠vh和vl序列中所有不同的氨基酸残基被人等同物置换,除了clb-t3/4的cdr区内的那些之外。因为对于vh序列没有发现相关的j-区,共同的wgqgtlvtvss序列用于重链的fr4区。将两个序列克隆至相关的表达载体和通过共转染hek293f细胞表达。huclb-t3/4具有包含seq id no:17所示的序列的vh区(vh huclb-t3/4)和包含seq id no:18所示的序列的vl区(vl huclb-t3/4)。huclb-t3/4具有分别在seq id no:55、56和57中所示的vh cdr1、cdr2和cdr3序列,和分别在seq id no:58、序列dts和seq id no:59中所示的vl cdr1、cdr2和cdr3序列。
[0081]
各种人源化hucd3抗体和huclb-t3/4结合人cd3ε (epsilon)。
[0082]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一重链可变序列(vh),其中所述vh序列与选自以下的vh序列所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性:a) seq id no:6所示的vh序列;b) seq id no:7所示的vh序列;c) seq id no:8所示的vh序列;d) seq id no:9所示的vh序列;和e) seq id no:17所示的vh序列。
[0083]
在一个实施方案中,第一抗原结合区的vh序列选自:a) seq id no:6所示的vh序列;b) seq id no:7所示的vh序列;c) seq id no:8所示的vh序列;d) seq id no:9所示的vh序列;e) seq id no:17所示的vh序列。
[0084]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一抗原结合区的第一vl序列,其中所述vl序列与选自以下的vl序列所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性:a) seq id no:10所示的vl序列;b) seq id no:11所示的vl序列;c) seq id no:12所示的vl序列;和d) seq id no:18所示的vl序列。
[0085]
在一个实施方案中,第一抗原结合区的vl序列选自:seq id no:10所示的vl序列;a)seq id no:11所示的vl序列;b) seq id no:12所示的vl序列;和
c)seq id no:18所示的vl序列。
[0086]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一vh和vl序列,其中第一抗原结合区的所述vh和vl序列选自:a) seq id no:6所示的vh序列和seq id no:10所示的vl序列;b) seq id no:8所示的vh序列和seq id no:10所示的vl序列;c) seq id no:9所示的vh序列和seq id no:10所示的vl序列;d) seq id no:6所示的vh序列和seq id no:11所示的vl序列;e) seq id no:6所示的vh序列和seq id no:12所示的vl序列;f) seq id no:7所示的vh序列和seq id no:10所示的vl序列;g) seq id no:7所示的vh序列和seq id no:11所示的vl序列;h) seq id no:7所示的vh序列和seq id no:12所示的vl序列;i) seq id no:8所示的vh序列和seq id no:11所示的vl序列;j) seq id no:8所示的vh序列和seq id no:12所示的vl序列;k) seq id no:9所示的vh序列和seq id no:11所示的vl序列;l) seq id no:9所示的vh序列和seq id no:12所示的vl序列;和m) seq id no:17所示的vh序列和seq id no:18所示的vl序列。
[0087]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一vh和vl序列,其中第一抗原结合区的所述vh和vl序列选自:a) seq id no:6所示的vh序列和seq id no:10所示的vl序列;b) seq id no:17所示的vh序列和seq id no:18所示的vl序列。
[0088]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含seq id no: 17和18所示的第一vh和vl序列。
[0089]
在一个实施方案中,任何公开的实施方案定义的双特异性抗体包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少90%序列同一性,和与seq id no:10所示的vl序列具有至少90%序列同一性。在一个实施方案中,序列偏差位于框架序列而非cdr序列。因此,在一个实施方案中,本发明涉及双特异性抗体,包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少90%序列同一性,和与seq id no:10所示的vl序列具有至少90%序列同一性,其中对于重链的cdr序列示于seq id no:1、2和3,和对于轻链的cdr序列示于seq id no:4、序列gtn和seq id no:5所示的序列,使得cdr序列未突变。
[0090]
在一个实施方案中,任何公开的实施方案定义的双特异性抗体包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少95%序列同一性,和与seq id no:10所示的vl序列具有至少95%序列同一性。在一个实施方案中,本发明涉及双特异性抗体,其包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少95%序列同一性,和与seq id no:10所示的vl序列具有至少95%序列同一性,其中对于重链的cdr序列示于seq id no:1、2和3,和对于轻链的cdr序列示于seq id no:4、序列gtn和seq id no:5所示的序列,使得cdr序列未突变。
[0091]
在一个实施方案中,任何公开的实施方案定义的双特异性抗体包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少97%序列同一性,和与seq id no:10所示的vl序列具有至少97%序列同一性。在一个实施方案中,本发明涉及双特异性抗体,其包含第一
抗原结合区,其与seq id no:6所示的vh序列具有至少97%序列同一性,和与seq id no:10所示的vl序列具有至少97%序列同一性,其中对于重链的cdr序列示于seq id no:1、2和3,和对于轻链的cdr序列示于seq id no:4、序列gtn和seq id no:5所示的序列,使得cdr序列未突变。
[0092]
在一个实施方案中,任何公开的实施方案定义的双特异性抗体包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少98%序列同一性,和与seq id no:10所示的vl序列具有至少98%序列同一性。在一个实施方案中,本发明涉及双特异性抗体,其包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少98%序列同一性,和与seq id no:10所示的vl序列具有至少98%序列同一性,其中对于重链的cdr序列示于seq id no:1、2和3,和对于轻链的cdr序列示于seq id no:4、序列gtn和seq id no:5所示的序列,使得cdr序列未突变。
[0093]
在一个实施方案中,任何公开的实施方案定义的双特异性抗体包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少99%序列同一性,和与seq id no:10所示的vl序列具有至少99%序列同一性。在一个实施方案中,本发明涉及双特异性抗体,其包含第一抗原结合区,其与seq id no:6所示的vh序列具有至少99%序列同一性,和与seq id no:10所示的vl序列具有至少99%序列同一性,其中对于重链的cdr序列示于seq id no:1、2和3,和对于轻链的cdr序列示于seq id no:4、序列gtn和seq id no:5所示的序列,使得cdr序列未突变。
[0094]
由此提供本发明的双特异性抗体,其中vh和vl序列可在与亲本序列的至少90%序列同一性内改变。优选的是,变体具有与亲本抗体相同的性质。在某些实施方案中,序列仅在框架序列中改变,使得cdr序列与亲本cdr序列相同。
[0095]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一抗原结合区包含seq id no:6所示的vh序列和seq id no:10所示的vl序列。
[0096]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第一结合臂源自小鼠抗体。
[0097]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第一结合臂源自人源化抗体。
[0098]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第一结合臂源自全长抗体。
[0099]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第一结合臂源自全长igg1,λ (lambda)或igg1, κ (kappa)抗体。
[0100]
第二结合臂用作本发明的双特异性抗体的第二结合臂的合适的cd20抗体是这样的cd20抗体,其结合人cd20上的表位,其不包含或需要位置170的氨基酸残基丙氨酸或位置172的脯氨酸,但其包含或需要位置163的氨基酸残基天冬酰胺和位置166的天冬酰胺。这样的抗体的实例是称为2f2和7d8的抗体,如wo2004035607 (genmab)所公开的,和称为2c6的抗体,如wo2005103081 (genmab)所公开的。2f2、7d8和2c6的cdr序列公开于表1。
[0101]
用作本发明的双特异性抗体的第二结合臂的其它合适的cd20抗体是这样的cd20抗体,其结合人cd20上的表位,其不包含或需要位置170的氨基酸残基丙氨酸或位置172的
脯氨酸。这样的抗体的实例是11b8,如wo2004035607 (genmab)所公开的。11b8的cdr序列公开于表1。
[0102]
用作本发明的双特异性抗体的第二抗原结合区的其它合适的cd20抗体是具有低的功能性离解速率的cd20抗体,意味着该抗体在结合后自cd20缓慢离解。
[0103]
kd离解常数或k
off
速率可通过在wo2004035607的实施例5的标题“抗-cd20 f(ab)2片段的离解速率”下描述的方法测定。因此,在一个实施方案中,cd20抗体具有1.0 x-4 sec-1
或以下、例如8.0 x 10-5 sec-1
或以下、例如8.0 x 10-5 sec-1
至4.0 x 10-5 sec-1
范围内的kd离解常数,如通过上述方法测定的。
[0104]
用作本发明的双特异性抗体的第二结合臂的其它合适的cd20抗体是具有称为11b8的抗体的6个cdr序列的cd20抗体,如wo2004035607所公开的。11b8的cdr序列公开于表1。
[0105]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含结合人cd20的第二抗原结合区,所述第二抗原结合区包含具有选自以下的序列的重链可变(vh)区cdr1、cdr2和cdr3:(i) seq id no:32的vh cdr1区, seq id no:33的vh cdr2区, seq id no:34的vh cdr3区,(ii)seq id no:38的vh cdr1区, seq id no:39的vh cdr2区, seq id no:34的vh cdr3区,(iii)seq id no:42的vh cdr1区, seq id no:43的vh cdr2区, seq id no:44的vh cdr3区, 或(iv)seq id no:49的vh cdr1区, seq id no:50的vh cdr2区, seq id no:51的vh cdr3区。
[0106]
在优选的实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第二抗原结合区,其包含seq id no:32的vh cdr1区, seq id no:33的vh cdr2区和seq id no:34的vh cdr3区。
[0107]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含结合人cd20的第二抗原结合区,所述第二抗原结合区包含重链可变(vh)区cdr1、cdr2和cdr3和轻链可变(lh)区cdr1、cdr2和cdr3序列,其选自:(i)seq id no:32的vh cdr1区, seq id no:33的vh cdr2区, seq id no:34的vh cdr3区, seq id no:35的vl cdr1区, das的vl cdr2区和seq id no:36的vl cdr3区,(ii)seq id no:38的vh cdr1区, seq id no:39的vh cdr2区, seq id no:34的vh cdr3区, seq id no:35的vl cdr1区, das的vl cdr2区和seq id no:36的vl cdr3区,(iii)seq id no:42的vh cdr1区, seq id no:43的vh cdr2区, seq id no:44的vh cdr3区, seq id no:45的vl cdr1区, das的vl cdr2区和seq id no:46的vl cdr3区,(iv)seq id no:49的vh cdr1区, seq id no:50的vh cdr2区, seq id no:51的vh cdr3区, seq id no:52的vl cdr1区, das的vl cdr2区和seq id no:53的vl cdr3区,(v)seq id no:32的vh cdr1区, seq id no:33的vh cdr2区, seq id no:34的vh cdr3区, seq id no:45的vl cdr1区, das的vl cdr2区和seq id no:46的vl cdr3区,(vi)seq id no:32的vh cdr1区, seq id no:33的vh cdr2区, seq id no:34的
vh cdr3区, seq id no:52的vl cdr1区, das的vl cdr2区和seq id no:53的vl cdr3区,(vii)seq id no:38的vh cdr1区, seq id no:39的vh cdr2区, seq id no:34的vh cdr3区, seq id no:45的vl cdr1区, das的vl cdr2区和seq id no:46的vl cdr3区,(viii)seq id no:38的vh cdr1区, seq id no:39的vh cdr2区, seq id no:34的vh cdr3区, seq id no:52的vl cdr1区, das的vl cdr2区和seq id no:53的vl cdr3区,(ix)seq id no:42的vh cdr1区, seq id no:43的vh cdr2区, seq id no:44的vh cdr3区, seq id no:35的vl cdr1区, das的vl cdr2区和seq id no:36的vl cdr3区,(x)seq id no:42的vh cdr1区, seq id no:43的vh cdr2区, seq id no:44的vh cdr3区, seq id no:52的vl cdr1区, das的vl cdr2区和seq id no:53的vl cdr3区,(xi)seq id no:49的vh cdr1区, seq id no:50的vh cdr2区, seq id no:51的vh cdr3区, seq id no:35的vl cdr1区, das的vl cdr2区和seq id no:36的vl cdr3区, 或(xii)seq id no:49的vh cdr1区, seq id no:50的vh cdr2区, seq id no:51的vh cdr3区, seq id no:45的vl cdr1区, das的vl cdr2区和seq id no:46的vl cdr3区。
[0108]
在优选的实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第二抗原结合区,其包含seq id no:32的vh cdr1区, seq id no:33的vh cdr2区, seq id no:34的vh cdr3区, seq id no:35的vl cdr1区, das的vl cdr2区和seq id no:36的vl cdr3区。
[0109]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:27所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:28所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0110]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:37所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列和与seq id no:28所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0111]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:40所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0112]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:47所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0113]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:27所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0114]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:27所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0115]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:37所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0116]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:37所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0117]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:40所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:28所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0118]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:40所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0119]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:47所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:28所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0120]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含与seq id no:47所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列。
[0121]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第二vh和vl序列,其中第二抗原结合区的所述vh和vl序列选自:(i)seq id no:27的vh序列和seq id no:28的vl序列,(ii)seq id no:37的vh序列和seq id no:28的vl序列,(iii)seq id no:40的vh序列和seq id no:41的vl序列,(iv)seq id no:47的vh序列和seq id no:48的vl序列,(v)seq id no:27的vh序列和seq id no:41的vl序列,(vi)seq id no:27的vh序列和seq id no:48的vl序列,(vii)seq id no:37的vh序列和seq id no:41的vl序列,(viii)seq id no:37的vh序列和seq id no:48的vl序列,(ix)seq id no:40的vh序列和seq id no:28的vl序列,
(x)seq id no:40的vh序列和seq id no:48的vl序列,(xi)seq id no:47的vh序列和seq id no:28的vl序列, 或(xii)seq id no:47的vh序列和seq id no:41的vl序列。
[0122]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第二抗原结合区包含seq id no:27的vh序列和seq id no:28的vl序列。
[0123]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第二结合臂源自人抗体。
[0124]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第二结合臂源自全长抗体。
[0125]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体的第二结合臂源自igg1, κ (kappa)抗体。
[0126]
双特异性抗体形式本发明提供了双特异性cd3xcd20抗体,其有效促进表达cd20的肿瘤细胞的t细胞-介导的杀伤。根据特定用途需要的功能性质,可从本发明提供的抗体或抗原结合区的集合中选择特定的抗原结合区。双特异性抗体的许多不同的形式和用途是本领域已知的,和综述于kontermann;drug discov today, 2015 jul;20(7):838-47;和mabs, 2012 mar-apr;4(2):182-97。
[0127]
本发明的双特异性抗体不限于任何特定的双特异性形式或产生它的方法。
[0128]
可用于本发明的双特异性抗体分子的实例包含(i) 具有包含不同的抗原结合区的两个臂的单一抗体;(ii) 具有对两个不同的表位的特异性的单链抗体,例如,通过额外的肽接头串联连接的两个scfv;(iii) 双重-可变结构域抗体(dvd-ig),其中每条轻链和重链包含通过短的肽键串联的两个可变结构域(wu et al., generation and characterization of a dual variable domain immunoglobulin (dvd-ig
™
) molecule, in: antibody engineering, springer berlin heidelberg (2010));(iv) 化学连接的双特异性(fab’)2片段;(v) tandab,其为两个单链双抗体的融合物,产生四价双特异性抗体,其对每个靶抗原具有两个结合位点;(vi) flexibody,其为scfv与双抗体的组合,产生多价分子;(vii) 所谓的“停泊和锁定(dock and lock)”分子,根据蛋白激酶a中的“二聚化和停泊结构域”,其当应用于fab时,可得到由连接至不同的fab片段的两个相同的fab片段组成的三价双特异性结合蛋白;(viii) 所谓的scorpion分子,包含例如,融合至人fab-臂的两个末端的两个scfv;和(ix) 双抗体。
[0129]
在一个实施方案中,本发明的双特异性抗体是双抗体、交叉抗体或通过受控的fab-臂交换得到的双特异性抗体(例如描述于wo2011131746 (genmab))。
[0130]
不同类型的双特异性抗体的实例包括但不限于(i) igg-样分子,具有互补的ch3结构域以促成异源二聚化;(ii) 重组igg-样双重靶向分子,其中分子的两侧各自包含至少两种不同的抗体的fab片段或fab片段的一部分;(iii) igg融合分子,其中全长igg抗体融合至额外的fab片段或fab片段的一部分;(iv) fc融合分子,其中单链fv分子或稳定的双抗体融合至重链恒定-结构域、fc-区或其部分;(v) fab融合分子,其中不同的fab-片段融合在一起,融合至重链恒定-结构域、fc-区或其部分;和(vi) 基于scfv-和双抗体-和重链抗体(例如,结构域抗体、纳米抗体),其中不同的单链fv分子或不同的双抗体或不同的重链抗
体(例如,结构域抗体、纳米抗体)彼此融合,或与融合至重链恒定-结构域、fc-区或其部分的另一蛋白或载体分子融合。
[0131]
具有互补的ch3结构域分子的igg-样分子的实例包括但不限于triomab/quadroma分子(trionpharma/freseniusbiotech;roche,wo2011069104)、所谓的结节至孔分子(genentech,wo9850431)、crossmabs(roche,wo2011117329)和静电匹配的分子(amgen,ep1870459和wo2009089004;chugai,us201000155133;oncomed,wo2010129304)、luz-y分子(genentech,wraniketal.j.biol.chem.2012,287(52):43331-9,doi:10.1074/jbc.m112.397869.epub2012nov1)、dig-体和pig-体分子(pharmabcine,wo2010134666,wo2014081202)、链交换工程改造的结构域抗体(seedbody)分子(emdserono,wo2007110205)、biclonics分子(merus,wo2013157953)、fcδadp分子(regeneron,wo201015792)、双特异性igg1和igg2分子(pfizer/rinat,wo11143545)、azymetric支架分子(zymeworks/merck,wo2012058768)、mab-fv分子(xencor,wo2011028952)、二价双特异性抗体(wo2009080254)和duobody
®
分子(genmaba/s,wo2011131746)。
[0132]
重组igg-样双重靶向分子的实例包括但不限于双重靶向(dt)-ig分子(wo2009058383)、二合一抗体(two-in-oneantibody)(genentech;bostrom,etal2009.science323,1610
–
1614.)、交联mabs(karmanoscancercenter)、mab2(f-star,wo2008003116)、zybody分子(zyngenia;lafleuretal.mabs.2013mar-apr;5(2):208-18)、用共同轻链的方法(crucell/merus,us7,262,028)、κλbodies(novimmune,wo2012023053)和covx-体(covx/pfizer;doppalapudi,v.r.,etal2007.bioorg.med.chem.lett.17,501
–
506.)。
[0133]
igg融合分子的实例包括但不限于双重可变结构域(dvd)-ig分子(abbott,us7,612,181)、双重结构域双头抗体(unilever;sanofiaventis,wo20100226923)、igg-样双特异性分子(imclone/elililly,lewisetal.natbiotechnol.2014feb;32(2):191-8)、ts2ab(medimmune/az;dimasietal.jmolbiol.2009oct30;393(3):672-92)和bsab分子(zymogenetics,wo2010111625)、hercules分子(biogenidec,us007951918)、scfv融合分子(novartis)、scfv融合分子(changzhouadambiotechinc,cn102250246)和tvab分子(roche,wo2012025525,wo2012025530)。
[0134]
fc融合分子的实例包括但不限于scfv/fc融合物(pearceetal.,biochemmolbiolint.1997sep;42(6):1179-88)、scorpion分子(emergentbiosolutions/trubion,blankenshipjw,etal.aacr100thannualmeeting2009(abstract#5465);zymogenetics/bms,wo2010111625)、双重亲和力再靶向技术(fc-dart)分子(macrogenics,wo2008157379,wo2010080538)和双重(scfv)2-fab分子(nationalresearchcenterforantibodymedicine
–
china)。
[0135]
fab融合物双特异性抗体的实例包括但不限于f(ab)2分子(medarex/amgen;deoetaljimmunol.1998feb15;160(4):1677-86.)、双重作用或双-fab分子(genentech,bostrom,etal2009.science323,1610
–
1614.)、停泊和锁定(dnl)分子(immunomedics,wo2003074569,wo2005004809)、二价双特异性分子(biotecnol,schoonjans,jimmunol.2000dec15;165(12):7050-7.)和fab-fv分子(ucb-celltech,
wo 2009040562 a1)。
[0136]
基于scfv-、双抗体-和结构域抗体的实例包括但不限于双特异性t细胞engager (bite)分子(micromet, wo2005061547)、串联双抗体分子(tandab) (affimed) le gall et al., protein eng des sel. 2004 apr;17(4):357-66.)、双重亲和力再靶向技术(dart)分子(macrogenics, wo2008157379, wo2010080538)、单链双抗体分子(lawrence, febs lett. 1998 apr 3;425(3):479-84)、tcr-样抗体(ait, receptorlogics)、人血清白蛋白scfv融合物(merrimack, wo2010059315)和combody分子(epigen biotech, zhu et al. immunol cell biol. 2010 aug;88(6):667-75.)、双重靶向纳米抗体(ablynx, hmila et al., faseb j. 2010)和双重靶向仅重链结构域抗体。
[0137]
在一个方面,本发明的双特异性抗体包含包含第一ch3区的第一fc-区和包含第二ch3区的第二fc-区,其中第一和第二ch3区的序列不同,并使得在所述第一和第二ch3区之间的异源二聚体相互作用强于所述第一和第二ch3区的每个同源二聚体相互作用。关于这些相互作用和它们可如何实现的更多细节提供在wo2011131746和wo2013060867 (genmab)中,其通过引用结合到本文中。
[0138]
如本文进一步描述的,使用特定的方法,根据一种同源二聚体起始cd20抗体和一种同源二聚体起始cd3抗体(在ch3区中仅包含少量相当保守的非对称突变),可以高收率获得稳定的双特异性cd3xcd20抗体。非对称突变意味着所述第一和第二ch3区的序列包含在不相同的位置上的氨基酸置换。
[0139]
在一个方面,本文公开的任何实施方案中定义的双特异性抗体包含第一和第二重链,其中所述第一和第二重链各自包含至少铰链区、ch2和ch3区,其中在所述第一重链中对应于选自人igg1重链的t366, l368, k370, d399, f405, y407和k409的位置的位置的至少一个氨基酸已被置换,和在所述第二重链中对应于选自人igg1重链的t366, l368, k370, d399, f405, y407和k409的位置的位置的至少一个氨基酸已被置换,和其中所述第一和所述第二重链未在相同的位置上置换。
[0140]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一和第二重链,其中(i) 在所述第一重链中对应于人igg1重链的f405的位置的氨基酸是l,和在所述第二重链中对应于人igg1重链的k409的位置的氨基酸是r,或(ii) 在所述第一重链中对应于人igg1重链的k409的位置的氨基酸是r,和在所述第二重链中对应于人igg1重链的f405的位置的氨基酸是l。
[0141]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有选自366, 368, 370, 399, 405, 407和409的位置的氨基酸置换和第二fc-区具有选自366, 368, 370, 399, 405, 407和409的位置的氨基酸置换,和其中第一和第二fc-区未在相同的位置上置换。
[0142]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置366的氨基酸置换和所述第二fc-区具有选自368, 370, 399, 405, 407和409的位置的氨基酸置换。在一个实施方案中位置366的氨基酸选自ala, asp, glu, his, asn, val或gln。
[0143]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置368的氨基酸置换和所述第二fc-区具有选自366, 370, 399, 405, 407和409
的位置的氨基酸置换。
[0144]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置370的氨基酸置换和所述第二fc-区具有选自366, 368, 399, 405, 407和409的位置的氨基酸置换。
[0145]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置399的氨基酸置换和所述第二fc-区具有选自366, 368, 370, 405, 407和409的位置的氨基酸置换。
[0146]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置405的氨基酸置换和所述第二fc-区具有选自366, 368, 370, 399, 407和409的位置的氨基酸置换。
[0147]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置407的氨基酸置换和所述第二fc-区具有选自366, 368, 370, 399, 405和409的位置的氨基酸置换。
[0148]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区具有位置409的氨基酸置换和所述第二fc-区具有选自366, 368, 370, 399, 405和407的位置的氨基酸置换。
[0149]
因此,在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,所述第一和第二ch3区的序列包含非对称突变,即,在两个ch3区的不同位置的突变,例如,在一个ch3区中位置405的突变和在另一个ch3区中位置409的突变。
[0150]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一fc-区在位置409具有并非lys, leu或met的氨基酸,例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区具有在选自366, 368, 370, 399, 405和407的位置的氨基酸置换。在一个这样的实施方案中,所述第一fc-区在位置409具有并非lys, leu或met的氨基酸,例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区在位置405具有并非phe的氨基酸,例如,gly, ala, val, ile, ser, thr, lys, arg, his, asp, asn, glu, gln, pro, trp, tyr, cys, lys或leu。在其进一步的实施方案中,所述第一fc-区在位置409具有并非lys, leu或met的氨基酸,例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区在位置405具有并非phe, arg或gly的氨基酸,例如,leu, ala, val, ile, ser, thr, met, lys, his, asp, asn, glu, gln, pro, trp, tyr或cys。
[0151]
在本文公开的任何实施方案中定义的双特异性抗体的另一个实施方案中,所述第一fc-区包含位置405的phe和位置409的并非lys, leu或met的氨基酸,例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区包含位置405的并非phe的氨基酸,例如,gly, ala, val, ile, ser, thr, lys, arg, his, asp, asn, glu, gln, pro, trp, tyr, leu, met或cys和位置409的lys。在其进一步的实施方案中,所述第一fc-区包含位置405的phe和位置409的并非lys, leu或met的氨基酸,例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区包含位置405的并非phe, arg或gly的
氨基酸,例如,leu, ala, val, ile, ser, thr, met, lys, his, asp, asn, glu, gln, pro, trp, tyr或cys和位置409的lys。
[0152]
在本文公开的任何实施方案中定义的双特异性抗体的另一个实施方案中,所述第一fc-区包含位置405的phe和位置409的并非lys, leu或met的氨基酸,例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区包含位置405的leu和位置409的lys。在其进一步的实施方案中,所述第一fc-区包含位置405的phe和位置409的arg,和所述第二fc-区包含位置405的并非phe, arg或gly的氨基酸,例如,leu, ala, val, ile, ser, thr, lys, met, his, asp, asn, glu, gln, pro, trp, tyr或cys,和位置409的lys。在另一个实施方案中,所述第一fc-区包含位置405的phe和位置409的arg,和所述第二fc-区包含位置405的leu和位置409的lys。
[0153]
在本文公开的任何实施方案中定义的双特异性抗体的进一步的实施方案中,所述第一fc-区包含位置409的并非lys, leu或met的氨基酸, 例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区包含位置409的lys、位置370的thr和位置405的leu。在进一步的实施方案中,所述第一fc-区包含位置409的arg和所述第二fc-区包含位置409的lys、位置370的thr和位置405的leu。
[0154]
在本文公开的任何实施方案中定义的双特异性抗体的甚至进一步的实施方案,所述第一fc-区包含位置370的lys、位置405的phe和位置409的arg,和所述第二fc-区包含位置409的lys、位置370的thr和位置405的leu。
[0155]
在本文公开的任何实施方案中定义的双特异性抗体的另一个实施方案中,所述第一fc-区包含位置409的并非lys, leu或met的氨基酸, 例如,gly, ala, val, ile, ser, thr, phe, arg, his, asp, asn, glu, gln, pro, trp, tyr或cys,和所述第二fc-区包含位置409的lys,和:a) 位置350的ile和位置405的leu,或b) 位置370的thr和位置405的leu。
[0156]
在本文公开的任何实施方案中定义的双特异性抗体的另一个实施方案中,所述第一fc-区包含位置409的arg,和所述第二fc区包含位置409的lys,和:a) 位置350的ile和位置405的leu,或b) 位置370的thr和位置405的leu。
[0157]
在本文公开的任何实施方案中定义的双特异性抗体的另一个实施方案中,所述第一fc-区包含位置350的thr、位置370的lys、位置405的phe和位置409的arg,和所述第二fc区包含位置409的lys,和:a) 位置350的ile和位置405的leu,或b) 位置370的thr和位置405的leu。
[0158]
在本文公开的任何实施方案中定义的双特异性抗体的另一个实施方案中,所述第一fc-区包含位置350的thr、位置370的lys、位置405的phe和位置409的arg,和所述第二fc-区包含位置350的ile、位置370的thr、位置405的leu和位置409的lys。
[0159]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,所述第一fc-区具有位置409的并非lys, leu或met的氨基酸和所述第二fc-区具有位置405的并非phe, 例如位置405的并非phe, arg或gly的氨基酸;或所述第一ch3区具有位置409的并非lys, leu或met的氨基酸和所述第二ch3区具有位置407的并非tyr, asp, glu, phe, lys, gln, arg, ser或thr的氨基酸。
pro-ser-cys序列。
[0177]
在进一步的实施方案中,所述第一和所述第二fc-区二者在(核心)铰链区中均包含cys-pro-pro-cys序列。
[0178]
在单独和特定的实施方案中,一个或两个fab臂包含重链恒定区序列,其独立选自seq id no:63, 64, 65, 66, 67, 68, 69, 70和71 (见表1)。
[0179]
在本文公开的任何实施方案的双特异性抗体的一个实施方案中,(a) 第一抗原结合区包含分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,和(b) 结合人cd20的第二抗原结合区分别包含seq id no:32的vh cdr1区, seq id no:33的vh cdr2区, seq id no:34的vh cdr3区, seq id no:35的vl cdr1区, das的vl cdr2区和seq id no:36的vl cdr3区。
[0180]
在本文公开的任何实施方案的双特异性抗体的一个实施方案中, (a) 第一抗原结合区包含seq id no:6所示的vh序列和seq id no:10所示的vl序列和(b) 第二抗原结合区包含seq id no:27所示的vh序列和seq id no:28所示的vl序列.在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一抗原结合区是源自igg1-hucd3-h1l1-feal的fab臂和第二抗原结合区是源自igg1-7d8-fear的fab臂。
[0181]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一结合臂是源自igg1-hucd3-h1l1-feal的半-分子抗体(即,包含一条重链和一条轻链)和第二结合臂是源自igg1-7d8-fear的半-分子抗体。
[0182]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一结合臂是源自igg1-hucd3-h1l1-fear的半-分子抗体和第二结合臂是源自igg1-7d8-feal的半-分子抗体。
[0183]
制备双特异性抗体的方法传统方法,例如杂合杂交瘤和化学缀合方法(marvin和zhu (2005) acta pharmacol sin 26:649)可用于制备本发明的双特异性抗体。在宿主细胞中由不同重链和轻链组成的两种抗体的共-表达产生除了需要的双特异性抗体之外的可能的抗体产物的混合物,其可然后通过例如,亲和色谱或类似的方法分离。
[0184]
在共-表达不同的抗体构建体后有助于形成功能性双特异性产物的策略也可使用,例如,描述于lindhofer et al. (1995 j immunol 155:219)的方法。产生不同的抗体的大鼠和小鼠杂交瘤的融合,产生有限数量的异源二聚体蛋白,因为偏好的物种-限制性重链/轻链配对。促进形成异源二聚体超过同源二聚体的另一个策略是“结节至孔”策略,其中在第一重链多肽上引入结节(protuberance)和在第二重链多肽中引入相应的孔,使得在这两条重链的界面处结节可定位于孔中,以促进异源二聚体形成和阻碍同源二聚体形成。"结节"通过置换来自第一多肽的界面的小的氨基酸侧链为较大的侧链来构建。补偿性的与结节相同或类似大小的"孔"在第二多肽的界面通过置换大的氨基酸侧链为较小的侧链产生(us patent 5,731,168)。ep1870459 (chugai)和wo2009089004 (amgen)描述了有助于在宿主细胞中共-表达不同的抗体结构域后异源二聚体形成的其它策略。在这些方法中,在两个ch3结构域中构成ch3-ch3界面的一个或多个残基被置换为带电荷的氨基酸,使得同源二
聚体形成在静电上为不利的,和异源二聚化在静电上是有利的。wo2007110205 (merck)描述了又一种策略,其中利用iga和igg ch3结构域之间的差异以促进异源二聚化。
[0185]
用于产生双特异性抗体的另一种体外方法已描述于wo2008119353 (genmab),其中双特异性抗体通过在还原条件下孵育后在两个单特异性igg4-或igg4-样抗体之间“fab-臂”或“半-分子”交换形成(重链和连接的轻链的交换)。得到的产物是具有可包含不同的序列的两个fab臂的双特异性抗体。
[0186]
制备本发明的双特异性cd3xcd20抗体的优选方法包括wo2011131746和wo13060867 (genmab)中描述的方法,包括以下步骤:a)提供包含fc区的第一抗体,所述fc区包含第一ch3区;b)提供包含第二fc区的第二抗体,所述fc区包含第二ch3区,其中第一抗体是cd3抗体和第二抗体是cd20抗体,或反之亦然;其中所述第一和第二ch3区的序列是不同的和使得在所述第一和第二ch3区之间的异源二聚体相互作用强于所述第一和第二ch3区的每个同源二聚体相互作用;c)在还原条件下孵育所述第一抗体与所述第二抗体;和d)获得所述双特异性cd3xcd20抗体。
[0187]
在一个实施方案中,所述第一抗体与所述第二抗体一起在足以允许铰链区的半胱氨酸经历二硫键异构化的还原条件下孵育,其中在产生的异源二聚体抗体中在所述第一和第二抗体之间的异源二聚体相互作用使得在37
°ꢀ
c下在24小时后在0.5 mm gsh中没有发生fab-臂交换。
[0188]
不受理论的限制,在步骤c)中,亲本抗体的铰链区中的重链二硫键被还原和产生的半胱氨酸然后能够与另一亲本抗体分子(初始具有不同的特异性)的半胱氨酸残基形成重链间二硫键。在该方法的一个实施方案中,在步骤c)中的还原条件包括添加还原剂,例如,选自以下的还原剂:2-巯基乙基胺(2-mea)、二硫苏糖醇(dtt)、二硫赤藓糖醇(dte)、谷胱甘肽、三(2-羧乙基)膦(tcep)、l-半胱氨酸和β-巯基乙醇,优选地选自以下的还原剂:2-巯基乙基胺、二硫苏糖醇和三(2-羧乙基)膦。在进一步的实施方案中,步骤c)包含恢复条件为非还原的或较低还原的,例如通过除去还原剂,例如,通过脱盐。
[0189]
对于此方法,上述的任何cd3和cd20抗体可使用,包括第一和第二cd3和cd20抗体,各自包含第一和/或第二fc区。这样的第一和第二fc区的实例,包括这样的第一和第二fc区的组合,可包括上述那些的任何一种。在具体的实施方案中,第一和第二cd3和cd20抗体各自可经选择,使得获得本文所述的双特异性抗体。
[0190]
在该方法的一个实施方案中,所述第一和/或第二抗体是全长抗体。
[0191]
第一和第二抗体的fc区可具有任何同种型,包括但不限于igg1, igg2, igg3或igg4。在该方法的一个实施方案中,所述第一和所述第二抗体二者的fc区具有igg1同种型。在另一个实施方案中,所述抗体的一个fc区具有igg1同种型和另一个具有igg4同种型。在后一实施方案中,得到的双特异性抗体包含igg1的fc区和igg4的fc区,和可因此具有在效应子功能的活化方面的有价值的中间性质。
[0192]
在进一步的实施方案中,抗体起始蛋白之一经工程改造而不结合蛋白a,因此允许通过使产物经过蛋白a柱来分离异源二聚体蛋白与所述同源二聚体起始蛋白。
[0193]
如上所述,同源二聚体起始抗体的第一和第二ch3区的序列是不同的,和使得在所
述第一和第二ch3区之间的异源二聚体相互作用强于所述第一和第二ch3区的每个同源二聚体相互作用。关于这些相互作用和它们可如何实现的更多细节提供在wo2011131746和wo2013060867 (genmab)中,其通过引用以其整体结合到本文中。
[0194]
特别是,可根据各自结合cd3和cd20和在ch3区中仅包含少量相当保守的非对称突变的两种同源二聚体起始抗体,使用本发明的上述方法以高收率,获得稳定的双特异性cd3xcd20抗体。非对称突变意味着所述第一和第二ch3区的序列包含不相同位置的氨基酸置换。
[0195]
本发明的双特异性抗体还可通过编码第一和第二多肽的构建体在单一细胞中共-表达来获得。因此,在进一步的方面,本发明涉及产生双特异性抗体的方法,所述方法包括以下步骤:a) 提供第一核酸构建体,其编码包含第一抗体重链的第一fc区和第一抗原结合区的第一多肽,所述第一fc区包含第一ch3区,b) 提供第二核酸构建体,其编码包含第二抗体重链的第二fc区和第二抗原结合区的第二多肽,所述第二fc区包含第二ch3区,其中所述第一和第二ch3区的序列是不同的,和使得在所述第一和第二ch3区之间的异源二聚体相互作用强于所述第一和第二ch3区的每个同源二聚体相互作用,和其中所述第一同源二聚体蛋白具有位置409的并非lys, leu或met的氨基酸,和所述第二同源二聚体蛋白具有选自366, 368, 370, 399, 405和407的位置的氨基酸置换,任选地,其中所述第一和第二核酸构建体编码所述第一和第二抗体的轻链序列c) 在宿主细胞中共-表达所述第一和第二核酸构建体,和d) 从细胞培养物获得所述异源二聚体蛋白。
[0196]
因此,本发明还涉及重组真核或原核宿主细胞,其产生本发明的双特异性抗体。
[0197]
在本发明的一个实施方案中,双特异性抗体通过本发明的任何方法获得。
[0198]
用于产生抗体的合适的表达载体,包括启动子、增强子等,和合适的宿主细胞,是本领域众所周知的。宿主细胞的实例包括酵母、细菌和哺乳动物细胞,例如cho或hek细胞。
[0199]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一和第二ch3区,除了指定的突变之外,包含seq id no:60的序列(igg1m(a))。
[0200]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一fc-区和第二fc-区,其中所述第一和所述第二fc-区在铰链区中都不包含cys-pro-ser-cys序列。
[0201]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一fc-区和第二fc-区,其中所述第一和所述第二fc-区二者在铰链区中包含cys-pro-pro-cys序列。
[0202]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一fc-区和第二fc-区,其中第一和第二fc-区是人抗体fc-区。
[0203]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一fc-区和第二fc-区,其中所述第一和第二fc区,除了指定的突变外,包含独立选自seq id no:63, 64, 65, 66, 67, 68, 69, 70和71的序列。
[0204]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一
mmtv和hiv ltr启动子)、有效的多聚(a)终止序列、在大肠杆菌中质粒产物的复制起点、作为可选择标记的抗生素抗性基因和/或方便的克隆位点(例如,聚合接头)。核酸还可包含与组成型启动子相对的诱导型启动子,例如cmv ie。
[0215]
在一个实施方案中,cd20和/或cd3抗体-编码表达载体可通过病毒载体位于和/或递送至宿主细胞或宿主动物。
[0216]
在甚至进一步的方面,本发明涉及包含上文指定的第一和第二核酸构建体的宿主细胞。
[0217]
因此,本发明还涉及重组的真核或原核宿主细胞,其产生本发明的双特异性抗体,例如转染瘤。
[0218]
第一cd20-特异性抗体可在重组的真核或原核宿主细胞中表达,例如转染瘤,其产生本文定义的本发明的抗体,或本文定义的本发明的双特异性抗体。cd3-特异性抗体可同样地在重组的真核或原核宿主细胞中表达,例如转染瘤,其产生本文定义的本发明的抗体或本文定义的本发明的双特异性抗体。
[0219]
宿主细胞的实例包括酵母、细菌、植物和哺乳动物细胞,例如cho, cho-s, hek, hek293, hek-293f, expi293f, per.c6或ns0细胞或淋巴细胞。例如,在一个实施方案中,宿主细胞可包含稳定整合至细胞基因组的第一和第二核酸构建体。在另一个实施方案中,本发明提供包含非整合核酸、例如质粒、粘粒、噬菌粒或线性表达元件的细胞,其包含上文指定的第一和第二核酸构建体。
[0220]
在甚至进一步的方面,本发明涉及转基因非-人动物或植物,其包含编码一组或两组人重链和人轻链的核酸,其中所述动物或植物产生本发明的双特异性抗体。
[0221]
在进一步的方面,本发明涉及杂交瘤,其产生用于本文定义的本发明的双特异性抗体的抗体。在甚至进一步的方面,本发明涉及转基因非-人动物或植物,其包含编码一组或两组人重链和人轻链的核酸,其中所述动物或植物产生用于双特异性抗体的抗体或本发明的双特异性抗体。
[0222]
在一个方面,本发明涉及编码表1所列的一个或多个氨基酸序列的核酸构建体。
[0223]
在一个方面,本发明涉及表达载体,其包含(i)核酸序列,其编码根据本文公开的任一个实施方案的第一结合臂的重链序列;(ii)核酸序列,其编码根据本文公开的任一个实施方案的第一结合臂的轻链序列;(iii)核酸序列,其编码根据本文公开的任一个实施方案的第二结合臂的重链序列;(iv)核酸序列,其编码根据本文公开的任一个实施方案的第二结合臂的轻链序列;(v)(i)中所示的核酸和(ii)中所示的核酸;(vi)(iii)中所示的核酸和(iv)中所示的核酸;(vii)(i)、(ii)、(iii)和(iv)中所示的核酸。
[0224]
在一个方面,本发明涉及产生根据本文公开的任一个实施方案的双特异性抗体的方法,包括以下步骤:a)培养本文公开的宿主细胞,其包含本文公开的表达本文公开的第一抗体的表达
载体,和自培养基纯化所述抗体;b)培养本文公开的宿主细胞,其包含本文公开的表达本文公开的第二抗体的表达载体,和自培养基纯化所述抗体;c)在足以允许铰链区的半胱氨酸经历二硫键异构化的还原条件下孵育所述第一抗体以及所述第二抗体,和d)获得所述双特异性抗体。
[0225]
在一个方面,本发明涉及包含上文定义的表达载体的宿主细胞。在一个实施方案中,宿主细胞是重组真核、重组原核或重组微生物宿主细胞。
[0226]
fc区在本发明的一个方面,本发明的双特异性cd3xcd20抗体进一步包含第一fc区和第二fc区,其可包含在各自还包含上述第一和第二抗原结合区(或反之亦然)的第一和第二fab-臂中。
[0227]
在本发明的另一个方面,双特异性cd3xcd20抗体包含第一和第二fab-臂,其各自包含第一和第二抗原结合区。双特异性cd3xcd20抗体进一步包含第一和第二fc区。在本发明的一个方面,双特异性cd3xcd20抗体包含第一fab-臂,其包含第一抗原结合区和第一fc区,和第二fab-臂,其包含第二抗原结合区和第二fc区。
[0228]
在本发明的另一个方面,双特异性cd3xcd20抗体包含第二fab-臂,其包含第二抗原结合区和第一fc区,和第一fab-臂,其包含第一抗原结合区和第二fc区。
[0229]
第一和第二fc-区可各自具有任何同种型,包括但不限于igg1, igg2, igg3和igg4,和可包含一个或多个突变或修饰。在一个实施方案中,每个第一和第二fc区具有igg4同种型或自其衍生,任选地具有一个或多个突变或修饰。在一个实施方案中,每个第一和第二fc区具有igg1同种型或自其衍生,任选地具有一个或多个突变或修饰。在另一个实施方案中,一个fc区具有igg1同种型和另一个具有igg4同种型,或衍生自各自这样的同种型,任选地具有一个或多个突变或修饰。
[0230]
在一个实施方案中,一个或两个fc区包含除去asn-连接的糖基化的受体位点的突变,或以其它方式操作以改变糖基化性质。例如,在igg1 fc-区中,n297q突变可用于除去asn-连接的糖基化位点。因此,在具体实施方案中,一个或两个fc-区包含具有n297q突变的igg1野生型序列(seq id no:66,见表1)。
[0231]
在一个实施方案中,一个或两个fc-区是效应子-功能缺陷的。例如,fc-区可具有igg4同种型或非-igg4类型,例如,igg1, igg2或igg3,其已被突变,使得介导效应子功能例如adcc的能力降低或甚至消除。这样的突变已描述于例如,dall'acqua wf et al., j immunol. 177(2):1129-1138 (2006)和hezareh m, j virol.;75(24):12161-12168 (2001)。在一个实施方案中,一个或两个fc-区包含igg1野生型序列(seq id no:63,见表1)。
[0232]
本发明的双特异性抗体可包含fc区中的修饰。当双特异性抗体包含这样的修饰时,其可变成惰性或非活化的双特异性抗体。如本文使用的术语“惰性”、“惰性的”或“非活化的”是指至少不能通过单个抗体的两个fc区结合任何fcγ受体、诱导fc-介导的fcr交联或诱导fcr-介导的靶抗原交联,或不能结合c1q的fc区。人源化或嵌合cd3抗体的fc区的惰性有利地使用单特异性形式的抗体测试。
[0233]
数个变体可经构建以制备对与fcγ (gamma)受体和c1q相互作用无活性的抗体的fc区,用于治疗性抗体开发。这样的变体的实例在本文中描述。
[0234]
因此,在一个实施方案中,抗体包含fc区,其已经修饰,使得与野生型抗体相比,所述抗体介导fc-介导的t-细胞增殖减少至少50%, 至少60%, 至少70%, 至少80%, 至少90%, 至少99%或100%,其中所述t-细胞增殖在基于外周血单核细胞(pbmc)的功能测定法中测量。
[0235]
因此,fc区中在与c1q和fcγ受体的相互作用中起主要作用的氨基酸可被修饰。可被修饰的氨基酸位置的实例包括位置l234、l235和p331。其组合,例如l234f/l235e/p331s,可引起与人cd64、cd32a、cd16和c1q结合的显著降低。
[0236]
因此,在一个实施方案中,对应于l234、l235和p331的至少一个位置上的氨基酸可以分别是a、a和s (xu et al., 2000, cell immunol. 200(1):16-26; oganesyan et al., 2008, acta cryst. (d64):700-4)。此外,l234f和l235e氨基酸置换可产生具有与fcγ受体和c1q的相互作用废除的fc区(canfield et al., 1991, j. exp.med. (173):1483-91; duncan et al., 1988, nature (332):738-40)。因此,在一个实施方案中,对应于l234和l235的位置上的氨基酸可以分别是f和e。d265a氨基酸置换可降低与所有fcγ受体的结合和防止adcc (shields et al., 2001, j. biol. chem. (276):6591-604)。因此,在一个实施方案中,对应于d265的位置上的氨基酸可以是a。与c1q的结合可通过突变位置d270、k322、p329和p331而废除。突变这些位置成d270a或k322a或p329a或p331a的任一个可使抗体缺乏cdc活性(idusogie ee, et al., 2000, j immunol. 164: 4178-84)。因此,在一个实施方案中,对应于d270、k322、p329和p331的至少一个位置上的氨基酸可以分别是a、a、a和a。
[0237]
使fc区与fcγ受体和c1q相互作用最小化的备选方法为通过除去抗体的糖基化位点。突变位置n297为例如q、a或e除去对于igg-fcγ受体相互作用是关键的糖基化位点。因此,在一个实施方案中,对应于n297的位置上的氨基酸可以是g、q、a或e (leabman et al., 2013, mabs; 5(6):896-903)。使fc区与fcγ受体的相互作用最小化的另一备选方法可以通过以下突变获得:p238a、a327q、p329a或e233p/l234v/l235a/g236del (shields et al., 2001, j. biol. chem. (276):6591-604)。
[0238]
或者,尽管人igg2和igg4亚类被认为天然在它们与c1q和fcγ受体的相互作用中不足,但是仍有人报道了与fcγ受体的相互作用(parren et al., 1992, j. clin invest. 90: 1537-1546; bruhns et al., 2009, blood 113: 3716-3725)。废除这些残留相互作用的突变可在这两个同种型中进行,导致与fcr结合有关的不需要的副作用减少。对于igg2,这些包括l234a和g237a,和对于igg4,包括l235e。因此,在一个实施方案中,人igg2重链中对应于l234和g237的位置上的氨基酸可以分别是a和a。在一个实施方案中,人igg4重链中对应于l235的位置上的氨基酸可以是e。
[0239]
在igg2抗体中进一步使与fcγ受体和c1q相互作用最小化的其它方法包括描述于wo2011066501和lightle, s., et al., 2010, protein science (19):753-62中的那些。
[0240]
关于与fcγ受体和补体的相互作用,抗体的铰链区也可能是重要的(brekke et al., 2006, j immunol 177:1129-1138; dall’acqua wf, et al., 2006, j immunol 177:1129-1138)。因此,铰链区的突变或缺失可影响抗体的效应器功能。
[0241]
本文使用的术语“交联”是指通过带有fcr的细胞结合抗体fc区的结合靶抗原的抗
体fab臂(单价或二价)的间接桥连。因此,在带有靶抗原的细胞上结合其靶抗原的抗体可使所述细胞与表达fcr的另一细胞交联。
[0242]
本文使用的术语“非特异性杀伤”是指通过t细胞或其它效应细胞的细胞毒性功能,经过所述细胞的肿瘤靶抗原-非依赖性活化杀伤细胞。因此,非特异性杀伤意思是效应细胞,例如细胞毒性t细胞,被活化并诱导细胞毒性,其不依赖于肿瘤靶向结合,例如通过使抗体与cd3和fcγr结合。
[0243]
因此,在一个实施方案中,双特异性抗体包含第一和第二免疫球蛋白重链,其中在所述第一和第二免疫球蛋白重链的至少一个中,对应于人igg1重链的位置l234、l235、d265、n297和p331的位置上的一个或多个氨基酸分别不是l、l、d、n和p。
[0244]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的位置l234、l235、d265、n297和p331的位置上的一个或多个氨基酸分别不是l、l、d、n和p。
[0245]
在另一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的一个或多个氨基酸分别不是l、l和d,和对应于人igg1重链的n297和p331的位置上的氨基酸分别是n和p。
[0246]
本文使用的术语“对应于位置的氨基酸”是指人igg1重链的氨基酸位置编号。在其它免疫球蛋白中相应的氨基酸位置可通过与人igg1比对而发现。除非另外说明或上下文矛盾,恒定区序列的氨基酸在本文中根据eu编号索引(描述于kabat, e.a. et al., 1991, sequences of proteins of immunological interest. 5th edition
ꢀ‑ꢀ
us department of health and human services, nih publication no. 91-3242, pp 662, 680, 689)编号。因此,一个序列中“对应于”另一个序列中的氨基酸或区段的氨基酸或区段是使用标准序列比对程序例如align、clustalw或类似程序,通常以默认设置与其它氨基酸或区段比对,并与人igg1重链具有至少50%、至少80%、至少90%或至少95%同一性的氨基酸或区段。本领域众所周知的是,如何比对序列或序列中的区段和从而确定序列中与本发明的氨基酸位置相应的位置。
[0247]
在本发明的背景下,氨基酸可如上文所述定义。
[0248]
术语“氨基酸不是”或类似用语当涉及重链中的氨基酸时,应理解为意思是氨基酸是并非提及的特定氨基酸的任何其它氨基酸。例如,对应于人igg1重链的l234的位置上的氨基酸不是l,意思是氨基酸可以是除了l之外的任何其它天然或非天然存在的氨基酸。
[0249]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸不是d。
[0250]
在一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的d265的位置上的氨基酸不是d,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0251]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸是疏水的或极性的氨基酸。
[0252]
本文使用的关于氨基酸残基的术语“疏水的”是指选自a、c、f、g、h、i、l、m、r、t、v、w和y的氨基酸残基。因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自由a、c、f、g、h、i、l、m、r、t、v、w和y组成的氨基酸。
[0253]
本文使用的关于氨基酸残基的术语“极性的”是指选自c、d、e、h、k、n、q、r、s和t的任何氨基酸残基。因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人重链的位置d265的位置上的氨基酸选自c、e、h、k、n、q、r、s和t。
[0254]
在另一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸是脂族不带电荷、芳族或酸性氨基酸。
[0255]
本文使用的关于氨基酸残基的术语“脂族不带电荷”是指选自a、g、i、l和v的任何氨基酸残基。因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、g、i、l和v。
[0256]
本文使用的关于氨基酸残基的术语“芳族”是指选自f、t和w的任何氨基酸残基。因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自f、t和w。
[0257]
本文使用的关于氨基酸残基的术语“酸性”是指选自d和e的任何氨基酸残基。因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自d和e。
[0258]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、e、f、g、i、l、t、v和w。
[0259]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸不是d。
[0260]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的d265的位置上的氨基酸不是d,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0261]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸是疏水的或极性的氨基酸。
[0262]
因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自由a、c、f、g、h、i、l、m、r、t、v、w和y组成的氨基酸。
[0263]
因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人重链的位置d265的位置上的氨基酸选自c、e、h、k、n、q、r、s和t。在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自由a、c、f、g、h、i、l、m、r、t、v、w和y组成的氨基酸。
[0264]
在一个实施方案中,在所述第一和第二重链两者中,对应于人重链的位置d265的位置上的氨基酸选自c、e、h、k、n、q、r、s和t。
[0265]
在另一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸是脂族不带电荷、芳族或酸性氨基酸。
[0266]
因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、g、i、l和v。
[0267]
因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自f、t和w。
[0268]
因此,在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自d和e。
[0269]
在具体的实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置
d265的位置上的氨基酸选自a、e、f、g、i、l、t、v和w。
[0270]
在进一步的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置n297的位置上的氨基酸不是n。
[0271]
在一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的n297的位置上的氨基酸不是n,和对应于人igg1重链的位置p331的位置上的氨基酸是p。
[0272]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置n297的位置上的氨基酸不是n。
[0273]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的n297的位置上的氨基酸不是n,和对应于人igg1重链的位置p331的位置上的氨基酸是p。
[0274]
在进一步的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸分别不是l和l。
[0275]
在一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的l234和l235的位置上的氨基酸分别不是l和l,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0276]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的氨基酸选自a、c、d、e、f、g、h、i、k、m、n、p、q、r、s、t、y、v。
[0277]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸是疏水的或极性的氨基酸。
[0278]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、f、g、h、i、m、r、t、v、w和y。
[0279]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自由c、d、e、h、k、n、q、r、s和t组成的氨基酸。
[0280]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、d、e、f、g、h、i、k、m、n、q、r、s、t、v、w和y。
[0281]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸分别不是l和l。
[0282]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的l234和l235的位置上的氨基酸分别不是l和l,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0283]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的l234和l235的位置上的氨基酸是疏水的或极性的氨基酸。
[0284]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、f、g、h、i、m、r、t、v、w和y。
[0285]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自由c、d、e、h、k、n、q、r、s和t组成的氨基酸。
[0286]
在具体的实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、d、e、f、g、h、i、k、m、n、q、r、s、t、v、w和y。
[0287]
在另一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸是脂族不带电荷、芳族或酸性氨基酸。
[0288]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、g、i和v。
[0289]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自f、t和w。
[0290]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自d和e。
[0291]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于l234和l235的位置上的氨基酸各自选自a、d、e、f、g、i、t、v和w。
[0292]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸分别是f和e;或a和a。
[0293]
在一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的l234和l235的位置上的氨基酸分别是f和e;或a和a,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0294]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸分别是f和e;或a和a。
[0295]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的l234和l235的位置上的氨基酸分别是f和e;或a和a,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0296]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸分别是f和e。
[0297]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸分别是f和e。
[0298]
在一个实施方案中,在所述第一和第二重链的至少一个中,至少对应于人igg1重链的位置l234和l235的位置上的氨基酸分别是a和a。
[0299]
在一个实施方案中,在所述第一和第二重链两者中,至少对应于人igg1重链的位置l234和l235的位置上的氨基酸分别是a和a。
[0300]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别不是l、l和d。
[0301]
在一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的l234、l235和d265的位置上的氨基酸分别不是l、l和d,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0302]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的氨基酸选自a、c、d、e、f、g、h、i、k、m、n、p、q、r、s、t、y、v和w,和对应于位置d265的氨基酸选自a、c、e、f、g、h、i、k、l、m、n、p、q、r、s、t、y、v和w。
[0303]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸是疏水的或极性的氨基酸。
[0304]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、c、f、g、h、i、l、m、r、t、v、w和y,和对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、f、g、h、i、m、r、t、v、w和y。
[0305]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自c、d、e、h、k、n、q、r、s和t,对应于人重链的位置d265的位置上的氨基酸选自c、e、h、k、n、q、r、s和t。
[0306]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、d、e、f、g、h、i、k、m、n、q、r、s、t、v、w和y,和对应于人igg1重链的位置d265的位置上的氨基酸选自a、c、e、f、g、h、i、k、l、m、n、q、r、s、t、v、w和y。
[0307]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的l234、l235和d265的位置上的氨基酸是疏水的或极性的氨基酸。
[0308]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、c、f、g、h、i、l、m、r、t、v、w和y,和对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、f、g、h、i、m、r、t、v、w和y。
[0309]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自c、d、e、h、k、n、q、r、s和t,对应于人重链的位置d265的位置上的氨基酸选自c、e、h、k、n、q、r、s和t。
[0310]
在具体的实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、c、d、e、f、g、h、i、k、m、n、q、r、s、t、v、w和y,和对应于人igg1重链的位置d265的位置上的氨基酸选自a、c、e、f、g、h、i、k、l、m、n、q、r、s、t、v、w和y。
[0311]
在另一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸是脂族不带电荷、芳族或酸性氨基酸。
[0312]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、g、i、l和v,和对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、g、i和v。
[0313]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸各自选自f、t和w。
[0314]
因此,在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸各自选自d和e。
[0315]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、e、f、g、i、l、t、v和w,和对应于l234和l235的位置上的氨基酸各自选自a、d、e、f、g、i、t、v和w。
[0316]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别不是l、l和d。
[0317]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的l234、l235和d265的位置上的氨基酸分别不是l、l和d,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0318]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的l234、l235和d265的位置上的氨基酸是脂族不带电荷、芳族或酸性氨基酸。
[0319]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置
d265的位置上的氨基酸选自a、g、i、l和v,和对应于人igg1重链的位置l234和l235的位置上的氨基酸各自选自a、g、i和v。
[0320]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸各自选自d和e。
[0321]
在具体的实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置d265的位置上的氨基酸选自a、e、f、g、i、l、t、v和w,和对应于l234和l235的位置上的氨基酸各自选自a、d、e、f、g、i、t、v和w。
[0322]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a;或a、a和a。
[0323]
在一个实施方案中,在第一和第二重链的至少一个中,对应于人igg1重链的l234、l235和d265的位置上的氨基酸分别是f、e和a;或a、a和a,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0324]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a;或a、a和a。
[0325]
在一个实施方案中,在第一和第二重链两者中,对应于人igg1重链的l234、l235和d265的位置上的氨基酸分别是f、e和a;或a、a和a,和对应于人igg1重链的位置n297和p331的位置上的氨基酸分别是n和p。
[0326]
在具体的实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0327]
在一个特别优选的实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0328]
在一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是a、a和a。
[0329]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是a、a和a。
[0330]
在另一个实施方案中,在所述第一和第二重链的至少一个中,对应于人igg1重链的位置l234、l235、d265、n297和p331的位置上的氨基酸分别是f、e、a、q和s。
[0331]
在一个实施方案中,在所述第一和第二重链两者中,对应于人igg1重链的位置l234、l235、d265、n297和p331的位置上的氨基酸分别是f、e、a、q和s。
[0332]
在具体的实施方案中,本发明的抗体包含seq id no:8所示的vh序列、seq id no:10所示的vl序列,和在至少一个重链中对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0333]
在另一个实施方案中,本发明的抗体包含seq id no:8所示的vh序列、seq id no:12所示的vl序列,和在至少一个重链中对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0334]
在另一个实施方案中,本发明的抗体包含seq id no:6所示的vh序列、seq id no:10所示的vl序列,和在至少一个重链中对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0335]
在另一个实施方案中,本发明的抗体包含seq id no:6所示的vh序列、seq id no:
12所示的vl序列,和在至少一个重链中对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0336]
在另一个实施方案中,本发明的抗体包含seq id no:9所示的vh序列、seq id no:10所示的vl序列,和在至少一个重链中对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0337]
在另一个实施方案中,本发明的抗体包含seq id no:9所示的vh序列、seq id no:12所示的vl序列,和在至少一个重链中对应于人igg1重链的位置l234、l235和d265的位置上的氨基酸分别是f、e和a。
[0338]
在一个方面,本发明的双特异性抗体包含seq id no:29的人iglc2/iglc3恒定结构域λ轻链。
[0339]
用fc区中的一个或多个氨基酸置换,产生数个抗体变体。未活化的fc区阻止抗体与血细胞(例如单核细胞)中存在的fc-受体相互作用,或阻止抗体与c1q相互作用以活化经典补体途径。在包含fc区的不同的氨基酸置换组合的抗体变体中测试fc活性降低。最多5个氨基酸置换被引入,其包括突变n297q, l234a, l235a, l234f, l235e, d265a和p331s。这5个氨基酸位置的一个或多个中的置换被引入k409r和/或f405l igg1骨架。产生huclb-t3/4抗体的以下fc区变体:n297q (是指n297q置换,称为igg1-huclb-t3/4-n297q), lfle (是指l234f/l235e置换,称为igg1-huclb-t3/4-lfle), lala (是指l234a/l235a置换,称为igg1-huclb-t3/4-lala), lflenq (是指l234f/l235e/n297q置换,称为igg1-huclb-t3/4-lflenq), lfleda (是指l234f/l235e/d265a置换,称为igg1-huclb-t3/4-lfleda), da (是指d265a置换,称为igg1-huclb-t3/4-da), daps (是指d265a/p331s置换,称为igg1-huclb-t3/4-daps), danq (是指d265a/n297q置换,称为igg1-huclb-t3/4-danq), lfleps (是指l234f/l235e/p331s置换,称为igg1-huclb-t3/4-lfleps)和lfledanqps (是指l234f/l235e/d265a/n297q/p331s置换,称为igg1-huclb-t3/4-lfledanqps)。
[0340]
特别是,在igg1-hucd3抗体变体中3个氨基酸置换的组合,其包括突变l234f, l235e和d265a和被称为lfleda或fea,被引入k409r和f405l igg1骨架以产生具有未活化fc区的抗体。得到的未活化抗体变体分别用后缀“fear”或“feal”表示。
[0341]
在一个方面,本发明的双特异性抗体可在轻链和/或重链中被修饰以增加表达水平和/或生产得率。在一个实施方案中,本发明的抗体可在轻链中被修饰。这样的修饰是本领域已知的和可根据描述于例如,zheng, l., goddard, j.-p., baumann, u., & reymond, j.-l. (2004). expressiopn improvement and mechanistic study of the retro-diels-alderase catalytic antibody 10f11 by site-directed mutagenesis. journal of molecular biology, 341(3), 807
–
14中的方法进行。
[0342]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一重链和第一轻链,其中第一轻链的对应于seq id no:10的λ轻链的位置t41的位置的氨基酸不是t。
[0343]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,对应于seq id no:10的λ轻链的位置t41的位置的氨基酸选自h, i, k, l, q, r和v。
[0344]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,对应于seq id no:10的λ轻链的位置t41的位置的氨基酸是h, k或r。
p和v。
[0356]
在一个实施方案中,本发明的双特异性抗体包含第一轻链,其中对应于位置r23的位置的氨基酸是a或g,例如a,和对应于位置a35的位置的氨基酸是p。
[0357]
在一个实施方案中,本发明的双特异性抗体包含第一轻链,其中对应于seq id no:10的λ轻链的位置f10, r23, a35, r47, d71, a82, d83, s86, i87和f89的位置的氨基酸分别不是f, r, a, r, d, a, d, s, i和f。
[0358]
在一个实施方案中,本发明的双特异性抗体包含第一轻链,其中对应于位置r23的位置的氨基酸选自a, g, h, k, q, s和t,例如选自a和g,其中对应于a35的位置的氨基酸选自i, l, m, p, v, g, f和w,例如选自i, l, m, p,和其中对应于seq id no:10的λ轻链的位置f10, r47, d71, a82, d83, s86, i87和f89的位置的氨基酸分别是l, t, g, p, e, a, e和y。
[0359]
在一个实施方案中,本发明的双特异性抗体包含第一轻链,其中对应于位置r23的位置的氨基酸是a或g,和其中对应于seq id no:10的λ轻链的位置f10, a35, r47, d71, a82, d83, s86, i87和f89的位置的氨基酸分别是l, p, t, g, p, e, a, e和y。
[0360]
在一个方面,本发明的双特异性抗体可在第一和/或第二轻链中被修饰以增加抗体的亲和力。
[0361]
在一个方面,本发明的双特异性抗体可在第一和/或第二结合臂的轻链中被修饰,以减少抗体的亲和力。这在一些情况下可能是有利的和导致增加的功效。特别是,第一结合臂的低亲和力(结合人cd3ε (epsilon))可对在循环和肿瘤部位中t细胞的运动性具有影响,因此导致t细胞与肿瘤细胞的更好接合,参见m
ø
lh
ø
j et al., molecular immunology 44 (2007)。特别是,这可用于双特异性形式,其中cd3抗体用作结合臂之一。导致抗体亲和力减少的修饰是本领域已知的,参见例如webster et al. int j cancer suppl. 1988;3:13-6。
[0362]
在一个实施方案中,本发明的双特异性抗体包含第一轻链,其中(i) 对应于seq id no:10的λ轻链的位置f10的位置的氨基酸不是f,或(ii) 对应于seq id no:10的λ轻链的位置k55的位置的氨基酸不是k,或(iii) 对应于seq id no:10的λ轻链的位置f10的位置的氨基酸不是f和对应于seq id no:10的λ轻链的位置k55的位置的氨基酸不是k。
[0363]
在一个实施方案中,本发明的抗体包含恒定轻链(lc),其中(i) 对应于seq id no:10的λ轻链的位置f10的位置的氨基酸是l,或(ii) 对应于seq id no:10的λ轻链的位置k55的位置的氨基酸是n,或(iii) 对应于seq id no:10的λ轻链的位置f10的位置的氨基酸是l和对应于seq id no:10的λ轻链的位置k55的位置的氨基酸是n。
[0364]
在一个实施方案中,本发明的双特异性抗体包含轻链,其中对应于seq id no:10的λ轻链的位置f10, t41, k55和l97的位置的氨基酸分别不是f, t, k和l。这样的修饰同时用于增加表达水平和减少亲和力。
[0365]
在一个实施方案中,本发明的双特异性抗体包含第一轻链,其中对应于seq id no:10的λ轻链的位置f10, t41, k55和l97的位置的氨基酸分别是l, k, n和h。这样的修饰同时用于增加表达水平和减少亲和力。
vh3和vh4和vl1, vl2和vl3的任何一个中,替换hucd3的cdr序列。在一个实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1。
[0369]
在进一步的实施方案中,cd3结合臂包含选自表2的6个cdr序列,其中seq id no:72的x1选自v, h, f, t, p, l, q, d, k, w, g, a, c和r;seq id no:73的x2选自n, a, h, q, p, f, m, y, l, w, d, e和c;seq id no:75的x4选自y, q, w, l, a, i, m, d, t, k, r, g, f, e, v, c和p;seq id no:76的x5选自n, l, y, w, h, m, g, f, k, s, v, r, q, d, c, e和p;seq id no:81的x
10
选自a, g, r, v, f, e, m, h, n, y, p, q, d, k和l;seq id no:83的x
12
选自d, k, q, g, v, e, t, n, y, s, p, w, f和m。
[0370]
与hucd3野生型cdr序列相比,这样的hucd3 cdr变体序列具有减少的结合亲和力。6个cdr序列可分别插入hucd3 vh和vl框架序列vh1, vh2, vh3和vh4和vl1, vl2和vl3的任何一个中,替换hucd3的cdr序列。在一个实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1中。在进一步的实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1中,其中vl1 (seq id no:10)的位置41的氨基酸t已被突变为k。
[0371]
在进一步的实施方案中,cd3结合臂包含选自表2的6个cdr序列,其中seq id no:72的x1选自l, p, q, d, k, w, s, g, a, c和r;seq id no:73的x2选自s, n, g, a, k, v, r, h, q, p, i, f, m, y, l, w, d, e和c;seq id no:74的x3选自m, w, g, q, v, t, s, l, p, i, a, k, r和c;seq id no:75的x4选自w, l, a, i, m, d, t, k, r, g, f, e, v, c和p;seq id no:76的x5选自c, e, p和t;seq id no:77的x6选自a, s, v, n, k, l, t, i, p, q, c, g, y, w, f和r;seq id no:78的x7选自p, c, s和t;seq id no:79的x8选自a, t, g, l, n, c, p, f, q, h, r, k, e, w和y ;seq id no:80的x9选自p, l, t, c, a, i, l, q, v, e, m, k, r, g和p;seq id no:81的x
10
选自e, h, i, m, n, y, p, q, d, k和l;seq id no:82的x
11
选自f, y, i, t, v, m, a, s, n, g, w, e, k, p, r和d;和seq id no:83的x
12
选自g, y, v, n, t, s, h, e, p, w, f和m。
[0372]
与hucd3野生型cdr序列相比,这样的hucd3 cdr变体序列具有减少的结合亲和力。6个cdr序列可分别插入hucd3 vh和vl框架序列vh1, vh2, vh3和vh4和vl1, vl2和vl3的任一个中,替换hucd3的cdr序列。在一个实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1。在进一步的实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1,其中vl1 (seq id no:10)的位置41的氨基酸t已被突变为k。
[0373]
在又一个实施方案中,cd3结合臂包含选自下文表3所述的cdr序列的6个cdr序列,其中seq id no:73的x2选自m和p;seq id no:74的x3是a;
seq id no:75的x4是e;seq id no:77的x6选自f, g, i, k, l和n;seq id no:78的x7是p;seq id no:79的x8选自a和g;和seq id no:80的x9选自m, r和v。
[0374]
表3与hucd3野生型cdr序列相比,这样的hucd3 cdr变体序列具有减少的结合亲和力。6个cdr序列可分别插入hucd3 vh和vl框架序列vh1, vh2, vh3和vh4和vl1, vl2和vl3的任一个中,替换hucd3的cdr序列。在一个实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1。在进一步的实施方案中,6个cdr序列插入hucd3框架序列vh1和vl1,其中vl1 (seq id no:10)的位置41的氨基酸t已被突变为k。
[0375]
在本文公开的任何实施方案中定义的双特异性抗体的进一步的实施方案中,第一结合臂源自cd3抗体,其具有大于3.4x10-8 m的对人cd3ε的结合亲和力值(kd),如通过bio-layer干涉测量法所测定的,例如3.5x10-8 m至9.9x10-8 m,或1.0x10-7 m至9.9x10-7 m,如通过bio-layer干涉测量法所测定的。
[0376]
在本发明的进一步的实施方案中,形成双特异性抗体的部分的一种或两种抗体已被工程改造,以减少或增加与新生fc受体(fcrn)的结合,以操纵双特异性抗体的血清半寿期。增加或减少血清半寿期的技术是本领域众所周知的。参见例如dall’acqua et al. 2006, j. biol. chem., 281:23514-24;hinton et al. 2006,j. immunol., 176:346-56;和zalevsky et al. 2010 nat. biotechnol., 28:157-9。
[0377]
在一个方面,本文公开的任何实施方案中定义的双特异性抗体包含第一恒定重链(hc)和第一恒定轻链(lc),其中第一重链和第二重链二者的对应于seq id no:15的人igg1重链的位置l234, l235和d265的位置分别是f, e和a。
[0378]
在一个实施方案中,本文公开的任何实施方案中定义的双特异性抗体包含第一和第二恒定重链(hc)和第一和第二恒定轻链(lc),其中第一重链和第二重链二者的对应于seq id no:15的人igg1重链的位置l234和l235的位置分别是f和e。
[0379]
在本文公开的任何实施方案中定义的双特异性抗体的一个实施方案中,第一结合臂是源自igg1-hucd3-h1l1-fear的fab臂,和第二结合臂是源自igg1-7d8-feal的fab臂。
[0380]
在本文中,hucd3-h1l1是指人源化sp34抗-cd3抗体,其具有表1中作为seq id no: 6和10示出的vh1和vl1。feal是指抗体的恒定区中的l234f, l235e和d265a和f405l突变,而fear是指抗体的恒定区中的l234f, l235e和d265a和k409r突变,其中氨基酸位置对应于人
in
ꢀ‘
the pharmacology of monoclonal antibodies’, vol. 113, rosenburg and moore eds. springer-verlag, new york, pp. 269-315 (1994), bird et al., science 242, 423-426 (1988), huston et al., pnas usa 85, 5879-5883 (1988)和mccafferty et al., nature 348, 552-554 (1990)。双特异性抗体然后可自来自单链cd20抗体和单链cd3抗体的两个vh和v
l
形成,或多价抗体自两个以上的vh和v
l
链形成。
[0388]
在一个实施方案中,用于产生本发明的特异性抗体的cd3和cd20单克隆抗体的一个或两个fc-区是效应子功能缺陷的。
[0389]
缀合物在进一步的方面,本发明提供连接或缀合至一个或多个治疗部分,例如细胞因子、免疫抑制剂、免疫刺激分子和/或放射性同位素的双特异性cd3xcd20抗体。这样的缀合物在本文称为“免疫缀合物”或“药物缀合物”。包括一种或多种细胞毒素的免疫缀合物称为“免疫毒素"。
[0390]
在一个实施方案中,第一和/或第二fc-区缀合至药物或前药,或包含对所述药物或前药的受体基团。这样的受体基团可例如,是非天然的氨基酸。
[0391]
组合物在进一步的方面,本发明涉及包含根据本文公开的任一个实施方案的双特异性抗体的组合物。
[0392]
在进一步的方面,本发明涉及药物组合物,其包含:
‑ꢀ
本文公开的任何实施方案定义的双特异性cd3xcd20抗体;和
‑ꢀ
药学上可接受的载体。
[0393]
本发明的药物组合物可包含本发明的一种双特异性抗体或本发明的不同的双特异性抗体的组合。
[0394]
药物组合物可根据常规技术配制,例如公开于remington: the science and practice of pharmacy, 19th edition, gennaro, ed., mack publishing co., easton, pa, 1995中的技术。本发明的药物组合物可例如,包括稀释剂、填充剂、盐、缓冲剂、去垢剂(例如,非离子去垢剂,例如tween-20或tween-80)、稳定剂(例如,糖或无蛋白氨基酸)、防腐剂、组织固定剂、增溶剂和/或适合包含在药物组合物中的其它材料。
[0395]
药学上可接受的载体包括任何和所有合适的溶剂、分散介质、包衣料、抗细菌剂和抗真菌剂、等渗剂、抗氧化剂和吸收延迟剂等,其与本发明的双特异性抗体在生理上是相容的。可用于本发明的药物组合物的合适的水性和非水性载体的实例包括水、盐水、磷酸盐缓冲盐水、乙醇、葡萄糖、多元醇(例如甘油、丙二醇、聚乙二醇等)和其合适的混合物、植物油、羧甲基纤维素胶体溶液、黄蓍胶和可注射有机酯,例如油酸乙酯,和/或各种缓冲液。药学上可接受的载体包括无菌水溶液或分散液,和用于临时制备无菌可注射溶液或分散液的无菌粉末。可例如通过使用包衣材料,例如卵磷脂,在分散液的情况下通过保持需要的粒径和通过使用表面活性剂,来保持合适的流动性。
[0396]
本发明的药用双特异性抗体还可包含药学上可接受的抗氧化剂,例如(1) 水溶性抗氧化剂,例如抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、偏亚硫酸氢钠、亚硫酸钠等;(2) 油溶性抗氧化剂,例如抗坏血酸棕榈酸酯、丁羟基茴香醚、丁羟基甲苯、卵磷脂、没食子酸丙酯、α-生育酚等;和(3) 金属螯合剂,例如柠檬酸、乙二胺四乙酸(edta)、山梨醇、酒石酸、磷
酸等。
[0397]
本发明的药用双特异性抗体还可在组合物中包含等渗剂,例如糖、多元醇例如甘露醇、山梨醇、甘油或氯化钠。
[0398]
本发明的药用双特异性抗体还可包含适合于选择的给药途径的一种或多种辅剂,例如防腐剂、增湿剂、乳化剂、分散剂、防腐剂或缓冲剂,其可提高药物组合物的保存期限或功效。本发明的双特异性抗体可用保护双特异性抗体免于快速释放的载体制备,例如控释制剂,包括植入物、透皮贴剂和微囊递送系统。这样的载体可包括明胶、单硬脂酸甘油酯、二硬脂酸甘油酯、生物可降解的生物相容的聚合物例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸,单独或与蜡一起,或本领域众所周知的其它材料。用于制备这样的制剂的方法通常是本领域技术人员已知的。
[0399]
无菌可注射溶液可通过将需要量的活性化合物掺入合适的溶剂中,按需要含例如上文列举的一种成分或成分的组合,接着无菌微过滤制备。通常,分散液通过将活性化合物掺入包含基础分散介质和需要的其它成分(例如选自上文列举的那些)的无菌溶媒来制备。在用于制备无菌可注射溶液的无菌粉末的情况下,制备方法的实例是真空干燥和冷冻干燥(冻干),其自其之前的无菌过滤溶液得到活性成分加任何另外的需要成分的粉末。
[0400]
药物组合物中的活性成分的实际剂量水平可改变,以获得足以实现对于特定患者、组合物和给药方式需要的治疗反应,对患者没有毒性的量的活性成分。选择的剂量水平取决于各种药代动力学因素,包括本发明使用的特定组分或其酰胺的活性,给药途径、给药次数、使用的特定化合物的排泄速率、治疗持续时间、与使用的特定组合物组合使用的其它药物、化合物和/或物质,治疗的患者的年龄、性别、重量、条件、一般健康和之前的病史和医学领域众所周知的类似因素。
[0401]
药物组合物可通过任何合适的途径和方式给予。在一个实施方案中,本发明的药物组合物胃肠外给予。如本文使用的"胃肠外给予"意指并非肠内和局部给药的给药方式,通常通过注射,和包括表皮、静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、腱内、经气管、皮下、表皮下、关节内、被膜下、蛛网膜下、椎内、颅内、胸内、硬膜外和胸骨内注射和输注。
[0402]
在一个实施方案中,药物组合物通过静脉内或皮下注射或输注给予。
[0403]
用途在一个方面,本发明涉及根据本文公开的任一个实施方案的双特异性抗体、本文公开的组合物或本文公开的药物组合物,其用作药物。
[0404]
在一个方面,本发明涉及根据本文公开的任一个实施方案的双特异性抗体、本文公开的组合物或本文公开的药物组合物,用于治疗疾病。
[0405]
在一个方面,本发明涉及治疗疾病的方法,包括给予根据本文公开的任一个实施方案的双特异性抗体、本文公开的组合物或本文公开的药物组合物至有需要的受试者。
[0406]
在一个实施方案中,疾病是成熟b-细胞恶性肿瘤。
[0407]
在一个实施方案中,疾病是癌症,例如nhl或b细胞白血病。
[0408]
本发明的双特异性抗体可用于许多目的。特别是,本发明的双特异性抗体可用于治疗各种形式的癌症,包括转移性癌症和难治性癌症。
[0409]
特别是,本发明的双特异性抗体可用于治疗性背景,其中表达cd20的细胞的特异
性靶向和t细胞-介导的杀伤是需要的,和与普通的cd20抗体相比在某些这样的适应症和背景中,它们可能是更有效的。
[0410]
本发明的双特异性抗体还在治疗和诊断各种cd20-相关的疾病中具有另外的功用。例如,双特异性抗体可用于体内或体外引发一种或多种以下生物学活性:抑制表达cd20的细胞的生长和/或分化;杀死表达cd20的细胞;在存在人效应细胞的情况下介导表达cd20的细胞的吞噬或adcc;在存在补体的情况下介导表达cd20的细胞的cdc;介导表达cd20的细胞的凋亡;和/或在结合cd20后诱导易位至脂质筏。
[0411]
在另一个实施方案中,本发明的双特异性抗体可用于实现t细胞-介导的免疫反应、炎症和微环境重塑。
[0412]
在具体的实施方案中,双特异性抗体体内用于治疗、预防或诊断各种cd20-相关的疾病。cd20-相关的疾病的实例特别包括b细胞淋巴瘤,例如,非霍奇金氏淋巴瘤(nhl)、b细胞白血病和免疫疾病,例如,自身免疫疾病,例如下文所列的那些。
[0413]
在一个实施方案中本发明的双特异性抗体用于治疗nhl或b细胞白血病。
[0414]
在一个实施方案中,本发明的双特异性抗体用于治疗cd20抗体-抵抗的nhl或b细胞白血病,例如利妥昔单抗-或奥法木单抗-抵抗的nhl或b细胞白血病,例如,利妥昔单抗-抵抗的非-侵略性b-细胞淋巴瘤。
[0415]
在一个实施方案中,本发明的双特异性抗体用于治疗急性成淋巴细胞性白血病(all),例如复发性或难治性all。
[0416]
在一个实施方案中,本发明的双特异性抗体用于治疗cll,例如复发性或难治性cll。
[0417]
在一个实施方案中,本发明的双特异性抗体用于治疗fl,例如复发性或难治性fl。
[0418]
在一个实施方案中,本发明的双特异性抗体用于治疗成人等级iii淋巴瘤样肉芽肿病;成人鼻型结节外nk/t-细胞淋巴瘤;间变性大细胞淋巴瘤;血管免疫母细胞t-细胞淋巴瘤;连续阶段ii成人伯基特淋巴瘤;连续阶段ii成人弥散性大细胞淋巴瘤;连续阶段ii成人弥散性混合细胞淋巴瘤;连续阶段ii成人弥散性小裂解细胞淋巴瘤;连续阶段ii成人成免疫细胞大细胞淋巴瘤;连续阶段ii成人成淋巴细胞性淋巴瘤;连续阶段ii等级1滤泡性淋巴瘤;连续阶段ii等级2滤泡性淋巴瘤;连续阶段ii等级3滤泡性淋巴瘤;连续阶段ii套细胞淋巴瘤;连续阶段ii边缘区淋巴瘤;连续阶段ii小淋巴细胞性淋巴瘤;皮肤b-细胞非霍奇金淋巴瘤;epstein-barr病毒感染;粘膜-相关的淋巴组织的结节外边缘区b-细胞淋巴瘤;肝脾t-细胞淋巴瘤;眼内淋巴瘤;结节边缘区b-细胞淋巴瘤;非连续阶段ii成人伯基特淋巴瘤;非连续阶段ii成人弥散性大细胞淋巴瘤;非连续阶段ii成人弥散性混合细胞淋巴瘤;非连续阶段ii成人弥散性小裂解细胞淋巴瘤;非连续阶段ii成人成免疫细胞性大细胞淋巴瘤;非连续阶段ii成人成淋巴细胞性淋巴瘤;非连续阶段ii等级1滤泡性淋巴瘤;非连续阶段ii等级2滤泡性淋巴瘤;非连续阶段ii等级3滤泡性淋巴瘤;非连续阶段ii套细胞淋巴瘤;非连续阶段ii边缘区淋巴瘤;非连续阶段ii小淋巴细胞性淋巴瘤;非皮肤结节外淋巴瘤;周围t-细胞淋巴瘤;移植后淋巴组织增生病症;进行性毛细胞白血病,初期治疗;再发性成人伯基特淋巴瘤;再发性成人弥散性混合细胞淋巴瘤;再发性成人弥散性小裂解细胞淋巴瘤;再发性成人等级iii淋巴瘤样肉芽肿病;再发性成人霍奇金淋巴瘤;再发性成人成免疫细胞性大细胞淋巴瘤;再发性成人成淋巴细胞淋巴瘤;再发性成人t-细胞白血病/淋巴瘤;再发
性皮肤t-细胞非霍奇金淋巴瘤;再发性等级1滤泡性淋巴瘤;再发性等级2滤泡性淋巴瘤;再发性等级3滤泡性淋巴瘤;再发性套细胞淋巴瘤;再发性边缘区淋巴瘤;再发性蕈样肉芽肿病/塞扎里综合征;再发性小淋巴细胞性淋巴瘤;难治性毛细胞白血病;小肠淋巴瘤;脾边缘区淋巴瘤;阶段i成人伯基特淋巴瘤;阶段i成人弥散性大细胞淋巴瘤;阶段i成人弥散性混合细胞淋巴瘤;阶段i成人弥散性小裂解细胞淋巴瘤;阶段i成人霍奇金淋巴瘤;阶段i成人成免疫细胞性大细胞淋巴瘤;阶段i成人成淋巴细胞性淋巴瘤;阶段i成人t-细胞白血病/淋巴瘤;阶段i皮肤t-细胞非霍奇金淋巴瘤;阶段i等级1滤泡性淋巴瘤;阶段i等级2滤泡性淋巴瘤;阶段i等级3滤泡性淋巴瘤;阶段i套细胞淋巴瘤;阶段i边缘区淋巴瘤;阶段i小淋巴细胞性淋巴瘤;阶段ia蕈样肉芽肿病/塞扎里综合征;阶段ib蕈样肉芽肿病/塞扎里综合征;阶段ii成人霍奇金淋巴瘤;阶段ii成人t-细胞白血病/淋巴瘤;阶段ii皮肤t-细胞非霍奇金淋巴瘤;阶段iia蕈样肉芽肿病/塞扎里综合征;阶段iib蕈样肉芽肿病/塞扎里综合征;阶段iii成人伯基特淋巴瘤;阶段iii成人弥散性大细胞淋巴瘤;阶段iii成人弥散性混合细胞淋巴瘤;阶段iii成人弥散性小裂解细胞淋巴瘤;阶段iii成人霍奇金淋巴瘤;阶段iii成人成免疫细胞性大细胞淋巴瘤;阶段iii成人成淋巴细胞性淋巴瘤;阶段iii成人t-细胞白血病/淋巴瘤;阶段iii皮肤t-细胞非霍奇金淋巴瘤;阶段iii等级1滤泡性淋巴瘤;阶段iii等级2滤泡性淋巴瘤;阶段iii等级3滤泡性淋巴瘤;阶段iii套细胞淋巴瘤;阶段iii边缘区淋巴瘤;阶段iii小淋巴细胞性淋巴瘤;阶段iiia蕈样肉芽肿病/塞扎里综合征;阶段iiib蕈样肉芽肿病/塞扎里综合征;阶段iv成人伯基特淋巴瘤;阶段iv成人弥散性大细胞淋巴瘤;阶段iv成人弥散性混合细胞淋巴瘤;阶段iv成人弥散性小裂解细胞淋巴瘤;阶段iv成人霍奇金淋巴瘤;阶段iv成人成免疫细胞大细胞淋巴瘤;阶段iv成人成淋巴细胞淋巴瘤;阶段iv成人t-细胞白血病/淋巴瘤;阶段iv皮肤t-细胞非霍奇金淋巴瘤;阶段iv等级1滤泡性淋巴瘤;阶段iv等级2滤泡性淋巴瘤;阶段iv等级3滤泡性淋巴瘤;阶段iv套细胞淋巴瘤;阶段iv边缘区淋巴瘤;阶段iv小淋巴细胞性淋巴瘤;阶段iva蕈样肉芽肿病/塞扎里综合征;阶段ivb蕈样肉芽肿病/塞扎里综合征;t-细胞大颗粒淋巴细胞性白血病;睾丸淋巴瘤;未治疗的毛细胞白血病;或瓦尔登斯特伦巨球蛋白血症。
[0419]
在具体的实施方案中,本发明的抗体用于治疗或预防nhl,因为所述抗体耗尽携带cd20的肿瘤细胞。
[0420]
nhl是一种b细胞淋巴瘤类型。淋巴瘤,例如,b细胞淋巴瘤,是一组相关的癌症,其当淋巴细胞(血细胞)变成恶性时产生。淋巴细胞的正常功能是防御身体免于侵入物:细菌、病毒、真菌、甚至癌症。淋巴细胞存在许多亚型和成熟阶段,因此存在许多种的淋巴瘤。像正常细胞,恶性淋巴细胞可移动到身体的许多部分。通常,淋巴瘤细胞在淋巴系统中形成肿瘤:骨髓、淋巴结、脾和血液。然而,这些细胞可迁移至其它器官。某些类型的淋巴瘤趋于生长在其中正常形式的细胞驻留的位置。例如,滤泡性nhl肿瘤通常发生在淋巴结。
[0421]
cd20通常以升高水平在与nhl有关的肿瘤(即,致瘤) b细胞上表达。因此,本发明的cd20结合抗体可用于耗尽携带cd20的肿瘤细胞(其导致nhl),因此可用于预防或治疗该疾病。
[0422]
本发明的双特异性抗体还可用于阻断或抑制cd20的其它作用。例如,已知cd20在b淋巴细胞上表达和参与这些细胞的增殖和/或分化。因为b淋巴细胞用作免疫调节剂,cd20是抗体介导的靶向b淋巴细胞的疗法的重要靶标,例如,以灭活或杀死b淋巴细胞,其涉及自
身免疫病症。这样的自身免疫病症包括例如上文所列的疾病。
[0423]
类似地,本发明涉及杀伤表达cd20的肿瘤细胞的方法,包括给予有需要的个体有效量的本发明的双特异性抗体。
[0424]
本发明还涉及抑制一种或多种表达cd20的肿瘤细胞的生长和/或增殖的方法,包括给予有需要的个体本发明的双特异性抗体。
[0425]
本发明还涉及治疗癌症的方法,包括a)选择患有癌症的受试者,其包含表达cd20的肿瘤细胞;和b)给予受试者本发明的双特异性抗体或本发明的药物组合物。
[0426]
此外,本发明涉及结合人cd3和人cd20的双特异性抗体用于制备治疗癌症(例如上述特定的癌症适应症的之一)的药物的用途。
[0427]
本发明还涉及双特异性抗体,用于治疗癌症,例如上述癌症适应症之一。
[0428]
在一个实施方案中双特异性抗体用于治疗成熟b-细胞恶性肿瘤。在一个实施方案中双特异性抗体用于治疗表达cd20的肿瘤。在一个实施方案中双特异性抗体用于治疗b细胞淋巴瘤。在一个实施方案中双特异性抗体用于治疗b细胞淋巴瘤例如nhl。在一个实施方案中双特异性抗体用于治疗前体b细胞成淋巴细胞性白血病。在一个实施方案中双特异性抗体用于治疗b细胞慢性淋巴细胞性白血病(cll)。
[0429]
在一个实施方案中双特异性抗体用于治疗小淋巴细胞性淋巴瘤 (sll)。
[0430]
在一个实施方案中双特异性抗体用于治疗b细胞前淋巴细胞性白血病。
[0431]
在一个实施方案中双特异性抗体用于治疗淋巴浆细胞淋巴瘤。
[0432]
在一个实施方案中双特异性抗体用于治疗套细胞淋巴瘤 (mcl)。
[0433]
在一个实施方案中双特异性抗体用于治疗滤泡性淋巴瘤(fl),包括低级、中级和高级fl。
[0434]
在一个实施方案中双特异性抗体用于治疗b细胞霍奇金淋巴瘤。
[0435]
在一个实施方案中双特异性抗体用于治疗免疫病症,其中涉及表达cd20的b细胞。
[0436]
在一个实施方案中双特异性抗体用于治疗银屑病。
[0437]
在一个实施方案中双特异性抗体用于治疗硬化症。
[0438]
在一个实施方案中双特异性抗体用于治疗炎性肠病。
[0439]
对于上述用途,优选的是,抗体是bsigg1-hucd3-h1l1-fealxcd20-7d8-fear,然而其可以是本文公开的任何双特异性cd3xcd20抗体。
[0440]
本发明的双特异性抗体具有许多体外和体内诊断和治疗功用,涉及诊断和治疗涉及表达cd20的细胞的病症。例如,抗体可给予培养的细胞,例如,体外或离体,或给予人受试者,例如体内,以治疗、预防和诊断各种病症。如本文使用的,术语"受试者"意图包括人和非-人动物,其对针对cd3和cd20的双特异性抗体有反应。优选的受试者包括具有病症的人患者,所述病症可通过抑制或控制b细胞(正常或恶性)而纠正或改善。
[0441]
在一个方面,本发明涉及包含根据本文公开的任一个实施方案的双特异性抗体的诊断组合物。
[0442]
在一个实施方案中,诊断组合物是伴侣诊断,其用于筛选和选择将获益于用双特异性抗体治疗的患者。
[0443]
在一个实施方案中,本发明的双特异性抗体可用于治疗具有致瘤病症的受试者,
例如,特征为存在表达cd20的肿瘤细胞的病症,包括例如,b细胞淋巴瘤,例如,nhl。可治疗和/或预防的致瘤疾病的实例包括b细胞淋巴瘤,例如,nhl,包括前体b细胞成淋巴细胞性白血病/淋巴瘤和成熟b细胞肿瘤,例如b细胞慢性淋巴细胞性白血病(cll)/小淋巴细胞性淋巴瘤(sll)、b细胞前淋巴细胞性白血病、淋巴浆细胞淋巴瘤、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(fl)包括低级、中级和高级fl、皮肤滤泡中心淋巴瘤、边缘区b细胞淋巴瘤(malt型、结节和脾型)、毛细胞白血病、弥散性大b细胞淋巴瘤(dlbcl)、伯基特淋巴瘤、浆细胞瘤、浆细胞骨髓瘤、移植后淋巴组织增生病症、瓦尔登斯特伦氏巨球蛋白血症、恶性黑素瘤和间变性大细胞淋巴瘤(alcl)。
[0444]
b细胞非霍奇金氏淋巴瘤的其它实例是淋巴瘤样肉芽肿病、原发渗出性淋巴瘤、血管内大b细胞淋巴瘤、纵膈大b细胞淋巴瘤、重链疾病(包括γ, μ和α疾病)、由免疫抑制剂治疗导致的淋巴瘤,例如环孢霉素诱导的淋巴瘤和甲氨蝶呤诱导的淋巴瘤。
[0445]
在进一步的实施方案中,本发明的双特异性抗体可用于治疗b细胞霍奇金淋巴瘤。
[0446]
可治疗和/或预防的其中涉及表达cd20的b细胞的免疫病症的实例,包括自身免疫病症,例如银屑病、银屑病关节炎、皮炎、系统性硬皮病和硬化症、炎性肠病(ibd)、克罗恩病、溃疡性结肠炎、呼吸窘迫综合征、脑膜炎、脑炎(包括慢性疲乏综合征/肌痛性脑炎(cfs/me)和慢性疲乏综合征/肌痛性脑炎(cfs/me)、葡萄膜炎、肾小球肾炎、湿疹、哮喘、动脉粥样硬化、白细胞粘连缺陷、多发性硬化、雷诺综合征、斯耶格伦综合征、青少年型糖尿病、莱特病、贝切特病、免疫复合物肾炎、iga肾病、igm多神经病、免疫-介导的血小板减少例如急性特发性血小板减少性紫癜和慢性特发性血小板减少性紫癜、溶血性贫血、重症肌无力、狼疮肾炎、系统性红斑狼疮、类风湿性关节炎(ra)、特应性皮炎、天疱疮、格雷夫斯病、桥本甲状腺炎、韦格纳肉芽肿病、omenn综合征、慢性肾衰竭、急性感染性单核细胞增多症、hiv和疱疹病毒相关的疾病。其它实例是严重急性呼吸窘迫综合征和脉络膜视网膜炎(choreoretinitis)。此外,其它疾病和病症包括由病毒例如epstein-barr病毒(ebv)感染b-细胞引起或介导的那些。
[0447]
其中自身抗体和/或过度b淋巴细胞活性是主要的并且可被治疗和/或预防的炎性、免疫和/或自身免疫病症的其它实例包括以下:血管炎和其它血管病症,例如显微多血管炎,churg-strauss综合征和其它anca相关的血管炎,结节性多动脉炎,特发性冷球蛋白血症血管炎,皮肤白细胞破碎性血管炎,川崎病,takayasu动脉炎,巨细胞性关节炎,过敏性紫癜,原发性或孤立性脑血管炎,结节性红斑,血栓闭塞性血管炎(thrombangiitis obliterans),血栓性血小板减少性紫癜(包括溶血性尿毒症综合征)和继发性血管炎,包括皮肤白细胞破碎性血管炎(例如继发于乙型肝炎,丙型肝炎,瓦尔登斯特伦氏巨球蛋白血症,b细胞瘤形成,类风湿性关节炎,斯耶格伦综合征或系统性红斑狼疮);其它实例是结节性红斑,过敏性血管炎,脂膜炎,韦勃-克莱斯坦病,紫癜性高球蛋白血症和布格氏病;皮肤病症,例如接触性皮炎,线性iga皮肤病,白癜风,坏疽性脓皮症,获得性大疱性表皮松解症,寻常型天疱疮(包括瘢痕性类天疱疮和大疱性类天疱疮),斑秃(包括全身脱毛和全部脱发),疱疹样皮炎,多形性红斑和慢性自身免疫性荨麻疹(包括血管神经性水肿和荨麻疹性血管炎);免疫介导的血细胞减少,例如自身免疫性中性粒细胞减少症,和纯红细胞再生障
碍;结缔组织疾病,例如cns狼疮,盘状红斑狼疮,crest综合征,混合性结缔组织病,多发性肌炎/皮肌炎,包涵体肌炎,继发性淀粉样变性,i型和ii型冷球蛋白血症,纤维肌痛,磷脂抗体综合征,继发性血友病,复发性多软骨炎,结节病,僵硬综合征和风湿热;其它实例是嗜曙红细胞性筋膜炎,肌炎和少年皮肌炎;关节病,例如强直性脊柱炎,青少年慢性关节炎,成人still氏病和sapho综合征;其它实例是骶髂关节炎(sacroileitis),反应性关节炎,still氏病和痛风;血液学病症,例如再生障碍性贫血,原发性溶血性贫血(包括冷凝集素综合征),继发于cll或系统性红斑狼疮的溶血性贫血; poems综合征,恶性贫血和瓦尔登斯特伦氏高球蛋白血症性紫癜(waldenstr
ö
m’s purpura hyperglobulinaemica);其它实例是粒细胞缺乏症,自身免疫性中性粒细胞减少症,富兰克林氏病,塞利格曼氏病,μ链疾病,继发于胸腺瘤和淋巴瘤的副肿瘤综合征,以及因子viii抑制剂形成;内分泌病,例如多发性内分泌疾病和艾迪生病;其它实例是自身免疫性低血糖症,自身免疫性甲状腺功能减退症,自身免疫性胰岛素综合征,德奎维氏甲状腺炎和胰岛素受体抗体介导的胰岛素抵抗;肝
ꢀ‑ꢀ
胃肠道疾病,例如乳糜泻,惠普尔病,原发性胆汁性肝硬化,慢性活动性肝炎和原发性硬化性胆管炎;另一个实例是自身免疫性胃炎;肾病,例如快速进行性肾小球肾炎,后链球菌性肾炎,古德帕斯彻综合征,膜性肾小球性肾炎和冷球蛋白血症肾炎;另一个实例是微小病变肾病;神经系统病症,例如自身免疫性神经病,多发性单神经炎,兰伯特
ꢀ‑ꢀ
伊顿的肌无力综合症,西登纳氏舞蹈病,脊髓痨和吉兰
ꢀ‑ꢀ
巴雷综合征;其它实例是脊髓病/热带痉挛性瘫痪,重症肌无力,急性炎性脱髓鞘性多发性神经病和慢性炎性脱髓鞘性多发性神经病;心脏和肺部病症,例如纤维化肺泡炎,闭塞性细支气管炎,过敏性曲霉病,囊性纤维化,洛芬综合征,心肌炎和心包炎;其它实例是过敏性肺炎和继发于肺癌的副肿瘤综合征;过敏性病症,例如支气管哮喘和高ige综合征;另一个实例是一时性黑矇;眼科病症,例如特发性脉络膜视网膜炎;传染病,例如细小病毒b感染(包括手-袜综合征);和妇产科病症,例如反复性流产,反复性妊娠丢失,子宫内生长迟缓;另一个实例是继发于妇科肿瘤的副肿瘤综合征;男性生殖障碍,例如继发于睾丸肿瘤的副肿瘤综合征;和移植衍生的病症,例如同种异体移植物和异种移植物排斥反应以及移植物抗宿主病(包括慢性移植物抗宿主病)。
[0448]
在一个实施方案中,疾病是炎性、免疫和/或自身免疫病症,选自溃疡性结肠炎、克罗恩病、青少年型糖尿病、多发性硬化、免疫-介导的血小板减少例如急性特发性血小板减少性紫癜和慢性特发性血小板减少性紫癜、溶血性贫血(包括自身免疫溶血性贫血)、重症肌无力、系统性硬化症和寻常型天疱疮。
[0449]
在本发明的治疗方法的进一步的实施方案中,治疗的功效在治疗期间监测,例如,在预定的时间点,通过测定相关的肿瘤细胞上的肿瘤负荷或cd20表达水平。
[0450]
上述治疗方法和用途的剂量方案经调整以提供需要的最佳反应(例如,治疗反应)。例如,可给予单次推注,可随时间给予数个分剂量或可按比例减少或增加剂量,取决于治疗形势的紧急情况。胃肠外组合物可以单位剂型配制,以易于给予和剂量均匀。
[0451]
双特异性抗体的有效剂量和剂量方案取决于待治疗的疾病或病况,和可由本领域技术人员确定。本发明的化合物的治疗有效量的实例性的非限制性范围是约0.001-10 mg/kg, 例如约0.001-5 mg/kg, 例如约0.001-2 mg/kg, 例如约0.001-1 mg/kg, 例如约0.001, 约0.01, 约0.1, 约1或约10 mg/kg。本发明的双特异性抗体的治疗有效量的另一个实例性的非限制性范围是约0.1-100 mg/kg, 例如约0.1-50 mg/kg, 例如约0.1-20 mg/kg, 例如约0.1-10 mg/kg, 例如约0.5, 约例如0.3, 约1, 约3, 约5或约8 mg/kg。
[0452]
具有本领域普通技术的医生或兽医可容易地确定和处方需要的药物组合物的有效量。例如,医生或兽医可在低于为了实现需要的治疗效果所需要的水平上开始药物组合物中使用的双特异性抗体的剂量,和逐渐增加剂量,直到实现需要的效果。通常,本发明的双特异性抗体的合适的每日剂量是有效产生治疗效果的最低剂量的化合物的量。给予可例如,是胃肠外的,例如静脉内、肌内或皮下。在一个实施方案中,双特异性抗体可通过mg/m2计算的每周剂量通过输注给予。这样的剂量可例如基于上文提供的mg/kg剂量,根据以下:剂量(mg/kg) x 70: 1.8。这样的给予可重复例如,1-8次,例如3-5次。给予可通过在2-24小时、例如2-12小时的时间内连续输注进行。在一个实施方案中,双特异性抗体可通过在一段时间内例如超过24小时缓慢连续输注给予,以减少毒性副作用。
[0453]
在一个实施方案中当一周一次给予时,双特异性抗体可以按固定剂量计算的每周剂量给予,至多8次,例如4-6次。这样的方案可按需要重复一次或多次,例如6个月或12个月后。这样的固定剂量可例如基于上文提供的mg/kg剂量,其中体重估计为70 kg。剂量可在给予后通过例如获得生物样品和使用靶向本发明的双特异性抗体的cd20抗原抗原结合区的抗-个体基因型抗体,通过测量本发明的双特异性抗体在血液中的量确定或调整。
[0454]
在一个实施方案中,双特异性抗体可作为维持疗法给予,例如,一周一次,持续6个月或更久。
[0455]
双特异性抗体还可预防性给予,以减少发生癌症的风险、延迟癌症进展事件的发生,和/或当癌症缓解时减少复发风险。
[0456]
本发明的双特异性抗体还可以组合疗法给予,即,与对于治疗的疾病或病况相关的其它治疗剂组合。因此,在一个实施方案中,包含双特异性抗体的药物与一种或多种其它治疗剂,例如细胞毒性剂、化疗剂或抗-血管生成剂组合。
[0457]
这样的组合给药可以是同时、分开或连续的。对于同时给药,合适时,可作为一个组合物或作为分开的组合物给予药剂。本发明因此还提供治疗如上所述的涉及表达cd20的细胞的病症的方法,所述方法包括给予本发明的双特异性抗体与如下所述的一种或多种另外的治疗剂的组合。
[0458]
在一个实施方案中,本发明提供在受试者中治疗涉及表达cd20的细胞的病症的方法,所述方法包括给予有需要的受试者治疗有效量的本发明的双特异性抗体和任选地至少一种另外的治疗剂,或结合与所述抗体不同的cd20表位的抗体。
[0459]
在一个实施方案中,本发明提供治疗或预防癌症的方法,所述方法包括给予有需要的受试者治疗有效量的本发明的双特异性抗体和至少一种另外的治疗剂。
[0460]
在一个实施方案中,这样的另外的治疗剂可选自酪氨酸激酶抑制剂(tki),例如imatinib (glivec, gleevec sti571), ibrutinib (pci-32765, imbruvica)或lapatinib (ptk787/zk222584)。
[0461]
在一个实施方案中,这样的另外的治疗剂可选自bruton酪氨酸激酶(btk)抑制剂,例如ibrutinib。
[0462]
在一个实施方案中,这样的另外的治疗剂可选自蛋白酶体抑制剂(pi),例如carfilzomib。
[0463]
在一个实施方案中,这样的另外的治疗剂可选自免疫调节剂(imid),例如pomalidomide, 沙利度胺或lenalidomide。
[0464]
在一个实施方案中,这样的另外的治疗剂可选自磷酸肌醇3-激酶抑制剂,例如idelalisib或duvelisib。
[0465]
在一个实施方案中,这样的另外的治疗剂可选自aurora a激酶抑制剂,例如alisertib。
[0466]
在一个实施方案中,这样的另外的治疗剂可选自b-细胞淋巴瘤-2 (bcl-2)抑制剂,例如venetoclax。
[0467]
在一个实施方案中,这样的另外的治疗剂可选自组蛋白脱酰酶(hdac)抑制剂,例如panobinostat。
[0468]
本发明的药物组合物还可以组合疗法给予,即,与其它药剂组合。在一个实施方案中,这样的治疗剂包括一种或多种化疗剂,选自以下类别:烷基化剂、抗代谢物、有丝分裂抑制剂、抗-肿瘤抗生素、拓扑异构酶抑制剂或铂类似物。这样的化学治疗剂的实例是多柔比星(adriamycin), 顺铂(platinol), 博来霉素(blenoxane), 卡莫司汀(gliadel), 环磷酰胺(cytoxan, procytox, neosar), 苯达莫司汀和苯丁酸氮芥(leukeran)。
[0469]
在另一个实施方案中,本发明的双特异性抗体可与以下组合给予:苯丁酸氮芥;chop (环磷酰胺, 羟基柔红霉素, 长春新碱, 泼尼松或泼尼松龙);环磷酰胺和泼尼松龙;环磷酰胺, 长春新碱和泼尼松;环磷酰胺, 长春新碱, 多柔比星和泼尼松;氟达拉滨和烷基化剂;剂量调整的epoch (依托泊苷, 泼尼松龙, 长春新碱, 环磷酰胺和多柔比星);gemox (吉西他滨和奥沙利铂);gdp (吉西他滨, 地塞米松和顺铂)或与用于nhl的其它常见的多药方案组合,例如公开于non-hodgkin’s lymphomas: making sense of diagnosis, treatment, and options, lorraine johnston, 1999, o’reilly and associates, inc.。
[0470]
在一个实施方案中,这样的另外的治疗剂可选自抗代谢物,例如甲氨蝶呤, 6-巯嘌呤, 6-硫鸟嘌呤, 阿糖胞苷, 氟达拉滨, 5-氟尿嘧啶, 氨烯咪胺, 羟基脲, 门冬酰胺酶, 吉西他滨或克拉屈滨.在另一个实施方案中,这样的另外的治疗剂可选自烷基化剂,例如氮芥, 塞替派, 苯丁酸氮芥, 美法仑, 卡莫司汀 (bsnu), 洛莫司汀 (ccnu), 环磷酰胺, 白消安, 二溴甘露醇, 链唑霉素, 达卡巴嗪 (dtic), 丙卡巴肼, 丝裂霉素 c, 顺铂和其它铂衍生物, 例如卡铂。
[0471]
在另一个实施方案中,这样的另外的治疗剂可选自抗-有丝分裂剂, 例如紫杉烷类, 例如多西他赛和紫杉醇和长春花碱类, 例如长春地辛, 长春新碱, 长春碱和长春瑞
滨。
[0472]
在另一个实施方案中,这样的另外的治疗剂可选自拓扑异构酶抑制剂, 例如托泊替康或伊立替康,或细胞生长抑制药物例如依托泊苷和替尼泊苷。
[0473]
在另一个实施方案中,本发明提供在受试者中治疗涉及表达cd20的细胞的病症的方法,所述方法包括给予有需要的受试者治疗有效量的本发明的双特异性抗体和血管发生、新生血管形成和/或其它血管化的至少一种抑制剂。
[0474]
这样的血管发生抑制剂的实例是尿激酶抑制剂、基质金属蛋白酶抑制剂(例如马立马司他, 新伐司他, bay 12-9566, ag 3340, bms-275291和类似的试剂)、内皮细胞迁移和增殖的抑制剂(例如tnp-470, 角鲨胺, 2-甲氧雌二醇, 考布他汀, 内皮他丁, 血管他丁, 青霉胺, sch66336 (schering-plough corp, madison, nj), r115777 (janssen pharmaceutica, inc, titusville, nj)和类似的试剂), 血管生成生长因子的拮抗剂(例如zd6474, su6668,针对血管生成剂的抗体和/或它们的受体(例如vegf (例如,贝伐单抗), bfgf和血管生成素-1), 沙利度胺, 沙利度胺类似物(例如cc-5013), sugen 5416, su5402, 抗血管生成核酶(例如angiozyme), 干扰素α (例如干扰素α2a), 苏拉明和类似的试剂), vegf-r激酶抑制剂和其它抗-血管生成酪氨酸激酶抑制剂(例如su011248), 内皮-特异性整联蛋白/存活信号转导的抑制剂(例如vitaxin和类似的试剂), 铜拮抗剂/螯合剂(例如四硫钼酸盐, 卡托普利和类似的试剂), 甲酰胺-三唑(cai), abt-627, cm101, 白细胞介素-12 (il-12), im862, pnu145156e以及抑制血管发生的核苷酸分子(例如反义-vegf-cdna, 编码血管他丁的cdna, 编码p53的cdna和编码缺陷vegf受体-2的cdna)。
[0475]
血管发生、新生血管形成和/或其它血管化的这样的抑制剂的其它实例是抗-血管生成肝素衍生物(例如,肝素酶iii), 替莫唑胺, nk4, 巨噬细胞迁移抑制因子, 环氧合酶-2抑制剂, 缺氧-诱导因子1的抑制剂, 抗-血管生成大豆异黄酮, 奥替普拉, 烟曲霉素和其类似物, 生长抑素类似物, 多硫酸戊聚糖, 替可加兰钠, dalteparin, tumstatin, 血小板反应素, nm-3, combrestatin, canstatin, avastatin, 针对其它靶标的抗体, 例如抗-α-v/β-3整联蛋白和抗-kininostatin抗体。
[0476]
在一个实施方案中,与双特异性抗体组合用于治疗如上所述的病症的治疗剂可以是抗-癌症免疫原, 例如癌症抗原/肿瘤相关抗原(例如,上皮细胞粘连分子(epcam/tacstd1), 粘蛋白1 (muc1), 癌胚抗原(cea), 肿瘤相关糖蛋白72 (tag-72), gp100, melan-a, mart-1, kdr, rcas1, mda7, 癌症相关病毒疫苗(例如,人乳头瘤病毒疫苗)或肿瘤来源的热休克蛋白。
[0477]
在一个实施方案中,与双特异性抗体组合用于治疗如上所述的病症的治疗剂可以是抗-癌症细胞因子, 趋化因子或其组合。合适的细胞因子和生长因子的实例包括ifnγ, il-2, il-4, il-6, il-7, il-10, il-12, il-13, il-15, il-18, il-23, il-24, il-27, il-28a, il-28b, il-29, kgf, ifnα (例如,infα2b), ifnβ, gm-csf, cd40l, flt3配体, 干细胞因子, 安西司亭和tnfα。合适的趋化因子可包括glu-leu-arg (elr)-阴性趋化因子例如ip-10, mcp-3, mig和sdf-1α,其来自人cxc和c-c趋化因子家族。合适的细胞因子包括细胞因子衍生物、细胞因子变体、细胞因子片段和细胞因子融合蛋白。
[0478]
在一个实施方案中,与双特异性抗体组合用于治疗如上所述的病症的治疗剂可以是细胞周期控制/凋亡调节剂(或"调节剂")。细胞周期控制/凋亡调节剂可包括靶向和调节
抗-cd22抗体, 抗-cd37抗体, 抗-cd38抗体, 抗-il6r抗体, 抗-il8抗体, 抗-il15抗体, 抗-il15r抗体, 抗-cd4抗体, 抗-cd11a抗体(例如,efalizumab), 抗-α-4/β-1整联蛋白(vla4)抗体(例如,那他珠单抗)和ctla4-ig。
[0488]
在进一步的实施方案中,双特异性抗体可与一种或多种阻断免疫检查点的抗体组合给予, 例如抗-ctla-4 (cd152)抗体, 抗-pd-1 (cd279)抗体, 抗-pd-l1 (cd274)抗体, 抗-lag-3 (cd223)抗体, 抗-tim3抗体, 抗-ceacam1 (cd66a)抗体, 抗-vista抗体, 抗-tigit抗体, 抗-btla (cd272)抗体。
[0489]
在进一步的实施方案中,双特异性抗体可与一种或多种对免疫细胞上的共刺激受体特异性的拮抗性抗体组合给予,例如抗-4-1bb (cd137)抗体(例如,urelumab), 抗-ox40 (cd134)抗体, 抗-cd40抗体, 抗-cd27抗体。
[0490]
在进一步的实施方案中,双特异性抗体可与一种或多种ii型巨噬细胞耗尽或极化抗体组合给予,例如抗-csf-1r (cd115)抗体。
[0491]
在进一步的实施方案中,双特异性抗体可与一种或多种结合参与调节先天免疫系统的分子的抗体组合给予,例如抗-cd47抗体, 抗-cd200抗体, 抗-cd200r抗体, 针对杀伤细胞抑制受体(kirs)的抗体,针对cd94/nkg2受体的抗体, 抗-cd305 (lair1)。
[0492]
在另一个具体的实施方案中,双特异性抗体与一种或多种抗体组合给予,其选自抗-cd19抗体, 抗-cd21抗体, 抗-cd22抗体, 抗-cd37抗体和抗-cd38抗体,用于治疗恶性疾病。
[0493]
在另一个具体的实施方案中,双特异性抗体与抗-cd20抗体, 例如奥法木单抗组合给予。
[0494]
在又一个具体的实施方案中,双特异性抗体与一种或多种抗体组合给予,其选自抗-il6r抗体, 抗-il8抗体, 抗-il15抗体, 抗-il15r抗体, 抗-cd4抗体, 抗-cd11a抗体(例如,efalizumab), 抗-α-4/β-1整联蛋白(vla4)抗体(例如那他珠单抗)和ctla4-ig,用于治疗炎性疾病。
[0495]
在一个实施方案中,本发明的双特异性抗体与一种或多种其它治疗性抗体组合使用, 例如zanolimumab, daratumumab (darzalex), ranibizumab, nimotuzumab, panitumumab, hu806, daclizumab (zenapax), basiliximab (simulect), infliximab (remicade), adalimumab (humira), natalizumab (tysabri), omalizumab (xolair)和/或efalizumab (raptiva)。
[0496]
在另一个实施方案中,本发明的双特异性抗体与一种或多种抗体-药物缀合物(adc)组合使用,例如brentuximab-vedotin (adcetris), inotuzumab ozogamicin (cmc-544), polatuzumab vedotin (rg7593), coltuximab ravtansine (sar3419), indatuximab ravtansine (bt-062), inotuzumab ozogamicin (cmc-544), denintuzumab mafodotin (sgn-cd19), polatuzumab vedotin (rg7596)或缀合的cd37-特异性抗体药物(例如imgn529或ags67e)。
[0497]
在另一个实施方案中,本发明的双特异性抗体可与抗-炎性剂或免疫抑制剂组合使用。例如,组合疗法可包括本发明的组合物与至少一种抗-炎性剂或至少一种免疫抑制剂。在一个实施方案中这样的治疗剂包括一种或多种抗-炎性剂,例如甾体药物或nsaid (非甾体抗炎药)。优选的药剂包括例如,阿司匹林和其它水杨酸盐, cox-2抑制剂, 例如塞
来考昔(celebrex), nsaid例如布洛芬(motrin, advil), 非诺洛芬(nalfon), 萘普生(naprosyn), 舒林酸(clinoril), 双氯芬酸(voltaren), 吡罗昔康(feldene), 酮洛芬(orudis), 二氟尼柳(dolobid), 萘丁美酮(relafen), 依托度酸(lodine), 奥沙普秦(daypro)和吲哚美辛(indocin)。
[0498]
在另一个实施方案中,这样的治疗剂包括一种或多种dmard, 例如甲氨蝶呤(rheumatrex), 羟氯喹(plaquenil), 柳氮磺吡啶(asulfidine), 嘧啶合成抑制剂, 例如,来氟米特(arava), il-1受体阻断剂, 例如,阿那白滞素(kineret)和tnf-α阻断剂, 例如,依那西普(enbrel), 英夫利昔单抗(remicade)和阿达木单抗。
[0499]
在另一个实施方案中,这样的治疗剂包括一种或多种免疫抑制剂, 例如环孢霉素(sandimmune, neoral)和硫唑嘌呤(imural)。
[0500]
在具体的实施方案中,双特异性抗体与抗-cd25抗体组合给予以治疗大疱性类天疱疮, 例如,在具有移植物抗宿主病的患者中。
[0501]
放射疗法
–
手术在一个实施方案中,本发明提供在受试者中治疗涉及表达cd20的细胞的病症的方法,所述方法包括给予有需要的受试者治疗有效量的本发明的cd3xcd20双特异性抗体和放射疗法。
[0502]
在一个实施方案中,本发明提供治疗或预防癌症的方法,所述方法包括给予有需要的受试者治疗有效量的本发明的cd3xcd20双特异性抗体和放射疗法。
[0503]
在一个实施方案中,本发明提供本发明的双特异性抗体用于制备与放射疗法组合给予的用于治疗癌症的药物组合物的用途。
[0504]
放射疗法可包含放射或伴随给予患者放射药物。放射的来源可以是治疗的患者的外部或内部的(放射治疗可以例如为外部光束放射疗法(ebrt)或短距离放射疗法(bt)的形式)。可用于实施这样的方法的放射性元素包括例如,镭, 铯-137, 铱-192, 镅-241, 金-198, 钴-57, 铜-67, 锝-99, 碘-123, 碘-131和铟-111。
[0505]
在进一步的实施方案中, 本发明提供治疗或预防癌症的方法,所述方法包括与手术组合给予有需要的受试者治疗有效量的本发明的双特异性抗体。
[0506]
诊断用途因此,在一个方面,本发明涉及包含本文定义的双特异性cd3xcd20抗体的诊断组合物和其用途。
[0507]
在另一方面,本发明涉及用于在源自患者的样品,例如血液样品、淋巴结样品或骨髓样品中,检测表达cd3和cd20的细胞之间的交联的试剂盒,其包含i) 根据本文公开的任一个实施方案的双特异性抗体;和ii) 所述试剂盒的使用说明书。
[0508]
在一个实施方案中,本发明提供诊断癌症的试剂盒,其包含容器,其包含双特异性cd3xcd20抗体和一种或多种用于检测表达cd20的细胞和表达cd3的细胞的交联的试剂。试剂可包括例如,荧光标签、酶标签或其它可检测标签。试剂还可包括第二或第三抗体或用于酶反应的试剂,其中酶反应产生可视化的产物。
[0509]
在进一步的方面,本发明涉及在给予根据本文公开的任一个实施方案的双特异性抗体后在源自患者的样品,例如血液样品、淋巴结样品或骨髓样品中检测在表达cd3和cd20
的细胞之间是否发生交联的方法,包括以下步骤:(i) 使样品与根据本文公开的任一个实施方案的双特异性抗体在允许所述双特异性抗体和表达cd3和cd20的细胞之间形成复合物的条件下接触;和(ii) 分析是否形成复合物。
[0510]
复合物的检测可通过本领域已知的方法,例如通过实施例5中公开的方法进行。
[0511]
在进一步的方面,本发明涉及抗-个体基因型抗体,其结合本文公开的任一个实施方案中定义的第一抗原结合区,或其结合本文公开的任一个实施方案中定义的第二抗原结合区。
具体实施方式
[0512]
本发明还涉及以下实施方案:1. 双特异性抗体,其包含(i) 第一结合臂,其包含结合人cd3ε (epsilon)的第一抗原结合区,其中所述第一抗原结合区包含(a) 分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3,和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,或者(b) 分别具有seq id no:55、56和57所示的序列的重链可变(vh)区cdr1、cdr2和cdr3,和分别具有seq id no:58所示的序列、序列dts和seq id no:59所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3,和(ii) 第二结合臂,其包含结合人cd20的第二抗原结合区。
[0513]
2. 实施方案1的双特异性抗体,其包含第一结合臂,所述第一结合臂包含结合人cd3ε (epsilon)的第一抗原结合区,其中所述第一抗原结合区包含分别具有seq id no:1、2和3所示的序列的重链可变(vh)区cdr1、cdr2和cdr3,和分别具有seq id no:4所示的序列、序列gtn和seq id no:5所示的序列的轻链可变(vl)区cdr1、cdr2和cdr3。
[0514]
3. 实施方案1或2的双特异性抗体,其中所述第一抗原结合区包含第一重链可变序列(vh)和第一轻链可变序列(vl),和所述第二抗原结合区包含第二重链可变序列(vh)和第二轻链可变序列(vl),和其中所述可变序列各自包含三个cdr序列,分别为cdr1、cdr2和cdr3,和四个框架序列,分别为fr1、fr2、fr3和fr4。
[0515]
4. 前述实施方案中任一项的双特异性抗体,其中(i) 所述第一结合臂包含第一重链和第一轻链,所述第一重链包含第一重链可变序列(vh)和第一重链恒定序列(ch),所述第一轻链包含第一轻链可变序列(vl)和第一轻链恒定序列(cl);和(ii) 所述第二结合臂包含第二重链和第二轻链,所述第二重链包含第二重链可变序列(vh)和第二重链恒定序列(ch),所述第二轻链包含第二轻链可变序列(vl)和第二轻链恒定序列(cl)。
[0516]
5. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vh序列与选自以下的vh序列所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性:a) seq id no:6所示的vh序列;b) seq id no:7所示的vh序列;c) seq id no:8所示的vh序列;d) seq id no:9所示的vh序列;和e) seq id no:17所示的vh序列。
[0517]
6. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vl序列与选自以下的vl序列所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性:a) seq id no:10所示的vl序列;b) seq id no:11所示的vl序列;c) seq id no:12所示的vl序列;和d) seq id no:18所示的vl序列。
[0518]
7. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vh序列的框架序列与选自以下的vh序列所示的框架氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性:a) seq id no:6所示的vh序列;b) seq id no:7所示的vh序列;c) seq id no:8所示的vh序列;d) seq id no:9所示的vh序列;和e) seq id no:17所示的vh序列。
[0519]
8. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vl序列的框架序列与选自以下的vl序列所示的框架氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性:a) seq id no:10所示的vl序列;b) seq id no:11所示的vl序列;c) seq id no:12所示的vl序列;和d) seq id no:18所示的vl序列。
[0520]
9. 实施方案5-8中任一项的双特异性抗体,其中所述vh和vl序列的cdr序列未发生突变,而是按表1所示。
[0521]
10. 实施方案5-7中任一项的双特异性抗体,其中vh和vl序列仅在框架序列中偏离。
[0522]
11. 实施方案5-8中任一项的双特异性抗体,其中第一抗原结合区的vh和vl序列的各个fr1、fr2、fr3和fr4框架序列与所述vh和vl序列的各个fr1、fr2、fr3和fr4框架序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性,和其中cdr序列未发生突变。
[0523]
12. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vh序列选自:a) seq id no:6所示的vh序列;b) seq id no:7所示的vh序列;c) seq id no:8所示的vh序列;d) seq id no:9所示的vh序列;e) seq id no:17所示的vh序列。
[0524]
13. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vl序列选自:
a) seq id no:10所示的vl序列;b) seq id no:11所示的vl序列;c) seq id no:12所示的vl序列;和d) seq id no:18所示的vl序列。
[0525]
14. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区的所述vh和vl序列选自:a) seq id no:6所示的vh序列和seq id no:10所示的vl序列;b) seq id no:8所示的vh序列和seq id no:10所示的vl序列;c) seq id no:9所示的vh序列和seq id no:10所示的vl序列;d) seq id no:6所示的vh序列和seq id no:11所示的vl序列;e) seq id no:6所示的vh序列和seq id no:12所示的vl序列;f) seq id no:7所示的vh序列和seq id no:10所示的vl序列;g) seq id no:7所示的vh序列和seq id no:11所示的vl序列;h) seq id no:7所示的vh序列和seq id no:12所示的vl序列;i) seq id no:8所示的vh序列和seq id no:11所示的vl序列;j) seq id no:8所示的vh序列和seq id no:12所示的vl序列;k) seq id no:9所示的vh序列和seq id no:11所示的vl序列;l) seq id no:9所示的vh序列和seq id no:12所示的vl序列;和m) seq id no:17所示的vh序列和seq id no:18所示的vl序列。
[0526]
15. 前述实施方案中任一项的双特异性抗体,其中所述第一抗原结合区包含选自以下的vh序列和vl序列:a) seq id no:6所示的vh序列和seq id no:10所示的vl序列;b) seq id no:17所示的vh序列和seq id no:18所示的vl序列。
[0527]
16. 前述实施方案中任一项的双特异性抗体,其中所述第一抗原结合区包含与seq id no:6所示的vh序列具有至少90%序列同一性的vh序列,和与seq id no:10所示的vl序列具有至少90%序列同一性的vl序列。
[0528]
17. 前述实施方案中任一项的双特异性抗体,其中所述第一抗原结合区包含与seq id no:6所示的vh序列具有至少95%序列同一性的vh序列,和与seq id no:10所示的vl序列具有至少95%序列同一性的vl序列。
[0529]
18. 前述实施方案中任一项的双特异性抗体,其中所述第一抗原结合区包含与seq id no:6所示的vh序列具有至少97%序列同一性的vh序列,和与seq id no:10所示的vl序列具有至少97%序列同一性的vl序列。
[0530]
19. 前述实施方案中任一项的双特异性抗体,其中所述第一抗原结合区包含seq id no:6所示的vh序列和seq id no:10所示的vl序列。
[0531]
20. 前述实施方案中任一项的双特异性抗体,其中第一结合臂源自小鼠抗体。
[0532]
21. 前述实施方案中任一项的双特异性抗体,其中第一结合臂源自人源化抗体。
[0533]
22. 前述实施方案中任一项的双特异性抗体,其中第一结合臂源自全长抗体。
[0534]
23. 前述实施方案中任一项的双特异性抗体,其中第一结合臂源自全长igg1,λ (lambda)或igg1, κ (kappa)抗体。
[0535]
24. 前述实施方案中任一项的双特异性抗体,其中第二抗原结合区源自结合人cd20上的表位的抗体,所述表位不包含或需要位置170的氨基酸残基丙氨酸或位置172的氨基酸残基脯氨酸。
[0536]
25. 实施方案21的双特异性抗体,其中第二抗原结合区源自结合人cd20上的表位的抗体,所述表位进一步包含或需要位置163的氨基酸残基天冬酰胺和位置166的氨基酸残基天冬酰胺。
[0537]
26. 前述实施方案中任一项的双特异性抗体,其中结合人cd20的第二抗原结合区包含:(i) seq id no:32的vh cdr1区、seq id no:33的vh cdr2区、seq id no:34的vh cdr3区,(ii) seq id no:38的vh cdr1区、seq id no:39的vh cdr2区、seq id no:34的vh cdr3区,(iii) seq id no:42的vh cdr1区、seq id no:43的vh cdr2区、seq id no:44的vh cdr3区,或(iv) seq id no:49的vh cdr1区、seq id no:50的vh cdr2区、seq id no:51的vh cdr3区。
[0538]
27. 前述实施方案中任一项的双特异性抗体,其中结合人cd20的第二抗原结合区包含:(i) seq id no:35的vl cdr1区、das的vl cdr2区、seq id no:36的vl cdr3区,(ii) seq id no:45的vl cdr1区、das的vl cdr2区、seq id no:46的vl cdr3区,(iii) seq id no:52的vl cdr1区、das的vl cdr2区das、seq id no:53的vl cdr3区。
[0539]
28. 前述实施方案中任一项的双特异性抗体,其中结合人cd20的第二抗原结合区包含:(i) seq id no:32的vh cdr1区、seq id no:33的vh cdr2区、seq id no:34的vh cdr3区、seq id no:35的vl cdr1区、das的vl cdr2区和seq id no:36的vl cdr3区,(ii) seq id no:38的vh cdr1区、seq id no:39的vh cdr2区、seq id no:34的vh cdr3区、seq id no:35的vl cdr1区、das的vl cdr2区和seq id no:36的vl cdr3区,(iii) seq id no:42的vh cdr1区、seq id no:43的vh cdr2区、seq id no:44的vh cdr3区、seq id no:45的vl cdr1区、das的vl cdr2区和seq id no:46的vl cdr3区,(iv) seq id no:49的vh cdr1区、seq id no:50的vh cdr2区、seq id no:51的vh cdr3区、seq id no:52的vl cdr1区、das的vl cdr2区和seq id no:53的vl cdr3区,(v) seq id no:32的vh cdr1区、seq id no:33的vh cdr2区、seq id no:34的vh cdr3区、seq id no:45的vl cdr1区、das的vl cdr2区和seq id no:46的vl cdr3区,(vi) seq id no:32的vh cdr1区、seq id no:33的vh cdr2区、seq id no:34的vh cdr3区、seq id no:52的vl cdr1区、das的vl cdr2区和seq id no:53的vl cdr3区,(vii) seq id no:38的vh cdr1区、seq id no:39的vh cdr2区、seq id no:34的vh cdr3区、seq id no:45的vl cdr1区、das的vl cdr2区和seq id no:46的vl cdr3区,(viii) seq id no:38的vh cdr1区、seq id no:39的vh cdr2区、seq id no:34的
vh cdr3区、seq id no:52的vl cdr1区、das的vl cdr2区和seq id no:53的vl cdr3区,(ix) seq id no:42的vh cdr1区、seq id no:43的vh cdr2区、seq id no:44的vh cdr3区、seq id no:35的vl cdr1区、das的vl cdr2区和seq id no:36的vl cdr3区,(x) seq id no:42的vh cdr1区、seq id no:43的vh cdr2区、seq id no:44的vh cdr3区、seq id no:52的vl cdr1区、das的vl cdr2区和seq id no:53的vl cdr3区,(xi) seq id no:49的vh cdr1区、seq id no:50的vh cdr2区、seq id no:51的vh cdr3区、seq id no:35的vl cdr1区、das的vl cdr2区和seq id no:36的vl cdr3区,或(xii) seq id no:49的vh cdr1区、seq id no:50的vh cdr2区、seq id no:51的vh cdr3区、seq id no:45的vl cdr1区、das的vl cdr2区和seq id no:46的vl cdr3区。
[0540]
29. 前述实施方案中任一项的双特异性抗体,其中结合人cd20的第二抗原结合区包含seq id no:32的vh cdr1区、seq id no:33的vh cdr2区、seq id no:34的vh cdr3区、seq id no:35的vl cdr1区、das的vl cdr2区和seq id no:36的vl cdr3区。
[0541]
30. 前述实施方案中任一项的双特异性抗体,其中结合人cd20的第二抗原结合区包含:(i) 与seq id no:27所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:28所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(ii) 与seq id no:37所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:28所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(iii) 与seq id no:40所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(iv) 与seq id no:47所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(v) 与seq id no:27所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(vi) 与seq id no:27所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(vii) 与seq id no:37所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:41所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(viii) 与seq id no:37所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vh序列,和与seq id no:48所示的氨基酸序列具有至少90%、至少95%、至少97%或至少99%的氨基酸序列同一性的vl序列,(ix) 与seq id no:40所示的氨基酸序列具有至少90%、至少95%、至少97%或至少
no:27所示的vh序列和seq id no:28所示的vl序列。
[0549]
38. 前述实施方案中任一项的双特异性抗体,其中第一抗原结合区是源自igg1-hucd3-h1l1-feal的半-分子抗体和第二抗原结合区是源自igg1-7d8-fear的半-分子抗体。
[0550]
39. 前述实施方案中任一项的双特异性抗体,其中第一结合臂是源自igg1-hucd3-h1l1-fear的半-分子抗体和第二结合臂是源自igg1-7d8-feal的半-分子抗体。
[0551]
40. 实施方案1-37中任一项的双特异性抗体,其中所述第一和第二重链各自至少包含铰链区、ch2和ch3区,其中在所述第一重链中对应于选自人igg1重链的t366, l368, k370, d399, f405, y407和k409的位置的位置中的至少一个氨基酸已被置换,和在所述第二重链中对应于选自人igg1重链的t366, l368, k370, d399, f405, y407和k409的位置的位置中的至少一个氨基酸已被置换,和其中所述第一重链和所述第二重链未在相同的位置上被置换。
[0552]
41. 实施方案40的双特异性抗体,其中(i) 在所述第一重链中对应于人igg1重链的f405的位置的氨基酸是l,和在所述第二重链中对应于人igg1重链的k409的位置的氨基酸是r,或(ii) 在所述第一重链中对应于人igg1重链的k409的位置的氨基酸是r,和在所述第二重链中对应于人igg1重链的f405的位置的氨基酸是l。
[0553]
42. 实施方案1-41中任一项的双特异性抗体,其中双特异性抗体包含第一恒定重链(hc)和第一恒定轻链(lc),其中第一重链和第二重链二者的对应于seq id no:15的人igg1重链的位置l234, l235和d265的位置分别是f、e和a。
[0554]
43. 实施方案1-41中任一项的双特异性抗体,其中双特异性抗体包含第一和第二恒定重链(hc)和第一和第二恒定轻链(lc),其中第一重链和第二重链二者的对应于seq id no:15的人igg1重链的位置l234和l235的位置分别是f和e。
[0555]
44. 实施方案1-43中任一项的双特异性抗体,其中第一结合臂是源自igg1-hucd3-h1l1-feal的半-分子抗体和第二结合臂是源自igg1-7d8-fear的半-分子抗体。
[0556]
45. 实施方案1-43中任一项的双特异性抗体,其中第一结合臂是源自igg1-hucd3-h1l1-fear的半-分子抗体和第二结合臂是源自igg1-7d8-feal的半-分子抗体。
[0557]
46. 实施方案1-45中任一项的双特异性抗体,其中双特异性抗体包含第一和第二恒定重链(hc)和第一和第二恒定轻链(lc),其中第一恒定重链和第二恒定重链二者的对应于seq id no:15的人igg1重链的位置l234, l235和d265的位置分别是f、e和a,和其中第一恒定重链的对应于seq id no:15的人igg1重链的f405的位置是l,和第二恒定重链的对应于seq id no:15的人igg1重链的k409的位置是r。
[0558]
47. 实施方案1-45中任一项的双特异性抗体,其中双特异性抗体包含恒定重链(hc)和恒定轻链(lc),其中第一重链和第二重链二者的对应于seq id no:15的人igg1重链的位置l234和l235的位置分别是f和e,和其中第一重链的对应于seq id no:15的人igg1重链的f405的位置是l,和第二重链的对应于seq id no:15的人igg1重链的k409的位置是r。
[0559]
48. 前述实施方案中任一项的双特异性抗体,其中所述抗体包含fc区,其已被修饰使得与野生型抗体相比,c1q与所述抗体的结合减少至少70%、至少80%、至少90%、至少95%、至少97%或100%,其中c1q结合通过elisa测定。
[0560]
49. 编码实施方案1-48的一个或多个氨基酸序列的核酸构建体。
[0561]
50. 编码实施方案1-48中任一项定义的双特异性抗体的核酸构建体。
[0562]
51. 表达载体,其包含:(i) 编码前述实施方案1-23中任一项定义的第一结合臂的重链序列的核酸序列;(ii) 编码前述实施方案1-23中任一项定义的第一结合臂的轻链序列的核酸序列;(iii) 编码前述实施方案24-32中任一项定义的第二结合臂的重链序列的核酸序列;(iv) 编码前述实施方案24-32中任一项定义的第二结合臂的轻链序列的核酸序列;(v) (i)所示的核酸和(ii)所示的核酸;(vi) (iii)所示的核酸和(iv)所示的核酸;(vii) (i)、(ii)、(iii)和(iv)所示的核酸。
[0563]
52. 包含实施方案51的表达载体的宿主细胞。
[0564]
53. 实施方案52的宿主细胞,其中所述宿主细胞是重组的真核宿主细胞、重组的原核宿主细胞或重组的微生物宿主细胞。
[0565]
54. 包含前述实施方案1-48中任一项的双特异性抗体的组合物。
[0566]
55. 药物组合物,其包含前述实施方案1-48中任一项的双特异性抗体和药学上可接受的载体。
[0567]
56. 实施方案1-48中任一项的双特异性抗体,实施方案54的组合物或实施方案55的药物组合物,其用作药物。
[0568]
57. 实施方案1-48中任一项的双特异性抗体,实施方案54的组合物或实施方案55的药物组合物,其用于治疗疾病。
[0569]
58. 根据实施方案57使用的双特异性抗体,其中所述用途是用于治疗癌症。
[0570]
59. 根据实施方案58使用的双特异性抗体,其中所述用途是用于治疗b细胞恶性肿瘤。
[0571]
60. 根据实施方案58或59使用的双特异性抗体,其中所述用途是用于治疗nhl或b细胞白血病。
[0572]
61. 治疗疾病的方法,包括给予有需要的受试者实施方案1-48中任一项的双特异性抗体、实施方案54的组合物或实施方案55的药物组合物。
[0573]
62. 实施方案1-48中任一项的双特异性抗体在制备药物中的用途。
[0574]
63. 实施方案1-48中任一项的双特异性抗体在制备用于治疗癌症的药物中的用途。
[0575]
64. 实施方案63的用途,其中所述用途是用于治疗b细胞恶性肿瘤。
[0576]
65. 实施方案63或64的用途,其中所述用途是用于治疗nhl或b细胞白血病。
[0577]
66. 实施方案56-65中任一项的方法或用途,其中实施方案1-48中任一项的双特异性抗体的方法或用途与一种或多种另外的治疗剂,例如化学治疗剂组合使用。
[0578]
67. 用于产生前述实施方案1-48中任一项的双特异性抗体的方法,包括以下步骤:a) 培养包含实施方案51(v)的表达载体的宿主细胞,和从培养基纯化所述抗体;b) 培养包含实施方案51(vi)的表达载体的宿主细胞和从培养基纯化所述抗体;
如果未另外定义,是指igg1-hucd3-h1l1。
[0586]
在一些实例中,包含huclb-t3/4的重链和轻链可变区序列(分别为seq id no:17和18)的cd3抗体用作本发明的双特异性抗体的第一抗原结合区。huclb-t3/4是人源化形式的鼠cd3抗体clb-t3/4 (parren et al., res immunol. 1991, 142(9):749-63)。将两个序列(seq id no:17和18)克隆至相关的pcdna3.3 (invitrogen)表达载体和通过在hek293f细胞中共转染表达。得到的cd3抗体称为igg1-huclb-t3/4。
[0587]
人源化cd3抗体进一步公开于wo2015001085。
[0588]
cd20抗体用作本发明的双特异性抗体的第二结合臂的cd20抗体进一步公开于wo2004035607 (genmab)和wo2005103081 (genmab)。
[0589]
对照以下抗体在实施例中用作对照:cd3抗体igg1-cd3 (亲本cd3抗体sp34,分别具有seq id no:25和seq id no:26所示的vh和vl序列)igg1-hucd3 (h1l1) (分别具有seq id no:6和seq id no:10所示的vh和vl序列)igg1-huclb-t3/4bsigg1-hucd3-h1l1-fealxb12-fear (双特异性抗体,使用抗体b12作为第二臂,其是gp120特异性抗体(barbas, cf. j mol biol. 1993 apr 5;230(3):812-23)igg1-hucd3-h1l1-fealigg1-huclb-t3/4-fealcd20抗体igg1-7d8 (分别具有seq id no:27和seq id no:28所示的vh和vl序列)igg1-11b8 (分别具有seq id no:40和seq id no:41所示的vh和vl序列)igg1-2f2 (分别具有seq id no:37和seq id no:28所示的vh和vl序列)igg1-rtx (具有利妥昔单抗的vh和vl序列)igg1-ga101 (具有obinutuzumab的vh和vl序列,chembl1743048, us8883980,含野生型人igg1 fc结构域)igg1-2c6 (分别具有seq id no:47和seq id no:48所示的vh和vl序列)igg1-7d8-fearigg1-11b8-fearigg1-2f2-fearigg1-ga101-fearigg1-2c6-fear表4:在不同的b细胞系上7d8 cd20抗体结合的定量定量流式细胞术(qifikit
®
, dako;cat. no k0078)按所述进行(poncelet和carayon, 1985, j. immunol. meth. 85: 65-74),以量化在实施例中使用的不同的人b-细胞系上7d8 cd20抗体的结合,作为cd20表达的指示。为此,人b-细胞系用饱和浓度的7d8孵育,和结合的7d8分子的数量使用定量流式细胞术测定。
[0590]
抗-人cd20抗体7d8,其经工程改造以表达鼠fc结构域(10
ꢀµ
g/ml, mmigg1-7d8 (overdijk et al. 2012, j. immunol. 189: 3430-3438),用于该测定法。b-all:b细胞急性成淋巴细胞性白血病,abc-dlbcl:活化的b细胞弥散性大b-细胞淋巴瘤,gc-dlbcl:生发中心弥散性大b-细胞-淋巴瘤,fl:滤泡性淋巴瘤。
[0591]
实施例2
ꢀ‑ꢀ
通过2-mea-诱导的fab-臂交换产生双特异性抗体产生双特异性抗体的体外方法描述于wo2008119353 (genmab)和由van der neut-kolfschoten et al. (science. 2007 sep 14;317(5844):1554-7)报道。在本文中,双特异性抗体通过在温和还原条件下孵育后在两种单特异性igg4-或igg4-样抗体之间“fab-臂”或“半-分子”交换形成(重链和连接的轻链的交换)。不受理论的限制,这种fab-臂交换反应是二硫键异构化反应的结果,其中单特异性抗体的铰链区的重链间二硫键减少,和得到的游离半胱氨酸与具有不同的特异性的另一抗体分子的半胱氨酸残基形成新的重链间二硫键。得到的产物是具有不同序列的两个fab臂的双特异性抗体。
[0592]
这种天然igg4 fab-臂交换的知识经改编以得到用于产生稳定的基于igg1的双特异性抗体的方法(wo2011131746 (genmab))。通过该下述方法产生的双特异性抗体产物不再参与igg4 fab-臂交换。这种方法的基础是使用互补的ch3结构域,其在特定的测定条件下促进异源二聚体的形成。为了能够通过该方法产生双特异性抗体,产生在ch3结构域中带有某些突变的igg1分子:在一种亲本igg1抗体中t350i, k370t和f405l突变(或最少f405l),在另一种亲本igg1抗体中k409r突变。
[0593]
为产生双特异性抗体,这2种亲本抗体,各抗体终浓度为0.5 mg/ml (等摩尔浓度),用25 mm 2-巯基乙基胺-hcl (2-mea)在总体积100
ꢀµ
l tris-edta (te)中在37
°
c孵育90 min。当还原剂2-mea使用离心柱(microcon离心滤器, 30k, millipore)根据制造商的方案除去时,终止还原反应。
[0594]
实施例3
ꢀ–
产生突变体以优化人源化cd3抗体的产生hucd3-l1突变体质粒的产生产生具有l1轻链突变的数种igg1-hucd3-h1l1变体,以提高在瞬时转染测定法中igg1-hucd3-h1l1的表达水平,参考表5。残基的选择基于与种系序列的比较,或筛选hucd3-l1序列中罕见残基的存在与来自同源抗体的晶体结构组合。选择的序列在geneart (life technologies, germany)分析。p33l编码人seq id no:29的iglc2/iglc3 λ轻链的恒定结构域。p33g1f编码seq id no:15的igg1m(f)重链恒定区。
[0595]
表5
在expi293f细胞中瞬时表达对于单一抗体,编码重链(hc)和轻链(lc)的质粒被瞬时转染至freestyle expi293f细胞(life technologies, usa),使用expifectamine 293 (life technologies)。将总共1.5
ꢀµ
g hc编码质粒和1.5
ꢀµ
g lc编码质粒(表5)稀释在150
ꢀµ
l opti-mem (gibco, usa)中。为制备转染混合物,将8
ꢀµ
l expifectamine 293稀释在150
ꢀµ
l opti-mem中和在室温下孵育5分钟。接着,将dna/opti-mem和expifectamine 293/opti-mem溶液混合,在室温下孵育20分钟和加入至2.55 ml expi293表达培养基,其包含7.5x10
6 expi293f细胞和50 u/ml pen-strep。将细胞在37
°
c, 8% co2中孵育和以200 rpm振动。为提高表达,转染后21小时,加入15
ꢀµ
l增强混合物1和150
ꢀµ
l增强混合物2。将细胞孵育4天,接着收获上清液。上清液以3,000xg离心和经0.2
ꢀµ
m滤器过滤除菌。igg表达水平在octet red (fortebio, us)上使用抗-人igg传感器(fortebio, usa)测量。
[0596]
igg浓度分析igg1-hucd3-h1l1抗体以72
ꢀµ
g/ml表达。对于igg1-hucd3-h1l1-lt41k突变体观察到igg表达增加4倍(295
ꢀµ
g/ml)。对于igg1-hucd3-h1l1-llknh突变体观察到类似的表达水平(311
ꢀµ
g/ml),特别包括t41k突变。当单独测试(igg1-hucd3-h1l1-lf10l, igg1-hucd3-h1l1-lk55n, igg1-hucd3-h1l1-ll97h)时,与igg1-hucd3-h1l1相比,这些构建体中的其它突变未显示表达提高。
[0597]
对于r23a和a35p的组合观察到第二组表达提高的突变。尽管缺少r23a和a35p的igg1-hucd3-h1l1-lltgpeaey变体未显示提高的表达(83
ꢀµ
g/ml),但包含另外的r23a和a35p突变的igg1-hucd3-h1l1-llaptgpeaey的确显示表达增加3倍(237
ꢀµ
g/ml)。单独地,r23a或a35p未显示提高的表达水平(分别56和81
ꢀµ
g/ml)。
[0598]
实施例4
ꢀ‑ꢀ
双特异性cd3xcd20抗体结合daudi和jurkat细胞
technologies, cat. no. 15061)或自pbmc使用dynabeads
®ꢀ
untouched
™ꢀ
人t细胞分离试剂盒(invitrogen;cat. no. 11344d),根据制造商的说明书获得。将细胞在pbs中洗涤两次,和使用t
ü
rk溶液计数和调整至1 x 106细胞/ml的浓度。
[0610]
细胞毒性测定法:将50
ꢀµ
l 51
cr-标记的靶细胞加入96-孔圆底板。加入50
ꢀµ
l抗体(终浓度范围10 pg/ml-10
ꢀµ
g/ml)/rpmi
后,将细胞在室温下孵育10 min。
[0611]
加入50
ꢀµ
l效应细胞(按所示的效应:靶标比率)、triton-x-100 (1.7%终浓度;测定最大溶解)或rpmi
(测定背景溶解)。将细胞在37
°
c, 5% co2孵育24-48小时。离心细胞(1,200 rpm, 3 min.)后,收获75
ꢀµ
l的上清液至1.4-ml管(micronic;cat. no. mp226rn)和在γ计数器(perkin elmer)中计数。特异性溶解百分比如下计算:%特异性溶解 = (cpm 样品
ꢀ–ꢀ
cpm 仅靶细胞)/(cpm 最大溶解
ꢀ–ꢀ
cpm 仅靶细胞) x 100。cpm= 计数/分钟。
[0612]
图3显示当使用pbmc (图3a, 3m)和纯化的t细胞(图3b-3l, 3n)作为效应细胞时,包含cd3-特异性fab臂(半-分子) (源自igg1-hucd3-h1l1-feal或igg1-huclb-t3/4-feal)和cd20-特异性fab臂(即,半-分子) (源自igg1-cd20-7d8-fear, igg1-cd20-11b8-fear, igg1-cd20-2f2-fear, igg1-cd20-rtx-fear, igg1-cd20-2c6-fear或igg1-cd20-ga101-fear)的所有双特异性抗体能够在测试的b细胞系中诱导细胞毒性。具有惰性fc结构域的单特异性二价抗体(igg1-7d8-fear, igg1-11b8-fear, igg1-hucd3-h1l1-feal, igg1-huclb-t3/4-feal)不能够在b细胞系中诱导t细胞-或pbmc-介导的细胞毒性。这表明,对于cd3xcd20双特异性抗体,细胞毒性取决于双特异性抗体与cd3和cd20二者结合。如之前公开的,具有活性的fc的单特异性二价cd20抗体(igg1-7d8和igg1-11b8-f405l)能够在daudi细胞中诱导通过pbmc的抗体-依赖性细胞-介导的细胞毒性(图3a, 3m)。在此情况下,主要的效应细胞是天然杀伤(nk)细胞。cd3xc20双特异性抗体在低于单特异性二价cd20抗体的浓度下是有活性的。图3c-3f显示igg1-huclb-t3/4-和igg1-hucd3-h1l1-来源的cd3臂二者诱导细胞毒性,具有类似的功效。此外图3g-3m显示,使用获自各种b细胞系的肿瘤细胞系获得类似的结果。这些细胞系源自不同的b细胞肿瘤,如表4。该表还显示了这些细胞系上的cd20表达水平。
[0613]
实施例7
ꢀ‑ꢀ
通过bsigg1-hucd3-h1l1-fealxcd20-7d8-fear,使用纯化的人外周血cd4
和cd8
t细胞作为效应细胞,体外诱导细胞毒性为了确定bsigg1-hucd3-h1l1-fealxcd20-7d8-fear是否能够诱导cd4和cd8 t细胞二者的细胞毒性活性,细胞毒性测定法使用不同的t细胞子集作为效应细胞进行。按上所述制备daudi细胞作为靶细胞。
[0614]
pbmc自来自健康供体的血沉棕黄层,使用淋巴细胞分离培养基,按上所述分离。
[0615]
t细胞(总t细胞群体,cd4
或cd8
t细胞群体)自pbmc,使用dynabeads
®ꢀ
untouched
™ꢀ
人t细胞、dynabeads
®ꢀ
untouched
™ꢀ
人cd4 t细胞或dynabeads
®ꢀ
untouched
™ꢀ
人cd8 t细胞细胞分离试剂盒(invitrogen, 目录号分别为11344d, 11352d和11348d)分离。分离后,各级分的纯度通过流式细胞术测定。细胞用cd3 (cd3-per-cp;becton dickinson, cat. no. 345766)和cd8 (cd8-apc;becton dickinson, cat. no. 555369)抗体在4
°
c孵育30 min,以鉴定不同的t细胞子集。通过流式细胞术,使用配备有自动化载板器(becton dickinson)的facscantoii分析样品。进行cd3/cd8象限分析以量化
cd3 事件(总t细胞群体)、cd3
cd8
双-阳性事件(cd8
t细胞群体)和cd3
cd8-事件(cd4
t细胞群体)的频率。
[0616]
总t细胞以10:1效应:靶标比率加入daudi细胞,cd4
t细胞以8:1效应:靶标比率加入和cd8
t细胞以4:1或8:1效应:靶标(e/t)比率加入(按所示) (图4a),和按上所述进行细胞毒性测定。为了测试当作为效应细胞加入时cd4
t细胞是否抑制cd8
t细胞的活性,使用仅cd8
t细胞(e/t比率4:1)或cd8
t细胞(e/t比率4:1)以及cd4
t细胞(e/t比率8:1)作为效应细胞(图4b)进行细胞毒性测定。
[0617]
图4a显示bsigg1-hucd3-h1l1-fealxcd20-7d8-fear在daudi细胞中诱导t-细胞-依赖性细胞毒性,使用总t细胞、cd4
t细胞或cd8
t细胞作为效应细胞。抗体bsigg1-hucd3-h1l1-fealxb12-fear和igg1-7d8-fear,此处用作阴性对照,不诱导daudi细胞的细胞毒性(数据未显示),表明细胞毒性取决于cd3和cd20二者被双特异性分子识别。图4b显示加入cd4
t细胞至cd8
t细胞作为效应细胞,不减少bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的功效。
[0618]
表6显示分离的细胞级分的纯度是~ 90%或更高。
[0619]
表6:t-细胞子集的纯度,通过流式细胞术测定实施例8
ꢀ‑ꢀ
使用纯化的t细胞作为效应细胞,通过bsigg1-huclb-t3/4-fealxcd20-7d8-fear的体外细胞毒性诱导的动力学为了测定bsigg1-huclb-t3/4-fealxcd20-7d8-fear-诱导的体外细胞毒性的动力学,daudi细胞用bsigg1-huclb-t3/4-fealxcd20-7d8-fear在存在纯化的t细胞的情况下孵育,和在不同的时间点评价细胞毒性。按上所述进行细胞毒性测定法,不同之处在于不仅24小时后,而且在孵育后范围3-24小时的不同的时间点收获上清液。
[0620]
图5显示两个独立实验的结果,用源自两个不同的供体的纯化的t细胞进行。使用来自第一供体的纯化的t细胞,12小时后观察到剂量-依赖性细胞毒性,和48-72小时后细胞毒性甚至更加有效(图5a)。在存在来自第二供体的纯化的t细胞的情况下,bsigg1-huclb-t3/4-fealxcd20-7d8-fear能够在孵育后早至3小时诱导细胞毒性,和在16-24小时孵育后功效增加(图5b)。
[0621]
实施例9
ꢀ‑ꢀ
通过不同的效应:靶标比率的cd3xcd20双特异性抗体,体外诱导细胞毒性的功效为了测定包含源自不同的cd20抗体的cd20 fab-臂的cd3xcd20双特异性抗体的细胞毒性诱导的功效,使用不同的效应:靶标比率,按上所述进行细胞毒性测定。pbmc用作效应细胞和daudi细胞用作靶细胞。
[0622]
如图6所示,甚至在10:1和25:1之间的e/t比率时,对于cd3xcd20双特异性抗体观察到细胞杀伤。
[0623]
实施例10
ꢀ‑ꢀ
在nod-scid小鼠的raji-luc共-移植模型中cd3xcd20双特异性抗体
的细胞毒性bsigg1-hucd3-h1l1-fealxcd20-7d8-fear, bsigg1-hucd3-h1l1-fealxcd20-11b8-fear和bsigg1-huclb-t3/4-fealxcd20-7d8-fear的体内抗-肿瘤功效在皮下raji-luc共-移植模型中评价。在此模型中,人未刺激的pbmc,作为人t细胞的来源,与肿瘤细胞共接种,类似于brischwein et al. (mol. immunol. 43 (2006), 1129
–
1143)描述的模型。在第0天,在200
ꢀµ
l pbs/0.1% bsa中包含5x10
6 pbmc和5x10
6 raji-luc细胞的混合物经皮下(s.c.)在各小鼠的右侧接种(雌性nod-scid小鼠;nod.c.b-17-prkdcscid/j, charles-river, 6-11周龄)。注射1小时内,将小鼠分为治疗组(4-5只小鼠/治疗组[实验示于图7a-f]或10只小鼠/治疗组[实验示于图7g-i]),和各组经静脉内(i.v.)注射单剂量的100-150
ꢀµ
l (双特异性)抗体/pbs。治疗组示于表7 (对于图7a, b, c中所示的实验)、表8 (对于图7d, e, f中所示的实验)和表8.1 (对于图7g, h, i中所示的实验)。以至少两次/周测定肿瘤体积。肿瘤体积(mm3)根据卡尺(plexx)测量计算为:0.52 x (长度) x (宽度)2。
[0624]
raji-luc细胞通过转染gwiz萤光素酶(gts, san diego, usa)产生。将细胞融化,在补充有10%供体牛血清与铁(gibco, cat. no. 10371-029)、青霉素/链霉素和丙酮酸钠和1
ꢀµ
g/ml嘌呤霉素(sigma, zwijndrecht, the netherlands;cat. no. p-8833)的rpmi (lonza, be12-115f)中培养。在对数期收获细胞和通过锥虫蓝排除计数。
[0625]
对于各研究,人pbmc自健康供体血沉棕黄层按上所述分离,冷冻和使用前融化。将所有细胞在pbs /0.1% bsa中洗涤,通过细胞滤器过滤和在pbs/0.1% bsa中重悬至浓度50 x 106细胞/ml。
[0626]
结果显示在图7中。0.05和0.5 mg/kg剂量的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear有效地减少raji-luc肿瘤大小。0.005 mg/kg的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear不影响肿瘤生长(图7a)。肿瘤接种后第21天(所有治疗组完成的最后一天),用0.5 mg/kg bsigg1-hucd3-h1l1-fealxcd20-7d8-fear治疗的小鼠的平均肿瘤大小显著小于用溶媒对照pbs治疗的小鼠(图7b) (p《0.01, kruskal wallis检验,接着dunn多重比较事后检验)。kaplan-meier分析证实,用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear (0.5和0.05 mg/kg)治疗后的无肿瘤生存显著好于用pbs治疗后(分别对于0.5和0.05 mg/kg治疗组,p《0.01和p《0.05,mantel cox分析) (图7c)。
[0627]
类似地,用剂量0.05和0.5 mg/kg的bsigg1-huclb-t3/4-fealxcd20-7d8-fear治疗显著抑制肿瘤生长(图7d)。肿瘤接种后第25天(所有治疗组完成的最后一天),用0.05和0.5 mg/kg bsigg1-huclb-t3/4-fealxcd20-7d8-fear治疗的小鼠的平均肿瘤大小明显小于用溶媒对照(pbs)治疗的小鼠(p《0.05, kruskal wallis检验,接着dunn多重比较事后检验) (图7e)。kaplan-meier分析证实,用bsigg1-huclb-t3/4-fealxcd20-7d8-fear (0.5和0.05 mg/kg)治疗后的无肿瘤生存显著好于用溶媒对照(pbs)治疗后(p《0.01, mantel cox分析) (图7f)。
[0628]
图7g显示bsigg1-hucd3-h1l1-fealxcd20-7d8-fear (测试的所有剂量)和bsigg1-hucd3-h1l1-fealxcd20-11b8-fear (0.05 mg/kg)二者诱导肿瘤生长的延迟。肿瘤接种后第20天(所有治疗组完成的最后一天),用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear (0.005, 0.05和0.5 mg/kg)治疗的小鼠和用0.05 mg/kg bsigg1-hucd3-h1l1-fealxcd20-11b8-fear治疗的小鼠的平均肿瘤大小显著小于用溶媒对照(pbs)治疗的小鼠(对于所有组
p《0.05,除了bsigg1-hucd3-h1l1-fealxcd20-7d8-fear 0.005
ꢀµ
g/kg组之外,其中p《0.01;单向anova,接着tukey多重比较事后检验) (图7h)。kaplan-meier分析证实,所有治疗组的无肿瘤生存,除了0.005 mg/kg的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear之外,显著好于用溶媒对照(pbs)治疗的小鼠(p《0.05, mantel cox分析) (图7i)。
[0629]
表7组抗体剂量1pbs 2bsigg1-hucd3-h1l1-fealxcd20-7d8-fear0.1
µ
g(~0.005mg/kg)3bsigg1-hucd3-h1l1-fealxcd20-7d8-fear1
µ
g(~0.05mg/kg)4bsigg1-hucd3-h1l1-fealxcd20-7d8-fear10
µ
g(~0.5mg/kg)表8组抗体剂量1pbs 2bsigg1-huclb-t3/4-fealxcd20-7d8-fear1
µ
g(~0.05mg/kg)3bsigg1-huclb-t3/4-fealxcd20-7d8-fear10
µ
g(~0.5mg/kg)4bsigg1-huclb-t3/4-fealxb12-fear1
µ
g(~0.05mg/kg)5bsigg1-huclb-t3/4-fealxb12-fear10
µ
g(~0.5mg/kg)表8.1组抗体剂量1pbs 2bsigg1-hucd3-h1l1-fealxcd20-7d8-fear1
µ
g(~0.05mg/kg)3bsigg1-hucd3-h1l1-fealxcd20-7d8-fear10
µ
g(~0.5mg/kg)4bsigg1-hucd3-h1l1-fealxcd20-7d8-fear1
µ
g(~0.05mg/kg)5bsigg1-hucd3-h1l1-fealxcd20-11b8-fear10
µ
g(~0.5mg/kg)6bsigg1-hucd3-h1l1-fealxcd20-11b8-fear1
µ
g(~0.05mg/kg)7bsigg1-hucd3-h1l1-fealxcd20-11b8-fear10
µ
g(~0.5mg/kg)实施例11
ꢀ–ꢀ
bsigg1-hucd3-h1l1-fealxcd20-7d8-fear在人源化免疫系统小鼠异种移植物模型中的抗-肿瘤活性bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的体内抗-肿瘤功效在人源化免疫系统(his)小鼠中评价,所述小鼠用人daudi-luc肿瘤细胞(brgs-his-daudi-luc)接种(在axenis, paris, france进行实验)。在此模型中,人生血cd34
祖细胞(~ 1 x 105细胞)获自脐带血和肝内注射至新生balb/c rag2tm1fwa il-2rγc tm1cgn sirpαnod (brgs)小鼠,如legrand et al. (pnas. 108 (2011), 13224
–
13229)所述。14周后,brgs小鼠的人源化通过流式细胞术证实。随后,根据在人cd45
群体中人cd3
t细胞的百分数,将小鼠分成三个组(7只小鼠/组) (29.5
ꢀ±ꢀ
7.5, 28.4
ꢀ±ꢀ
9.4和28.3
ꢀ±ꢀ
11.6,分别对于pbs-, bsigg1-hucd3-h1l1-fealxb12-fear-和bsigg1-hucd3-h1l1-fealxcd20-7d8-fear-治疗组)。第15周时,将5 x 10
6 daudi-luc细胞/100
ꢀµ
l pbs静脉内注射(i.v.)至brgs-his小鼠,这指定为研究的第0天。在第3和7天,向含daudi-luc细胞的brgs-his小鼠经i.v.注射1 mg/kg (双特异性)抗体。治疗组显示于表9。肿瘤生长通过生物发光成像(bli)每周评价(第2天开始)。
小鼠经腹膜内注射(i.p) 100
ꢀµ
l萤火虫d-萤光素(30 mg/ml;caliper lifesciences)和使用biospace生物发光成像系统(perkinelmer)测量生物发光。此外,在第9天获得每个小鼠的血液样品和进行流式细胞术以测定不同的白细胞群体的百分数(总人白细胞: hcd45
mcd45-群体;b细胞: hcd3-hcd19
群体;t细胞: hcd3
hcd19
‑ 群体和活化的t细胞: hcd3
hcd19-fsc
hi 群体。以下抗体用于染色:抗-hcd45克隆hi30,用alexa fluor
®ꢀ
700标记(biolegend, cat. no. 304023;最终稀释 1:50);抗-mcd45克隆30-f11,用别藻蓝蛋白(apc)-efluor
®ꢀ
780标记(ebioscience, cat. no. 47-0451-80;最终稀释 1:200);抗-hcd3克隆ucht1,用efluor
®ꢀ
450标记(ebioscience, cat. no. 48-0038-80;最终稀释1:50),抗-hcd19克隆hib19,用藻红蛋白(pe)标记(becton dickinson, cat. no.561741 ;最终稀释 1:25)。
[0630]
结果显示在图8。自图8a可见,剂量1 mg/kg的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear有效地减少肿瘤负荷。对照双特异性抗体bsigg1-hucd3-h1l1-fealxb12-fear不抑制肿瘤生长。第21天的肿瘤负荷的统计学比较(kruskal wallis检验,接着dunn多重比较事后检验)证实,bsigg1-hucd3-h1l1-fealxcd20-7d8-fear治疗组的肿瘤负荷显著低于溶媒(pbs)-治疗的动物(p 《 0.01)。bsigg1-hucd3-h1l1-fealxb12-fear和溶媒治疗组之间的差异不显著(图8b)。
[0631]
在图8c中,显示了通过流式细胞术测定的不同的人白细胞群体的百分数。循环人白细胞(hcd45
细胞)的百分数在所有组中相当。然而,在用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear治疗的小鼠中人b细胞的百分数强烈减少(p = 0.0012,与溶媒对照组相比,根据mann whitney检验)。用对照双特异性抗体bsigg1-hucd3-h1l1-fealxb12-fear治疗不影响人b细胞的百分数。活化的t细胞(hcd3
fsc
hi 群体)的百分数在用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear治疗的小鼠中升高(p=0.0093,与溶媒对照组相比,根据mann whitney检验)。用对照双特异性抗体bsigg1-hucd3-h1l1-fealxb12-fear治疗不显著改变活化的t细胞的数量。这表明用cd3xcd20双特异性抗体治疗后的t细胞活化依赖于cd3和cd20结合二者,而不依赖于单独的cd3结合。
[0632]
表9组抗体剂量1pbs 2bsigg1-hucd3-h1l1-fealxb12-fear1mg/kg(~20
µ
g) 3bsigg1-hucd3-h1l1-fealxcd20-7d8-fear1mg/kg(~20
µ
g) 实施例12
ꢀ–
在食蟹猴中测定cd3xcd20双特异性抗体的药理学和药代动力学的实验性研究在食蟹猴中通过本发明的一种cd3xcd20双特异性抗体 bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的安全性概况、药代动力学和b细胞耗尽的诱导根据下述研究测试。
[0633]
该研究的目的是在通过尾静脉单次静脉内输注后,测定bsigg1-hucd3-h1l1-fealxcd20-7d8-fear在雌性食蟹猴(macaca fascicularis,来源于mauritius, 大约2-3岁;重量范围2.5-3 kg)中的药代动力学特征、毒理学和药理学效果。在charles river laboratories, tranent, uk进行研究。亲本igg1抗体igg1-hucd3-h1l1和igg1-7d8,其经工程改造以制备双特异性分子,已显示分别与食蟹猴cd3和cd20交叉反应。将8只雌性食蟹
猴分配至4个剂量组,其接受剂量为0.01, 0.1, 1或10 mg/kg的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear,恒定剂量体积为10 ml/kg。各剂量组的一只动物在给予剂量后28天处死,而各剂量组的第二只动物当在该动物中的b-细胞计数已恢复到与给药前的值相当的水平时处死,如通过流式细胞术评价的(恢复动物)。该研究中使用的实践和程序与united kingdom department of health所述的oecd principles of good laboratory practice一致。
[0634]
在给药后不同的时间点,外周血中的b和t细胞群体通过流式细胞术分析。b细胞使用细胞表面标记物cd19和cd21鉴定(cd19
cd21
细胞);总t细胞作为cd4
和cd8
细胞的总和评价。如图9a所示,给予剂量水平1和10 mg/kg的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear导致通过测量的第一时间点(给药后1天),耗尽循环b细胞至不可检测的水平。剂量水平0.01和0.1 mg/kg仅显示部分耗尽或无耗尽。在1 mg/kg剂量组中b-细胞耗尽得到保持,直至给药后4-6周(28-42天),接着b-细胞水平恢复,在给药后9周(63天)达到给药前水平。在10 mg/kg剂量组中,b-细胞水平恢复仅开始于给药后9-10周(70天)。在所有剂量组中在给药后1天观察到循环t细胞数的瞬时降低(图9b)。在第3天接着的测量中t-细胞水平回到给药前水平,并保持恒定,直到实验结束。
[0635]
在给药后不同的时间点,自所有动物的浅表淋巴结(左侧和右侧腹股沟和腋窝)获得活组织检查样品(大约20 mg)。将活组织检查样品匀浆和通过流式细胞术评价b和t细胞的频率,作为总淋巴细胞群体的百分数(根据前散射-侧散射(fsc-ssc)鉴定)。b细胞使用细胞表面标志物cd19和cd21鉴定(cd19
cd21
细胞);总t细胞作为cd4
和cd8
细胞的总和鉴定。如图9c所示,给予剂量水平1和10 mg/kg的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear导致在测量的第一时间点(给药后7天)耗尽b细胞至不可检测的水平。在这些剂量组中b-细胞耗尽得到维持,直至给药后7周,接着b-细胞水平恢复,其在给药后13-14周(84-95天)仍未完成。剂量水平0.01和0.1 mg/kg在给药后16天诱导最大b-细胞耗尽,在给药后28天(0.01 mg/kg)观察到完全恢复或在给药后14周(95天) (0.1 mg/kg)部分恢复。在淋巴结中以任何剂量水平,未观察到t细胞频率的较大变化(图9d)。
[0636]
使用标准分析方法,分析血浆样品的细胞因子水平(il-2, il-6, il-8, il-10, ifn-γ和tnf-α)。给予bsigg1-hucd3-h1l1-fealxcd20-7d8-fear诱导血浆细胞因子水平的瞬时增加,其显示为剂量-依赖性的(图9e)。在给药后24小时,所有细胞因子水平回到给药前水平。
[0637]
bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的药代动力学概况通过分析给药前和给药后各个时间点直至70天获得的血浆样品进行分析。双特异性抗体的总浓度通过免疫pcr测定。药代动力学参数通过非区室分析(phoenix winnonlin)计算。结果显示在表10。剂量标准化的auc
0-∞
值(auc
0-∞
/dose)显示血浆暴露中的非线性增加。这些auc
0-∞
值的大于成比例增加表明bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的靶标-介导的清除。此外,与食蟹猴中给予的典型的igg1-型单克隆抗体相比,bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的药代动力学概况显示较快的初始分布和清除(图9f)。
[0638]
此外,测量在食蟹猴血清中对bsigg1-hucd3-h1l1-fealxcd20-7d8-fear的抗-药物抗体(ada)反应(数据未显示)。从15天起,在所有动物中观察到ada反应,除了10 mg/kg动物。
[0639]
表10。bsigg1-hucd3-h1l1-fealxcd20-7d8-fear在食蟹猴中的药代动力学特征实施例13
ꢀ–
参与cd3xcd20双特异性抗体的结合的cd20氨基酸的鉴定之前的研究表明,在cd20的细胞外环中的位置170的丙氨酸残基(a170)和特别是位置172的脯氨酸残基(p172)对于利妥昔单抗识别cd20是关键的(polyak et al. 2002, blood 99: 3256-3262;perosa et al. 2005, blood 107: 1070-1077)。在引入cd20细胞
外结构域的a170s和p172s突变(“axp突变”)后,利妥昔单抗完全失去与在hek293f上表达的cd20的结合。小鼠mab b1也显示与axp突变体强烈减少的结合,尽管观察到残留的结合。相比之下,igg1-2f2, igg1-7d8和igg1-2c6与cd20的结合不受axp突变影响。然而,改变位置163或166的天冬酰胺残基为天冬氨酸(分别为n163d或n166d)完全废除igg1-2c6的结合和减少igg1-2f2和igg1-7d8的结合达75%。除了n163d和n166d突变之外还具有位置159的苏氨酸至赖氨酸突变(t159k)的三重突变体(t159k/n163d/n166d,
ꢀ“
kdd突变”)废除2f2, 7d8和2c6的结合。kdd突变仅对利妥昔单抗和b1的结合具有适度的影响(teeling et al. 2006, the journal of immunology 177: 362-371)。
[0640]
为了检查cd3xcd20双特异性抗体与野生型(wt) cd20、axp突变体和kdd突变体的结合,使用合适的引物(引入限制位点和理想的kozak序列以便最佳表达),通过扩增cd20编码序列,构建cd20表达载体。扩增的片段经消化,和连接至表达载体pee12.4 (lonza, slough, uk)。转化至大肠杆菌后,筛选菌落的插入物,和选择两个克隆用于测序,以证实正确的序列。构建体称为pee12.4cd20hs-ga。进行诱变以在人cd20的细胞外环区域引入axp或kdd突变。诱变通过限制酶消化和测序检查。将构建体在hek293f细胞中瞬时表达和转染后24小时使用流式细胞术分析。
[0641]
寡核苷酸pcr引物:寡核苷酸引物通过isogen bv (maarssen, the netherlands)合成和定量。将引物复溶于水中,浓度为100 pmol/
µ
l和在-20
°
c贮存直至使用。pcr和测序引物的概述示于表11。
[0642]
核酸的光密度测定:使用ultrospec 2100 pro classic (amersham biosciences, uppsala, sweden),根据制造商的说明书测定光密度。dna浓度通过分析od260nm测量,其中1个od260nm单位 = 50
ꢀµ
g/ml。参比溶液与用于溶解核酸的溶液相同。
[0643]
自大肠杆菌培养物分离质粒dna:使用来自qiagen (westburg bv, leusden, the netherlands)的试剂盒,根据制造商的说明书,自大肠杆菌培养物分离质粒dna。对于“大量”质粒制备,使用hi-speed plasmid maxi试剂盒或hi-speed plasmid midi试剂盒(qiagen)。对小规模质粒制备(即,2 ml的大肠杆菌培养物),使用qiaprep spin miniprep试剂盒(qiagen)和将dna在50
ꢀµ
l te (tris-hcl 10 mm ph 8.0, edta 1 mm)中洗脱。
[0644]
pcr扩增:根据对于pfu-turbo
©ꢀ
hotstart dna聚合酶的制造商的说明书(stratagene, amsterdam, the netherlands),进行pcr反应。各20 ml-反应包含1 x pcr反应缓冲液、200 mm混合dntps、6.7 pmol的各正向引物和反向引物、大约1 ng模板dna和1单位的pfu-turbo
©ꢀ
hotstart dna聚合酶。pcr反应在t-gradient thermocycler 96 (biometra gmbh, goettingen, germany)上进行,使用30个循环程序: 95
°
c 2 min,接着30个循环的 95
°
c 30 sec;退火:梯度45-65
°
c 30 sec和延伸: 72
°
c 2 min,接着最后延伸步骤72
°
c 10 min和随后贮存在4
°
c。完成的反应通过琼脂糖凝胶电泳分析。
[0645]
琼脂糖凝胶电泳:琼脂糖凝胶电泳根据sambrook (molecular cloning laboratory manual, 3rd edition),使用50 ml凝胶,在1 x tris/乙酸/edta (tae)缓冲液中进行。dna通过在凝胶中包含溴化乙锭可视化,和在uv光下观察。通过ccd相机和图像分析系统(genegnome;syngene, cambridge, uk)记录凝胶图像。
[0646]
限制酶消化:限制酶由new england biolabs (beverly, ma)提供和根据供应商的建议使用。一般而言,100 ng用5单位的酶在合适的缓冲液中以总体积10 ml消化。反应体
积按合适进行放大。消化液在制造商推荐的温度下孵育最少60 min。
[0647]
对于需要用具有不相容的缓冲液或温度需要的限制酶双重消化的片段而言,序贯进行消化以对于每种酶依次提供有利的条件。
[0648]
碱性磷酸酶处理:虾碱性磷酸酶(usb, cleveland, oh)根据供应商的建议使用。碱性磷酸酶从dna片段的末端除去5
’‑
磷酸基团,从而防止自连接。当dna片段的自身再连接可产生能够复制的载体时,这特别相关。该酶在大多数限制酶缓冲液中是有活性的和按合适加入。消化后,该酶通过升高温度至70
°
c达15 min失活。
[0649]
pcr和限制酶反应产物的纯化:使用mini型洗脱pcr纯化试剂盒(由qiagen提供),根据制造商的说明书进行纯化。简言之,dna样品稀释在5倍体积的结合缓冲液i (qiagen)中,并上样到eppendorf离心管内的mini型洗脱柱。将组件在台式微量离心机中离心。将柱用缓冲液ii (qiagen)洗涤两次:施加缓冲液后,将组件离心,和弃去穿流液。在不加入缓冲液的情况下通过离心将柱干燥。dna通过向柱加入洗脱缓冲液洗脱和通过离心收集洗出液。分离的dna通过uv光谱法定量,和通过琼脂糖凝胶电泳评价质量。
[0650]
从琼脂糖凝胶分离dna片段:合适时(即,当存在多个片段时),消化的dna样品通过凝胶电泳分离和需要的片段从凝胶上切下,和使用qiaex ii凝胶提取试剂盒(qiagen),根据制造商的说明书回收。简言之,将dna条带从琼脂糖凝胶上切下,并在合适的缓冲液中在 55
°
c融化。将qiaex ii树脂加入和孵育5 min。qiaex ii树脂通过短暂离心步骤沉淀(1 min, 14000 g, 室温)和用500
ꢀµ
l洗涤缓冲液pe (cat. no. 19065, qiagen)洗涤两次。最终的沉淀在通风橱干燥,和dna用合适体积的te和在合适的温度下(取决于dna的大小)洗脱。
[0651]
dna片段的连接:用quick ligation kit (new england biolabs),根据制造商的说明书进行连接。对于每次连接,载体dna与大约3倍摩尔过量的插入物dna混合,使得dna总量低于200 ng/10
ꢀµ
l,体积用水按合适调整。向其加入10
ꢀµ
l 2 x quick ligation buffer和1
ꢀµ
l quick t4 dna连接酶和连接混合物在室温下孵育5-30 min。
[0652]
转化dna至细菌:使用热休克方法,根据制造商的说明书,dna样品用于转化one shot dh5α-t1r感受态大肠杆菌细胞(invitrogen, breda, the netherlands)。简言之,将1-5
ꢀµ
l的dna溶液(通常2
ꢀµ
l的dna连接混合物)加入至等份的转化感受态细菌细胞,并将混合物在冰上孵育30 min。细胞然后通过转移至42
°
c水浴30 sec热休克,接着在冰上进一步孵育5 min。通过在无选择性培养基(soc)中孵育使细胞恢复,同时在37
°
c搅拌1小时,随后涂布到包含合适的选择剂(青霉素,50
ꢀµ
g/ml)的琼脂板上。将板在 37
°
c孵育16-18小时或直至细菌菌落变得明显。
[0653]
通过pcr筛选细菌菌落:使用pcr菌落筛选技术,筛选细菌菌落中包含需要序列的载体的存在。将20
ꢀµ
l包含0.5体积的hotstartaq master mix (qiagen)、4 pmol的正向和反向引物和用水补足的pcr反应混合物加入至pcr管中。用20
ꢀµ
l的移液管头轻轻触碰菌落,其马上触碰在培养管中的2 ml lb (用于生长包含相应质粒的细菌)和悬浮于20
ꢀµ
l pcr混合物。在tgradient thermocycler 96 (biometra)上使用35个循环程序进行pcr: 95
°
c 15 min,接着35个循环: 94
°
c 30 sec, 退火:55
°
c 30 sec和延伸: 72
°
c 2 min,接着最后延伸步骤72
°
c 10 min和随后贮存在4
°
c。完成的反应通过琼脂糖凝胶电泳分析。对于用于菌落pcr的引物对的细节,参见表11。
[0654]
dna测序:将质粒dna样品送到agowa (berlin, germany)进行序列分析。序列使用载体nti软件包(informax, frederick, md, usa)分析。
[0655]
表11诱变:使用quikchange
®ꢀ
xl定点诱变试剂盒(cat 200517-5, lot 1120630, stratagene europe),根据制造商的说明书进行诱变。
[0656]
诱变反应物使用乙醇沉淀浓缩和转化至oneshot dh5α-tir感受态大肠杆菌细胞或电穿孔至electroten-blue
®
电穿孔-感受态细胞。通过菌落pcr检查菌落,和在转染前进
行限制酶消化。
[0657]
hek293f细胞转染:hek293f细胞获自invitrogen和根据制造商的说明书,使用293fectin转染。
[0658]
抗-cd20抗体结合:将hek293f细胞置于染色缓冲液(pbs,补充有0.1% bsa和0.02% nan3)和加入至圆底板(1-3 x 105/孔,100
ꢀµ
l)。然后,以连续稀释(0.0015-10
ꢀµ
g/ml,3倍稀释) (4
°
c, 30 min),加入50
ꢀµ
l cd3xcd20双特异性抗体。
[0659]
在染色缓冲液中洗涤两次后,将细胞在50 μl第二抗体中在4
°
c孵育30 min。作为第二抗体,使用r-藻红蛋白(pe)-缀合的山羊-抗-人igg f(ab’)2,按上所述。接着,将细胞在染色缓冲液中洗涤一次,重悬于150 μl染色缓冲液和在流式细胞仪上分析(facscanto-720, becton dickinson, san diego, ca, usa)和以高流速获得10,000事件/样品。结合曲线使用非线性回归(s形剂量反应,具有可变斜率),使用graphpad prism v75.04软件(graphpad software, san diego, ca, usa)分析。
[0660]
所有cd3xcd20双特异性抗体有效结合表达wt cd20的hek293f细胞(图10a)。如图10b和表12所示,bsigg1-hucd3-h1l1-fealxcd20-7d8-fear, bsigg1-hucd3-h1l1-fealxcd20-2f2-fear, bsigg1-hucd3-h1l1-fealxcd20-11b8-fear和bsigg1-hucd3-h1l1-fealxcd20-2c6-fear有效结合axp突变体。类似地,bsigg1-huclb-3/4-fealxcd20-7d8-fear, bsigg1-huclb-3/4-fealxcd20-2f2-fear和bsigg1-huclb-3/4-fealxcd20-11b8-fear显示有效结合cd20-axp。如所预期的,bsigg1-hucd3-h1l1-fealxcd20-rtx-fear完全丢失与axp突变体的结合,如之前对于亲本抗体igg1-rtx所示的。bsigg1-hucd3-h1l1-fealxcd20-ga101-fear显示极大减少与cd20-axp的结合。
[0661]
在引入kdd突变后,bsigg1-hucd3-h1l1-fealxcd20-7d8-fear, bsigg1-hucd3-h1l1-fealxcd20-2f2-fear和bsigg1-hucd3-h1l1-fealxcd20-2c6-fear,以及bsigg1-huclb-3/4-fealxcd20-7d8-fear和bsigg1-huclb-3/4-fealxcd20-2f2-fear丢失与cd20的结合(表12),证实了单价结合cd20的这些双特异性抗体分别显示与亲本抗体igg1-7d8, igg1-2f2和igg1-2c6相当的结合特征。当存在kdd突变时,bsigg1-hucd3-h1l1-fealxcd20-11b8-fear和bsigg1-huclb-3/4-fealxcd20-11b8-fear部分地失去与cd20的结合。
[0662]
表12:cd3xcd20双特异性抗体与cd20突变体的结合cd3xcd20双特异性抗体与hek293f细胞中表达的cd20突变体的结合通过流式细胞术测定。数量指示在10
ꢀµ
g/ml时,相对于与野生型cd20的结合,与cd20突变体的结合百分数。结合百分数通过下式计算:(mfi与cd20突变体的结合)/(mfi与cd20 wt的结合) x 100%
实施例14
ꢀ–
使用bio-layer干涉法测定cd3结合亲和力为测定cd3xcd20双特异性抗体对cd3的亲和力,在fortebio octet htx上进行bio-layer干涉法。抗-人fc capture (ahc)生物传感器(fortebio, portsmouth, uk;cat no. 18-5060)用cd3xcd20双特异性抗体(1 μg/ml)加载600 s,目标是加载反应1 nm。基线(200 s)后,可溶性cd3ε27-gska的缔合(1000 s)和离解(2000 s)使用范围1 nm和1000 nm的浓度测定。cd3ε27-gska 蛋白由融合至κ lc的n-末端的人cd3ε 肽 (aa1-27)组成(seq id no: 402)。对于计算,使用基于氨基酸序列的cd3ε27-gska的理论分子量,即,27.1 kda。在振动条件下(1000 rpm)在30
°
c进行实验。
[0663]
数据用fortebio数据分析软件v8.1,使用1:1模型和整体完全拟合分析,其中1000 s缔合时间和200 s离解时间。数据迹线通过减去参比曲线(cd3xcd20双特异性抗体,没有cd3ε27-gska)校正,y-轴对齐至基线的最后10 s,和应用步间校正以及savitzky-golay过滤。具有低于0.05 nm的反应的数据迹线从分析中排除。
[0664]
cd3xcd20双特异性抗体的平衡离解常数(kd)都在亲本igg1-hucd3-h1l1-feal分子的kd的2倍内。
[0665]
表13:选择的cd3xcd20双特异性抗体的平衡离解常数(kd)、缔合速率(k
on
)和离解速率(k
dis
)
抗体idkd(m)k
on
(1/ms)k
dis
(1/s)igg1-hucd3-h1l1-feal1.4e-083.2e 054.5e-03bsigg1-hucd3-h1l1-fealxcd20-2f2-fear1.5e-082.7e 054.1e-03bsigg1-hucd3-h1l1-fealxcd20-ga101-fear1.5e-082.7e 054.0e-03bsigg1-hucd3-h1l1-fealxcd20-11b8-fear1.2e-084.1e 054.8e-03bsigg1-hucd3-h1l1-fealxcd20-2c6-fear0.81e-083.3e 052.7e-03bsigg1-hucd3-h1l1-fealxcd20-rtx-fear1.1e-083.9e 054.3e-03bsigg1-hucd3-h1l1-fealxcd20-7d8-fear1.1e-083.8e 054.3e-03bsigg1-hucd3-h1l1-fealxcd20-b12-fear2.1e-081.7e 053.7e-03
实施例15
ꢀ–ꢀ
bsigg1-hucd3-h1l1-fealxcd20-7d8-fear在b细胞的存在下诱导t细胞活化在b细胞的存在下cd3xcd20双特异性抗体诱导t细胞活化的能力通过用bsigg1-hucd3-h1l1-fealxcd20-7d8-fear孵育pbmc测试。t细胞活化通过测量cd69表达评价。
[0666]
pbmc,按上述自健康供体分离,加入至96-孔圆底培养板(greiner bio-one, cat 650180;100,000细胞/孔)和用稀释在rpmi
中的bsigg1-hucd3-h1l1-fealxcd20-7d8-fear (最终抗体浓度0.1
ꢀ–ꢀ
1000 ng/ml)孵育。各孔的最终体积是100
ꢀµ
l。igg1-hucd3-h1l1-feal和igg1-huclb-t3/4-feal,二者均是二价cd3-特异性igg1抗体,具有失活的fc结构域,以及同种型对照igg1-b12-feal包括在内作为阴性对照抗体。ige-huclb-t3/4,二价cd3-特异性ige抗体,其已知诱导t细胞活化,和igg1-huclb-t3/4-f405l,二价cd3特异性igg1抗体,具有活性的fc结构域,包括在内作为阳性对照。pbmc用抗体(37
°
c, 5% co2)孵育16-24小时。
[0667]
为了评价t细胞活化,将pbmc在染色缓冲液中洗涤两次,和重悬于包含apc-标记的小鼠抗-人cd69抗体(bd pharmingen, cat 340560;最终稀释 1:100)和pe-标记ide小鼠抗-人cd28抗体(milteny biotech, cat 130-092-921;最终稀释 1:40)的染色缓冲液(终体积50
ꢀµ
l)。在4
°
c 30分钟后,将细胞洗涤两次。将细胞悬浮于150
ꢀµ
l染色缓冲液和使用facs canto ii (bd)分析。apc (cd69)的中值荧光强度在一群cd28-阳性细胞中评价。cd28用作标记物以鉴定t细胞。
[0668]
如图11所示,bsigg1-hucd3-h1l1-fealxcd20-7d8-fear诱导t细胞的剂量-依赖性活化,如通过在外周血t细胞中cd69表达的增加所示的。在用阳性对照ige-huclb-t3/4和igg1-hu-clb3/4-f405l孵育后也观察到t细胞活化。相比之下,阴性对照抗体igg1-hucd3-h1l1-feal, igg1-huclb-t3/4-feal和igg1-b12-feal不诱导cd69表达。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。