1.本发明涉及一种产岩藻糖基乳糖的基因工程菌及生产方法,属于代谢工程和食品发酵技术。
背景技术:
2.人乳寡糖(human milk oligosaccharides,hmos)是人乳中仅次于乳糖和脂肪的第三大固体组分。hmos作为母乳中重要的免疫活性成分,对婴幼儿健康及生长发育起到至关重要的作用,并且越来越多的动物和临床试验证实了hmos的有益特性,例如作为益生元维持肠道生态平衡、抵抗病原菌的黏附、免疫调节以及促进神经系统发育和修复等多种功能活性。岩藻糖基乳糖包括2
’‑
岩藻糖基乳糖(2
’‑
fl)和3-岩藻糖基乳糖(3-fl)是母乳中分泌最丰富的中性人乳寡糖,约占hmos总量的35%,因其在营养保健和药物用途中的潜在应用而受到了极大的关注。目前,欧盟,美国和中国已批准2
’‑
fl作为新食品成分使用,且对其安全性、适用性以及使用剂量等进行了规范。
3.岩藻糖基乳糖的生产可采用母乳分离、化学合成、酶法合成和微生物发酵。因母乳来源有限及化学合成过程需精准地对侧链保护和脱保护,过程繁琐,使得岩藻糖基乳糖的高效合成受限。酶法合成岩藻糖基乳糖,可根据受体和糖基供体的构型筛选合适的酶类,但是核苷供体gdp-岩藻糖、udp-半乳糖等价格昂贵,且糖基转移酶的催化活力低,产量仅有毫克级别,无法实现大规模的工业化制造。随着代谢工程和合成生物学的发展,通过操控微生物的遗传单元、重构细胞生化网络,构建新的底盘微生物,利用微生物合成岩藻糖基乳糖已显然成为具有绿色高效及可持续发展特征的制造策略。
4.目前,研究较多的是以大肠杆菌为模式生物,通过从头合成途径和补救途径代谢生产gdp-l-岩藻糖,在此基础上异源表达岩藻糖基转移酶,最终发酵得到岩藻糖基乳糖。大肠杆菌具备生长迅速、培养简单、重组子稳定、载体受体系统完备等特点,是作为gdp-岩藻糖合成研究的理想模式微生物。在从头合成途径中,工程菌可直接利用廉价的底物(甘油和葡萄糖)实现关键前体gdp-岩藻糖和受体乳糖的高效合成,进而为岩藻糖基乳糖的工业制备提供了有利条件。本发明旨在利用合成生物学手段,基于从头合成途径构建岩藻糖基乳糖的大肠杆菌细胞工厂,通过解析底盘微生物的代谢网络,采用crispr/cas9基因编辑技术对宿主细胞中的旁路相关基因进行敲除,强化细胞代谢流,实现了代谢通路的全局优化;开展代谢途径的模块化表达,通过多质粒表达系统进行基因组装,构建不同拷贝数的表达载体以增加关键基因的表达水平;筛选不同来源的岩藻糖基转移酶提高限速酶的活力。该方法为岩藻糖基乳糖的批量生产提供了有效途径,同时具有较强的理论研究价值和社会经济效益,市场开发前景广阔。
技术实现要素:
5.[技术问题]
[0006]
现有技术生产岩藻糖基乳糖的成本高昂,糖苷供体昂贵且产量较低,不足以实现
工业化生产,无法提供高效生产岩藻糖基乳糖的菌株,也不能提供成本低廉且绿色高效的岩藻糖基乳糖的制备方法。
[0007]
[技术方案]
[0008]
本发明为了解决现有生物法合成的岩藻糖基乳糖产量较低的问题,提供了一种产2
’‑
fl和/或3-fl的基因工程菌及其构建方法。
[0009]
本发明的第一个目的是提供一种基因工程菌,所述基因工程菌敲除了β-半乳糖苷酶基因lacz、udp-葡萄糖脂质载体转移酶基因wcaj、gdp-甘露糖甘露糖基水解酶基因nudd、gdp-甘露糖水解酶基因nudk、6-磷酸果糖激酶-1基因pfka、6-磷酸果糖激酶-2基因pfkb、甘露醇-1-磷酸脱氢酶基因mtld、蛋白酶基因lon、果糖-6-磷酸醛缩酶a基因fsaa、果糖-6-磷酸醛缩酶b基因fsab和岩藻糖异构酶/墨角藻糖激酶fuci-fuck基因簇中的一种或多种基因,并表达了磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag。
[0010]
在一种实施方式中,所述基因工程菌敲除了β-半乳糖苷酶基因lacz,并在此基础上分别敲除了udp-葡萄糖脂质载体转移酶基因wcaj、gdp-甘露糖甘露糖基水解酶基因nudd、gdp-甘露糖水解酶基因nudk、6-磷酸果糖激酶-1基因pfka、6-磷酸果糖激酶-2基因pfkb、甘露醇-1-磷酸脱氢酶基因mtld、蛋白酶基因lon、果糖-6-磷酸醛缩酶a基因fsaa、果糖-6-磷酸醛缩酶b基因fsab和岩藻糖异构酶/墨角藻糖激酶fuci-fuck基因簇,并同时表达了磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag。
[0011]
在一种实施方式中,所述基因工程菌同时敲除了β-半乳糖苷酶基因lacz和udp-葡萄糖脂质载体转移酶基因wcaj,并在此基础上分别敲除了gdp-甘露糖甘露糖基水解酶基因nudd、gdp-甘露糖水解酶基因nudk、6-磷酸果糖激酶-1基因pfka、6-磷酸果糖激酶-2基因pfkb、甘露醇-1-磷酸脱氢酶基因mtld、蛋白酶基因lon、果糖-6-磷酸醛缩酶a基因fsaa、果糖-6-磷酸醛缩酶b基因fsab和岩藻糖异构酶/墨角藻糖激酶fuci-fuck基因簇,并同时表达了磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag。
[0012]
在一种实施方式中,所述基因工程菌同时敲除了β-半乳糖苷酶基因lacz、udp-葡萄糖脂质载体转移酶基因wcaj和gdp-甘露糖甘露糖基水解酶基因nudd,并在此基础上敲除了6-磷酸果糖激酶-1基因pfka或蛋白酶基因lon,并同时表达了磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag。
[0013]
在一种实施方式中,所述基因工程菌同时敲除了β-半乳糖苷酶基因lacz、udp-葡萄糖脂质载体转移酶基因wcaj、gdp-甘露糖甘露糖基水解酶基因nudd和6-磷酸果糖激酶-1基因pfka并在此基础上敲除了蛋白酶基因lon,并同时表达了磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag。
[0014]
在一种实施方式中,在上述基因工程菌中表达α-1,2岩藻糖基转移酶基因或α-1,3岩藻糖基转移酶基因。
[0015]
在一种实施方式中,所述β-半乳糖苷酶基因lacz的gene id为945006,udp-葡萄糖
脂质载体转移酶基因wcaj的gene id为946583,gdp-甘露糖甘露糖基水解酶基因nudd的gene id为946559,gdp-甘露糖水解酶基因nudk的gene id为947072,6-磷酸果糖激酶-1基因pfka的gene id为948412,6-磷酸果糖激酶-2基因pfkb的gene id为946230,甘露醇-1-磷酸脱氢酶基因mtld的gene id为948117,蛋白酶基因lon的gene id为945085,果糖-6-磷酸醛缩酶a基因fsaa的gene id为945449,果糖-6-磷酸醛缩酶b基因fsab的gene id为948439,岩藻糖异构酶/墨角藻糖激酶fuci-fuck基因簇的gene id为946195和946022。
[0016]
在一种实施方式中,所述α-1,2岩藻糖基转移酶基因分别筛选来源于幽门螺杆菌atcc 26695的hpfutc、细长嗜热聚球藻bp-1的tvfutc、嗜热蓝藻的tsfutc、人参假单胞菌的ppfutc、大肠杆菌o126的ecwbgl以及脆弱拟杆菌的bfwcfb,α-1,3岩藻糖基转移酶基因分别筛选来源于幽门螺杆菌nctc 11639的m32和幽门螺杆菌atcc 26695的hpfuta。
[0017]
在一种实施方式中,来源于幽门螺杆菌atcc 26695、细长嗜热聚球藻bp-1、嗜热蓝藻、人参假单胞菌、大肠杆菌o126和脆弱拟杆菌的α-1,2岩藻糖基转移酶基因的核苷酸序列分别如seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5、seq id no.6所示;来源于幽门螺杆菌nctc 11639、幽门螺杆菌atcc 26695的α-1,3岩藻糖基转移酶基因的核苷酸序列分别如seq id no.7、seq id no.8所示。
[0018]
在一种实施方式中,所述编码磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd和gdp-岩藻糖合成酶基因wcag均来源于大肠杆菌k12 mg655。
[0019]
在一种实施方式中,磷酸甘露糖变位酶基因manb的核苷酸序列如seq id no.9所示,甘露糖-1-磷酸鸟嘌呤基转移酶基因manc的核苷酸序列如seq id no.10所示,gdp-甘露糖-6-脱氢酶基因gmd的核苷酸序列如seq id no.11所示,gdp-岩藻糖合成酶基因wcag的核苷酸序列如seq id no.12所示。
[0020]
在一种实施方式中,所述基因工程菌以大肠杆菌为宿主。
[0021]
在一种实施方式中,所述基因工程菌利用prsfduet-1、petduet-1、pcdfduet-1、pacycduet-1或pcoladuet-1载体过表达基因manb、manc、gmd、wcag、futc和/或m32。
[0022]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达幽门螺杆菌atcc 26695来源的hpfutc。
[0023]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达细长嗜热聚球藻bp-1来源的tvfutc。
[0024]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达嗜热蓝藻来源的tsfutc。
[0025]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达人参假单胞菌来源的ppfutc。
[0026]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达大肠杆菌o126来源的ecwbgl。
[0027]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达脆弱拟杆菌来源的bfwcfb。
[0028]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达幽门螺杆菌nctc 11639来源的m32。
[0029]
在一种实施方式中,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达幽门螺杆菌atcc 26695来源的hpfuta。
[0030]
本发明提供了一种构建所述基因工程菌的方法,在大肠杆菌bl21(de3)基因组中敲除了β-半乳糖苷酶基因lacz、udp-葡萄糖脂质载体转移酶基因wcaj、gdp-甘露糖甘露糖基水解酶基因nudd、6-磷酸果糖激酶-1基因pfka和蛋白酶基因lon,通过多质粒表达系统过表达磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag、α-1,2岩藻糖基转移酶基因futc和/或α-1,3岩藻糖基转移酶基因m32。
[0031]
在一种实施方式中,表达载体为prsfduet-1、petduet-1、pcdfduet-1、pacycduet-1和/或pcoladuet-1,所述基因工程菌利用prsfduet-1表达manb、manc、gmd和wcag,利用petduet-1表达hpfutc或m32。
[0032]
本发明提供了一种生产岩藻糖基乳糖的方法,以所述的工程菌为发酵菌株,在以甘油为碳源、以iptg为诱导剂的含乳糖发酵体系中生产2
’‑
岩藻糖基乳糖和3-岩藻糖基乳糖。
[0033]
在一种实施方式中,所述甘油在发酵体系中的浓度为10~30g/l。
[0034]
在一种实施方式中,所述发酵体系中还含有甘油20~30g/l,磷酸二氢钾10~15g/l,柠檬酸1~2g/l,磷酸氢二氨3~5g/l,七水硫酸镁1~2g/l,酵母提取物8~10g/l,微量金属溶液8~10ml/l。
[0035]
在一种实施方式中,所述微量金属溶液中含有柠檬酸三铁8~10g/l,七水硫酸镁2~3g/l,五水硫酸铜0.5~1.0g/l,一水硫酸锰0.2~0.5g/l,硼砂0.2~0.5g/l,钼酸铵0.1~0.2g/l,二水氯化钙1~2g/l。
[0036]
在一种实施方式中,将所述基因工程菌在发酵体系中培养至od
600
为0.6
±
0.1,加入终浓度为0.2~0.3mm的iptg及终浓度为5~10g/l的乳糖,在20~30℃下培养不少于70h。
[0037]
在一种实施方式中,将所述基因工程菌在发酵体系中培养至od
600
为20
±
3,加入终浓度为0.1~0.3mm的iptg及终浓度为5~15g/l的乳糖,在20~30℃诱导培养,维持发酵体系中的溶氧为20~50%,ph为6.5~7.0。
[0038]
在一种实施方式中,待反应体系中初始甘油消耗完后流加甘油,使得甘油的浓度能够保持菌体生长和代谢。
[0039]
在一种实施方式中,待初始乳糖消耗完后补加乳糖,使其浓度维持在10g/l。
[0040]
在一种实施方式中,发酵时间不少于50h。
[0041]
本发明还提供了所述的基因工程菌在生产2
’‑
岩藻糖基乳糖和3-岩藻糖基乳糖及含有2
’‑
岩藻糖基乳糖和3-岩藻糖基乳糖产品中的应用。
[0042]
本发明的有益效果:
[0043]
本发明通过敲除大肠杆菌bl21(de3)中的岩藻糖基乳糖代谢途径中的β-半乳糖苷酶基因lacz、udp-葡萄糖脂质载体转移酶基因wcaj、gdp-甘露糖甘露糖基水解酶基因nudd、6-磷酸果糖激酶基因pfka和蛋白酶基因lon,组合调控从头合成2
’‑
fl和3-fl所需的磷酸甘露糖变位酶基因manb、甘露糖-1-磷酸鸟嘌呤基转移酶基因manc、gdp-甘露糖-6-脱氢酶基因gmd,gdp-岩藻糖合成酶基因wcag、α-1,2岩藻糖基转移酶基因hpfutc和/或α-1,3岩藻糖基转移酶基因m32的表达,实现了岩藻糖基乳糖在重组大肠杆菌中的高效合成。本发明利用
重组大肠杆菌制备2
’‑
fl和3-fl,具有培养基简单,底物廉价,菌株生长快,遗传稳定,表达水平高等优势,具备显著的工业化生产潜力。
[0044]
在摇瓶发酵培养条件下,本技术构建的基因工程菌生产2
’‑
fl的能力由初始的0.26g/l提升至6.24g/l,生产3
’‑
fl的能力由初始的0.22g/l提升至3.56g/l;在3l发酵罐培养条件下,2
’‑
fl和3-f的产量分别达到54.82和34.20g/l,为岩藻糖基乳糖的工业化生产奠定了基础。
附图说明
[0045]
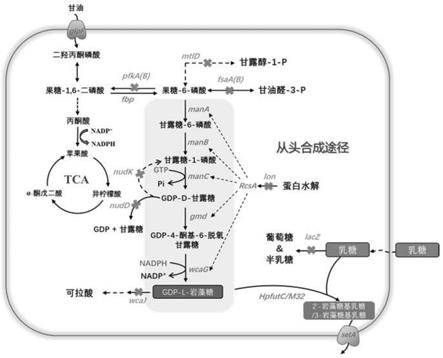
图1为岩藻糖基乳糖的代谢通路图。
[0046]
图2为菌株bzwndpal-c1摇瓶发酵生产2
’‑
fl。
[0047]
图3为菌株bzwndpal-m1摇瓶发酵生产3-fl。
[0048]
图4为菌株bzwndpal-c1的3l发酵罐补料分批发酵。
[0049]
图5为菌株bzwndpal-m1的3l发酵罐补料分批发酵。
[0050]
图6为2
’‑
fl的hplc检测结果。
[0051]
图7为3-fl的hplc检测结果。
具体实施方式
[0052]
以下结合实例与附图对本发明的具体实施作进一步的说明,以下实例中所使用的质粒、pcr试剂、限制性内切酶、质粒抽提试剂盒、dna胶回收试剂盒等采用商业产品,具体操作按照试剂盒说明书进行。
[0053]
本发明的实施方式不限于此,其他未注明的实验操作和工艺参数按照常规技术进行。
[0054]
载体prsfduet-1、petduet-1、pcdfduet-1、pacycduet-1和pcoladuet-1购自addgene。
[0055]
dna产物、质粒的测序工作交予天霖生物科技(无锡)有限公司完成。
[0056]
大肠杆菌感受态的制备:上海生工生物工程公司试剂盒。
[0057]
lb液体培养基:10g/l蛋白胨,5g/l酵母提取物,10g/l氯化钠。
[0058]
lb固体培养基:10g/l蛋白胨,5g/l酵母提取物,10g/l氯化钠,18g/l琼脂粉。
[0059]
发酵培养基:甘油30g/l,磷酸二氢钾13.5g/l,柠檬酸1.7g/l,磷酸氢二氨4.0g/l,七水硫酸镁1.4g/l,酵母提取物10g/l,微量金属溶液10ml/l(柠檬酸三铁10g/l,七水硫酸镁2.25g/l,五水硫酸铜1.0g/l,一水硫酸锰0.35g/l,硼砂0.23g/l,钼酸铵0.11g/l,二水氯化钙2.0g/l),ph 6.8。
[0060]2’‑
fl和3-fl的测定方法:
[0061]
使用hplc测定:1ml发酵液于100℃煮沸10min,12000r/min离心5min,上清液经0.22μm膜过滤处理,利用hplc检测岩藻糖基乳糖的生成量以及乳糖和甘油的消耗量。hplc检测条件:示差折光检测器;色谱柱为rezex roa-organic acid(phenomenex,usa),柱温为50℃;流动相为0.005mol/l的h2so4水溶液,流速为0.6ml/min;进样量为10μl。
[0062]
下述实施例中菌株的摇瓶发酵条件:工程菌单菌落接种于lb液体培养基,37℃,200rpm,摇瓶培养12h,得到种子液;将种子液以3%(v/v)的接种量接入50ml发酵培养基,37
℃,200rpm,摇瓶培养至od
600
为0.6;加入终浓度为0.3mm的iptg,同时加入乳糖至终浓度为8g/l,25℃,200rpm的条件下诱导培养72h。
[0063]
实施例1:crispr-cas9基因敲除技术改造大肠杆菌底盘微生物
[0064]
根据岩藻糖基乳糖的代谢通路(图1所示),以大肠杆菌bl21(de3)δlaczδwcaj为出发菌株(大肠杆菌bl21(de3)δlaczδwcaj的构建方法已公开于公开号为cn112342176a的专利文献中),利用crispr-cas9基因敲除系统分别或同时敲除了大肠杆菌bl21(de3)δlaczδwcaj基因组中的nudd、nudk、pfka、pfkb、mtld、lon、fsaa、fsab和fucik基因,具体步骤如下(所涉及到的引物序列见表1):
[0065]
(1)以nudd基因为例,通过http://www.regenome.net/cas-offinder查找靶标基因的特异性靶点grna(20bp),使用nudd-grna-f/grna-r上下游引物,以ptargetf质粒(addgene:#62226)为模板进行pcr扩增,扩增产物经限制性内切酶dpn i酶切,以去除多余的环状ptargetf质粒。后将扩增产物转化e.coli dh5α感受态细胞,小提质粒,使用引物grna-pf/grna-pr测序鉴定,将构建成功的敲除质粒命名为ptargetf-nudd。
[0066]
(2)以大肠杆菌bl21(de3)δlaczδwcaj基因组为模板,利用上游同源臂引物nudd-us-f/nudd-us-r和下游同源臂引物nudd-ds-f/nudd-ds-r分别扩增同源臂序列片段,产物纯化回收后采用soe-pcr方法用引物nudd-us-f/nudd-ds-r将两片段连接起来获得基因同源修复模板。
[0067]
(3)取pcas9质粒(addgene:#62225)及大肠杆菌bl21(de3)δlaczδwcaj电转感受态细胞,冰上放置5min后进行感受态融化,取10μl质粒加入100μl感受态细胞中,轻轻混匀。将质粒和电转感受态细胞转入预冷的电转杯中,2.5kv电击5ms,电击后迅速加入预冷的液体lb,轻轻吹打混匀后将混有质粒和感受态细胞的培养基转移到新的离心管中扩大培养1.5h。6000r/min离心2min,弃去上清液,菌体涂布于含有卡那抗性的lb平板上,放置于30℃培养箱过夜培养。
[0068]
(4)挑取大肠杆菌bl21(de3)δlaczδwcaj/pcas9单菌落于lb培养基中,30℃培养1.0h,加入终浓度为30mm的l-阿拉伯糖以诱导λ-red系统表达。当od
600
达到0.6-0.8时,制备大肠杆菌bl21(de3)δlaczδwcaj/pcas9感受态。
[0069]
(5)将500ng步骤(1)构建的带有nudd特异性靶点grna(20bp)的靶向质粒ptargetf和1000ng步骤(2)构建的同源修复模板电转至步骤(4)制备的大肠杆菌bl21(de3)δlaczδwcaj/pcas9感受态细胞,涂布于lb平板(卡那霉素和壮观霉素),30℃培养16-24h,对平板上长出的单菌落进行菌落pcr验证,筛选阳性转化子和进行基因测序。
[0070]
(6)对验证正确的单菌落进行ptargetf-nudd和pcas9质粒的消除,单菌落接种于lb液体培养基(卡那抗性)中,30℃、200r/min培养至对数生长期,加入终浓度为0.5mmol/l的iptg过夜培养,诱导ptargetf-nudd质粒失活。菌液划线含有kan的lb平板上,于30℃、200r/min培养12h。单菌落点板于卡那和壮观霉素的双抗性平板上,若无菌落生长,表明ptargetf-nudd质粒消除成功。
[0071]
(7)pcas9质粒为温敏型质粒,将消除成功ptargetf-nudd质粒的单菌落转接至lb无抗性液体培养基中,42℃传代培养消除pcas9质粒。菌液划线无抗性的lb平板后37℃恒温培养,单菌落点板于含卡那抗性的lb培养基中,若单菌落不生长,则表明pcas9质粒消除成功,将构建好的无ptargetf-nudd质粒和pcas9质粒的基因缺失菌株在-80℃条件下保存备
用。
[0072]
(8)基因nudk、pfka、pfkb、mtld、lon、fsaa、fsab和fucik基因的敲除操作参照上述基因nudd的敲除。
[0073]
表1.基因敲除引物
[0074]
[0075][0076]
实施例2:从头合成路径的构建及敲除菌株分批发酵生产岩藻糖基乳糖
[0077]
从头合成路径表达载体的构建具体步骤如下(涉及到的引物序列见表2):
[0078]
(1)manb,manc,gmd和wcag片段的获得:以大肠杆菌k12的基因组为模板,使用引物mancb_f/r和gw_f/r进行pcr扩增,胶回收dna,获得manc-manb、gmd-wcag基因片段。
[0079]
(2)以prsfduet-1、petduet-1、pcdfduet-1、pacycduet-1和pcoladuet-1为模板,使用引物v1_f/r和v2_f/r扩增载体骨架序列。根据in-fusion克隆技术,将片段manc-manb分别插入上述载体的nco i/bamh i酶切位点之间,片段gmd-wcag分别插入上述载体的nde i/xho i酶切位点之间,筛选阳性克隆并测序,最终得到重组质粒prsf-cbgw、pet-cbgw、pcdf-cbgw、pacyc-cbgw和pcola-cbgw。
[0080]
(3)hpfutc和m32基因片段的获得:委托天霖生物科技(上海)有限公司合成来源于幽门螺杆菌atcc26695的hpfutc基因序列(seq id no.1)和来源于幽门螺杆菌nctc 11639的m32基因序列(seq id no.7)。将合成后的目的基因片段通过无缝克隆试剂盒(南京诺唯赞生命科技有限公司)连接到载体prsfduet-1、petduet-1、pcdfduet-1、pacycduet-1和pcoladuet-1的nco i/bamh i酶切位点之间,分别获得质粒prsf-hpfutc、pet-hpfutc、pcdf-hpfutc、pacyc-hpfutc、pcola-hpfutc以及prsf-m32、pet-m32、pcdf-m32、pacyc-m32和pcola-m32。
[0081]
表2.质粒构建引物
[0082][0083][0084]
(4)将上述步骤中获得的质粒prsf-cbgw以及pet-hpfutc或pet-m32组合转入实施例1中获得的大肠杆菌菌株(见表3)。在单轮、二轮、三轮和四轮的基因敲除后,最终获得了产量均提升的bzw、bzwnd、bzwndpa、bzwndl和bzwndpal等缺陷菌株。摇瓶条件下,最佳菌株bzwndpal经72h发酵后产物2
’‑
fl和3-fl的产量最高达到6.24和3.56g/l(图2和图3),分别是原始菌株bl21(de3)的24倍和16倍。
[0085]
表3.菌株详细信息
[0086][0087][0088]
实施例3:模块途径工程优化岩藻糖基乳糖从头合成的代谢网络
[0089]
通过质粒表达系统进行基因组装,构建不同拷贝数的表达载体以增加上游关键基因和下游糖基转移酶的表达水平(实施例2)。采用5种不同强度的表达载体(pcolduet-1、pacycduet-1、pcdfduet-1、petduet-1和prsfduet-1)进行优化,将关键基因包括从头合成
途径的gmd,wcag,manc,manb划分为上游模块,将含有糖基转移酶的hpfutc或m32划分为下游模块。最终得到包含岩藻糖基乳糖完整代谢路径的多拷贝质粒系统。筛选出不同模块组合的表达载体,比较不同组合下岩藻糖基乳糖的生产性能。
[0090]
发酵实验结果显示,以e.coli bl21(de3)δlaczδwcajδnuddδpfkaδlon为宿主菌产2
’‑
fl或3-fl的最佳质粒组合为prsf-cbgw和pet-hpfutc/m32。在下游模块固定表达下,产物积累随上游模块表达强度的增加而呈上升趋势,固定上游模块的表达后,下游模块在略低于上游模块的表达强度时,产物积累较多。最佳菌株bzwndpal-c1和bzwndpal-m1经60h发酵后产物2
’‑
fl和3-fl的产量最高达到6.24和3.56g/l。
[0091]
表4.不同质粒组合的工程菌的详细信息
[0092][0093][0094]
实施例4:不同来源岩藻糖基转移酶的筛选
[0095]
(1)hpfutc、tvfutc、tsfutc、ppfutc、ecwbgl、bfwcfb、m32和futa基因片段的获得:
委托天霖生物科技(上海)有限公司合成来源于幽门螺杆菌atcc 26695的hpfutc基因序列、来源于细长嗜热聚球藻bp-1的tvfutc基因序列、来源于嗜热蓝藻的tsfutc基因序列、来源于人参假单胞菌的ppfutc基因序列、来源于大肠杆菌o126的ecwbgl基因序列、来源于脆弱拟杆菌的bfwcfb基因序列、来源于幽门螺杆菌nctc 11639的m32基因序列和来源于幽门螺杆菌atcc 26695的futa基因序列。将合成后的目的基因片段通过无缝克隆试剂盒(南京诺唯赞生命科技有限公司)连接到载体petduet-1的nco i/bamh i酶切位点之间,分别获得质粒pet-hpfutc、pet-tvfutc、pet-tsfutc、pet-ppfutc、pet-ecwbgl、pet-bfwcfb、pet-m32和pet-futa。
[0096]
(2)将实施例2中的表达载体prsf-cbgw和上述(1)中岩藻糖基转移酶的表达载体共转化至e.coli bl21(de3)δlaczδwcajδnuddδpfkaδlon,所得菌株如表5所示。发酵结果显示,来源于幽门螺杆菌atcc26695的hpfutc基因和来源于幽门螺杆菌nctc 11639的m32基因具备较强的岩藻糖基转化能力。
[0097]
表5.含不同来源岩藻糖基转移酶的工程菌
[0098][0099]
实施例5:bzwndpal菌株分批发酵及遗传稳定性分析
[0100]
1、bzwndpal菌株分批发酵
[0101]
(1)重组菌株bzwndpal-c1和bzwndpal-m1的单菌落接种于5ml种子液,37℃,200r/min回旋式摇床过夜培养。
[0102]
(2)重组菌株种子液以3.0%(v/v)的接种量接种于50ml发酵培养基,37℃,200r/min培养菌体od
600
至0.6-0.8,加入iptg终浓度为0.3mm,同时加入8g/l乳糖,诱导培养72h。
[0103]
(3)发酵过程定时取样,使用hplc检测发酵产物。发酵结果如图2和图3所示,重组菌摇瓶发酵过程中,bzwndpal-c1菌株代谢合成2
’‑
fl的积累量浓度可达6.24g/l,bzwndpal-m1菌株代谢合成3-fl的积累量浓度可达3.56g/l。
[0104]
2、菌株遗传稳定性
[0105]
将上述菌株bzwndpal-c1和bzwndpal-m1按照上述的摇瓶生产方法,传代培养6代,检测每代的2
’‑
fl和3-fl的产量,结果表6所示,筛选出的菌株在2
’‑
fl和3-fl生产中均保持稳定的生产性能,具备良好的遗传稳定。
[0106]
表6.重组菌株传代6次后2
’‑
fl和3-fl的产量(g/l)
[0107][0108]
实施例6:3l发酵罐补料分批发酵生产岩藻糖基乳糖
[0109]
为了制备高产量的2
’‑
fl和3-fl,使用重组菌bzwndpal-c1和bzwndpal-m1分别在3l发酵罐进行高密度的补料分批发酵。
[0110]
发酵条件:发酵培养基,接种量5%(v/v),诱导前培养温度37℃,待od
600
达到20,加入iptg诱导蛋白表达使得其在发酵体系中的浓度为0.2mmol/l,初始乳糖浓度为10g/l,诱导发酵温度为25℃。发酵全程使用nh4oh控制罐体ph恒定为6.80。为了维持菌体生长以及岩藻糖基乳糖的合成,待初始甘油消耗完后流加800g/l的甘油(含20g/l的mgso4·
7h2o)以补充碳源,通过ph反馈调节(设置流速为20ml/h)使甘油在发酵体系中的浓度维持在较低浓度水平(甘油用于菌体生长和代谢,浓度约为0g/l)至发酵结束,待初始乳糖消耗完后手动补加200g/l的乳糖并使其在发酵体系中的终浓度维持在10
±
2g/l,发酵过程中若乳糖消耗至较低浓度时继续补加乳糖至发酵结束。发酵过程中系统级联控制,通过调节转速,通气量和氧气使罐内溶氧为30
±
5%。
[0111]
发酵全程定时取样并测定菌体od
600
,1ml发酵液煮沸15min使细胞破碎完全,12000r/min离心10min,上清液经0.22μm膜过滤处理,发酵过程中利用hplc检测2
’‑
fl和3-fl的生成量以及乳糖和甘油的消耗量(图4和图5)。结果显示,发酵结束后(共发酵100小时),产物2
’‑
fl的浓度可达54.82g/l,产物3-fl的浓度可达34.2g/l。
[0112]
在发酵80、90、100小时2
’‑
fl的浓度分别为35.75、48.42、54.82g/l,转化率分别达到0.63、0.62、0.64mol 2
’‑
fl/mol乳糖。
[0113]
在发酵80、90、100小时3
’‑
fl的浓度分别为30.42、32.45、34.2g/l,转化率分别达到0.68、0.68、0.69mol 3-fl/mol乳糖。
[0114]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。