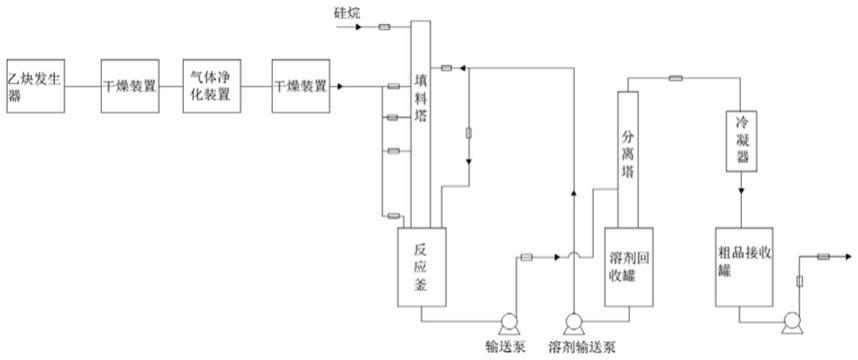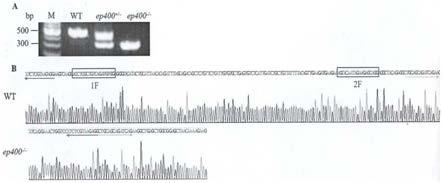
1.本发明涉及基因敲除领域,特别是公开了ep400基因敲除斑马鱼心力衰竭模型的构建及其应用的方法。
背景技术:
2.ep400(e1a binding protein p400)基因位于斑马鱼第8号染色体上,包含52个外显子,cdna全长9126bp,ep400是一种 swr1 类 atp 依赖性染色质重塑蛋白,与tip60组成组蛋白乙酰化tip60/p400复合物,参与多种基因的转录调节,同时在细胞进程中发挥着抑制细胞凋亡或衰老的作用,但目前为止,尚未有ep400与心脏疾病发生、发展相关报道。
3.斑马鱼与人类心脏发育过程中的基因、信号通路具有高度保守性;斑马鱼和哺乳动物心脏的相似性、个体小、易于饲养、发育快、繁殖能力强、体外受精、胚胎体外发育且透明等优点,同时斑马鱼生理病理特征与人类极为相似,使其广泛应用于疾病研究、遗传发育及药物筛选等领域。
4.基因编辑技术是目前动物模型建立、基因功能及疾病治疗研究中最主要的技术之一。crispr/cas9技术作为一种新型基因编辑技术,以操作简单、成本低,效率高等优点,使基因组靶向敲除得以在多物种中广泛应用,这极大地推动了基因功能与疾病模型的研究。该技术主要是利用缺失突变、基因灭活、染色体大片段删除以及外源基因导入等方式来改变生物的遗传信息,并且在生殖系中稳定遗传后表达突变性状,对研究生物体内特定基因在生长发育过程中的作用,以及构建疾病模型中具有广泛应用价值,因此这类技术已成为现代分子生物学研究热点。
5.crispr/cas9基因编辑系统由guide rna(简称grna)和cas9蛋白构成,在grna序列中,包含有一段与dna片段靶序列互补配对的20bp片段,及另一段用于招募cas9蛋白行使剪切功能的sgrna序列;cas9蛋白是一种rna介导的核酸酶,其能通过grna的介导对目的基因特定dna序列进行切割;需要补充的一点是,cas9蛋白在发挥剪切作用时,需要通过识别一段三联体碱基的pam序列(即ngg),然后将在pam序列上游3-8个碱基的位置处进行剪切,生物体自身将会激发机体自身的dna损伤修复机制,在修复过程中,靶序列位置会引起碱基的插入或缺失,以此实现靶基因的编辑。
6.
技术实现要素:
7.本发明基于crispr/cas9基因编辑技术,通过特异性grna组合敲除斑马鱼ep400基因第11号和12号外显子间162bp片段(其中外显子76bp,内含子86bp),构建斑马鱼ep400基因敲除品系;利用心脏转基因荧光品系在纯合子中荧光信号变化来深入探究体内ep400基因的生物学功能,通过观察分析斑马鱼心脏形态、心脏搏动及细胞组织结构的变化,以确定心力衰竭的突变表型,从而构建ep400基因敲除斑马鱼心力衰竭模型。这也是首次提出
ep400基因与心力衰竭疾病的发生具有相关性,将对心力衰竭疾病的致病机理及临床用药具有重要意义。
8.解决上述技术问题的技术方案如下:1)crispr/cas9技术ep400基因打靶位点grna的合成(1)通过ncbi和ensembl在线软件分析ep400基因第11和12号外显子序列,及依据crispr/cas9技术靶位点设计原则,设计靶位点合成的引物;(2)以线性化质粒p42250为模板,所设计的特异性靶位点pcr 引物进行pcr扩增;(3)dna片段纯化回收后,体外转录及rna纯化,即得grna(1f和2f)2)将cas9 蛋白和grna组成的注射体系,进行显微注射(1)预混合好cas9 蛋白和grna体系,显微注射装置调试好,待用;(2)选取发育至单细胞期的正常野生型斑马鱼胚胎,并放置在琼脂糖凝胶配置的注射板上,通过显微注射仪,将预混液注射一定量进入胚胎单细胞内;(3)将注射的胚胎培养,待后续实验所用3)斑马鱼ep400基因打靶位点grna有效性检测(1)待上述注射胚胎发育至48h左右,随机选取注射胚胎和对照组未注射胚胎各3管,每管8颗胚胎,加入适量裂解液,65℃过夜裂解,即可得到基因组dna;(2)以该基因组dna为模板,ep400-检-f/r为引物进行pcr扩增,待反应结束后,利用琼脂糖凝胶电泳对目的片段进行分析,同时通过对pcr产物进行sanger测序检测靶位点有效性4)斑马鱼ep400基因f0代嵌合体筛选将剩余注射的胚胎培养至性成熟后,进行基因型鉴定,筛选出f0代嵌合体5)斑马鱼ep400基因f1代基因敲除杂合子筛选将获得的f0代嵌合体与不同性别的野生型斑马鱼进行杂交,对获得的子代胚胎进行可遗传性检测,并将可遗传后代养大至成鱼即可获得ep400基因f1代基因敲除杂合突变体6)斑马鱼ep400基因f2代基因敲除纯合子筛选将基因型相同f1代杂合子成鱼进行交配(雌雄比例1:1),得到f2代胚胎,并将其养大至成鱼后进行基因型鉴定,即可获得ep400基因f1代基因敲除纯合子7)斑马鱼ep400基因敲除纯合子中心力衰竭突变表型观察与分析将f1代杂合子成鱼与斑马鱼心脏转基因标记品系(如:tg(cmlc2: egfp),tg(cypher: egfp)等)进行交配,得到稳定遗传携带荧光标记的ep400基因f1代杂合子,随后将该杂合子成鱼与未带荧光标记的f1代杂合子进行交配,收集培养胚胎,发育至一定时期,在共聚焦显微镜下观察并拍摄胚胎的心脏发育情况。
9.本发明的有益效果是:本发明基于crispr/cas9基因编辑技术,通过特异性grna组合敲除斑马鱼ep400基因第11号和12号外显子间162bp片段(其中外显子76bp,内含子86bp),构建斑马鱼ep400基因敲除品系,同时利用心脏转基因荧光品系在纯合子中荧光信号的变化观察并分析斑马鱼心脏形态、心脏搏动及细胞组织结构的变化,以确定心力衰竭的突变表型,从而构建ep400基因敲除斑马鱼心力衰竭模型。本发明将有助于探究体内ep400基因的生物学功能,同时也
是首次提出ep400基因与心力衰竭疾病的发生具有相关性,这将对心力衰竭致病机理及临床用药具有深远意义。
10.附图说明
11.图1为斑马鱼ep400基因打靶位点结构图;图2为斑马鱼ep400基因敲除品系基因型鉴定结果图;图3为野生型对照组wt和斑马鱼ep400基因纯合子基因序列比对结果图;图4为斑马鱼ep400基因纯合子心脏突变表型结果图
具体实施方式
12.下面结合说明书附图和具体的实施例,对本发明作详细描述。
13.实施例1:1)分别设计crispr/cas9基因敲除靶位点和检测引物在nationalcenterforbiotechnologyinformation(ncbi)上查询斑马鱼ep400基因的基因组dna序列,根据crispr/cas9敲除原理,在网站thezifittargeter(http://zifit.partners.org/zifit/)上设计ep400基因的打靶位点(打靶位点在第11号和12号外显子区域各选泽1个);特异性靶位点pcr引物如下:f1(正向引物)tgtaatacgactcactataggacctcgctgtcagatgtgggttttagagctagaaatagcf2(正向引物)tgtaatacgactcactataggtacaatagaagagcagggttttagagctagaaatagcr(反向引物):aagcaccgactcggtgccactpcr检测引物:f(5
’‑
gcttgcctctggaaattctgct-3’)r(5
’‑
tcgaagccctcagcgtaagcc-3’)2)特异性grna体外合成a、用bsai限制酶将p42250线性化,以线性化的p42250载体为模板,通过1)中特异性引物(f1/r和f2/r)进行pcr扩增,反应条件为:预变性95℃5min,(变性95℃30s,退火60℃30s,延伸72℃15s)35个循环,再72℃8min;待反应结束后,取1μl样品点样于1.6%琼脂糖凝胶,进行电泳检测,条带检测正确后,进行琼脂糖凝胶dna片段回收;pcr反应体系如下:ddh2o15μl2
×
buffer25μldntps(10mm)1μlprimerf1/f2(10um)2μlprimerr(10um)2μl模板4μl
高保真酶1μl总体积50μlb、测定纯化的dna浓度,再以此dna为模板,用20μl体系进行体外转录,合成特异性grna;体外转录反应体系:模板dna12μl10
×
buffer2μlratp(10mm)1μlrutp(10mm)1μlrctp(10mm)1μlrgtp(10mm)1μlt7rna聚合酶2μl总体积20μl将反应物全部加入1.5mlrnase-free的ep管中,混匀之后,于37℃水浴2.5h;然后向转录体系中加入1μldna酶,放置于37℃水浴锅中反应40-50min,用以消化dna模板;再取1μl转录终产物,即grna进行琼脂糖凝胶电泳,以检测转录效率;c、特异性grna的纯化用rneasyminikit试剂盒纯化转录成功的grna,保存于-20℃;吸取纯化后的grna溶液1μl进行浓度检测;3)斑马鱼胚胎的显微注射在受精后30min之内,用吸管吸取胚胎转移至用琼脂糖制作的显微注射专用培养皿中,提前预混好cas9蛋白和grna(1f和2f)注射体系(其中cas9蛋白购于thermofisher公司),cas9蛋白的浓度为5μg/μl,grna的终浓度在80-100ng/μl之间,注射约1.8nlcas9蛋白和grna混合液于一细胞期的受精卵内;注射过的受精卵放置于e3水中,28℃孵化培养;4)sanger测序检测靶位点的有效性对斑马鱼胚胎进行显微注射之后,随机选取3管胚胎,每管8颗胚胎,裂解提取基因组,a、提取斑马鱼基因组(1)斑马鱼胚胎受精48hpf后,分别收集野生型(对照组)和注射后胚胎于1.5mlep管中,每管8颗胚胎,向装有胚胎的ep管中加入100μl细胞裂解液,1μl蛋白酶k,放置于55℃恒温箱中裂解过夜;(2)将ep管放在振荡器上充分震荡,加入等体积预先冷却的异丙醇,充分颠倒混匀,于4℃条件下,12000rpm离心10min,倒掉上清液;(3)加入75%乙醇200μl,于4℃条件下,12000rpm离心5min,弃上清液,超净工作台中风干8-10min;(4)加入10μl去离子水,充分吹打混匀,即得斑马鱼基因组dna;b、pcr扩增目的序列提取基因组dna后,根据crispr靶位点上下游约100-300bp的基因组区域,利用
primerpremier3.0软件设计引物序列以扩增出目的dna片段;pcr反应体系如下:2
×
estaqmastermix10μlprimerf(10μm)0.6μlprimerr(10μm)0.6μl模板1μlddh2o7.8μl总体积20μl震荡混匀之后,4℃离心,于pcr仪上进行扩增反应,反应条件为:预变性95℃5min,(变性95℃30s,退火62℃30s,延伸72℃40s)30个循环,再72℃8min;c、用1.6%琼脂糖凝胶电泳检测pcr产物,其中pcr产物大小为498bp,靶位点1f和2f相差101bp,若所设计靶位点均有效,在琼脂糖凝胶电泳中还会得到1条小于498bp的条带,为了结果的可靠性,将送部分pcr产物进行sanger测序,由测序的峰图来进一步对所设靶位点1f和2f有效性进行检测;5)斑马鱼ep400基因f0代嵌合体筛选将3)中注射的胚胎养大至性成熟,收集成鱼部分鱼尾组织进行基因型鉴定,同上基因型鉴定步骤,即可筛选到斑马鱼ep400基因f0代嵌合体;6)斑马鱼ep400基因f1代杂合子筛选将得到的f0代嵌合体分别与野生型斑马鱼杂交得到f1代胚胎,置于28℃培养,在初期观察f1代的存活率;胚胎发育至48h后,每皿f1代胚胎分别取3管胚胎,每管8颗,进行突变遗传性鉴定;将每管胚胎单独提取基因组,进行pcr扩增反应,通过琼脂糖凝胶电泳对pcr片段大小进行检测,筛选获得可稳定遗传的斑马鱼ep400基因f1代杂合子(具体方法如前面所述);6)斑马鱼ep400基因f2代纯合子筛选将基因型相同的f1代杂合子进行雌雄1:1交配,并将该f2代胚胎培养于28℃恒温箱,获得斑马鱼ep400基因f2代纯合子7)斑马鱼ep400基因敲除纯合子中心力衰竭突变表型观察与分析将f1代杂合子成鱼与斑马鱼心脏转基因标记品系(如:tg(cmlc2:egfp),tg(cypher:egfp)等)进行交配,得到稳定遗传携带荧光标记的ep400基因f1代杂合子,随后将该杂合子成鱼与未带荧光标记的f1代杂合子进行交配,收集培养胚胎,发育至一定时期,在共聚焦显微镜下观察并拍摄胚胎的心脏发育情况。
14.图1为斑马鱼ep400基因打靶位点结构图;图2为斑马鱼ep400基因敲除品系基因型鉴定结果图,图a为斑马鱼f2代胚胎基因型检测电泳结果图,图b为wt和ep400基因敲除品系pcr产物测序峰图,从图中可知,已成功构建斑马鱼ep400基因敲除品系;图3为野生型对照组wt和斑马鱼ep400基因纯合子基因序列比对结果图,从图中可知,通过斑马鱼ep400基因敲除品系中缺失了162bp片段(其中内含子缺失86bp,外显子缺失76bp)。图4为斑马鱼ep400基因纯合子心脏突变表型结果图,图a为以转基因斑马鱼tg(cmlc2:egfp)为基础的表型结果图,从图中可知,与野生型对照组wt相比,当ep400-/-组胚胎发育至第四天(4d),心脏环化出现异常,发育至第五天时(5d),心脏发育更加畸形,形成了线性化心脏,同时发育过程中
伴随着腔室变小;图b为以转基因斑马鱼tg(cypher:egfp)为基础的表型结果图,从图中可知,与野生型对照组wt相比,ep400-/-组中发育至第四天和第五天胚胎出现了肌纤维分布疏松,心脏z线排列异常等突变表型,这些突变表型与已报道的心力衰竭表型高度一致。
15.本发明基于crispr/cas9基因编辑技术,通过特异性grna组合敲除ep400基因,首次构建ep400基因敲除斑马鱼心力衰竭模型。本发明提供的心力衰竭模型,一方面有助于深入探究体内ep400基因的生物学功能,为今后心力衰竭相关药物筛选提供理想的动物模型,这将对心力衰竭致病机理及临床用药具有深远意义。
16.以上所述,仅是本发明的较佳实施例,并非对本发明做任何形式上的限制,凡是依据本发明的技术实质上对以上实施例所作的任何简单修改、等同变化,均落入本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。