一种富集孕妇血浆中胎儿dna的方法和试剂盒
技术领域
1.本发明属于分子生物学领域,尤其涉及一种富集孕妇血浆中胎儿dna的方法和试剂盒。
背景技术:
2.血浆dna又称循环dna,是血液中的细胞外dna,长约几十到几百核苷酸。1997年卢煜明教授在怀有男胎的孕妇血浆中检出y染色体序列1,由此发现在孕妇血浆中含有游离胎儿dna(cell-free fetal dna,cffdna)片段,从而为无创产前检测(noninvasive prenatal testing,nipt)提供了理论可能。母体血浆中的游离dna为胎儿和母体游离dna的混合物,其中大部分都是母体自身的游离dna,胎儿dna仅占总游离dna的很少部分,约占总游离dna 5%-30%,随着妊娠期不同,胎儿游离dna比例有所变化,胎儿游离dna可最早于妊娠4周检出,绝大部分孕妇在妊娠10周胎儿游离dna量可超过4%。孕妇血浆中的游离dna具有母源dna背景高,相对微量的特点。
3.随着第二代测序技术的发展和逐步成熟,无创伤地直接检测胚胎染色体病成了一个重大的研究课题。染色体病是指由染色体异常引起的疾病,是出生缺陷中最严重的一类疾病,常见的染色体异常包括染色体数目异常(非整倍体)和染色体结构异常(微缺失、微重复等)。目前基于游离dna的胎儿染色体非整倍体无创产前检测凭借其无创、简便、快速、灵敏度高的特点在临床上广泛应用,受到临床认可。
4.临床需求不仅限于染色体非整倍体的无创检测需求,还包括对染色体微缺失/微重复(cnv)的无创检测需求。然而,因为染色体微缺失/微重复(cnv)的区域较小,其无创检测难度远高于染色体非整倍体。通常认为胎儿游离dna占比越高,染色体微缺失/微重复(cnv)越容易被检出,低胎儿游离dna占比(《4%)与检测失败和假阴性结果有关。因此,在无创产前检测中,为了保证低胎源比样本准确检测染色体异常,非常有必要提高所建文库中胎源dna的占比,来提高胎源dna信号强度。
5.孕妇血浆中的母体和胎儿游离dna以类似于“ladder”的片段模式分布,不同点在于,胎儿游离dna片段长度偏小:胎儿游离dna主峰为143bp,仅有20%》193bp2,不超过313bp;而母体游离dna主峰为166bp,部分片段>300bp3,故可通过dna片段长度对二者进行鉴别,达到富集胎儿的游离dna的目的。
6.目前基于dna片段长度分离的方法有:(1)对血浆游离dna进行电泳富集4,电泳富集效率很低,且电泳属于开放式操作,极易造成样品间的交叉污染。
7.(2)磁珠富集法,利用磁珠分选dna片段的功能,调整磁珠的加入量,将血浆游离dna中大片段丢弃,回收剩余小片段,达到升高样本胎源比的目的。但是磁珠分选需要足够多的dna量,为了保证有足够多的dna量供分选,需要进行pcr扩增。此前有人使用游离dna进行pcr扩增,再利用磁珠片段筛选方法富集胎儿dna。pcr扩增有如下的缺点:1)pcr扩增会有碱基偏好性(pcr bias)以及会产生过多的重复分子,上机测序就会产生过高的冗余,造成
不必要的数据量浪费;2)pcr扩增会有扩增错误以及可能会有环境与样本间的污染,最终都会影响检测结果准性。现有的2步磁珠片段分选法无法应用于pcr free文库,原因是(1)连接体系中dna微量,对磁珠用量过于敏感,首次分选时少量的beads加入量差异都会对丢弃的片段大小和丢弃量造成巨大的影响,无法找到稳定条件。(2)连接体系中含接头自连产物,在二次分选时极容易回收回来,影响文库质量。因此,现有双xp分选法无法在胎源dna富集效果、文库产量和避免接头自连之间找到平衡点,无法应用于pcr free文库中胎源dna的富集。
8.除了dna片段长度分离的方法还有人尝试化学法以及dna碱基序列的分离方法:(1)有人提出对胎儿游离dna进行甲醛富集5,甲醛可以延缓血浆游离dna的降解,甲醛富集是一个相对封闭的过程,不易造成交叉污染,但是甲醛属于有害物质有毒且易挥发,该方法尚未获得广泛认可。
9.(2)此外还有外周血游离dna靶向富集法,该方法利用母体游离dna和胎儿游离dna碱基序列来区分和富集胎儿游离dna,即设计与母源性dna互补配对的biotin引物,利用链酶亲和素磁珠和biotin结合靶向抓取母源性dna。首先母体游离dna和胎儿游离dna碱基序列无法特异的区分,其次该方法需要设计特异性的引物,且链酶亲和素磁珠价格昂贵。因此该方法既增加了流程的繁琐性,也增加了建库成本。
10.因此,非常需要开发一种简单、经济、有效且无pcr扩增的富集孕妇血浆中胎儿dna的方法,来达到无创产前检测的最佳效果。
技术实现要素:
11.为了解决上述问题,本发明人提出一种富集孕妇血浆中胎儿dna的方法和试剂盒,其可以实现低dna起始量且pcr free的胎儿游离dna文库的富集。该方法既具备pcr free的建库优势,又可通过片段筛选的提高胎儿游离dna浓度进而提高检测准确性,具有安全、简单、快速、数据均一、准确性更高的特点,易于临床推广。根据本发明方法制备的文库可用于多种二代测序平台,包括但不限于如roche/454 flx、illumina/hiseq、miseq、nextseq和life technologies/solid system、pgm、proton等测序平台。
12.具体地,本发明的关键点在于提供一种可以实现微量dna且无需pcr扩增的孕妇血浆中胎儿dna富集技术。传统的血浆高通量测序文库制备是为了在dna分子两端加上测序用接头dna片段。主要包含以下步骤 :(1)末端修复并纯化,将提取的血浆dna片段修复成平末端后纯化回收;(2)3’加碱基“a”并纯化,使dna片段能与3’端带有“t”碱基的特殊接头连接后纯化回收;(3)接头连接并纯化,t4 dna连接酶将接头连上dna片段后纯化回收;(4)pcr扩增并纯化。此方法各步骤都有纯化且最终有pcr扩增,流程成本高,操作复杂,且存在气溶胶污染的风险;pcr扩增存在扩增错误和对于高gc和重复区域有扩增偏好性的问题。
13.在本发明之前,发明人已提出一种快速构建血浆dna测序文库的方法,其中末端补平、末端悬a,连接测序接头可在一个反应中进行,中间不需要纯化,且无需pcr,即可得到待上机的文库。具有成本低,高效,快速,准确的特点,pcr-free技术的血浆dna建库是首次报道。
14.孕妇外周血里提取的游离dna多数来自母体,少数来自胎儿,胎儿游离dna的占比叫胎儿dna浓度。数据显示有2-5%的孕妇胎儿浓度偏低或过低;胎儿dna浓度过低时,容易产
生假阴性结果,假阴性是游离胎儿dna检测的最大挑战之一。为解决母源dna背景高,胎儿游离dna含量低的问题,基于先发明pcr-free技术快速构建血浆dna测序文库的方法的基础上,发明了一种保证获得稳定的高比例胎儿游离dna文库构建方法,可以筛选孕妇血浆游离dna片段,提高文库中胎儿核酸片段浓度。
15.为此,本发明首先考虑的是提高连接产物后纯化步骤中的磁珠的用量,添加不同倍数的磁珠对小片段dna的回收效率不同。磁珠与连接产物的体积比越低,得到的文库片段越大;反之,得到的文库片段越小。因此提高磁珠添加倍数可能提高样本胎儿游离dna回收量,进而提高胎儿游离dna的占比。经过测试发现,该方法对提高胎儿游离dna占比效果不显著。
16.接着,本发明进一步考虑采用对连接产物进行磁珠2步筛选纯化的方法,2步磁珠筛选法中第一步是影响胎儿游离dna占比的关键步骤,但是这一步骤用量体积小,很可能因为加入量的误差导致样本胎源比提高比例的大幅度变化,导致流程稳定性差,尤其是对于微量dna以及自动化建库。
17.基于此,本发明提出制备磁珠预混液,磁珠预混液为磁珠与peg的混合溶液,使用磁珠预混液既可以增大第一步片段筛选时试剂的加入体积,减小因加入量的误差导致样本胎源比提高比例的大幅度变化;也可以减少磁珠的使用量,控制成本。由于第一步回收反应时已经有一定浓度的peg,因此第二步磁珠回收时,磁珠用量也可以减少。使用本发明流程安全,简单,成本低,且可以平衡胎源dna富集效果、文库产量和避免接头自连,达到富集胎儿游离dna的目的。
18.具体地,根据本发明的第一方面,其提供一种富集孕妇血浆中胎儿dna的方法,包括以下步骤:1)抽提孕妇血液,以获得血浆dna;2)对所述血浆dna进行末端补平和3’悬a,以获得3’悬a后的血浆dna;3)将所述3’悬a后的血浆dna与测序接头连接,以获得连接产物;4)将上述步骤3)得到的连接产物和磁珠预混液混匀、磁吸、吸取上清液,其中所述磁珠预混液由磁珠与磁珠稀释液按照体积比1:2-3:2混合,优选地,按照体积比1:1混合而成;5)将上述步骤4)得到的上清液与磁珠混匀、磁吸、弃去上清液;6)对上述步骤5)保留的磁珠进行清洗和洗脱,以获得经富集的胎儿dna;并且其中所述步骤2)的末端补平和3’悬a在一个反应体系中进行,且所述步骤2)和3)之间不包括纯化步骤。
19.在一种实施方案中,所述步骤4)中,所述磁珠预混液由磁珠与磁珠稀释液按照体积比1:1混合。
20.在一种实施方案中,所述磁珠稀释液是浓度为10%-25%的peg,优选浓度为16%。
21.在一种实施方案中,所述peg是peg4000、peg6000或peg8000。
22.在一种实施方案中,所述磁珠预混液与上述步骤3)得到的连接产物的体积比是(0.4-0.65):1,优选为0.48:1。
23.在一种实施方案中,所述步骤5)中,磁珠与上述步骤4)得到的上清液的体积比是(0.1-0.2):1,优选为0.18:1。
24.在一种实施方案中,所述磁珠选用下组中的一种或者多种:ampure xp磁珠(beckman)、spriselect磁珠(beckman)、kapa pure beads(kapa)、vahts
®ꢀ
dna clean beads(vazyme)、pronex beads (for size selection)(promega)、tianseq dna片段分选磁珠(tiagen)和cleanngs(cleanna)磁珠。
25.在一种实施方案中,步骤2)的所述末端补平采用t4 dna聚合酶进行。
26.在一种实施方案中,步骤2)的所述3’悬a采用klenow ex-酶、taq酶、或klenow ex-酶与taq酶的组合进行。
27.在一种实施方案中,步骤3)的所述连接通过选自以下的一种或两种酶来进行:t4 dna连接酶和t7 dna连接酶。
28.在一种实施方案中,所述测序接头为双链的测序接头。
29.根据本发明的第二方面,其提供一种富集孕妇血浆中胎儿dna的试剂盒,包括:1)磁珠预混液,其中所述磁珠预混液由磁珠与磁珠稀释液按照体积比1:2-3:2混合,优选地,按照体积比1:1混合而成;2)磁珠;和3)用于磁珠清洗和洗脱的试剂。
30.在一种实施方案中,所述磁珠预混液由磁珠与磁珠稀释液按照体积比1:1混合而成。
31.在一种实施方案中,所述磁珠稀释液为浓度为10%-25%的peg,优选浓度为16%。
32.在一种实施方案中,所述peg是peg4000、peg6000或peg8000。
33.在一种实施方案中,所述磁珠选自下组中的一种或者多种:ampure xp磁珠(beckman)、spriselect磁珠(beckman)、kapa pure beads(kapa)、vahts
®ꢀ
dna clean beads(vazyme)、pronex beads (for size selection)(promega)、tianseq dna片段分选磁珠(tiagen)和cleanngs(cleanna)磁珠。
34.在一种实施方案中,所述试剂盒还包括dna 末端补平试剂和3’悬a试剂,连接酶和测序接头。
35.在一种实施方案中,所述末端补平试剂采用t4 dna聚合酶,并且所述3’悬a试剂采用klenow ex-酶、taq酶、或klenow ex-酶与taq酶的组合。
36.在一种实施方案中,所述连接酶是t4 dna连接酶和/或t7 dna连接酶。
37.在一种实施方案中,所述测序接头为双链的测序接头。
38.通过采用上述第一方面的方法或上述第二方面的试剂盒可以实现以下技术效果:(1)dna使用先发明实验流程构建血浆dna测序文库,将最后一个步骤的文库1步回收优化为本发明的片段筛选后,可以筛选去除大于230bp的cfdna,并且富集片段大小在40bp-160bp的小片段dna分子;(2)胎儿游离dna比例有23%-125%的提升,平均提升比例可以达到62%;(3)纯化磁珠与磁珠稀释液a制备为磁珠预混液a,磁珠预混液a可以达到理想的dna回收效果。同时这种方式有减少磁珠加入量,增大加入体积的效果,既可以节约成本,又可以减小因加入量的误差导致样本胎源dna提高比例和文库产量的大幅度变化;(4)2步片段筛选后回收,满足文库上机,文库总量够二次以上上机。
39.应当理解,本部分所描述的内容并非旨在标识本发明的实施例的关键或重要特征,也不用于限制本发明的范围。本发明的其它特征将通过以下的说明书而变得容易理解。
附图说明
40.图1是实施例1与对照实施例1(即富集与未富集胎源dna)的片段大小分布图。
41.图2是对照实施例3与本发明实施例1所得文库熔解曲线图。
42.图3是分别按照本发明实施例1和对照实施例1对390例男胎样本进行片段筛选后cffdna%的提升效果图。
43.图4a-4n是实施例4的14个样本(12例阳性样本和2例阴性样本)的高通量测序结果的染色体散点图。
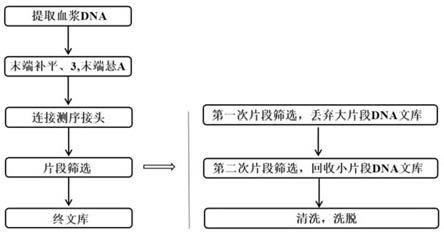
44.图5是本发明dna片段筛选流程图。
具体实施方式
45.下面将更详细地描述本发明的实施例。然而应当理解的是,本发明可以通过各种形式来实现,而且不应该被解释为限于这里阐述的实施例,相反提供这些实施例是为了更加透彻和完整地理解本发明。应当理解的是,本发明的实施例仅用于示例性作用,并非用于限制本发明的保护范围。
46.除非另有限定,本文使用的所有技术以及科学术语具有与本发明所属领域普通技术人员通常理解的相同的含义。当存在矛盾时,以本说明书中的定义为准。
47.本文中所用的术语“包含”、“包括”、“具有”、“含有”或其任何其它变形,意在覆盖非排它性的包括。
48.当量、浓度、或其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“1至5”时,所描述的范围应被解释为包括范围“1至4”、“1至3”、“1-2”、“1-2和4-5”、“1-3和5”等。当数值范围在本文中被描述时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。
49.此外,本文中要素或组分前的不定冠词“一种”和“一个”对要素或组分的数量要求(即出现次数)无限制性。因此“一个”或“一种”应被解读为包括一个或至少一个,并且单数形式的要素或组分也包括复数形式,除非所述数量明显旨在限定单数形式。
50.进一步地,在以下说明书中将提及大量的表述,这些表述被定义为具有下列含义。
[0051]“测序”是指测定在dna中的核苷酸(碱基序列)的顺序。
[0052]“末端补平”是指对由于限制性核酸内切酶消化和人工合成的寡核苷酸退火以及其他原因形成的核酸双链dna 5
′
端突出的黏性末端,填补上核苷酸使其转变成平末端的技术。
[0053]
如前文所描述,现有技术中缺乏简单、经济、有效且无pcr扩增的富集孕妇血浆中胎儿dna的方法。
[0054]
peg浓度百分比“%”是指质量体积比,例如20%peg是将20g peg粉末溶于水后定容至100ml得到。
[0055]
富集孕妇血浆中胎儿dna的方法为了至少部分地解决上述问题以及其他潜在问题中的一个或者多个,本发明的第一示例实施方案提出一种富集孕妇血浆中胎儿dna的方法,包括以下步骤:
1)抽提孕妇血液,以获得血浆dna;2)对所述血浆dna进行末端补平和3’悬a,以获得3’悬a后的血浆dna;3)将所述3’悬a后的血浆dna与测序接头连接,以获得连接产物;4)将上述步骤3)得到的连接产物和磁珠预混液混匀、磁吸、吸取上清液,其中所述磁珠预混液由磁珠与磁珠稀释液按照体积比1:2-3:2混合,优选地,按照体积比1:1混合而成;5)将上述步骤4)得到的上清液与磁珠混匀、磁吸、弃去上清液;6)对上述步骤5)保留的磁珠进行清洗和洗脱,以获得经富集的胎儿dna;并且其中所述步骤2)的末端补平和3’悬a在一个反应体系中进行,且所述步骤2)和3)之间不包括纯化步骤。
[0056]
关于“血浆dna”,可以是微量(例如低至2ng)的血浆游离dna,仍可以获得经过胎儿游离dna富集后的文库,完成测序分析,得到准确的分析结果。据此,扩宽了样本检范围,可以提高低胎源比样本的胎儿dna浓度,解决低胎源比样本检测准确性问题,满足低胎源比样本的检测。
[0057]
关于“磁珠预混液”,其为磁珠与磁珠稀释液的混合溶液,使用磁珠预混液既可以增大第一步片段筛选时试剂的加入体积,减小因加入量的误差导致样本胎源比提高比例的大幅度变化;也可以减少磁珠的使用量,控制成本。因为第一步回收反应时已经有一定浓度的磁珠稀释液,因此第二步磁珠回收时,磁珠用量也可以减少。使用本发明流程安全,简单,成本低,且可以平衡胎源dna富集效果、文库产量和避免接头自连,达到富集胎儿游离dna的目的。可见,通过将纯化磁珠与磁珠稀释液制备为磁珠预混液,磁珠预混液可以达到理想的dna回收效果。同时这种方式有减少磁珠加入量,增大加入体积的效果,既可以节约成本,又可以减小因加入量的误差导致样本胎源dna提高比例和文库产量的大幅度变化。
[0058]
关于“磁珠稀释液”,其可以优选是浓度为10%-25%的peg,优选浓度为16%。例如,可以实际采用的浓度是10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%或这些数值之间的任何数值。
[0059]
关于peg的类型,其可以优选是peg4000、peg6000或peg8000。
[0060]
关于所述磁珠预混液与上述步骤3)得到的连接产物的体积比,其可以是(0.4-0.65):1。例如,可以实际采用0.3:1、0.4:1、0.5:1、0.6:1、0.65:1、或这些数值之间的任何数值。
[0061]
关于所述步骤5)中,磁珠与上述步骤4)得到的上清液的体积比,其可以是(0.1-0.2):1,优选0.18:1。例如,可以实际采用0.1:1、0.11:1、0.12:1、0.13:1、0.14:1、0.15:1、0.16:1、0.17:1、0.18:1、0.19:1、0.2:1或这些数值之间的任何数值。
[0062]
关于“磁珠”,其并无特别限制,可以是本领域常规使用的那些。但优选地,所述磁珠选用下组中的一种或者多种:ampure xp磁珠(beckman)、spriselect磁珠(beckman)、kapa pure beads(kapa)、vahts
®ꢀ
dna clean beads(vazyme)、pronex beads (for size selection)(promega)、tianseq dna片段分选磁珠(tiagen)和cleanngs(cleanna)磁珠。
[0063]
关于末端补平,优选采用t4 dna聚合酶进行。
[0064]
关于“3’悬a”,其优选采用klenow ex-酶、taq酶、或klenow ex-酶与taq酶的组合。
[0065]
关于上述步骤3)的连接,其优选通过选自以下的一种或两种酶来进行:t4 dna连
接酶和t7 dna连接酶。
[0066]
关于“测序接头”,其优选为双链的测序接头。
[0067]
为了至少部分地解决上述问题以及其他潜在问题中的一个或者多个,本发明的第二示例实施方案提出一种富集孕妇血浆中胎儿dna的试剂盒,包括:1)磁珠预混液,其中所述磁珠预混液由磁珠与磁珠稀释液按照体积比1:2-3:2混合,优选地,按照体积比1:1混合而成;2)磁珠;和3)用于磁珠清洗和洗脱的试剂。
[0068]
关于“磁珠预混液”,其为磁珠与磁珠稀释液的混合溶液,使用磁珠预混液既可以增大第一步片段筛选时试剂的加入体积,减小因加入量的误差导致样本胎源比提高比例的大幅度变化;也可以减少磁珠的使用量,控制成本。因为第一步回收反应时已经有一定浓度的磁珠稀释液,因此第二步磁珠回收时,磁珠用量也可以减少。使用本发明流程安全,简单,成本低,且可以平衡胎源dna富集效果、文库产量和避免接头自连,达到富集胎儿游离dna的目的。
[0069]
关于“磁珠稀释液”,其可以优选是浓度为10%-25%的peg,优选浓度为16%。例如,可以实际采用的浓度是10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%或这些数值之间的任何数值。
[0070]
关于peg的类型,其可以优选是peg4000、peg6000或peg8000。
[0071]
关于“磁珠”,其并无特别限制,可以是本领域常规使用的那些。但优选地,所述磁珠选用下组中的一种或者多种:ampure xp磁珠(beckman)、spriselect磁珠(beckman)、kapa pure beads(kapa)、vahts
®ꢀ
dna clean beads(vazyme)、pronex beads (for size selection)(promega)、tianseq dna片段分选磁珠(tiagen)和cleanngs(cleanna)磁珠。
[0072]
优选地,所述试剂盒还包括dna 末端补平试剂和3’悬a试剂,连接酶和测序接头。
[0073]
关于dna 末端补平试剂,其优选采用t4 dna聚合酶。
[0074]
关于3’悬a试剂,其优选采用klenow ex-酶、taq酶、或klenow ex-酶与taq酶的组合。
[0075]
关于“连接酶”,其优选是t4 dna连接酶或t7 dna连接酶。
[0076]
关于“测序接头”,其优选是双链的测序接头。
[0077]
通过本发明的第一示例实施方案的方法或本发明的第二示例实施方案的试剂盒,可以使所得文库可以减少母源dna背景,提高胎儿dna的占比,胎儿染色体异常更容易被检出,因此可以降低假阳性和假阴性的概率,可以更准确的判别胎儿dna是否异常。
优选实施例
[0078]
下面结合说明书附图,进一步对本发明的优选实施例进行详细描述,以下的描述为示例性的,并非对本发明的限制,任何的其他类似情形也都落入本发明的保护范围之中。
[0079]
实施例1.根据本发明的方法纯化血浆dna文库参照图5所示,实施本发明实施例1,具体步骤如下:步骤1.按照胎儿染色体非整倍体(t13/t18/t21)检测试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r1000)方法操作,以获得连接产物;
步骤2.对连接产物进行第一次片段筛选,丢弃大片段dna文库;(1)平衡磁珠将beckman agencourt ampure xp磁珠从2-8℃冰箱中取出,震荡混匀后在室温中平衡至少30min。
[0080]
(2)配制稀释液a稀释液a试剂组分为16% peg8000。
[0081]
(3)配制磁珠预混液a稀释液a从-20℃冰箱取出,室温融解后震荡混匀,将xp磁珠与稀释液a按照体积比1:1的比例混合,将xp磁珠与稀释液a混合液充分漩涡震荡混匀。
[0082]
(4)第一次片段筛选吸取37 μl磁珠预混液a加入到pcr管连接产物中,震荡混匀,室温孵育10min。将pcr管放到磁力架上,吸附5min。
[0083]
步骤3. 对连接产物进行第二次片段筛选,回收小片段dna文库;吸取20 μl xp磁珠加入新的1.5 ml离心管内,用移液器将上一步pcr管中上清液转移至已加入xp磁珠的1.5 ml离心管内。震荡混匀,室温孵育10min。将离心管放到磁力架上,吸附10min,用移液器吸取上清弃掉,不要吸取磁珠。
[0084]
步骤4. 对上一步保留的磁珠进行清洗和洗脱,以获得经过片段筛选后的文库。
[0085]
(1)第一次清洗在磁力架上,沿远离磁珠方向加入200 μl 80%乙醇清洗液,轻轻转动磁力架,避免磁珠散开,用移液器吸取上清丢弃。
[0086]
(2)第二次清洗 重复上一步骤(3)将离心管从磁力架上取下,放入离心机中瞬时离心3秒,再次将离心管放置到磁力架上,用10μl移液器吸弃所有废液。
[0087]
(4)打开1.5 ml离心管,室温干燥3min左右,至磁珠表面没有反光水膜即可(5)将1.5 ml离心管从磁力架上取下,加入22 μl buffer eb,震荡混匀,室温孵育10min。
[0088]
(6)将1.5 ml离心管放到磁力架上吸附5min,吸取20 μl上清至新的1.5 ml离心管中。
[0089]
对照实施例1对照实施例1的和实施例1纯化血浆dna文库的区别在于,2步磁珠片段筛选更改为1步文库纯化回收,具体的为:步骤1.获得末端修复和末端加a,连接接头后的反应混合液即连接产物。
[0090]
此步骤按照胎儿染色体非整倍体(t13/t18/t21)检测试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r1000)方法操作。
[0091]
步骤2.文库纯化(1)平衡磁珠将beckman agencourt ampure xp磁珠从2-8℃冰箱中取出,震荡混匀后在室温中平衡至少30min。
[0092]
(2)文库回收按照下表1体积,取28μl磁珠加入到pcr管连接产物中,震荡混匀,室温孵育10min,将pcr管放到磁力架上,吸附5min。使用移液器吸弃上清,不要吸取磁珠。
[0093]
(3)第一次清洗在磁力架上,沿远离磁珠方向加入200μl 80%乙醇清洗液,轻轻转动磁力架,避免磁珠散落,30s后用移液器吸取上清丢弃。
[0094]
(4)第二次清洗重复上一步骤(5)将1.5ml离心管从磁力架上取下,放入离心机中瞬时离心3秒,再次将离心管放回磁力架,使用10 μl移液器吸弃所有废液。(6)打开1.5ml离心管盖子,室温晾干4分钟左右,至磁珠表面没有反光水膜即可。(7)将1.5ml离心管从磁力架上取下,加入22ul洗脱液,手指轻弹混匀洗脱液与磁珠,室温放置5分钟:(8)将1.5ml离心管放上磁力架吸附5分钟,吸取上清于新1.5ml离心管中,操作时,发现管壁和管盖有液体,请短暂离心使液体甩入管底,再置于磁力架上,应避免吸到磁珠。
[0095]
选取1例阴性孕妇血浆(男性胎儿),使用血浆游离dna提取试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r0011)提取孕妇血浆中的游离dna,将获得的血浆游离dna分为2份,分别按照实施例1和对照实施例1的方式构建文库,然后qpcr定量,文库浓度均符合上机标准,按照测序仪标准操作流程,使用illumina nextseq cn500测序平台对文库进行测序(150bp双端测序),将测序数据进行生物信息学分析游离dna的长度,如图1所示。
[0096]
由图1可见本发明方法通过磁珠筛选去除大于230bp的游离dna片段,并且富集片段大小在40bp-160bp的小片段dna分子,研究表明小于160bp的dna片段多为胎儿游离dna分子,说明本方法可以去除母源性游离dna,富集胎儿游离dna。
[0097]
对照实施例2-对照实施例2的方法与对照实施例1的方法相同,区别在于纯化血浆dna和接头的连接产物的磁珠的用量,具体为38.5
µ
l(0.5倍)、46.2
µ
l(0.6倍)、53.9
µ
l(0.7倍)。
[0098]
选取5例阴性孕妇血浆(男性胎儿)混合均匀,使用血浆游离dna提取试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r0011)提取孕妇混合血浆中的游离dna,按照以上实施例1、对照实施例1和对照实施例2所述的方法制备的文库,然后qpcr检测文库浓度(文库浓度见下表2),后按照测序仪标准操作流程,使用illuminanextseq cn500测序平台对文库进行测序(150bp双端测序)。将测序数据进行生物信息学分析cffdna%(胎儿游离dna的占比,利用男性胎儿的y染色体计算),结果如下表2所示。
[0099]
表2:实施例1、对照实施例1和对照实施例2的文库浓度以及cffdna%含量的对比分
析结果备注:cffdna%提高比例计算方法为(对照实施例2或者实施例1的cffdna%含量-现有流程cffdna%含量)/现有流程cffdna%含量上表2可知:1)对照实施例2中增加磁珠添加倍数可以增加文库浓度,说明更多的dna文库被回收,并且结果显示每个梯度磁珠用量所得的cffdna%都有提升,cffdna%从16.5%最高提升到18.5%,但是提高比例仅为12. 1%。由此可见1步磁珠回收的方法无法解决胎儿游离dna占比低的问题。
[0100]
2)使用本发明方法(实施例1)获得的文库可以提高胎儿游离dna占比,提高比例可达到55.3%。且文库浓度符合上机要求(即文库浓度》15pm)。
[0101]
对照实施例3对照实施例3的和实施例1纯化血浆dna文库的方法都为2步磁珠筛选法,区别在于对照实施例3使用通用的2步磁珠筛选法,具体为第一次片段筛选使用的是磁珠代替实施例1中的磁珠预混液a,磁珠的用量具体为20
µ
l、21
µ
l、22
µ
l、23
µ
l、24
µ
l、25
µ
l。根据第一次磁珠使用量计算得来的第二次片段筛选磁珠使用量分别为172.6
µ
l、171.6
µ
l、170.6
µ
l、169.6
µ
l、168.6
µ
l、167.6
µ
l。
[0102]
选取7例阴性孕妇血浆(男性胎儿)混合均匀,使用血浆游离dna提取试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r0011)提取孕妇混合血浆中的游离dna,按照以上对照实施例3和对照实施例1所述的方法制备的文库,然后qpcr检测文库浓度(文库浓度见下表),后按照测序仪标准操作流程,使用illuminanextseq cn500测序平台对文库进行测序(150bp双端测序)。将测序数据进行生物信息学分析胎儿游离dna的占比(即cffdna%,利用男性胎儿的y染色体计算),结果如下表3所示。
[0103]
表3:对照实施例3和对照实施例1的文库浓度以及cffdna%含量的对比分析结果
ꢀ
备注:cffdna%提高比例计算方法为(对照实施例3 cffdna%含量-现有流程cffdna%含量)/现有流程cffdna%含量从上表3可知:1)使用同一胎儿游离dna含量(9.43%)血浆游离dna按照对照实施例3的方法建库,所得测序文库可以提高胎儿游离dna占比;但是该方法首次分选时磁珠加入量分别为20
µ
l、21
µ
l、22
µ
l、23
µ
l、24
µ
l、25
µ
l,各条件间仅1
µ
l的磁珠差异,就会造成所得文库浓度以及胎儿dna提升比例有极大的差异。2)通用的2步磁珠筛选法,在二次分选时会回收接头自连产物,体现为qpcr熔解曲线双峰,如图2所示,影响文库质量。因此该方法不适合应用于pcr free文库。
[0104]
实施例2
‑ꢀ
磁珠筛选用量范围本实施例的文库与实施例1的方法相同,区别在于,在一些实施方案中,稀释液a的浓度可以是10%-25%的peg溶液,将上述浓度范围的peg 8000与磁珠按照1:1比例混合制备为磁珠预混液a,吸取0.46倍磁珠预混液a加入到连接产物中。取男性胎儿孕妇血浆混合均匀,使用血浆游离dna提取试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r0011)提取孕妇混合血浆中的游离dna,按照实施例2的方法建库。将终文库qpcr检测文库浓度,后按照测序仪标准操作流程,使用illuminanextseq cn500测序平台对文库进行测序(150bp双端测序)。将测序数据进行生物信息学分析cffdna%,结果如下表4a所示。
[0105]
表4a:实施例2 peg浓度范围对文库浓度以及cffdna%含量的影响
备注:cffdna%提高比例计算方法为(本发明 cffdna%含量-现有流程cffdna%含量)/现有流程cffdna%含量。(下同)由上表4a可知,3种条件,可以发现随着peg浓度增加,cffdna%提升比例也随着增加,文库浓度相应减少;上述3种条件的文库浓度都符合上机标准且 cffdna%可以得到不同程度的富集,其中25% peg 8000的条件可以使cffdna%提升比例高达88.56%;16% peg 8000的文库浓度损失较少且可以得到53.99% 的cffdna%提升比例,考虑到需要能够适用于低起始量的血浆dna样本,该条件可以同时保证文库浓度足够上机以及保证cffdna%富集效果,故推荐16% peg 8000的浓度。
[0106]
实施例2的方法,另一些实施方案中,其中磁珠和稀释液a可以按照1:2-3:2比例混合;本实施例展示磁珠与稀释液a(16% peg 8000)按照1:2、1:1、3:2三种比例的所得文库浓度以及nextseq cn500测序平台150bp双端测序结果,如下表4b。
[0107]
表4b:实施例2 peg添加比例对文库浓度以及cffdna%含量的影响由上表4b可知,上述3种条件,随着16% peg 8000用量增加,cffdna%含量也随着增加,文库浓度也相应减少;3种条件的文库浓度都符合上机标准且cffdna%可以得到不同程度的富集,其中1:1的混合比例相较于另外2个条件所得的文库浓度损失少且cffdna%提升比例高,故本发明优选采用磁珠与16% peg 8000按照1:1条件混合。
[0108]
实施例2的方法,在一些实施方案中,向连接产物中加入磁珠预混液a,加入磁珠预混液a体积可以为连接产物体积的0.4倍到0.65倍。本实施例展示磁珠预混液a按照0.4倍、0.46倍、0.46倍三种条件所构建的文库浓度以及nextseq cn500测序平台150bp双端测序结果,如下表4c。
[0109]
表4c:实施例2 磁珠预混液a用量对文库浓度以及cffdna%含量的影响
由上表4c可知,上述3种条件,随着磁珠预混液a用量增加,cffdna%含量也随着增加,文库浓度也相应减少;3种条件的文库浓度都符合上机标准且 cffdna%可以得到不同程度的富集,其中0.65倍磁珠预混液a的条件可以使cffdna%提升比例高达121.54%, 但是该条件文库浓度损失较多。0.46倍磁珠预混液a的条件的文库浓度损失较少且可以得到53.99%不错的cffdna%提升比例,可以同时保证文库浓度和cffdna%富集效果,且考虑到能够适用于低起始量的血浆dna样本,故本发明推荐使用0.46倍磁珠预混液a。
[0110]
另一方面,该实施例在上述范围内构建的文库qpcr熔解曲线正常,说明本发明流程无接头自连产物,文库质量合格,如图2(右图)所示。
[0111]
实施例3-390例男性胎儿样本胎儿游离dna占比提升比例选取390例的孕妇血浆(男性胎儿),使用血浆游离dna提取试剂盒(杭州贝瑞和康基因诊断技术有限公司,货号r0011)提取孕妇外周血中的游离dna,将390例男性胎儿孕妇血浆dna按照实施例1所述的方法构建文库,后进行qpcr定量,文库浓度均符合上机标准,然后按照测序仪标准操作流程,使用illumina nextseq cn500测序平台对文库进行测序(150bp双端测序)。对测序结果进行生物信息分析,利用男性胎儿的y染色体计算390例男性胎儿游离dna含量,结果如图3所示,可见每个样本的cffdna%(胎儿游离dna占比/胎源比)都有提升,胎源比从3%-37%提升至6.77%-45.91%,富集效率为23%-125%。平均胎源比从11.36%提18.37%,平均提高比例为61.71%。
[0112]
其中390例男性胎儿中有23例胎儿游离dna浓度在2.05%-3.52%,属于低胎源比样本,如图3所示,23例低胎源比样本,每个样本的cffdna%都有提升,胎源比从2.05%-3.52%提升至3.00%-7.51%,富集效率为33.63%-125.67% 。平均胎源比从3.36%提高至5.88%,平均提高比例为74.79%。由此可知本发明方法同时扩宽了样本检测范围,可以检测胎儿游离dna含量低的样本。
[0113]
实施例4-染色体非整倍体样本、染色体微缺失微重复的样本&阴性样本的检测性能根据实施例1所述的方法,选取14例北京贝瑞和康医学检验实验室自愿接受无创dna产前检测的妊娠孕妇的检测结果进行了回顾性分析,挑选的样本具有羊水/脐血穿刺核型分析结果/随访结果以此来验证本发明方法检测结果的准确性,样本类型包含临床阳性样本(染色体非整倍体样本、染色体微缺失微重复的样本)和临床阴性样本。
[0114]
使用杭州贝瑞和康基因诊断技术有限公司生产的血浆游离dna提取试剂盒
(r0011)提取上述孕妇外周血中的游离dna,将文库进行qpcr定量,文库浓度均符合上机标准,然后按照测序仪标准操作流程,使用illumina nextseq cn500测序平台对文库进行测序(150bp双端测序)。
[0115]
14例临床样本中包含8例男性胎儿样本,利用男性胎儿的y染色体计算8例男性cffdna%(胎儿游离dna占比),结果如下表5:由上表5可知,每一例男性胎儿dna占比都提高,平均胎源比从10.07%提高至17.16%,平均提高比例为76.63%。
[0116]
利用生物信息方法分析本发明检出染色体非整倍体、染色体微缺失微重复的性能,结果见图4a-图4n,图4a-图4n为实施例4的14个样本高通量测序结果的染色体散点图,直观的展示了染色体的染色体非整倍体、染色体微缺失。取1例染色体微缺失阳性样本19tp22575的染色体散点图为例说明,在其chr22染色体横坐标为17.3-22m区间(22q11.2)的位置处,z值小于正常阈值范围,软件判定为22染色体q11.2微缺失,同时报出22q11_deletion_syndrome (digeorge综合征ⅰ型),该结果与有创检测结果一致。再取1例染色体非整倍体阳性样本19tp03361的染色体散点图为例说明,该样本的chr18整条染色体z值大于正常阈值范围,软件判定为18染色体三体,同时报出18三体综合征,该结果与有创检测结果一致。另取1例阴性样17tp61941为例说明,该样本的染色体散点图展示了chr13、chr18、chr21的z值均在正常阈值范围即染色体正常,其余染色体均正常(图略),分析软件报出该样本检出为阴性,该结果与随访结果一致。汇总本发明流程的14例样本的结果并与羊水/脐血穿刺核型分析结果/随访结果进行了比较,汇总结果如下表6所示:表6
由上表6以及图4a-图4n可知,本发明流程可以正确检出染色体非整倍体样本、染色体微缺失微重复的样本以及阴性样本,具体检出结果的染色体散点图见图4a-图4n,所得结果和有创检测金标准结果一致。
[0117] 从上表还可以看出,样本编号为19tp22575,19tp23009,19tp39177,2dl34271,2dl22374的5例样本建库起始量至2-3ng之间,上述微量dna根据本发明方法所构建文库浓度为24.68pm、43.74、34.93pm、39.68pm、45.79pm,满足上机要求(文库浓度》15 pm)。并且5例低起始量文库的测序分析结果有创检测结果一致。所以本发明方法同时可以实现微量dna的检测。
[0118]
基于此,本发明的富集孕妇血浆中胎儿dna的方法,至少取得了以下技术效果:(1)全建库流程pcr-free,避免了pcr造成的扩增错误和碱基偏好性以及可能造成的环境与样本间的污染,结果更真实有效;(2)为减小第一步xp磁珠加入量的误差因素, 将纯化磁珠与peg8000混合制备为磁珠预混液a,这种方式有减少磁珠加入量,增大加入体积的效果;既可以节约成本,又可以减小因加入量的误差导致样本胎源比提高比例的大幅度变化,使本流程更加稳定;(3)本发明所得文库可以减少母源dna背景,提高胎儿dna的占比,胎儿染色体异常更容易被检出,因此可以降低假阳性和假阴性的概率,可以更准确的判别胎儿dna是否异常;(4)本发明扩宽了样本检范围,可以提高低胎源比样本的胎儿dna浓度,解决低胎源比样本检测准确性问题,满足低胎源比样本的检测;(5)本发明对dna的起始量要求低,依据本发明方法,微量(低至2ng)的血浆游离dna也可以成功获得经过胎儿游离dna富集后的文库,完成测序分析,得到准确的分析结果。
[0119]
综上,本发明提供了简单、经济、有效且无pcr扩增的富集孕妇血浆中胎儿dna的方法,达到了无创产前检测的最佳效果,取得了明显的有益技术效果。
[0120]
前述的示例仅是说明性的,用于解释本发明的特征的一些特征。所附的权利要求旨在要求可以设想的尽可能广的范围,且本文所呈现的实施例仅是根据所有可能的实施例的组合的选择的实施方式的说明。因此,申请人的用意是所附的权利要求并不被说明本技术的特征的示例的选择限制。如在权利要求中使用的,术语“包括”和其语意上的变体在逻辑上也包括不同和变化的用语,例如但不限于“基本组成为”或“组成为”。当需要时,提供了一些数值范围,而这些范围也包括了在其之间的子范围。这些范围中的变化也对于本领域
技术人员也是自明的,且不应被认为被捐献给公众,而这些变化也应在可能的情况下被解释为被所附的权利要求覆盖。而且在科技上的进步将形成由于语言表达的不准确的原因而未被目前考虑的可能的等同物或子替换,且这些变化也应在可能的情况下被解释为被所附的权利要求覆盖。
[0121]
参考文献1.lo ym,corbetta n,chamberlain pf,et al.presence of fetal dna in maternal plasma and serum.lancet,1997,350:485-487.2.c han k c,zhang j,h ui a b,et a1.size distributions of maternal and fetal dna in maternal plasma.clin chem,2004,59 88-92.3.allen chan kc,jiang py,sun k,et al. second generation noninvasive fetal genome analysis reveals de novo mutations, single-base parental inheritance and preferred dna ends. pnas, 2016,e8159
–
e8168.4.liy,holzgrevew,hahns. size fractionation of cell
ꢀ–
free dna in maternal plasma and its application in noninvasive detection of fetal single gene point mutations. methodsmolbiol,2008,444 239-251.5.5.dhallan r,au wc,mattagajasingh s,etal. methods to increase the percentage of free fetal dna recovered from the maternal circulation, jama,2004,291:1114-1119.6.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。