1.本发明涉及有机电致发光技术领域,尤其涉及有机电致发光器件技术领域,特别涉及一种金属络合物及其在有机电致发光器件上的应用。
背景技术:
2.目前,作为新一代显示技术的有机电致发光器件(oled)在显示和照明技术方面都获得了越来越多的关注,应用前景十分广泛。但是,和市场应用要求相比,oled器件的发光效率、驱动电压、使用寿命等性能还需要继续加强和改进。
3.一般来说,oled器件基本结构为在金属电极中间夹杂各种不同功能的有机功能材料薄膜,犹如一个三明治的结构,在电流的驱动下,从阴阳两极分别注入空穴和电子,空穴和电子在移动一段距离后,在发光层得到复合,并以光或热的形式进行释放,从而产生了oled的发光。然而,有机功能材料是有机电致发光器件的核心组成部分,材料的热稳定性、光化学稳定性、电化学稳定性、量子产率、成膜稳定性、结晶性、色饱和度等都是影响器件性能表现的主要因素。
4.一般地,有机功能材料包括荧光材料和磷光材料。荧光材料通常为有机小分子材料,一般只能利用25%单重态发光,所以发光效率比较低。而磷光材料由于重原子效应引起地自旋轨道耦合作用,除了利用25%单重态之外,还可以利用75%三重态激子的能量,所以发光效率可以得到提升。但是相较于荧光材料,磷光材料起步较晚,且材料的热稳定性、寿命、色饱和度等都有待提升,是一个具有挑战性的课题。现有技术中,已经有人开发出各种有机金属化合物作为这种磷光材料。然而,市场仍然期望能进一步改善有机电致发光器件性能的新型材料的开发。
技术实现要素:
5.本发明提供高性能的有机电致发光器件及可实现这样的有机电致发光器件的新型材料。
6.本发明人为了达成前述目的而反复进行了深入的研究,结果发现,通过使用包含下述式(1)表示的结构作为配体的金属络合物,可以得到高性能的有机电致发光器件。
7.本发明的目的之一在于提供一种金属络合物,该类金属络合物具有升华温度较低,光、电化学稳定性高,色饱和度高,发光效率高,器件寿命长等优点,可用于有机电致发光器件中。特别是作为绿色发光掺杂体,具有应用于oled产业的可能。
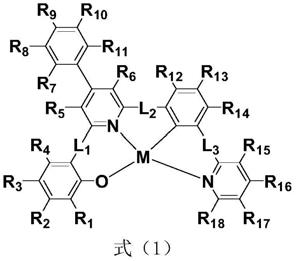
8.一种金属络合物,其具有式(1)所示的结构:
[0009][0010]
其中r1-r18至少之一为式(2)所示的结构;
[0011][0012]
其中
[0013]
*表示与式(1)连接的位置;
[0014]
m独立的为pt、pd;
[0015]
x独立的表示o,s,se,crarb;
[0016]
l1-l3各自独立的选自直接键合单键,o,s,se,nrc,crdre,so,so2,po(rf)(rg);
[0017]
l4为单键,o,取代的或未取代的c1-c20亚烷基、取代的或未取代的c3-c30亚环烷基、取代的或未取代的c1-c20亚杂烷基、取代的或未取代的c7-c30亚芳烷基,取代或未取代的c2-c20的亚烯基、取代的或未取代的c3-c30亚烷基硅基、取代的或未取代的c6-c30亚芳基、取代的或未取代的c3-c30亚杂芳基、取代的或未取代的c3-c30亚芳基硅基、取代或未取代的c0-c20的亚胺基;
[0018]
其余r1-r18、r101-r102和ra-rg独立地选自氢、氘、卤素、取代的或未取代的c1-c20烷基、取代的或未取代的c3-c30环烷基、取代的或未取代的c1-c20杂烷基、取代的或未取代的c7-c30芳烷基、取代的或未取代的c1-c20烷氧基、取代的或未取代的c6-c30芳氧基、取代或未取代的c2-c20的烯基、取代的或未取代的c3-c30烷基硅基、取代的或未取代的c6-c30芳基、取代的或未取代的c3-c30杂芳基、取代的或未取代的c3-c30芳基硅基、取代或未取代的c0-c20的胺基、氰基、腈、异腈、膦基;或者任意两个相邻的基团之间相互连接以形成环状结构或者并环结构;所述取代为被氘、卤素、c1-c4烷基、氰基所取代;
[0019]
r101、r102的取代个数独立的表示无取代到最大取代个数。
[0020]
优选:其具有式(3)所示的结构:
[0021][0022]
其中r1-r18至少之一为式(2)所示的结构;
[0023][0024]
其中*,x,l4,r1-r18,r101-r102和ra-rb与前述定义相同。
[0025]
优选:其具有式(4)所示的结构:
[0026][0027]
其中
[0028]
x独立的表示o,s,se,crarb;
[0029]
l4为单键,o,取代的或未取代的c1-c10亚烷基、取代的或未取代的c3-c10亚环烷基、取代的或未取代的c2-c10亚杂烷基、取代的或未取代的c7-c20亚芳烷基,取代或未取代的c2-c20的亚烯基、取代的或未取代的c3-c30亚烷基硅基、取代的或未取代的c6-c30亚芳基、取代的或未取代的c3-c30亚杂芳基、取代的或未取代的c3-c30亚芳基硅基、取代或未取代的c0-c20的亚胺基;
[0030]
r1、r2、r7、r8、r10、r11、r18、r101、r102、ra和rb与前述定义相同。
[0031]
优选:其中l4为单键、o及以下结构之一:
[0032][0033]
其中
[0034]
*表示与式(1)及式(2)连接的位置
[0035]
rx的个数表示无取代到最大取代个数,当rx为多取代时,相邻的两个取代基可以互相连接以形成环状或并环结构;
[0036]
rx和ry独立地为氢、氘、卤素、取代的或未取代的c1-c20烷基、取代的或未取代的c3-c30环烷基、取代的或未取代的c1-c20杂烷基、取代的或未取代的c7-c30芳烷基、取代的或未取代的c1-c20烷氧基、取代的或未取代的c6-c30芳氧基、取代或未取代的c2-c20的烯基、取代的或未取代的c3-c30烷基硅基、取代的或未取代的c6-c30芳基、取代的或未取代的c3-c30杂芳基、取代的或未取代的c3-c30芳基硅基、取代或未取代的c0-c20的胺基、氰基、腈、异腈、膦基。
[0037]
优选:其中r1、r2、r7、r8、r10、r11、r18、r101、r102、ra、rb、rx和ry独立地选自氢、氘、卤素、取代的或未取代的c1-c8烷基、取代的或未取代的c3-c10环烷基、取代的或未取代的c1-c8杂烷基、取代的或未取代的c7-c10芳烷基、取代或未取代的c2-c20的烯基、取代的或未取代的c3-c8烷基硅基、取代的或未取代的c6-c10芳基、取代的或未取代的c3-c10杂芳基、取代的或未取代的c3-c10芳基硅基、取代或未取代的c0-c6的胺基、氰基。
[0038]
优选:其中r1、r2、r7、r8、r10、r11、r18、r101、r102、ra、rb、rx和ry独立地选自氢、氘、卤素、取代的或未取代的c1-c8烷基、取代的或未取代的c3-c10环烷基、取代的或未取代的c1-c8杂烷基、取代的或未取代的苯基烷基、取代的或未取代的c6-c10芳基、取代的或未取代的c3-c10杂芳基。
[0039]
优选:其中r18为氘、取代或未取代的直链碳原子c1-c4烷基、取代或未取代的c1-c6个环烷基,所述取代为被氘、卤素所取代。
[0040]
优选:其中r1和r2至少之一不为氢。
[0041]
作为优选的金属络合物,其中优选为以下结构式之一;
[0042]
[0043]
[0044]
[0045]
[0046]
[0047]
[0048]
[0049]
[0050][0051]
金属络合物的前体,具有如下结构:
[0052][0053]
其中r1-r18至少之一为式(2)所示的结构;
[0054][0055]
其中r1-r18、r101、r102的定义与前述相同。
[0056]
本发明的目的之一还在于提供一种电致发光器件,其包括:阴极,阳极以及设置在阴极阳极之间的有机层,所述有机层至少一层包含金属络合物。
[0057]
本发明的另一目的在于提供一种电致发光器件,其中所述有机层包含发光层,所述金属络合物作为发光层中材料,特别是作为绿色发光材料;
[0058]
本发明的另一目的还在于提供一种电致发光器件,其中所述有机层包含空穴注入层,所述金属络合物作为空穴注入层中材料。
[0059]
器件结果表明本发明的化合物具有光、电化学稳定性高,色饱和度高,发光效率高,器件寿命长等优点,可用于有机电致发光器件中。特别是作为绿色磷光材料,具有应用于oled产业的可能。
附图说明
[0060]
图1化合物a 39的hnmr谱图,
[0061]
图2化合物a 82的hnmr谱图,
[0062]
图3化合物a 39的uv/pl谱图,
[0063]
图4化合物a 82的uv/pl谱图。
具体实施方式
[0064]
所述实施例仅仅是为了便于理解技术发明,不应视为本发明的具体限制。
[0065]
本发明中的化合物合成中涉及的原物料和溶剂等均购自于alfa、acros等本领域技术人员熟知的供应商。
[0066]
实施例1化合物a1的合成
[0067]
中间体a1-6的合成
[0068][0069]
化合物a1-2的合成
[0070]
向1l单口烧瓶中依次加入a1-1(120g,0.6mol,1.0eq),碘单质(168.3g,0.6mol,1.0eq),吡啶(600ml),真空、氮气置换三次,升温至回流反应过夜。反应有大量固体析出,降至室温,过滤,滤饼用甲醇淋洗两次,共计200ml,抽干后固体再用甲醇热打浆2次,每次200ml。收集固体,干燥得到类白色固体a1-2(207.3g,收率85.1%)。质谱:405.0(m h)化合物a1-4的合成
[0071]
向3l三口烧瓶中依次加入a1-3(96g,0.63mol,1.0eq),苯甲醛(74.6g,0.7mol,1.1eq),氢氧化钾(179.3g,3.2mol,4.0eq),去离子水(195ml),甲醇(670ml),真空、氮气置换三次,升温至50℃反应过夜。反应有大量固体析出,降至室温,过滤,收集固体加到乙酸乙
酯(500ml)中,搅拌溶清,加入去离子水进行水洗两次,每次200ml。有机相浓缩至剩余少量,加入甲醇(250ml)进行打浆纯化,抽滤,收集滤饼干燥得到白色固体a1-4(93.5g,收率61.4%)。
[0072]
质谱:239.2(m h)
[0073]
化合物a1-5的合成
[0074]
向1l三口烧瓶中依次加入a1-4(80g,0.33mol,1.0eq),a1-2(135.6g,0.33mol,1.0eq),乙酸铵(155.2g,2.0mol,6.0eq),乙酸(350ml),真空、氮气置换三次,升温至回流反应过夜。降至室温,浓缩除去乙酸,旋干的固体加入二氯甲烷(1.0l),搅拌溶清,加入去离子水进行水洗两次,每次300ml。有机相浓缩至剩余少量,加入甲醇(250ml)进行结晶纯化,抽滤,收集固体再用甲醇(300ml)热打浆2次。干燥得到白色固体a1-5(119.6g,收率85.6%)。
[0075]
质谱:417.3(m h)
[0076]
化合物a1-6的合成
[0077]
向一个1l单口瓶,依次将化合物a1-5(110.0g,0.260mol,1.0eq)、联硼酸频那醇酯(80.5g,0.31mol,1.2eq),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(3.87g,5.28mmol,0.02eq)、醋酸钾(51.8g,0.52mol,2.0eq),二氧六环(900ml),氮气置换三次后加热至100℃,保温搅拌6h,tlc监控(展开剂:乙酸乙酯/正己烷=1/10),原料a1-5基本反应完全。反应液降温至40℃,进行硅藻土过滤,用少量二氧六环冲洗滤饼,滤液减压浓缩至200ml,加入甲醇(400ml)室温下搅拌2h,过滤,得到固体采用四氢呋喃/甲醇(100ml/200ml)重结晶两次,过滤烘干得到米白色固体化合物a1-6(84.1g,收率68.7%)。质谱:464.3(m h).化合物a1的合成
[0078][0079][0080]
化合物a1-7的合成
[0081]
向一个3l三口瓶,依次将化合物a1-6(75.0g,0.16mol,1.0eq)、2,4-二氯-6-甲基吡啶(39.3g,0.24mol,1.5eq),四(三苯基膦)钯(9.35g,8.09mmol,0.05eq)、氢氧化钠(51.8g,0.52mol,3.0eq),二氧六环(650ml),去离子水(130ml),氮气置换三次后加热至70℃,保温搅拌6h,tlc监控(展开剂:二氯甲烷/正己烷=1/10),原料a1-6基本反应完全。反应液降温至室温,往体系加入二氯甲烷(300ml)和去离子水(300ml),萃取,收集有机相过硅
胶,再用二氯甲烷(200ml)冲洗硅胶,滤液旋干得到的固体加入甲苯(150ml)/甲醇(350ml)重结晶3次,烘干得到白色固体化合物a1-7(54.1g,收率72.3%)。质谱:464.0(m h).化合物a1-8的合成
[0082]
向一个1l三口瓶,依次将化合物a1-7(10.5g,22.6mmol,1.0eq)、二苯并呋喃-4-硼酸(7.2g,34.0mmol,1.5eq),二氯-二叔丁基-(4-二甲基氨基苯基)磷钯(ii)(0.24g,0.34mmol,0.015eq)、磷酸三钾(9.63g,45.3mmol,2.0eq),二氧六环(300ml),去离子水(100ml),氮气置换三次后加热至60℃,保温搅拌3h,tlc监控(展开剂:乙酸乙酯/正己烷=1/20),原料a1-7基本反应完全。反应液降温至室温,往体系加入二氯甲烷(200ml)和去离子水(100ml),萃取,收集有机相旋干,进行柱层析纯化(洗脱剂:乙酸乙酯/正己烷=1/40),干燥得到白色固体化合物a1-8(10.6g,收率79.1%)。质谱:595.7(m h).
[0083]
化合物a1-9的合成
[0084]
将a1-8(10.6g,17.8mmol,1.0eq),吡啶盐酸盐(98.8g,0.85mol,48eq)、加入到500ml单口瓶中,再加入二氯苯(24ml),搅拌,氮气置换三次,升温至190℃,反应2.5h后tlc监测(展开剂:乙酸乙酯/正己烷=1/3),原料反应完全,反应降至室温。向反应中加入饱和碳酸氢钠溶液(120ml)和甲苯(120ml),搅拌溶清分液,有机相再水洗2次(150ml/次),收集有机相旋干。粗品硅胶柱层析纯化(洗脱剂:乙酸乙酯/正己烷=1/20),干燥得到黄色固体a1-9(8.33g,收率80.5%)。质谱:581.2(m h)。
[0085]
化合物a 1的合成
[0086]
取1l单口瓶,投入a1-9(6.5g,11.19mmol,1.0eq),氯亚铂酸钾(8.11g,17.35mmol,1.55eq)和四丁基溴化铵(541mg,1.68mmol,0.15eq)和乙酸(650ml)。真空、氮气置换三次,在氮气保护下加热至125℃,反应72h。tlc监测(展开剂:二氯甲烷/正己烷=1/2),原料a1-9反应完全,反应降至室温。反应液加到装有去离子水(650ml)的烧杯中,搅拌析出固体,过滤收集固体。粗品进行硅胶柱层析分离(洗脱剂:二氯甲烷/正己烷=1/8),所得橙黄色固体,再采用二氯甲烷(60ml)/甲醇(80ml)重结晶1次,得到橙黄色化合物a1(5.23g,收率60.3%)。将5.23克a1粗品升华纯化后得到升华纯a1(3.64g,收率69.5%),质谱:774.2(m h)。1h nmr(400mhz,cdcl3)δ8.65(s,1h),8.44(s,1h),8.23(d,j=30.0hz,4h),8.12
–
7.94(m,3h),7.72(d,j=25.0hz,3h),7.58
–
7.22(m,10h),6.97(s,1h),3.27(s,3h).
[0087]
实施例2化合物a 3的合成
[0088][0089]
化合物a3-2的合成
[0090]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:671.8(m h)。
[0091]
化合物a3-3的合成
[0092]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:657.8(m h)。
[0093]
化合物a 3的合成
[0094]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 3(4.66g,收率59.4%)。将4.66克a 3粗品升华纯化后得到升华纯a 3(2.91g,收率61.4%)。质谱:850.8(m h)。1h nmr(400mhz,cdcl3)δ8.64(s,1h),8.42(s,1h),8.24(d,j=30.0hz,4h),8.05(d,j=30.0hz,4h),7.72(d,j=25.0hz,3h),7.59
–
7.34(m,11h),7.29(d,j=5.0hz,2h),6.98(s,1h),3.28(s,3h).
[0095]
实施例3化合物a 28的合成
[0096]
中间体a 28-4的合成
[0097][0098]
化合物a28-2的合成
[0099]
参照化合物a1-4的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:257.3(m h)。
[0100]
化合物a28-3的合成
[0101]
参照化合物a1-5的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:435.3(m h)。
[0102]
化合物a28-4的合成
[0103]
参照化合物a1-5的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:482.4(m h)。
[0104]
化合物a 28的合成
[0105][0106]
化合物a28-5的合成
[0107]
参照化合物a1-7的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:482.0(m h)。
[0108]
化合物a28-6的合成
[0109]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:595.7(m h)。
[0110]
化合物a28-9的合成
[0111]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:599.7(m h)。
[0112]
化合物a 28的合成
[0113]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,同时采用氘代乙酸做为反应溶剂,得到橙黄色化合物a 28(4.24g,收率64.1%)。将4.24克a 28粗品升华纯化后得到升华纯a 28(2.64g,收率62.2%)。质谱:871.8(m h)。1h nmr(400mhz,cdcl3)δ8.43(d,j=10.0hz,2h),8.23(d,j=30.0hz,4h),8.05(d,j=30.0hz,4h),7.72(d,j=25.0hz,3h),7.57
–
7.34(m,11h),7.09(d,j=35.0hz,2h).实施例4化合物a 39的合成
[0114]
中间体a 39-3的合成
[0115][0116]
化合物a39-1的合成
[0117]
参照化合物a1-4的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:257.3(m h)。
[0118]
化合物a39-2的合成
[0119]
参照化合物a1-5的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:435.3(m h)。
[0120]
化合物a39-3的合成
[0121]
参照化合物a1-5的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:482.4(m h)。
[0122]
化合物a 39的合成
[0123][0124]
化合物a39-4的合成
[0125]
参照化合物a1-7的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:576.2(m h)。
[0126]
化合物a39-5的合成
[0127]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:784.0(m h)。
[0128]
化合物a39-6的合成
[0129]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即
可。质谱:770.0(m h)。
[0130]
化合物a 39的合成
[0131]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可,同时采用氘代乙酸做为反应溶剂,得到橙黄色化合物a 39(4.37g,收率67.4%)。将4.37克a 39粗品升华纯化后得到升华纯a 39(2.66g,收率60.8%)。质谱:963.0(m h)。1h nmr(400mhz,cdcl3)δ8.22(d,j=15.9hz,2h),7.98(dt,j=15.0,7.3hz,5h),7.84
–
7.65(m,5h),7.64
–
7.31(m,11h),7.18(t,j=7.8hz,1h),6.69(t,1h),3.28(s,3h),1.52(d,j=44.0hz,18h).
[0132]
实施例5化合物a 71的合成
[0133][0134]
化合物a71-2的合成
[0135]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:687.9(m h)。
[0136]
化合物a71-3的合成
[0137]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:672.8(m h)。
[0138]
化合物a 71的合成
[0139]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 71(4.37g,收率56.2%)。将4.37克a 71粗品升华纯化后得到升华纯a 71(2.4g,收率54.9%)。质谱:866.9(m h)。h nmr(400mhz,cdcl3)δ8.63(s,1h),8.53(s,2h),8.41(s,1h),8.37
–
8.17(m,6h),7.72(d,j=25.0hz,3h),7.55
–
7.37(m,11h),7.29(d,j=5.0hz,2h),7.01(s,1h),3.28(s,3h).
[0140]
实施例6化合物a 82的合成
[0141][0142]
化合物a82-1的合成
[0143]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:724.0(m h)。
[0144]
化合物a82-2的合成
[0145]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:710.0(m h)。
[0146]
化合物a 82的合成
[0147]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 82(3.97g,收率63.7%)。将3.97克a 82粗品升华纯化后得到升华纯a 82(2.58g,收率64.9%)。质谱:903.0(m h)。1h nmr(400mhz,cdcl3)δ8.22(s,1h),8.18(d,j=5.9hz,2h),7.98(d,j=7.7hz,1h),7.88(s,1h),7.85
–
7.78(m,1h),7.71
–
7.41(m,10h),7.39
–
7.32(m,1h),7.31
–
7.23(m,2h),7.19(t,j=7.6hz,1h),6.67(t,j=6.8hz,1h),3.27(s,3h),1.59(s,18h).
[0148]
实施例7化合物a 89的合成
[0149][0150]
化合物a89-2的合成
[0151]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:645.8(m h)。
[0152]
化合物a89-3的合成
[0153]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:631.7(m h)。
[0154]
化合物a 89的合成
[0155]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 89(3.57g,收率56.7%)。将3.57克a 89粗品升华纯化后得到升华纯a 89(2.16g,收率60.5%)。质谱:824.8(m h)。1h nmr(400mhz,cdcl3)δ8.66(s,1h),8.45(s,1h),8.24(d,j=30.0hz,4h),8.13
–
7.95(m,3h),7.73(d,j=25.0hz,3h),7.58
–
7.22(m,10h),6.99(s,1h),3.28(s,3h).
[0156]
实施例8化合物a 100的合成
[0157][0158]
化合物a100-2的合成
[0159]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:858.1(m h)。
[0160]
化合物a100-3的合成
[0161]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:844.1(m h)。
[0162]
化合物a 100的合成
[0163]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 100(4.12g,收率58.8%)。将4.12克a 100粗品升华纯化后得到升华纯a 100(2.59g,收率62.86%)。质谱:1037.2(m h)。1h nmr(400mhz,cdcl3)δ8.66(s,1h),8.44(s,1h),8.22(d,j=30.0hz,4h),8.11(s,1h),7.90(s,1h),7.83
–
7.66(m,4h),7.54
–
7.38(m,4h),7.37
–
7.14(m,10h),7.10(s,4h),6.99(s,1h),3.28(s,3h),1.60(s,18h).
[0164]
实施例9化合物a 111的合成
[0165]
[0166][0167]
化合物a111-1的合成
[0168]
参照化合物a1-6的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:555.5(m h)。
[0169]
化合物a111-2的合成
[0170]
向一个500ml三口瓶,依次将化合物a111-1(11.5g,20.7mmol,1.0eq)、2,5-二溴呋喃(7.03g,31.1mmol,1.5eq),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(0.3g,0.41mmol,0.02eq)、碳酸钾(5.73g,41.8mmol,2.0eq),甲苯(115ml),乙醇(25ml),去离子水(25ml),氮气置换三次后加热至65℃,保温搅拌6h,tlc监控(展开剂:二氯甲烷/正己烷=1/15),原料a111-1基本反应完全。反应液降温至室温,往体系加入二氯甲烷(150ml)和去离子水(100ml),萃取,收集有机相旋干。粗品进行硅胶柱层析分离(洗脱剂:二氯甲烷/正己烷=1/40),所得橙类白色固体a111-2(7.46g,收率62.7%)。质谱:574.5(m h).
[0171]
化合物a111-4的合成
[0172]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:745.9(m h)。
[0173]
化合物a111-5的合成
[0174]
参照化合物a1-9的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:731.7(m h)。
[0175]
化合物a 111的合成
[0176]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 111(3.75g,收率61.1%)。将3.75克a 111粗品升华纯化后得到升华纯a 111(2.17g,收率57.8%)。质谱:916.9(m h)。1h nmr(400mhz,cdcl3)δ8.65(s,1h),8.32
–
8.17(m,5h),8.05(d,j=30.0hz,2h),7.81
–
7.66(m,5h),7.62
–
7.37(m,11h),7.29(d,j=5.0hz,2h),7.05(s,2h),6.99(s,1h),3.28(s,3h)
[0177]
实施例10化合物a 125的合成
[0178][0179]
化合物a125-2的合成
[0180]
参照化合物a111-2的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:624.5(m h)。
[0181]
化合物a125-3的合成
[0182]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:711.8(m h)。
[0183]
化合物a125-4的合成
[0184]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:697.8(m h)。
[0185]
化合物a 125的合成
[0186]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 125(3.93g,收率59.3%)。将3.93克a 125粗品升华纯化后得到升华纯a 125(2.28g,收率58.0%)。质谱:890.9(m h)。1h nmr(400mhz,cdcl3)δ8.64(s,1h),8.32
–
8.17(m,5h),7.98(s,2h),7.81
–
7.67(m,6h),7.61
–
7.45(m,5h),7.46
–
7.24(m,8h),6.98(s,1h),3.27(s,3h).
[0187]
实施例11化合物a 168的合成
[0188]
[0189]
化合物a168-1的合成
[0190]
参照化合物a111-2的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:590.5(m h)。
[0191]
化合物a168-2的合成
[0192]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:826.0(m h)。
[0193]
化合物a168-3的合成
[0194]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:811.0(m h)。
[0195]
化合物a 168的合成
[0196]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 168(4.22g,收率63.1%)。将4.22克a 168粗品升华纯化后得到升华纯a 168(2.69g,收率63.7%)。质谱:1005.1(m h)。1h nmr(400mhz,cdcl3)δ8.66(s,1h),8.31
–
8.18(m,5h),8.09(s,1h),7.90(d,j=5.0hz,6h),7.82
–
7.65(m,5h),7.54
–
7.18(m,14h),6.99(s,1h),3.28(s,3h),
[0197]
实施例12化合物a 197的合成
[0198][0199][0200]
化合物a197-2的合成
[0201]
参照化合物a111-2的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:637.6(m h)。
[0202]
化合物a197-3的合成
[0203]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:724.9(m h)。
[0204]
化合物a197-4的合成
[0205]
参照化合物a1-8的合成过程及后处理纯化方法,只需要将对应的原物料变更即可。质谱:710.8(m h)。
[0206]
化合物a 197的合成
[0207]
参照化合物a1的合成过程及后处理纯化方法,只需要将对应的原物料变更即可得到橙黄色化合物a 197(3.67g,收率55.8%)。将3.67克a 197粗品升华纯化后得到升华纯a 197(2.08g,收率56.6%)。质谱:903.9(m h)。h nmr(400mhz,cdcl3)δ8.67(s,1h),8.33
–
8.17(m,5h),7.98(s,1h),7.75(dd,j=30.0,15.0hz,6h),7.61
–
7.23(m,12h),7.01(d,j=45.0hz,2h),3.82(s,3h),3.27(s,3h).
[0208]
应用例:有机电致发光器件的制作
[0209]
将50mm*50mm*1.0mm的具有ito(100nm)透明电极的玻璃基板在乙醇中超声清洗10分钟,再150度烘干后经过n2 plasma处理30分钟。将洗涤后的玻璃基板安装在真空蒸镀装置的基板支架上,首先再有透明电极线一侧的面上按照覆盖透明电极的方式蒸镀化合物hatcn,形成膜厚为5nm的薄膜,紧接着蒸镀一层htm1形成膜厚为60nm的薄膜,再在htm1薄膜上蒸镀一层htm2形成膜厚为10nm的薄膜,然后,在htm2膜层上再采用共蒸镀的模式蒸镀主体材料1、主体材料2和参杂化合物(对比化合物x、cpd x),膜厚为30nm,主体材料和参杂材料比例为45%:45%:10%。在发光层上再依次蒸镀etl膜层(25nm)liq膜层(1nm),最后蒸镀一层金属al(100nm)作为电极。
[0210][0211]
评价:
[0212]
将上述器件进行器件性能测试,在各实施例和比较例中,使用恒定电流电源(keithley2400),使用固定的电流密度流过发光元件,使用分光辐射俩都系(cs 2000)测试发光波谱。同时测定电压值以及测试亮度为初始亮度的90%的时间(lt90)。结果如下:
[0213][0214][0215]
由上面表格中的数据对比可知,使用本发明的化合物作为绿光掺杂剂的有机电致发光器件,相较于对比化合物在驱动电压、发光效率、器件寿命都表现出更加优越的性能。
[0216]
上述结果表明本发明的化合物具有光、电化学稳定性高,色饱和度高,发光效率高,器件寿命长等优点,可用于有机电致发光器件中。特别是作为绿色磷光材料,具有应用于oled产业的可能。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。