一种利用角质酶突变体促进重组蛋白胞外表达的方法
1.本技术是针对原申请号为:cn202011208395.6,原申请日为2020年11月3日,发明名称为一种利用角质酶促进蛋白在枯草芽孢杆菌中胞外表达的方法的分案申请。
技术领域
2.本发明涉及一种利用角质酶突变体促进重组蛋白胞外表达的方法,属于基因工程、酶工程、微生物工程技术领域。
背景技术:
3.蛋白质的胞外表达可简化下游纯化工艺,节约成本,在大规模工业化生产中具有绝对优势。而对于天然胞内定位型蛋白,通常只能在细胞内进行表达,并且需要利用物理或化学方法对细胞进行破碎才能获得目的蛋白,后续提取工艺不但繁琐而且成本较高,因此寻找能够有效的简化下游提取步骤降低产物纯化成本成为了研究者的目标。
4.发明人课题组在前期研究中发现,角质酶在无信号肽介导的情况下实现了在大肠杆菌系统中高效胞外基质“分泌”型表达,尽管这种“分泌”机制还未完全解析,但是推测该现象与角质酶有限的磷脂水解活性引发的膜通透性增强有关。此外,发明人课题组还发现,当角质酶在大肠杆菌中与胞内蛋白共表达时,该效应还能够引发天然胞内定位型蛋白的胞外释放,并且在此过程中未发现明显的细胞裂解现象,因此,不会对下游分离提取过程产生明显的不利影响。当角质酶与天然胞内定位型蛋白在大肠杆菌中共表达时,角质酶能够在一定程度水解细胞膜的磷脂成分,增加细胞膜的通透性,保证细胞完整性的情况下使天然胞内定位型蛋白分泌到胞外,为重组胞内定位型酶的胞外表达提供了一种新的方向;但是大肠杆菌是非食品用菌株,其安全性不可控,因此,无法扩大其应用范围。
5.而枯草芽孢杆菌属于革兰氏阳性菌,具备无致病性,环境兼容性好、不易产生抗药性等优点,而且还具有良好的发酵基础,其培养简单快速,已被美国食品药物管理局和中国相关部门认定为食品安全级菌株gras(generally recognized as safe),目前广泛用于生产各种工业用酶。
6.发明人课题组尝试将角质酶与天然胞内定位型蛋白在大肠杆菌中共表达的技术方案应用于枯草芽孢杆菌表达系统中时,由于大肠杆菌的细胞膜的组成成分与枯草芽孢杆菌细胞膜的组成成分不同,以及大肠杆菌表达系统与枯草芽孢杆菌表达系统的差异,导致天然胞内定位型蛋白的胞外分泌效果不佳,因此,如何实现天然胞内定位型蛋白胞外分泌,以及如何才能得到一种安全、高效的天然胞内定位型蛋白胞外分泌成为了亟待解决的问题。
技术实现要素:
7.针对现有技术中采用大肠杆菌表达系统实现天然胞内定位型蛋白的胞外表达中,存在的不安全性问题,本发明为了得到一种安全、高效的天然胞内定位型蛋白胞外分泌的方法,首先提供了一种角质酶突变体,所述角质酶突变体是将氨基酸序列如seq id no.1所
示的角质酶的第175、177、178、207、209、213、214位中的一个或多个位点进行突变得到的。
8.在本发明的一种实施方式中,所述角质酶来源于嗜热单孢菌thermobifida fusca。
9.在本发明的一种实施方式中,所述角质酶的核苷酸序列如seq id no.2所示。
10.在本发明的一种实施方式中,所述角质酶突变体为,将氨基酸序列如seq id no.1所示的角质酶的第175、177、178、207、209、213或214位的氨基酸突变为丙氨酸得到的,分别命名为:l175a、t177a、i178a、t207a、f209a、i213a、p214a。
11.在本发明的一种实施方式中,所述突变体是将第175位置的亮氨酸(leu)变成丙氨酸(ala),同时将第177位置的苏氨酸(thr)变成丙氨酸(ala),得到l175a/t177a。
12.在本发明的一种实施方式中,所述突变体是将第207位置的苏氨酸(thr)变成丙氨酸(ala),同时将第209位置的苯丙氨酸(phe)变成丙氨酸(ala),得到t207a/f209a。
13.在本发明的一种实施方式中,所述突变体是将第213位置的异亮氨酸(ile)变成丙氨酸(ala),同时将第214位置的苯丙氨酸(phe)变成丙氨酸(ala),得到i213a/p214a。
14.本发明还提供了编码上述突变体的基因。
15.本发明还提供了携带上述基因的重组载体。
16.本发明还提供了上述基因,或上述重组载体的重组细胞。
17.在本发明的一种实施方式中,所述重组细胞以枯草芽孢杆菌为表达宿主。
18.本发明还提供了一种重组枯草芽孢杆菌,所述重组枯草芽孢杆菌共表达了上述角质酶突变体与胞内蛋白。
19.所述胞内蛋白是天然胞内定位型蛋白,即合成于核糖体后在伴侣蛋白的辅助下,仍定位在细胞质中的蛋白。
20.在本发明的一种实施方式中,所述胞内蛋白包括但不限于木糖异构酶、4,6-α-葡萄糖基转移酶、4-α-糖基转移酶、海藻糖合酶和分支酶。
21.在本发明的一种实施方式中,所述木糖异构酶的氨基酸序列如seq id no.3所示。
22.在本发明的一种实施方式中,所述木糖异构酶的核苷酸序列如seq id no.4所示。
23.在本发明的一种实施方式中,所述4,6-α-葡萄糖基转移酶的氨基酸序列如seq id no.5所示。
24.在本发明的一种实施方式中,所述4,6-α-葡萄糖基转移酶的核苷酸序列如seq id no.6所示。
25.在本发明的一种实施方式中,所述4-α-糖基转移酶的氨基酸序列如seq id no.7所示。
26.在本发明的一种实施方式中,所述4-α-糖基转移酶的核苷酸序列如seq id no.8所示。
27.在本发明的一种实施方式中,所述海藻糖合酶的ncbi登录号:wp_011291031.1。
28.在本发明的一种实施方式中,所述分支酶的ncbi登录号:wp_011228999.1。
29.在本发明的一种实施方式中,是以枯草芽孢杆菌ws5、枯草芽孢杆菌168、枯草芽孢杆菌w600、枯草芽孢杆菌w800、枯草芽孢杆菌rik1285中的任一为表达宿主。
30.在本发明的一种实施方式中,是以phy300plk、pub110、pbe-s、pwb980中的任一为表达载体。
31.本发明还提供了构建上述重组枯草芽孢杆菌的方法,将编码角质酶突变体的基因和编码胞内蛋白的基因连接到表达载体上,得到重组表达载体,然后将重组表达载体转化到表达宿主中。
32.在本发明的一种实施方式中,包括如下步骤:
33.(1)将编码角质酶和胞内蛋白的基因同phy300plk质粒连接,得到重组质粒,将重组质粒作为定点突变的模板,设计定点突变的突变引物进行定点突变;构建含有编码突变体的基因的重组突变体质粒。
34.(2)将步骤(1)得到的重组突变体质粒转化进枯草芽孢杆菌宿主细胞(bacillus subtilis)ws5。
35.(3)挑选步骤(2)中的阳性克隆进行发酵培养,离心收集细胞,细胞发酵上清液即为胞内蛋白的粗酶液。
36.所述枯草芽孢杆菌(bacillus subtilis)ws5已于2016年9月29日保藏于中国典型培养物保藏中心,保藏编号为cctcc no:m 2016536,保藏地址为中国.武汉.武汉大学。
37.所述枯草芽孢杆菌(bacillus subtilis)ws5记载于公开号为cn106754466a,申请号为201611025858.9的专利申请文本中。
38.本发明还提供了上述突变体,或上述基因,或上述载体在促进枯草芽孢杆菌将重组胞内酶在胞外表达的中应用。所述应用为,将上述突变体或上述基因与胞内蛋白共表达,或在上述载体上连接有角质酶基因与胞内蛋白的基因。
39.在本发明的一种实施方式中,所述应用为将上述重组枯草芽孢杆菌接种至发酵培养基中。
40.本发明还提供了一种生产胞外蛋白的方法,将上述重组枯草芽孢杆菌接种至种子培养基中,得到种子液,将种子液接种至发酵培养基中进行发酵,离心,收集发酵上清液。
41.在本发明的一种实施方式中,所述方法为,将上述重组枯草芽孢杆菌工程菌先接种于种子培养基中,于35~38℃、180~220rpm下培养8-10h,得到种子液,然后将种子液接种至发酵培养基中,于30~37℃、180~220rpm下培养20~26h。
42.在本发明的一种实施方式中,所述种子培养基成分包含8~12g/l的蛋白胨、4~6g/l的酵母粉以及8~12g/l的氯化钠。
43.在本发明的一种实施方式中,所述发酵培养基的成分包含20~25g/l的酵母浸膏、5~10g/l的大豆蛋白胨以及4~6g/l的甘油;所述发酵培养基的初始ph为6~7。
44.本发明还提供了上述突变体,或上述基因,或上述载体,或上述重组细胞,或上述重组枯草芽孢杆菌在发酵产酶或参与酶解催化反应方面的应用。
45.有益效果
46.(1)本发明提供了一种利用角质酶突变体促进枯草芽孢杆菌系统的重组胞内酶在胞外分泌,以木糖异构酶、4,6-α-葡萄糖基转移酶、4-α-葡萄糖基转移酶、海藻糖合酶及分支酶为例,本发明成功实现了木糖异构酶、4,6-α-葡萄糖基转移酶、4-α-葡萄糖基转移酶、海藻糖合酶及分支酶的胞外表达,可简化下游纯化工艺,节约成本,在大规模工业化生产中具有绝对优势。
47.(2)当木糖异构酶单独表达时,木糖异构酶胞外酶活未检出,采用本发明提供的技术方案,木糖异构酶胞外酶活最高可达5.6u/ml。
48.(3)当4,6-α-葡萄糖基转移酶单独表达时,4,6-α-葡萄糖基转移酶胞外酶活未检出,采用本发明提供的技术方案,4,6-α-葡萄糖基转移酶胞外酶活最高可达745.2u/ml,实现重组胞内定位型酶的高效胞外制备。
49.(4)当4-α-葡萄糖基转移酶单独表达时,4-α-葡萄糖基转移酶胞外酶活未检出,采用本发明提供的技术方案,4-α-葡萄糖基转移酶胞外酶活最高可达11.4u/ml。
具体实施方式
50.下述实施例所涉及的培养基如下:
51.lb固体培养基:10g/l蛋白胨、5g/l的酵母膏、10g/l的nacl、0.2g/l的琼脂粉。
52.lb液体培养基:10g/l蛋白胨、5g/l的酵母膏、10g/l的nacl。
53.种子培养基:10g/l的蛋白胨、5g/l的酵母粉以及10g/l的氯化钠。
54.发酵培养基:24g/l的酵母浸膏、12g/l的大豆蛋白胨以及5g/l的甘油,12.54g/l的k2hpo4,2.31g/l的kh2po4;初始ph为6~7。
55.下述实施例所涉及的检测方法如下:
56.木糖异构酶酶活检测方法:
57.向反应体系(底物3mol
·
l-1
,葡萄糖溶液100μl,50mmol
·
l-1
mgso4溶液100μl,0.3mol
·
l-1
、ph 7.5的na2hpo
4-kh2po4缓冲液100μl,h2o 600μl)中加入待测液100μl。在70℃条件下反应10min后,加入0.5mol l-1
的hclo
4 1ml停止反应。取上述反应液500μl,加入半胱氨酸盐酸盐溶液(15g l-1
)100μl,75%浓h2so
4 3ml和咔唑-酒精溶液100μl,震荡混匀,60℃显色10min。冰浴冷却,于560nm波长处测定吸光度(以同样操作的灭活酶液作为空白对照)。
58.酶活力定义为,上述反应条件下,每分钟生成果糖量1μmol所需的酶量。
59.4,6-α-葡萄糖基转移酶酶活测定方法:
60.(1)1%直链淀粉母液配制:40mg的直链淀粉加入2ml的蒸馏水充分润湿,加入2ml的2m的naoh溶液,漩涡振荡充分溶解,用时取500μl的直链淀粉母液加250μl的2m的hcl溶液,然后加入3250μl的磷酸-柠檬酸缓冲液(ph 7.0)配成0.125%的底物。
61.(2)鲁戈碘液的配制:0.26g碘与2.60g碘化钾溶于10ml的容量瓶中(提前3天配制,确保碘完全溶解),用时取100μl的鲁戈碘液,加入50μl的2m的hcl溶液然后补水到26ml配成碘显色液。
62.反应体系为,取200μl的步骤(1)配制的底物于1.5ml离心管中,35℃温浴10min。加入200μl的待测酶液,35℃反应10min,反应结束后取200μl反应液加入到3800μl的碘显色液中显示5min,分光光度计测定660nm下的吸光度。对照用缓冲液代替酶液,空白取200μl的缓冲液加入到3800μl的碘显色液中显示5min。
63.酶活单位定义为,单位时间吸光值下降一个百分点为一个酶活单位。
64.海藻糖合酶酶活检测方法:
65.取400μl稀释合适倍数的酶液,加入400μl用20mmol/l、ph7.0磷酸缓冲液配制的5%(w/v)麦芽糖溶液,混合溶液30℃反应30min,然后沸水浴10min终止酶反应,用hplc测定生成的海藻糖含量。hplc检测条件为流动相:乙腈:水=80:20,流速:0.8ml/min,柱温:40℃,nh2柱,示差检测器。
112.引入t177a突变的定点突变引物为:
113.t177a-f:5
’‑
gggccgacctcgacgcgatcgcgccggtcg-3’114.t177a-r:5
’‑
cgaccggcgcgatcgcgtcgaggtcggccc-3’115.引入t207a突变的定点突变引物为:
116.t207a-f:5
’‑
ggagctggacggcgcagcccacttcgccccgaac-3’117.t207a-r:5
’‑
gttcggggcgaagtgggctgcgccgtccagctcc-3’118.引入f209a突变的定点突变引物为:
119.f209a-f:5
’‑
gctggacggcgcaacccacgcagccccgaacatcccc-3’120.f209a-r:5
’‑
ggggatgttcggggctgcgtgggttgcgccgtccagc-3’121.引入i213a突变的定点突变引物为:
122.i213a-f:5
’‑
ccacttcgccccgaacgcccccaacaagatcatcgg-3’123.i213a-r:5
’‑
ccgatgatcttgttgggggcgttcggggcgaagtgg-3’124.引入p214a突变的定点突变引物为:
125.p214a-f:5
’‑
ccacttcgccccgaacatcgccaacaagatcatcgg-3’126.p214a-r:5
’‑
ccgatgatcttgttggcgatgttcggggcgaagtgg-3’127.实施例3:角质酶突变体与木糖异构酶共表达重组菌构建
128.(1)感受态细胞的制备:
129.用接种环沾取冻存的bacillus subtilis ws5,然后在lb平板上划线,37℃培养过夜活化;挑取单菌落接种于10ml lb液体培养基中,37℃,200rpm过夜培养8h;取2.5ml转接入40ml含有0.5m山梨醇的lb培养基,37℃,200rpm震荡培养4~5h;将菌液冰水浴10min,然后4℃5000rpm离心5min,收集菌体。用50ml预冷的电转缓冲液重悬菌体,4℃5000rpm离心5min,去上清,如此漂洗4次;将洗涤后的菌体重悬于1ml电转培养基中,分装到1.5ml ep管中,每管200μl,得到感受态细胞。
130.(2)感受态细胞的转化:
131.向步骤(1)得到的感受态细胞中分别加入实施例1和2所得的各重组质粒,冰浴18min,加入预冷的电转杯(2mm)中,电击一次(2.4kv,25μf,200ω);电击完毕后立即加入1ml预冷的rm培养基(蛋白胨10g/l,酵母粉5g/l,nacl 10g/l,山梨醇91g/l,甘露醇69g/l),37℃,200rpm,复苏3h后,涂含四环素抗性(50ug/ml)的平板,即得到重组菌:
132.bacillus subtilis ws5/phy300plk-xyla,bacillus subtilis ws5/phy300plk-xyla-cut,bacillus subtilis ws5/phy300plk-xyla-l175a/t177a,bacillus subtilis ws5/phy300plk-xyla-t207a/f209a,bacillus subtilis ws5/phy300plk-xyla-i213a/p214a,bacillus subtilis ws5/phy300plk-xyla-i178a,bacillus subtilis ws5/phy300plk-xyla-l175a,bacillus subtilis ws5/phy300plk-xyla-t177a,bacillus subtilis ws5/phy300plk-xyla-t207a,bacillus subtilis ws5/phy300plk-xyla-f209a,bacillus subtilis ws5/phy300plk-xyla-i213a,bacillus subtilis ws5/phy300plk-xyla-p214a。
133.实施例4:摇瓶发酵产木糖异构酶
134.具体步骤如下:
135.(1)分别将实施例3中得到的重组枯草芽孢杆菌菌株接种于种子培养基中,于35~
38℃、180~220rpm条件下培养8~10h,分别得到种子液;
136.(2)分别将步骤(1)得到的各种子液按照5%(v/v)接种量转接至发酵培养基中,于33℃、200rpm下培养24h,然后在12000r
·
min-1
,10min离心后获得发酵上清液,分别对发酵上清液进行木糖异构酶酶活检测,检测结果如表1所示:
137.表1发酵上清液中木糖异构酶酶活
[0138][0139]
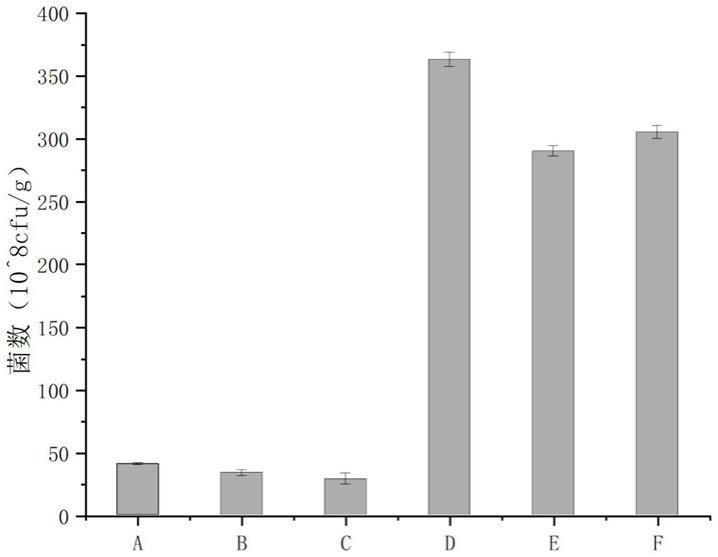
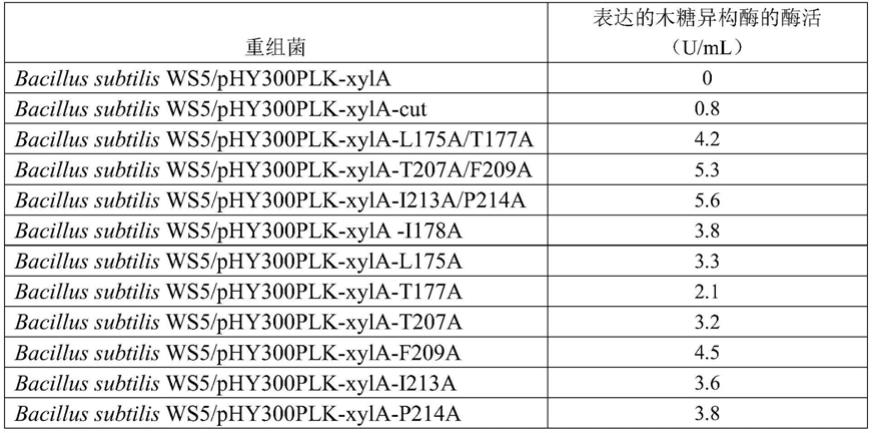
由检测结果可以看出:当木糖异构酶单独表达时,木糖异构酶胞外酶活未检出;与角质酶、或其突变体共表达时,在胞外均测到了酶活,证明本发明的技术方案,实现了木糖异构酶的在枯草芽孢杆菌中的胞外分泌,同时,采用木糖异构酶与角质酶突变体i213a/p214a共表达时的酶活,是采用木糖异构酶与野生型角质酶共表达的酶活的7倍。
[0140]
实施例5:共表达角质酶突变体促进4,6-α-葡萄糖基转移酶的胞外表达
[0141]
具体步骤如下:
[0142]
(1)采用实施例1-3的方法构建重组质粒phy300plk-gtfb,phy300plk-gtfb-cut,phy300plk-gtfb-l175a/t177a,phy300plk-gtfb-t207a/f209a,phy300plk-gtfb-i213a/p214a,phy300plk-gtfb-i178a,phy300plk-gtfb-l175a,phy300plk-gtfb-t177a,phy300plk-gtfb-t207a,phy300plk-gtfb-f209a,phy300plk-gtfb-i213a,phy300plk-gtfb-p214a并转化bacillus subtilis ws5,得到重组菌:
[0143]
bacillus subtilis ws5/phy300plk-gtfb,bacillus subtilis ws5/phy300plk-gtfb-cut,bacillus subtilis ws5/phy300plk-gtfb-l175a/t177a,bacillus subtilis ws5/phy300plk-gtfb-t207a/f209a,bacillus subtilis ws5/phy300plk-gtfb-i213a/p214a,bacillus subtilis ws5/phy300plk-gtfb-i178a,bacillus subtilis ws5/phy300plk-gtfb-l175a,bacillus subtilis ws5/phy300plk-gtfb-t177a,bacillus subtilis ws5/phy300plk-gtfb-t207a,bacillus subtilis ws5/phy300plk-gtfb-f209a,bacillus subtilis ws5/phy300plk-gtfb-i213a,bacillus subtilis ws5/phy300plk-gtfb-p214a;
[0144]
(2)将上述重组枯草芽孢杆菌菌株分别接种于种子培养基中,于35~38℃、180~220rpm条件下培养8~10h,分别得到种子液;
[0145]
(3)分别将步骤(2)得到的各种子液按照5%(v/v)接种量转接至发酵培养基中,于
33℃、200rpm下培养24h,然后在12000r
·
min-1
,10min离心后获得发酵上清液,分别对发酵上清液进行4,6-α-葡萄糖基转移酶酶活检测,检测结果如表2所示:
[0146]
表2发酵上清液中4,6-α-葡萄糖基转移酶酶活
[0147][0148][0149]
由检测结果可以看出:当4,6-α-葡萄糖基转移酶单独表达时,4,6-α-葡萄糖基转移酶胞外酶活未检出。
[0150]
采用4,6-α-葡萄糖基转移酶与角质酶突变体i213a/p214a共表达时的酶活,是采用木4,6-α-葡萄糖基转移酶与野生型角质酶共表达的酶活的6倍。
[0151]
实施例6:共表达角质酶突变体促进4-α-糖基转移酶的胞外表达
[0152]
具体步骤如下:
[0153]
(1)采用实施例1-3的方法构建重组质粒phy300plk-4gt,phy300plk-4gt-cut,phy300plk-4gt-l175a/t177a,phy300plk-4gt-t207a/f209a,phy300plk-4gt-i213a/p214a,phy300plk-4gt-i178a,phy300plk-4gt-l175a,phy300plk-4gt-t177a,phy300plk-4gt-t207a,phy300plk-4gt-f209a,phy300plk-4gt-i213a,phy300plk-4gt-p214a并转化bacillus subtilis ws5,得到重组菌:
[0154]
bacillus subtilis ws5/phy300plk-4gt,bacillus subtilis ws5/phy300plk-4gt-cut,bacillus subtilis ws5/phy300plk-4gt-l175a/t177a,bacillus subtilis ws5/phy300plk-4gt-t207a/f209a,bacillus subtilis ws5/phy300plk-4gt i213a/p214a,bacillus subtilis ws5/phy300plk-4gt-i178a,bacillus subtilis ws5/phy300plk-4gt-l175a,bacillus subtilis ws5/phy300plk-4gt-t177a,bacillus subtilis ws5/phy300plk-4gt-t207a,bacillus subtilis ws5/phy300plk-4gt-f209a,bacillus subtilis ws5/phy300plk-4gt-i213a,bacillus subtilis ws5/phy300plk-4gt-p214a;
[0155]
(2)将上述重组枯草芽孢杆菌菌株分别接种于种子培养基中,于35~38℃、180~220rpm条件下培养8~10h,分别得到种子液;
[0156]
(3)分别将步骤(2)得到的各种子液按照5%(v/v)接种量转接至发酵培养基中,于33℃、200rpm下培养24h,然后在12000r
·
min-1
,10min离心后获得发酵上清液,分别对发酵上清液进行4-α-糖基转移酶酶活检测,检测结果如表3所示:
[0157]
表3发酵上清液中4-α-葡萄糖基转移酶酶活
[0158][0159][0160]
由检测结果可以看出:当4-α-葡萄糖基转移酶单独表达时,4-α-葡萄糖基转移酶胞外酶活未检出。
[0161]
采用4-α-葡萄糖基转移酶与角质酶突变体t207a/f209a共表达时的酶活,是采用木糖异构酶与野生型角质酶共表达的酶活的4.6倍。
[0162]
实施例7:共表达角质酶突变体促进海藻糖合酶的胞外表达
[0163]
具体步骤如下:
[0164]
(1)采用实施例1-3的方法构建重组质粒并转化bacillus subtilis ws5,得到重组菌:
[0165]
bacillus subtilis ws5/phy300plk-tres,bacillus subtilis ws5/phy300plk-tres-cut,bacillus subtilis ws5/phy300plk-tres-l175a/t177a,bacillus subtilis ws5/phy300plk-tres-t207a/f209a,bacillus subtilis ws5/phy300plk-tres-i213a/p214a,bacillus subtilis ws5/phy300plk-tres-i178a,bacillus subtilis ws5/phy300plk-tres-l175a,bacillus subtilis ws5/phy300plk-tres-t177a,bacillus subtilis ws5/phy300plk-tres-t207a,bacillus subtilis ws5/phy300plk-tres-f209a,bacillus subtilis ws5/phy300plk-tres-i213a,bacillus subtilis ws5/phy300plk-tres-p214a(其中,质粒构建涉及的文献分别为:江南大学张康博士学位论文“枯草芽孢杆菌菌株改造、启动子优化和普鲁兰酶的高效制备研究”,2018,罗锋,段绪果,宿玲恰,吴敬,thermobifida fusca海藻糖合成酶基因的克隆表达及发酵优化,中国生物工程杂志,2013,33(8):98-104);
[0166]
(2)分别将上述重组枯草芽孢杆菌菌株接种于种子培养基中,于35~38℃、180~220rpm条件下培养8~10h,分别得到种子液;
[0167]
(3)分别将步骤(2)得到的各种子液按照5%(v/v)接种量转接至发酵培养基中,于33℃、200rpm下培养24h,然后在12000r
·
min-1
,10min离心后获得发酵上清液,分别对发酵上清液进行海藻糖合成酶酶活检测,其中当海藻糖合成酶单独表达时,海藻糖合成酶胞外酶活未检出;与角质酶、或其突变体共表达时,在胞外均测到了酶活。
[0168]
实施例8:共表达角质酶突变体促进分支酶的胞外表达
[0169]
具体步骤如下:
[0170]
(1)采用实施例1-3的方法构建重组质粒并转化bacillus subtilis ws5,得到重组菌:
[0171]
bacillus subtilis ws5/phy300plk-ttsbe,bacillus subtilis ws5/phy300plk-ttsbe-cut,bacillus subtilis ws5/phy300plk-ttsbe-l175a/t177a,bacillus subtilis ws5/phy300plk-ttsbe-t207a/f209a,bacillus subtilis ws5/phy300plk-ttsbe-i213a/p214a,bacillus subtilis ws5/phy300plk-ttsbe-i178a,bacillus subtilis ws5/phy300plk-ttsbe-l175a,bacillus subtilis ws5/phy300plk-ttsbe-t177a,bacillus subtilis ws5/phy300plk-ttsbe-t207a,bacillus subtilis ws5/phy300plk-ttsbe-f209a,bacillus subtilis ws5/phy300plk-ttsbe-i213a,bacillus subtilis ws5/phy300plk-ttsbe-p214a(其中,质粒构建涉及的文献为:2017年江南大学刘军硕士学位论文);
[0172]
(2)分别将上述重组枯草芽孢杆菌菌株接种于种子培养基中,于35~38℃、180~220rpm条件下培养8~10h,分别得到种子液;
[0173]
(3)分别将步骤(2)得到的种子液按照5%(v/v)接种量转接至发酵培养基中,于33℃、200rpm下培养24h,然后在12000r
·
min-1
,10min离心后获得发酵上清液,分别对发酵上清液进行分支酶酶活检测,其中,当分支酶单独表达时,分支酶胞外酶活未检出;与角质酶、或其突变体共表达时,在胞外均测到了酶活。
[0174]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。