pim激酶抑制剂
技术领域
1.本发明属于药物化学领域,涉及一种pim激酶抑制剂、其药物组合物、制备方法及其在制备、预防和/或治疗与pim信号通路相关适应症的药物的用途。
背景技术:
2.莫洛尼小鼠白血病病毒的前病毒插入位点(proviral integration site of murine leukemia virus,pim)激酶是一种丝/苏氨酸蛋白激酶,由三种亚型pim1、pim2、pim3组成。pim1和pim2在血液瘤和实体瘤中高表达,pim3在肝细胞癌、胰腺癌和结肠癌中高表达。
3.pim激酶是jak/stat通路的下游分子,jak通路在自身免疫性疾病中发挥重要作用,文献研究表明pim-1抑制剂在小鼠炎症性肠炎模型中有效。提示pim激酶抑制剂在自身免疫性疾病中的应用。
4.此外,pim激酶可通过磷酸化一系列下游信号分子如p53、bad、myc等调控细胞增殖、生长、侵袭性,在肿瘤的发生发展中起到重要作用。临床前研究发现pim抑制剂对急性髓系白血病、骨髓纤维化、慢性淋巴细胞性白血病等血液瘤以及胃癌、前列腺癌等实体瘤中均有疗效,提示pim抑制剂在肿瘤治疗中的作用。
5.日本住友医药开发了一款pim抑制剂tp-3654(wo2013013188),但其细胞抑制活性低,毒性较大,生物利用度低。因此,目前急需提供一种效果更好的pim抑制剂。
技术实现要素:
6.针对上述的技术问题,本发明的第一个方面提供一种具有通式(i)所示结构的化合物、其氘代物、立体异构体或药学上可接受的盐:
[0007][0008]
其中,环a为5-6元杂环基、5-6元芳基或5-6元杂芳基;所述5-6元杂环基、5-6元杂芳基含有至少1个选自n、o、s的杂原子;
[0009]
x为ch或n;
[0010]
l为化学键或亚甲基;
[0011]
r1选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、卤素取代的-c
1-c6烷基、卤素取代的-o(c
1-c6烷基)、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、甲磺酰基或5-6元杂芳基;且当r1为5-6元杂芳基时,任选地被0-3个rb取代;
[0012]
r2选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-coorc;
[0013]
r3选自3-10元饱和或不饱和的烃基(包括直链或支链的烷基或杂烷基)、单环或双
环的环烷基或杂环基、或单环或双环的芳基或杂芳基;所述杂烷基、杂环基、杂芳基含有至少1个选自n、o、s的杂原子;
[0014]
所述r3任选地被1-3个ra取代;
[0015]
所述ra选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-c
3-c6环烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-(c
1-c6亚烷基)-oh;
[0016]
rb、rc各自独立地选自卤素或-c
1-c3烷基。
[0017]
在根据本发明的某些实施方式中,本发明提供的具有通式(i)所示结构的化合物、其氘代物、立体异构体或药学上可接受的盐可以进一步为:
[0018]
环a为5-6元芳基或5-6元杂芳基;所述5-6元杂芳基含有至少1个选自n、o、s的杂原子;
[0019]
x为ch或n;
[0020]
l为化学键或亚甲基;
[0021]
r1选自氢、卤素、羟基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基或三氟甲基氧基;
[0022]
r2选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基或三氟甲基氧基;
[0023]
r3选自直链、支链的烷基或杂烷基、单环或双环的环烷基或杂环基、或单环或双环的芳基或杂芳基;所述杂烷基、杂环基、杂芳基含有至少1个选自n、o、s的杂原子;
[0024]
所述r3任选地被1-3个ra取代;
[0025]
所述ra选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-(c
1-c6亚烷基)-oh。
[0026]
在根据本发明的某些实施方式中,本发明提供的具有通式(i)所示结构的化合物、其氘代物、立体异构体或药学上可接受的盐可以进一步为:
[0027]
环a为苯基或5-6元杂芳基,所述5-6元杂芳基含有1个选自n、o、s的杂原子;
[0028]
x为n原子;
[0029]
l为化学键或亚甲基;
[0030]
r1选自氢、三氟甲基或三氟甲基氧基;
[0031]
r2选自氢;
[0032]
r3选自3-10元单环或双环的环烷基或杂环基,所述杂环基含有至少1个选自n、o、s的杂原子;
[0033]
所述r3任选地被1-3个ra取代;
[0034]
所述ra选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-(c
1-c6亚烷基)-oh。
[0035]
在根据本发明的某些实施方式中,本发明提供的化合物进一步具有通式(ii)所示结构:
c(ch3)
2-oh。
[0056]
在根据本发明的某些实施方式中,本发明提供的具有通式(ii)所示结构的化合物、其氘代物、立体异构体或药学上可接受的盐可以进一步为:
[0057]
环a选自
[0058]
l为化学键;
[0059]
r1选自氢或三氟甲基;
[0060]
r3选自或
[0061]
r3选自8-9元双环的环烷基或杂环基,所述杂环基任选地含有1个选自n、o、s的杂原子,所述双环为螺环或桥环,所述r3任选地被1个ra取代;
[0062]
所述ra选自氢、羟基、-c
1-c3烷基、-c
3-c6环烷基或-(c
1-c6亚烷基)-oh。
[0063]
在一些优选的实施方式中,r3选自
[0064]
在一些优选的实施方式中,所述ra选自氢、羟基、甲基、环丙基、-亚甲基羟基或-c(ch3)
2-oh。
[0065]
在一些更优选的实施方式中,r3选自选自
[0066]
所述ra选自氢、羟基、甲基、-亚甲基羟基或-c(ch3)
2-oh。
[0067]
在根据本发明的某些实施方式中,本发明提供的化合物进一步具有通式(iii-1)或(iii-2)所示结构:
[0068]
[0069]
其中,r3选自所述r3任选地被1个ra取代,取代位点为c或n;
[0070]
所述ra选自氢、羟基、-亚甲基羟基或-c(ch3)
2-oh。
[0071]
在一些优选的实施方式中,所述r3选自:
[0072][0073]
在一些更优选的实施方式中,所述r3选自:
[0074][0075]
在一些更优选的实施方式中,所述r3选自:
[0076][0077]
在根据本发明的某些实施方式中,本发明提供的化合物进一步具有具有通式(iii-1)所示结构:
[0078][0079]
其中,r3选自
[0080]
在根据本发明的某些实施方式中,本发明提供的化合物进一步具有通式(iii-2)所示结构:
[0081]
[0082]
其中,r3选自
[0083]
在根据本发明的某些实施方式中,本发明提供的化合物进一步具有通式(iv-1)或(iv-2)所示结构:
[0084][0085]
其中,环a选自
[0086]
r1选自氢或三氟甲基。
[0087]
在一些优选的实施方式中,环a选自
[0088][0089]
在根据本发明的某些实施方式中,本发明提供通式(ii)所示结构化合物还可概括为:
[0090][0091]
其中,
[0092]
环a为苯基或5元杂芳基,所述5元杂芳基含有1或2个任选自n、o、s的杂原子;且环a被r1取代;
[0093]
l为化学键或亚甲基;
[0094]
r1选自氢、卤素、羟基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、三氟甲基或三氟甲基氧基;
[0095]
r3选自3-10元单环或双环的环烷基或杂环基,所述杂环基含有1或2个任选自n、o、s的杂原子;
[0096]
所述r3任选地被1-3个ra取代;
[0097]
所述ra选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-(c
1-c6亚烷基)-oh。在一些优选的实施方式中,通式(ii)所示结构化合物可进一步为:
[0098]
环a选自苯基、呋喃基、噻吩基、吡咯基、噻唑基或吡唑基;且环a被r1取代;
[0099]
l为化学键或亚甲基;
[0100]
r1选自氢、卤素、羟基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、三氟甲基或三氟甲基氧基;
[0101]
r3选自6-10元单环或双环的环烷基或杂环基,所述杂环基含有1个任选自n、o、s的杂原子;所述r3任选地被1-3个ra取代;
[0102]
所述ra选自氢、卤素、羟基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)或-(c
1-c6亚烷基)-oh。
[0103]
在一些更优选的实施方式中,通式(ii)所示结构化合物可进一步为:
[0104]
环a选自且环a被r1取代;
[0105]
l为化学键或亚甲基;
[0106]
r1选自氢或三氟甲基;
[0107]
r3选自
[0108]
所述r3任选地被1-3个ra取代,取代位点为c或n;
[0109]
所述ra选自氢、羟基、羧基、-c
1-c6烷基或-(c
1-c6亚烷基)-oh;
[0110]
在一些更优选的实施方式中,通式(ii)所示结构化合物可进一步优选如下:
[0111]
环a选自且环a被r1取代;
[0112]
l为化学键或亚甲基;
[0113]
r1选自氢或三氟甲基;
[0114]
r3选自
[0115]
所述r3任选地被1-2个ra取代,取代位点为c或n;
[0116]
所述ra选自氢、羟基、羧基、-c
1-c3烷基或-(c
1-c3亚烷基)-oh;其他变量如本发明所定义。
[0117]
在一些更为具体的实施方式中,当r3基团中含有杂原子n时,取代位点优选于n位。当r3基团中不含有杂原子或者杂原子为o时,取代位点优选于r3基团与l连接位点的间位或者对位。当r3基团为桥环结构时,取代位点通常为与l连接位点另一端的桥头碳上。
[0118]
在一些更为具体的实施方式中,ra基团可以是氢,此时也可以看成是未取代的。
[0119]
在一些更为具体的实施方式中,ra基团不是氢时,其可以是羟基、羧基、-c
1-c3烷基、-(c
1-c3亚烷基)-oh。在没有特殊说明的情况下,-c
1-c3烷基可以是甲基、乙基、正丙基、
异丙基或环丙基。在没有特殊说明的情况下,-(c
1-c3亚烷基)-oh是亚甲基羟基、亚乙基羟基、
[0120]
作为优选:环a为苯基、吡啶基、四氢吡喃基或吡唑基;
[0121]
l为化学键或亚甲基;
[0122]
r1选自氢、三氟甲基或三氟甲基氧基;
[0123]
r2选自氢、甲基、卤素、羧基或氰基;
[0124]
r3选自单环或双环的环烷基或杂环基、或单环或双环的芳基或杂芳基;所述杂环基、杂芳基含有至少1个选自n、o、s的杂原子;所述r3任选地被1-3个ra取代;
[0125]
所述ra选自甲基、异丙基、羧基或2-羟基异丙基
[0126]
作为优选:环a选自
[0127]
r3选自
[0128]
所述ra选自甲基、异丙基、羧基或2-羟基异丙基。
[0129]
作为优选:r3选自选自
[0130]
在根据本发明的某些实施方式中,本发明提供的化合物包括以下任意一种:
[0131]
[0132]
[0133][0134]
本发明的第二个方面提供了通式(ii)所示结构化合物的制备方法,包括如下制备过程:
[0135][0136]
其中,z为h或i,m为卤素或硼酸基,其他基团的定义与通式(ii)结构所示化合物一致。中间体1先与化合物r
1-a-m反应得到中间体2,再与r
3-l-nh2反应得到通式(ii)所示结构化合物。
[0137]
在一些优选的实施方式中,中间体1中的z原子可以为h。当z为h时,m为卤素,此情况下,中间体1与r
1-a-m发生heck偶联反应,得到中间体2。在另一些优选的实施方式中,中间体1中的z原子可以为i。当z为i时,m为硼酸基,此情况下,中间体1与r
1-a-m发生suzuki偶联反应,得到中间体2。
[0138]
在一些优选的实施方式中,中间体2与r
3-l-nh2发生亲核取代反应得到通式(ii)所示结构化合物。在另一些优选的实施方式中,中间体2与r
3-l-nh2发生buchwald-hartwig偶联反应,得到通式(ii)所示结构化合物。
[0139]
本发明的第三个方面提供了一种药物组合物,所述药物组合物含有根据前述技术方案任意一项所述的化合物、其氘代物、立体异构体或药学上可接受的盐,及其药学上可接受的载体。
[0140]
本发明的第四个方面提供了前述技术方案任意一项所述的化合物、其氘代物、立体异构体或药学上可接受的盐、或前述技术方案任意一项所述的药物组合物在制备治疗和/或预防pim相关的疾病的药物中的用途。
[0141]
在一些优选的实施方式中,所述pim相关的疾病包括自身免疫疾病或肿瘤。
[0142]
在一些更优选的实施方式中,所述pim相关的疾病包括炎症性肠炎、血液瘤或实体瘤;
[0143]
在一些进一步优选的实施方式中,所述血液瘤包括但不限于急性髓系白血病、骨髓纤维化、慢性淋巴细胞性白血病等;所述实体瘤包括但不限于胃癌、前列腺癌等。
[0144]
本发明的第五个方面提供了前述技术方案任意一项所述的化合物、其氘代物、立体异构体或药学上可接受的盐、或前述技术方案任意一项所述的药物组合物作为pim激酶
抑制剂的用途。
[0145]
在一些优选的实施方式中,所述pim激酶抑制剂用于治疗和/或预防pim相关的疾病,例如自身免疫疾病或肿瘤。
[0146]
在一些更优选的实施方式中,所述pim相关的疾病包括炎症性肠炎、血液瘤或实体瘤;
[0147]
在一些进一步优选的实施方式中,所述血液瘤包括但不限于急性髓系白血病、骨髓纤维化、慢性淋巴细胞性白血病等;所述实体瘤包括但不限于胃癌、前列腺癌等。
[0148]
本发明提供的化合物具有良好的pim激酶抑制效果,相比于pim抑制剂tp-3654具有更强的细胞抑制活性、更低的毒副作用,且药效强、药代性质好、生物利用度高,是一种新型的、高活性、低毒性的理想pim抑制剂,可用于治疗和/或预防急性髓系白血病、骨髓纤维化、慢性淋巴细胞性白血病等血液瘤、胃癌、前列腺癌等实体瘤等疾病。
具体实施方式
[0149]
定义
[0150]
本文所使用的数值区间包括端点值以及端点值之间的任意数值。举例而言,“0-3”可包括0、1、2或3,“1-3”可包括1、2或3。
[0151]
本文所使用的“c
1-c
n”包括c
1-c2、c
1-c3、
……c1-cn。举例而言,“c
1-c
6”基团是指该部分中具有1-6个碳原子,即基团包含1个碳原子、2个碳原子、3个碳原子、4个碳原子、5个碳原子或6个碳原子。因此,举例而言,“c
1-c4烷基”是指含有1-4个碳原子的烷基,即所述烷基选自甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。本文中的数字范围,例如“1-6”是指给定范围中的各个整数。
[0152]
本文单独或组合使用的术语“烷基”是指任选取代的直链或任选取代的支链的饱和脂肪族烃类。本文的“烷基”优选可具有1-6个碳原子,例如具有1-5个碳原子,或具有1-4个碳原子,或具有1-3个碳原子。烷基的非限定性示例包括甲基、乙基、正丙基、异丙基、2-甲基-l-丙基、2-甲基-2-丙基、2-甲基-1-丁基、3-甲基-l-丁基、2-甲基-3-丁基、2,2-二甲基-1-丙基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-l-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2,2-二甲基-l-丁基、3,3-二甲基-1-丁基、2-乙基-1-丁基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、己基等。本文定义的基团中,如“烷基”出现数字范围时,例如,“c
1-c6烷基”是指可由1个碳原子、2个碳原子、3个碳原子、4个碳原子、5个碳原子或6个碳原子构成的烷基,本文的烷基也包含未指定数字范围的情况。烷基可以是任选取代的或未取代的。
[0153]
本文组合使用的“烷基”是指与其他基团连接的烷基,例如,烷氧基中的烷基,其定义与单独使用时相同。
[0154]
本文单独或组合使用的术语“亚烷基”是指从直链或支链的饱和脂肪族烃基中去掉两个氢原子所得到的饱和的脂肪族二价烃基基团。本文的“亚烷基”优选可具有1-6个碳原子,例如具有1-5个碳原子,或具有1-4个碳原子,或具有1-3个碳原子。亚烷基的非限定性示例包括-ch
2-(即亚甲基)、-ch
2-ch
2-(即亚乙基)、-ch
2-ch
2-ch
2-、-ch(ch3)ch
2-、-c(ch3)
2-、-ch
2-c(ch3)-ch
2-、-ch
2-ch
2-ch
2-ch
2-、-ch
2-c(ch3)-ch
2-ch
2-、-ch
2-ch
2-ch
2-ch
2-ch
2-、-ch
2-ch
2-ch
2-ch
2-ch
2-ch
2-等。亚烷基可以是任选取代的或未取代的。
[0155]
本文单独或组合使用的术语“杂烷基”是指烷基中的碳原子被一个或多个选自氮、氧、硫的杂原子所替代后得到的基团,其中所述烷基的定义与前文中的“烷基”的定义相同。
[0156]
本文单独或组合使用的术语“烷氧基”表示为“烷基-o
‑”
。烷氧基的非限定性示例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基等。烷氧基可以是任选取代的或未取代的。
[0157]
本文单独或组合使用的术语“环烷基”是指饱和单环、双环、稠环、桥环、螺环等碳环。本文优选为c
3-c
12
环烷基,更优选为c
3-c
10
环烷基,最优选为c
3-c8环烷基。单环环烷基的非限定性示例包括但不限于环丙基、环丁基、环戊基、环己基、环庚基、环辛基等环烷基,其可以是任选取代的或未取代的。
[0158]“环烷基”的定义中,“螺环”是指两个或两个以上环状结构且单环之间彼此共用一个碳原子(称螺原子)的全碳多环基团。本文优选为6至12元,更优选为8至9元。根据环与环之间共用螺原子的数目螺环分为单螺、双螺或多螺环烷基,本文优选为单螺和双螺环烷基,优选为4元/5元、4元/6元、5元/5元或5元/6元螺环烷基。
[0159]“环烷基”的定义中,“稠环”是指含有两个或两个以上环状结构且彼此公用一对碳原子的全碳多环基团。本文优选为6至12元,更优选为8至9元。根据组成环的数目可以分为双环、三环、四环或多环稠环烷基,本文优选为双环或三环,更优选为5元/5元、5元/6元或6元/6元双环烷基。
[0160]“环烷基”的定义中,“桥环”是指含有两个或两个以上环状结构且彼此共用两个不直接相连接碳原子的全碳多环基团。本文优选为6至12元,更优选为8至9元。根据组成环的数目可以分为双环、三环、四环或多环桥环烷基,优选为双环或三环。
[0161]
本文单独或组合使用的术语“杂芳基”是指5至12元(优选5至10元、更优选5至6元)单环、双环或三环体系,其中至少一个环是芳香族的,且至少一个环包含一个或多个选自氮、氧、硫的杂原子,同时,所述杂芳基还有一个或多个附着点与分子其余部分相连。“杂芳基”的非限定性示例包括呋喃基、咪唑基、异噁唑基、噁唑基、吡咯基、吡唑基、吡啶基、嘧啶基、哒嗪基、吡嗪基、噻吩基、噻唑基等;也包括以下的双环,但不限于这些双环:苯并咪唑基、苯并呋喃基、苯并噻吩基、吲哚基、氧代吲哚基、二氢吲哚基、咪唑并吡啶基、吡唑并吡啶基、吡唑并嘧啶基、喹啉基、异喹啉基、喹唑啉基等。杂芳基可以是任选取代的或未取代的。
[0162]
本文单独或组合使用的术语“杂环基”包括脂杂环基和芳杂环基,其中一个或多个成环的原子是杂原子,如氧、氮、硫原子等,包括单环、稠环、桥环和螺环。本文优选3-10元单环、双环或三环的杂环基,其可以包含1、2或3个选自氮、氧和/或硫中的环原子。“杂环基”的非限定性示例包括吗啉基、氧杂环丁烷基、硫代吗啉基、四氢吡喃基、1,1-二氧代-硫代吗啉基、哌啶基、2-氧代-哌啶基、吡咯烷基、2-氧代-吡咯烷基、哌嗪-2-酮、8-氧杂-3-氮杂-双环[3.2.1]辛基、哌嗪基等。杂环基可以是任选取代的或未取代的。
[0163]“杂环基”的定义中,“螺环”是指两个或两个以上环状结构且单环之间彼此共用一个原子的多环基团,环内含有1个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,其中一个或多个环原子选自氮、氧或s(o)n(其中n选自0、1或2)的杂原子,其余环原子为碳。本文优选为6至12元,更优选为8至9元。根据环与环之间共用螺原子的数目将螺环分为单螺杂环基、双螺杂环基或多螺杂环基,优选为单螺杂环基和双螺杂环基,更优选为4元/4元、4元/5元、4元/6元、5元/5元或5元/6元单螺杂环基。
[0164]“杂环基”的定义中,“稠环”是指含有两个或两个以上环状结构且彼此共用一对原子的多环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,同时至少一个环具有完全共轭的π电子的芳香系统,其中一个或多个环原子选自氮、氧或s(o)n(其中n选自0、1或2)的杂原子,其余环原子为碳。本文优选为6至12元,更优选为8至9元。根据组成环的数目可以分为双环、三环、四环或多环稠杂环基,优选为双环或三环,更优选为5元/5元或5元/6元双环稠杂环基。
[0165]“杂环基”的定义中,“桥环”是指含有两个或两个以上环状结构且彼此共用两个不直接相连接的原子的多环基团,一个或多个环可以含有一个或多个双键,但没有一个环具有完全共轭的π电子的芳香系统,其中一个或多个环原子选自氮、氧或s(o)n(其中n选自0、1或2)的杂原子,其余环原子为碳。本文优选为6至12元,更优选为8至9元。根据组成环的数目可以分为双环、三环、四环或多环桥杂环基,优选为双环或三环。
[0166]
本文单独或组合使用的术语“卤素”是指氟、氯、溴或碘。
[0167]
本文单独或组合使用的术语“羟基”是指-oh。
[0168]
本文单独或组合使用的术语“氰基”是指-cn。
[0169]
本文单独或组合使用的术语“甲磺酰基”是指-s(o)
2-ch3。
[0170]
本文所使用的术语“(被)取代的”或“被
……
取代”是指在一个特定的原子上一个或更多的氢被指定的基团(如卤素、烷基等)所替代,如果指定的原子的正常化合价在现有的情况下没有超出,那么取代后结果是一个稳定的化合物。
[0171]
本文所使用的术语“药学上可接受的盐”在所属领域是为本领域技术人员所熟知的。
[0172]
本文所使用的术语“药学上可接受的”是指不影响本发明化合物的生物活性或性质的物质(如载体或稀释剂),并且相对无毒,即该物质可施用于个体而不造成不良的生物反应或以不良方式与组合物中包含的任意组分相互作用。
[0173]
本文所使用的术语“药物组合物”是指任选地混合有至少一种药学上可接受的化学成分的生物活性化合物,所述药学上可接受的化学成分包括但不限于载体、稳定剂、稀释剂、分散剂、悬浮剂、增稠剂和/或赋形剂。
[0174]
本文所使用的术语“载体”是指相对无毒的化学化合物或试剂,其有助于将化合物引入到细胞或组织中。
[0175]
本文所使用的术语“立体异构体”包括但不限于对映异构体、顺反异构体等。
[0176]
本文所使用的术语“对映异构体”是指具有相同分子式的化合物中,由于原子或原子团(基团)在空间配制不同而引起的同分异构现象,互为对映异构体的两个化合物互为镜像且不能重合。本文所使用的术语“顺反异构体”通常是指化合物分子中由于具有自由旋转的限制因素,使各个基团在空间的排列方式不同而出现的非对映异构的立体异构现象。含有此类异构的有机分子如烯烃、偶氮化合物、脂环烃等被视作顺反异构。在本技术中,顺反异构主要以脂环烃形式体现。例如在环己烷中,环己烷被两个取代基取代时会出现顺反异构,两个取代基取代在环的同一侧时为“顺式”异构体,不同侧的为“反式”异构体。
[0177]
本发明化合物可以含有不对称中心或手性中心,因此以不同的立体异构体形式存在。所预期的是,本发明化合物的所有立体异构体形式,包括但不限于非对映异构体、对映异构体、位阻异构体和几何(构象)异构体及它们的混合物,如外消旋体混合物,均在本发明
的范围内。
[0178]
除非另外指出,本发明描述的结构还包括此结构的所有异构体(如,非对映异构体、对映异构体、顺反异构体、位阻异构体、几何(构象)异构体形式),例如,各不对称中心的r和s构型、(z)和(e)双键异构体、脂肪族环烃类顺反异构、联苯类结构的位阻异构体(参见《基础有机化学》(第二版)上册,邢其毅等,p104-105);pac,1996,68,2193.(basic terminology of stereochemistry(iupac recommendations 1996,on page 2201))、(z)和(e)构象异构体。因此本发明化合物的单个立体异构体以及对映体混合物、非对映异构体混合物、位阻异构体和几何(构象)异构体混合物均在本发明范围内。
[0179]
在以下实施例中,所制备的各化合物均具有通式(i)所示结构:
[0180][0181]
其中,环a为5-6元芳基或5-6元杂芳基;所述5-6元杂芳基含有至少1个选自n、o、s的杂原子;
[0182]
x为c或n原子;
[0183]
l为化学键或亚甲基;
[0184]
r1选自氢、卤素、羟基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基或三氟甲基氧基;
[0185]
r2选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基或三氟甲基氧基;
[0186]
r3选自3-10元饱和或不饱和的烃基(包括直链、支链的烷基或杂烷基)、单环或双环的环烷基或杂环烷基、单环或双环的芳基或杂芳基;所述杂烷基、杂环基、杂芳基含有至少1个选自n、o、s的杂原子;所述r3任选地被1-3个ra取代;
[0187]
所述ra选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-(c
1-c6亚烷基)-oh。
[0188]
其中部分化合物也符合通式(ii)所示结构:
[0189][0190]
其中,环a为苯基或5元杂芳基,所述5元杂芳基含有1或2个任选自n、o、s的杂原子;且环a被r1取代;
[0191]
l为化学键或亚甲基;
[0192]
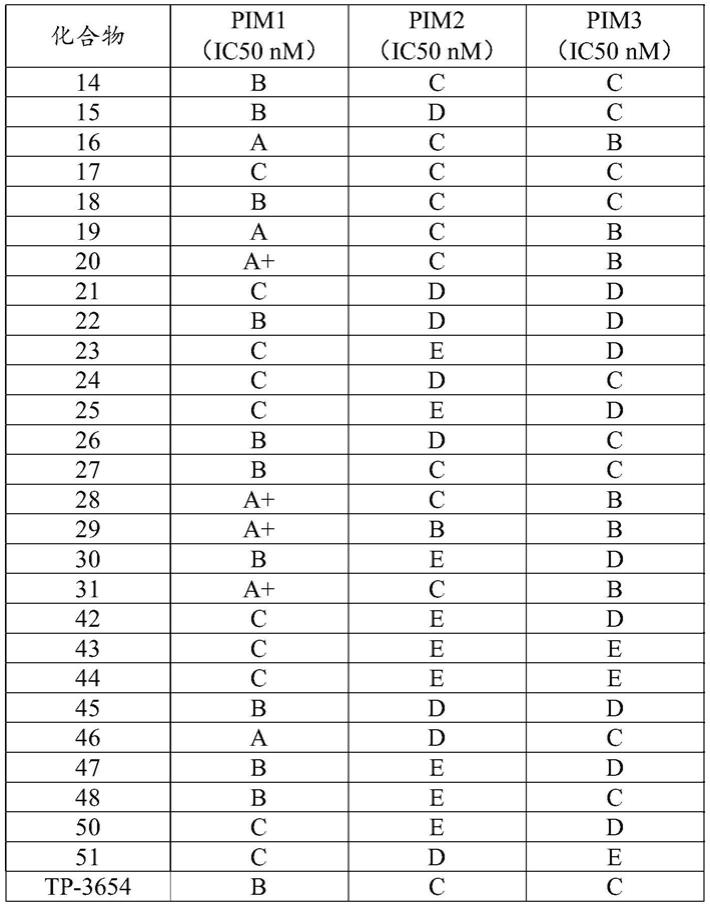
r1选自氢、卤素、羟基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、-n(c
1-c6烷基)2、三氟甲基或三氟甲基氧基;
[0193]
r3选自3-10元单环或双环的环烷基或杂环基,所述杂环基含有1或2个任选自n、o、s的杂原子;所述r3任选地被1-3个ra取代;
[0194]
所述ra选自氢、卤素、羟基、羧基、氰基、-nh2、-c
1-c6烷基、-o(c
1-c6烷基)、-nh(c
1-c6烷基)、三氟甲基、三氟甲基氧基或-(c
1-c6亚烷基)-oh。
[0195]
对于通式(ii)所示结构的化合物,通常情况下可采用以下方法进行合成。
[0196][0197]
其中,z为h或i,m为卤素或硼酸基,其他基团的定义与通式(ii)结构所示化合物一致。中间体1先与化合物r
1-a-m反应得到中间体2,再与r
3-l-nh2反应得到通式ii所示结构化合物。
[0198]
第一步:中间体2的合成。
[0199]
当中间体1的z原子为h时,此时m为卤素。此情况下,中间体1与r
1-a-x发生heck偶联反应,得到中间体2。此时的具体反应条件为:
[0200][0201]
在室温、氮气保护下,向中间体1溶液中依次加入r
1-a-x,然后加入pd催化剂、载体以及碱,在高于室温的条件下反应,用tlc或lcms等方法监测反应直到反应完全,得到中间体2。其中,溶剂、pd催化剂、载体以及碱可以从常见的heck反应体系中选择。在一些具体的实施方式中,溶剂可以选择甲苯、dmf、nmp等。在一些具体的实施方式中,pd催化剂可以是氯化钯、醋酸钯、四三苯基膦钯,在某些特殊条件下还可以使用碘化亚铜等铜催化剂。在一些具体的实施方式中,载体可以选择三苯基膦、binap等。在一些具体的实施方式中,碱可以是三乙胺、碳酸钾、醋酸钠、醋酸钾。其中,反应温度高于室温,也可以选择溶剂的回流温度,或者略低于回流温度,具体地可以是20-120℃中的任意一个温度。
[0202]
当中间体1中的z原子为i,此时m为硼酸基。此情况下,中间体1与r
1-a-m发生suzuki偶联反应,得到中间体2。此时的具体反应条件为:
[0203][0204]
在室温、氮气保护下,向中间体1溶液中依次加入r
1-a-b(oh)2,然后加入pd催化剂、载体以及碱,在高于室温的条件下反应,用tlc或lcms等方法监测反应直到反应完全,得到中间体2。其中,溶剂、pd催化剂、载体以及碱可以从常见的suzuki反应体系中选择。在一些具体的实施方式中,溶剂可以选择甲苯、二氧六环、水或者其组合。在一些具体的实施方式中,pd催化剂可以是氯化钯、pd/c、醋酸钯、四三苯基膦钯、pd2(dba)3,在某些特殊条件下还可以使用镍催化剂。在一些具体的实施方式中,载体可以选择三苯基膦、binap以及pcy3等。在一些具体的实施方式中,碱可以是碳酸钾、碳酸钠、碳酸铯、碳酸锂。其中,反应温度高于室温,也可以选择溶剂的回流温度,或者略低于回流温度,具体地可以是80-110℃中的任意一个温度。
[0205]
第二步:通式(ii)所示结构的化合物的合成。
[0206]
对于部分化合物而言,其适用于亲核取代反应,此时的具体反应条件为:
[0207][0208]
在室温下,向中间体2的二甲基亚砜溶液中依次加入r
3-l-nh2和碱,然后升温反应,用tlc或lcms等方法监测反应直到反应完全,得到通式(ii)所示结构化合物。在一些具体的实施方式中,碱可以选择氟化铯、氟化钾、氟化铯以及n,n-二异丙基乙胺或者其组合,或者选择不加碱。在一些具体的实施方式中,反应温度通常高于室温,具体地可以是100~140℃中的任意值。
[0209]
对于另一部分化合物,则更适合buchwald-hartwig偶联反应,此时的具体反应条件为:
[0210][0211]
在室温、氮气保护下,向中间体2溶液中依次加入r
3-l-nh2,然后加入催化剂、载体以及碱,在高于室温的条件下反应,用tlc或lcms等方法监测反应直到反应完全,得到通式(ii)所示结构化合物。其中,溶剂、pd催化剂、载体以及碱可以从常见的buchwald-hartwig反应体系中选择。在一些具体的实施方式中,溶剂可以选择甲苯、二氧六环、水或者其组合。在一些具体的实施方式中,催化剂可以是醋酸钯、pd2(dba)3。在一些具体的实施方式中,载体可以选择p(t-bu)3、binap、p(o-tolyl)3、xantphos。在某些具体的实施方式中,碱可以是碳酸铯、叔丁醇钾、叔丁醇钠。其中,反应温度高于室温,也可以选择溶剂的回流温度,或者略低于回流温度,具体地可以是80-110℃中的任意一个温度。
[0212]
下面结合具体实施例对本发明做进一步详细的说明,但本发明并不限于以下实施例。
[0213]
实施例使用的部分制备条件如下:
[0214]
制备pre-hplc条件:仪器:gilson-gx281;波长:220nm&254nm;柱型号:waters x-bridge(30
×
100mm,10μm)或luna c18(30
×
75mm,3μm)或luna c18(30
×
75mm,3μm);流动相:a:10mm碳酸氢铵或h2o(0.1%甲酸)或h2o(0.1%三氟乙酸),b:乙腈;运行时间:15min;流速:25ml/min。
[0215]
反向柱纯化使用c18反向硅胶柱(spherical c18,40-60μm,40g-120g),以水/乙腈(95/5~30/70)为流动相。
[0216]
实施例1:6-(((1-甲基哌啶-4-基)甲基)氨基)-3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸(化合物6)
[0217][0218]
(1)3-溴-6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯
[0219]
将6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯(1.0g,3.92mmol)溶于二氯甲烷(15ml)中,加入nbs(1.1g,5.88mmol),该反应体系在室温下搅拌反应过夜。向反应液中加入水,并用二氯甲烷萃取分液。有机相用饱和食盐水(10ml)洗,用无水硫酸钠干燥,减压浓缩,粗产品使用反相柱纯化,得到3-溴-6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯(310mg,收率:24%),黄色固体。ms(esi):m/z 305.8[m h]
。
[0220]
(2)6-氯-3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸乙酯
[0221]
在氮气条件下,将四三苯基膦钯(185mg,0.16mmol)加入到3-溴-6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯(500mg,1.64mmol),(3-(三氟甲氧基)苯基)硼酸(185mg,0.16mmol)和碳酸钾(375mg,4.94mmol)的二氧六环和水的混合溶液(5:1,12ml)中,该反应体系加热到90℃后搅拌过夜,反应体系直接减压浓缩,粗产品使用反相柱纯化,得到6-氯-3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸乙酯(310mg,收率:49%),黄色固体。ms(esi):m/z 385.9[m h]
。
[0222]
(3)6-(((1-甲基哌啶-4-基)甲基)氨基)-3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸
[0223]
将6-氯-3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸乙酯(100mg,0.26mmol)溶于甲苯(5ml)中,然后加入叔丁醇钠(75mg,0.78mmol),binap(23mg,0.05mmol),三(二亚苄基丙酮)二钯(27mg,0.03mmol)和(1-甲基哌啶-4-基)甲胺(66mg,0.52mmol),氮气抽换气,100℃反应过夜。反应液过滤,滤液浓缩干后直接使用反相柱纯化得到粗品,粗品使用prep-hplc纯化得到6-(((1-甲基哌啶-4-基)甲基)氨基)-3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸(8.5mg,收率:7%),白色固体。ms(esi):m/z 450.2[m h]
。1h nmr(400mhz,dmso-d6)δ7.77-7.72(m,3h),7.55(t,j=8.4hz,1h),7.38(d,j=8.4hz,1h),7.28(t,j=5.6hz,1h),6.82(d,j=9.6hz,1h),2.99(t,j=6.0hz,2h),2.87-2.81(m,2h),2.23(s,3h),2.00(t,j=11.6hz,2h),1.65-1.58(m,3h),1.24-1.18(m,2h)。
[0224]
实施例2:n-((1-甲基哌啶-4-基)甲基)-3-(吡啶-3-基)咪唑[1,2-a]吡啶-6-胺(化合物7)
[0225][0226]
(1)6-氯-3-(吡啶-3-基)咪唑并[1,2-a]吡啶
[0227]
参照实施例1步骤(2)的方法,使用3-溴-6-氯咪唑并[1,2-a]吡啶(200mg,
羧酸(122mg,0.28mmol)溶于甲醇(5ml)中,加入37%甲醛溶液(113.5mg,1.4mmol),氰基硼氢化钠(35.2mg,0.56mmol)。反应室温搅拌过夜。反应液过滤旋干,残余物通过pre-hplc纯化得到1-甲基-4-(((3-(3-(三氟甲氧基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)甲基)哌啶-4-羧酸(35.8mg,收率:29%),白色固体。ms(esi):m/z 450.3[m h]
。1h nmr(400mhz,dmso-d6)δ8.45(s,1h),8.19(s,1h),8.10(d,j=8.4hz,1h),8.01(s,1h),7.77(d,j=10.0hz,1h),7.56(t,j=8.0hz 1h),7.29(d,j=8.0hz,1h),7.02(s,1h),6.87(d,j=9.6hz,1h),3.52(s,2h),2.69(d,j=10.8hz,2h),2.19(s,3h),2.16-2.09(m,4h),1.56(t,j=10.4hz,2h)。
[0240]
实施例4:n-(1-异丙基-1h-吡唑-3-基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-胺(化合物10)
[0241][0242]
(1)1-异丙基-3-硝基-1h-吡唑
[0243]
将3-硝基-1h-吡唑(1050mg,9.2mmol),nah(446mg,11.1mmol)溶于dmf(5ml)中,反应体系在0℃下搅拌0.5小时,向反应体系中加入2-溴丙烷(1250mg,10.2mmol),反应体系在室温下搅拌反应过夜,加入少量水淬灭,混合液使用乙酸乙酯分液萃取,有机相依次使用饱和食盐水洗涤,无水硫酸钠干燥,过滤,减压浓缩,经反相柱纯化得到1-异丙基-3-硝基-1h-吡唑[2,3-b]吡啶(320mg,收率:23%),无色油状物。ms(esi):m/z 156.1[m h]
。
[0244]
(2)1-异丙基-1h-吡唑-3-胺
[0245]
将1-异丙基-3-硝基-1h-吡唑(200mg,1.2mmol),pd/c(100mg),加入甲醇(4ml)溶液中。在氢气保护下升温至40℃,搅拌反应过夜。将反应液过滤旋干得到1-异丙基-1h-吡唑-3-胺(120mg,收率:74%),无色油状物。ms(esi):m/z 126.1[m h]
。
[0246]
(3)6-氯-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪
[0247]
参照实施例1步骤(2)的方法,使用3-溴-6-氯咪唑并[1,2-b]哒嗪(300mg,1.2mmol),(3-(三氟甲基)苯基)硼酸(246mg,1.2mmol)为原料,得到(6-氯-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪(120mg,收率:31%),黄色固体。ms(esi):m/z 298.3[m h]
。
[0248]
(4)n-(1-异丙基-1h-吡唑-3-基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-胺
[0249]
参照实施例1步骤(3)的方法,使用6-氯-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪(120mg,0.4mmol)1-异丙基-1h-吡唑-3-胺(50mg,0.4mmol)为原料,得到n-(1-异丙基-1h-吡唑-3-基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-胺(15.8mg,收率:10%),白色固体。ms(esi):m/z 387.2[m h]
。1h nmr(400mhz,dmso-d6)10.01(s,1h),8.58(s,1h),8.32-8.29(m,1h),8.04(s,1h),7.93(d,j=9.6hz,1h),7.75-7.70(m,2h),7.62(s,1h),7.03(d,j=9.6hz,1h),6.54(s,1h),4.48-4.38(m,1h),1.42-1.40(m,6h)。
[0250]
实施例5:2-((1r,4r)-4-((2-甲基-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙醇(化合物11)
[0251][0252]
(1)3-溴-6-氯-2-甲基咪唑并[1,2-b]哒嗪
[0253]
将6-氯-2-甲基咪唑并[1,2-b]哒嗪(300mg,1.8mmol),nbs(350mg,1.9mmol)溶于二氯甲烷(5ml)中,反应体系在室温过夜,反应液减压浓缩,经硅胶柱(pe:ea=3:1)纯化得到3-溴-6-氯-2-甲基咪唑并[1,2-b]哒嗪(440mg,收率:100%),白色固体。ms(esi):m/z 245.7[m h]
。
[0254]
(2)6-氯-2-甲基-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪
[0255]
参照实施例1步骤(2)的方法,使用3-溴-6-氯-2-甲基咪唑并[1,2-b]哒嗪(450mg,1.8mmol),3-(三氟甲基)苯基)硼酸(279mg,1.5mmol)为原料,得到6-氯-2-甲基-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪(110mg,收率:19%),白色固体。ms(esi):m/z 311.9[m h]
。
[0256]
(3)2-((1r,4r)-4-((2-甲基-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙醇
[0257]
参照实施例1步骤(3)的方法,使用6-氯-2-甲基-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪(40mg,0.1mmol),2-((1r,4r)-4-氨基环己基)丙醇(40mg,0.3mmol)为原料,得到2-((1r,4r)-4-((2-甲基-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙醇(23.8mg,收率:43%),白色固体。ms(esi):m/z 433.4[m h]
。1h nmr(400mhz,dmso-d6)δ8.35(s,1h),7.93(d,j=7.5hz,1h),7.75
–
7.61(m,3h),6.83(d,j=7.3hz,1h),6.65(d,j=9.6hz,1h),4.02(s,1h),3.54
–
3.37(m,1h),2.45(s,3h),2.09(d,j=10.1hz,2h),1.81(d,j=12.0hz,2h),1.27
–
0.95(m,11h)。
[0258]
实施例6:2-[(1r,4r)-4-[[3-(2-噻吩基)咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇(化合物14)
[0259][0260]
(1)6-氯-3-(2-噻吩基)咪唑并[1,2-b]哒嗪
[0261]
参照实施例1步骤(2)的方法,使用6-氯-3-碘-咪唑并[1,2-b]哒嗪(0.05g,178.9μmol),2-噻吩硼酸(27.47mg,214.7μmol)为原料,平行6批反应,得到6-氯-3-(2-噻吩基)咪唑并[1,2-b]哒嗪(0.2g,收率:79.05%),黄色固体。1h nmr(400mhz,cdcl3)δ7.71-7.64(m,2h),7.61-7.52(m,2h),7.50-7.43(m,2h)。
[0262]
(2)2-[4-[[3-(2-噻吩基)咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇
[0263]
在20℃下,向6-氯-3-(2-噻吩基)咪唑并[1,2-b]哒嗪(0.005g,21.21μmol)的二甲
基亚砜(0.05ml)溶剂中依次加入2-((1r,4r)-4-氨基环己基)丙-2-醇(6.67mg,42.43μmol),氟化铯(6.44mg,42.43μmol)和n,n-二异丙基乙胺(5.48mg,42.43μmol,7.39μl)。加料完毕后,将反应体系升温至100℃,搅拌12小时。lcms显示原料反应完全并有产品生成。反应液经prep-hplc分离纯化,得到2-[(1r,4r)-4-[[3-(2-噻吩基)咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇(0.002g,收率:26.45%),黄色固体。ms(esi):m/z 357.1[m h]
。1h nmr(400mhz,cdcl3)δ7.78(brs,1h),7.59(dd,j=1.1,3.7hz,2h),7.30(d,j=5.3hz,1h),7.08(dd,j=3.7,5.1hz,1h),6.33(d,j=9.0hz,1h),4.17(brs,1h),3.82-3.67(m,1h),2.36(d,j=11.0hz,2h),1.92(d,j=9.4hz,2h),1.37-1.18(m,5h),1.18(s,6h)。
[0264]
实施例7:n-(7-氮杂螺[3.5]壬烷-2-基)-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-胺(化合物16)
[0265][0266]
(1)2-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯
[0267]
在20℃下,将2-氨基-7-boc-7-氮杂螺环[3.5]壬烷(0.66g,2.75mmol)和6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(0.6g,2.02mmol)溶于二甲基亚砜(3ml)中,然后向反应液中加入氟化钾(468.42mg,8.06mmol)。加料完毕,将反应液升温至140℃并在该温度下搅拌12小时。tlc显示原料消耗完全。将反应液冷却至室温,然后将反应液倒入水中,用乙酸乙酯进行萃取。将合并后的有机相浓缩至干,得到粗品。将所得粗品经柱层析纯化得到2-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯(0.68g,收率:65.24%),黄色固体。
[0268]
(2)n-(7-氮杂螺[3.5]壬烷-2-基)-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-胺
[0269]
在25℃下,将2-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯(0.68g,1.36mmol)溶于二氯甲烷(3ml)中,向溶液中加入盐酸二氧六环(4m,5ml),加料完毕后在25℃下搅拌0.5小时。lcms显示原料消耗完全。用氨水将反应液ph调至~8,然后浓缩至干,得到粗品。将所得粗品经prep-hplc纯化得到n-(7-氮杂螺[3.5]壬烷-2-基)-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-胺(0.5g,收率:91.87%),白色固体。ms(esi):m/z 402.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.94(s,1h),8.28(d,j=6.7hz,1h),8.07(s,1h),7.79(d,j=9.7hz,1h),7.71-7.63(m,2h),7.44(d,j=6.1hz,1h),6.72(d,j=9.7hz,1h),4.25-4.13(m,1h),2.69-2.62(m,2h),2.60-2.55(m,2h),2.38-2.30(m,2h),1.72-1.61(m,2h),1.56-1.49(m,2h),1.48-1.41(m,2h)。
[0270]
实施例8:n-(6-氮杂螺[3.4]辛烷-2-基甲基)-3-(3-(三氟甲基)苯基)咪唑[1,2-b]哒嗪-6-胺(化合物18)
[0271][0272]
(1)2-[[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]甲基]-6-氮杂螺[3.4]辛烷-6-羧酸叔丁酯
[0273]
参照实施例7步骤(1)的方法,以6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(50mg,167.98μmol),2-(氨基甲基)-6-氮杂螺[3.4]辛烷-6-羧酸叔丁酯(52.48mg,218.37μmol)为原料,得到2-[[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]甲基]-6-氮杂螺[3.4]辛烷-6-羧酸叔丁酯(45mg,粗品),黄色油状物。
[0274]
(2)n-(6-氮杂螺[3.4]辛烷-2-基甲基)-3-(3-(三氟甲基)苯基)咪唑[1,2-b]哒嗪-6-胺
[0275]
参照实施例7步骤(2)的方法,以2-[[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]甲基]-6-氮杂螺[3.4]辛烷-6-羧酸叔丁酯(45mg,89.72μmol)为原料,得到n-(6-氮杂螺[3.4]辛烷-2-基甲基)-3-(3-(三氟甲基)苯基)咪唑[1,2-b]哒嗪-6-胺(9.4mg,收率:26.10%),黄色固体。ms(esi):m/z 402.0[m h]
。1h nmr(400mhz,dmso-d6)δ8.97(s,1h),8.32(d,j=7.39hz,1h),8.09(s,1h),7.79(d,j=9.66hz,1h),7.62-7.72(m,2h),7.25(t,j=5.13hz,1h),6.76(d,j=9.66hz,1h),3.14-3.24(m,4h),2.85-3.00(m,3h),2.56-2.53(m,1h),2.00-2.18(m,2h),1.70-1.90(m,4h)。
[0276]
实施例9:n-(氮杂环庚烷-4-基)-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-胺(化合物19)
[0277][0278]
(1)4-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]氮杂环庚烷-1-羧酸叔丁酯
[0279]
参照实施例7步骤(1)的方法,以6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(50mg,167.98μmol),氮杂环庚烷-1-羧酸叔丁酯(720.0mg,3.36mmol)为原料,得到4-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]氮杂环庚烷-1-羧酸叔丁酯(0.4g,收率:50.08%),黄色固体。
[0280]
(2)n-(氮杂环庚烷-4-基)-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-胺
[0281]
参照实施例7步骤(2)的方法,4-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]氮杂环庚烷-1-羧酸叔丁酯(0.4g,105.15μmol)为原料,得到n-(氮杂环庚烷-4-基)-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-胺(0.22g,收率:69.67%),黄色固体。ms(esi):m/z 376.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.73(s,1h),8.40(d,j=7.2hz,1h),8.08-8.04(m,1h),7.82-7.75(m,1h),7.72-7.63(m,2h),7.14-7.03(m,1h),6.76(d,j=
9.7hz,1h),3.93(td,j=3.8,7.8hz,1h),2.91-2.76(m,3h),2.73-2.64(m,1h),2.53(br s,1h),2.11-1.94(m,2h),1.79-1.67(m,2h),1.63(dt,j=4.6,9.1hz,1h),1.60-1.49(m,1h)。
[0282]
实施例10:2-((1r,4r)-4-((3-(5-(三氟甲基)噻吩-2-基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙-2-醇(化合物20)
[0283][0284]
(1)6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪
[0285]
在20℃下,向6-氯咪唑并[1,2-b]哒嗪(1g,6.51mmol)的甲苯(10ml)溶液中依次加入2-溴-5-(三氟甲基)噻吩(1.81g,7.81mmol),碳酸钾(1.80g,13.02mmol)和三苯基膦(341.59mg,1.30mmol),然后将体系用氮气置换3次。置换完氮气之后,在氮气保护下向反应体系中加入醋酸钯(146.19mg,651.17μmol)。加料完毕,将反应液升温至120℃并在120℃下搅拌12小时。tlc显示反应完全,lcms显示有产品生成。将反应液降至室温之后倒入水中,然后用乙酸乙酯进行萃取。将合并后的有机相用无水硫酸钠干燥后过滤,将滤液浓缩至干,得到6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(1.8g,粗品),黄色固体。
[0286]
(2)2-((1r,4r)-4-((3-(5-(三氟甲基)噻吩-2-基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙-2-醇
[0287]
在20℃下,向6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(0.5g,1.65mmol)的二甲基亚砜(5ml)溶液中依次加入2-((1r,4r)-4-氨基环己基)丙-2-醇(310.68mg,1.98mmol),氟化铯(500.18mg,3.29mmol)和n,n-二异丙基乙胺(425.56mg,3.29mmol)。加料完毕,将体系升温至100℃并在100℃下搅拌12小时。tlc显示反应完全,lcms显示有产品生成。将反应液冷却至室温后倒入水中,然后用乙酸乙酯进行萃取。将有机相用饱和食盐水洗涤,用无水硫酸钠干燥后过滤,然后将滤液浓缩至干,得到粗品。将所得粗品通过prep-hplc进行纯化,得到2-((1r,4r)-4-((3-(5-(三氟甲基)噻吩-2-基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙-2-醇(0.18g,收率:25.76%),白色固体。ms(esi):m/z 425.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.14(s,1h),7.92-7.70(m,3h),7.28(d,j=6.8hz,1h),6.73(d,j=9.7hz,1h),4.09(s,1h),3.67(brs,1h),2.27(brs,2h),1.94(brs,2h),1.30(d,j=9.0hz,1h),1.25-1.14(m,4h),1.07(s,6h)。
[0288]
实施例11:(1s,3r)-3-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]环庚醇(化合物21)
[0289][0290]
在25℃下,向8ml反应瓶中将6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪
基]氨基]-6-氮杂螺[3.4]辛烷-6-羧酸叔丁酯(60mg,123.07μmol)为原料,得到n-(6-氮杂螺[3.4]辛烷-2-基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-胺(5.1mg,收率:10.70%),黄色固体。ms(esi):m/z 388.2[m h]
。1h nmr(400mhz,dmso-d6)δ8.88(s,1h),8.32-8.39(m,1h),8.08-8.12(m,1h),7.79-7.86(m,1h),7.65-7.74(m,2h),7.53(d,j=5.99hz,1h),6.73(d,j=9.78hz,1h),4.13-4.24(m,1h),3.49-3.59(m,1h),3.12(s,2h),3.06(t,j=7.15hz,2h),2.56(d,j=3.18hz,2h),2.00-2.08(m,2h),1.92(t,j=7.34hz,2h)。
[0300]
实施例14:[(2r,5s)-5-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(化合物25)
[0301][0302]
(1)(2s)-2-(叔丁氧基羰基氨基)己-5-烯酸甲酯
[0303]
将活化后的锌粉(44.70g,683.6mmol)和n,n-二甲基甲酰胺(200ml)加入到反应瓶1中,随后将反应体系冷却到0℃,滴加(2r)-2-(叔丁氧基羰基氨基)-3-碘丙酸甲酯(45g,136.72mmol)的n,n-二甲基甲酰胺(50ml)溶液,反应体系升温至20℃后搅拌一小时,静置并吸取上清液备用。在反应瓶2中将3-溴丙烯(28.12g,232.4mmol)在20℃下加入含有溴化亚铜(35.30g,246.1mmol)的n,n-二甲基甲酰胺(200ml)中,随后冷却到-15℃,滴加反应瓶1中的反应上清液,随后升至20℃后搅拌12小时。tlc(石油醚/乙酸乙酯=3/1)显示原料反应完全并有新点形成,即形成产物。向反应体系中加入500ml的乙酸乙酯继续搅拌15分钟,随后加入500ml的水分液,有机相依次用1m的硫代硫酸钠溶液(300ml),水(300ml)洗涤,再加无水硫酸钠干燥,过滤,浓缩完全,得到粗品。粗品通过柱层析法进行纯化(石油醚/乙酸乙酯=100/1到100%乙酸乙酯)得到(2s)-2-(叔丁氧基羰基氨基)己-5-烯酸甲酯(20g,收率:60.12%),无色油状物。
[0304]
(2)n-[(1s)-1-(羟甲基)戊-4-烯基]氨基甲酸叔丁酯
[0305]
在20℃、氮气保护下,向四氢呋喃(100ml)中分批次加入硼氢化锂(1.79g,82.20mmol),再缓慢滴加(2s)-2-(叔丁氧基羰基氨基)己-5-烯酸甲酯(20g,82.20mmol)的四氢呋喃(60ml)溶液,随后反应在20℃下搅拌12小时。tlc(石油醚/乙酸乙酯=5/1)显示原料反应完全并有新点形成,即形成产物。反应液加入500ml的水中淬灭,再用乙酸乙酯(300ml
×
2)进行萃取,有机相用500ml饱和食盐水洗,无水硫酸钠干燥,减压浓缩除去溶剂得到n-[(1s)-1-(羟甲基)戊-4-烯基]氨基甲酸叔丁酯(12g,收率:67.81%),无色油状物,并将所得粗品直接用于下一步。1h nmr(400mhz,cdcl3)δ5.74(tdd,j=6.6,10.3,17.0hz,1h),5.01-4.88(m,2h),4.59(brs,1h),3.68-3.55(m,2h),3.55-3.41(m,1h),2.11-2.01(m,2h),1.61-1.41(m,3h),1.38(s,9h)。
[0306]
(3)n-[(1s)-1-(羟甲基)-3-(环氧乙烷-2-基)丙基]氨基甲酸叔丁酯
[0307]
在20℃下,将n-[(1s)-1-(羟甲基)戊-4-烯基]氨基甲酸叔丁酯(10g,46.45mmol)
的二氯甲烷溶液(150ml)和磷酸二氢钾(18.96g,139.35mmol)的水溶液(200ml)混合在一起,随后在20℃下加入间氯过氧苯甲酸(8.02g,46.45mmol),搅拌12小时。tlc(石油醚/乙酸乙酯=1/1)显示原料反应完全并有新点形成,即形成产物。将反应液分液得到有机相,水相再用二氯甲烷(100ml
×
2)萃取,有机相合并后,减压浓缩除去溶剂,得到粗产品。粗品通过柱层析法纯化(石油醚/乙酸乙酯=100/1到100%乙酸乙酯),得到n-[(1s)-1-(羟甲基)-3-(环氧乙烷-2-基)丙基]氨基甲酸叔丁酯(4g,收率:37.23%),黄色油状物。
[0308]
(4)n-[(3s,6r)-6-(羟甲基)四氢吡喃-3-基]氨基甲酸叔丁酯
[0309]
在20℃下,将樟脑-10-磺酸(97.40mg,389.1μmol)加入到n-[(1s)-1-(羟甲基)-3-(环氧乙烷-2-基)丙基]氨基甲酸叔丁酯(0.9g,3.89mmol)的二氯甲烷(9ml)溶液中,随后在20℃下搅拌12小时。tlc(石油醚/乙酸乙酯=0/1)显示原料反应完全并有新点形成,即形成产物。将反应液浓缩除去溶剂,得到粗品,随后粗品通过柱层析法纯化(石油醚/乙酸乙酯=100/1到100%乙酸乙酯),得到n-[(3s,6r)-6-(羟甲基)四氢吡喃-3-基]氨基甲酸叔丁酯(0.28g,收率:31.11%),白色固体。1h nmr(400mhz,cdcl3)δ4.22(brs,1h),4.06-4.02(m,1h),3.58-3.50(m,2h),3.47-3.42(m,1h),3.48-3.42(m,1h),3.33-3.25(m,1h),2.95(t,j=10.6hz,1h),2.04(d,j=12.3hz,1h),1.88(d,j=12.7hz,1h),1.38(d,j=5.4hz,10h),1.29-1.21(m,1h)。
[0310]
(5)[(2r,5s)-5-氨基四氢吡喃-2-基]甲醇盐酸盐
[0311]
在20℃下,将n-[(3s,6r)-6-(羟甲基)四氢吡喃-3-基]氨基甲酸叔丁酯(0.3g,1.30mmol)加入到盐酸二氧六环(3ml)中,随后在20℃下搅拌2小时。tlc(石油醚/乙酸乙酯=0/1)显示原料反应完全并有新点形成,即形成产物。反应液减压浓缩除去溶剂得到[(2r,5s)-5-氨基四氢吡喃-2-基]甲醇盐酸盐(0.2g,收率:91.98%),白色固体,并将所得粗品直接用于下一步。
[0312]
(6)[(2r,5s)-5-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇
[0313]
参照实施例7步骤(1)的方法,以[(2r,5s)-5-氨基四氢吡喃-2-基]甲醇盐酸盐(0.10g,760μmol),6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(250mg,840.0μmol)为原料,得到[(2r,5s)-5-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(0.0054g,收率:2.84%),白色固体。ms(esi):m/z 393.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.89(s,1h),8.37(d,j=7.5hz,1h),8.14(s,1h),7.87(d,j=9.9hz,1h),7.81-7.67(m,2h),7.34(d,j=6.6hz,1h),7.03(d,j=9.8hz,1h),4.68(t,j=5.4hz,1h),4.12(d,j=11.1hz,1h),3.90(brs,1h),3.69(d,j=10.6hz,1h),3.57-3.49(m,3h),2.18(d,j=13.7hz,1h),1.94-1.77(m,1h),1.73-1.52(m,2h)。
[0314]
实施例15:n-(7-甲基-7-氮杂螺[3.5]壬烷-2-基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-胺(化合物26)
390.1[m h]
。1h nmr(400mhz,cdcl3)δ8.55(s,1h),8.07(t,j=3.8hz,1h),7.78(s,1h),7.59(d,j=9.5hz,1h),7.48(d,j=4.9hz,2h),6.41(d,j=9.6hz,1h),4.87(d,j=8.0hz,1h),4.17(tq,j=4.1,7.9hz,1h),2.76-2.58(m,2h),2.51-2.41(m,2h),2.33(s,3h),2.10-1.99(m,1h),1.92-1.82(m,3h),1.78-1.57(m,2h)。
[0324]
实施例17:n-(氮杂环庚烷-4-基)-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-胺(化合物28)
[0325][0326]
(1)4-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]氮杂环庚烷-1-羧酸叔丁酯
[0327]
参照实施例10步骤(2)的方法,以6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(0.22g,724.42μmol),4-氨基氮杂环庚烷-1-羧酸叔丁酯(186.30mg,869.31μmol)为原料,得到4-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]氮杂环庚烷-1-羧酸叔丁酯(0.26g,收率:74.53%),黄色固体。
[0328]
(2)n-(氮杂环庚烷-4-基)-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-胺
[0329]
参照实施例7步骤(2)的方法,以4-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]氮杂环庚烷-1-羧酸叔丁酯(0.25g,519.17μmol)为原料,得到n-(氮杂环庚烷-4-基)-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-胺(0.12g,收率:60.60%),黄色固体。ms(esi):m/z 382.0[m h]
。1h nmr(400mhz,cd3od)δ7.98(s,1h),7.70-7.65(m,2h),7.58(dd,j=1.1,4.0hz,1h),6.77(d,j=9.8hz,1h),4.17-4.06(m,1h),3.21-3.11(m,1h),3.09-2.92(m,3h),2.43-2.26(m,2h),2.00-1.70(m,4h)。
[0330]
实施例18:4-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]双环[2.2.2]辛烷-1-醇(化合物29)
[0331][0332]
参照实施例10步骤(2)的方法,以6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(0.03g,98.78μmol),4-氨基双环[2.2.2]辛-1-醇盐酸盐(21.06mg,118.54μmol)为原料,得到4-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]双环[2.2.2]辛烷-1-醇(10mg,收率:24.79%),黄色固体。ms(esi):m/z 409.0[m h]
。1h nmr(400mhz,dmso-d6)δ8.13(s,1h),7.81-7.69(m,3h),6.89(s,1h),6.76(d,j=9.8hz,1h),4.38(s,1h),2.25-2.17(m,6h),1.76-1.66(m,6h)。
[0333]
实施例19:n-(7-环丙基-7-氮杂螺[3.5]壬烷-2-基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-胺(化合物30)
[0334][0335]
在25℃下,向1-乙氧基-1-三甲硅氧基环丙烷(156.32mg,896.80μmol,180.30μl)的甲醇(4ml)溶液中加入n-(7-氮杂螺[3.5]壬-2-基)-3-(3-(三氟甲基)苯基)咪唑[1,2-b]哒嗪-6-胺(60mg,149.47μmol),氰基硼氢化钠(56.36mg,896.80μmol)和醋酸(53.85mg,896.80μmol,51.29μl),加料完毕后将反应液升温至60℃并在60℃下搅拌12小时。lcms显示原料消耗完全,反应液未经处理直接经prep-hplc纯化,得到n-(7-氮杂螺[3.5]壬-2-基)-3-(3-(三氟甲基)苯基)咪唑[1,2-b]哒嗪-6-胺(27mg,收率:46.28%),白色固体。ms(esi):m/z 442.3[m h]
。1h nmr(400mhz,cdcl3)δ8.70(s,1h),8.00(d,j=6.8hz,1h),7.81(s,1h),7.62(d,j=9.6hz,1h),7.55-7.44(m,2h),6.39(d,j=9.6hz,1h),4.46(d,j=6.0hz,1h),4.32-4.20(m,1h),2.65-2.34(m,6h),1.72-1.54(m,7h),0.38(brs,4h)。
[0336]
实施例20:n-(7-氮杂螺[3.5]壬烷-2-基)-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-胺(化合物31)
[0337][0338]
(1)2-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯
[0339]
参照实施例10步骤(2)的方法,以6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(220mg,724.42μmol),2-氨基-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯(208.93mg,869.31μmol)为原料,得到2-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯(0.2g,收率:54.39%),黄色固体。
[0340]
(2)n-(7-氮杂螺[3.5]壬烷-2-基)-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-胺
[0341]
参照实施例7步骤(2)的方法,以2-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]-7-氮杂螺[3.5]壬烷-7-羧酸叔丁酯(0.2g,394.03μmol)为原料,得到n-(7-氮杂螺[3.5]壬烷-2-基)-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-胺(0.134g,收率:83.46%),白色固体。ms(esi):m/z 408.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.16(s,1h),7.88-7.72(m,4h),6.76(d,j=9.7hz,1h),4.38-4.27(m,1h),3.04(brs,2h),2.97-2.90(m,2h),2.55(brs,2h),1.87-1.69(m,6h)。
[0342]
实施例21:6-(((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸(化合物42)
[0343][0344]
(1)3-溴-6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯
[0345]
将6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯(2g,8.8mmol),nbs(1.9g,10.6mmol)溶于二氯甲烷(20ml)中,反应体系在40℃下搅拌48小时,加入少量水,混合液使用乙酸乙酯(40ml x 2)分液萃取,无水硫酸钠干燥,过滤,减压浓缩,经反相柱纯化得到3-溴-6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯(2.3g,收率:88%),白色固体。ms(esi):m/z 304.3[m h]
。
[0346]
(2)参照实施例1步骤(2)的方法,以3-溴-6-氯咪唑并[1,2-b]哒嗪-2-羧酸乙酯(300mg,0.9mmol),(3-(三氟甲基)苯基)硼酸(131mg,0.6mmol)为原料,得到6-氯-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸乙酯(60mg,收率:16%),黄色固体。
[0347]
(3)参照实施例1步骤(3)的方法,以6-氯-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸乙酯(60mg,0.4mmol)和2-((1r,4r)-4-氨基环己基)丙醇(50mg,0.4mmol)为原料,得到6-(((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-羧酸(15.8mg,收率:10%),白色固体。ms(esi):m/z 463.3[m h]
。1h nmr(400mhz,dmso-d6)δ8.14(s,1h),8.01(d,j=6.8hz,1h),7.76(d,j=7.6hz,2h),7.67(t,j=8.0hz,1h),7.09(d,j=7.2hz,1h),6.78(d,j=9.2hz,1h),4.01(s,1h),2.03(d,j=9.8hz,2h),1.78(d,j=11.6hz,2h),1.23-0.90(m,11h)。
[0348]
实施例22:(1r,3r)-3-((3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环庚醇(化合物44)
[0349][0350]
参照实施例10步骤(2)的方法,以(1r,3r)-3-氨基环庚醇盐酸盐(35mg,211.28μmol),6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(62.89mg,211.28μmol)为原料,得到(1r,3r)-3-((3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环庚醇(8.1mg,收率:9.82%),黄色固体。ms(esi):m/z 391.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.74(s,1h),8.43(d,j=7.46hz,1h),8.06(s,1h),7.77(d,j=9.66hz,1h),7.63-7.73(m,2h),7.07(d,j=7.34hz,1h),6.76(d,j=9.66hz,1h),4.41(d,j=3.79hz,1h),4.01-4.09(m,1h),3.86(dd,j=8.68,3.67hz,1h),2.02-2.12(m,2h),1.82-1.96(m,2h),1.65-1.79(m,2h),1.30-1.56(m,4h)。
[0351]
实施例23:(1r,4r)-4-((3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)
环庚醇(化合物45)
[0352][0353]
参照实施例7步骤(1)的方法,以(1r,4r)-4-氨基环庚醇盐酸盐(28.90mg,174.45μmol)和6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(41.29mg,174.45μmol)为原料,得到4-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]环庚醇(11mg,收率:16.15%),白色固体。ms(esi):m/z 391.2[m h]
。1h nmr(400mhz,cd3od)δ8.60(s,1h),8.38-8.29(m,2h),7.93(d,j=9.9hz,1h),7.87-7.74(m,2h),7.19(d,j=9.8hz,1h),4.03-3.97(m,1h),3.92-3.78(m,1h),2.21-2.06(m,2h),2.05-1.93(m,2h),1.73-1.49(m,6h)。
[0354]
实施例24:[(2s,5r)-5-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(化合物46)
[0355][0356]
参照实施例7步骤(1)的方法,以[(2s,5r)-5-氨基四氢吡喃-2-基]甲醇盐酸盐(实施例28,30.00mg,228.71μmol)和6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(76.40mg,251.58μmol)为原料,得到[(2s,5r)-5-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(0.005g,收率:5.49%),白色固体。ms(esi):m/z 399.0[m h]
。1h nmr(400mhz,dmso-d6)δ8.16(s,1h),7.84(d,j=9.7hz,1h),7.81-7.75(m,2h),7.26(d,j=6.9hz,1h),6.74(d,j=9.8hz,1h),4.72-4.61(m,1h),4.17(d,j=8.5hz,1h),3.92(s,1h),3.46-3.39(m,1h),3.30-3.23(m,2h),3.17(t,j=10.6hz,1h),1.82(d,j=11.3hz,1h),1.53-1.31(m,2h),1.15(s,1h)。
[0357]
实施例25:[(2r,5s)-5-[[3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(化合物47)
[0358][0359]
参照实施例7步骤(1)的方法,以[(2r,5s)-5-氨基四氢吡喃-2-基]甲醇盐酸盐(实施例14,30.00mg,228.71μmol)和6-氯-3-[5-(三氟甲基)-2-噻吩基]咪唑并[1,2-b]哒嗪(76.40mg,251.58μmol)为原料,得到黄色固体[(2r,5s)-5-[[3-[5-(三氟甲基)-2-噻吩基]
碘-咪唑并[1,2-b]哒嗪(0.35g,1.25mmol),三丁基(噻唑-2-基)锡烷(468.61mg,1.25mmol)的n,n二甲基甲酰胺(3.5ml)溶液中。加料完毕后将反应液在110℃搅拌6小时。lcms显示原料已消耗完,有产品生成。将反应液倒入10ml水溶液中,加乙酸乙酯萃取,合并有机相并用饱和食盐水洗涤,将有机相经无水硫酸钠干燥,过滤,减压浓缩得到2-(6-氯咪唑并[1,2-b]哒嗪-3-基)噻唑(0.22g,粗品),白色固体。
[0370]
(2)2-[4-[(3-噻唑-2-基咪唑[1,2-b]哒嗪-6-基)氨基]环己基]丙-2-醇
[0371]
参照实施例7步骤(1)的方法,以2-((1r,4r)-4-氨基环己基)丙-2-醇(132.88mg,845.02μmol),2-(6-氯咪唑并[1,2-b]哒嗪-3-基)噻唑(200mg,845.02μmol)为原料,得到2-[(1r,4r)-4-[(3-噻唑-2-基咪唑[1,2-b]哒嗪-6-基)氨基]环己基]丙-2-醇(7.5mg,收率:2.48%),淡黄色固体。ms(esi):m/z 358.2[m h]
。1h nmr(400mhz,dmso-d6)δ8.06(s,1h),7.96(brs,1h),7.87-7.80(m,2h),7.24(d,j=6.4hz,1h),6.78(d,j=9.3hz,1h),4.10(s,1h),3.70(brs,1h),2.31(brs,2h),1.90(brs,2h),1.23(d,j=8.4hz,5h),1.10(s,6h)。
[0372]
实施例28:[(2s,5r)-5-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(化合物22)
[0373][0374]
(1)[(2s,5r)-5-氨基四氢吡喃-2-基]甲醇盐酸盐
[0375]
将n-[(3r,6s)-6-(羟甲基)四氢吡喃-3-基]氨基甲酸叔丁酯(150mg,648.54μmol)的盐酸/甲醇(4m,1.50ml)溶液在20℃搅拌1小时。tlc显示原料已消耗完。将反应液减压浓缩得到[(2s,5r)-5-氨基四氢吡喃-2-基]甲醇盐酸盐(85mg,粗品),白色固体。
[0376]
(2)2-[4-[(3-噻唑-2-基咪唑[1,2-b]哒嗪-6-基)氨基]环己基]丙-2-醇
[0377]
参照实施例7步骤(1)的方法,以[(2s,5r)-5-氨基四氢吡喃-2-基]甲醇盐酸盐(85mg,507.06μmol)和6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(166.03mg,557.76μmol)为原料,得到白色固体产品[(2s,5r)-5-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]四氢吡喃-2-基]甲醇(9.4mg,收率:4.72%)。ms(esi):m/z 393.2[m h]
。1h nmr(400mhz,dmso-d6)δ8.79(s,1h),8.32(d,j=7.2hz,1h),8.06(s,1h),7.80(d,j=9.7hz,1h),7.72-7.64(m,2h),7.05(d,j=7.5hz,1h),6.72(d,j=9.7hz,1h),4.65(t,j=5.7hz,1h),4.11-4.05(m,1h),3.88-3.77(m,1h),3.45-3.38(m,1h),3.32-3.27(m,2h),3.11(t,j=10.5hz,1h),2.24(d,j=11.8hz,1h),1.78(d,j=12.2hz,1h),1.51-1.38(m,1h),1.36-1.23(m,1h)。
[0378]
实施例29:2-((1r,4r)-4-((3-(3-(呋喃-2-基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙-2-醇(化合物48)
[0379][0380]
(1)2-(3-溴苯基)呋喃
[0381]
将1-溴-3-碘苯(500mg,1.77mmol)溶于二氧六环/水(10ml/1ml),加入呋喃-2-硼酸(237mg,2.12mmol),加入碳酸钾(561mg,5.31mmol)和pdcl2(dppf)(102mg,0.089mmol),反应体系在90℃条件下搅拌反应过夜。反应液直接过滤,减压浓缩,经反相柱纯化得到2-(3-溴苯基)呋喃(310mg,收率:79%),无色液体。
[0382]
(2)2-(3-(呋喃-2-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷
[0383]
将2-(3-溴苯基)呋喃(200mg,0.89mmol)溶于二氧六环溶液(10ml)中,在氮气条件下向其中加入双联频哪醇硼酸酯(227mg,0.89mmol),醋酸钾(262mg,2.67mmol)和1,1'-双二苯基膦二茂铁二氯化钯(33mg,0.05mmol),该混合体系在氮气条件下加热至90℃,搅拌反应过夜,反应液直接用于下一步。
[0384]
(3)6-氯-3-(3-(呋喃-2-基)苯基)咪唑并[1,2-b]哒嗪
[0385]
向2-(3-(呋喃-2-基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷的二氧六环溶液(10ml)中加入3-溴-6-氯咪唑并[1,2-b]哒嗪(206mg,0.89mmol),1,1'-双二苯基膦二茂铁二氯化钯(33mg,0.045mmol)和水(1ml),混合液在氮气条件下加热至90℃,搅拌过夜,lcms监测反应完全。反应体系浓缩后经反相柱纯化得到目标产物6-氯-3-(3-(呋喃-2-基)苯基)咪唑并[1,2-b]哒嗪(100mg,收率:38%),白色固体。ms(esi):m/z 295.9[m h]
。
[0386]
(4)2-((1r,4r)-4-((3-(3-(呋喃-2-基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙-2-醇
[0387]
将6-氯-3-(3-(呋喃-2-基)苯基)咪唑并[1,2-b]哒嗪(100mg,0.34mmol),2-((1r,4r)-4-氨基环己基)丙醇(86mg,0.68mmol),叔丁醇钠(98mg,1.02mmol),分散在甲苯(5ml)中,加入binap(15mg,0.023mmol)和pd2(dba)3(16mg,0.017mmol)。在氮气保护下升温至90℃,搅拌反应过夜。反应液旋干,向反应体系中加入水(10ml),混合液使用乙酸乙酯(20ml x2)分液萃取,无水硫酸钠干燥,过滤,减压浓缩,经prep-hplc纯化得到2-((1r,4r)-4-((3-(3-(呋喃-2-基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙-2-醇(7.8mg,收率:5%),白色固体。ms(esi):m/z 417.3[m h]
。1h nmr(400mhz,dmso-d6)8.63(t,j=1.6hz,1h),7.97-7.91(m,2h),7.78-7.77(m,1h),7.74(d,j=10.8hz,1h),7.68-7.60(m,1h),7.49(t,j=7.6hz,1h),6.99-6.95(m,1h),6.92(d,j=6.8hz,1h),6.68(d,j=9.6hz,1h),6.59(q,j=1.6hz,1h),4.02(s,1h),3.65-3.58(m,1h),2.21(d,j=6.0hz,2h),1.83(d,j=11.6hz,2h),1.23-1.00(m,11h)。
[0388]
实施例30:2-((1r,4r)-4-((3-(3-(5-甲基-1,3,4-恶二唑-2-基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙烷-2-醇(化合物49)
[0389][0390]
(1)2-甲基-5-(3-(4,4,5,5-四甲基-1,3,2-二氧苯甲醛-2-基)苯基)-1,3,4-恶二唑
[0391]
取反应瓶加入2-(3-溴苯基)-5-甲基-1,3,4-恶二唑(400.0mg,1.68mmol),联硼酸频那醇酯(414.2mg,1.68mmol),醋酸钾(328.3mg,3.36mol)和[1,1'-双(二苯基膦基)二茂铁]二氯化钯(122.0mg,0.17mmol),加入二氧六环(8ml)。氮气保护90℃,搅拌过夜。反应液旋干,直接得到粗品2-甲基-5-(3-(4,4,5,5-四甲基-1,3,2-二氧苯甲醛-2-基)苯基)-1,3,4-恶二唑(480mg,收率:99%)。ms(esi):m/z 287.1[m h]
。
[0392]
(2)2-(3-(6-氯咪唑并[1,2-b]哒嗪-3-基)苯基)-5-甲基-1,3,4-恶二唑
[0393]
将2-甲基-5-(3-(4,4,5,5-四甲基-1,3,2-二氧苯甲醛-2-基)苯基)-1,3,4-恶二唑(480mg,1.68mmol),3-溴-6-氯咪唑并[1,2-b]哒嗪(389.0mg,1.68mmol),四(三苯基膦)钯(195.6mg,0.17mmol)和碳酸钾(460.0mg,3.7mmol)溶于二氧六环/水(8ml/2ml)中。氮气保护90c搅拌过夜。反应液旋干后通过正向柱(pe/ea=1/1)纯化,得到2-(3-(6-氯咪唑并[1,2-b]哒嗪-3-基)苯基)-5-甲基-1,3,4-恶二唑(110mg,收率:21%),黄色固体。ms(esi):m/z 311.9[m h]
。
[0394]
(3)2-((1r,4r)-4-((3-(3-(5-甲基-1,3,4-恶二唑-2-基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙烷-2-醇
[0395]
将2-(3-(6-氯咪唑并[1,2-b]哒嗪-3-基)苯基)-5-甲基-1,3,4-恶二唑(110mg,0.19mmol),2-((1r,4r)-4-氨基环己基)丙烷-2-醇(30.3mg,0.19mmol),三(二亚苄基丙酮)二钯(17.3mg,0.02mmol),叔丁醇钠(55.6mg,0.58mmol),4,5-双二苯基膦-9,9-二甲基氧杂蒽(22.0mg,0.04mmol),溶于甲苯(5ml)中。反应体系在110℃下搅拌反应过夜。反应液旋干后经pre-hplc纯化得到2-((1r,4r)-4-((3-(3-(5-甲基-1,3,4-恶二唑-2-基)苯基)咪唑并[1,2-b]哒嗪-6-基)氨基)环己基)丙烷-2-醇(5.2mg,收率:6.2%),白色固体。ms(esi):m/z 433.1[m h]
。1h nmr(400mhz,dmso-d6)δ8.89(s,1h),8.42(s,1h),8.23(d,j=8.4hz,1h),8.02-7.98(m,2h),7.74(t,j=8.0hz,1h),7.55(d,j=6.8hz,1h),7.09(d,j=10.0hz,1h),3.61-3.54(m,1h),2.60(s,3h),2.18(d,j=10.0hz,2h),1.79(d,j=12.0hz,2h),1.22-1.13(m,3h),1.05(d,j=10.8hz,2h),0.99(s,6h)。
[0396]
实施例31:3-(3-(二甲氨基)苯基)-n-((1-甲基哌啶-4-基)甲基)咪唑并[1,2-b]哒嗪-6-胺(化合物50)
[0397][0398]
(1)3-(6-氯咪唑并[1,2-b]哒嗪-3-基)-n,n-二甲基苯胺
[0399]
参照实施例30步骤(2)的方法,以3-溴-6-氯咪唑并[1,2-b]哒嗪(100mg,0.434mmol)和(3-(二甲氨基)苯基)硼酸(86mg,0.521mmol)为原料,得到3-(6-氯咪唑并[1,2-b]哒嗪-3-基)-n,n-二甲基苯胺(64mg,收率:50.8%),白色固体。
[0400]
(2)3-(3-(二甲氨基)苯基)-n-((1-甲基哌啶-4-基)甲基)咪唑并[1,2-b]哒嗪-6-胺
[0401]
参照实施例30步骤(3)的方法,以3-(6-氯咪唑并[1,2-b]哒嗪-3-基)-n,n-二甲基苯胺(142mg,0.522mmol)和(1-甲基哌啶-4-基)甲胺(74mg,0.574mmol)为原料,得到3-(3-(二甲氨基)苯基)-n-((1-甲基哌啶-4-基)甲基)咪唑并[1,2-b]哒嗪-6-胺(7.2mg,收率:3.9%),白色固体。ms(esi):m/z 365.4[m h]
。1h nmr(400mhz,dmso-d6)δ8.26(s,1h),8.34-8.30(m,2h),7.97-7.95(d,j=9.6hz,1h),7.64-7.61(m,2h),7.39-7.37(m,1h),7.34-7.30(m,1h),7.05-7.02(m,1h),6.80-6.78(m,1h),3.46-3.43(m,2h),3.25-3.22(m,2h),2.93(s,6h),2.90-2.88(m,2h),2.70-2.66(d,j=4.8hz,3h),2.32-1.72(m,2h),1.40-1.37(m,2h)。
[0402]
实施例32:2-[(1r,4r)-4-[[3-(3-甲基磺酰基苯基)咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇(化合物51)
[0403][0404]
(1)6-氯-3-(3-甲基磺酰基苯基)咪唑并[1,2-b]哒嗪
[0405]
参照实施例29步骤(3)的方法,以6-氯-3-碘-咪唑并[1,2-b]哒嗪(200mg,715.65μmol)和(3-甲基磺酰基苯基)硼酸(171.77mg,858.78μmol)为原料,得到6-氯-3-(3-甲基磺酰基苯基)咪唑并[1,2-b]哒嗪(120mg,收率:54.48%),黄色固体。ms(esi):m/z 307.9[m h]
。
[0406]
(2)2-[(1r,4r)-4-[[3-(3-甲基磺酰基苯基)咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇
[0407]
参照实施例29步骤(4)的方法,以6-氯-3-(3-甲基磺酰基苯基)咪唑并[1,2-b]哒嗪(60mg,194.96μmol)和2-((1r,4r)-4-氨基环己基)丙-2-醇(55.18mg,350.93μmol)为原料,得到2-[(1r,4r)-4-[[3-(3-甲基磺酰基苯基)咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇(8.5mg,收率:10.17%),白色固体。ms(esi):m/z 429.1[m h]
。1h nmr(400mhz,
dmso-d6)δ8.98(brs,1h),8.33-8.46(m,1h),8.05(d,j=3.06hz,1h),7.66-7.93(m,3h),6.99(d,j=4.77hz,1h),6.72(dd,j=9.48,3.12hz,1h),4.03(d,j=2.93hz,1h),3.65-3.75(m,1h),3.24(d,j=3.18hz,3h),2.15(s,2h),1.82(d,j=2.08hz,2h),1.16-1.32(m,4h),1.07(d,j=3.06hz,6h)。
[0408]
实施例33:2-[(1r,4r)-4-[[2-氨基-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇(化合物52)
[0409][0410]
(1)6-氯-3-碘-咪唑并[1,2-b]哒嗪-2-胺
[0411]
在0℃下,向6-氯咪唑并[1,2-b]哒嗪-2-胺(1g,5.93mmol)的n,n-二甲基甲酰胺(20ml)溶液中分批加入n-碘琥珀酰亚胺(1.60g,7.12mmol)。加完之后,将反应液自然升温至25℃并在25℃下搅拌2小时。将反应液缓慢倒入冰水(50ml)中淬灭反应,然后用乙酸乙酯萃取(30ml x 3)。合并有机相并用饱和食盐水洗涤(30ml)。将有机相用无水硫酸钠干燥,过滤后浓缩至干,得到粗品。将所得粗品通过柱层析进行纯化(石油醚/乙酸乙酯=50/1~3/1),得到6-氯-3-碘-咪唑并[1,2-b]哒嗪-2-胺(0.6g,粗品),棕色固体,直接用于下一步。
[0412]
(2)6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-2-胺
[0413]
25℃下,向6-氯-3-碘-咪唑并[1,2-b]哒嗪-2-胺(0.3g,1.02mmol)的二氧六环(3ml)溶液中依次加入[3-(三氟甲基)苯基]硼酸(212.84mg,1.12mmol),碳酸钾(281.60mg,2.04mmol)和二碳酸二叔丁酯(244.58mg,1.12mmol),然后用氮气置换3次。然后在氮气保护下,向反应液中加入1,1-双(二苯基磷)二茂铁氯化钯(74.54mg,101.87μmol)。加料完毕,将体系升温至80℃并在80℃下搅拌12小时。将反应液降温至25℃后过滤,将滤液浓缩至干,得到粗品。将所得粗品通过prep-tlc(100%乙酸乙酯)进行纯化得到6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-2-胺(0.1g,粗品),黄色固体,直接用于下一步。
[0414]
(3)2-[(1r,4r)-4-[[2-氨基-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇
[0415]
20℃下,向6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-2-胺(0.05g,159.91μmol)的二甲基亚砜(0.5ml)溶液中依次加入2-((1r,4r)-4-氨基环己基)丙-2-醇(30.18mg,191.89μmol),n,n-二异丙基乙胺(51.67mg,399.77μmol)和氟化铯(60.73mg,399.77μmol)。将体系升温至140℃搅拌12小时。将反应液冷却至20℃,然后用水(3ml)进行稀释。将所得溶液用乙酸乙酯(2ml x 3)萃取,然后将合并后的有机相用饱和食盐水洗涤(2ml x 2),用无水硫酸钠干燥,过滤后浓缩得到粗品。所得粗品通过prep-hplc纯化得到2-[(1r,4r)-4-[[2-氨基-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]环己基]丙-2-醇(0.01g,收率:12.78%),淡黄色固体。ms(esi):m/z 434.1[m h]
。1h nmr(400mhz,cd3od)δ8.27-8.48(m,1h),7.95-8.13(m,1h),7.60-7.82(m,3h),6.84-6.94(m,1h),3.53-3.69(m,1h),2.18(d,j=10.27hz,2h),1.86-2.04(m,2h),1.18-1.41(m,5h),1.14-1.17(m,
6h)。
[0416]
实施例34:4-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]双环[2.2.2]辛-1-醇(化合物36)
[0417][0418]
参照实施例7步骤(1)的方法,以4-氨基双环[2.2.2]辛-1-醇盐酸盐(21mg,120.94μmol)和6-氯-3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪(30mg,100.79μmol)为原料,得到4-[[3-[3-(三氟甲基)苯基]咪唑并[1,2-b]哒嗪-6-基]氨基]双环[2.2.2]辛-1-醇(81mg,收率:33.3%),黄色固体。ms(esi):m/z 403.2[m h]
。1h nmr(400mhz,dmso-d6)δ8.59(s,1h),8.33-8.24(m,1h),8.05-7.95(m,1h),7.77-7.66(m,3h),6.78-6.71(m,1h),6.68-6.59(m,1h),4.34(s,1h),2.12-2.03(m,6h),1.71-1.62(m,6h)。
[0419]
实施例35:6-((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-碳腈(化合物43)
[0420][0421]
(1)3-溴-6-氯咪唑[1,2-b]哒嗪-2-羧酸
[0422]
将3-溴-6-氯咪唑[1,2-b]哒嗪-2-羧酸乙酯(400mg,1.32mmol)溶于四氢呋喃/水(8ml,v/v=3/1)中,加入naoh(1.81g,6.62mmol),反应体系在25℃条件下搅拌2小时。反应液中加入稀盐酸调ph到6,旋干。得到的固体加入甲醇(5ml),搅拌后过滤,滤液旋干,得到3-溴-6-氯咪唑[1,2-b]哒嗪-2-羧酸(345mg,收率:95%),白色固体,直接用于下一步。ms(esi):m/z 275.9[m h]
。
[0423]
(2)3-溴-6-氯咪唑[1,2-b]哒嗪-2-甲酰胺
[0424]
将3-溴-6-氯咪唑[1,2-b]哒嗪-2-羧酸(345mg,1.25mmol)和2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(570mg,1.50mmol)溶于n,n-二甲基甲酰胺(10ml)中,加入n,n-二异丙基乙胺(322mg,2.50mmol)和氯化铵(100mg,1.88mmol),反应体系在室温条件下搅拌1小时。向反应体系中加入水(10ml),混合液使用乙酸乙酯分液萃取(10ml x 2),有机相使用饱和食盐水(10ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩,经反向柱(乙腈/水)纯化得到3-溴-6-氯咪唑[1,2-b]哒嗪-2-甲酰胺(276mg,收率:80.9%),白色固体。ms(esi):m/z 274.9[m h]
。
[0425]
(3)3-溴-6-氯咪唑[1,2-b]哒嗪-2-碳腈
[0426]
将3-溴-6-氯咪唑[1,2-b]哒嗪-2-甲酰胺(276mg,1.01mmol)溶于二氯甲烷(5ml)中,加入n-(三乙基铵磺酰)氨基甲酸甲酯(1.24g,5.05mmol)。反应体系在25℃下搅拌16小
时。反应液旋干,过反相柱(乙腈/水)纯化得到3-溴-6-氯咪唑[1,2-b]哒嗪-2-碳腈(86mg,收率:33.4%),白色固体。ms(esi):m/z 256.9[m h]
。
[0427]
(4)3-溴-6-((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基咪唑[1,2-b]哒嗪-2-碳腈
[0428]
将3-溴-6-氯咪唑[1,2-b]哒嗪-2-碳腈(86mg,0.33mmol)溶于二甲基亚砜(5ml)中,加入2-((1r,4r)-4-氨基环己基)丙烷-2-醇(58mg,0.37mmol),三乙胺(68mg,0.62mmol)和氟化铯(102mg,0.67mmol)。反应体系在110℃下搅拌16小时。向反应体系中加入水(5ml),混合液使用乙酸乙酯分液萃取(10ml x 2),有机相使用饱和食盐水(10ml)洗涤,无水硫酸钠干燥,过滤,减压浓缩得到3-溴-6-((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基咪唑[1,2-b]哒嗪-2-碳腈(90mg,收率:70.8%),白色固体。ms(esi):m/z 378.1[m h]
。
[0429]
(5)6-((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-碳腈
[0430]
将3-溴-6-((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基咪唑[1,2-b]哒嗪-2-碳腈(90mg,0.23mmol)和(3-(三氟甲基)苯基)硼酸(49mg,0.26mmol)溶于1,4-二氧六环/水(4ml,v/v=3/1),溶液中加入[1,1'-双(二苯基膦基)二茂铁]二氯化钯(17mg,0.02mmol)和碳酸钾(65mg,0.47mmol)。将反应液搅拌过夜。除去溶剂后,直接用反向柱纯化得到粗品,粗品pre-hplc纯化得到6-((1r,4r)-4-(2-羟基丙烷-2-基)环己基)氨基)-3-(3-(三氟甲基)苯基)咪唑并[1,2-b]哒嗪-2-碳腈(9.2mg,收率:8.7%),白色固体。ms(esi):m/z 444.2[m h]
。1h nmr(400mhz,dmso-d6)δ8.55(s,1h),8.22(d,j=8.8hz,1h),7.89-7.84(m,3h),7.44-7.42(d,j=8.4hz,1h),6.95-6.91(d,j=13.6hz,1h),4.07(s,1h),3.50(br,1h),2.11(d,j=13.6hz,2h),1.85(d,j=15.2hz,2h),1.24-1.10(m,5h),1.05(s,6h)。
[0431]
其他化合物参照前述工艺路线制备。
[0432]
测试例1:pim1/2/3激酶活性测试
[0433]
1.实验方法
[0434]
利用mobility shift assay方法进行化合物的pim1/2/3活性测试,具体方法如下:将待测化合物溶解在dmso中,配制成10mm储存液,化合物测试起始浓度为10μm,3倍稀释,10个浓度。
[0435]
阳性对照药物tp-3654为市售获得或根据专利wo2013013188实施例31制备得到。
[0436]
将pim1、pim2、pim3(三种激酶均来自carna公司)分别用1
×
kinase buffer配制2.5倍终浓度的激酶溶液。在化合物孔和阳性对照孔分别加10μl的2.5倍终浓度的激酶溶液,在阴性对照孔中加10μl的1
×
kinase buffer。1000rpm离心30秒,反应板振荡混匀后室温孵育10分钟。用1
×
kinase buffer配制25/15倍终浓度的atp和kinase substrate20(来自gl公司)的混合溶液。加入15μl的25/15倍终浓度的atp和kinase substrate20的混合溶液,开始反应。将384孔板1000rpm离心30秒,振荡混匀后室温孵育60分钟。加入30μl终止检测液停止激酶反应,1000rpm离心30秒,振荡混匀。用caliper ez reader读取转化率。
[0437]
2.结果计算
[0438]
采用分析软件graphpad prism 5的拟合量效曲线,得出各个待测化合物对酶活性的ic50值。各化合物结果如表1所示,其中a 表示<2nm,a表示2-10nm,b表示10-100nm,c表示100-1000nm,d表示1000-10000nm,e表示>10000nm。
[0439]
表1 pim1/2/3激酶活性测试结果
[0440][0441]
测试例2:细胞抑制活性测试
[0442]
通过逆转录病毒包装系统,将epor-jak2-v617f基因转入到ba/f3野生型细胞,获得稳转株细胞系ba/f3-epor-jak2-v617f,用于化合物细胞抑制活性ic
50
测试(参考文献:blood.2010;115(15):3109-3117)。具体方法如下:
[0443]
以96孔板接种细胞,用来自dmso原液的待测化合物(0.2%最终dmso浓度)处理,37℃、5%co2培养72小时后采用ctg(cell-titer glo)方法进行细胞增殖抑制活性检测。化合物测试起始浓度为10μm,3倍稀释,9个浓度。采用graphpad 7.0分析软件进行量效关系曲线拟合,并得到ic
50
值。
[0444]
结果表明,大部分化合物的细胞抑制活性强于或相当于pim抑制剂tp-3654。部分优选化合物的细胞抑制活性ic
50
显著优于pim抑制剂tp-3654(tp-3654根据专利wo2013013188实施例31制备得到)(显著优于指数量级差异)。部分测试化合物结果如表2所示,其中 表示0-50nm, 表示50-100nm, 表示100-150nm, 表示>150nm。
[0445]
表2细胞抑制活性数据测试结果
[0446][0447]
测试例3:药代试验
[0448]
1.实验方法
[0449]
实验动物:balb/c小鼠,雌性;体重:19-25g。
[0450]
供试品配制:将目标化合物配制成0.4mg/ml(为静脉给药用)和5.0mg/ml(为口服给药用),待用。给药途径:口服/静脉注射。给药容量及频率:5ml/kg(静脉注射)或10ml/kg(口服),单次给药。
[0451]
样品采集:按照下列时间点采集血液,给药后5min、15min、30min、1hr、2hr、4hr、8hr和24hr取血。
[0452]
2、样品分析及结果
[0453]
样品分析:使用lc-ms/ms方法对采集样品进行检测。使用仪器型号为ab sciex5500。
[0454]
药物动力学数据分析:按照非房室模型法对所得血药浓度数据进行拟合和计算,部分结果总结在表3中。
[0455]
表3药物动力学试验结果
[0456][0457]
注:1、静脉给药制剂为:10%dmso/50%peg400/40%(23%hpbcd);
[0458]
2、口服制剂为:10%tween20 90%(0.5%mc)(化合物29、46和tp-3654)和5%tween20 5%solutol 90%(0.5%mc)(化合物20)。
[0459]
试验结果表明本发明化合物具有良好的药物动力学特征,测试化合物口服动物体内药物暴露量(c
max
和auc)均高tp-3654,测试化合物生物利用度高于tp-3654。
[0460]
另外,还对本发明化合物的毒副作用进行了试验测试。对裸鼠每日一次连续给药30天,结果表明本发明化合物具有较小的毒副作用,在动物中的耐受性良好,已测试的最高剂量为150mg/kg/天。
[0461]
除非特别限定,本发明所用术语均为本领域技术人员通常理解的含义。
[0462]
本发明所描述的实施方式仅出于示例性目的,并非用以限制本发明的保护范围,本领域技术人员可在本发明的范围内作出各种其他替换、改变和改进,因而,本发明不限于上述实施方式,而仅由权利要求限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。