1.本发明涉及具有产乳酸能力的重组嗜氢菌属(hydrogenophilus)细菌以及使用所述细菌生产乳酸的方法。
背景技术:
2.2015年通过的《巴黎协定》(the paris agreement)规定,应迅速减少全球温室气体排放。根据所述协定,日本设定了到2030年将其温室气体例如二氧化碳和甲烷的排放量与2013年的水平相比减少26%的目标。
3.在世界范围内,大部分化学品的生产依赖于石油资源,加剧了温室气体排放增加的问题。因此,摆脱对石油的依赖是化学品生产的理想策略,并且各国正在认真开展从生物质生产绿色化学品的生物炼制的研究和开发。然而,用作微生物发酵的原材料的生物质的糖化除了成本高之外还需要复杂的工艺。
4.作为试图摆脱对石油的依赖的研究的一部分,诸如二氧化碳、甲烷和一氧化碳等的气体作为更加可持续的碳源备受关注,并且使用利用这些气体的微生物生产有价值的化学品和生物燃料的技术成为让人有浓厚兴趣的主题。尤其是作为气候变暖的重要贡献者的二氧化碳的碳固定和二氧化碳的高效利用,备受期待。
5.鉴于海洋被塑料垃圾污染等问题,最终被自然界中的微生物分解成水和二氧化碳的可生物降解塑料已引起关注。可生物降解塑料根据制造方法分为细菌产物系列、天然产物系列和化学合成系列。在所有可生物降解塑料中研究和实际实现进展最快的聚乳酸(乳酸树脂)被认为是介于细菌产物系列与化学合成系列之间的一种可生物降解塑料中间体,因为它的原材料是乳酸,是糖酵解系统这种活体内代谢途径的产物。也就是说,聚乳酸通过纯化由微生物发酵产生的乳酸并进行化学缩聚来生产。目前的聚乳酸生产使用生物质作为原材料,如前所述将生物质转化成糖需要复杂的步骤,因此目前的聚乳酸生产具有成本高的问题。
6.因此,需要一种能够以更简单的步骤生产乳酸的实用方法,特别是能够通过二氧化碳固定生产乳酸的实用方法。
7.乳酸从丙酮酸这种重要的活体内代谢产物产生。也就是说,乳酸通过乳酸脱氢酶的催化活性从丙酮酸产生。
8.作为使用重组微生物制造乳酸的技术,专利文献1描述了一种使用通过将瑞士乳杆菌(lactobacillus helveticus)或巨大芽孢杆菌(bacillus megaterium)的乳酸脱氢酶基因(ldh基因)引入到酵母菌株中而获得的转化体来生产乳酸的方法。
9.专利文献2描述了一种使用通过将戊糖乳杆菌(lactobacillus pentosus)ldh基因作为乳酸脱氢酶基因引入到粟酒裂殖酵母(schizosaccharomyces pombe)中而获得的转化体来生产乳酸的方法。
10.专利文献3描述了一种使用通过将thermoanaerobacter pseudethanolicus ldh基因作为乳酸脱氢酶基因引入到热醋穆尔氏菌(moorella thermoacetica)中而获得的转
化体来生产乳酸的方法。
11.专利文献4描述了一种使用通过将德氏乳杆菌(lactobacillus delbrueckii)hdhd基因或ldha基因作为乳酸脱氢酶基因引入到热葡萄糖苷酶地芽孢杆菌(geobacillus thermoglucosidans)中而获得的转化体来生产乳酸的方法。
12.非专利文献1描述了一种使用通过将干酪乳杆菌(lactobacillus casei)的乳酸脱氢酶基因引入到大肠埃希氏杆菌(escherichia coli)中而获得的转化体来生产乳酸的方法。
13.然而,所有这些方法都是使用糖作为碳源生产乳酸的方法,而不是使用二氧化碳作为碳源生产乳酸的方法。
14.非专利文献2描述了一种使用通过将枯草芽孢杆菌(bacillus subtilis)的乳酸脱氢酶基因引入到集胞藻属(synechocystis sp.)菌株pcc6803中而获得的转化体来生产乳酸的方法。这种方法使用蓝细菌这种光合细菌作为宿主并使用碳酸氢钠作为碳源来生产乳酸。
15.蓝细菌与植物相比具有更高的二氧化碳固碳能力。然而,由于蓝细菌的二氧化碳固定能力不足,使用蓝细菌作为宿主的方法尚未作为生产乳酸的工业化方法投入实用。
16.专利文献5描述了一种使用通过将嗜热栖热菌(thermus thermophilus)ldh基因作为乳酸脱氢酶基因引入到嗜热氢杆菌(hydrogenobacter thermophilus)中而获得的转化体来生产乳酸的方法。
17.嗜热氢杆菌是一种氢氧化细菌,其在1.5小时内生长两倍。然而,为了生产足够量的乳酸需要施加电流,因此使用嗜热氢杆菌作为宿主的方法尚未作为生产乳酸的工业化方法投入实用。
18.引文列表
19.专利文献
20.[专利文献1]jp2005-528106a
[0021]
[专利文献2]jp2014/030655a1
[0022]
[专利文献3]jp2015-023854a
[0023]
[专利文献4]jp2017-523778a
[0024]
[专利文献5]jp2017-093465a
[0025]
非专利文献
[0026]
[非专利文献1]在代谢工程改造的大肠埃希氏杆菌rr1中同型发酵生产d或l-乳酸(homofermentative production of d-or l-lactate in metabolically engineered escherichia coli rr1),chang de,jung hc,rhee js,pan jg.appl.environ.microbiol.(1999)65:1384-1389
[0027]
[非专利文献2]工程化改造蓝细菌细胞工厂以生产乳酸(engineering a cyanobacterial cell factory for production of lactic acid),angermayr sa,paszota m,hellingwerf kj.appl.environ.microbiol.(2012)78:7098-7106
技术实现要素:
[0028]
技术问题
[0029]
本发明的目的是提供一种能够利用二氧化碳作为唯一碳源高效生产乳酸的重组嗜氢菌属细菌,以及使用这种重组体高效生产乳酸的方法。
[0030]
技术解决方案
[0031]
嗜氢菌属细菌是氢氧化细菌,其通过利用氢能从二氧化碳产生有机物质来生长。氢氧化细菌的生长速率通常极为缓慢,但嗜氢菌属细菌的生长速率快,并且它们的二氧化碳固碳能力明显高于植物和光合细菌。
[0032]
然而,嗜氢菌属细菌不具有在工业规模上生产乳酸的能力。嗜氢菌属细菌不具有已知编码催化从丙酮酸产生乳酸的反应的酶的乳酸脱氢酶基因和苹果酸/乳酸脱氢酶基因。为了向所述细菌提供在工业规模上生产乳酸的能力,需要引入催化产生乳酸的反应的酶的基因。
[0033]
然而,本发明的发明人的研究显示,当使用在嗜氢菌属细菌中有功能的载体将异源基因引入到嗜氢菌属细菌中时,有功能的蛋白质通常不会产生或不会足量产生。在嗜氢菌属之外的细菌中引起活性的基因在嗜氢菌属细菌中通常不引起或不足量地引起活性。
[0034]
面对这种情况,本发明的发明人发现,当将乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因引入到嗜氢菌属细菌中时,所述基因在嗜氢菌属细菌中发挥作用并引起高活性。
[0035]
此外,本发明的发明人发现,作为乳酸脱氢酶基因的热葡萄糖苷酶副地芽孢杆菌(parageobacillus thermoglucosidasius)、嗜热地芽孢杆菌(geobacillus kaustophilus)或嗜热栖热菌的ldh基因和作为苹果酸/乳酸脱氢酶基因的嗜热栖热菌的mldh基因和红色亚栖热菌(meiothermus ruber)的mldh-1和mldh-2基因引起更高的酶活性表达,特别是在嗜氢菌属细菌中。
[0036]
已知嗜氢菌属细菌利用乳酸(agric.biol.chem.(1978)42(7):1305-1308;orlygsson j.,kristjansson j.k.(2014)嗜氢菌科(the familyhydrogenophilaceae),rosenberg e.,delong e.f.,lory s.,stackebrandt e.,thompson f.主编,《原核生物》(the prokaryotes),springer,berlin,heidelberg)。
[0037]
本发明的发明人推测,并排出现在hydrogenophilus thermoluteolus的基因组上的hptl_1694、hptl_1695和hptl_1696基因起到乳酸利用酶基因的作用。
[0038]
可以想象,当乳酸利用酶基因发挥作用时,在嗜氢菌属细菌的细胞内产生的乳酸被利用,因此分泌到培养基上清液中的乳酸的量减少。
[0039]
本发明的发明人已经观察到,在其中引入有乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因的hydrogenophilus thermoluteolus转化体中,当基因组上的hptl_1694、hptl_1695和hptl_1696中的一个或多个基因被破坏时,分泌到培养基中的乳酸的量显著增加。有鉴于此,本发明人推断hptl_1694、hptl_1695和hptl_1696基因是乳酸利用酶基因。
[0040]
hptl_1694、hptl_1695和hptl_1696基因中的任一者或多者的破坏增强得到的细胞的乳酸生产能力,因此可以设想这三个基因形成操纵子,并且由这些基因编码的三个蛋白质形成复合体,表现出利用乳酸的功能。
[0041]
本发明的发明人还观察到上述乳酸利用酶基因被破坏的菌株极为高效地通过使用二氧化碳作为唯一碳源生产乳酸。
[0042]
本发明的发明人还观察到,当将编码促进乳酸分泌到细胞外的乳酸透性酶的基因引入到其中引入有乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因的嗜氢菌属细菌的乳酸
利用酶基因被破坏的菌株中时,分泌到培养基中的乳酸的量进一步增加。
[0043]
本发明在上述观察的基础上得以完成,并提供了下述条目[1]至[8]。
[0044]
[1]一种重组嗜氢菌属细菌,其具有引入到其中的乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因,并且其中基因组上的三个乳酸利用酶基因中的一者或多者被破坏。
[0045]
[2]根据条目[1]所述的重组嗜氢菌属细菌,其中所述三个乳酸利用酶基因分别由下述(a1)至(a6)中的任一者的dna、下述(b1)至(b6)中的任一者的dna和下述(c1)至(c6)中的任一者的dna形成:
[0046]
(a1)由seq id no:1中阐述的碱基序列形成的dna;
[0047]
(a2)由与seq id no:1中阐述的碱基序列具有90%或更高同一性的碱基序列形成,并编码具有乳酸利用酶活性的多肽的dna;
[0048]
(a3)在严紧条件下与由seq id no:1的互补碱基序列形成的dna杂交,并编码具有乳酸利用酶活性的多肽的dna;
[0049]
(a4)编码由seq id no:2中阐述的氨基酸序列形成的多肽的dna;
[0050]
(a5)编码由与seq id no:2具有90%或更高同一性的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0051]
(a6)编码由在seq id no:2中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;
[0052]
(b1)由seq id no:3中阐述的碱基序列形成的dna;
[0053]
(b2)由与seq id no:3中阐述的碱基序列具有90%或更高同一性的碱基序列形成,并编码具有乳酸利用酶活性的多肽的dna;
[0054]
(b3)在严紧条件下与由seq id no:3的互补碱基序列形成的dna杂交,并编码具有乳酸利用酶活性的多肽的dna;
[0055]
(b4)编码由seq id no:4中阐述的氨基酸序列形成的多肽的dna;
[0056]
(b5)编码由与seq id no:4具有90%或更高同一性的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0057]
(b6)编码由在seq id no:4中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0058]
(c1)由seq id no:5中阐述的碱基序列形成的dna;
[0059]
(c2)由与seq id no:5中阐述的碱基序列具有90%或更高同一性的碱基序列形成,并编码具有乳酸利用酶活性的多肽的dna;
[0060]
(c3)在严紧条件下与由seq id no:5的互补碱基序列形成的dna杂交,并编码具有乳酸利用酶活性的多肽的dna;
[0061]
(c4)编码由seq id no:6中阐述的氨基酸序列形成的多肽的dna;
[0062]
(c5)编码由与seq id no:6具有90%或更高同一性的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0063]
(c6)编码由在seq id no:6中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna。
[0064]
[3]根据条目[1]或[2]所述的重组嗜氢菌属细菌,其中所述三个乳酸利用酶基因中的一者或多者通过在所述三个乳酸利用酶基因中的一者或多者中引入一个或多个核苷
酸的缺失、添加、替换或其组合而被破坏。
[0065]
[4]根据条目[1]至[3]中的任一者所述的重组嗜氢菌属细菌,其中所述乳酸脱氢酶基因由下述(d1)至(d6)中的任一者的dna形成:
[0066]
(d1)由seq id no:9、10或11中阐述的碱基序列形成的dna;
[0067]
(d2)由与seq id no:9、10或11中阐述的碱基序列形成的dna具有90%或更高同一性的碱基序列形成,并编码具有乳酸脱氢酶活性的多肽的dna;
[0068]
(d3)在严紧条件下与由seq id no:9、10或11的互补碱基序列形成的dna杂交,并编码具有乳酸脱氢酶活性的多肽的dna;
[0069]
(d4)编码由seq id no:12、13或14中阐述的氨基酸序列形成的多肽的dna;
[0070]
(d5)编码由与seq id no:12、13或14具有90%或更高同一性的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna;和
[0071]
(d6)编码由在seq id no:12、13或14中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna。
[0072]
[5]根据条目[1]至[4]中的任一者所述的重组嗜氢菌属细菌,其中所述苹果酸/乳酸脱氢酶基因由下述(e1)至(e6)中的任一者的dna形成:
[0073]
(e1)由seq id no:15、16或17中阐述的碱基序列形成的dna;
[0074]
(e2)由与seq id no:15、16或17中阐述的碱基序列形成的dna具有90%或更高同一性的碱基序列形成,并编码具有乳酸脱氢酶活性的多肽的dna;
[0075]
(e3)在严紧条件下与由seq id no:15、16或17的互补碱基序列形成的dna杂交,并编码具有乳酸脱氢酶活性的多肽的dna;
[0076]
(e4)编码由seq id no:18、19或20中阐述的氨基酸序列形成的多肽的dna;
[0077]
(e5)编码由与seq id no:18、19或20具有90%或更高同一性的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna;和
[0078]
(e6)编码由在seq id no:18、19或20中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna。
[0079]
[6]根据条目[1]至[5]中的任一者所述的重组嗜氢菌属细菌,其中所述重组嗜氢菌属细菌还具有引入到其中的乳酸透性酶基因。
[0080]
[7]根据条目[6]所述的重组嗜氢菌属细菌,其中所述乳酸透性酶基因由下述(f1)至(f6)中的任一者的dna形成:
[0081]
(f1)由seq id no:21中阐述的碱基序列形成的dna;
[0082]
(f2)由与seq id no:21中阐述的碱基序列形成的dna具有90%或更高同一性的碱基序列形成,并编码具有乳酸透性酶活性的多肽的dna;
[0083]
(f3)在严紧条件下与由seq id no:21的互补碱基序列形成的dna杂交,并编码具有乳酸透性酶活性的多肽的dna;
[0084]
(f4)编码由seq id no:22中阐述的氨基酸序列形成的多肽的dna;
[0085]
(f5)编码由与seq id no:22具有90%或更高同一性的氨基酸序列形成并具有乳酸透性酶活性的多肽的dna;和
[0086]
(f6)编码由在seq id no:22中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸透性酶活性的多肽的dna。
[0087]
[8]一种生产乳酸的方法,所述方法包括利用二氧化碳作为基本上唯一的碳源培养条目[1]至[7]中的任一者所述的重组嗜氢菌属细菌的步骤。
[0088]
有利效果
[0089]
应对大气中二氧化碳增加的措施需要减少二氧化碳排放并固定排放出的二氧化碳。为了减少二氧化碳排放,利用太阳能、风能、地热能和类似能源来代替化石能源。然而,此类能源的利用广度尚不足以抑制大气中二氧化碳的积累。因此,有必要加强大气碳固定或排放的二氧化碳的循环利用。
[0090]
二氧化碳的碳固定可以通过物理或化学方式进行,但利用活细胞的固定产生有机物质,因此可用作食品、饲料和燃料。这样一来,二氧化碳本身变成了一种可以被直接转化成有价值的化学产品的资源。因此,由大气中的二氧化碳增加造成的全球变暖和食品、饲料和燃料短缺的双重问题可以得到解决。此外,在抑制因二氧化碳排放增加引起的全球变暖的同时,还可以生产非常需要的化学产品。
[0091]
化学产品中的可生物降解塑料由于其环境益处而受到关注。通过二氧化碳固定产生的可生物降解塑料被环境中的微生物分解成水和二氧化碳。也就是说,可生物降解塑料是碳中和的,能够同时解决由二氧化碳排放增加引起的全球变暖、获得生活必需的塑料产品的困难和环境问题例如海洋污染。
[0092]
氢氧化细菌可以通过利用由氢气与氧气的反应产生的化学能并使用二氧化碳作为唯一碳源来生长。由于氢氧化细菌可以从氧气、氢气和二氧化碳的混合物作为原材料生产化学产品,因此所述细胞可以高效地从二氧化碳同化碳并在简单培养基中培养。典型的氢氧化细菌通常生长缓慢,但嗜氢菌属细菌的生产速率格外高。三菱综合研究所杂志(the journal of mitsubishi research institute)第34期1999将嗜氢菌属细菌描述如下:“它们的增殖能力如此之高,使得它们对二氧化碳的碳固定能力无法与植物相比,这真正说明了微生物的高二氧化碳固定能力。”[0093]
当使用在嗜氢菌属细菌中起作用的载体将异源基因引入到嗜氢菌属细菌中时,通常不产生有功能的蛋白质。在这种情况下,通过将乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因引入到嗜氢菌属细菌中,所述基因在嗜氢菌属细菌中起作用,并且可以高效生产乳酸。
[0094]
当将上述嗜氢菌属细菌的转化体的基因组上的三个乳酸利用酶基因中的一者或多者破坏时,可以显著提高培养基中产生的乳酸的量。
[0095]
当进一步将乳酸透性酶基因引入到所述其中引入有乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因的嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株中时,所述乳酸透性酶基因在所述重组菌株中起作用,提高了分泌到培养基中的乳酸的量。通过破坏充当宿主的嗜氢菌属细菌的乳酸利用酶基因,引入乳酸透性酶基因的乳酸分泌量提高效果被显著增强。
[0096]
如上所述,在具有二氧化碳固定能力的微生物中,嗜氢菌属细菌具有特别出色的二氧化碳固定能力。因此,使用本发明的重组体能够通过固定二氧化碳进行乳酸的工业生产。乳酸充当生产聚乳酸这种典型的可生物降解塑料的原材料,因此本发明为利用二氧化碳高效工业生产聚乳酸铺平了道路。
附图说明
[0097]
图1是示意图,说明了产生乳酸利用酶基因被破坏的菌株的实例的方法。
具体实施方式
[0098]
下面详细描述本发明。
[0099]
本发明的重组嗜氢菌属细菌是其中引入有乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因,并且其中基因组上的三个乳酸利用酶基因中的一者或多者被破坏的重组嗜氢菌属细菌。
[0100]
(1)嗜氢菌属细菌
[0101]
嗜氢菌属细菌的实例包括hydrogenophilus thermoluteolus、hydrogenophilus halorhabdus、反硝化嗜氢菌(hydrogenophilus denitrificans)、hydrogenophilus hirschii、hydrogenophilus islandicus、嗜氢菌属菌株mar3(hydrogenophilus sp.mar3)和嗜氢菌属菌株z1038(hydrogenophilus sp.z1038)。具体来说,hydrogenophilus thermoluteolus是优选的,因为它的优越生长速率使其从二氧化碳固定碳的能力在固定二氧化碳的微生物中处于顶级水平。
[0102]
已从遍及地球的多种多样的区域容易地分离到嗜氢菌属细菌。优选的hydrogenophilus thermoluteolus菌株是菌株th-1(nbrc 14978)。hydrogenophilus thermoluteolus菌株th-1(nbrc 14978)在固定二氧化碳的微生物中表现出顶级水平的生长速率(agricultural and biological chemistry,41,685-690(1977))。hydrogenophilus thermoluteolus菌株nbrc 14978根据布达佩斯公约(budapest treaty)被国际保藏,因此可供公众使用。
[0103]
(2)乳酸利用酶基因
[0104]
(2-1)野生型乳酸利用酶基因
[0105]
野生型嗜氢菌属细菌在基因组上具有三个乳酸利用酶基因,并且由这些基因编码的多肽形成乳酸利用酶复合体(被认为是一种乳酸氧化酶复合体)。野生型嗜氢菌属细菌产生具有活性的乳酸利用酶复合体,因此具有乳酸利用能力。
[0106]
所述三个野生型乳酸利用酶基因分别由下述(a1)至(a6)中的任一者的dna、下述(b1)至(b6)中的任一者的dna和下述(c1)至(c6)中的任一者的dna形成:
[0107]
(a1)由seq id no:1中阐述的碱基序列形成的dna;
[0108]
(a2)由与seq id no:1中阐述的碱基序列具有90%或更高同一性的碱基序列形成,并编码具有乳酸利用酶活性的多肽的dna;
[0109]
(a3)在严紧条件下与由seq id no:1的互补碱基序列形成的dna杂交,并编码具有乳酸利用酶活性的多肽的dna;
[0110]
(a4)编码由seq id no:2中阐述的氨基酸序列形成的多肽的dna;
[0111]
(a5)编码由与seq id no:2具有90%或更高同一性的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0112]
(a6)编码由在seq id no:2中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna。
[0113]
seq id no:1阐述了hydrogenophilus thermoluteolus野生型菌株的hptl_1694
基因的碱基序列,并且seq id no:2阐述了由hydrogenophilus thermoluteolus野生型菌株的hptl_1694基因编码的多肽的氨基酸序列。
[0114]
(b1)由seq id no:3中阐述的碱基序列形成的dna;
[0115]
(b2)由与seq id no:3中阐述的碱基序列具有90%或更高同一性的碱基序列形成,并编码具有乳酸利用酶活性的多肽的dna;
[0116]
(b3)在严紧条件下与由seq id no:3的互补碱基序列形成的dna杂交,并编码具有乳酸利用酶活性的多肽的dna;
[0117]
(b4)编码由seq id no:4中阐述的氨基酸序列形成的多肽的dna;
[0118]
(b5)编码由与seq id no:4具有90%或更高同一性的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0119]
(b6)编码由在seq id no:4中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna。
[0120]
seq id no:3阐述了hydrogenophilus thermoluteolus野生型菌株的hptl_1695基因的碱基序列,并且seq id no:4阐述了由hydrogenophilus thermoluteolus野生型菌株的hptl_1695基因编码的多肽的氨基酸序列。
[0121]
(c1)由seq id no:5中阐述的碱基序列形成的dna;
[0122]
(c2)由与seq id no:5中阐述的碱基序列具有90%或更高同一性的碱基序列形成,并编码具有乳酸利用酶活性的多肽的dna;
[0123]
(c3)在严紧条件下与由seq id no:5的互补碱基序列形成的dna杂交,并编码具有乳酸利用酶活性的多肽的dna;
[0124]
(c4)编码由seq id no:6中阐述的氨基酸序列形成的多肽的dna;
[0125]
(c5)编码由与seq id no:6具有90%或更高同一性的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna;和
[0126]
(c6)编码由在seq id no:6中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸利用酶活性的多肽的dna。
[0127]
seq id no:5阐述了hydrogenophilus thermoluteolus野生型菌株的hptl_1696基因的碱基序列,并且seq id no:6阐述了由hydrogenophilus thermoluteolus野生型菌株的hptl_1696基因编码的多肽的氨基酸序列。
[0128]
在本发明中,每个碱基序列和氨基酸序列的同一性是使用genetyx第17版(由genetyx corporation制造)计算的值。
[0129]
在本发明中,术语“严紧条件”是指下述条件:杂交在具有6
×
ssc的盐浓度的杂交溶液中,在50℃至60℃的温度下进行16小时,然后在具有0.1
×
ssc的盐浓度的溶液中进行清洗。
[0130]
所述(a2)、(b2)或(c2)的dna优选地分别由与seq id no:1、3或5中阐述的碱基序列具有95%或更高、特别是98%或更高、特别是99%或更高同一性的碱基序列形成。
[0131]
所述(a5)、(b5)或(c5)的dna优选地分别编码由与seq id no:2、4或6中阐述的氨基酸序列具有95%或更高、特别是98%或更高、特别是99%或更高同一性的氨基酸序列形成的多肽。
[0132]
在本发明中,数目“一个或多个氨基酸”是例如1至5个,特别是1至3个,特别是1或2
个,特别是1个。所述多个包含几个。
[0133]
待测试的多肽具有乳酸利用酶活性这一事实,通过将所述待测试的多肽和其他两个野生型乳酸利用酶与5mm乳酸在120μg/ml的吩嗪硫酸甲酯(pms)和60μg/ml的3-(4,5-二甲基噻唑基-2)-2,5-二苯基溴化四唑(mtt)存在下进行反应,并检测570nm处的吸光度增加来核实。与其中乳酸被氧化成丙酮酸的乳酸氧化酶反应一起,mtt在pms存在下被还原成甲瓒,因此570nm处的吸光度增加。当所述待测试的多肽显示出即使是轻微的570nm处的吸光度的增加时,判断形成的乳酸利用酶复合体显示出乳酸氧化酶活性,并因此判断所述待测试的多肽具有乳酸利用酶活性。
[0134]
例如,当所述待测试的多肽是由与seq id no:1相似的碱基序列编码的多肽时,将所述待测试的多肽、由seq id no:2编码的多肽和由seq id no:3编码的多肽与乳酸在pms和mtt存在下进行反应。
[0135]
(2-2)乳酸利用酶基因的破坏
[0136]
在本发明的重组嗜氢菌属细菌中,基因组上的上述三个乳酸利用酶基因中的一者或多者被破坏。结果,具有活性的乳酸利用酶复合体不会形成,或者活性低于野生型乳酸利用酶复合体的活性。
[0137]
在本发明中,所述重组嗜氢菌属细菌不形成具有活性的乳酸利用酶复合体或形成与野生型乳酸利用酶复合体相比具有更低活性的乳酸利用酶复合体这一事实,可以通过所述重组嗜氢菌属细菌不能在含有乳酸作为唯一碳源的培养基中生长或具有比野生菌株更低的生长速率这一事实来核实。
[0138]
为了破坏乳酸利用酶基因,缺失所述乳酸利用酶基因的全部或一部分通常是适合的。乳酸利用酶基因可以通过在基因中插入一些核苷酸、寡核苷酸或多核苷酸来破坏。当基因破坏通过晚些时候描述的同源重组进行时,将正选择标志物基因插入到所述乳酸利用酶基因中是适合的。可以将所述乳酸利用酶基因的全部或一部分用其他核苷酸、寡核苷酸或多核苷酸替换。
[0139]
如上所述,通过一个或多个核苷酸的缺失、添加(包括插入)、替换或其组合(在后文中有时被称为“突变”)来破坏所述乳酸利用酶基因是适合的。当引入多个核苷酸的缺失、添加(包括插入)或替换时,所述突变可以被引入到所述基因中的一个位点处,或者可以被分散地引入到其中的多个位点处。
[0140]
优选地,待缺失、添加(包括插入)或替换的核苷酸的数量为3个或更多,特别是5个或更多,特别是10个或更多,特别是20个或更多,特别是50个或更多。优选地,被缺失、添加(包括插入)或替换的核苷酸的数量对应于所述基因的全长的1%或更多,特别是5%或更多,特别是10%或更多,特别是50%或更多。这确保了所述乳酸利用酶基因的破坏。所述乳酸利用酶基因的全长(即所述乳酸利用酶基因的组成核苷酸数量的100%)可以被缺失或替换。在添加(包括插入)的情况下,可以添加多达100,000个核苷酸。可以添加多达1,000个或多达100个核苷酸。
[0141]
除了缺失整个所述乳酸利用酶基因的情况之外,理想情况下上述突变被引入到编码所述乳酸利用酶的c-端附近的区域之外的位点处。这有助于所述乳酸利用酶基因功能的丧失或降低。例如,理想情况下,上述突变被引入到编码从所述乳酸利用酶的n-端起对应于全长的95%或更小、特别是90%或更小、特别是80%或更小的区域中。当编码所述乳酸利用
酶的n-端附近的区域被突变时,在许多情况下所述多肽不表达或所述多肽不具有正常的高级结构,因此可以将上述突变引入到编码所述乳酸利用酶的n-端附近的区域中。
[0142]
例如,通过经pcr等产生被破坏的乳酸利用酶基因,并将所述被破坏的基因引入到母体菌株中以引起所述被破坏的基因与基因组上的基因之间的同源重组,可以将染色体上的乳酸利用酶基因用所述被破坏的基因替换。
[0143]
基于同源重组的基因破坏方法本身是公知的,但在嗜氢菌属细菌中利用同源重组来修饰基因组上的基因是前所未有的。本发明的发明人鉴定到一种在嗜氢菌属细菌中起作用并且可以用作正选择标志物的潮霉素抗性基因,并且鉴定到一种在嗜氢菌属细菌中(特别是在链霉素抗性菌株中)起作用并且可以用作反选择标志物的链霉素敏感基因。因此,通过使用这些基因,可以通过同源重组破坏嗜氢菌属细菌的乳酸利用酶基因。
[0144]
在这种方法中,可以例如使用由seq id no:7中阐述的碱基序列形成的链霉素敏感基因作为反选择标志物。在这种方法中,可以例如使用由seq id no:8中阐述的碱基序列形成的潮霉素抗性基因作为在嗜氢菌属细菌中起作用的正选择标志物基因。
[0145]
下面以涉及缺失乳酸利用酶基因内的部分区域的方法为例描述破坏乳酸利用酶基因的方法。图1是这种方法的图示说明。
[0146]
在适合情况下,使用嗜氢菌属细菌的基因组dna作为模板,通过进行pcr分别扩增由嗜氢菌属细菌的乳酸利用酶基因形成的dna片段的待缺失区域的5’上游dna区域和同一待缺失区域的3’dna下游区域,并将通过所述5’上游区域与3’下游区域彼此相连而获得的dna连接到可以在宿主例如大肠埃希氏杆菌中使用的载体。所述通过将待缺失区域的5’上游区域与3’下游区域彼此相连而获得的dna,是其中乳酸利用酶基因的内部已被缺失的dna。
[0147]
为了提高同源重组效率,优选地所述5’上游dna区域和3’下游dna区域由10或更多个核苷酸、优选为50或更多个核苷酸、更优选为100或更多个核苷酸组成。或者,所述待彼此连接的dna不必分别由与所述待缺失区域的5’上游区域和所述待缺失区域的3’下游区域完全相同的碱基序列形成,并且随着用于同源重组的区域的长度增加,同源重组可以利用与所述待缺失区域的5’上游区域或3’下游区域更低的同一性来引起。
[0148]
然后,产生待插入到在载体上彼此相连的所述待缺失区域的5’上游区域与3’下游区域之间的标志物盒。在这里,所述标志物盒使得在嗜氢菌属细菌中起作用的链霉素敏感基因和在嗜氢菌属细菌中起作用的潮霉素抗性基因彼此相邻连接,或在其间插入有约10,000个碱基对或更小的dna。
[0149]
然后,在适合情况下,将所述标志物盒插入到载体上的待缺失区域的5’上游区域与3’下游区域之间,在所述载体中已插入有其中所述乳酸利用酶基因的内部已被缺失的dna片段。此外,在适合情况下,按照常规方法,用得到的载体转化宿主,并从转化体提取所述载体。
[0150]
然后,在适合情况下,通过用限制性酶切割所述载体的部分或所述载体与5’上游区域或3’下游区域之间的边界,将所述载体线性化,由此提供标记dna片段。所述切割的进行使所述标志物盒处于被插入到所述待缺失区域的5’上游区域与3’下游区域之间的状态下。因此得到其中插入有所述标志物盒的标记dna片段,在所述标志物盒中含有链霉素敏感基因的dna片段和含有潮霉素抗性基因的dna片段彼此相连。
[0151]
在适合情况下,进行将所述标记dna片段引入到嗜氢菌属细菌的链霉素抗性菌株中的操作,并通过使用潮霉素抗性的存在作为指标,选择其中所述链霉素抗性菌株的乳酸利用酶基因已被所述标记dna片段替换的每个转化体。
[0152]
dna在嗜氢菌属细菌细胞中的引入可以通过已知方法来进行,例如氯化钙法、磷酸钙法、deae-葡聚糖介导的转染法或电脉冲法。
[0153]
然后,为了消除所述插入到内部区段已被缺失的乳酸利用酶基因中的标志物盒,使用先前产生的其中乳酸利用酶基因内的区段已被缺失的dna片段进行同源重组。
[0154]
通过以不分开所述缺失的乳酸利用酶基因的方式进行切割,将所述其中插入有内部区段已被缺失的乳酸利用酶基因的载体线性化。在适合情况下,进行将所述线性dna片段引入到链霉素敏感菌株(其中乳酸利用酶基因已被所述标记dna片段替换的每个重组体)中的操作,并选择已变成链霉素抗性的菌株。选择具有链霉素抗性并且已失去潮霉素抗性的菌株也是优选的。因此获得了插入到乳酸利用酶基因中的标志物盒已被消除的重组体,也就是说在所述乳酸利用酶基因内具有缺失的重组体。
[0155]
在适合情况下,确定得到的重组体的乳酸利用酶基因的碱基序列,以核实所述基因内部的缺失。
[0156]
由于所述乳酸利用酶基因内部的区段缺失,所述重组体与嗜氢菌属细菌的母体菌株相比在使用乳酸作为唯一碳源的培养基中生长速率降低,或在其中不生长。
[0157]
(3)乳酸利用酶基因被破坏的菌株的转化体
[0158]
(3-1)乳酸脱氢酶基因
·
苹果酸/乳酸脱氢酶基因
[0159]
本发明的重组体是作为上述嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株并在其中引入有乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因的重组体。换句话说,这种重组体在基因组上具有被破坏的乳酸利用酶基因,并具有外源乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因。所述苹果酸/乳酸脱氢酶是具有乳酸脱氢酶活性的酶。可以引入两种或更多种乳酸脱氢酶基因,并且可以引入两种或更多种苹果酸/乳酸脱氢酶基因。
[0160]
野生型嗜氢菌属细菌的基因组上的乳酸利用酶基因可以在引入所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因之前被破坏,或者所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因可以在基因组上的乳酸利用酶基因被破坏之前引入到野生型嗜氢菌属细菌中。
[0161]
从良好的乳酸生产效率的观点来看,所述乳酸脱氢酶基因优选为(d1)热葡萄糖苷酶副地芽孢杆菌的ldh基因、嗜热地芽孢杆菌的ldh基因或嗜热栖热菌的ldh基因。
[0162]
热葡萄糖苷酶副地芽孢杆菌的ldh基因的碱基序列阐述在seq id no:9中,嗜热地芽孢杆菌的ldh基因的碱基序列阐述在seq id no:10中,并且嗜热栖热菌的ldh基因的碱基序列阐述在seq id no:11中。
[0163]
也可以优选地使用(d2)由与seq id no:9、10或11中阐述的碱基序列形成的dna具有90%或更高、特别是95%或更高、特别是98%或更高、特别是99%或更高同一性的碱基序列形成,并编码具有乳酸脱氢酶活性的多肽的dna。
[0164]
也可以优选地使用(d3)在严紧条件下与由seq id no:9、10或11的互补碱基序列形成的dna杂交,并编码具有乳酸脱氢酶活性的多肽的dna。
[0165]
也可以优选地使用(d4)编码由seq id no:12、13或14中阐述的氨基酸序列形成的
多肽的dna。seq id no:12阐述了热葡萄糖苷酶副地芽孢杆菌的乳酸脱氢酶的氨基酸序列,seq id no:13阐述了嗜热地芽孢杆菌的乳酸脱氢酶的氨基酸序列,并且seq id no:14阐述了嗜热栖热菌的乳酸脱氢酶的氨基酸序列。
[0166]
也可以优选地使用(d5)编码由与seq id no:12、13或14具有90%或更高、特别是95%或更高、特别是98%或更高、特别是99%或更高同一性的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna。
[0167]
也可以优选地使用(d6)编码由在seq id no:12、13或14中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna。
[0168]
从良好的乳酸生产效率的观点来看,所述苹果酸/乳酸脱氢酶基因优选为(e1)嗜热栖热菌的mldh基因和红色亚栖热菌的mldh-1和mldh-2基因中的任一者。
[0169]
嗜热栖热菌的mldh基因的碱基序列阐述在seq id no:15中,红色亚栖热菌的mldh-1基因的碱基序列阐述在seq id no:16中,并且红色亚栖热菌的mldh-2基因的碱基序列阐述在seq id no:17中。
[0170]
也可以优选地使用(e2)由与seq id no:15、16或17中阐述的碱基序列形成的dna具有90%或更高、特别是95%或更高、特别是98%或更高、特别是99%或更高同一性的碱基序列形成,并编码具有乳酸脱氢酶活性的多肽的dna;或(e3)在严紧条件下与由seq id no:15、16或17的互补碱基序列形成的dna杂交,并编码具有乳酸脱氢酶活性的多肽的dna。
[0171]
所述苹果酸/乳酸脱氢酶具有苹果酸脱氢酶活性和乳酸脱氢酶活性两者,但在本发明中,所述苹果酸/乳酸脱氢酶通过乳酸脱氢酶活性的存在来鉴定。
[0172]
也可以优选地使用(e4)编码由seq id no:18、19或20中阐述的氨基酸序列形成的多肽的dna。seq id no:18阐述了由嗜热栖热菌的苹果酸/乳酸脱氢酶(mldh)基因编码的氨基酸序列,seq id no:19阐述了由红色亚栖热菌的苹果酸/乳酸脱氢酶(mldh-1)基因编码的氨基酸序列,并且seq id no:20阐述了由红色亚栖热菌的苹果酸/乳酸脱氢酶(mldh-2)基因编码的氨基酸序列。
[0173]
也可以优选地使用(e5)编码由与seq id no:18、19或20具有90%或更高、特别是95%或更高、特别是98%或更高、特别是99%或更高同一性的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna dna;或(e6)编码由在seq id no:18、19或20中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸脱氢酶活性的多肽的dna。
[0174]
在本发明中,多肽具有乳酸脱氢酶活性这一事实,通过将待测试的多肽与丙酮酸在nadh存在下进行反应,并检测340nm处的吸光度的降低来核实。乳酸脱氢酶从丙酮酸产生乳酸。在从丙酮酸生产乳酸中乳酸脱氢酶消耗nadh,因此使用340nm处的吸光度的降低作为指标来检测nadh量的减少。具体来说,执行在“实施例”章节中描述的方法。当所述待测试的多肽即使是轻微降低340nm处的吸光度时,也判断所述多肽具有乳酸脱氢酶活性。
[0175]
(3-2)乳酸透性酶基因
[0176]
本发明涵盖了作为上述嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株,并在其中引入有乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及乳酸透性酶基因的重组体。换句话说,所述重组体在基因组上具有被破坏的乳酸利用酶基因,并具有外源或非本源的乳酸
脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及外源或非本源的乳酸透性酶基因。
[0177]
可以引入一种或两种或更多种的乳酸脱氢酶基因、苹果酸/乳酸脱氢酶基因和乳酸透性酶基因中的每一者。
[0178]
所述野生型嗜氢菌属细菌的基因组上的乳酸利用酶基因可以在引入所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及乳酸透性酶基因之前被破坏,或者所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及乳酸透性酶基因可以在基因组上的乳酸利用酶基因被破坏之前引入到所述野生型嗜氢菌属细菌中。所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因可以在基因组上的乳酸利用酶基因被破坏之前引入到所述野生型嗜氢菌属细菌中,然后引入所述乳酸透性酶基因,或者所述乳酸透性酶基因可以在基因组上的乳酸利用酶基因被破坏之前引入到所述野生型嗜氢菌属细菌中,然后引入所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因。
[0179]
从嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株的良好的乳酸分泌效率的观点来看,所述乳酸透性酶基因优选为(f1)嗜热地芽孢杆菌的lutp基因。
[0180]
嗜热地芽孢杆菌的lutp基因的碱基序列阐述在seq id no:21中。
[0181]
也可以优选地使用(f2)由与seq id no:21中阐述的碱基序列形成的dna具有90%或更高、特别是95%或更高、特别是98%或更高、特别是99%或更高同一性的碱基序列形成,并编码具有乳酸透性酶活性的多肽的dna。
[0182]
也可以优选地使用(f3)在严紧条件下与由seq id no:21的互补碱基序列形成的dna杂交,并编码具有乳酸透性酶活性的多肽的dna。
[0183]
也可以优选地使用(f4)编码由seq id no:22中阐述的氨基酸序列形成的多肽的dna。seq id no:22阐述了嗜热地芽孢杆菌的乳酸透性酶(lutp)的氨基酸序列。
[0184]
也可以优选地使用(f5)编码由与seq id no:22具有90%或更高、特别是95%或更高、特别是98%或更高、特别是99%或更高同一性的氨基酸序列形成并具有乳酸透性酶活性的多肽的dna。
[0185]
也可以优选地使用(f6)编码由在seq id no:22中阐述的氨基酸序列中具有一个或多个氨基酸缺失、替换或添加的氨基酸序列形成并具有乳酸透性酶活性的多肽的dna。
[0186]
在本发明中,待测试的多肽具有乳酸透性酶活性这一事实,通过当将编码所述待测试的多肽的dna引入到大肠埃希氏杆菌中然后培养时,与引入之前的宿主相比培养上清液中乳酸的生产量提高这一事实来核实。大肠埃希氏杆菌被用作宿主是因为大肠埃希氏杆菌具有乳酸脱氢酶基因并产生乳酸。
[0187]
(3-3)产生转化体的方法
[0188]
对获得转化体的方法进行了描述,所述方法包括将乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及乳酸透性酶基因引入到充当宿主的嗜氢菌属细菌的野生菌株或乳酸利用酶基因被破坏的菌株中。
[0189]
用于将上述dna引入到宿主中的质粒载体应该含有控制嗜氢菌属细菌内的自主复制功能的dna,实例包括广宿主范围载体prk415(genbank:ef437940.1)、pbhr1(genbank:y14439.1)、pmmb67eh(atcc 37622)、pcar1(ncbi参考序列:nc_004444.1)、pc194(ncbi参考序列:nc_002013.1)、pk18mobsacb(genbank:fj437239.1)、pub110(ncbi参考序列:nc_001384.1)等。
[0190]
优选的启动子的实例包括tac启动子、lac启动子、trc启动子或来自于oxford genetics ltd的启动子oxb1和oxb11至oxb20中的每一者。优选的终止子的实例包括大肠埃希氏杆菌rrna操纵子rrnb的t1t2终止子、λ噬菌体的t0转录终止子、t7终止子等。
[0191]
转化可以通过公知的方法来进行,例如氯化钙法、磷酸钙法、deae-葡聚糖转染法和电脉冲法。
[0192]
嗜氢菌属细菌在自养条件下生长。然而,由于它们也可以在异养条件下生长,因此用于培养嗜氢菌属细菌、嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株或嗜氢菌属细菌转化体的培养基可以是无机培养基或有机培养基。可以使用包含糖、有机酸、氨基酸等的有机培养基。然而,乳酸利用酶基因被破坏的菌株不具有乳酸利用能力或具有降低的乳酸利用能力,因此理想情况下不将含有乳酸作为唯一碳源的培养基用于培养所述菌株。培养基的ph可以被调整到大约6.2至8。
[0193]
在任何情况下,培养可以在供应含有氢气、氧气和二氧化碳的气体混合物、优选为由氢气、氧气和二氧化碳组成的气体混合物的同时进行。当使用有机培养基时,可以将含有氢气、氧气和二氧化碳的气体混合物例如空气用于通气。当不供应二氧化碳气体时,可以使用含有碳酸盐作为碳源的培养基。混合气体可以被捕获在气密培养容器内或连续供应到气密培养容器中,并且可以利用振摇培养溶解在培养基中。可选地,所述培养容器可以是气密或开放式的,并且可以通过鼓泡将混合气体溶解在培养基中。
[0194]
所述供应气体中氢气、氧气和二氧化碳的体积比(氢气:氧气:二氧化碳)优选为1.75至7.5:1:0.25至3,更优选为5至7.5:1:1至2,更优选为6.25至7.5:1:1.5。嗜氢菌属细菌是嗜热细菌,因此培养温度优选为35至55℃,更优选为37至52℃,甚至更优选为50至52℃。
[0195]
当所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及所述乳酸透性酶基因两者均被引入到所述乳酸利用酶基因被破坏的菌株中时,所述乳酸透性酶基因可以通过将所述乳酸脱氢酶基因和/或苹果酸/乳酸脱氢酶基因以及所述乳酸透性酶基因克隆到同一质粒载体中来引入,或者可以通过克隆到不同质粒载体中来引入。
[0196]
所述乳酸脱氢酶基因、苹果酸/乳酸脱氢酶基因和乳酸透性酶基因可以各自通过同源重组等并入到所述嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株的基因组上。
[0197]
(4)生产乳酸的方法
[0198]
当使用上述嗜氢菌属细菌的转化体生产乳酸时,所述转化体可以使用无机或有机培养基培养,同时供应含有氢气、氧气和二氧化碳的气体混合物。
[0199]
所述供应的气体优选为由氢气、氧气和二氧化碳组成的气体混合物。然而,可以在其中混合不同种类的气体,只要可以高效生产乳酸即可。
[0200]
嗜氢菌属细菌可以使用氢气作为能源并使用二氧化碳作为唯一碳源生长,因此,通过基本上仅使用二氧化碳(特别是通过仅使用二氧化碳)作为碳源生产上述化合物,二氧化碳可以被特别高效地固定。因此,使用不含诸如有机物质和碳酸盐的碳源的无机培养基,即基本上仅使用二氧化碳(特别是仅使用二氧化碳)作为碳源进行培养是优选的。“基本上仅使用二氧化碳作为碳源”涵盖了其中混合有不可避免的量的其他碳源的情况。此外,也可以使用含有有机物质例如糖、有机酸和氨基酸以及碳酸盐的培养基,而不供应二氧化碳。
[0201]
所述培养基的ph优选为6.2至8,更优选为6.4至7.4,更优选为6.6至7。当ph在该范
围内时,细菌生长良好且混合气体在培养基中溶解良好,并且可以高效生产乳酸。
[0202]
当使用分批培养时,混合气体可以被捕获在气密培养容器内,并且可以进行静置培养或振摇培养。当使用连续培养时,混合气体可以被连续供应到气密培养容器中并且可以进行振摇培养,或者可以使用气密培养容器培养重组体,同时通过鼓泡将混合气体引入到培养基中。振摇培养是优选的,因为可以实现混合气体在培养基中的更好溶解。
[0203]
所述供应气体混合物中氢气、氧气和二氧化碳的体积比(氢气:氧气:二氧化碳)优选为1.75至7.5:1:0.25至3,更优选为5至7.5:1:1至2,甚至更优选为6.25至7.5:1:1.5。当体积比在这个范围内时,细菌生长良好,并且可以高效生产目标化合物。
[0204]
混合气体或原料气体的供应速率可以是每1l培养基10.5至60l/小时,特别是10.5至40l/小时,特别是10.5至21l/小时。当供应速率在这个范围内时,转化体生长良好,可以高效生产目标化合物,并且可以减少废混合气体的量。
[0205]
培养温度优选为35至55℃,更优选为37至52℃,甚至更优选为50至52℃。当温度在这个范围内时,转化体生长良好,并且可以高效生产乳酸。
[0206]
通过以上述方式进行培养,在反应溶液中产生目标化合物乳酸。收集所述反应溶液能够回收乳酸,然而,也可以通过遵照公知方法从所述反应溶液进一步分离乳酸。此类公知方法包括沉淀法、分馏和电渗析。
[0207]
实施例
[0208]
接下来将参考实施例进一步详细描述本发明,但本发明不限于这些实施例。
[0209]
(1)链霉素抗性菌株的获取
[0210]
使用铂环将hydrogenophilus thermoluteolus th-1菌株(nbrc14978)(在后文中有时被称为“th-1菌株”)接种在其中放置有5ml a液体培养基[在1l蒸馏水中溶解有3.0g(nh4)2so4、1.0g kh2po4、2.0g k2hpo4、0.25g nacl、0.014g feso4·
7h2o、0.5g mgso4·
7h2o、0.03g cacl2、4.0mg moo3、28mg znso4·
7h2o、2.0mg cuso4·
5h2o、4.0mg h3bo3、4.0mg mnso4·
5h2o和4.0mg cocl2·
6h2o(ph 7.0)]的试管中,所述试管充有h2:o2:co2=7.5:1:1.5的混合气体,并在50℃进行振摇培养。24小时后,将培养液施加到含有500μg/ml链霉素的a固体培养基[在1l蒸馏水中溶解有3.0g(nh4)2so4、1.0g kh2po4、2.0g k2hpo4、0.25g nacl、0.014g feso4·
7h2o、0.5g mgso4·
7h2o、0.03g cacl2、4.0mg moo3、28mg znso4·
7h2o、2.0mg cuso4·
5h2o、4.0mg h3bo3、4.0mg mnso4·
5h2o、4.0mg cocl2·
6h2o和15g琼脂(ph 7.0)]上,并在充有h2:o2:co2=7.5:1:1.5的混合气体的培养箱中在50℃培养60小时。
[0211]
结果,在含有500μg/ml链霉素的a固体培养基上能够识别出三个菌落的形成。这些生长的菌株是th-1菌株的链霉素抗性菌株,并且所述菌株之一被命名为noc269菌株。
[0212]
(2)标志物盒的构建
[0213]
(2-1)反选择标志物的制备
[0214]
按照常规方法从th-1菌株的野生菌株(链霉素敏感菌株)提取基因组dna。使用所述提取的基因组dna作为模板,通过pcr方法扩增含有rpsl基因的dna片段,所述基因是编码核糖体蛋白s12的链霉素敏感基因。将下述引物用于所述pcr。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,通过常规方法来进行。
[0215]
用于扩增th-1菌株的野生型rpsl基因的引物:
[0216]
(a-1)5
’‑
atacgcgtcctccgatgcgtcgtaagggaaacgtc-3’(seq id no:23)
[0217]
(b-1)5
’‑
atagtcgacttatttcttgcccgcagcggcgcccg-3’(seq id no:24)
[0218]
引物(a-1)添加有mlui限制性酶位点,引物(b-1)添加有sali限制性酶位点。
[0219]
(2-2)正选择标志物的制备
[0220]
使用含有潮霉素抗性基因(在后文中有时被称为“hph”)序列的质粒pjr225(genbank:k01193)[gene,25,179-188(1983)]的dna作为模板,通过pcr方法扩增含有所述hph基因的dna片段。将下述引物用于所述pcr。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,通过常规方法来进行。
[0221]
用于扩增hph基因的引物:
[0222]
(a-2)5
’‑
atactcgaggagatgacgttggaggggcaaggtcg-3’(seq id no:25)
[0223]
(b-2)5
’‑
atacgcgtctattcctttgccctcggacgagtgct-3’(seq id no:26)
[0224]
引物(a-2)添加有xhoi限制性酶位点,引物(b-2)添加有mlui限制性酶位点。
[0225]
使用1%琼脂糖凝胶对通过上述每个pcr产生的反应液进行电泳。结果,当使用th-1菌株的基因组dna作为模板时,检测到对应于rpsl基因的约0.5-kbp dna片段,而当使用pjr225质粒dna作为模板时,检测到对应于hph基因的约1.0-kbp dna片段。
[0226]
将由此制备的含有rpsl基因的dna片段和含有hph基因的dna片段分别用限制性酶sali和限制性酶xhoi切割,并与已用限制性酶smai切割的大肠埃希氏杆菌质粒载体puc19(genbank:m77789.2)混合,然后使用t4 dna连接酶(由takara bio inc.制造)彼此连接。
[0227]
通过氯化钙法用得到的连接溶液转化大肠埃希氏杆菌jm109,并将转化体施加到含有50μg/ml氨苄青霉素和50μg/ml潮霉素的lb琼脂培养基上。通过常规方法对在所述培养基上生长的菌株进行液体培养,从培养液提取质粒dna,并将质粒用限制性酶mlui切割。由此鉴定插入的片段。结果,除了puc19载体的约2.7-kbp dna片段之外,还发现了对应于彼此相连的rpsl基因和hph基因的序列的约1.5-kbp dna片段。
[0228]
所构建的含有其中rpsl基因和hph基因彼此相连的标志物盒的质粒被命名为puc-sms·
hmr。
[0229]
(3)宿主的乳酸利用酶基因的破坏
[0230]
(3-1)用于破坏hptl_1695基因的dna的构建
[0231]
使用th-1菌株的野生菌株的基因组dna作为模板,通过pcr方法扩增对应于hptl_1695基因的待缺失区域的5
’‑
上游和3
’‑
下游区域的dna片段。将下述引物用于所述pcr。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,通过常规方法来进行。
[0232]
用于扩增hptl_1695基因的待缺失区域的5
’‑
上游区域的引物
[0233]
(a-3)5
’‑
cgcgaattcatggctacccaaccccgcgtcggtct-3’(seq id no:27)
[0234]
(b-3)5
’‑
cgcacgcgttggagtgcggctggtcatcgggtgac-3’(seq id no:28)
[0235]
引物(a-3)添加有ecori限制性酶位点,引物(b-3)添加有mlui限制性酶位点。
[0236]
用于扩增hptl_1695基因的待缺失区域的3
’‑
下游区域的引物
[0237]
(a-4)5
’‑
gcacgcgtctgcagaacggaggcgagcgatgaacg-3’(seq id no:29)
[0238]
(b-4)5
’‑
cgcgcatgctcaggggatcaagaagacgtgcaccc-3’(seq id no:30)
technologies corporation制造的“dna热循环仪”并使用takara ex taq(由takara bio inc.制造)作为反应试剂,通过常规方法来进行。
[0253]
用于扩增含有hptl_1695基因的区域的引物
[0254]
(a-5)5
’‑
cgcgaattcatggctacccaaccccgcgtcggtct-3’(seq id no:31)
[0255]
(b-5)5
’‑
cgcgcatgctcaggggatcaagaagacgtgcaccc-3’(seq id no:32)
[0256]
使用1%琼脂糖凝胶对得到的反应混合物进行电泳。结果,检测到对应于在hptl_1695基因中插入有标志物盒的序列的大约3.1-kbp dna片段。在这个菌株中,标志物盒被插入到hptl_1695基因中。也就是说,得到了其中hptl_1695基因用标志物标记的菌株。
[0257]
(3-4)hptl_1695基因的破坏(反选择)
[0258]
通过用限制性酶ecori和sphi切割将在(3-1)中制备的环状质粒pδhptl_1695线性化。通过电脉冲法(电穿孔法)用得到的线性pδhptl_1695转化在(3-3)中得到的hptl_1695基因被标记的菌株。将转化体转移到含有500μg/ml链霉素的a固体培养基上,并在充有h2:o2:co2=7.5:1:1.5的混合气体的培养箱中在50℃培养60小时。
[0259]
将每个在所述a固体培养基上生长的菌株在含有100μg/ml潮霉素或500μg/ml链霉素的a固体培养基上重新划线,并在充有h2:o2:co2=7.5:1:1.5的混合气体的培养箱中在50℃培养60小时。
[0260]
使用作为上述步骤的结果获得的潮霉素敏感和链霉素抗性菌株作为模板,通过菌落pcr方法扩增含有hptl_1695基因的dna区域。所述菌落pcr通过与(3-3)中相同的方法来进行。
[0261]
使用1%琼脂糖凝胶对得到的反应混合物进行电泳。结果,检测到在hptl_1695基因被(3-1)的处于其中hptl_1695基因内的区段已被缺失的状态下的dna片段替换的情况下会扩增的大约1.6-kbp dna片段。也就是说,hptl_1695基因内的区段已被缺失,因此hptl_1695基因已被破坏。其中hptl_1695基因被破坏的菌株被命名为noc373菌株。
[0262]
在所述noc373菌株中,th-1菌株的hptl_1695基因的碱基序列(seq id no:3)的第19至1410号碱基的区域被acgcgtctgcag(seq id no:33)替换。这对应于th-1菌株的由hptl_1695基因编码的多肽的氨基酸序列(seq id no:4)的第7至470号氨基酸的区域被trlq(seq id no:34)替换。
[0263]
(3-5)noc373菌株的乳酸利用性能的确定
[0264]
在所述noc373菌株中,hptl_1695基因被破坏。其中hptl_1695基因被破坏的noc373菌株是否已丧失乳酸利用性能如下所述来确定。
[0265]
将noc373菌株和充当noc373菌株的母体菌株的noc269菌株各自在含有30mm乳酸钠作为唯一碳源的a固体培养基上划线,并在50℃培养60小时。结果发现,充当母体菌株的noc269菌株在含有30mm乳酸钠的a固体培养基上生长,但其中hptl_1695基因被破坏的noc373菌株完全不生长。也就是说,通过破坏hptl_1695基因,noc373菌株失去了其原始的乳酸利用能力。因此确认了hptl_1695基因确实是乳酸利用酶基因。
[0266]
(4)乳酸脱氢酶基因
·
苹果酸/乳酸脱氢酶基因的引入
[0267]
(4-1)质粒载体的构建
[0268]
下面描述常用于引入提供乳酸生产能力的基因的质粒载体的构建方法。
[0269]
首先,使用广宿主范围载体prk415(genbank:ef437940.1)(gene,70,191-197
(1998))作为模板并进行pcr。为了扩增不包括四环素基因区域的质粒区域的dna片段,合成并使用了下述引物对。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,通过常规方法来进行。
[0270]
用于扩增prk415质粒序列的引物
[0271]
(a-6)5
’‑
cgtggccaactaggcccagccagatactcccgatc-3’(seq id no:35)
[0272]
(b-6)5
’‑
tgaggcctcattggccggagcgcaacccactcact-3’(seq id no:36)
[0273]
sfii限制性位点已被添加到引物(a-6)和(b-6)。
[0274]
使用含有新霉素/卡那霉素抗性基因(在后文中,所述基因可以被称为“nptii”)的质粒pk18mobsacb(genbank:fj437239.1)(gene,145,69-73(1994))作为模板并按照常规方法进行pcr。在所述pcr中合成并使用了下述引物对以扩增含有nptii基因序列的dna片段。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,通过常规方法来进行。
[0275]
用于扩增nptii基因序列的引物
[0276]
(a-7)5
’‑
ctgggcctagttggccacgtagaaagccagtccgc-3’(seq id no:37)
[0277]
(b-7)5
’‑
tccggccaatgaggcctcagaagaactcgtcaaga-3’(seq id no:38)
[0278]
sfii限制性位点已被添加到引物(a-7)和(b-7)。
[0279]
使用1%琼脂糖凝胶对通过每个上述pcr产生的反应溶液进行电泳,结果,当使用prk415质粒作为模板时检测到大约8.7-kb的dna片段,并在使用nptii基因作为模板时检测到大约1.1-kb的dna片段。
[0280]
将由此制备的dna片段各自用限制性酶sfii切割,并与t4 dna连接酶(由takara bio inc.制造)反应,以获得连接溶液。通过氯化钙法(journal of molecular biology,53,159-162(1970))用得到的连接溶液转化大肠埃希氏杆菌jm109,并将转化体施加到含有50μg/ml卡那霉素的lb琼脂培养基上。将可以在所述培养基上存活的菌株通过常规方法在液体培养基中培养,并从得到的培养液提取质粒dna。将该质粒dna用限制性酶sfii切割,并确认插入的片段。结果,除了源自于prk415质粒的大约2.0-kb、3.0-kb和3.7-kb的dna片段之外,还观察到大约1.1-kb的nptii基因序列的dna片段。
[0281]
所构建的质粒被命名为pcyk01。
[0282]
(4-2)用于基因表达的克隆载体的构建
[0283]
(4-2-1)λt0终止子序列的dna片段的制备
[0284]
合成了下述引物对并用于pcr中,以便制备具有λt0终止子序列的dna。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂来进行。没有包含模板dna,因为延伸使用每个引物作为另一个引物的模板来进行。
[0285]
用于制备λt0终止子序列的引物
[0286]
(a-8)5
’‑
gcattaatccttggactcctgttgatagatccagtaatgacctcagaactccatctggatttgttcagaacgctcggttgccg-3’(seq id no:39)
[0287]
(b-8)5
’‑
caccgtgcagtcgatggatctggattctcaccaataaaaaacgcccggcggcaaccgagcgttctgaacaaatccagatggag-3’(seq id no:40)
[0288]
引物(a-8)和(b-8)的3’末端的碱基序列彼此互补。
[0289]
使用1%琼脂糖凝胶对产生的反应溶液进行电泳,结果,检测到对应于λt0终止子序列的大约0.13-kb的dna片段。
[0290]
(4-2-2)tac启动子序列的dna片段的制备
[0291]
pcr使用含有tac启动子的质粒pmal-c5x(由new england biolabs inc.制造)作为模板来进行。在所述pcr中,合成并使用了下述引物对以便扩增tac启动子序列。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,按照常规方法来进行。
[0292]
用于扩增tac启动子序列的引物
[0293]
(a-9)5
’‑
ttattggtgagaatccagatccatcgactgcacggtgcaccaatgcttct-3’(seq id no:41)
[0294]
(b-9)5
’‑
gcaagcttggagtgatcatcgtatgcatatgcgtttctcctccagatccctgtttcctgtgtgaaattgt-3’(seq id no:42)
[0295]
使用1%琼脂糖凝胶对产生的反应溶液进行电泳,结果,检测到对应于tac启动子序列的大约0.3-kb的dna片段。
[0296]
(4-2-3)λt0终止子和tac启动子序列的引入
[0297]
从琼脂糖凝胶上切下在上述(4-2-1)和(4-2-2)中制备的dna片段,并通过冷冻和融化凝胶从所述凝胶回收dna。将回收的对应于λt0终止子序列和tac启动子序列的dna片段混合并用作模板,进行重叠延伸pcr。在所述重叠延伸pcr中使用上述引物(a-8)和(b-9)的组合,以便制备其中tac启动子被连接到λt0终止子下游的dna。被用于扩增模板dna片段的引物(b-8)和(a-9)的5’末端的碱基序列彼此互补。pshbi和hindiii限制性位点已被分别添加到引物(a-8)和(b-9)。
[0298]
使用1%琼脂糖凝胶对产生的反应溶液进行电泳,结果,检测到大约0.4-kb的dna片段,其对应于其中tac启动子被连接到λt0终止子下游的dna。
[0299]
将所述通过pcr扩增的其中tac启动子被连接到λt0终止子下游的大约0.4-kb dna片段和上述克隆载体pcyk01的大约9.8-kb dna片段用限制性酶pshbi和hindiii切割。使用t4 dna连接酶(由takara bio inc.制造)将所述切割的dna片段彼此连接。
[0300]
通过氯化钙法用得到的连接溶液转化大肠埃希氏杆菌jm109,并将转化体施加到含有50μg/ml卡那霉素的lb琼脂培养基上。将在所述培养基上存活的菌株通过常规方法在液体培养基中培养,并从得到的培养液提取质粒dna。将该质粒dna用限制性酶pshbi和hindiii切割并确认插入的片段。结果,除了来自于质粒pcyk01的大约9.6-kb的dna片段之外,还观察到其中tac启动子被连接到λt0终止子下游的大约0.4-kb的dna片段。
[0301]
(4-2-4)rrnb t1t2双向终止子(在后文中可以被称为“rrnb终止子”)的引入
[0302]
使用含有rrnb终止子序列的质粒pmal-c5x(由new england biolabs inc.制造)作为模板进行pcr。在所述pcr中,合成并使用了下述引物对以便扩增rrnb终止子序列。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,按照常规方法来进行。
[0303]
用于扩增rrnb终止子序列的引物
[0304]
(a-10)5
’‑
ctcgaattcactggccgtcgttttacaacgtcgtg-3’(seq id no:43)
[0305]
(b-10)5
’‑
cgcaattgagtttgtagaaacgcaaaaaggccatc-3’(seq id no:44)
[0306]
ecori和muni限制性位点已被分别添加到引物(a-10)和(b-10)。
[0307]
使用1%琼脂糖凝胶对产生的反应溶液进行电泳,结果,检测到对应于rrnb终止子序列的大约0.6-kb的dna片段。
[0308]
将通过上述pcr扩增的包含rrnb终止子序列的大约0.6-kb dna片段用限制性酶ecori和muni切割,并将在上述(4-2-3)中构建的质粒的大约10.0-kb dna片段用限制性酶ecori切割。使用t4 dna连接酶(由takara bio inc.制造)将所述切割的dna片段彼此连接。
[0309]
通过氯化钙法用得到的连接溶液转化大肠埃希氏杆菌jm109,并将得到的转化体施加到含有50μg/ml卡那霉素的lb琼脂培养基上。将在所述培养基上存活的菌株通过常规方法在液体培养基中培养,并从得到的培养液提取质粒dna。将该质粒用限制性酶ecori和muni切割,并确认插入的片段。结果,除了来自于上述(4-2-3)的质粒的大约10.0-kb的dna片段之外,还观察到对应于rrnb终止子序列的大约0.6-kb的dna片段。
[0310]
所构建的用于基因表达的克隆载体被命名为pcyk21。
[0311]
(4-3)乳酸脱氢酶基因
·
苹果酸/乳酸脱氢酶基因的引入
[0312]
(4-3-1)乳酸脱氢酶基因的克隆
[0313]
按照常规方法从热葡萄糖苷酶副地芽孢杆菌nbrc 107763、嗜热地芽孢杆菌nbrc 102445和红色亚栖热菌nbrc 106122提取基因组dna。嗜热栖热菌hb8菌株(atcc 27634)的基因组dna购自takara bio inc。
[0314]
将上述四种基因组dna各自用作模板,通过pcr方法分别扩增含有热葡萄糖苷酶副地芽孢杆菌、嗜热地芽孢杆菌和嗜热栖热菌中的每一者的乳酸脱氢酶ldh基因的dna片段和含有嗜热栖热菌和红色亚栖热菌中的每一者的苹果酸/乳酸脱氢酶mldh基因的dna片段。将下述引物用于pcr。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,按照常规方法来进行。
[0315]
用于扩增热葡萄糖苷酶副地芽孢杆菌ldh基因的引物
[0316]
(a-11)5
’‑
ttacatatgaaacaacaaggcatgaatcgagtagc-3’(seq id no:45)
[0317]
(b-11)5
’‑
ttagaattcttattttacatcatcaaaataacggg-3’(seq id no:46)
[0318]
ndei限制性位点已被添加到引物(a-11),ecori限制性位点已被添加到引物(b-11)。
[0319]
用于扩增嗜热地芽孢杆菌ldh基因的引物
[0320]
(a-12)5
’‑
ttacatatgaaaaacgggagaggaaatcgggtagc-3’(seq id no:47)
[0321]
(b-12)5
’‑
ttagaattcttactgagcaaaatagcgcgccaata-3’(seq id no:48)
[0322]
ndei限制性位点已被添加到引物(a-12),ecori限制性位点已被添加到引物(b-12)。
[0323]
用于扩增嗜热栖热菌ldh基因的引物
[0324]
(a-13)5
’‑
ttacatatgaaggtcggcatcgtgggaagcggcat-3’(seq id no:49)
[0325]
(b-13)5
’‑
ttagaattcctaaaaccccagggcgaaggccgcct-3’(seq id no:50)
[0326]
ndei限制性位点已被添加到引物(a-13),ecori限制性位点已被添加到引物(b-13)。
[0327]
用于扩增嗜热栖热菌mldh基因的引物
[0328]
(a-14)5
’‑
ttacatatgaggtggcgggcggacttcctctcggc-3’(seq id no:51)
[0329]
(b-14)5
’‑
ttagaattctcaagcatcgtccctccaaggcacgc-3’(seq id no:52)
[0330]
ndei限制性位点已被添加到引物(a-14),ecori限制性位点已被添加到引物(b-14)。
[0331]
用于扩增红色亚栖热菌mldh-1基因的引物
[0332]
(a-15)5
’‑
ttacatatgcaaggcattcctgtgcaacaactgcg-3’(seq id no:53)
[0333]
(b-15)5
’‑
ttagaattcttaaaggcccaccgctttagcggcct-3’(seq id no:54)
[0334]
ndei限制性位点已被添加到引物(a-15),ecori限制性位点已被添加到引物(b-15)。
[0335]
用于扩增红色亚栖热菌mldh-2基因的引物
[0336]
(a-18)5
’‑
ttacatatgagggttccttatcccgtactcaagca-3’(seq id no:55)
[0337]
(b-18)5
’‑
tttgaattctcatcttgtccctcctccttgtagat-3’(seq id no:56)
[0338]
ndei限制性位点已被添加到引物(a-18),ecori限制性位点已被添加到引物(b-18)。
[0339]
使用1%琼脂糖凝胶对产生的反应溶液进行电泳,并且对于热葡萄糖苷酶副地芽孢杆菌ldh基因、嗜热地芽孢杆菌ldh基因、嗜热栖热菌ldh基因、嗜热栖热菌mldh基因和红色亚栖热菌mldh-1基因和mldh-2基因中的每一者来说,检测到大约1.0-kb的dna片段。
[0340]
将通过上述pcr扩增的含有热葡萄糖苷酶副地芽孢杆菌ldh基因、嗜热地芽孢杆菌ldh基因、嗜热栖热菌ldh基因、嗜热栖热菌mldh基因和红色亚栖热菌mldh-1基因和mldh-2基因中的每一者的大约1.0-kb dna片段用限制性酶ndei和ecori切割。将上述克隆载体pcyk21的大约10.6-kb dna片段也用限制性酶ndei和ecori切割。使用t4dna连接酶(由takara bio inc.制造)将每个所述切割的1.0-kb dna片段和10.6-kb dna片段彼此连接。
[0341]
通过电脉冲法用得到的连接溶液转化hydrogenophilus thermoluteolus菌株th-1(nbrc 14978),并将得到的转化体施加到含有50μg/ml卡那霉素的a固体培养基上,并在充有h2:o2:co2=7.5:1:1.5的混合气体的培养箱中在50℃培养60小时。
[0342]
使用铂环将在所述a固体培养基上存活的每个菌株接种到含有5ml含有50μg/ml卡那霉素的a液体培养基的试管中。向所述试管填充h2:o2:co2=7.5:1:1.5的混合气体,在50℃进行振摇培养,并从培养液提取质粒dna。将分别包含热葡萄糖苷酶副地芽孢杆菌ldh基因、嗜热地芽孢杆菌ldh基因、嗜热栖热菌ldh基因、嗜热栖热菌mldh基因和红色亚栖热菌mldh-1基因和mldh-2基因的质粒用限制性酶ndei和ecori切割,并确认插入的片段。结果,除了质粒pcyk21的大约10.6-kb dna片段之外还观察到长度为大约1.0-kb的片段,它们各自是热葡萄糖苷酶副地芽孢杆菌ldh基因、嗜热地芽孢杆菌ldh基因、嗜热栖热菌ldh基因、嗜热栖热菌mldh基因和红色亚栖热菌mldh-1基因和mldh-2基因的插入片段。
[0343]
含有热葡萄糖苷酶副地芽孢杆菌ldh基因的质粒被命名为pc-pth-ldh,含有嗜热地芽孢杆菌ldh基因的质粒被命名为pc-gka-ldh,含有嗜热栖热菌ldh基因的质粒被命名为pc-tth-ldh,含有嗜热栖热菌mldh基因的质粒被命名为pc-tth-mldh,含有红色亚栖热菌mldh-1基因的质粒被命名为pc-mru-mldh-1,并且含有红色亚栖热菌mldh-2基因的质粒被命名为pc-mru-mldh-2。
[0344]
(4-3-2)乳酸脱氢酶基因
·
乳酸/苹果酸脱氢酶基因在hydrogenophilus thermoluteolus菌株中的表达的确认
[0345]
使用铂环将如上所述获得的每个引入有乳酸脱氢酶基因或苹果酸/乳酸脱氢酶基因的菌株接种到含有5ml含有50μg/ml卡那霉素的a液体培养基的试管中。向所述试管填充h2:o2:co2=7.5:1:1.5的混合气体,并在50℃振摇培养20小时。
[0346]
通过离心(4℃,15,000rpm,1分钟)收集由此培养和增殖的细菌细胞。通过超声处理破坏所述细菌细胞,随后离心(4℃,15,000rpm,5分钟)以获得细胞破坏上清液。将所述细胞破坏上清液用作粗酶液,以通过下述方法测量乳酸脱氢酶活性。将粗酶液、50mm乙酸钠(ph5.0)、0.5mm nadh、0.2mm果糖1,6-二磷酸和5mm丙酮酸钠混合,在50℃反应,跟踪来自于nadh的340nm处的吸光度的降低,并分析初始反应速率。从所述初始反应速率和蛋白质浓度计算比活性。每分钟产生1μmol乳酸的酶水平被定义为1u(单位)。
[0347]
结果,在其中引入有热葡萄糖苷酶副地芽孢杆菌ldh基因的菌株ldh03、其中引入有嗜热地芽孢杆菌ldh基因的菌株ldh04、其中引入有嗜热栖热菌ldh基因的菌株ldh05、其中引入有嗜热栖热菌mldh基因的菌株mldh01、其中引入有红色亚栖热菌mldh-1基因的菌株mldh02和其中引入有红色亚栖热菌mldh-2基因的菌株mldh03中的每一者中,检测到乳酸脱氢酶活性。
[0348]
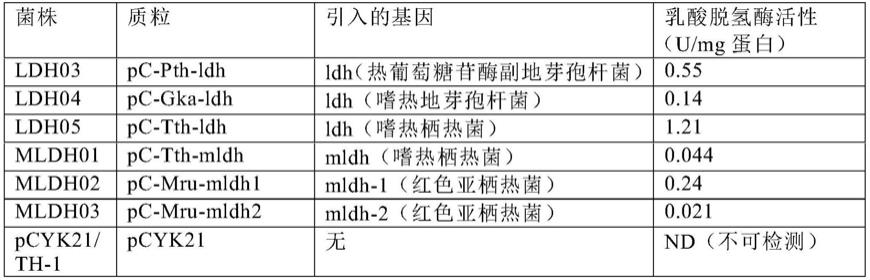
[表1]
[0349]
通过引入ldh或mldh基因而获得的hydrogenophilus thermoluteolus菌株的乳酸脱氢酶活性
[0350][0351]
表1中的转化体的宿主不是乳酸利用酶基因被破坏的菌株,而是作为野生型菌株的hydrogenophilus thermoluteolus th-1菌株。然而,揭示出每个上述ldh基因和mldh基因均在hydrogenophilus thermoluteolus中起作用,能够表达酶活性。
[0352]
(4-3-3)乳酸脱氢酶基因
·
苹果酸/乳酸脱氢酶基因在嗜氢菌属细菌的乳酸利用酶基因被破坏的菌株中的引入
[0353]
通过常规方法从具有含有嗜热栖热菌的乳酸脱氢酶基因(ldh)的pc-tth-ldh质粒的hydrogenophilus thermoluteolus ldh05(具有野生型hptl_1695)和具有含有红色亚栖热菌的苹果酸/乳酸脱氢酶基因(mldh-1)的pc-mru-mldh1质粒的hydrogenophilus thermoluteolus mldh02(具有野生型hptl_1695)提取相应的质粒,并通过电脉冲法(电穿孔法)用每种质粒转化noc373菌株(hptl_1695基因被破坏的菌株)。将转化体转移到含有50μg/ml卡那霉素的a固体培养基上,并在充有h2:o2:co2=7.5:1:1.5的混合气体的培养箱中在50℃培养60小时。
[0354]
使用铂环将在所述a固体培养基上生长的每个菌株接种到试管中,所述试管中放置有5ml含有50μg/ml卡那霉素的a液体培养基,将所述试管用h2:o2:co2=7.5:1:1.5的混合
气体装填,并在50℃进行振摇培养,然后从培养液提取质粒dna。将分别含有嗜热栖热菌的ldh基因和红色亚栖热菌的mldh-1基因的每个质粒用限制性酶ndei和ecori切割。由此鉴定插入的片段。结果,除了质粒pcyk21的大约10.6-kb dna片段之外,还鉴定到长度为大约1.0-kb的插入片段,其对应于嗜热栖热菌的ldh基因和红色亚栖热菌的mldh-1基因中的每一者。得到的菌株如表2中所示来命名。
[0355]
表2
[0356][0357]
(4-3-4)乳酸生产
[0358]
使用铂环将表2中的每种细菌菌株接种到含有50μg/ml卡那霉素的a液体培养基中,并在50℃进行24小时的振摇培养,并随着培养供应h2:o2:co2=7.5:1:1.5的混合气体。
[0359]
在培养后,使用f-试剂盒l-乳酸(roche)对通过离心(4℃,15,000rpm,5分钟)获得的培养上清液中的乳酸进行定量。
[0360]
如表3中所示,其中hptl_1695基因被破坏的每个lac01菌株和lac02菌株与相应的ldh05菌株和mldh02菌株相比,分别显示出培养基上清液中乳酸量的显著增加。
[0361]
表3
[0362][0363]
ldh05菌株和mldh02菌株的宿主是hydrogenophilus thermoluteolus th-1菌株,
而lac01菌株和lac02菌株的宿主是通过破坏hydrogenophilus thermoluteolus th-1菌株的链霉素抗性菌株noc269菌株中的hptl_1695基因而获得的noc373菌株。
[0364]
一个转化体的培养基上清液中的乳酸量与ldh05菌株几乎相同,所述转化体通过将嗜热栖热菌的ldh基因引入到作为宿主的noc373菌株的母体菌株noc269菌株(链霉素抗性菌株)中而制备。一个转化体的培养基上清液中的乳酸量与mldh02菌株几乎相同,所述转化体通过将红色亚栖热菌的mldh-1基因引入到作为宿主的noc373菌株的母体菌株noc269菌株(链霉素抗性菌株)中而制备。已显示链霉素抗性的性状不影响乳酸生产能力。
[0365]
(5)乳酸透性酶基因的引入
[0366]
为了进一步促进细胞中产生的乳酸向培养基上清液的分泌,将乳酸透性酶基因共表达。
[0367]
(5-1)乳酸透性酶基因的克隆
[0368]
使用嗜热地芽孢杆菌的基因组dna作为模板,通过pcr方法扩增嗜热地芽孢杆菌的乳酸透性酶基因。下述引物被用于所述pcr。pcr使用由life technologies corporation制造的“dna热循环仪”并使用kod fx neo(由toyobo co.,ltd.制造)作为反应试剂,通过常规方法来进行。
[0369]
用于扩增嗜热地芽孢杆菌的乳酸透性酶基因(lutp)的引物
[0370]
(a-19)5
’‑
cggcaattgcgggcacaaaggggaggagaaaacc g-3’(seq id no:57)
[0371]
(b-19)5
’‑
cggcaattgttatggaatcatccacgacaataccg-3’(seq id no:58)
[0372]
引物(a-19)和(b-19)各自添加有muni限制性酶位点。
[0373]
使用1%琼脂糖凝胶对来自于所述pcr的反应混合物进行电泳。结果,检测到乳酸透性酶基因的大约1.7-kbp dna片段。
[0374]
将通过pcr扩增的含有嗜热地芽孢杆菌的乳酸透性酶基因的大约1.7-kb dna片段用限制性酶muni切割,并用限制性酶ecori切割。使用t4 dna连接酶(由takara bio inc.制造)将所述dna片段连接到在(4-3-1)中描述的每个质粒dna,即pc-tth-ldh(含有嗜热栖热菌的乳酸脱氢酶基因(ldh基因))和pc-mru-mldh1(含有红色亚栖热菌的苹果酸/乳酸脱氢酶基因(mldh基因))。
[0375]
通过电脉冲法(电穿孔法)用每个得到的连接产物各自转化noc269菌株和noc373菌株。将转化体施加到含有50μg/ml卡那霉素的a固体培养基上,并在充有h2:o2:co2=7.5:1:1.5的混合气体的培养箱中在50℃培养60小时。
[0376]
从在所述固体培养基上生长的菌株,通过菌落pcr选择乳酸透性酶基因以与ldh基因或mldh基因相同的方向被克隆到所述质粒中包含的ldh基因或mldh基因的下游的菌株。当所述菌落pcr使用对应于ldh基因或mldh基因的上游序列的引物与上述引物(b-19)的组合来进行时,可以在是否可以扩增到dna片段的基础上鉴定乳酸透性酶基因以与ldh基因或mldh基因相同的方向被克隆的菌株。所述pcr使用由life technologies corporation制造的“dna热循环仪”并使用takara ex taq(由takara bio inc.制造)作为反应试剂,通过常规方法来进行。
[0377]
用于菌落pcr的引物
[0378]
嗜热地芽孢杆菌的乳酸透性酶基因lutp
[0379]
(a-20)5
’‑
ggctcgtataatgtgtggaattgtgagcggataac-3’(seq id no:59)
[0380]
(b-20)5
’‑
cggcaattgttatggaatcatccacgacaataccg-3’(seq id no:60)
[0381]
结果,在每种转化中,检测到在乳酸透性酶基因以与ldh基因或mldh基因相同的方向被克隆的情况下将被扩增的大约2.7-kb dna片段。得到的质粒和细菌菌株如表4中所示来命名。
[0382]
表4
[0383][0384]
(5-2)乳酸生产
[0385]
使用铂环将表4中的每个其中引入有乳酸透性酶基因的菌株接种在含有50μg/ml卡那霉素的a液体培养基中,并在50℃进行24小时的振摇培养,并随着培养供应h2:o2:co2=7.5:1:1.5的混合气体。
[0386]
在培养后,使用f-试剂盒l-乳酸(roche)对通过离心(4℃,15,000rpm,5分钟)获得的培养上清液中的乳酸进行定量。结果确定,如表5中所示,通过将嗜热地芽孢杆菌的乳酸透性酶基因lutp引入到作为hptl_1695基因被破坏的菌株的noc373菌株中而获得的lac06和lac12菌株,与各自是其中没有引入乳酸透性酶基因的菌株的lac01和lac02菌株相比,分别显示出培养基上清液中乳酸量的增加。
[0387]
当其中乳酸利用酶基因未被破坏的noc269菌株是宿主时,引入乳酸透性酶基因的效果并不显著。相比之下,当乳酸利用酶基因被破坏时,通过乳酸透性酶基因的引入导致的乳酸生产能力的增强变得显著。也就是说,乳酸利用酶基因的破坏和乳酸透性酶基因的引入协同作用以增强乳酸生产能力。
[0388]
表5
[0389][0390]
(7)保藏菌株
[0391]
hydrogenophilus thermoluteolus lac06菌株和hydrogenophilus thermoluteolus lac12菌株被保藏在日本国立技术和评估研究所nite专利微生物保藏中心(nite patent microorganisms depositary,national institute of technology and evaluation)(2-5-8kazusakamatari,kisarazu-shi,chiba,japan(邮政编码292-0818))。
[0392]
对于hydrogenophilus thermoluteolus lac06菌株来说,登记号是bp-03007,接受日期是2019年7月30日。对于hydrogenophilus thermoluteolus lac12菌株来说,登记号是bp-03008,接受日期是2019年7月30日。
[0393]
此外,hydrogenophilus thermoluteolus ldh05菌株和hydrogenophilus thermoluteolus mldh02菌株也被保藏在日本国立技术和评估研究所nite专利微生物保藏中心(nite patent microorganisms depositary,national institute of technology and evaluation)(2-5-8kazusakamatari,kisarazu-shi,chiba,japan(邮政编码292-0818))。
[0394]
对于hydrogenophilus thermoluteolus ldh05菌株来说,登记号是bp-02822,接受日期是2018年11月14日。对于hydrogenophilus thermoluteolus mldh02菌株来说,登记号是bp-02828,接受日期是2018年11月21日。
[0395]
因此,这些菌株可供公众使用。
[0396]
此外,本说明书中描述的所有菌株(包括atcc菌株和nbrc菌株)均根据布达佩斯公约(budapest treaty)国际保藏,或由不附加任何条款或条件提供所述菌株的组织拥有,或在市场上销售,因此,这些菌株均可供公众使用。
[0397]
工业实用性
[0398]
本发明的重组体使用二氧化碳作为唯一碳源有效地生产乳酸,因此,它能够高效生产可生物降解塑料的原料,同时解决了由二氧化碳排放增加导致的全球变暖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。