制备在利用核酸聚合酶来检测核酸时使用的高精度核酸的方法
1.本技术是申请日为2013年4月8日的中国发明专利申请201380029805.2(pct申请号pct/kr2013/002895)的分案申请。
技术领域
2.本发明涉及一种制备在通过核酸聚合酶来检测核酸时使用的、具高灵敏度的核酸的方法,更具体而言,本发明涉及一种制备核酸的方法,所述核酸通过防止非特异性核酸聚合而能够检测痕量核酸,所述非特异性核酸聚合是由于包含在提取自生物样品的核酸中的单链核酸引起自引发(self-priming)所诱发,制备在核酸检测中用于检测核酸的核酸样品的方法在室温下使用pcr、rt-pcr、定量pcr、定量rt-pcr、转录扩增或核酸扩增所需的核酸聚合酶和引物。
背景技术:
3.各种利用核酸聚合酶来检测核酸的方法以高灵敏度和特异性已被用于各种检查,例如针对病毒、病原体、致癌基因等的测试。高灵敏度可以通过利用检测用的核酸聚合酶将靶核酸的数量扩增到上亿或更多来实现。高特异性可通过利用与靶核酸特异性杂交的引物,以在杂交温度下经由与靶核酸选择性地杂交,通过引发(priming)而选择性地进行核酸聚合反应来实现。然而,在诸如pcr反应、实时定量pcr反应等的具有多种核酸聚合酶的检测方法中,对于检测痕量的核酸而言,非特异性引发和随后的聚合反应扮演着劣化检测极限的主要因素。由于添加的引物与用于引发反应的靶核酸杂交,并且以众多数量竞争性存在的单链核酸非特异性地且部分地杂交而引发,使得核酸聚合反应竞争性地出现,故造成非特异性扩增。
4.与针对dna的检测相比,针对大多数包括单链核酸的rna的检测通常以较小灵敏度进行。一般而言,用于检测rna的方法通过逆转录(rt)反应接着pcr反应来进行。对于具有高灵敏度的反应而言,rt反应首先在一个反应器中进行,在rt反应完成后,在单独的反应器中利用rt反应产物进行pcr反应。
5.然而,在这种情况下,由于反应管需要再次打开以添加溶液,这不方便的且当打开反应管并进行操作时有被污染的高度可能性,故而主要使用通常在一个管中包括逆转录酶接着pcr反应的逆转录酶聚合酶链式反应(rt-pcr)方法。然而,在这种情况下,与分别进行反应的情况相比,存在灵敏度大大劣化的问题。
6.逆转录酶聚合酶链式反应(rt-pcr)在进行逆转录反应时需要引物,其中有使用随机引物的方法和使用作为靶特异性引物的反义引物的方法。
7.使用随机引物的方法能够制备关于全部核酸的cdna,因而已被主要用于制备cdna库或用于分析转录组的cdna。然而,在检测痕量rna的情况下,由于合成了关于全部rna的cdna而制备了许多非靶cdna,故非靶dna的量过度增加,使得难以如上所述地检测到靶。需要如上所述的高灵敏度的检测(如rna病毒诊断试剂盒)通常采用一种利用与靶rna互补的
反义引物的方法。
8.靶特异性反义引物通常能够提高检测极限。然而,即使使用靶特异性引物,由于在含有室温下对rna具有高活性的逆转录酶的混合反应溶液中,在低于引物杂交温度的温度下发生非特异性引发以及随后的逆转录酶反应是不可避免的,故出现了制备出许多非特异性cdna的问题。
9.一种被开发来克服上述问题并检测痕量的核酸的技术是热启动pcr反应。热启动pcr反应是一种包括在低温下的样品混合过程以控制不起始pcr反应,然后仅在靶特异性引物的杂交温度以上活化pcr反应的方法。
10.在该方法中,pcr反应仅在达到引物与靶核酸实现完全杂交的温度后才起始,从而防止了在低于引物杂交温度的温度下具非特异性引发的pcr反应进程。作为一种特异性方法,开发了热启动pcr方法,其中反应溶液中包含作为聚合酶抑制剂的焦磷酸酯,且反应中额外包含降解焦磷酸酯的焦磷酸酶以通过在引物的杂交温度下反应预定时间来消除焦磷酸酯,这样接着起始pcr反应,从而可抑制在低温下的非特异性核酸合成,以检测痕量的核酸。热启动pcr方法描述于本技术的申请人所提交的韩国专利第10-1098764号中。
11.然而,在包含痕量靶rna的情况下,即使通过反义引物或热启动逆转录酶反应来进行反应,也不能够实际进行只有相关靶rna的cdna的合成。原因是当反义引物杂交时,各种rna而非引物能够在低温下杂交。各种非靶rna可起到用于逆转录酶反应的引物的作用,并最终可与靶核酸杂交且起到引物作用从而制备各种cdna。
12.特别而言,在进行使用含有大量rna的样品的逆转录酶反应的情况下,其中所述rna各具有100bp或更少的短长度,例如提取自血清或石蜡块组织的rna作为模板,包含了许多长度比引物长度稍长的rna,使得各种rna在逆转录酶反应温度下引发,从而制备数量极其多的cdna。cdna参与pcr反应,生成各种非特异性扩增产物。当进行靶向包含痕量癌细胞或rna病毒的生物样品的检查时,这种现象是严重的问题。为检测靶rna,需要以尽可能大的量从生物样品中提取出核酸,其中所提取的rna量随生物样品的量成正比地增加,非靶rna的量不可避免地增加,并最终通过非特异性逆转录酶反应制备无数cdna。此外,在cdna当中,包括具有与靶特异性引物部分类似的碱基序列的cdna,从而在随后的pcr反应步骤中非特异性地扩增,使得在靶核酸扩增之前,非靶核酸就扩增而结束反应,最终,这成为阻碍扩增和检测痕量癌细胞或病毒的rna的主要原因。
13.为了解决上述问题,正进行着各种尝试。
14.首先,尝试通过更特异性地杂交引物来提高特异性靶标的检测极限。开发了一种用lna取代引物的5’末端以更牢固地与靶标杂交,由此减少非特异性扩增的方法(malgoyre a et al.,biochem biophys res commun.,354:246,2007)。
15.第二,当在rt反应步骤中进行rt反应时,特别是在低温下,通过引物之间的部分杂交而开展聚合,使得可形成二聚体,这是rt反应的灵敏度迅速劣化的主要原因之一。为解决该问题,开发了使引物尽可能多地在低温下不部分杂交的技术。开发了经延伸使得5’碱基序列的5bp碱基形成发夹的引物(hong,j.y.et al.,virol j.8:330,2011)。
16.然而,由于rock引物方法通过额外添加碱基序列而具有高的杂交温度,故可能诱发对具有类似碱基序列的非特异性靶标的非特异性杂交,且在杂交步骤中发夹结构可能稍微劣化效率。
17.此外,曾宣称当通过使用在高温下杂交的引物和即使在高温下也工作的amv逆转录酶来在诸如70℃的高温下合成cdna时,引物可能更特异性地扩增(fuchs b et al.,mol biotechnol.,12:237,1999)。在多重rt-pcr反应中,特异性更加重要。
18.多重单管rt-pcr方法是一种使用受热分解的磷酸三酯的方法,其中引物初始被封闭,然后按顺序地受热水解并用作引物(hidalgo ae et al.,bmc mol biol.,10:113,2009)。通过使用该方法,可防止经由正义引物的非特异性引发以抑制cdna非特异性合成,从而提高多重rt-pcr特异性和灵敏度。
19.此外,为提高用于检查呼吸检查样品中的各种病毒的试剂盒的灵敏度,开发了一种方法,其中排除了同源于rrna的引物,使得包含在呼吸样品中的rrna不进行逆转录反应,且在进行rt反应时一同添加寡核苷酸(oligo),所述寡核苷酸中与具有互补于rrna的碱基序列的部分相对应的3’端被封闭,从而防止rrna的逆转录和扩增,使得可高灵敏度地进行rt-pcr(de vries m et al.,plos one,6:e16118,2011)。
20.进一步地,taqman方法中使用实时定量pcr的在管(on-tube)rt-pcr方法提供了高灵敏度和高选择性,然而,具有这样的问题,即在含有rna/dna的样品中,例如提取自血液的含有核酸的样品中,可能不能对每个反应都检测到100拷贝或更少的样品(espy m.j.et al,clin.microbiol.rev.19:165,2006)。为解决该问题,已经使用了一种最初通过普通pcr的15循环进行扩增、然后在此上进行实时定量pcr的方法,然而,其不方便且有假阳性的风险(brian h.bird et al,j clin microbiol.45:35063513,2007)。
21.类似于上述情况,在含有小碎片的dna片段的dna核酸提取物的情况下,所述小碎片是由于生物样品的分离
·
纯化过程和样品的分解引起,在pcr反应中该核酸提取物在95℃下被修饰,然后大量的非特异性核酸通过非特异性引发而扩增,所述非特异性引发中许多小碎片的单链dna起到杂交过程中的引物的作用,使得可能检测不到预期的靶核酸。
22.为进行核酸的精确检查,高效率地提取核酸以进行高灵敏度的核酸扩增很重要。即使已开发了多种类型的用于自动进行核酸提取的提取核酸自动化设备,由于模板核酸自身被非特异性地引发而在用以检测痕量核酸的、使用核酸聚合酶和引物以用于扩增核酸的反应(如pcr反应或实时定量pcr反应)中被主要地扩增,故可能出现假阳性,或者难以检测靶核酸。
23.因此,本发明的发明者们发现了一种制备能够高灵敏度地仅扩增和检测靶核酸的、高灵敏度的核酸的方法,所述方法使用通过如下方式制备的模板核酸:先向模板核酸中加入终止聚合反应的核酸聚合终止子和聚合酶以进行聚合终止反应,然后消除所述核酸聚合终止子,从而完成了本发明。
24.更具体而言,由所述制备高灵敏度的核酸的方法发现,将核酸聚合终止子添加到模板核酸中,所述模板核酸在用于检测痕量核酸的、使用核酸聚合(如pcr反应或实时定量pcr反应)来检测核酸时使用,使得可以基本上消除抑制靶核酸的扩增反应的非特异性自引发和随后的非特异性扩增。
技术实现要素:
25.本发明的一个目的在于提供一种核酸聚合终止子,所述核酸聚合终止子通过终止模板核酸的3’末端而能够制备以高灵敏进行核酸扩增反应所需的核酸。
26.本发明的另一个目的在于提供一种使用核酸聚合终止子来制备具有高灵敏度的核酸的方法。
27.本发明的另一个目的在于提供一种扩增核酸的方法,包括用于制备核酸的方法。
28.本发明的另一个目的在于提供一种用于制备核酸的试剂盒,包括核酸聚合终止子。
29.本发明的另一个目的在于提供一种用于纯化核酸的自动化设备,包括储存核酸聚合终止子的储存部分;和向含有靶核酸的样品供给核酸聚合终止子的供给部分。
30.本发明的另一个目的在于提供一种用于检查核酸的全自动装备,包括用于纯化核酸的自动化设备。
31.本发明的另一个目的在于提供一种用于聚合核酸的组合物,包含被核酸聚合终止子结合于3’以防止非特异性反应的模板核酸。
32.为实现上述目的,本发明提供了一种制备核酸的方法,包括:1)使包含核酸、核酸聚合酶、酶反应缓冲液和核酸聚合终止子的反应混合物反应,其中所述核酸聚合终止子抑制核酸的3’末端延伸以终止核酸的3’末端;和2)从反应混合物中灭活或消除未反应的游离核酸聚合终止子,作为在使用核酸聚合反应来扩增和检测核酸时使用的核酸的制备方法。
33.此外,本发明提供了一种用于制备核酸的试剂盒,包括核酸聚合酶、酶反应缓冲液和核酸聚合终止子,其中所述核酸聚合终止子抑制核酸的3’末端的延伸,所述核酸是在使用核酸聚合反应来扩增和检测核酸时使用的核酸的制备方法所需的。
34.进一步,本发明提供了一种用于纯化核酸的自动化设备,包括储存核酸聚合酶和核酸聚合终止子的储存部分;和向含有靶核酸的样品供给核酸聚合酶和核酸聚合终止子的供给部分。
35.本发明提供了一种用于检查核酸的全自动装备,包括用于纯化核酸的自动化设备。
36.此外,本发明提供了一种使用用于核酸聚合反应的模板核酸的核酸聚合方法,其中核酸聚合终止子结合于3’末端以防止非特异性核酸聚合。
37.进一步,本发明提供了一种用于核酸聚合的组合物,包含被核酸聚合终止子结合于3’末端以防止非特异性核酸聚合的模板核酸、mg
2
离子、4种dntp、dna聚合酶和用于扩增模板核酸的引物。
38.此外,用于核酸聚合的组合物可进一步包含阻断寡核苷酸,所述阻断寡核苷酸具有与用于扩增模板核酸的引物互补的碱基序列和经阻断的3’羟基。
附图说明
39.图1是本发明比较例1的结果,其示出经由短rna片段的逆转录酶聚合酶链式反应产物的电泳照片(a:rna寡核苷酸,b:dna寡核苷酸)。
40.图2是本发明比较例1的结果,其示出经由短rna片段的非特异性逆转录酶聚合酶链式反应和pcr反应产物的电泳照片。
41.图3是本发明实施例1的结果,其示出使用maldi-tof质谱仪经由3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)的反应的终止。
42.图4是本发明实施例1的结果,其示出经由3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)终止
的单链rna的非特异性逆转录酶聚合酶链式反应产物的电泳照片(a:不具有合成的3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)的rna寡核苷酸,b:具有合成的3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)的rna寡核苷酸)。
43.图5是本发明比较例3的结果,其示出通过提取自人血清的rna的实时逆转录酶聚合酶链式反应抑制现象的证实(a:提取自depc-d.w的样品,b:提取自人血清的样品)。
44.图6是本发明实施例2的结果,其示出通过终止人血清中存在的rna的实时聚合酶链式反应抑制现象的证实(a:模板rna,b:将通常提取自人血清的rna加入模板rna中,c:将通常提取自人血清的rna经终止然后加入模板rna中)。
45.图7是本发明实施例2的结果,其示出使用碱性磷酸酶(cip)的3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)的活化抑制的证实(a:通过终止rna并使用cip水解3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)所获得的样品,b:在通过3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)终止rna后含有3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)而未纯化的样品,c:通过accuprep pcr纯化消除了3
′‑
脱氧腺苷5
′‑
三磷酸(3
′‑
datp)的样品)。
46.图8是本发明实施例3的结果,其示出通过rna终止的经由rna自引发的非特异性逆转录酶聚合酶链式反应抑制效果的证实,所述非特异性逆转录酶聚合酶链式反应采用通用逆转录酶聚合酶链式反应(a和c)和热启动逆转录酶聚合酶链式反应(b和d)(a:未终止的rna,b:未终止的rna,c:经终止的rna,d:经终止的rna)。
47.图9示出根据本发明的缓冲盒(cartridge)。
48.图10示出使用图9的缓冲盒的核酸制备方法的试验流程图。
49.图11是示出通过阻断寡核苷酸的非特异性反应抑制效果的图表。
50.图12示出基于在构建阻断寡核苷酸时使用的各种修饰,非特异性反应抑制效果的证实,其中a是使用具有热启动功能的产物的阳性对照组,b-g示出通过胺、磷酸酯、c3-间隔臂、c6-间隔臂、c12-间隔臂和c18-间隔臂修饰的情况,泳道1-3分别示出通过扩增三种不同的靶碱基所获得的结果,泳道m示出能够区分dna尺寸的100bp的dna分子梯度。
51.图13的a表示,在实时pcr中依赖于添加阻断寡核苷酸的引物二聚体和非特异性反应的抑制效果,其中横轴表示pcr反应循环,纵轴表示基于反应循环测得的荧光值,线条i示出对照组的荧光检测曲线的结果,线条ii示出实验组的荧光检测曲线的结果;b是示出使用荧光测量曲线的熔解曲线的图表,其中横轴表示温度变化,纵轴表示基于温度增加测得的荧光值,线条i示出对照组的熔解曲线的结果,线条ii示出实验组的熔解曲线的结果。
具体实施方式
52.下面,将详细描述本发明。
53.为对核酸进行精确的检查,不仅高效率地提取核酸很重要,而且在用于扩增核酸的反应中高灵敏度地扩增和检测所提取的核酸也很重要。即使已开发了自动进行核酸提取的、用于提取核酸的各种自动化设备,但当在使用核酸聚合酶和引物的、扩增核酸的反应(如pcr反应或实时定量反应)中检测痕量核酸时,可能出现假阳性,或者难以检测靶核酸。
54.因此,本发明的发明者们发现,由于核酸自身被非特异性地自引发并在用于扩增核酸的检查中(如用于检测靶核酸的pcr反应或实时定量pcr反应)被主要扩增,所以出现了所述问题,因而向核酸中添加了终止聚合反应和核酸聚合酶的物质,接着终止使得核酸不
能够起到引物的作用,从而仅靶核酸可以高灵敏度被扩增并检测到,由此完成了本发明。
55.在一个方面,本发明提供了一种使用核酸聚合反应来制备在扩增和检测核酸时使用的核酸的方法,所述方法包括:
56.1)使用含有核酸聚合酶、酶反应缓冲液和核酸聚合终止子的反应混合物,终止核酸的3’末端;和
57.2)从所述反应混合物中灭活或消除核酸聚合终止子。
58.更具体而言,本发明提供了一种通过核酸聚合反应来制备用于扩增和检测核酸的核酸的方法,所述方法包括:
59.1)从含有核酸的生物样品中分离并纯化所述核酸;
60.2)通过使用含有核酸聚合酶、酶反应缓冲液和核酸聚合终止子的反应混合物来终止步骤1)所分离并纯化的核酸的3’末端;和
61.3)从含有带被终止的3’末端的所述核酸的所述反应混合物中灭活或消除核酸聚合终止子。
62.根据本发明用于制备核酸的方法可应用于通常所知的自动化设备,用以提取核酸,例如所述设备揭示于韩国专利第148239号,美国专利第5702590号,美国专利第5647994号,欧洲专利第0691541号,美国专利第5336760号,美国专利第5897783号,美国专利第6187270号和韩国专利申请第10-2009-025743号。此外,由bioneer公司生产的exiprep
tm 16-全自动dna/rna/蛋白质纯化系统可优选用作提取本发明的核酸的自动化设备。
63.本发明中,样品可以是来自含有作为多核苷酸的核酸的任何植物、动物、细菌或病毒的样品。
64.在本发明中,所述核酸是rna或dna,所述核酸聚合酶包括能够将终止子结合到dna或rna的3’末端以使得聚合不再进一步进展的所有核酸聚合酶。
65.更具体而言,优选本发明的核酸聚合酶不具有3
’→5’
外切酶活性,使得所述终止子不再水解,更优选地,所述酶的效价可在超过90℃的高温下失去。所述核酸聚合酶可包括选自由以下物质构成的组的至少一种:rna依赖型rna聚合酶、rna依赖型dna聚合酶、dna聚合酶和rna聚合酶。
66.所述rna可以是mrna、无多聚a尾巴的rna或者病毒或原核生物rna,但本发明并不仅限于此。
67.本发明中,所使用的rna依赖型rna聚合酶是一种通用的酶,其主要包含在病毒中,以rna作为模板合成rna,可以使用来自诸如登革热病毒或口蹄疫病毒的黄病毒(flavivirus)的ns5酶。
68.此外,本发明中使用的dna聚合酶是指通过使用dna链作为模板来合成新dna链的酶。dna聚合酶包括pol i型dna聚合酶(例如大肠杆菌dna聚合酶i,klenow片段和taq dna聚合酶)、非α、非poli型dna聚合酶(例如wo 97/24444中揭示的dna聚合酶),但本发明并不限于此。
69.rna依赖型dna聚合酶是一种逆转录酶,可以使用各种逆转录酶,例如mmlv逆转录酶、amv逆转录酶、hiv逆转录酶等。此外,可以包括末端脱氧核苷酸转移酶(例如将腺苷结合到3’末端的poly(a)聚合酶)作为rna聚合酶。
70.例如,作为hiv逆转录酶,在azt(3
’‑
叠氮-3
’‑
脱氧胸苷)作为hiv治疗剂的人体中,
作为逆转录酶的活化形式的3
’‑
叠氮-3
’‑
脱氧胸苷5
’‑
三磷酸可有效地用于本发明中,所述3
’‑
叠氮-3
’‑
脱氧胸苷5
’‑
三磷酸表现出的反应性是来自人的dna聚合酶的反应性的100倍高(furman,p.a.et al.,pnas,83:8333,1986)。
71.本文使用的术语“核酸聚合终止子”是指终止所有核酸片段的聚合反应使得核酸不再进一步延伸的物质,和结合于核酸片段末端使得核酸链延伸不再进一步发生的物质。
72.本文使用的术语“终止”是指通过将“所述核酸聚合终止子”共价结合于核酸的3’末端,核酸聚合反应不再进一步进展,其中将所使用的物质定义为终止子。
73.更具体而言,本文中提及的术语“终止”是指通过将核酸的3’位置无羟基的物质,或者具有经由聚合酶的聚合反应不进展的化学基团的物质,共价结合于核酸的3’末端,核酸聚合反应不再进一步进展,其中所使用的物质定义为终止子。
74.在本发明中,核酸聚合终止子是类核酸化合物,所述类核酸化合物作为能够作用于核酸聚合酶的三磷酸酯形式被活化,可以使用不存在3’羟基连接于核酸或者3’羟基被其它基团所取代的各种核苷酸三磷酸酯,并且可选择使用与每种核酸聚合酶具有良好反应性的核酸聚合终止子。
75.在本发明中,所述类核酸化合物可以选自由以下物质构成的组中的至少一种:2
’3’‑
双脱氧核苷5
’‑
三磷酸、3
’‑
脱氧腺苷5
’‑
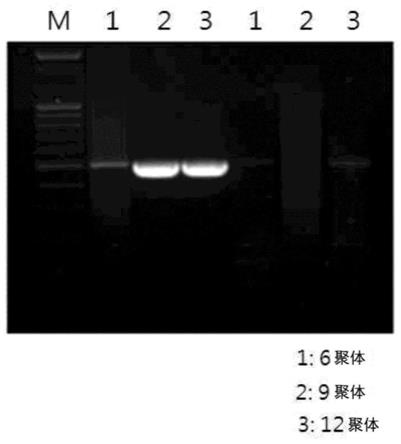
三磷酸、3
’‑
叠氮-3
’‑
脱氧胸苷5
’‑
三磷酸、1-β-d-阿拉伯呋喃糖核苷酸(arabinofuranosylnucleoside)5
′‑
三磷酸、无环鸟苷三磷酸、3
’‑
氨基-3
’‑
脱氧核苷酸5
’‑
三磷酸和3
’‑
氟-3
’‑
脱氧核苷酸5
’‑
三磷酸。
76.更具体而言,作为来自大肠杆菌或耐热细菌的dna聚合酶,可以使用sanger开发的大量用于双脱氧碱基序列测定的双脱氧核苷酸三磷酸酯(2
’3’‑
双脱氧核苷三磷酸:ddntp)。
77.本文使用的术语“双脱氧核苷三磷酸(ddntp)”可包括选自由以下物质构成的组中的至少一种:双脱氧鸟苷三磷酸(ddgtp)、双脱氧腺苷三磷酸(ddatp)、双脱氧胸苷三磷酸(ddttp)和双脱氧胞苷三磷酸(ddctp)。
78.脱氧核苷三磷酸(dntp)可包括选自鸟苷、腺苷、胸苷、尿苷和胞苷中的至少一种。
79.作为其实例,为进行使用dna聚合酶的终止反应,可使用各种核酸聚合终止子。在使用来自哺乳动物dna聚合酶的情况下,可以使用与该酶具有高反应性的5
′‑
三磷酸1-β-d-阿拉伯呋喃糖胞嘧啶或5
′‑
三磷酸9-β-d-阿拉伯呋喃糖腺嘌呤(j.j.furth和seymour s.cohen,cancer res,28;2061,1968)。
80.此外,已大量用作抑制来自病毒的dna聚合酶的抗病毒剂的阿昔洛韦(acyclovir)核酸(无环核苷)的三磷酸也可用作核酸聚合终止子(p a furman,et al.,j.virol.,32:72,1979)。
81.作为另一实例,作为rna聚合酶的poly a聚合酶是适用于本发明的核酸聚合终止反应的酶,所述poly a聚合酶是将腺苷结合于rna的3’末端的酶。当使用这种酶时,可以使用已知作为poly a聚合酶的抑制剂的3
’‑
脱氧腺苷三磷酸(3
’‑
datp,虫草素(cordycepin))。
82.在本发明中,步骤2)是灭活或消除步骤1)之后未反应的核酸聚合终止子的过程,其中在灭活核酸聚合终止子时,可使用能够水解用在聚合中的各种核酸聚合终止子的三磷酸键的所有各种酶。
83.更具体而言,在灭活核酸聚合终止子时,核酸聚合终止子水解灭活,并且需要失去该酶的功能,由此其优选容易受热失去活性。这是因为在随后的逆转录酶反应或pcr反应中核苷三磷酸不应当降解。
84.例如,磷键水解酶是具有降解三磷酸酯的底物性质的碱性磷酸酶,可以使用细菌碱性磷酸酶(bap)和小牛肠磷酸酶(cip)等,并更优选地,可使用容易受热灭活的cip。
85.此外,可以使用水解焦磷酸酯、atp等的来自各种有机体(即大肠杆菌、牛小肠和虾)的碱性磷酸酶,也可以使用autotaxin(clair t.et al.,j.biol.chem.272:996,1997)。可以使用非特异性降解核苷三磷酸的金黄色葡萄球菌(staphylococcus aureus)腺苷三磷酸合成酶(adsa)。
86.根据本发明的用于制备核酸的方法可包括:进行用于分离并纯化核酸的过程,随后,将核酸聚合酶和核酸聚合终止子添加到所提取的核酸中,从而终止互补核酸的聚合反应,由此消除经由核酸的非特异性引发。反应之后,由于未反应的核酸聚合终止子起着随后的聚合链式反应或pcr反应的抑制剂的作用,故需要消除未反应的核酸聚合终止子。
87.可以使用凝胶过滤或离液剂和碳化硅(silicarbide)来消除核酸聚合终止子,但本发明并不限于此。
88.在根据本发明的制备核酸的方法中,可以使用已知的用于分析核酸的集成设备,所述集成设备整体上管理已知的用于提取核酸的自动化设备和基因扩增设备,优选地,可以使用exiprep 16dx(bioneer公司制造),但本发明并不限于此。
89.更具体而言,进行用于分离并纯化核酸的过程,随后,将核酸聚合酶和核酸聚合终止子添加到所提取的核酸中,从而进行核酸聚合终止反应,从而灭活所有核酸的引发功能。由于反应之后剩余的终止子起着随后的逆转录酶反应或pcr反应的抑制剂的作用,所以可使用两种方法来消除剩余的终止子。
90.两种方法中的一种是通过使用exiprep 16dx(bioneer公司制造)再次进行rna纯化;另一种是降解核酸聚合终止子以使得反应不再进一步进行。
91.通过各种步骤进行使用设备进行纯化的方法,所述方法是一种在离液剂的存在下结合二氧化硅磁性颗粒、接着进行洗涤和洗脱过程的方法,这样该方法具有如下问题:需要许多时间,且纯化的rna可能在各种步骤中损失。同时,将作为经活化的核酸聚合终止子的核苷三磷酸通过水解酶降解成二或单三磷酸酸酯来使其灭活的方法迅速而简单,且不会劣化收率。
92.将详细描述使用酶的灭活方法。由于在exiprep 16dx的采集磁性颗粒的洗脱步骤中使用的孔的温度是可控的,故用洗脱缓冲液洗脱孔,然后向孔中添加作为三磷酸酯水解酶、自体毒素、金黄色葡萄球菌腺苷合成酶(adsa)的碱性磷酸酶,并在37℃下反应,使得可容易地消除终止子。
93.作为具体实例,通过使用exiprep 16dx(bioneer公司制造)进行纯化的方法可使用缓冲盒(buffer cartridge)。本发明的缓冲盒可由总共12个孔和一个样品试管组成。孔
①
到
⑩
用于提取并纯化核酸,其构成如下:
94.孔
①
是试剂混合并进行反应的孔,孔
②
是含有提取核酸所需的酶的孔,孔
③
是含有进行血液、血清和培养细胞的细胞裂解的细胞裂解溶液的孔,孔
④
是含有用于将经洗脱的核酸结合于硅珠的结合溶液的的孔,孔
⑤
含有用于结合核酸的硅珠的孔,而孔
⑥
是含有
用于消除剩余在硅珠中的污染物的初次洗涤溶液的孔,所述硅珠具有结合于其上的核酸。孔
⑦
是含有用于消除剩余在硅珠中的污染物的二次洗涤溶液的孔,所述硅珠具有结合于其上的核酸,孔
⑧
是含有用于消除剩余在硅珠中的污染物的三次洗涤溶液的孔,所述硅珠具有结合于其上的核酸,孔
⑨
是含有枪头洗涤溶液的孔,所述枪头洗涤溶液用于干净地洗涤核酸提取中使用的枪头,而孔
⑩
是含有用于将核酸从硅珠上洗脱的洗脱溶液的孔,所述硅珠具有结合于其上的核酸。参见图9。
95.更具体而言,将样品试管中包含的样品转移到孔
①
,并取孔
③
中包含的细胞裂解溶液与孔
②
中包含的提取核酸所需的酶混合,然后转移到包含样品的孔
①
中。通过将温度提升到60℃降解所有细胞,并将孔
①
中的所有溶液转移到含有核酸结合溶液的孔
④
并一起混合。取所有反应溶液并转移到含有硅珠的孔
⑤
,将暴露在反应溶液中的所有核酸结合于硅珠。在孔
①
中完全弃掉剩余的反应溶液而仅留下其上结合有核酸的硅珠。用孔
⑥
中包含的初次洗涤溶液、孔
⑦
中包含的二次洗涤溶液和孔
⑧
中包含的三次洗涤溶液按顺序地洗涤硅珠的表面,使得仅经纯化的核酸留在硅珠的表面上。对于最后的核酸提取而言,通过使用枪头洗涤溶液来洗涤提取核酸中使用的枪头的表面,然后从含有核酸洗脱溶液的孔
⑩
取核酸洗脱溶液,并与具有核酸的硅珠混合,从而从硅珠分离核酸,并用核酸洗脱溶液洗脱核酸。
96.取孔中包含的所有poly(a)聚合酶和3
’‑
datp、反应溶液并转移到经洗脱的核酸溶液中,接着在37℃下反应10分钟,从而完成在所提取的核糖核酸的3’末端处的终止反应。这里,由于本反应中使用的3
’‑
datp抑制逆转录酶反应或pcr反应,故3
’‑
datp必然应当被去除。为解决该问题,可采用以下两种方法。
97.当参考图10解释时,全过程首先根据rna提取和纯化、rna终止来进行,然后为消除在rna终止中使用的3
’‑
datp的活性,进行以下两种方法,即通过rna纯化消除3
’‑
datp,或使用磷酸酶水解3
’‑
datp的三磷酸酯。
98.第一种方法是使用在提取核酸中使用的反应剂的纯化方法,该方法是“通过rna纯化来消除3
’‑
datp的过程”。取进行rna终止反应后获得的所有反应溶液和硅珠,并转移到含有在核酸提取中使用的核酸结合溶液的孔
④
。剩余反应溶液全部弃去,而仅留下与核酸结合溶液混合的硅珠以结合孔
①
中的核酸。通过使用孔
⑧
中包含的三次洗涤溶液来洗涤硅珠的表面,使得仅经纯化的核酸留在硅珠表面上。然后,从含有核酸洗脱溶液的孔
⑩
取核酸洗脱溶液,并与具有核酸的硅珠混合,从而从硅珠上分离核酸,并用核酸洗脱溶液洗脱核酸。
99.第二种方法是向进行了rna终止反应之后获得的反应溶液中加入碱性磷酸酶,以消除存在于3
’‑
datp的5’末端的三磷酸酯残余物,从而防止在随后的pcr过程中的副反应,所述方法为“使用碱性磷酸酶来水解3
’‑
datp的过程”。取进行了rna终止反应后获得的所有反应溶液,并转移到含有碱性磷酸酶的孔并充分混合在一起。取所混合的反应溶液并转移到孔
①
,接着在37℃下反应10分钟,从而在消除ddatp的5’末端处的所有磷酸酯残余物。为灭活反应中使用的碱性磷酸酶,将温度升高至65℃并进行反应10分钟。反应完成后,仅取洗脱同时仅留下硅珠的所有核酸来用于pcr反应。
100.另一方面,本发明还提供了一种用于聚合核酸的方法,所述方法使用用于核酸聚合反应的核酸,其中所述核酸的3’末端结合核酸聚合终止子以防止非特异性核酸聚合。
101.本发明提供了一种用于扩增核酸的方法,包括用于制备核酸的方法,其中用于制
备核酸的方法包括:1)通过使用含有核酸聚合酶、酶反应缓冲液和核酸聚合终止子的反应混合物来终止所述核酸的3’末端;和2)从所述反应混合物中灭活或消除所述核酸聚合终止子,所述反应混合物包含具有经终止的3’末端的核酸。
102.在本发明中,所述扩增方法可用于热启动pcr、巢式pcr、多重pcr、逆转录酶pcr(rt-pcr)、实时pcr、简并性寡核苷酸引物(dop)pcr、定量rt-pcr和类似方法,以及普通pcr反应。此外,所述扩增方法还可通过引物和核酸聚合酶的聚合反应的选择,应用于扩增特异性碱基序列的信号的所有方法,从而用于检查聚合酶扩增的各种方法,例如等温滚环扩增、使用逆转录的等温扩增等。
103.另一方面,本发明提供了一种用于制备核酸的试剂盒,包括核酸聚合酶、酶反应缓冲液和抑制核酸的3’末端延伸的核酸聚合终止子,所述核酸是用于制备在使用核酸聚合反应来扩增和检测核酸中使用的核酸的方法中所需的。
104.在本发明中,用于制备核酸的试剂盒可包括选自由以下物质构成的组的至少一种作为核酸聚合酶:rna依赖型rna聚合酶、rna依赖型dna聚合酶、dna聚合酶和rna聚合酶,并优选可包括poly(a)聚合酶。
105.在本发明中,用于制备核酸的试剂盒可包括tris-hcl、kcl、(nh4)2so4、mgso4和triton x-100作为酶反应缓冲液。
106.在本发明中,用于制备核酸的试剂盒可包括选自由以下物质构成的组中的至少一种作为核酸聚合终止子:2
’3’‑
双脱氧核苷5
’‑
三磷酸、3
’‑
脱氧腺苷5
’‑
三磷酸、3
’‑
叠氮-3
’‑
脱氧胸苷5
’‑
三磷酸、1-β-d-阿拉伯呋喃糖核苷酸5
′‑
三磷酸、无环鸟苷三磷酸、3
’‑
氨基-3
’‑
脱氧核苷酸5
’‑
三磷酸和3
’‑
氟-3
’‑
脱氧核苷酸5
’‑
三磷酸。
107.在本发明中,用于制备核酸的试剂盒可进一步包括水解三磷酸酯的磷键水解酶,所述磷键水解酶灭活核酸聚合终止子,其中作为磷键水解酶,也可使用选自由以下物质组成的组中的至少一种:来自大肠杆菌、牛小肠和虾的碱性磷酸酶和自分泌运动因子(autotaxin)。
108.所述试剂盒可包括操作指南。“操作指南”是一种说明试剂盒用法的印刷物,所述用法例如,用于制备核酸制备用的试剂溶液的方法、要存在的制备条件等。操作指南包括在诸如手册或样册之类的活页表面上的说明、贴于试剂盒的标签和包含试剂盒的包装。此外,操作指南包括通过诸如因特网之类的电媒介出版或提供的信息。
109.另一方面,本发明提供了一种用于纯化核酸的自动化设备,包括储存核酸聚合酶和核酸聚合终止子的储存部分、以及将核酸聚合酶和核酸聚合终止子供给含有靶核酸的样品的供给部分。
110.在本发明中,储存部分可进一步包含三磷酸酯水解酶和酶反应缓冲液,且所述设备可进一步包括计算机控制器以实现整体自动化。
111.本发明提供了一种用于检查核酸的全自动装备,包括用于纯化核酸的自动化设备。
112.作为本发明的用于检查核酸的全自动装备,可使用已知的用于分析核酸的集成设备,所述集成设备整体上管理用于提取核酸的已知制动化设备和基因扩增设备。优选地,可使用本技术人开发的完全自动化地纯化、扩增和分析核酸的分析核酸用完全自动化装备(韩国专利申请第10-2010-0086468号和第10-2012-0013757号)。作为实时基因扩增设备,
可使用已知的实时基因扩增设备。优选地,可使用韩国专利第10-794703号中公开的设备、pct/kr2008/064558中公开的设备或bioneer公司制造的exicycler 96实时定量热阻块(exicycler 96real-time quantitative thermal block),但本发明并不限于此。
113.此外,本发明提供了一种用于聚合核酸的组合物,所述组合物包含被核酸聚合终止子结合于3’末端以防止非特异性核酸聚合的核酸、mg
2
离子、四种dntp、dna聚合酶和用于扩增所述核酸的引物。
114.用于聚合核酸的组合物可根据需要进一步包含引物、探针、荧光染料、逆转录酶等。本文所使用的术语“核酸”没有限制,包括待扩增的模板核酸、dna、rna、dna和rna的杂交物、其混合物、核酸提取物或核酸样品等。
115.用于聚合核酸的组合物可进一步包含阻断寡核苷酸(blocking oligonucleotide),所述阻断寡核苷酸具有与用于扩增模板核酸的引物互补的碱基序列和被阻断的3’羟基。
116.阻断寡核苷酸的碱基序列数量小于具有互补碱基序列的引物的碱基序列数量。当如上所述阻断寡核苷酸的碱基序列的数量小于引物的碱基序列数量时,引物(或模板核酸)阻断寡核苷酸键的熔解温度低于引物-模板靶dna键的熔解温度。因而,引物和阻断寡核苷酸在低温下通过双螺旋结构结合,然而,具有略低变性温度的阻断寡核苷酸在到达引物的退火温度之前就解离,使得不再进一步形成双螺旋结构,这样在pcr反应中就不具有效果,从而有效地用于热启动pcr。如上所述的使用阻断寡核苷酸的方法可以相同的方式应用于探针。根据本发明的实施方式,优选阻断寡核苷酸具有比引物的熔解温度低1℃或更多,优选2℃或更多的溶解温度,优选阻断寡核苷酸具有至少25℃或更高,优选50℃或更高的熔解温度。
117.此外,阻断寡核苷酸在3’末端缺乏羟基,或在3’末端具有除羟基外的其他取代基。通过3’末端的羟基和5’末端的磷酸基相互结合的方式,dna聚合方法进展,使得当3’末端羟基被其他不同取代基所取代时,dna聚合反应不再进一步进展。根据本发明的实施方式,荧光物质(染料)、猝灭剂或由表1中所示的以下化学式表示的物质可用作取代基,然而本发明并不限于此。
118.[表1]
[0119]
[0120]
[0121][0122]
此外,根据本发明的实施方式,优选阻断寡核苷酸的5’末端第一个碱基形成与互补结合于该阻断寡核苷酸的引物的3’末端第一个碱基的互补结合,或者形成与引物的3’末端的第二或后面碱基的互补结合,从而防止阻断寡核苷酸的5’末端的至少一个碱基不配对。即,优选阻断寡核苷酸的5’末端的所有碱基形成与引物的3’末端的碱基的互补结合。如果阻断寡核苷酸的5’末端的至少一个碱基不配对,则dna聚合反应从引物的3’末端起始到阻断寡核苷酸的5’末端的第一个碱基,结果,引物的长度可进一步延伸。在如上所述的长度延伸的引物存在于反应溶液中的情况下,引物二聚体的形成(现存问题)可能更多地增加非特异性扩增所得产物,这是不优选的。
[0123]
此外,对于具有针对阻断寡核苷酸的互补序列的引物对,阻断寡核苷酸可特异性地结合于正向引物和反向引物中任何一种,或者所有的正向引物和反向引物。
[0124]
在本发明中,用于反应的缓冲液优选为10mm tris hcl,40mm kcl且ph为9.0。四种dntp为datp、dttp、dgtp和dctp。作为dna聚合酶,没有限制,可以使用任何已知的dna聚合酶。其中,具有5
’→3’
核酸外切酶活性的聚合酶、具有3
’→5’
核酸外切酶活性的聚合酶、和不具有5
’→3’
核酸外切酶活性和3
’→5’
核酸外切酶活性的聚合酶可以单独或组合使用。具有5
’→3’
核酸外切酶活性的聚合酶实例包括taq dna聚合酶,具有3
’→5’
核酸外切酶活性的聚合酶实例包括pfu dna聚合酶或tla dna聚合酶,而不具有5
’→3’
核酸外切酶活性和3
’→5’
核酸外切酶活性的聚合酶包括top dna聚合酶,但本发明并不限于此。dna聚合酶可以以0.1到10u(单位),优选以0.5到2u,最优选以1u的浓度包含在pcr的组合物中。
[0125]
同时,本发明的用于聚合核酸的组合物可进一步包含对核酸非反应性的染料物质,以对实验提供便利、防止被pcr反应产物污染、稳定dna聚合酶和dntp并提高反应性。非反应性染料物质可选自对pcr反应无影响的物质,满足该条件的物质的实例包括水性染料如溴酚蓝、二甲苯青、溴甲酚红、甲酚红等。基于所述总组合物,所述非反应性染料物质可以具有0.0001-0.01wt%的含量,且含量优选0.001-0.005wt%,更优选为0.001-0.003wt%。如果非反应性染料物质以少于0.0001wt%的含量添加到所述组合物中,则由于在pcr反应之后进行用于分析的琼脂糖凝胶电泳时染料具有低浓度,所以难以肉眼观察到样品的迁移,而如果非反应性染料物质以高于0.01wt%的量添加,则在进行pcr反应时,高浓度的水溶性染料会起到反应抑制剂的作用。此外,在琼脂糖凝胶中沉淀之后,可防止样本在进行电泳时迁移。
[0126]
进一步,如果需要,本发明的用于聚合核酸的组合物可含有用于合成cdna的逆转录酶。如上所述,在含有逆转录酶的逆转录酶pcr的情况下,优选将待扩增rna的正义引物的阻断寡核苷酸添加到本发明的用于热启动pcr的组合物中。
[0127]
dna聚合酶是一种通过将由单条线组成的部分双螺旋结构的5’末端结合于3’末端来生成聚合反应的酶。在本发明中,考虑dna聚合酶的性质来设计阻断寡核苷酸。本发明中,
设计成使得阻断寡核苷酸的5’末端互补地结合于引物的3’末端,从而防止引物非特异性地进一步反应,并防止引物与其他核酸杂交以延伸碱基。此外,阻断寡核苷酸的3’末端具有比引物的5’末端的长度更短的长度,使得dna聚合酶良好地附着,同时,为防止阻断寡核苷酸延伸,用其他取代基阻断了3’羟基。据此,正是通过向反应产物添加阻断寡核苷酸,dna聚合酶附着于引物和阻断寡核苷酸的双螺旋,使得非特异性反应可不进一步进行,从而防止在室温下引物的扩增反应。
[0128]
此外,用于本发明的热启动pcr用组合物的阻断寡核苷酸(其为与引物或探针具有互补碱基序列的寡核苷酸)具有比引物/探针的长度更短的长度,以在低温下与引物/探针具有双螺旋结构,且当dna聚合酶将该双螺旋结构识别为底物时,它们彼此结合;然而由于3’末端被阻断,故不发生dna聚合。因而,在普通pcr反应中可能是问题的引物非特异性聚合可以被抑制,从而防止非特异性pcr产物出现。因而,当使用本发明的热启动pcr用组合物时,不像使用用于现有技术中的抗体、化学配方和焦磷酸酯的热启动pcr方法,聚合酶在引物-靶模板dna双螺旋的熔接温度下直接脱离以被活化,使得pcr反应可以直接进行而不耗费用于活化的孵育时间。
[0129]
当考虑阻断寡核苷酸的作用机理时,正向引物和反向引物在pcr反应中起到必要因子的作用。对引物具有高特异性的阻断寡核苷酸是一种由具有核苷酸的互补碱基序列构成的寡核苷酸,其中核苷酸的数量比正向引物或反向引物的核苷酸数量少一个或多个。因而,当混合正向/反向引物与阻断寡核苷酸时,阻断寡核苷酸就结合于正向/反向引物,以防止正向/反向引物起作用,从而先防止引物二聚体形成和参与非特异性反应。当达到适当的温度时,即阻断寡核苷酸的熔解温度时,引物和阻断寡核苷酸之间的结合被打破,使得引物结合于靶模板核酸,从而精确而有效地实现pcr反应。也就是说,由于阻断寡核苷酸被构建为具有与引物/探针相比相对较短的长度,故当达到引物结合于模板核酸的适当温度时,阻断寡核苷酸就从引物/探针上解离,这对于引物与模板的结合不具有效果。
[0130]
在本发明中,阻断寡核苷酸为阻断寡核苷酸rna,核酸聚合为rt-qpcr。
[0131]
在本发明的示例性实施方式中,本发明的使用阻断寡核苷酸的热启动pcr方法可有效地应用于以下情况,然而本发明并不限于此:
[0132]
i.存在在单重pcr反应中由非特异性反应导致的pcr扩增产物的吸引现象的情况。
[0133]
ii.在pcr反应中由非特异性反应导致的多种扩增产物出现的情况。
[0134]
iii.由引物二聚体导致的pcr反应效率劣化的情况。
[0135]
iv.对于具有低扩增率的特异性靶标,试图提高pcr反应效率的情况。
[0136]
v.试图确认至少一种扩增产物(多重pcr)的情况。
[0137]
vi.在诸如检查和疾病诊断等领域,试图提高对于特异性靶标的pcr反应效率的情况。
[0138]
vii.进行需要特异性的实时pcr反应的情况。
[0139]
viii.使用具有特别不同的tm值的引物的情况。
[0140]
ix.在一步rt-pcr反应中出现非特异性扩增产物的情况。
[0141]
此外,本发明的用于聚合核酸的组合物与现有技术中曾报道过的各种pcr组合物相比,具有以下优点:
[0142]
1)由于反应按照普通pcr方法进行,所以不需要在高温下的长预处理时间。
[0143]
2)本发明的组合物与现有的pcr用组合物相比是经济的。
[0144]
3)由于防止了以低严谨度引发导致的扩增产物的产生,本发明的组合物可应用于同时使用各种样品的多重pcr反应。
[0145]
将以下面示例性实施方式来更详细地描述本发明。然而,描述以下本发明的示例性实施方式来帮助理解本发明。因而,本发明的范围并不限于示例性实施方式。
[0146]
这里,技术和科学术语除非本文另外定义,否则它们具有本发明所属领域技术人员所理解的含义。在以下描述和附图中将省略模糊化本发明要旨的已知功能和成分。
[0147]
[比较例1]通过短rna片段的逆转录酶聚合酶链式反应
[0148]
在从rna模板合成cdna的逆转录酶聚合酶链式反应中,为比较dna寡核苷酸和rna寡核苷酸之间的逆转录酶反应效率,合成三种各自具有不同长度的单链rna寡核苷酸。
[0149]
所合成的单链rna被构建为具有随机碱基序列(6聚体,nnn nnn;9聚体,nnn nnn nnn;12聚体,nnn nnn nnn nnn)。合成与rna寡核苷酸具有相同碱基序列和相同长度的dna寡核苷酸作为对照组。
[0150]
为证实通过所合成的单链rna的逆转录酶聚合酶链式反应(rt-pcr)和聚合酶链式反应(pcr),将10ng提取自hela细胞的人总rna加入accupower rt premix(bioneer公司,韩国)中,并靶向人gapdh基因的碱基序列。
[0151]
将所合成的单链rna寡核苷酸各100pmol加入用于逆转录酶聚合酶链式反应(rt-pcr)的引物中,并使用具有相同量的单链dna寡核苷酸作为阳性对照组。在accupower rt premix(bioneer公司,韩国)的最佳温度42℃下进行一次逆转录酶聚合酶链式反应60分钟,然后在95℃下进行一次5分钟以便灭活逆转录酶。
[0152]
将5μl通过逆转录酶聚合酶链式反应获得的产物(20μl)加入accupower rt premix(bioneer公司,韩国)中,然后以人gapdh基因靶标设计并合成gapdh正向引物(gaa ggt gaa ggt cgg agt caa cg:seq id no:1)和gapdh反向引物(agt cct tcc acg ata cca aag ttg:seq id no:2),并进行pcr反应。
[0153]
通过重复单循环的过程进行pcr反应,所述单循环的过程包括在95℃下30秒的步骤,在55℃下30秒的步骤和在72℃下30秒的步骤总共30次,并分别进行在95℃下预变性5分钟和72℃下最终延伸5分钟。将通过pcr反应获得的产物在带dna分子标记的琼脂糖凝胶上进行电泳,然后用溴化乙锭(etbr)染色,并通过数码相机对pcr反应扩增的dna带拍照。
[0154]
对使用逆转录酶premix(rt premix)(bioneer公司,韩国)获得的产物进行pcr反应,其中不加入单链dna,经合成作为阳性对照组。
[0155]
结果,可以看到通过rna以及所合成的单链dna进行了逆转录酶聚合酶链式反应(rt-pcr)。其结果在图1中示出。
[0156]
在图1中,泳道1、2和3是在进行逆转录酶聚合酶链式反应(rt-pcr)时按顺序地加入100pmol各自具有6聚体、9聚体和12聚体长度的寡核苷酸的样品。
[0157]
泳道n是不加入寡核苷酸的空白样本。
[0158]
在图1中,a示出通过加入rna寡核苷酸,接着rt-pcr和pcr反应获得的结果,b示出作为对照组通过加入dna寡核苷酸,接着rt-pcr和pcr反应获得的结果。
[0159]
泳道m是100bpdna分子梯度(bioneer公司,韩国),可证实pcr产物的尺寸。
[0160]
从图1可以看出,使用dna寡核苷酸,通过rna寡核苷酸作为样品可实现rt-pcr。
[0161]
[比较例2]通过小片段rna的非特异性rt-pcr和pcr反应
[0162]
为证实通过小片段rna的非特异性rt-pcr和pcr反应,合成三种各自具有随机碱基序列和不同长度的单链rna。所合成的单链rna被构建为具有随机碱基序列(6聚体,nnn nnn;9聚体,nnn nnn nnn;12聚体,nnn nnn nnn nnn)。
[0163]
为证实通过所合成的单链rna的非特异性rt-pcr和pcr反应,将10ng提取自hela细胞的人总rna加入accupower rt premix(bioneer公司,韩国)中,靶向人β肌动蛋白基因,并用具有靶碱基序列(tag aag cat ttg cgg tgg ac:seq id no:3)的反向引物作为rt-pcr中使用的引物。
[0164]
为证实通过小片段rna的非特异性rt-pcr,分别加入200pmol所合成的单链rna。作为阳性对照组,使用未加入所合成的单链rna的样品,并进行rt-pcr。
[0165]
在accupower rt premix(bioneer公司,韩国)的最佳温度42℃下进行一次逆转录酶聚合酶链式反应60分钟,然后在95℃下进行一次5分钟以便灭活逆转录酶。
[0166]
将5μl通过逆转录酶聚合酶链式反应获得的产物(20μl)加入accupower rt premix(bioneer公司,韩国)中,然后以人β肌动蛋白基因靶标设计并合成β肌动蛋白正向引物(agg att cct atg tgg gcg ac:seq id no:4)和β肌动蛋白反向引物(tag aag cat ttg cgg tgg ac:seq id no:5),并进行pcr反应。
[0167]
通过重复单循环的过程进行pcr反应,所述单循环的过程包括在95℃下30秒的步骤,在55℃下30秒的步骤和在72℃下30秒的步骤总共30次,并分别进行在95℃下预变性5分钟和72℃下最终延伸5分钟。将通过pcr反应获得的产物在带dna分子标记的琼脂糖凝胶上进行电泳,然后用溴化乙锭(etbr)染色,并通过数码相机对pcr反应扩增的dna带拍照。
[0168]
对使用逆转录酶premix(rt premix)(bioneer公司,韩国)获得的产物进行pcr反应,其中不加入单链dna,经合成作为阳性对照组。
[0169]
结果,可以证实在所有加入了所合成的单链rna的样品上都出现非特异性反应。其结果在图2中示出。
[0170]
在图2中,泳道1、2和3是在进行逆转录酶聚合酶链式反应(rt-pcr)时加入200pmol所合成的单链rna的样品,泳道4是未加入所合成的单链rna的样品。
[0171]
泳道1是加入具有六个随机碱基序列(6聚体)的单链rna的样品,泳道2是加入具有九个随机碱基序列(9聚体)的单链rna的样品,而泳道3是加入具有十二个随机碱基序列(12聚体)的单链rna的样品。
[0172]
泳道4示出作为阳性对照组,未加入所合成的单链rna样品,接着rt-pcr和pcr反应所获得的结果。泳道1、2和3示出加入200pmol各自具有不同长度的所合成的单链rna样品,接着rt-pcr和pcr反应所获得的结果。泳道m是100bpdna分子梯度(bioneer公司,韩国),可证实pcr产物的尺寸。
[0173]
结果可以证实,与未加入所合成的单链rna的样品相比,无论长度如何,在所有加入了单链rna的样品中都未检测到由非特异性反应导致的靶标。
[0174]
该结果意味着在rt-pcr和pcr反应中,除靶引物之外,单链rna也起着引物的作用,这证实了非特异性被诱发。
[0175]
[实施例1]通过3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止的单链rna的非特异性rt-pcr抑制效果
[0176]
(1)通过poly(a)聚合酶和3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的rna片段的终止反应
[0177]
为抑制单链rna的非特异性引发反应,使用poly(a)聚合酶(takara,日本)和3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)进行终止反应。
[0178]
加入5μl 10x反应缓冲液、0.1mm 3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)、2个单位poly(a)聚合酶和1nmol在比较例1中合成的具有十二个随机碱基序列(12聚体)单链rna,然后加入蒸馏水至具有最终体积50μl,接着在37℃下反应15分钟。
[0179]
反应之后,通过accupower pcr纯化试剂盒(bioneer公司,韩国)进行纯化。在纯化产物中,通过maldi-tof质谱仪(shimadzu公司,日本)证实在具分子量的单链rna中是否合成3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)。具有随机碱基序列的单链rna具有3408.2到3888.4mw的分子量,而3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)具有491.18mw的分子量。
[0180]
使用poly(a)聚合酶在单链rna(12聚体)中合成3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)之后,测得分子量为4000到4300mw,这证实通过poly(a)聚合酶加入了3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)。其结果如图3所示。
[0181]
(2)通过3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止的单链rna的非特异性rt-pcr反应的抑制效果
[0182]
以与比较例1相同的模板rna和引物,并通过如上所述的方法(1),使用在与比较例1相同的rna寡核苷酸中通过3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止的具有随机碱基序列的rna寡核苷酸。作为对照组,使用未通过3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止的单链rna寡核苷酸。
[0183]
为证实通过被3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止的单链rna的rt-pcr的抑制反应,将10ng提取自hela细胞的人总rna加入accupower rt premix(bioneer公司,韩国)中,靶向人gapdh基因,并向逆转录酶聚合酶链式反应(rt-pcr)中使用的引物中加入100pmol其中加入了3
’‑
脱氧腺苷的每种单链rna寡核苷酸,并且作为阳性对照组,使用具有相同量但其中未加入3
’‑
脱氧腺苷的rna寡核苷酸。在accupower rt premix(bioneer公司,韩国)的最佳温度42℃下进行一次逆转录酶聚合酶链式反应60分钟,然后在95℃下进行一次5分钟以便灭活逆转录酶。
[0184]
通过与比较例1相同的方法进行rt-pcr和pcr反应。在使用含有rna寡核苷酸的逆转录酶premix(rt premix)(bioneer公司,韩国)获得的产物上进行pcr反应,所述rna寡核苷酸中未加入3
’‑
脱氧腺苷作为阳性对照组。
[0185]
结果可以证实,在使用通过3
’‑
脱氧腺苷终止的rna寡核苷酸的样品中,非特异性rt-pcr和pcr反应受到抑制。其结果如图4中所示。
[0186]
在图4中,泳道1、2和3是在进行逆转录酶聚合酶链式反应(rt-pcr)时顺次加入100pmol各自具有6聚体、9聚体和12聚体长度的单链rna寡核苷酸的样品。
[0187]
在图4中,a示出通过加入其中未加入3
’‑
脱氧腺苷的rna寡核苷酸,接着rt-pcr和pcr反应获得的结果,b示出通过加入被3
’‑
脱氧腺苷终止的rna寡核苷酸,接着rt-pcr和pcr反应获得的结果。
[0188]
泳道m是100bpdna分子梯度(bioneer公司,韩国),可证实pcr产物的尺寸。
[0189]
结果可以证实,通过3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)进行终止,rt-pcr和pcr反
应中的非特异性扩增反应受到抑制。
[0190]
[比较例3]通过提取自人血清的rna的实时rt-pcr的抑制现象
[0191]
为进行实时rt-pcr,首先构建模板rna。具体而言,通过基因合成方法(biochem.biophys,res.commun 1998,248,200-203)合成丙肝病毒部分,并将其一部分克隆到pgem-t-easy载体中(cat.a1360,promega公司,美国)。
[0192]
具体而言,将5μl 2x快速连接缓冲液(promega公司,美国)、1μl t-easy载体(promega公司,美国)、1μl t4 dna连接酶(promega公司,美国)和3μl(8ng)所合成的基因放入同一试管中,并相互混合,然后在37℃的恒定温度放置1小时。
[0193]
然后,将5μl恒定温度放置的反应溶液放入50μl大肠杆菌感受态细胞中,然后置于冰上40分钟,接着在42℃下培养40秒,然后再次置于冰上2分钟。将反应溶液接种到含氨苄青霉素(ampicillin)、iptg和x-gal的lb板中之后,接着在37℃下培养16小时。
[0194]
取白色克隆并在lb液体培养基中培养大约16小时,接着离心以去除上清液,并使用accuprep plasmid prep试剂盒(bioneer公司,韩国)从沉淀中提取质粒dna。通过uv光度计(shimazu公司,日本)测量质粒dna的浓度和纯度,证实其纯度为1.8到2.0,然后通过maxiscript体外转录试剂盒(ambion公司,美国)转录质粒dna。
[0195]
转录之后,通过uv光度计测量浓度和纯度,将纯度在1.8到2.0之间的dna在随后的实时rt-pcr中用作模板rna。通过以下公式计算rna的拷贝数:
[0196]
[公式1]
[0197]
6.02x 10
23
x浓度(通过uv光度计测定的浓度g/ml)/(3015 150)x 340
[0198]
(3015bp:t-载体的大小,150bp:丙肝病毒模板rna的大小)
[0199]
计算模板rna的拷贝数之后,用1x te缓冲液(10mm tris-hcl,ph 8.0,0.1mm edta)10倍稀释rna,并在使用前存放于-70℃下。
[0200]
使用accuprep病毒rna提取试剂盒(bioneer公司,韩国)从人血清(sigma-aldrich公司,美国)中提取rna,然后将200μl人血清用来提取,使用depc-d.w进行纯化以便具有50μl的最终体积。
[0201]
作为对照组,使用200μl depc-d.w,通过与自人血清提取rna相同的方法提取rna。通过nanodrop 2000(thermo scientific公司,美国)定量2μg提取自血清的rna然后使用。通过accupower hcv定量rt-pcr试剂盒(bioneer公司,韩国)进行实时rt-pcr。
[0202]
将构建的模板丙肝rna加入accupower hcv定量rt-pcr试剂盒中,以具有103、102和101的拷贝数。放入使用人血清提取的样品和depc-d.w与模板rna一起,以具有50μl的最终体积。
[0203]
通过exicycler 96实时定量热阻块(bioneer公司,韩国)进行实时rt-pcr,其中对于反应条件,一次反应循环包括如下rt-pcr:在50℃下15分钟、95℃下预变性5分钟、95℃下变性5秒、60℃下退火5秒、延伸、和扫描检测荧光,同时进行,总共重复45次。结果如图5中所示。
[0204]
结果可以证实,在具有加入了人血清提取rna的样品中的c(t)与具有使用depc-d.w提取的产物的样品相比向右侧移动,而荧光值显著降低。从c(t)向右侧移动和荧光值降低的现象可以得知,提取自人血清的rna造成了非特异性反应,该非特异性反应与hcr特异性rt-pcr竞争性反应,从而抑制了扩增。因而可以得知,当加入提取自人血清的rna时,与使
用depc-d.w的情况相比,hcv的实时rt-pcr受到抑制。
[0205]
在图5中,a示出通过加入提取自depc-d.w的样品获得的结果,b示出通过加入提取自人血清的样品获得的结果。
[0206]
[实施例2]存在于人血清中的通过rna终止的实时pcr中非特异性反应的抑制效果
[0207]
(1)通过poly(a)聚合酶和3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的rna终止反应
[0208]
在如实施例1中所描述那样从人血清中提取rna后,通过poly(a)聚合酶和3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止所提取的rna(3μg)的3
′
末端(处理组)。
[0209]
必须消除rna终止期间未反应而留下的3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp),因为其可起到rt-pcr和pcr反应的抑制剂的作用。
[0210]
通过3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止的rna由accuprep pcr纯化试剂盒(bioneer公司,韩国)纯化。3
′
末端未终止的rna(非处理组)也通过上述相同的方法纯化,并如上面实施例1所述,对处理组和非处理的每种rna定量2μg相同的量,且除进行终止之外,所有条件均以相同的方式进行。
[0211]
通过accupower hcv定量rt-pcr试剂盒(bioneer公司,韩国)进行实时rt-pcr。向accupower hcv定量rt-pcr试剂盒加入构建的模板丙肝病毒rna,以具有104、103和102的拷贝数。
[0212]
将被终止的rna(处理组)和普通提取的rna(非处理组)放进其中与模板rna一起,以具有50μl的最终体积。
[0213]
通过exicycler 96实时定量热阻块(bioneer公司,韩国)进行实时rt-pcr,其中对于反应条件,一次反应循环包括如下rt-pcr:在50℃下15分钟、95℃下预变性5分钟、95℃下变性5秒、60℃下退火5秒、延伸、和扫描检测荧光,同时进行,总共重复45次。结果如图6中所示。
[0214]
结果可以证实,与使用未终止的rna的样品(图6b)相比,实时rt-pcr中的反应抑制现象在使用经终止的rna的样品中显著减少(图6c)。
[0215]
从上述结果可以证实,rna可以起到rt-pcr和pcr反应中的引物的作用,而rna已经在先被防止起引物作用,使得非特异性扩增受到抑制,从而能够改善rt-pcr和pcr反应。
[0216]
在图6中,a示出通过添加仅作为模板的模板rna获得的结果,b示出通过向模板rna中添加普通提取自人血清的rna获得的结果,而c示出通过向模板rna添加提取自人血清的rna并终止获得的结果。
[0217]
(2)使用碱性磷酸酶(cip)去除3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的去除
[0218]
用于上面(1)中的rna终止的3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)在终止反应后剩余,其中优选在rna终止后消除所剩余的3
’‑
datp,因为其起到rt-pcr和pcr反应的抑制剂的作用。
[0219]
在实例1和上面(1)中,使用accuprep pcr纯化试剂盒(bioneer公司,韩国)消除3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)。
[0220]
为抑制3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的活性而不使用纯化试剂盒,使用cip(sigma-aldrich)。
[0221]
通过与上面(1)相同的方法终止rna,使用经cip处理以抑制3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的样品,并使用其中rna经3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止然后包含3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)而不纯化的样品,和通过accuprep pcr纯化试剂盒去除3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的样品作为对照组。
[0222]
以高温和ph变化灭活cip,因而cip在rt-pcr和pcr反应中灭活,从而最小化反应。然后,通过与上面(1)相同的条件进行实时rt-pcr。其结果示于图7中。
[0223]
在图7中,a示出使用其中片段rna经终止,然后通过cip水解3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的样品获得的结果,b和c作为对照组分别示出使用其中rna经3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)终止,然后包含3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)而不纯化的样品获得的结果,和c为通过accuprep pcr纯化试剂盒去除3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的样品。
[0224]
结果可以证实,rt-pcr和pcr反应被3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)所抑制。
[0225]
同时,可以证实在通过accuprep pcr纯化试剂盒和cip去除剩余的3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的样品中,rt-pcr和pcr反应没有被抑制。
[0226]
从上述结果可以证实,通过包含在大量rna中的rna自身的非特异性自引发能够由处理实施例的带3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的经纯化的核酸而去除,并能够以高灵敏度地获得能够检测靶核酸的核酸。
[0227]
此外,从上述结果能够证实,基本上消除了在用于检测痕量核酸的pcr反应或实时定量pcr反应中抑制靶核酸扩增反应的模板核酸的自引发,使得仅靶核酸能够被精确地扩增和检测,获者仅靶核酸的浓度能够被精确地测量。
[0228]
[实施例3]通过rna终止的经由rna自引发的非特异性rt-pcr的抑制效果
[0229]
(1)通过poly(a)聚合酶和3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)的rna终止反应
[0230]
通过与上面实施例1相同的rna提取试剂盒从作为一种人类细胞的hela c细胞提取rna。使用poly(a)聚合酶和3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp)(c,d)终止所提取的rna的3
′
末端。
[0231]
为消除剩余的3
’‑
脱氧腺苷5
’‑
三磷酸(3
’‑
datp),通过accuprep pcr纯化试剂盒(bioneer公司,韩国)纯化经终止的rna。在相同条件下通过上述相同的方法纯化3
′
末端未终止的rna(a和b)用于比较。为比较热启动rt-pct的效果,对b和d进行具有热启动功能的rt-pcr,而对a和c进行无热启动功能的rt-pcr。
[0232]
使用5μg每种rna,并用accupower rocketscript rt premix(bioneer公司,韩国)进行普通pcr,而对于热启动rt-pcr,向accupower rocketscript rt premix(bioneer公司,韩国)加入焦磷酸酯和焦磷酸酶(韩国专利第10-1098764号),然后加入蒸馏水,以具有20μl的最终体积,进行rt-pcr。为证实rna自引发的效果,不向其中加入rt-pcr所需的任何种类的引物。
[0233]
通过mygenie 96梯度热阻块(mygenie 96gradient thermal block,bioneer公司,韩国)进行rt-pcr,为证实rna自引发在反应混合过程中的效果,在25℃下进行温育20分钟。
[0234]
然后,为证实是否开展了通过rna自引发的rt-pcr,使用每种rt-pcr产物作为模板,并使用accupower dualstar qpcr premix(bioneer公司,韩国)对靶人gapdh基因进行实时rt-pcr(正向引物5
’‑
cgtggaaggactcatgaccaca-3’:seq id no:6,反向引物gccttggcagcgccagtaga-3’:seq id no:7和gapdh探针5
’‑
ctgtggatggcccctccgggaaa-3’:seq id no:8,分别具有10nm的浓度)。
[0235]
通过exicycler 96实时定量热阻块(bioneer公司,韩国)进行实时pcr,其中对于反应条件,一次反应循环包括在95℃下预变性5分钟、95℃下变性5秒、60℃下退火5秒、延伸、和扫描检测荧光,同时进行,总共重复45次反应循环。
[0236]
其结果在图8中示出。通过人gapdh基因的检测可以证实,即使未加入任何引物,在未终止的rna(a和b)中也产生了cdna。结果,由于通过自引发合成cdna,所以在pcr中实现了扩增。
[0237]
此外,即使热启动rt-pcr防止了非特异性cdna合成和随后的pcr扩增,其也没有完全完全被抑制,但通过rna自引发的rt-pcr部分受到抑制,使得ct值向右侧移动了大约5,从而以1/30的比例抑制了反应。
[0238]
然而,从具有3’末端被终止的rna的样品(c和d)可以得知,直到45个循环也没有实现在所有rt-pcr中的扩增,表明完全没有合成cdna。
[0239]
从上述结果可以证实,在混合rt-pcr反应物时,发生了许多非特异性rt-pcr,因而产生了很多非特异性cdna。此外,从上述结果可以证实,仅通过热启动rt-pcr不能够抑制不想要的反应,并且最终,通过使用本发明的终止反应来进行防止,能够完全抑制经由rna自引发的非特异性rt-pcr。
[0240]
图8中,a和b中使用未终止的rna,c和d中使用经终止的rna。在a和c中进行普通rt反应,而在b和d中进行热启动rt反应。
[0241]
[实施例4]通过各种修饰的阻断寡核苷酸的非特异性反应的抑制效果
[0242]
在将各种取代基施加于阻断寡核苷酸的3’末端之后,证实了热启动反应对阻断寡核苷酸的效果。所使用的取代基在下表2中示出。通过重复一个循环过程进行pcr反应,所述一个循环过程包括95℃下20秒的步骤,55℃下40秒的步骤,和72℃下60秒的步骤,总共30次,并且分别在94℃进行5分钟的预变性和72℃下进行5分钟的最终延伸。其结果在图12中示出。
[0243]
在图12中,泳道1、2和3分别示出使用具有表1中示出的碱基序列p55/p63(447bp)、p55/p73(1,082bp)和p55/p83(1,29 6bp)的引物对的结果。此外,a示出使用具有热启动功能的热启动pcr预混合物作为阳性对照组的结果,而b、c、d、e、f和g作为阴性对照组示出在不具有热启动功能的pcr预混合物中,使用下表2中示出的每种即时阻断寡核苷酸,接着pcr反应获得的结果。泳道m示出能够区分dna尺寸的100bp dna分子梯度。
[0244]
[表2]
[0245][0246][0247]
结果可以证实,即使在具有与引物互补的碱基序列的阻断寡核苷酸的3’末端存在任何种类的能够阻断dna聚合酶的化学物质,也能够抑制非特异性扩增反应。
[0248]
[实施例5]实时pcr反应中通过阻断寡核苷酸的引物二聚体抑制效果
[0249]
为证实在实时pcr反应中通过含有阻断寡核苷酸的pcr的热启动效果,通过如下方式来制备组合物:向2x pcr premix溶液(含10mm tris hcl ph 9.0、50mm kcl、2.0mm mgcl2、四种dntp每种250μm、1u taq.dna聚合酶、0.01%tween 20和稳定剂)中加入荧光物质(greenstar
tm
,bioneer公司),以便20μl的每种反应为0.3x,然后加入20mol与正向引物相同浓度的阻断寡核苷酸。作为对照组,向2x pcr premix溶液中加入荧光物质,以便20μl的每种反应为0.25x。荧光物质为能够通过测定由双链dna之间夹层所生成的荧光量来方便地进行分析的荧光物质,所述双链dna在扩增无荧光探针并具有特异性碱基序列的模板dna时出现。使用通过以下方法获得的5μl cdna作为模板dna:向accupower cyclescript rt premix(bioneer公司)加入100ng提取自人细胞的总rna,接着在42℃下反应1小时,然后在95℃下灭活逆转录酶5分钟。对20μl的每种反应以每种20pmol的浓度使用下表3中所述的引物和阻断寡核苷酸。
[0250]
[表3]
[0251][0252]
通过实时pcr反应exicycler 96实时定量热阻块(bioneer公司,韩国)进行实时pcr反应,其中对于反应条件,一次反应循环包括在94℃下预变性5分钟、95℃下变性10秒、60℃下退火15秒、延伸,同时进行,总共重复45次反应循环。然后,进行解离步骤,然后对扩增产物准备熔解曲线以证实pcr扩增产物上的pcr反应性和特异性。其结果在图13中示出。
[0253]
结果,线条i和线条ii的预知循环值(ct)为,线条i为23.89c(t),线条ii为29.5c(t)(图13)。在线条i中,与线条ii相比,c(t)值向左侧移动,原因是含有阻断寡核苷酸的线条ii表现出仅一个荧光峰值,表明只产生精确的扩增产物;同时不含阻断寡核苷酸的线条i表现出两个峰值,表明产生了两种扩增产物,如熔解曲线中示出。这意味着产生了尺寸比目的pcr扩增产物的尺寸小的荧光二聚体扩增产物或非特异性扩增产物。此外,证实了在实验组(线条ii)和对照组(线条i)中精确pcr扩增产物的熔解温度(tm)为85.5℃,而证实了引物二聚体或非特异性扩增产物的熔解温度(tm)为75.5℃,低于精确pcr扩增产物的熔解温度。
[0254]
从上述结果可以得知,在对照组中,产生了除扩增产物外的引物二聚体从而具有低特异性,相比之下,本发明中使用的即时热启动pcr方法在实时pcr反应和pcr反应中能够有效地复原抑制在低温下表现出的非特异性反应的pcr反应,从而具有抑制非特异性pcr扩增产物产生的热启动方法的优点,并证实了精确的结果。
[0255]
尽管详细描述了本发明的具体实施方式,但本领域技术人员显然知道,该具体描述仅仅是希望的示例性实施方式,而不应被视为对本发明范围的限制。因而,本发明的实质范围由所附权利要求书及其等同方式来限定。
[0256]
工业实用性
[0257]
利用根据本发明的用于制备核酸的方法,将核酸聚合终止子加入在检测核酸中使用的模板核酸中,所述检测核酸使用诸如pcr反应、实时定量pcr反应或类似反应的核酸聚合来检测痕量核酸,使得可以基本上消除抑制靶核酸的扩增反应的非特异性自引发和随后的非特异性扩增,从而可消除假阳性扩增,可以精确地仅检测靶核酸,特别是痕量核酸。
[0258]
序列目录
[0259]
已附上附件。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
