低密度细胞培养
1.本发明涉及一种从cd34
人干细胞产生自然杀伤细胞的集合的方法。本发明进一步涉及一种由此产生的自然杀伤细胞的集合和一种包含此类自然杀伤细胞的药物组合物。此外,本发明涉及该药物组合物作为药物、特别是用于在用于治疗恶性肿瘤中的免疫疗法的方法中使用的用途。
背景技术:
2.造血
3.造血干细胞
4.多细胞生物体的发育主要依赖于成体干细胞的功能。这些细胞被定义为未分化细胞,这些未分化细胞可以在长时间段内自我更新,并且在发育期间产生定型为更特定谱系的祖细胞。干细胞的受控发育和分化导致高度复杂的功能器官或器官系统。然而,干细胞不受控制的分化或遗传畸变可能导致死亡或者发展癌症、免疫缺陷、自身免疫或骨髓功能不全。在过去50年中,就自我更新能力或谱系特异性分化以及遗传和功能水平上的细胞命运定型而言,hsc已成为研究最深入的干细胞。此外,hsc的移植已被广泛用于治疗白血病和其他类型的癌症(1,2)。已经清楚地证明,成人和新生儿hsc在清髓性治疗后保持重建患者的造血系统的能力(3)。因此,hsc的一个重要特征是能够补充所有谱系的成熟血细胞的能力。
5.从hsc至成熟血细胞
6.造血描述了hsc的自我更新以及对代表祖细胞和效应细胞的所有不同血液谱系的终生替代的过程和能力。造血在胚胎发育期间发生,并且hsc在妊娠中期中产生在含有背主动脉、性腺和中肾的胚胎区域(即agm区域)内,并且在卵黄囊、胎盘和胎肝中进一步发育(4)。成人造血位于骨髓(bm)中,并且hsc的自我更新和分化在bm的特定小生境内受到调控(5,6)。在过去30年中,最常见的造血发育模型描述了造血的二元细胞命运树,其中在第一分支中,hsc产生两种不同的造血祖细胞(hpc),即针对髓样-红细胞的共同髓样祖细胞(cmp)(产生红细胞、血小板、单核细胞、巨噬细胞和粒细胞)和针对淋巴细胞的共同淋巴样祖细胞(clp)(分化为t细胞、b细胞和nk细胞)(7)。
7.造血干细胞移植
8.自50多年以来,在用化学疗法和放射疗法进行一线治疗以减轻肿瘤负担并实现长期缓解后,将hsc用于移植以治疗血液癌症和一些实体瘤(8)。由于耐药性和复发仍然是主要问题,因此自体和人白细胞抗原(hla)相匹配的异基因hsct被用作恶性和非恶性血液疾病的潜在治愈性细胞疗法治疗。在异基因hsct中,供体t细胞介导强大的移植物抗肿瘤(gvt)效应(9)。然而,t细胞也可能引起gvhd,并且因此限制了异基因hsct的整体有效性。t细胞耗尽的各种方法降低了gvhd的风险,并且另外允许跨组织相容性屏障进行移植,但可能增加移植物排斥或复发的风险。最有趣的是,nk细胞已被描述为消除白血病复发和移植物排斥,并且保护患者免于单倍体相合hsct环境中的gvhd(10),这主要是因为其抑制和裂解gvhd诱导t细胞(11)和宿主抗原呈递细胞(apc)的能力,这两种细胞对于gvhd诱导中供体t细胞的激活是至关重要的(12)。此外,有临床证据表明,高nk细胞剂量在非亲缘hsct中预
防严重gvhd,同时保留gvt效应(13)。因此,nk细胞如今已成为非常有吸引力的淋巴细胞群体用于hsct和非hsct移植相关治疗方案中的抗癌免疫疗法。
9.自然杀伤细胞
10.nk细胞亚组和功能
11.nk细胞最初在70年代中期被鉴定为除了t细胞和b细胞以外的第三大淋巴细胞亚群(14-17)。nk细胞是先天性免疫系统的重要效应细胞,因为它们可以在没有预先敏化即“自然”杀伤的情况下发挥快速效应功能。因此,nk细胞在早期防御病毒和细菌感染中以及在肿瘤免疫监视中起关键作用(18,19)。nk细胞存在于淋巴器官和各种非淋巴组织中。除了它们的细胞溶解活性以外,nk细胞能够产生多种多样的细胞因子和趋化因子来影响免疫系统的其他细胞区室(20,21)。nk细胞可以广义地定义为cd56
cd3-淋巴细胞(占循环淋巴细胞群体的5%-15%)(22)。基于cd56表达水平,可以将它们细分为两个主要亚组。cd56
暗淡
nk细胞(占外周血nk细胞的大约90%)具有显著的细胞溶解潜力,并且表达高水平的低亲和力fc受体iii(fcrγiii;被cd16识别),从而允许它们介导抗体依赖性细胞毒性(adcc)(23,24)。相比之下,cd56
亮
nk细胞(占所有nk细胞的约10%)主要具有由inf-γtnf-α和gm-csf的有效产生介导的免疫调控功能。
12.nk细胞通过来自种系编码的抑制性受体(ir)或激活性受体(ar)的信号来识别并杀伤感染或恶性转化的细胞(25)。这些信号的组合平衡并调节nk细胞效应功能。当激活性信号占主导时,触发nk细胞的细胞毒性和细胞因子产生。相比之下,当抑制占主导时,这些功能被阻断。激活后,nk细胞使用若干种杀伤机制裂解易感靶细胞(26),这些若干种杀伤机制包括含有穿孔素和颗粒酶的细胞毒性颗粒的释放(27,28)、trail依赖性细胞毒性和fas介导的细胞凋亡的激活(28,29)。
13.nk细胞受体
14.nk细胞使用多种ar和ir来识别肿瘤细胞或病毒感染细胞(30-32)。在人中,已描述了若干种类型的hla i类特异性ir,包括识别成组的hla i类分子的杀伤抑制性免疫球蛋白受体(kir)和对呈递源自经典hla i类分子的信号序列的肽的非经典hla-e分子具有特异性的cd94/nkg2a家族的c型凝集素受体(33,34)。这些受体的发现显现于显示nk细胞的细胞毒性由缺乏自身mhc i类分子的肿瘤细胞触发(这被称为,,自身缺失”识别)的早期观察结果。每个nk细胞表达抑制性受体和刺激性受体的不同组合,使得存在对自身mhc i类等位基因具有特异性的至少一种抑制性kir。在稳态下,nk细胞由对否决潜在刺激信号的自身hla i类分子的识别抑制。但在恶性转化的情况下,肿瘤细胞可以下调自身hla i类表达或在hla错配的移植环境中仅显示非自身hla i类分子,同时上调触发nk细胞介导的肿瘤细胞裂解的激活性配体。在hsct环境中,在供体nk细胞未出现针对接受者肿瘤细胞上存在的hla配体的抑制性kir的情况下,认为nk细胞发挥更高的gvt效应,因为它们潜在地较少受到现有“kir-配体”错配的抑制。在半相合异基因hsct、脐带血(35)和异基因过继性nk细胞疗法的环境中的回顾性研究已显示,此,,kir-配体”错配可能是抗肿瘤作用的原因。
15.激活性信号由ar介导,其中除了上述cd16以外,最重要的受体是nkg2d、dnam-1以及自然细胞毒性受体(ncr)即nkp30、nkp44和nkp46。nkg2d的配体是应激诱导型蛋白mica/b和ulbp。dnam-1识别脊髓灰质炎病毒受体(pvr)和连接素-2,而ncr的配体是肝素、硫酸肝素和病毒血凝素,但也存在参与ncr的识别但目前尚未鉴定出的潜在蛋白质。这些ar的大多数
配体主要由“应激”癌性细胞和病毒感染细胞表达。激活性配体的高表达与nk细胞上ar的高表达可以克服抑制性信号并且激活nk细胞以杀伤靶细胞。基于这些功能概念,nk细胞可以在没有预先免疫的情况下诱导肿瘤细胞死亡,并且产生为激活淋巴结中树突状细胞的关键介体的细胞因子(诸如ifn-γtnf-α和gm-csf),从而将基于先天性nk细胞的免疫与适应性t细胞介导的免疫相关联。有趣的是,在用诸如il-2、il-15、il-18、il-12或ifn-γ的细胞因子刺激后,nk细胞的细胞毒性活性增加,并且这些激活的nk细胞能够根除对所谓“静息nk细胞”具有抗性的靶标(18)。
16.nk细胞发育
17.nk细胞产生自hsc,并且bm通常被认为是人nk细胞发育的主要部位(4-7)nk细胞及其祖细胞也存在于诸如脾脏、肝脏和淋巴结的淋巴器官中,但也可以迁移至肺、肠道和各种其他组织中(综述于(36)中)。在bm微环境内,cd34
hsc和hpc可以由生长因子像il-2或il-15强制分化为nk细胞谱系。在2005年,freud等人鉴定出驻留在淋巴结(ln)中的bm来源的cd34
hpc,在淋巴结中可能发生进一步分化为cd56
亮
nk细胞(37)。此外,他们基于cd34、cd117和cd94的细胞表面表达鉴定出次级淋巴组织(slt)内人nk细胞发育的四个独立阶段:即第1阶段,cd34
cd117-cd94-;第2阶段,cd34
cd117
cd94-;第3阶段,cd34-cd117
cd94-;以及第4阶段,cd34-cd117
/-cd94
(38)。nk细胞发育后,在第3阶段发生向nk细胞谱系的定型,其中cd56显现在细胞表面上并且在第4阶段中产生cd56
亮
nk细胞。这些数据确认了描述slt中大量存在cd56
亮
nk细胞的先前研究(39,40)。另外,已显示cd56
亮
细胞是在造血sct之后出现的第一成熟nk细胞(41,42)。总的来说,这些数据支持体内人nk细胞发育模型,其中cd34
nk细胞前体从bm运输至slt,在此处发生进一步分化为cd56
亮
nk细胞。
18.迄今为止,尚未描述人nk细胞发育和成熟的完整途径,并且nk细胞前体有可能从bm运输至其他组织以进行原位终末分化(43)。此外,nk细胞通过称为“nk细胞许可或教育”的过程获得其细胞毒性和细胞因子产生能力(44,45)。尽管此过程仍有待完全理解,但据推测,在教育过程期间ir与自身hla i类配体接合之后,nk细胞变为具有功能能力的(即“得到许可来杀伤”)(44,46)。基于此“许可”模型,没有ir表达的nk细胞未完成教育过程,因此仍然未得到许可并且在功能上“低反应”(46-48)。在所描述的nk细胞通过nk细胞发育途径的若干个阶段的转变期间,第3阶段细胞通过获得cd94/nkg2a受体转变为第4阶段细胞。然后这些细胞能够与某些细胞因子诸如il-2、il-12、il-15、il-18或il-21起反应,以获得细胞因子产生功能和低细胞毒性潜力(49,50)。此后,经充分教育的nk细胞获得迁移至外周组织的能力,并且另外获得功能性受体像cd16、nkg2d或kir,从而变为具有高度细胞毒性(51,52)。
19.已在cd34
hsc和hpc的池中鉴定出若干种nk细胞祖细胞,并且初始认为nk细胞由t细胞和nk细胞的双能祖细胞发育(53)。大多数关于nk细胞发育的体外研究已通过以下方式进行:主要在il-15、il-2、scf和fms相关酪氨酸激酶3配体(flt3-l)的存在下,培养来自bm(54)、pb、cb(55)和胎肝(fl)(56)的纯化人cd34 细胞,这些细胞可以分化为cd56
cd3-nk细胞。此方法已鉴定出nk细胞祖细胞上的另外表面抗原,包括cd7(57)、cd122(58)、cd161(59)和cd45ra
高
(37)。此外,发现cd34
cd38-cd7
细胞是最原始的淋巴前体细胞,这些细胞产生nk细胞、b细胞和dc,但不产生髓样细胞或红细胞。然而,最近也已描述髓样cd14
cd11b
cd13
cd33
细胞(60)或cd56-cd117
m-csfr
细胞(61)具有使用il-15和flt3-l或基质饲养细胞
(stromal feeder cell)分化为成熟和功能性nk细胞的能力。基于小鼠nk细胞和小鼠模型的大部分研究已鉴定出在调控nk细胞发育中起作用的各种转录因子,诸如ets-1(62)、pu.1(63)、mef(64)、gata-3(65)、t-bet(66)、irf-2(67)、id2(68,69)、e4bp4(70),然而,如敲除实验中所示,这些转录因子中的大多数并非在nk细胞发育中起唯一作用。
20.因此,大多数体外扩增和分化方案利用了来源材料(例如bm、pb、cb或胎肝)中存在的cd34
干细胞。nk细胞产生的放大在很大程度上受到这些组织中cd34
干细胞的低百分比、且因此受这些细胞用于开始的低绝对细胞计数的阻碍。例如,可以在从骨髓动员至血液之后,使用单采术机器从外周血中分离出cd34
干细胞,其量为约1,5x105/ml(71)。在单一单采术中,可以获得多达7x108个cd34
细胞(71,72)。
21.从脐带血开始,预期总细胞计数甚至更低,来自一名供体的总计中值为约1.5x106个,具有高变异性。已显示脐带血中cd34
造血干细胞的产量随胎龄(73)、分娩方式(74)和分娩后分娩的新生儿的姿态(75)而变化。由于其中的低细胞计数和高变异性,因此所有脐带血单位中仅约20%(即所谓的“高输出”脐带血单位)为我们先前描述和验证的nk细胞扩增和分化方案提供足够的起始材料,以便获得足够的nk细胞用于临床试验中(wo 2017077096)。因此,仅每五个脐带血单位可用于产生临床批次。
22.尽管脐带血作为用于扩增和分化为nk细胞的起始材料产生的cd34
细胞绝对数量最低,但脐带血因其易于收集、相对免疫耐受性、无限供应和没有伦理担心而是优选的(76)。然而,如上所述,每次收集的cd34
细胞数量低造成一个明显的缺点,尤其是对于较大体型的成人移植接受者。在不改变每个脐带组分内的细胞质量的情况下提高绝对cd34
数量的方法对于其在临床研究中的持续使用极其重要。此类研究已被其他人(76)综述并且例如使用stemregenin1在培养15天后显示出cd34
绝对数量的高达330倍增加(77)。例如,烟酰胺在21天后显示出21倍增加(78),并且间充质干细胞共培养物在14天后显示出30倍增加(79)。然而,向(初始)培养物中添加化学化合物或饲养细胞可以对nk细胞的进一步发育和分化产生影响。它还可以对获得上市许可产生影响。
23.因此,需要在分化前增加cd34
干细胞的数量的新方法和/或增加最终分化的nk细胞的数量和/或质量的方法。
技术实现要素:
24.本发明提供了用于增加cd34
来源的nk细胞的产量的此类一种或多种方法。在一方面,本发明提供了一种用于产生干细胞、祖细胞、和/或祖nk细胞的集合的方法,所述方法包括以下步骤:
25.(i)从包含cd34
人干细胞的样品起始细胞培养并且将这些细胞在基本培养基中培养至少7天,该基本培养基包含干细胞因子(scf)和白介素-7(il-7)、以及flt-3配体(flt-3l)和血小板生成素(tpo)中的一种或多种,其特征在于该包含cd34
人干细胞的细胞培养以10,000个cd34
细胞/ml或更少、优选地在500与10,000个cd34
细胞/ml之间、更优选地在1,000与8,000个cd34 细胞/ml之间、更优选地在2,000与6,000个cd34 细胞/ml之间的细胞密度起始。随后,该培养步骤之后可以是将步骤(ii)中获得的细胞在包含细胞因子的集合的培养基中培养至少4天,从而获得含有多种nk祖细胞和/或nk细胞的培养细胞的集合,其中所述细胞因子的集合包含il-15、il-2、scf、和il-7中的三种或更多种。
26.根据本发明的方法不仅在培养12-15天后导致造血干细胞或祖细胞的绝对增加,而且令人惊讶地发现进一步扩增和分化培养方法(如实例中和先前在wo 2017077096中所述的)导致扩增的进一步增加并且导致与以更密浓度培养cd34
干细胞的方法相比等同或更佳质量的nk细胞)。根据本发明的方法的一个另外优点在于,该方法能够培养从自动细胞分选仪获得的cd34
造血干细胞,而无需预先人工操作(例如像离心和悬浮)为更小体积。这是因为自动细胞分选之后的细胞浓度在约500-10,000个cd34
细胞/ml的范围内,而常规地初始培养约100,000个cd34
细胞/ml或更多(veluchamy等人,front immunol[免疫学前沿]2017,8:87;roeven等人,stem cells and development[干细胞和发育]2015,24(24):2886-2898)。这使得能够进一步自动化选择和培养过程,从而有益于标准化和获得上市许可。
[0027]
在一方面,因此,本发明提供了一种用于产生干细胞、祖细胞、和/或nk细胞的集合的方法,所述方法包括以下步骤:
[0028]-通过全自动封闭系统选择cd34
hsc;
[0029]-收集和培养由此从包含cd34
人干细胞的样品选择的cd34
hsc并且将这些细胞在基本培养基中培养至少7天,该基本培养基包含白介素-7(il-7)和干细胞因子(scf)、以及flt-3配体(flt-3l)和血小板生成素(tpo)中的一种或多种,其中该收集步骤优选地在该全自动封闭系统内,其特征在于该细胞培养以最多12,000个cd34
细胞/ml、优选地在500与10,000个cd34
细胞/ml之间、更优选地在1,000与8,000个cd34
细胞/ml之间的细胞密度,最优选地以在2,000与6,000个cd34
细胞/ml之间的细胞浓度起始。该方法可以通过进行以下随后培养步骤进一步扩展:将步骤(ii)中获得的细胞在包含细胞因子的集合的培养基中培养至少13天,从而获得含有多种nk祖细胞和/或nk细胞的培养细胞的集合,其中所述细胞因子的集合包含il-15、il-2、scf、和il-7中的三种或更多种。
[0030]
由此获得的nk细胞与迄今为止已知的nk细胞的不同之处在于:它们在培养28天或35天后尤其是以非常高百分比完全分化、能够高效杀伤靶细胞、并且可以从单一供体以非常高的细胞数量获得。因此,在一方面,本发明还提供了一种通过根据本发明的方法获得的nk细胞的集合,其中该nk细胞的集合具有这些新颖和创造性特性中的至少一种或多种。在一方面,根据本发明的nk细胞的集合的特征在于该集合含有来自单一供体的至少10,000,000,000(10
10
)个nk细胞。
[0031]
在一方面,本发明提供了一种药物组合物,该药物组合物包含这些新颖和创造性nk细胞的集合(该集合的一部分)。该药物组合物尤其可用作药物、特别是用于在治疗肿瘤和血液恶性肿瘤中使用。
[0032]
在一方面,本发明提供了治疗需要过继性nk细胞转移的个体的方法,该方法包括向所述个体施用这些新颖和创造性nk细胞的集合(该集合的一部分)。
附图说明
[0033]
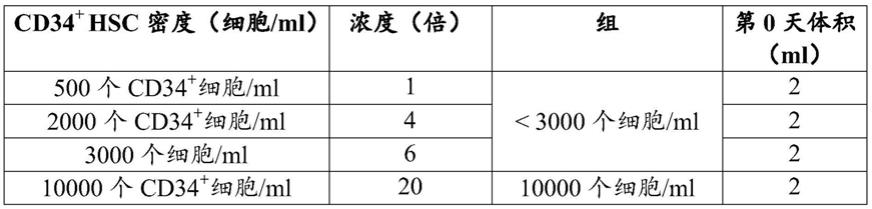
图1-接种密度对从新鲜脐带血(ucb)中纯化且在完全扩增培养基中培养的cd34
造血干细胞(hsc)的扩增的影响。a.将新鲜分离的第0天hsc在扩增培养基中以不同的增加密度培养,并且经由流式细胞术在第5-6、8-9和12-15天分析细胞扩增。将类似的细胞密度分组:500个cd34
细胞/ml、2000个cd34
细胞/ml和3000个cd34
细胞/ml:《3000个cd34
细
胞/ml;10000个cd34
细胞/ml;30000个cd34
细胞/ml和40000个cd34
细胞/ml:30-40000个cd34
细胞/ml;60000个cd34
细胞/ml和75000个cd34
细胞/ml:60-75000个cd34
细胞/ml;100000个cd34
细胞/ml和》250000个cd34
细胞/ml。将针对每种条件的细胞扩增(计算为[在测量日的细胞数/ml除以在第0天的cd34
细胞数/ml])相对于时间进行作图。低密度接种细胞,即高达10000个cd34
细胞/ml显示出更高的扩增潜力。b.针对基于100000个cd34
细胞/ml(设置为=1)的每种细胞密度计算hsc相对终点(第12-15天)扩增并且将其相对于增加密度进行作图,其中将500个cd34
细胞/ml设置为=1(即,1-6=《3000个cd34
细胞/ml,20=10000个cd34
细胞/ml,60-80=30-40000个cd34
细胞/ml等)。直方图示出了两个变量之间的逆相关性,表明了当细胞密度增加时低密度接种细胞的高扩增潜力如何逐渐降低。结果是针对n=5个生物学平行测定的技术一式两份或一式三份的平均值(sd);使用单因素方差分析来分析数据。*p≤0.033;**p≤0.002;***p≤0.001;观察到的所有其他差异是统计学上不显著的。
[0034]
图2-扩增期密度对cd34
造血干细胞(hsc)来源的祖细胞在完全分化培养基中分化为成熟效应细胞的影响。在第12-15天,将细胞培养设置从扩增切换至分化期;将所有条件设置在1.5*106个细胞/ml的相同密度下并且在第20-21、27-28和35-36天经由流式细胞术监测细胞分化表型。将类似的细胞密度分组:500个cd34
细胞/ml、2000个cd34
细胞/ml和3000个cd34
细胞/ml:《3000个cd34
细胞/ml;10000个cd34
细胞/ml;30000个cd34
细胞/ml和40000个cd34
细胞/ml:40000个cd34
细胞/ml;60000个cd34
细胞/ml和75000个cd34
细胞/ml:75000个cd34
细胞/ml;100000个cd34
细胞/ml。该图示出了分化(作为培养中分化细胞的%)相对于时间的进展。低密度条件(《3000个cd34
细胞/ml)在早期分化(第20-21天)期间稍微延迟。在第35-36天,所有条件完全分化为效应细胞,其中低密度(《3000个cd34
细胞/ml且特别是10000个cd34
细胞/ml)达到稍微更高且更一致的数量。结果是针对n=5个生物学平行测定的技术一式两份或一式四份的平均值(sd);使用单因素方差分析来分析数据。观察到的任何差异是统计学上不显著的。
[0035]
图3-扩增期密度对完全培养基中的成熟效应细胞效力的影响。在第35-36天针对所有扩增密度经由流式细胞术分析效应细胞的效力(确定为以1:1效应物:靶标比率共培养过夜之后杀伤靶肿瘤细胞的%)。该图示出了针对所有密度的杀伤靶细胞的%,分组如下:500个cd34
细胞/ml、2000个cd34
细胞/ml和3000个cd34
细胞/ml:《3000个cd34
细胞/ml;10000个cd34
细胞/ml;30000个cd34
细胞/ml和40000个cd34
细胞/ml:40000个cd34
细胞/ml;60000个cd34
细胞/ml和75000个cd34
细胞/ml:75000个cd34
细胞/ml;100000个cd34
细胞/ml。细胞效力对于低密度条件(10000个cd34
细胞/ml、且特别是《3000个cd34
细胞/ml)更高并且随着增加的密度逐渐降低。结果是针对n=4个生物学平行测定的技术一式三份的平均值(sd);使用单因素方差分析来分析数据。观察到的任何差异是统计学上不显著的。
[0036]
图4-细胞培养期间的prodigy选择和人工选择的cd34
造血干细胞(hsc)和效应细胞形态。在扩增期和分化期期间监测hsc和效应细胞的视觉外观和增殖;对于prodigy选择和人工选择两种方法示出了75000个cd34
细胞/ml以作为所有扩增条件的代表。细胞保持健康、圆形并且未由于扩增聚集;强烈增殖从第2天(小图a、b)至第9天(小图c、d)是明显的,直到第14天(小图e、f)。在第2天存在于培养物中的红细胞在第14天完全消失。对于两种方
法,在第35天的分化效应细胞看起来健康并且梨形(小图g、h)。第2、9和14天图片对于两种条件自相同细胞培养孔拍摄;第35天图片自分化之后的相同细胞拍摄。n=1个生物学平行测定。
[0037]
图5-细胞分离方法和接种细胞密度对从新鲜脐带血(ucb)中纯化且在完全扩增培养基中培养的cd34
造血干细胞(hsc)的扩增的影响。a.将新鲜prodigy分离和人工分离的第0天cd34
hsc在扩增培养基中以6种不同的增加密度(500个cd34
细胞/ml、2000个cd34
细胞/ml、10000个cd34
细胞/ml、40000个cd34
细胞/ml、75000个cd34
细胞/ml、100000个cd34
细胞/ml)培养并且在第15天经由流式细胞术分析细胞扩增。对于第0天和第15天对针对每种条件的细胞扩增(计算为[在第15天的细胞数/ml除以在第0天的cd34
细胞数/ml])进行作图。低密度接种细胞显示出更高的扩增潜力,在两种方法之间没有差异。b.针对基于100000个cd34
细胞/ml(设置为=1)的每种细胞密度计算prodigy选择和人工选择的细胞相对第15天扩增并且将其相对于增加密度进行作图,其中将500个cd34
细胞/ml设置为=1(即,1=500个cd34
细胞/ml,4=2000个cd34
细胞/ml,20=10,000个cd34
细胞/ml等)。直方图示出了密度与扩增之间的逆相关性,在两种方法之间没有差异。结果是单一数据点或者一式两份的平均值。n=1个生物学平行测定。
[0038]
图6-细胞分离方法和扩增期密度对cd34
造血干细胞(hsc)来源的祖细胞在完全分化培养基中分化为成熟效应细胞的影响。在第15天,以1.5*106个细胞/ml接种以不同密度扩增的prodigy分离和人工分离的细胞,并且将细胞培养条件从扩增期切换至分化期。在第20、28和35天经由流式细胞术监测细胞分化进展。该图示出了对于两种方法分化(作为培养中分化细胞的%)相对于时间的进展。在prodigy分离的细胞中,所有较低细胞密度条件(500个cd34
细胞/ml、2000个cd34
细胞/ml和10000个cd34
细胞/ml)在所有阶段中显示出与较高初始密度(40000个cd34
细胞/ml、75000个cd34
细胞/ml和100000个cd34
细胞/ml)相比更高的分化状态,在早期时间具有更突出的优势(第20-28天)。对于人工分离的cd34
细胞,可以看到类似的趋势,但不太突出。结果是单一数据点或者一式两份或一式四份的平均值。n=1个生物学平行测定。
[0039]
图7-细胞分离方法和扩增期密度对完全培养基中的成熟效应细胞效力的影响。在第35天针对prodigy选择和人工选择的扩增条件经由流式细胞术分析效应细胞的效力(确定为以1:1效应物:靶标比率共培养过夜之后杀伤靶肿瘤细胞的%)。直方图示出了相对于密度的靶细胞杀伤的%。低密度条件(500个cd34
细胞/ml、10000个cd34
细胞/ml、且特别是2000个cd34
细胞/ml)对于两种方法类似地相比于较高密度(75000个cd34
细胞/ml和100000个cd34
细胞/ml)触发更高的杀伤,但在prodigy分离的细胞中更突出。结果是单一数据点或者一式两份(各自以技术一式三份分析)的平均值。n=1个生物学平行测定。
[0040]
图8-接种密度对从新鲜脐带血(ucb)中纯化的cd34
造血干细胞(hsc)在无低密度细胞因子混合物(ldc)的扩增培养基中的扩增的影响。a.将新鲜分离的第0天hsc在无ldc的扩增培养基中以不同的增加密度培养,并且经由流式细胞术在第6、9和13-14天分析细胞扩增。将类似的细胞密度分组:500个cd34
细胞/ml、2000个cd34
细胞/ml和10000个cd34
细胞/ml:《10000个cd34
细胞/ml;40000个cd34
细胞/ml、75000个cd34
细胞/ml和100000个cd34
细胞/ml:》40000个cd34
细胞/ml。将细胞扩增针对每种条件计算为[在测量日的细胞数/ml除以在第0天的cd34
细胞数/ml],相对于时间进行作图。低于10000个cd34
细胞/ml的
细胞接种密度在第13天导致更高的细胞扩增。b.针对基于100000个cd34
细胞/ml(设置为=1)的每种细胞密度计算hsc相对终点(第13-14天)扩增并且将其相对于增加密度进行作图,其中将500个cd34
细胞/ml设置为=1(即,1-20=500-10,000个cd34
细胞/ml并且80-200=40,000-100,000个cd34
细胞/ml)。直方图示出了两个变量之间的逆相关性,表明了当细胞密度增加时低密度接种细胞的高扩增潜力如何逐渐降低。结果是针对n=2个生物学平行测定的技术一式两份或一式三份的平均值(sd);使用学生t检验来分析数据。ns=统计学上不显著的差异;*p≤0.033。
[0041]
图9-扩增期密度对cd34
造血干细胞(hsc)来源的祖细胞在无低密度细胞因子混合物(ldc)的分化培养基中分化为成熟效应细胞的影响。在第13-14天,将细胞对于分化培养期接种在无ldc的分化培养基中;将所有条件设置在1.5*106个细胞/ml的相同密度下并且在第20-21、27-28和35-36天经由流式细胞术监测细胞分化表型。将类似的细胞密度分组:500个cd34
细胞/ml、2000个cd34
细胞/ml和10000个cd34
细胞/ml:《10000个cd34
细胞/ml;40000个cd34
细胞/ml、75000个cd34
细胞/ml和100000个cd34
细胞/ml:》40000个cd34
细胞/ml。该图示出了随时间的分化细胞的%。在低密度(《10000个cd34
细胞/ml)与高密度(》40000个cd34
细胞/ml)之间未观察到差异。结果是针对n=4个生物学平行测定的单一数据点的平均值(sd);使用学生t检验来分析数据。观察到的任何差异是统计学上不显著的。
[0042]
图10-扩增期密度对无低密度细胞因子混合物(ldc)的培养基中的成熟效应细胞效力的影响。在第35-36天针对在无ldc的培养基中培养的所有扩增密度经由流式细胞术分析效应细胞的效力(确定为以1:1效应物:靶标比率共培养过夜之后杀伤靶肿瘤细胞的%)。该图示出了针对所有密度的杀伤靶细胞的%,分组如下:500个cd34
细胞/ml、2000个cd34
细胞/ml和10000个cd34
细胞/ml:《10000个cd34
细胞/ml;40000个cd34
细胞/ml、75000个cd34
细胞/ml和100000个cd34
细胞/ml:》40000个cd34
细胞/ml。相比于较高密度(》40000个cd34
细胞/ml),杀伤效力在低密度条件(《10000个cd34
细胞/ml)下更高结果是针对n=3个生物学平行测定的技术一式三份的平均值(sd);使用学生t检验来分析数据。*p≤0.033。
[0043]
图11-接种密度对从新鲜脐带血(ucb)中纯化的cd34
造血干细胞(hsc)在2%人血清、5x细胞因子、无低密度细胞因子混合物(ldc)的扩增培养基中的扩增的影响。a.将新鲜分离的第0天hsc在2%人血清、5x细胞因子、无低密度细胞因子混合物(ldc)的扩增培养基中以低密度(2000个cd34
细胞/ml)或高密度(40000个cd34
细胞/ml)培养,并且在第6、9和14天经由流式细胞术分析细胞扩增。将针对每种条件随时间测量的细胞扩增(计算为[在测量日的细胞数/ml/在第0天的cd34
细胞数/ml])相对于时间进行作图。如果相比于40000个cd34
细胞/ml,则2000个cd34
细胞/ml的接种密度导致更高的细胞扩增。b.针对基于40000个cd34
细胞/ml(设置为=1)的每种细胞密度计算hsc相对终点(第14天)扩增并且将其相对于增加密度进行作图,其中将2000个cd34
细胞/ml设置为=1(即,1=2000个cd34
细胞/ml并且20=40,000个cd34
细胞/ml)。直方图示出了两个变量之间的逆相关性,表明了当细胞密度增加时低密度接种细胞的高扩增潜力如何逐渐降低。结果是针对n=2个生物学平行测定的单一数据点的平均值(sd);使用学生t检验来分析数据。ns:统计学上不显著的差异。
[0044]
图12-扩增期密度对cd34
造血干细胞(hsc)来源的祖细胞在2%人血清、5x细胞因子、无低密度细胞因子混合物(ldc)的分化培养基中分化为成熟效应细胞的影响。在第14
天,将2000个cd34
细胞/ml和40000个cd34
细胞/ml扩增条件对于分化培养期以1.5*106个细胞/ml的相同密度接种在2%人血清、5x细胞因子、无低密度细胞因子混合物(ldc)的分化培养基中,并且在第21、27和35天经由流式细胞术监测细胞分化表型。直方图示出了随时间的分化细胞的%,对于低密度具有稍微改善的分化%。结果是针对n=2个生物学平行测定的单一数据点的平均值(sd);使用学生t检验来分析数据。观察到的任何差异是统计学上不显著的。
[0045]
图13-扩增期密度对2%人血清、5x细胞因子、无低密度细胞因子混合物(ldc)的培养基中的成熟效应细胞效力的影响。在第35天针对在2%人血清、5x细胞因子、无低密度细胞因子混合物(ldc)的培养基中培养的2000个cd34
细胞/ml和40000个cd34
细胞/ml扩增密度经由流式细胞术分析效应细胞的效力(确定为以1:1效应物:靶标比率共培养过夜之后杀伤靶肿瘤细胞的%)。该图示出了相对于细胞密度的杀伤靶细胞的%。效力对于2000个cd34
细胞/ml稍微更高。结果是针对n=2个生物学平行测定的技术一式三份的平均值(sd);学生t检验来分析数据。观察到的任何差异是统计学上不显著的。
[0046]
图14-接种密度对从新鲜脐带血(ucb)中纯化的cd34
造血干细胞(hsc)在2%人血清、1x细胞因子、无低密度细胞因子混合物(ldc)的扩增培养基中的扩增的影响。a.将新鲜分离的第0天hsc在2%人血清、1x细胞因子、无低密度细胞因子混合物(ldc)的扩增培养基中以低密度(2000个cd34
细胞/ml)或高密度(40000个cd34
细胞/ml)培养,并且在第6、9和14天经由流式细胞术分析细胞扩增。将针对每种条件的细胞扩增(计算为[在测量日的细胞数/ml除以在第0天的cd34
细胞数/ml])相对于时间进行作图。如果相比于40000个cd34
细胞/ml,则2000个cd34
细胞/ml的接种密度导致更高的细胞扩增。b.针对基于40000个cd34
细胞/ml(设置为=1)的每种细胞密度计算hsc相对终点(第13-14天)扩增并且将其相对于增加密度进行作图,其中将2000个cd34
细胞/ml设置为=1(即,1=2000个cd34
细胞/ml并且20=40,000个cd34
细胞/ml)。直方图示出了两个变量之间的逆相关性,表明了当细胞密度增加时低密度接种细胞的高扩增潜力如何逐渐降低。结果是针对n=2个生物学平行测定的单一数据点的平均值(sd);使用学生t检验来分析数据。ns:统计学上不显著的差异。
[0047]
图15-扩增期密度对cd34
造血干细胞(hsc)来源的祖细胞在2%人血清、1x细胞因子、无低密度细胞因子混合物(ldc)的分化培养基中分化为成熟效应细胞的影响。在第14天,将2000个cd34
细胞/ml和40000个cd34
细胞/ml条件对于分化培养期以1.5*106个细胞/ml的相同密度接种在2%人血清、1x细胞因子、无低密度细胞因子混合物(ldc)的分化培养基中,并且在第21、27和35天经由流式细胞术监测细胞分化表型。直方图示出了随时间的分化细胞的%,其中低密度在第35天显示出稍微的优势。结果是针对n=2个生物学平行测定的单一数据点的平均值(sd);使用学生t检验来分析数据。观察到的任何差异是统计学上不显著的。
[0048]
图16-扩增期密度对2%人血清、1x细胞因子、无低密度细胞因子混合物(ldc)的培养基中的成熟效应细胞效力的影响。在第35天针对在2%人血清、1x细胞因子、无低密度细胞因子混合物(ldc)的培养基中培养的2000个cd34
细胞/ml和40000个cd34
细胞/ml扩增密度经由流式细胞术分析效应细胞的效力(确定为以1:1效应物:靶标比率共培养过夜之后杀伤靶肿瘤细胞的%)。该图示出了相对于细胞密度的杀伤靶细胞的%。效力对于2000个cd34
细胞/ml更高。示出了针对n=1个生物学平行测定的技术一式三份的结果。
[0049]
图17-第0天接种密度对在完全扩增培养基中培养的效应细胞的第35天终点扩增的影响。测量效应细胞的终点(第35-36天)扩增并且将其相对于第0天造血干细胞接种密度进行作图。将低细胞密度分组:500个cd34
细胞/ml和2000个cd34
细胞/ml:《3000个cd34
细胞/ml;测试的其他细胞密度:10000个cd34
细胞/ml;40000个cd34
细胞/ml;75000个cd34
细胞/ml和100000个cd34
细胞/ml。将细胞扩增针对每种条件计算为[在测量日的细胞数/ml除以在第0天的cd34
细胞数/ml])。低密度接种细胞(高达10000个cd34
细胞/ml、且特别是《3000个cd34
细胞/ml)显示在整个培养中保持对细胞扩增的有益效应,即使将所有细胞对于分化期以相同密度接种。结果是针对n=4个生物学平行测定的技术一式两份或一式三份的平均值(sd);使用单因素方差分析来分析数据。观察到的任何差异是统计学上不显著的。
具体实施方式
[0050]
在第一实施例中,本发明提供了一种用于产生干细胞、祖细胞、和/或nk细胞的集合的方法,所述方法包括以下步骤:(i)从包含cd34
人干细胞的样品起始细胞培养并且将这些细胞在基本培养基中培养至少7天、优选地至少9天,该基本培养基包含白介素-7(il-7)和干细胞因子(scf)、以及flt-3配体(flt-3l)和血小板生成素(tpo)中的一种或多种,其特征在于该细胞培养以12,000个cd34
细胞/ml或更少的细胞密度起始。优选地,该细胞培养以在500与10,000个cd34
细胞/ml之间的细胞密度,更优选地以在1,000与8,000个cd34
细胞/ml之间、最优选地在2,000与6,000个cd34 细胞/ml之间的细胞密度起始。在一个优选实施例中,该基本培养基进一步包含gm-csf、g-csf和il-6中的两种或更多种。
[0051]
优选地,根据本发明的方法的步骤(i)包括将这些细胞在所述培养基中培养7-10天、更优选地9天。
[0052]
优选地,该方法进一步包括以下步骤(ii):将步骤(i)中获得的这些细胞在包含il-15和il-7以及scf或flt-3l中的一种或多种的培养基中培养至少4天、更优选地至少5天、更优选地5-7天、更优选地5天。优选地,步骤(ii)中的该培养基进一步包含gm-csf、g-csf和il-6中的两种或更多种。
[0053]
本发明的方法的步骤(ii)的培养优选地在用于优选地在静态条件下培养哺乳动物细胞的一次性袋中进行。一次性袋允许该培养在临床应用所需的封闭系统中进行。步骤ii优选地在静态条件下进行。已经发现在此阶段中优选静态条件,因为此举在步骤ii结束时实现培养的干细胞和祖细胞或两者的良好产量。不受理论的束缚,据认为静态条件允许细胞沉降并与一次性袋的壁附连并且与相邻细胞附连,并且此附连有利地影响所需细胞的产量。
[0054]
典型地且优选地,存在于步骤(ii)中且优选地不存在于步骤(i)中的il-15的添加通过以下方式实施:抽吸步骤(i)中使用的培养基的一半并且添加包含两倍量的如上指出的细胞因子和生长因子的新培养基。在从步骤(i)至步骤(ii)的转变期间,优选地不对细胞进行洗涤、离心、和/或浓缩或稀释。
[0055]
在一个优选实施例中,该方法进一步包括以下步骤(iii):将步骤(ii)中获得的细胞优选地在将培养基在培养期间连续混合的同时在包含scf、il-7、il-15和il-2中的三种或更多种的培养基中以在0.5x106个细胞/ml-20x106个细胞/ml之间、优选地在0.75x106个
细胞/ml-10x106个细胞/ml之间、更优选地在1x106个细胞/ml与5x106个细胞/ml之间、更优选地在1.2x106个细胞/ml与4x106个细胞/ml之间、最优选地在1.5x106个细胞/ml与3x106个细胞/ml之间的细胞密度培养至少13天、优选地14-28天、更优选地19-23天、最优选地21天,从而获得含有多种nk细胞的培养细胞的集合。在一个优选实施例中,根据本发明的方法的步骤(iii)中使用的培养基进一步包含gm-csf、g-csf、和il-6中的两种或更多种。本发明的方法的步骤iii的培养优选地在将培养基在培养期间混合的同时进行,以增强气体交换并且减少细胞对固体表面的附着,从而增加所获得的nk细胞的纯度。在本发明的方法的优选实施例中,收获步骤(iii)中获得的细胞。收获的细胞可以直接用于过继性细胞转移目的。这种过继性细胞转移优选地进行用于治疗任何种类的人疾病,优选地所有恶性疾病(诸如肿瘤、癌症、白血病)以及所有病毒性疾病,也在实体移植排斥情况以及自身免疫性疾病和妊娠丢失中进行。
[0056]
在一个优选实施例中,将收获的细胞在封闭系统中洗涤,使得培养基组分被稀释至少500倍并且被与人施用相容、包含人血清白蛋白的溶液替代。优选的是,洗涤细胞所用的所述溶液不含人血清。优选的是,存在于溶液中的人血清白蛋白来源于包含基本上纯的人血清白蛋白的批次。在一个优选实施例中,所述人血清白蛋白是重组产生的人血清白蛋白。在一个优选实施例中,所述溶液包含0,3%与10%之间的人血清白蛋白。优选地,所述溶液包含0,5%与5%之间的人血清白蛋白。已观察到,按以上方式处理并收集在与人施用相容且包含人血清白蛋白的溶液中的细胞可以在这些条件下储存延长的时间段,而没有活力和/或活性的不利丧失。细胞储存于其中的溶液也进一步称为“储存溶液”。储存溶液优选地包含少于0.1%的人血清,优选地所述储存溶液不包含人血清。在一个优选实施例中,所述储存溶液包含来源于包含基本上纯的人血清白蛋白的人血清。在一个优选实施例中,所述人血清白蛋白是重组产生的人血清白蛋白。在一个优选实施例中,所述储存溶液包含0,3%与10%之间的人血清白蛋白。优选地,所述储存溶液包含0,5%与5%之间的人血清白蛋白。与人施用相容的优选溶液优选地是pbs或生理盐溶液。pbs或生理盐溶液可以含有一种或多种添加剂。在一个实施例中,添加剂是人血清白蛋白。在一个优选实施例中,相容溶液是生理盐溶液。优选地将收获的细胞在室温与0℃之间的温度下储存至少一天,优选地将所述收获的细胞在所述温度下储存1、2或3天。优选地,所述与人施用相容的溶液是生理盐溶液。生理盐溶液典型地但不一定是0,9%nacl。在一个实施例中,将收获和/或储存的细胞分成至少5份并且储存在低于-70℃的温度下。优选地,所述溶液包含高达75%的cs 10冷冻保存培养基,该冷冻保存培养基可以在西格玛-奥德里奇公司(sigma-aldrich)处订购。cryostor cs 10包含10%dmso,所述溶液中的最终浓度dmso因此是7.5%。典型地,包含一个剂量的细胞的一个输注袋包含在25ml如上所述的溶液中的500-1000x106个细胞,该溶液优选地包含75%(v/v)cryostor cs 10和25%(v/v)nacl 0.9%。
[0057]
已观察到,与以第0天的较高细胞密度(例如高于10,000个cd34
细胞/ml,像40,000个cd34
细胞/ml)开始相比,以在500-10,000个cd34
细胞/ml之间的初始细胞密度开始的根据本发明的方法令人惊讶地导致造血干细胞和/或nk祖细胞的高得多的扩增。此更高的扩增在步骤(i)之后已经看到并且直至并包括步骤(iii)继续是更高的。在工作实例中,相比于100,000个cd34
细胞/ml,该方法在将细胞仅以500-2000个cd34
细胞/ml接种时导致高10至16倍之间的相对细胞扩增。在第12-15天,当将细胞以500-10,000个细胞/ml之间的
初始密度接种时达到150倍与700倍之间的扩增,而在较高密度下,倍数扩增低于100。此外,并且甚至更令人惊讶的,增加的扩增在以较低密度起始的培养中甚至在第8-9天之后继续,而在具有较高起始细胞密度的那些培养中显示出受限扩增。此情况在分化期期间发生,其中在第12-15天将细胞设置在相同密度(1-2x106个细胞/ml)下,然后跟踪其在分化期期间的扩增。在一个优选实施例中,提供了根据本发明的方法,其中该方法在第12天导致细胞的至少150倍扩增、优选地至少200倍、更优选地至少300倍、最优选地至少500倍。优选地,根据本发明的方法在第15天导致细胞的至少150倍扩增、优选地至少200倍、更优选地至少400倍、最优选地至少800倍。
[0058]
cd34
干细胞可以源自例如脐带血、胎盘、外周血、骨髓等。优选地,包含cd34
人干细胞的样品从人脐带血获得。用于从这些来源获得cd34
干细胞的方法(使用人工选择或全自动的)由技术人员已知,并且例如描述于实例和各种出版物(christopher y park等人,nature protocols[自然实验手册].第3卷,第12期.(2008年12月)第1932-1940页;avecilla st等人,transfusion[输注].2016年5月;56(5):1008-12;h
ü
mmer c等人,j transl med.[转化医学杂志]2016年3月16日;14:76)中。优选的是,将包含cd34
人干细胞的样品经由通过全自动封闭系统(例如像美天旎生物科技公司(miltenyi biotec gmbh)的符合临床gmp的clinimacs)选择cd34
人干细胞(hsc)获得,并且直接收集在培养袋中以便在根据本发明的方法的步骤(i)中进行进一步培养。本发明的方法能够实现这种程序,因为典型地,通过全自动封闭系统获得的cd34
hsc在选择之后以如或高于用于在根据本发明的方法中起始cd34
细胞培养的细胞密度存在。在本发明前,必须将由此获得的cd34
hsc例如通过离心和悬浮浓缩在更小体积的培养基中以便实现至少50,000-100,000个cd34
细胞/ml。因此,第一次可以使用封闭系统,该封闭系统全自动收集和培养cd34
人干细胞,而无需封闭系统之外的任何步骤,从而防止例如空气携带微生物的污染并且减少实际操作时间。
[0059]
在一方面,本发明由此提供了一种用于产生干细胞、祖细胞、和/或nk细胞的集合的方法,所述方法包括以下步骤:
[0060]-通过全自动封闭系统选择cd34
hsc;
[0061]-收集和培养由此从包含cd34
人干细胞的样品选择的cd34
hsc,其细胞密度不超过10,000个cd34
细胞/ml、优选地在500与10,000个cd34
细胞/ml之间、更优选地在1,000与8,000个cd34
细胞/ml之间、更优选地在2,000与6,000个cd34
细胞/ml,并且将这些细胞在基本培养基中培养至少7天,该基本培养基包含干细胞因子(scf)和白介素-7(il-7)、以及flt-3配体(flt-3l)和血小板生成素(tpo)中的一种或多种,其中该收集步骤优选地在该全自动封闭系统内。如先前所述,该方法可以通过进行步骤(ii)、或步骤(ii)和步骤(iii)进一步扩展。在此背景下,术语“在全自动封闭系统内”意指在没有人工干扰的情况下将细胞收集至合适的培养装置,诸如转移袋、培养袋或生物反应器中。细胞从而优选地不离开封闭系统。优选地,在收集步骤与培养步骤之间不浓缩细胞。如果需要,可以在收集步骤之后使用封闭系统的向培养物中添加培养基的装置来用新鲜培养基稀释细胞,以获得较低细胞密度培养物。此类装置可以例如是通过重力(从较高袋流动至较低袋)添加培养基的三通阀和管道或者通过使用注射器(通过推送从培养基袋中移走培养基,在改变了活塞途径之后推入培养袋中。
[0062]
然而,如果适当操作,也可以人工获得cd34
人干细胞。在另一个优选实施例中,因此,提供了根据本发明的方法,其中包含来自人胚后期组织的cd34
干细胞的样品通过以下方式获得:通过人工柱分离,优选地使用cd34阳性选择来选择cd34
人干细胞(hsc),例如,如实例中所述。
[0063]
优选地,以上提及的生长因子和细胞因子彼此独立,并且如果存在,则以下述浓度使用:scf、flt-3l、tpo、il-7、和il-15的浓度在2ng/ml与200ng/ml之间、优选地在4ng/ml与100ng/ml之间、更优选地在10与50ng/ml之间,最优选地其浓度为约20ng/ml;il-2的浓度在100-10,000u/ml之间、优选地在200-5,000u/ml之间、更优选地在500-2,000u/ml之间,最优选地其浓度为约1,000u/ml;il-6的浓度在5-500pg/ml之间、优选地在20-200pg/ml之间、更优选地在40-100u/ml之间,最优选地其浓度为约50pg/ml;gm-csf的浓度在1-100pg/ml之间、优选地在2-50pg/ml之间、更优选地在5-25pg/ml之间,最优选地其浓度为约10pg/ml;并且g-csf的浓度在25-2,500pg/ml之间、更优选地在100-1000pg/ml之间、更优选地在200-500pg/ml之间,最优选地其浓度为约250pg/ml。
[0064]
因此,在一个优选实施例中,提供了根据本发明的方法,其中彼此独立地,并且如果存在,scf以在2ng/ml与200ng/ml之间、优选地在4ng/ml与100ng/ml之间、更优选地在10与50ng/ml之间的浓度,最优选地以约20ng/ml的浓度存在;flt-3l以在2ng/ml与200ng/ml之间、优选地在4ng/ml与100ng/ml之间、更优选地在10与50ng/ml之间的浓度,最优选地以约20ng/ml的浓度存在;tpo以在2ng/ml与200ng/ml之间、优选地在4ng/ml与100ng/ml之间、更优选地在10与50ng/ml之间的浓度,最优选地以约20ng/ml的浓度存在;il-7以在2ng/ml与200ng/ml之间、优选地在4ng/ml与100ng/ml之间、更优选地在10与50ng/ml之间的浓度,最优选地以约20ng/ml的浓度存在;il-15以在2ng/ml与200ng/ml之间、优选地在4ng/ml与100ng/ml之间、更优选地在10与50ng/ml之间的浓度,最优选地以约20ng/ml的浓度存在;il-2以在100-10,000u/ml之间、优选地在200-5,000u/ml之间、更优选地在500-2,000u/ml之间的浓度,最优选地以约1,000u/ml的浓度存在;il-6以在5-500pg/ml之间、优选地在20-200pg/ml之间、更优选地在40-100u/ml之间的浓度,最优选地以约50pg/ml的浓度存在;gm-csf以在1-100pg/ml之间、优选地在2-50pg/ml之间、更优选地在5-25pg/ml之间的浓度,最优选地以约10pg/ml的浓度存在;并且g-csf以在25-2,500pg/ml之间、更优选地在100-1000pg/ml之间、更优选地在200-500pg/ml之间的浓度,最优选地以约250pg/m的浓度存在。
[0065]
在此背景下,“约”意指少或多20%、优选地10%。因此,约250pg/ml意指在200-300pg/ml之间、优选地在225-275pg/ml之间。这种变化典型地是吸移和其他误差的结果。
[0066]
本发明令人惊讶地显示,以如所述的,即低于或处于12,000个cd34
细胞/ml之间、优选地在500-10,000之间、更优选地在1,000与8,000个之间、最优选地在2,000与6,000个cd34 细胞/ml之间的浓度开始不仅导致更高的扩增,还导致更高的向nk细胞的分化。在一个优选实施例中,提供了根据本发明的方法,其中在步骤iii之后获得的nk细胞在培养28天之后包含至少50%、优选地至少60%、更优选地至少75%、最优选地至少80%的完全分化的nk细胞。优选地,在步骤iii之后获得的nk细胞在培养35天之后包含至少75%、更优选地至少80%、更优选地至少85%、最优选地至少90%的完全分化的nk细胞。在此背景下,完全分化的意指细胞是cd56 且cd3-的。因此,例如至少80%完全分化的nk细胞意指由根据本发明的方法获得的细胞中的至少80%是cd56 且cd3-的。
[0067]
已进一步观察到,根据本发明的方法导致具有优异的细胞毒性特性的nk细胞。在工作实例中,其中将cd34
hsc以2,000个cd34
细胞/ml的初始浓度接种的根据本发明的方法导致nk细胞能够以1个效应细胞与1个靶细胞比率平均杀伤49%的k562细胞。如果将cd34
hsc以常规密度(约100,000个cd34
细胞/ml)接种,仅观察到约29%的细胞杀伤。在一个优选实施例中,因此,提供了根据本发明的方法,其中当在以1个效应细胞与1个靶细胞比率针对k562细胞的细胞毒性测定中测量时,所获得的nk细胞能够杀伤至少30%、更优选地至少40%、最优选地至少45%的其靶细胞。这种细胞毒性测定是本领域已知的并且描述于实例中。具体地,在此背景下,参考如实例1中所述的测定。
[0068]
既然本发明提供了如上所述的方法,本发明还提供了一种通过根据本发明的方法获得的nk细胞的集合。优选地,这种集合是由这样的方法获得的,其中将细胞在步骤(i)中培养至少7天、优选地至少9天,在步骤(ii)中培养至少4天、优选地至少5天并且在步骤(iii)中培养至少13天、优选地至少21天。从调控角度而不是从效率角度来看,特别优选的是从单一供体获得用于根据本发明使用的组合物。甚至更优选的是,单一供体提供了多于一个治疗剂量,使得大规模批次可以生产、批准或认证,并且在必须用根据本发明使用的组合物治疗随机个体的情况下可以成品使用。如本文所用的“成品(off-the-shelf)”意指制备并且储存以在需要时直接使用的组合物。具体地,可用于“成品”的组合物不是针对特定接受者产生,而是通常可以在不同时间点用于不同接受者。例如,可以将如本发明定义的集合冷冻,并且当需要时,如本发明定义那样解冻和使用。如本发明定义的集合使得能够实现大规模生产gmp产生的免疫效应细胞,这些免疫效应细胞理论上可以在任何随机接受者需要时的几分钟内提供。
[0069]
优选地,这种nk细胞的集合包含来自单一供体的至少10,000,000,000(10
10
)个细胞,更优选地这种nk细胞的集合包含来自单一供体的至少20,000,000,000(2x10
10
)个细胞、最优选地至少25,000,000,000(2.5x10
10
)个细胞。根据本发明的集合优选地包含超过80%、优选地超过85%、最优选地超过90%的cd56阳性cd3阴性细胞,优选地所述细胞是cd117和cd34阴性的。在一个优选实施例中,提供了根据本发明的集合,其中该集合的在一次治疗中待施用的该部分包含少于1x107个cd3阳性细胞、更优选地少于1x106个cd3阳性细胞、更优选地少于1x105个cd3阳性细胞。在一个优选实施例中,相对于组合物中存在的总细胞数量的cd3阳性细胞%不超过1%、更优选地0.1%,并且最优选地相对于组合物中存在的总细胞数量其不超过0.01%。在一个优选实施例中,相对于组合物中存在的总细胞数量的cd19阳性细胞%不超过1%、更优选地0.1%,并且最优选地相对于组合物中存在的总细胞数量其不超过0.01%。
[0070]
在一个优选实施例中,所述多种nk细胞或nk祖细胞或两者包含至少70%、更优选地至少75%、更优选地至少80%、最优选地至少85%的活nk细胞或nk祖细胞或两者,优选地如通过7aad排除确定的。
[0071]
还提供了一种药物组合物,该药物组合物包含根据本发明的nk细胞的集合。可以将这种药物组合物分配为几部分以便在有需要的患者中进行多次注射/输注。例如,从来自单一供体的10
10
个细胞开始,可以制备9个剂量的1x109个cd56 cd3-nk细胞,例如用于三名患者,每名患者接受三个连续剂量。如果获得2.5x10
10
个细胞,可以用各自3个剂量的1x109个cd56 cd3-nk细胞治疗8名患者。典型地,患者将接受至少三个剂量的约1x109个细胞,其
中超过70%是cd56
cd3-的,但做常规药代动力学和动态学研究的技术人员将能够以或少或多剂量与例如或多或少细胞/剂量的组合确定治疗有效方案。在本发明之前,并且在不使用饲养细胞或化学化合物的情况下,仅可以从高输出脐带血单位制备约3个剂量的1x109个细胞,从而仅制备用于单一患者的剂量。此外,本发明使得能够还使用非高输出脐带血单位,这些非高输出脐带血单位占可获得的所有脐带血单位的80%,先前是被丢弃的。在一个优选实施例中,提供了根据本发明的方法,其中未向细胞培养物中添加饲养细胞。在此方面,应注意,表述“未添加饲养细胞”意指此类细胞未被有意或另外添加至细胞培养物中,即不作为起始细胞培养的包含cd34
人干细胞的样品的一部分。
[0072]
因为根据本发明的药物组合物包含足够量和纯度的具有优异细胞毒性特性的nk细胞,所以本发明进一步提供了用于在医学中使用、优选地用于在免疫疗法中使用的这种药物组合物。优选地,根据本发明的药物组合物是用于在治疗肿瘤和血液恶性肿瘤中使用。
[0073]
可以通过任何可接受的方法施用本发明的组合物,条件是免疫效应细胞能够达到其在个体中的靶标。例如,可以经由静脉内途径或经由局部途径(包括但不限于眼部、皮肤、肺部、经颊和鼻内途径)施用本发明的组合物。如本文所用的局部途径还意指任何直接局部施用(例如像在骨髓中),但也指直接注射入例如实体肿瘤中。在特定情况下,例如,如果免疫疗法旨在影响胃肠道的粘膜层,则可以使用口服途径。
[0074]
优选地,提供了用于根据本发明使用的组合物,其中通过静脉内途径或通过局部途径或通过口服途径或通过这些途径的任何组合来施用组合物。如本文使用的术语“局部”意指局部地、优选地在肿瘤部位(可以位于任何解剖学部位中,更具体地,肿瘤可以位于骨髓或任何其他器官中)施用免疫效应细胞。可以施用一次用于根据本发明使用的组合物,但是如果认为有必要,则可以多次施用组合物。这些可以是一天多次、一周多次或甚至一月多次。还可能的是,首先等待第一次施用(例如输注)的临床结果,并且如果认为有必要,在组合物无效的情况下进行第二次施用,并且甚至进行第三次施用、第四次施用等等。
[0075]
如之前已经详尽阐述的,用于根据本发明使用的组合物在用于治疗肿瘤的免疫疗法中是尤其有用的。不受疗法的束缚,据认为hla错配的免疫效应细胞在识别其靶标之后通过分泌性溶酶体胞吐作用杀伤肿瘤细胞。靶细胞识别诱导免疫效应细胞与其靶标之间形成裂解免疫突触。然后激活分泌性溶酶体的极化胞吐作用,并且这些细胞器在裂解突触处释放其细胞毒性内容物,从而特异性杀伤靶细胞。用于在治疗肿瘤中使用的用于根据本发明使用的组合物可用于造血肿瘤或淋巴肿瘤和实体瘤两者。在一个优选实施例中,提供了根据本发明的组合物,其中免疫效应细胞能够通过分泌性溶酶体胞吐作用杀伤肿瘤细胞。
[0076]
在一个优选实施例中,提供了用于根据本发明使用的组合物用于治疗肿瘤,其中肿瘤是造血肿瘤或淋巴肿瘤,或者其中肿瘤是实体肿瘤。
[0077]
术语“血液肿瘤”、“造血肿瘤”或“淋巴肿瘤”意指这些是造血组织或淋巴组织的肿瘤。造血恶性肿瘤和淋巴恶性肿瘤是影响血液、骨髓、淋巴、和淋巴系统的肿瘤。
[0078]
本发明示出了关于本发明的组合物用于在治疗造血肿瘤和实体肿瘤两者中使用的有效性的示例性结果。
[0079]
在肿瘤是造血肿瘤或淋巴肿瘤的那些情况下,提供了用于根据本发明使用的组合物,其中肿瘤是以下中的一种或多种:白血病、淋巴瘤、骨髓增生异常综合征或骨髓瘤,优选地选自以下的白血病、淋巴瘤或骨髓瘤:急性骨髓性白血病(aml)、慢性骨髓性白血病
(cml)、急性t细胞白血病、急性成淋巴细胞性白血病(all)、慢性淋巴细胞性白血病(cll)、急性单核细胞白血病(amol)、套细胞淋巴瘤(mcl)、组织细胞性淋巴瘤或多发性骨髓瘤,优选地aml。
[0080]
在肿瘤是实体肿瘤的那些情况下,提供了用于根据本发明使用的组合物,其中肿瘤是以下中的一种:腺癌、鳞状细胞癌、腺鳞癌、未分化癌、大细胞癌或小细胞癌、肝细胞癌、肝母细胞瘤、结肠腺癌、肾细胞癌、肾细胞腺癌、结肠直肠癌、结肠直肠腺癌、胶质母细胞瘤、神经胶质瘤、头颈癌、肺癌、乳腺癌、默克尔细胞癌、横纹肌肉瘤、恶性黑色素瘤、表皮样癌、肺癌、肾癌、肾腺癌、乳房癌、乳房腺癌、乳腺导管癌、非小细胞肺癌、卵巢癌、口腔癌、肛门癌、皮肤癌、尤因肉瘤、胃癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌、维尔姆斯瘤(wilms tumour)、瓦尔登斯特伦巨球蛋白血症、胰腺癌、胰腺腺癌、子宫颈癌、鳞状细胞癌、髓母细胞瘤、前列腺癌、结肠癌、结肠腺癌、移行细胞癌、骨肉瘤、导管癌、大细胞肺癌、小细胞肺癌、卵巢腺癌、卵巢畸胎瘤、膀胱乳头状瘤、成神经细胞瘤、多形性胶质母细胞瘤、胶质母细胞瘤、星形细胞瘤、上皮样癌、黑色素瘤或视网膜母细胞瘤的恶性赘生物或转移性诱导性继发性肿瘤。
[0081]
在一个优选实施例中,提供了用于根据本发明使用的组合物,其中实体肿瘤选自宫颈癌的恶性赘生物或转移性诱导性继发性肿瘤,这些宫颈癌选自:腺癌、鳞状细胞癌、腺鳞癌、子宫颈癌、小细胞癌、和黑色素瘤。在另一个优选实施例中,提供了用于根据本发明使用的组合物,其中实体肿瘤选自结肠直肠癌症的恶性赘生物或转移性诱导性继发性肿瘤,这些结肠直肠癌症选自:腺癌、鳞状细胞癌、结肠腺癌、结肠直肠癌、结肠直肠腺癌、结肠癌、和黑色素瘤。
[0082]
相对于迄今为止已知的治疗选择,本发明的组合物具有若干优点。本发明的组合物是有利地,不依赖于hpv类型、肿瘤病史、肿瘤egfr表达和kras状态。除此之外,本发明的免疫效应细胞还克服了hla-e、hla-g和(ido)抑制,由此导致针对肿瘤(尤其是针对宫颈癌和结肠直肠癌症)的增强的抗肿瘤效果。
[0083]
如通常所述,术语“表皮生长因子受体”或egfr是指在几乎所有健康组织中广泛表达的细胞表面蛋白。egfr蛋白由跨膜糖蛋白编码,并且是蛋白激酶家族的成员。egfr的过表达及其下游信号传导途径中的突变与若干实体肿瘤(像结肠、肺和子宫颈)中的不良预后相关联。
[0084]
术语柯尔斯顿(kirsten)大鼠肉瘤病毒癌基因(kras)是指主动参与调控正常组织信号传导(egfr下游信号传导途径的一部分)的基因。然而,已报道了kras基因在结肠、直肠和肺的实体肿瘤的肿瘤细胞中的突变。发生在超过50%的结肠直肠癌症患者中的这些激活突变帮助肿瘤细胞逃避egfr靶向药物,像西妥昔单抗和帕尼单抗。
[0085]
如本文使用的术语“人乳头状瘤病毒(hpv)”是指在女性中引起宫颈癌的病毒组。hpv病毒影响嘴、喉、外阴、子宫颈和阴道周围的皮肤和湿膜。hpv感染引起会导致子宫颈中癌症的异常细胞变化。
[0086]
如本文使用的术语吲哚胺2,3双加氧酶(ido)是指在将氨基酸l-色氨酸降解为n-甲酰犬尿氨酸中充当催化剂的酶。报道了ido通常在前列腺、胃、卵巢、子宫颈和结肠的实体肿瘤中过表达,使得肿瘤细胞能够逃避被细胞毒性t细胞和nk细胞杀伤。
[0087]
对于允许医学治疗方面的权利要求的那些管辖范围,本发明还提供以下实施例。
下文列出的每一个实施例可以彼此组合和/或与上述的任何实施例组合。
[0088]
用于治疗需要免疫疗法的个体的方法,该方法包括向个体施用根据本发明的组合物,其中组合物包含治疗有效量的cd56 cd3-细胞。
[0089]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中免疫疗法用于治疗肿瘤。
[0090]
用于治疗需要根据本发明的免疫疗法的个体的方法,该方法进一步包括在施用根据本发明的组合物前向所述个体施用环磷酰胺和/或氟达拉滨,其特征在于环磷酰胺在随后的2、3、4或5天给药,总剂量为400-10000mg/m2、优选地800-8000、更优选地1600-6000、更优选地2000-4000、最优选地约3600mg/m2;和/或氟达拉滨在随后的2、3、4或5天给药,总剂量为1-1000、优选地10-500、更优选地50-250、最优选地约120mg/m2。
[0091]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中在一次治疗中待施用的组合物包含至少5x108个cd34
细胞、更优选地至少1x109个cd34
个细胞。
[0092]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中在一次治疗中待施用的组合物包含不超过1x10
10
个cd34
细胞。
[0093]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中在一次治疗中待施用的组合物包含少于1x107个cd3阳性细胞。
[0094]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中在一次治疗中待施用的组合物包含少于1x107个cd19阳性细胞。
[0095]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中组合物通过静脉内途径施用。
[0096]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中组合物通过局部途径施用。
[0097]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中肿瘤是造血肿瘤或淋巴肿瘤,或者其中肿瘤是实体肿瘤。
[0098]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中肿瘤是造血肿瘤或淋巴肿瘤,该造血肿瘤或淋巴肿瘤选自白血病、淋巴瘤、骨髓增生异常综合征或骨髓瘤,优选地选自以下的白血病、淋巴瘤或骨髓瘤:急性骨髓性白血病(aml)、慢性骨髓性白血病(cml)、急性t细胞白血病、急性成淋巴细胞性白血病(all)、慢性淋巴细胞性白血病(cll)、急性单核细胞白血病(amol)、套细胞淋巴瘤(mcl)、组织细胞性淋巴瘤、多发性骨髓瘤、任何其他?。
[0099]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中白血病是aml。
[0100]
用于治疗需要根据本发明的免疫疗法的个体的方法,其中肿瘤是实体肿瘤,该实体肿瘤选自腺癌、鳞状细胞癌、腺鳞癌、未分化癌、大细胞癌或小细胞癌、肝细胞癌、肝母细胞瘤、结肠腺癌、肾细胞癌、肾细胞腺癌、结肠直肠癌、结肠直肠腺癌、胶质母细胞瘤、神经胶质瘤、头颈癌、肺癌、乳腺癌、默克尔细胞癌、横纹肌肉瘤、恶性黑色素瘤、表皮样癌、肺癌、肾癌、肾腺癌、乳房癌、乳房腺癌、乳腺导管癌、非小细胞肺癌、卵巢癌、口腔癌、肛门癌、皮肤癌、尤因肉瘤、胃癌、尿道癌、子宫癌、子宫肉瘤、阴道癌、外阴癌、维尔姆斯瘤、瓦尔登斯特伦巨球蛋白血症、胰腺癌、胰腺腺癌、子宫颈癌、鳞状细胞癌、髓母细胞瘤、前列腺癌、结肠癌、结肠腺癌、移行细胞癌、骨肉瘤、导管癌、大细胞肺癌、小细胞肺癌、卵巢腺癌、卵巢畸胎瘤、膀胱乳头状瘤、成神经细胞瘤、多形性胶质母细胞瘤、胶质母细胞瘤、星形细胞瘤、上皮样
癌、黑色素瘤和视网膜母细胞瘤的恶性赘生物或转移性诱导性继发性肿瘤。
[0101]
在一个优选实施例中,提供了根据本发明的方法,其中实体肿瘤选自宫颈癌的恶性赘生物或转移性诱导性继发性肿瘤,这些宫颈癌选自:腺癌、鳞状细胞癌、腺鳞癌、子宫颈癌、小细胞癌、和黑色素瘤。
[0102]
在另一个优选实施例中,提供了根据本发明的方法,其中实体肿瘤选自结肠直肠癌症的恶性赘生物或转移性诱导性继发性肿瘤,这些结肠直肠癌症选自:腺癌、鳞状细胞癌、结肠腺癌、结肠直肠癌、结肠直肠腺癌、结肠癌、和黑色素瘤。
[0103]
在以下非限制性实例中进一步举例说明了本发明。
[0104]
实例
[0105]
实例1
[0106]
简介
[0107]
从新鲜脐带血(ucb)中分离的人cd34
造血干细胞(hsc)可以经由多步体外过程产生能够杀伤靶肿瘤细胞的效应细胞,该多步体外过程基于初始扩增期(第0-14天),之后是效应细胞特异性分化期(第14-35/42天)。扩增和分化条件的优化可用于产生大批量的高度分化的效应细胞。在此,在完全培养基中分析第0天cd34
hsc细胞培养密度对效应细胞的扩增、分化和杀伤靶细胞的效力的影响。将ucb来源的cd34
hsc对于扩增期以6种或更多种不同的增加密度(表示为细胞/ml)接种,并且在第0天与第12-14天之间进行监测,此时经由流式细胞术确定中间(第5-6天和第8-9天)和最终的细胞扩增。在第12-15天,将所有条件对于分化期设置在相同密度下,以确定初始扩增密度对随后分化的影响。在第20-21、27-28和35-36天,经由流式细胞术监测效应细胞分化。在第35-36天,经由体外测定分析终点效应细胞的效力,其中将效应细胞与靶肿瘤细胞共培养过夜并且经由流式细胞术评估靶标的杀伤。
[0108]
材料和方法
[0109]
肿瘤细胞系
[0110]
将用于效应细胞效力测定中的肿瘤细胞系培养在imdm培养基(伊斯科夫改良杜尔贝科氏培养基(iscove’s modified dulbecco’s medium),荷兰马斯特里赫特(maastricht)的龙沙集团(lonza))中,该培养基含有100u/ml青霉素和100u/ml链霉素(龙沙集团)、2mm l-谷氨酰胺(龙沙集团)和10%胎牛血清(fbs,荷兰兰茨梅尔(landsmeer)的飞世尔科技公司)。每5天将细胞培养物传代并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0111]
从脐带血(ucb)中分离cd34
造血干细胞(hsc)
[0112]
通过两种方法,即自动封闭系统或人工开放系统从新鲜脐带血单位(由英国伦敦安东尼
·
诺兰机构(anthony nolan)供应)中分离cd34
hsc。通过使用封闭免疫磁性clinimacslp-34系统(德国贝吉施格拉德巴赫(bergisch gladbach)的美天旎生物科技公司)进行全自动选择。将clinimacs prodigy ts310管路组安装在仪器上并且连接clinimacs pbs/edta(磷酸盐缓冲盐水/乙二胺四乙酸)缓冲液。在启动仪器之后,连接新鲜脐带血袋并且添加用于标记cd34
细胞的clinimacs cd34试剂。将磁性标记的cd34
细胞保留在分离柱(其中产生强磁场)中以进行洗涤步骤,然后在去除磁场之后在80ml细胞培养基
中洗脱。根据clinimacslp-34系统用户手册进行所有步骤。
[0113]
通过以下方式进行人工选择:将用pbs 1:3稀释的新鲜血液吸移在无菌管中的菲科帕克(ficoll-paque)(荷兰荷佛拉肯(hoevelaken)的通用医疗生命科学公司(ge healthcare))层的顶部上,然后在关闭制动器的情况下在20℃下以900g离心30min。使用移液管将分离的单核细胞层转移至无菌管;然后将细胞用pbs洗涤两次(龙沙集团)。将细胞经由流式细胞术计数,并且用cd34微珠试剂盒(美天旎生物科技公司)标记cd34
细胞;在标记之后,将细胞负载在放置在分选架(multistand)上的ls柱上(两者均来自美天旎生物科技公司)以施加磁场,洗涤未标记的细胞,然后通过去除磁场将cd34
hsc在15ml facs缓冲液中洗脱,该缓冲液由补充有0.5%白蛋白(荷兰阿姆斯特丹的伞奎公司(sanquin))和2mm edta ph 8.0(飞世尔科技公司)的1x pbs构成。根据制造商方案进行所有步骤。在完成自动程序和人工程序两者之后,将阳性选择细胞经由流式细胞术计数并且将其适当稀释以进行板培养。
[0114]
ucb来源的cd34
hsc扩增
[0115]
为了实现扩增,将从ucb分离的cd34
hsc以不同密度(细胞/ml)以2ml/孔的体积接种至6孔组织培养板(荷兰阿姆斯特丹的康宁公司)中,并且在格雷克斯迪姆(glycostem)基本生长培养基(gbgm,比利时veernem的fertipro n.v.公司)中培养12-15天,该基本生长培养基补充有10%人血清(hs,伞奎公司)、25ng/ml重组人干细胞因子(rh scf)、fms样酪氨酸激酶3配体(rh flt-3l)、促血小板生成素(rh tpo)和白介素-7(rh il-7)(全部来自德国弗莱堡的cellgenix公司);第9天之后,将tpo用20ng/ml白介素-15(rh il-15)(cellgenix)替代。将最终浓度为25μg/ml的低分子量肝素(lmwh)(德国威斯巴登(wiesbaden)的雅培公司(abbott))和低剂量细胞因子混合物添加至完全
‘
扩增培养基’混合物中,该低剂量细胞因子混合物由以下组成:10pg/ml粒细胞-巨噬细胞集落刺激因子(rh gm-csf)(cellgenix)、250pg/ml粒细胞集落刺激因子(rh g-csf)(荷兰布雷达(breda)的安进欧洲公司(amgen europe b.v.))和50pg/ml白介素-6(rh il-6)(cellgenix)。每2-3天用新培养基更新ucb-cd34
祖细胞培养物并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0116]
扩增的ucb来源的cd34
hsc分化为ucb效应细胞
[0117]
在培养的第12-15天,通过将培养基混合物切换为
‘
分化培养基’来诱导细胞分化(和进一步扩增),该分化培养基即补充有以下的gbgm:10%hs、20ng/ml il-7、scf、il-15(cellgenix)和1000u/ml白介素-2(rh il-2)(德国慕尼黑的凯龙公司(chiron))以及针对扩增培养基所述的相同低剂量细胞因子混合物。将ucb效应细胞以1.5*106个细胞/ml的密度以2-5ml/孔的体积培养,并且从第15天至培养终点(第35/42天)每周用新培养基更新培养物两次。
[0118]
流式细胞术
[0119]
在cytoflex lx(荷兰武尔登(woerden)的贝克曼库尔特生命科学公司(beckman coulter life sciences))上进行流式细胞术分析。使用此技术来确定效应细胞和靶细胞活力、表型(经由细胞表面标记物表达)并且定量地确定细胞数量。将细胞在4℃下用抗原特异性荧光染料标记的抗体染色15分钟,然后洗涤并且重悬于facs缓冲液中,该缓冲液由补
充有0.5%白蛋白(伞奎公司)和2mm edta ph 8.0(飞世尔科技公司)的1x pbs(龙沙集团)构成。为了分析细胞活力,使用7-氨基放线菌素d(7-aad)dna嵌入标记物:活细胞(其膜不可透过染料)是阴性的,而死亡细胞(其中染料能够嵌入dna)是阳性的。通过将前向散射(fsc)相对于侧向散射(ssc)进行作图来初始鉴定感兴趣的细胞群体。在fsc/ssc图上鉴定出感兴趣的群体,然后将其针对活力(7-aad-)和针对感兴趣的表面抗原的阳性进行门控。使用的抗体是:抗cd45-kromeorange克隆j.33、抗cd34-pc7克隆581(两者均来自贝克曼库尔特公司)、抗cd56-apc-vio770克隆rea196(美天旎生物科技公司)和7-aad染料(荷兰兹韦恩德雷赫特(zwijndrecht)的西格玛奥德里奇公司)。
[0120]
基于流式细胞术的效应细胞效力测定
[0121]
通过以下方式分析效应细胞效力:将效应细胞和靶肿瘤细胞系共培养过夜并且随后经由7-aad染色和流式细胞术确定靶细胞杀伤。将靶细胞以1*107个细胞/ml悬浮于pbs中并且在细胞培养箱中用0.012mg/ml pacific blue
tm
琥珀酰亚胺酯(pbse,赛默飞世尔科技公司)预标记10分钟;通过添加1体积的补充有10%fbs的靶细胞培养基停止标记。然后将细胞用pbs洗涤两次,经由流式细胞术计数并且最终以1*106个细胞/ml悬浮于具有10%fbs的培养基中。将效应细胞用细胞特异性表面标记物染色并且经由流式细胞术计数,然后最终以1*106个细胞/ml悬浮于补充有2%hs的gbgm中。然后将预染色的靶细胞与效应细胞在96孔组织培养板中以1:1比率共培养,针对每种细胞类型5*104个细胞/孔,体积为100μl,技术一式三份。包括单独效应细胞和单独靶细胞以作为对照。在细胞培养箱(37℃、95%湿度、5%co2)中共培养过夜之后,将样品用facs缓冲液1:1稀释,用7-aad染色并且立即经由流式细胞术分析。通过fsc/ssc特性和pbse阳性将靶细胞与效应细胞区分开;然后将pbse阳性7-aad阴性或阳性细胞(pbse
/7-aad-,即活靶细胞或pbse
/7-aad
,即死靶细胞)计数。将来自共培养一式三份的pbse
/7-aad-细胞的平均值根据单独培养的靶细胞获得的相同值进行归一化,以排除靶细胞生理性死亡的影响,然后通过相对于1减去所获得的值并将其乘以100来计算杀伤的细胞的百分比。
[0122]
统计分析
[0123]
使用graphpad prism 8软件(加利福尼亚州圣地亚哥)进行所有统计学分析。数据表示为独立生物学供体(n=4-5)的平均值,误差计算为标准偏差(sd)。进行学生t检验或单因素方差分析与多重比较检验(tukey方法),并且结果的显著性示出为p值(ns,统计学上不显著的;*p≤0.033;**p≤0.002;***p≤0.001)。
[0124]
结果
[0125]
部分1-cd34
造血干细胞(hsc)祖细胞的接种密度对完全培养基中的体外细胞扩增的影响
[0126]
将从新鲜ucb分离的第0天人cd34
hsc经由流式细胞术计数并且以6种或更多种不同的增加密度(表示为细胞/ml)稀释以在完全培养基中进行扩增培养(表1)。监测培养物并且定期更新扩增培养基直到第12-15天;在第5-6、8-9和12-15天经由流式细胞术分析中间和最终的细胞扩增。对于每个时间点,针对每种条件基于第0天初始细胞密度计算扩增,并且将其相对于时间进行作图(图1a)。如图所示,中间和最终的细胞扩增对于较低细胞密度更高,从第8-9天显著增加,直到扩增期结束。终点扩增的范围为从针对少于3000个cd34
细胞/ml的590倍至针对超过250000个cd34
细胞/ml的19倍。细胞培养密度与扩增之间的逆相
关性展示于图1b中,其中将相对细胞扩增相对于密度的逐渐相对增加进行作图。这些数据示出了当细胞培养以低密度开始时如何在完全培养基中实现更高的cd34
hsc扩增,以及逐渐降低密度如何影响扩增。
[0127]
部分2-cd34
造血干细胞(hsc)祖细胞的扩增密度对完全培养基中的效应细胞分化和效力的影响
[0128]
进行至分化期,将来自每种扩增条件的第12-15天细胞以1.5*106个细胞/ml的密度设置在分化培养基中;每周更新培养基两次,并且每周监测一次效应细胞进一步扩增和表型,直到第35-36天。此设置允许检查初始扩增对细胞分化的影响,排除了分化期期间不平等细胞操作的任何影响。图2示出了在第20天与第35天之间效应细胞的分化对于所有条件如何逐渐增加(从5%-13%至75%-95%)。尽管最低初始密度培养物(《3000个cd34
细胞/ml)相对于较高密度稍微较晚地开始分化,但这种差距在第27-28天在很大程度上弥合。在第35天,所有细胞是高效分化的,但最低百分比是由100000个cd34
细胞/ml达到(平均88%),并且最高的是由10000个cd34
细胞/ml或更低达到(平均94%)。在分化期期间,细胞仍在扩增,但以较慢速度;扩增对于低密度条件保持更高(图17)。这些结果示出了扩增期期间的初始低细胞密度如何不仅增加细胞扩增,而且它也对分化终点有益,从而导致效应细胞在完全培养基中的更高成熟度。
[0129]
在第35天确定效应细胞在杀伤靶肿瘤细胞方面的效力。将所有效应细胞条件与肿瘤细胞系共培养过夜,并且随后经由流式细胞术确定靶细胞杀伤。如图3中所示,在过夜共培养之后通过效应细胞杀伤了15%-72%的靶细胞,这证明了效应细胞有效识别并消除肿瘤细胞的巨大潜力。然而,低密度扩增条件(特别是《3000个cd34
细胞/ml)相比于较高密度在杀伤方面更高效,显示出多高达1.5倍的效力(《3000个cd34
细胞/ml相比于75000个cd34
细胞/ml)。此类数据表明,较低扩增密度不仅改善在完全培养基中培养的效应细胞的细胞扩增和分化,也改善其功能。
[0130]
在此第一实例中,将由人工和由自动封闭系统选择获得的数据合并,在下一个实例中,将人工选择和自动选择相互比较。
[0131]
表1-从新鲜脐带血(ucb)纯化的cd34
造血干细胞(hsc)的第0天接种条件。将新鲜分离的hsc经由流式细胞术计数,并且以不同的增加细胞浓度(表示为细胞/ml)以2ml/孔的体积稀释于6孔组织培养板(以一式两份或一式三份)中。由于并非所有实验中均使用了所有条件,因此如“组”列中所示合并了类似的细胞密度。“浓度”列示出了所有条件之间的相对细胞密度,其中将最低的即500个cd34
细胞/ml设置为1。
[0132]
[0133][0134]
实例2
[0135]
简介
[0136]
从新鲜脐带血(ucb)中分离的人cd34
造血干细胞(hsc)可以经由多步体外过程产生能够杀伤靶肿瘤细胞的效应细胞,该多步体外过程基于初始扩增期(第0-14天),之后是效应细胞特异性分化期(第15-35/42天)。祖细胞的分离过程以及扩增和分化条件的优化可用于产生大批量的高度分化效应细胞。在此,分析第0天cd34
hsc细胞分离方法和培养密度对效应细胞的扩增、分化和杀伤靶细胞的效力的影响。比较了用于从血液中进行cd34
hsc分离的两种方法,即一种自动封闭方法和一种人工开放系统。对于两种方法,将选择的祖细胞对于扩增期以6种增加密度(表示为细胞/ml)接种,并且在第0天与第15天之间进行监测,此时经由流式细胞术确定最终的细胞扩增。在第15天,将所有条件对于分化期设置在相同密度下,从而确定初始扩增密度对随后分化的影响。在第20、28和35天,经由流式细胞术监测效应细胞分化。在第35天,经由体外测定分析终点效应细胞的效力,其中将效应细胞与靶肿瘤细胞共培养过夜并且经由流式细胞术评估靶标的杀伤。
[0137]
材料和方法
[0138]
肿瘤细胞系
[0139]
将用于效应细胞效力测定中的肿瘤细胞系培养在imdm培养基(伊斯科夫改良杜尔贝科氏培养基,荷兰马斯特里赫特的龙沙集团)中,该培养基含有100u/ml青霉素和100u/ml链霉素(龙沙集团)、2mm l-谷氨酰胺(龙沙集团)和10%胎牛血清(fbs,荷兰兰茨梅尔的飞世尔科技公司)。每5天将细胞培养物传代并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0140]
从脐带血(ucb)中分离cd34
造血干细胞(hsc)
[0141]
将新鲜脐带血单位(由英国伦敦安东尼
·
诺兰机构供应)分为两个等同体积并且指定用于通过两种方法即自动封闭系统和人工开放系统同时、平行分离cd34
hsc。通过使用封闭免疫磁性clinimacslp-34系统(德国贝吉施格拉德巴赫的美天旎生物科技公司)进行全自动选择。将clinimacs prodigy ts310管路组安装在仪器上并且连接clinimacs pbs/edta(磷酸盐缓冲盐水/乙二胺四乙酸)缓冲液。在启动仪器之后,连接新鲜脐带血并且添加用于标记cd34
细胞的clinimacs cd34试剂。将磁性标记的cd34
细胞保留在分离柱(其中产生强磁场)中以进行洗涤步骤,然后在去除磁场之后在80ml细胞培养基中洗脱。根据clinimacslp-34系统用户手册进行所有步骤。
[0142]
通过以下方式进行人工选择:将用pbs 1:3稀释的新鲜血液吸移在无菌管中的菲科帕克(荷兰荷佛拉肯的通用医疗生命科学公司)层的顶部上,然后在关闭制动器的情况下在20℃下以900g离心30min。使用移液管将分离的单核细胞层转移至无菌管;然后将细胞用pbs洗涤两次(龙沙集团)。将细胞经由流式细胞术计数,并且用cd34微珠试剂盒(美天旎生
物科技公司)标记cd34
细胞;在标记之后,将细胞负载在放置在分选架上的ls柱上(两者均来自美天旎生物科技公司)以施加磁场,洗涤未标记的细胞,然后通过去除磁场将cd34
hsc在15ml facs缓冲液中洗脱,该缓冲液由补充有0.5%白蛋白(荷兰阿姆斯特丹的伞奎公司)和2mm edta ph 8.0(马萨诸塞州沃尔瑟姆的赛默飞世尔科技公司)的1x pbs构成。根据制造商方案进行所有步骤。在完成自动程序和人工程序两者之后,将阳性选择细胞经由流式细胞术计数并且将其适当稀释以进行板培养。
[0143]
ucb来源的cd34
hsc扩增
[0144]
为了实现扩增,将从ucb分离的cd34
hsc以不同细胞密度(表示为细胞/ml)以2ml/孔的体积接种至6孔组织培养板(荷兰阿姆斯特丹的康宁公司)中,并且在格雷克斯迪姆基本生长培养基(gbgm,比利时veernem的fertipro n.v.公司)中培养15天,该基本生长培养基补充有10%人血清(hs,荷兰阿姆斯特丹的伞奎公司)、25ng/ml重组人干细胞因子(rh scf)、fms样酪氨酸激酶3配体(rh flt-3l)、促血小板生成素(rh tpo)和白介素-7(rh il-7)(全部来自德国弗莱堡的cellgenix公司);第9天之后,将tpo用20ng/ml白介素-15(rh il-15)(cellgenix)替代。将低剂量细胞因子混合物添加至完全
‘
扩增培养基’混合物中,该低剂量细胞因子混合物由以下组成:10pg/ml粒细胞-巨噬细胞集落刺激因子(rh gm-csf)(cellgenix)、250pg/ml粒细胞集落刺激因子(rh g-csf)(荷兰布雷达的安进欧洲公司)和50pg/ml白介素-6(rh il-6)(cellgenix)。每2-3天用新培养基更新ucb-cd34
祖细胞培养物并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0145]
扩增的ucb来源的cd34
hsc分化为ucb效应细胞
[0146]
在培养的第14-15天,通过将培养基混合物切换为
‘
分化培养基’来诱导细胞分化(和进一步扩增),该分化培养基即补充有以下的gbgm:10%hs、20ng/ml il-7、scf、il-15(cellgenix)和1000u/ml白介素-2(rh il-2)(德国慕尼黑的凯龙公司)以及针对扩增培养基所述的相同低剂量细胞因子混合物。将ucb效应细胞以1.5*106个细胞/ml的密度以2-5ml/孔的体积培养,并且从第15天至培养终点(第35-42天)每周用新培养基更新培养物两次。
[0147]
流式细胞术
[0148]
在cytoflex lx(荷兰武尔登的贝克曼库尔特生命科学公司)上进行流式细胞术分析。使用此技术来确定效应细胞和靶细胞活力、表型(经由细胞表面标记物表达)并且定量地确定细胞数量。将细胞在4℃下用抗原特异性荧光染料标记的抗体染色15分钟,然后洗涤并且重悬于facs缓冲液中,该缓冲液由补充有0.5%白蛋白(伞奎公司)和2mm edta ph 8.0(飞世尔科技公司)的1x pbs(龙沙集团)构成。为了分析细胞活力,使用7-氨基放线菌素d(7-aad)dna嵌入标记物:活细胞(其膜不可透过染料)是阴性的,而死亡细胞(其中染料能够嵌入dna)是阳性的。通过将前向散射(fsc)相对于侧向散射(ssc)进行作图来初始鉴定感兴趣的细胞群体。在fsc/ssc图上鉴定出感兴趣的群体,然后将其针对活力(7-aad-)和针对感兴趣的表面抗原的阳性进行门控。使用的抗体是:抗cd45-kromeorange克隆j.33、抗cd34-pc7克隆581(两者均来自贝克曼库尔特公司)、抗cd56-apc-vio770克隆rea196(美天旎生物科技公司)和7-aad染料(荷兰兹韦恩德雷赫特的西格玛奥德里奇公司)。
[0149]
基于流式细胞术的效应细胞效力测定
[0150]
通过以下方式分析效应细胞效力:将效应细胞和靶肿瘤细胞系共培养过夜并且随
后经由7-aad染色和流式细胞术确定靶细胞杀伤。将靶细胞以1*107个细胞/ml悬浮于pbs中并且在细胞培养箱中用0.012mg/ml pacific blue
tm
琥珀酰亚胺酯(pbse,赛默飞世尔科技公司)预标记10分钟;通过添加1体积的补充有10%fbs的靶细胞培养基停止标记。然后将细胞用pbs洗涤两次,经由流式细胞术计数并且最终以1*106个细胞/ml悬浮于具有10%fbs的培养基中。将效应细胞用细胞特异性表面标记物染色并且经由流式细胞术计数,然后最终以1*106个细胞/ml悬浮于补充有2%hs的gbgm中。然后将预染色的靶细胞与效应细胞在96孔组织培养板中以1:1比率共培养,针对每种细胞类型5*104个细胞/孔,体积为100μl,技术一式三份。包括单独效应细胞和单独靶细胞以作为对照。在细胞培养箱(37℃、95%湿度、5%co2)中共培养过夜之后,将样品用facs缓冲液1:1稀释,用7-aad染色并且立即经由流式细胞术分析。通过fsc/ssc特性和pbse阳性将靶细胞与效应细胞区分开;然后将pbse阳性7-aad阴性或阳性细胞(pbse
/7-aad-,即活靶细胞或pbse
/7-aad
,即死靶细胞)计数。将来自共培养一式三份的pbse
/7-aad-细胞的平均值根据单独培养的靶细胞获得的相同值进行归一化,以排除靶细胞生理性死亡的影响,然后通过相对于1减去所获得的值并将其乘以100来计算杀伤的细胞的百分比。
[0151]
结果
[0152]
部分1-cd34
造血干细胞(hsc)祖细胞的分离方法和接种密度对完全培养基中的体外细胞扩增的影响
[0153]
将一个单位的新鲜人脐带血分为两个等同体积,并且用clinimacs prodigy(自动封闭系统(进一步命名为:prodigy))或者进行菲科帕克梯度之后进行柱分离(人工开放系统(进一步命名为:人工))平行分离cd34
hsc。然后将分离细胞经由流式细胞术计数并且稀释于完全扩增培养基中以进行细胞培养(参见下文)。值得注意的是,cd34
细胞回收在两种方法之间是可比的,其中从prodigy收获1.08*106个细胞并且从人工程序收获0.98*106个细胞。然后研究了cd34
分离方法对细胞形态学、扩增、分化和效力的影响。
[0154]
然后将prodigy选择和人工选择的cd34
hsc以6种不同的增加密度(表示为细胞/ml)稀释以进行扩增培养(表2)。在不同时间点对细胞的视觉检查在两种方法之间没有显示出任何差异;存在一些红细胞,尤其是在prodigy选择的细胞中,但它们在培养几天后消失,并且不影响细胞健康、增殖或分化(图4)。在扩增培养期间,定期更新培养基直到第15天,此时经由流式细胞术分析细胞扩增。针对每种条件基于第0天初始细胞密度计算在第15天的扩增,并且将其相对于时间进行作图(图5a)。如图所示,prodigy选择和人工选择的细胞对于所有条件显示出非常相似的扩增概况,其范围为从针对较低密度的非常高的扩增(针对500个cd34
细胞/ml,对于prodigy为940倍且对于人工为870倍)逐渐降低至针对100000个cd34
细胞/ml的25倍。细胞培养密度与扩增之间的逆相关性趋势展示于图5b中,其中对于prodigy方法和人工方法两者将相对细胞扩增相对于密度的逐渐相对增加进行作图。这些数据示出了当细胞培养以低密度开始时如何实现更高的cd34
hsc扩增而与选择的细胞分离方法无关,以及逐渐降低密度如何影响扩增。
[0155]
部分2-cd34
造血干细胞(hsc)祖细胞的分离方法和扩增密度对完全培养基中的效应细胞分化和效力的影响
[0156]
进行至分化期,将来自每种扩增条件的第15天细胞以1.5*106个细胞/ml的密度设置在完全分化培养基中;每周更新培养基两次,并且每周监测一次效应细胞进一步扩增和
表型,直到第35天。此设置允许检查初始扩增对细胞分化的影响,排除了分化期期间不平等细胞操作的任何影响。图6示出了在第20天与第35天之间效应细胞的分化对于所有条件如何逐渐增加(从在第20天的针对prodigy的7%-13%和针对人工的4%-10%至在第35天的针对prodigy的76%-95%和针对人工的79%-96%)。值得注意的是,特别是对于prodigy分离的cd34
细胞,相比于较高密度(40,000个cd34
细胞/ml、75,000个cd34
细胞/ml和100,000个cd34
细胞/ml),较低密度扩增条件(500个cd34
细胞/ml、2000个cd34
细胞/ml、10000个cd34
细胞/ml)更快地进行通过早期分化(第20-28天)。此差距在第35天在很大程度上减少,这最可能是因为达到几乎100%分化的平台。然而,较低细胞初始细胞密度(特别是500、2000和10,000个cd34
细胞/ml看来优于40,000个或更多(prodigy)或者75,000个或更多(人工)。在分化期期间,细胞仍在扩增,但以较慢速度。然而,对于两种方法,扩增仍对于低密度条件更高(未示出)。这些结果示出了扩增期期间的初始低细胞密度如何不仅增加细胞扩增,也增强细胞分化,从而导致效应细胞的更高成熟度。值得注意的是,选择的cd34
细胞分离方法不影响此行为,因为自动技术和人工技术给出可比结果。
[0157]
在第35天确定效应细胞在杀伤靶肿瘤细胞方面的效力。将所有效应细胞条件与肿瘤细胞系共培养过夜,并且随后经由流式细胞术确定靶细胞杀伤。如图7中所示,在过夜共培养之后通过效应细胞杀伤了38%-82%(对于prodigy)和37%-70%(对于人工)的靶细胞,这证明了效应细胞有效识别并消除肿瘤细胞的巨大潜力。然而,相比于较高密度(40000个cd34
细胞/ml、75000个cd34
细胞/ml和100000个cd34
细胞/ml),低密度扩增条件(500个cd34
细胞/ml、2000个cd34
细胞/ml和10000个cd34
细胞/ml)在杀伤方面更高效,对于两种方法、但特别是对于prodigy分离的细胞显示出超过60%的效力。此类数据表明较低扩增密度不仅改善细胞扩增和分化,还改善杀伤靶肿瘤细胞的效力,并且细胞分离方法对细胞功能性不具有任何影响。
[0158]
表2-从新鲜脐带血(ucb)纯化的cd34
造血干细胞(hsc)的第0天接种条件。将新鲜prodigy或人工分离的hsc经由流式细胞术计数,并且以6种不同的增加细胞浓度(表示为细胞/ml)以2ml/孔的体积稀释于6孔组织培养板(作为单一平行测定)中。“浓度”列示出了所有条件之间的相对细胞密度,其中将最低的即500个cd34
细胞/ml设置为1。
[0159]
cd34
hsc密度(细胞/ml)浓度(倍)第0天体积(ml)500个cd34
细胞/ml122000个cd34
细胞/ml4210000个cd34
细胞/ml20240000个cd34
细胞/ml80275000个cd34
细胞/ml1252100000个cd34
细胞/ml2002
[0160]
实例3
[0161]
简介
[0162]
从新鲜脐带血(ucb)中分离的人cd34
造血干细胞(hsc)可以经由多步体外过程产生能够杀伤靶肿瘤细胞的效应细胞,该多步体外过程基于初始扩增期(第0-14天),之后是效应细胞特异性分化期(第15-35/42天)。如实例1和2中所示,在时间0的细胞接种密度对效应细胞的扩增、分化和效力具有重大影响。低密度接种细胞(低于10000个cd34
细胞/ml)在
扩增、分化为效应细胞和针对靶肿瘤细胞的杀伤潜力方面具有很强的优势。在此实例中,研究了培养基组成对效应细胞的此类特征的影响。在扩增期和分化期期间,将细胞在没有低密度细胞因子(ldc)混合物的情况下培养,该低密度细胞因子混合物存在于完全扩增和分化培养基中并且由10pg/ml粒细胞-巨噬细胞集落刺激因子(rh gm-csf)、250pg/ml粒细胞集落刺激因子(rh g-csf)和50pg/ml白介素-6(rh il-6)组成。将第0天hsc以6种不同密度(范围为从2000至100000个cd34
细胞/ml)接种在无ldc的培养基中,然后确定在此类潜在次优条件下祖细胞的扩增、效应细胞的分化和效力。
[0163]
材料和方法
[0164]
肿瘤细胞系
[0165]
将用于效应细胞效力测定中的肿瘤细胞系培养在imdm培养基(伊斯科夫改良杜尔贝科氏培养基,荷兰马斯特里赫特的龙沙集团)中,该培养基含有100u/ml青霉素和100u/ml链霉素(龙沙集团)、2mm l-谷氨酰胺(龙沙集团)和10%胎牛血清(fbs,荷兰兰茨梅尔的飞世尔科技公司)。每5天将细胞培养物传代并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0166]
从脐带血(ucb)中分离cd34
造血干细胞(hsc)
[0167]
使用人工选择从新鲜脐带血单位(由英国伦敦安东尼
·
诺兰机构供应)中分离cd34
hsc。首先,将新鲜血液用pbs 1:3稀释并且吸移在无菌管中的菲科帕克(荷兰荷佛拉肯的通用医疗生命科学公司)层的顶部上,以便在关闭制动器的情况下在20℃下以900g离心30min。使用移液管将分离的单核细胞层转移至无菌管;然后将细胞用pbs洗涤两次(龙沙集团)。将细胞经由流式细胞术计数,并且用cd34微珠试剂盒(美天旎生物科技公司)标记cd34
细胞;在标记之后,将细胞负载在放置在分选架上的ls柱上(两者均来自美天旎生物科技公司)以施加磁场,洗涤未标记的细胞,然后通过去除磁场将cd34
hsc在15ml facs缓冲液中洗脱,该缓冲液由补充有0.5%白蛋白(荷兰阿姆斯特丹的伞奎公司)和2mm edta ph 8.0(马萨诸塞州沃尔瑟姆的赛默飞世尔科技公司)的1x pbs构成。根据制造商方案进行所有步骤。在选择之后,将细胞经由流式细胞术计数并且适当地稀释以进行板培养。
[0168]
ucb来源的cd34
hsc扩增
[0169]
为了实现扩增,将从ucb分离的cd34
hsc以不同细胞密度(表示为细胞/ml)以2ml/孔的体积接种至6孔组织培养板(荷兰阿姆斯特丹的康宁公司)中,并且在格雷克斯迪姆基本生长培养基(gbgm,比利时veernem的fertipro n.v.公司)中培养13-14天,该基本生长培养基补充有10%人血清(hs,荷兰阿姆斯特丹的伞奎公司)、25ng/ml重组人干细胞因子(rh scf)、fms样酪氨酸激酶3配体(rh flt-3l)、促血小板生成素(rh tpo)和白介素-7(rh il-7)(全部来自德国弗莱堡的cellgenix公司)以完成
‘
无ldc的扩增培养基’混合物;第9天之后,将tpo用20ng/ml白介素-15(rh il-15)(cellgenix)替代。每2-3天用新培养基更新ucb-cd34
培养物并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0170]
扩增的ucb来源的cd34
hsc分化为ucb效应细胞
[0171]
在培养的第13-14天,通过将培养基混合物切换为
‘
无ldc的分化培养基’来诱导细胞分化(和进一步扩增),该分化培养基即补充有以下的gbgm:10%hs、20ng/ml il-7、scf、il-15(cellgenix)和1000u/ml白介素-2(rh il-2)(德国慕尼黑的凯龙公司)。将ucb效应细胞以1.5*106个细胞/ml的密度以2-5ml/孔的体积培养,并且从第13-14天至培
养终点(第35-42天)每周用新培养基更新培养物两次。
[0172]
流式细胞术
[0173]
在cytoflex lx(荷兰武尔登的贝克曼库尔特生命科学公司)上进行流式细胞术分析。使用此技术来确定效应细胞和靶细胞活力、表型(经由细胞表面标记物表达)并且定量地确定细胞数量。将细胞在4℃下用抗原特异性荧光染料标记的抗体染色15分钟,然后洗涤并且重悬于facs缓冲液中,该缓冲液由补充有0.5%白蛋白(伞奎公司)和2mm edta ph 8.0(飞世尔科技公司)的1x pbs(龙沙集团)构成。为了分析细胞活力,使用7-氨基放线菌素d(7-aad)dna嵌入标记物:活细胞(其膜不可透过染料)是阴性的,而死亡细胞(其中染料能够嵌入dna)是阳性的。通过将前向散射(fsc)相对于侧向散射(ssc)进行作图来初始鉴定感兴趣的细胞群体。在fsc/ssc图上鉴定出感兴趣的群体,然后将其针对活力(7-aad-)和针对感兴趣的表面抗原的阳性进行门控。使用的抗体是:抗cd45-kromeorange克隆j.33、抗cd34-pc7克隆581(两者均来自贝克曼库尔特公司)、抗cd56-apc-vio770克隆rea196(美天旎生物科技公司)和7-aad染料(荷兰兹韦恩德雷赫特的西格玛奥德里奇公司)。
[0174]
基于流式细胞术的效应细胞效力测定
[0175]
通过以下方式分析效应细胞效力:将效应细胞和靶肿瘤细胞系共培养过夜并且随后经由7-aad染色和流式细胞术确定靶细胞杀伤。将靶细胞以1*107个细胞/ml悬浮于pbs中并且在细胞培养箱中用0.012mg/ml pacific blue
tm
琥珀酰亚胺酯(pbse,赛默飞世尔科技公司)预标记10分钟;通过添加1体积的补充有10%fbs的靶细胞培养基停止标记。然后将细胞用pbs洗涤两次,经由流式细胞术计数并且最终以1*106个细胞/ml悬浮于具有10%fbs的培养基中。将效应细胞用细胞特异性表面标记物染色并且经由流式细胞术计数,然后最终以1*106个细胞/ml悬浮于补充有2%hs的gbgm中。然后将预染色的靶细胞与效应细胞在96孔组织培养板中以1:1比率共培养,针对每种细胞类型5*104个细胞/孔,体积为100μl,技术一式三份。包括单独效应细胞和单独靶细胞以作为对照。在细胞培养箱(37℃、95%湿度、5%co2)中共培养过夜之后,将样品用facs缓冲液1:1稀释,用7-aad染色并且立即经由流式细胞术分析。通过fsc/ssc特性和pbse阳性将靶细胞与效应细胞区分开;然后将pbse阳性7-aad阴性或阳性细胞(pbse
/7-aad-,即活靶细胞或pbse
/7-aad
,即死靶细胞)计数。将来自共培养一式三份的pbse
/7-aad-细胞的平均值根据单独培养的靶细胞获得的相同值进行归一化,以排除靶细胞生理性死亡的影响,然后通过相对于1减去所获得的值并将其乘以100来计算杀伤的细胞的百分比。
[0176]
统计分析
[0177]
使用graphpad prism 8软件(加利福尼亚州圣地亚哥)进行所有统计学分析。数据表示为独立生物学供体(n=3-4)的平均值,误差计算为标准偏差(sd)。进行学生t检验或单因素方差分析与多重比较检验(tukey方法),并且结果的显著性示出为p值(ns,统计学上不显著的:p》0.12;*p≤0.033;**p≤0.002;***p≤0.001)。
[0178]
结果
[0179]
部分1-cd34
造血干细胞(hsc)祖细胞的接种密度对无ldc的培养基中的体外细胞扩增的影响
[0180]
将从新鲜ucb分离、经由流式细胞术计数并且以6种不同的增加密度(表示为细胞/ml)稀释的第0天人cd34
hsc接种以在无ldc的培养基中进行扩增培养(表3)。监测培养物并
且定期更新培养基直到第13-14天;在第6、9和13-14天经由流式细胞术分析中间和最终的细胞扩增。对于每个时间点,针对每种条件基于第0天初始细胞密度计算扩增;将低密度设置(500个cd34
细胞/ml、2000个cd34
细胞/ml和10000个cd34
细胞/ml,示出为《10000个cd34
细胞/ml)和高密度设置(40000个cd34
细胞/ml、75000个cd34
细胞/ml和100000个cd34
细胞/ml,示出为》40000个cd34
细胞/ml)合并,并且将两个组的平均扩增相对于时间进行作图(图8a)。如图所示,如果相比于完全培养基(实例1和2),则无ldc的培养基中的扩增总体更低。然而,即使在此类次优条件下,通过低密度接种细胞实现了更高的扩增。终点扩增对于《10000个cd34
细胞/ml平均达到57倍或对于》40000个cd34
细胞/ml平均达到22倍。细胞培养密度与扩增之间的逆相关性展示于图8b中,其中对于两个组将相对细胞扩增相对于密度的逐渐相对增加进行作图。此类结果显示,即使在无ldc的培养条件下,如果以低密度接种细胞,则实现更高的cd34
hsc扩增。
[0181]
部分2-cd34
造血干细胞(hsc)祖细胞的扩增密度对无ldc的培养基中的效应细胞分化和效力的影响
[0182]
对于分化期,将来自每种扩增条件的第13-14天细胞以1.5*106个细胞/ml的密度设置在无ldc的分化培养基中;由于低细胞数量而将从500个cd34
细胞/ml和2000个cd34
细胞/ml起始培养获得的细胞合并。如在常规培养中的,每周进行两次培养基更新,并且每周进行一次细胞计数和表型分析,直到第35-36天。监测细胞分化为成熟效应细胞和进一步扩增的能力。图9示出了在无ldc的分化培养基中培养的细胞在第20与35天之间总体上如何逐渐成熟为效应细胞(从第20-21天的20%-38%至第35-36天的85%-89%)。在低密度培养细胞与高密度培养细胞之间没有观察到分化率的统计学上显著的差异。然而,分化细胞的扩增对于低密度条件保持稍微更高(未示出)。
[0183]
在第35天,在效力测定中分析效应细胞杀伤靶肿瘤细胞的能力。将所有效应细胞条件与肿瘤细胞系共培养过夜,并且随后经由流式细胞术确定靶细胞杀伤。如图10中所示,在以1:1效应物:靶标比率共培养过夜之后通过效应细胞杀伤了12%-62%的靶细胞,这表明在任何条件下产生功能性效应细胞。然而,相比于较高密度(》40000个cd34
细胞/ml),低密度扩增条件(《10000个cd34
细胞/ml)在杀伤方面显著更高效,显示出高1.5倍的效力。总之,即使细胞在无ldc的条件下受到更大程度的挑战,但低密度接种始终有益于实现更多数量的功能性效应细胞。
[0184]
表3-从新鲜脐带血(ucb)纯化且在无ldc的培养基中培养的cd34
造血干细胞(hsc)的第0天接种条件。将新鲜分离的hsc经由流式细胞术计数,并且以6种不同的增加细胞浓度(表示为细胞/ml)以2ml/孔的体积稀释于6孔组织培养板(作为单一平行测定)中。“浓度”列示出了所有条件之间的相对细胞密度,其中将最低的即500个cd34
细胞/ml设置为1。
[0185][0186]
实例4
[0187]
简介
[0188]
从新鲜脐带血(ucb)中分离的人cd34
造血干细胞(hsc)可以经由多步体外过程产生能够杀伤靶肿瘤细胞的效应细胞,该多步体外过程基于初始扩增期(第0-14天),之后是效应细胞特异性分化期(第15-35/42天)。如实例1和2中所示,第0天ucb来源的cd34
hsc培养密度对效应细胞的扩增、分化和效力具有重大影响。低密度接种细胞(低于10000个cd34
细胞/ml)在扩增、分化为效应细胞和针对靶肿瘤细胞的杀伤潜力方面具有很强的优势。有趣的是,如实例3中所示,通过从完全培养基中去除低密度细胞因子(ldc)混合物诱导的次优培养条件仍然支持低密度培养的这种有益效应。在此实例中,随着将培养基中的血清浓度从10%降低至2%,细胞受到更大程度的挑战。为了以某种方式补偿血清剥夺,与完全培养基相比,将细胞因子浓度增加5倍,同时将ldc排除在外。将第0天hsc以2种不同密度(低的(2000个cd34
细胞/ml)或高的(40000个cd34
细胞/ml))接种在2%hs、5x细胞因子、无ldc的培养基中,然后分析在此类次优条件下祖细胞的扩增、效应细胞的分化和效力。
[0189]
材料和方法
[0190]
肿瘤细胞系
[0191]
将用于效应细胞效力测定中的肿瘤细胞系培养在imdm培养基(伊斯科夫改良杜尔贝科氏培养基,荷兰马斯特里赫特的龙沙集团)中,该培养基含有100u/ml青霉素和100u/ml链霉素(龙沙集团)、2mm l-谷氨酰胺(龙沙集团)和10%胎牛血清(fbs,荷兰兰茨梅尔的飞世尔科技公司)。每5天将细胞培养物传代并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0192]
从脐带血(ucb)中分离cd34
造血干细胞(hsc)
[0193]
使用人工选择从新鲜脐带血单位(由英国伦敦安东尼
·
诺兰机构供应)中分离cd34
hsc。首先,将新鲜血液用pbs 1:3稀释并且吸移在无菌管中的菲科帕克(荷兰荷佛拉肯的通用医疗生命科学公司)层的顶部上,以便在关闭制动器的情况下在20℃下以900g离心30min。使用移液管将分离的单核细胞层转移至无菌管;然后将细胞用pbs洗涤两次(龙沙集团)。将细胞经由流式细胞术计数,并且用cd34微珠试剂盒(美天旎生物科技公司)标记cd34
细胞;在标记之后,将细胞负载在放置在分选架上的ls柱上(两者均来自美天旎生物科技公司)以施加磁场,洗涤未标记的细胞,然后通过去除磁场将cd34
hsc在15ml facs缓冲液中洗脱,该缓冲液由补充有0.5%白蛋白(荷兰阿姆斯特丹的伞奎公司)和2mm edta ph 8.0(马萨诸塞州沃尔瑟姆的赛默飞世尔科技公司)的1x pbs构成。根据制造商方案进行所有步骤。在选择之后,将细胞经由流式细胞术计数并且适当地稀释以进行板培养。
[0194]
ucb来源的cd34
hsc扩增
[0195]
为了实现扩增,将从ucb分离的cd34
hsc以两种不同的细胞密度(表示为细胞/ml)以2ml/孔的体积接种至6孔组织培养板(荷兰阿姆斯特丹的康宁公司)中,并且在格雷克斯迪姆基本生长培养基(gbgm,比利时veernem的fertipro n.v.公司)中培养14天,该基本生长培养基补充有2%人血清(hs,荷兰阿姆斯特丹的伞奎公司)、125ng/ml重组人干细胞因子(rh scf)、fms样酪氨酸激酶3配体(rh flt-3l)、促血小板生成素(rh tpo)和白介素-7(rh il-7)(全部来自德国弗莱堡的cellgenix公司)以完成
‘
2%hs、5x细胞因子、无ldc的扩增培养基’混合物;第9天之后,将tpo用100ng/ml白介素-15(rh il-15)(cellgenix)替代。每2-3天用新培养基更新ucb-cd34
培养物并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0196]
扩增的ucb来源的cd34
hsc分化为ucb效应细胞
[0197]
在培养的第14天,通过将培养基混合物切换为
‘
2%hs、5x细胞因子、无ldc的分化培养基’来诱导细胞分化(和进一步扩增),该分化培养基即补充有以下的gbgm:2%hs、100ng/ml il-7、scf、il-15(cellgenix)和5000u/ml白介素-2(rh il-2)(德国慕尼黑的凯龙公司)。将ucb效应细胞以1.5*106个细胞/ml的密度以2-5ml/孔的体积培养,并且从第14天至培养终点(第35-42天)每周用新培养基更新培养物两次。
[0198]
流式细胞术
[0199]
在cytoflex lx(荷兰武尔登的贝克曼库尔特生命科学公司)上进行流式细胞术分析。使用此技术来确定效应细胞和靶细胞活力、表型(经由细胞表面标记物表达)并且定量地确定细胞数量。将细胞在4℃下用抗原特异性荧光染料标记的抗体染色15分钟,然后洗涤并且重悬于facs缓冲液中,该缓冲液由补充有0.5%白蛋白(伞奎公司)和2mm edta ph 8.0(飞世尔科技公司)的1x pbs(龙沙集团)构成。为了分析细胞活力,使用7-氨基放线菌素d(7-aad)dna嵌入标记物:活细胞(其膜不可透过染料)是阴性的,而死亡细胞(其中染料能够嵌入dna)是阳性的。通过将前向散射(fsc)相对于侧向散射(ssc)进行作图来初始鉴定感兴趣的细胞群体。在fsc/ssc图上鉴定出感兴趣的群体,然后将其针对活力(7-aad-)和针对感兴趣的表面抗原的阳性进行门控。使用的抗体是:抗cd45-kromeorange克隆j.33、抗cd34-pc7克隆581(两者均来自贝克曼库尔特公司)、抗cd56-apc-vio770克隆rea196(美天旎生物科技公司)和7-aad染料(荷兰兹韦恩德雷赫特的西格玛奥德里奇公司)。
[0200]
基于流式细胞术的效应细胞效力测定
[0201]
通过以下方式分析效应细胞效力:将效应细胞和靶肿瘤细胞系共培养过夜并且随后经由7-aad染色和流式细胞术确定靶细胞杀伤。将靶细胞以1*107个细胞/ml悬浮于pbs中并且在细胞培养箱中用0.012mg/ml pacific blue
tm
琥珀酰亚胺酯(pbse,赛默飞世尔科技公司)预标记10分钟;通过添加1体积的补充有10%fbs的靶细胞培养基停止标记。然后将细胞用pbs洗涤两次,经由流式细胞术计数并且最终以1*106个细胞/ml悬浮于具有10%fbs的培养基中。将效应细胞用细胞特异性表面标记物染色并且经由流式细胞术计数,然后最终以1*106个细胞/ml悬浮于补充有2%hs的gbgm中。然后将预染色的靶细胞与效应细胞在96孔组织培养板中以1:1比率共培养,针对每种细胞类型5*104个细胞/孔,体积为100μl,技术一式三份。包括单独效应细胞和单独靶细胞以作为对照。在细胞培养箱(37℃、95%湿度、5%co2)中共培养过夜之后,将样品用facs缓冲液1:1稀释,用7-aad染色并且立即经由流式细胞术分析。通过fsc/ssc特性和pbse阳性将靶细胞与效应细胞区分开;然后将pbse阳性7-aad阴性或阳性细胞(pbse
/7-aad-,即活靶细胞或pbse
/7-aad
,即死靶细胞)计数。将来自
共培养一式三份的pbse
/7-aad-细胞的平均值根据单独培养的靶细胞获得的相同值进行归一化,以排除靶细胞生理性死亡的影响,然后通过相对于1减去所获得的值并将其乘以100来计算杀伤的细胞的百分比。
[0202]
统计分析
[0203]
使用graphpad prism 8软件(加利福尼亚州圣地亚哥)进行所有统计学分析。数据表示为独立生物学供体(n=2)的平均值,误差计算为标准偏差(sd)。进行学生t检验或单因素方差分析与多重比较检验(tukey方法),并且结果的显著性示出为p值(ns,统计学上不显著的:p》0.12;*p≤0.033;**p≤0.002;***p≤0.001)。
[0204]
结果
[0205]
部分1-cd34
造血干细胞(hsc)祖细胞的接种密度对2%血清、5x细胞因子且无ldc的培养基中的体外细胞扩增的影响
[0206]
将从新鲜ucb分离、经由流式细胞术计数并且以2种密度(低的(2000个cd34
细胞/ml)或高的(40000个cd34
细胞/ml)稀释的第0天人cd34
hsc接种以在2%血清、5x细胞因子且无ldc的培养基中进行扩增培养(表4)。监测培养物并且定期更新培养基直到第14天;在第6、9和14天经由流式细胞术分析中间和最终的细胞扩增。对于每个时间点,基于第0天初始细胞密度计算扩增,并且将两种条件的平均扩增相对于时间进行作图(图11a)。有趣的是,在2%hs、5x细胞因子、无ldc的培养基中的细胞扩增潜力与在无ldc的培养基中获得的细胞扩增潜力(如实例3中所示)是可比的,并且类似地在低密度培养中得到增加。终点扩增对于2000个cd34
细胞/ml平均达到57倍并且对于10000个cd34
细胞/ml平均达到22倍。细胞密度与相对扩增之间的逆相关性示出于图11b中。总体上,即使血清可用性降低,但如果以低密度接种细胞,则实现更高的扩增。
[0207]
部分2-cd34
造血干细胞(hsc)祖细胞的扩增密度对2%血清、5x细胞因子且无ldc的培养基中的效应细胞分化和效力的影响
[0208]
对于分化期,将第14天细胞以1.5*106个细胞/ml的密度设置在2%血清、5x细胞因子且无ldc的分化培养基中。每周监测细胞分化为成熟效应细胞和进一步扩增的能力,直到第35天,并且每周更新培养基两次。图12示出了细胞分化从第21至35天的进展(从第21天的11%-44%至第35天的60%-96%)。相比于40,000个cd34
细胞/ml时,对于以2000个cd34
细胞/ml扩增的细胞在较晚阶段观察到稍微分化优势。第35天扩增类似地对于低密度起始培养更高(未示出)。
[0209]
在第35天测试的效应细胞效力确认了低密度接种如何在杀伤靶肿瘤细胞方面给出优势(图13)。平均而言,在以1:1e:t比率共培养过夜之后,通过2000个cd34
细胞/ml效应细胞杀伤了51%的靶细胞,其中通过40000个cd34
细胞/ml效应细胞杀伤了43%(效力增加1.2倍)。此实例加强了对cd34
hsc的低接种密度的偏好,即使在细胞无法利用其完全潜力的条件(如血清剥夺、高细胞因子和无ldc设置)下。
[0210]
此实例示出了即使当将细胞维持在次优条件(如血清剥夺、高细胞因子、无ldc的培养条件)下,第0天cd34
造血干细胞的低接种密度如何有益于祖细胞的扩增、效应细胞的成熟和效力。此类培养条件对细胞扩增、分化和杀伤靶细胞的能力提出了挑战,其中细胞扩增是最受影响的过程。尽管细胞扩增总体下降(高达10倍),但低密度细胞保持相比于高密度细胞的优势,从而在整个分化中和在功能方面都具有优势。
8.0(马萨诸塞州沃尔瑟姆的赛默飞世尔科技公司)的1x pbs构成。根据制造商方案进行所有步骤。在选择之后,将细胞经由流式细胞术计数并且适当地稀释以进行板培养。
[0221]
ucb来源的cd34
hsc扩增
[0222]
为了实现扩增,将从ucb分离的cd34
hsc以两种不同的细胞密度(表示为细胞/ml)以2ml/孔的体积接种至6孔组织培养板(荷兰阿姆斯特丹的康宁公司)中,并且在格雷克斯迪姆基本生长培养基(gbgm,比利时veernem的fertipro n.v.公司)中培养14天,该基本生长培养基补充有2%人血清(hs,荷兰阿姆斯特丹的伞奎公司)、25ng/ml重组人干细胞因子(rh scf)、fms样酪氨酸激酶3配体(rh flt-3l)、促血小板生成素(rh tpo)和白介素-7(rh il-7)(全部来自德国弗莱堡的cellgenix公司)以完成
‘
2%hs、1x细胞因子、无ldc的扩增培养基’混合物;第9天之后,将tpo用20ng/ml白介素-15(rh il-15)(cellgenix)替代。每2-3天用新培养基更新ucb-cd34
培养物并且保持在37℃、95%湿度、5%co2下的细胞培养箱中。
[0223]
扩增的ucb来源的cd34
hsc分化为ucb效应细胞
[0224]
在培养的第14天,通过将培养基混合物切换为
‘
2%hs、1x细胞因子、无ldc的分化培养基’来诱导细胞分化(和进一步扩增),该分化培养基即补充有以下的gbgm:2%hs、20ng/ml il-7、scf、il-15(cellgenix)和1000u/ml白介素-2(rh il-2)(德国慕尼黑的凯龙公司)。将ucb效应细胞以1.5*106个细胞/ml的密度以2-5ml/孔的体积培养,并且从第14天至培养终点(第35-42天)每周用新培养基更新培养物两次。
[0225]
流式细胞术
[0226]
在cytoflex lx(荷兰武尔登的贝克曼库尔特生命科学公司)上进行流式细胞术分析。使用此技术来确定效应细胞和靶细胞活力、表型(经由细胞表面标记物表达)并且定量地确定细胞数量。将细胞在4℃下用抗原特异性荧光染料标记的抗体染色15分钟,然后洗涤并且重悬于facs缓冲液中,该缓冲液由补充有0.5%白蛋白(伞奎公司)和2mm edta ph 8.0(飞世尔科技公司)的1x pbs(龙沙集团)构成。为了分析细胞活力,使用7-氨基放线菌素d(7-aad)dna嵌入标记物:活细胞(其膜不可透过染料)是阴性的,而死亡细胞(其中染料能够嵌入dna)是阳性的。通过将前向散射(fsc)相对于侧向散射(ssc)进行作图来初始鉴定感兴趣的细胞群体。在fsc/ssc图上鉴定出感兴趣的群体,然后将其针对活力(7-aad-)和针对感兴趣的表面抗原的阳性进行门控。使用的抗体是:抗cd45-kromeorange克隆j.33、抗cd34-pc7克隆581(两者均来自贝克曼库尔特公司)、抗cd56-apc-vio770克隆rea196(美天旎生物科技公司)和7-aad染料(荷兰兹韦恩德雷赫特的西格玛奥德里奇公司)。
[0227]
基于流式细胞术的效应细胞效力测定
[0228]
通过以下方式分析效应细胞效力:将效应细胞和靶肿瘤细胞系共培养过夜并且随后经由7-aad染色和流式细胞术确定靶细胞杀伤。将靶细胞以1*107个细胞/ml悬浮于pbs中并且在细胞培养箱中用0.012mg/ml pacific blue
tm
琥珀酰亚胺酯(pbse,赛默飞世尔科技公司)预标记10分钟;通过添加1体积的补充有10%fbs的靶细胞培养基停止标记。然后将细胞用pbs洗涤两次,经由流式细胞术计数并且最终以1*106个细胞/ml悬浮于具有10%fbs的培养基中。将效应细胞用细胞特异性表面标记物染色并且经由流式细胞术计数,然后最终以1*106个细胞/ml悬浮于补充有2%hs的gbgm中。然后将预染色的靶细胞与效应细胞在96孔组织培养板中以1:1比率共培养,针对每种细胞类型5*104个细胞/孔,体积为100μl,技术一式三份。包括单独效应细胞和单独靶细胞以作为对照。在细胞培养箱(37℃、95%湿度、
5%co2)中共培养过夜之后,将样品用facs缓冲液1:1稀释,用7-aad染色并且立即经由流式细胞术分析。通过fsc/ssc特性和pbse阳性将靶细胞与效应细胞区分开;然后将pbse阳性7-aad阴性或阳性细胞(pbse
/7-aad-,即活靶细胞或pbse
/7-aad
,即死靶细胞)计数。将来自共培养一式三份的pbse
/7-aad-细胞的平均值根据单独培养的靶细胞获得的相同值进行归一化,以排除靶细胞生理性死亡的影响,然后通过相对于1减去所获得的值并将其乘以100来计算杀伤的细胞的百分比。
[0229]
统计分析
[0230]
使用graphpad prism 8软件(加利福尼亚州圣地亚哥)进行所有统计学分析。数据表示为独立生物学供体(n=2)的平均值,误差计算为标准偏差(sd)。进行学生t检验或单因素方差分析与多重比较检验(tukey方法),并且结果的显著性示出为p值(ns,统计学上不显著的:p》0.12;*p≤0.033;**p≤0.002;***p≤0.001)。
[0231]
结果
[0232]
部分1-cd34
造血干细胞(hsc)祖细胞的接种密度对2%血清、1x细胞因子且无ldc的培养基中的体外细胞扩增的影响
[0233]
将从新鲜ucb分离、经由流式细胞术计数并且以2种密度(低的(2000个cd34
细胞/ml)或高的(40000个cd34
细胞/ml)稀释的第0天人cd34
hsc接种以在2%血清、1x细胞因子且无ldc的培养基中进行扩增培养(表4)。监测培养物并且定期更新培养基直到第14天;在第6、9和14天经由流式细胞术分析中间和最终的细胞扩增。对于每个时间点,基于第0天初始细胞密度计算扩增,并且将两种条件的平均扩增相对于时间进行作图(图14a)。所观察到的细胞扩增类似于在无ldc的培养基(如实例3中所示)中和在2%血清、5x细胞因子、无ldc的培养基(如实例4中所示)中观察到的细胞扩增。类似地,该细胞扩增通过低密度接种得到增加。终点扩增对于2000个cd34
细胞/ml平均达到53倍或对于40000个cd34
细胞/ml平均达到14倍。细胞密度与相对扩增之间的逆相关性示出于图14b中。这些数据展示了即使培养基中的血清减少未通过增加细胞因子补偿,低密度接种如何仍在细胞扩增方面给出优势。
[0234]
部分2-cd34
造血干细胞(hsc)祖细胞的扩增密度对2%血清、1x细胞因子且无ldc的培养基中的效应细胞分化和效力的影响
[0235]
对于分化期,将第14天细胞以1.5*106个细胞/ml的密度设置在2%血清、1x细胞因子且无ldc的分化培养基中。每周监测细胞分化为成熟效应细胞和进一步扩增的能力,直到第35天,并且每周更新培养基两次。图15示出了细胞分化从第21至35天的进展(从第21天的15%-45%至第35天的55%-96%)。相比于40,000个cd34
细胞/ml时,对于以2000个cd34
细胞/ml扩增的细胞,尽管初始在分化方面较缓慢,但在较晚阶段观察到优势。第35天扩增类似地在低密度下更高(未示出)。
[0236]
在第35天测试的效应细胞效力示出了低密度接种如何在杀伤靶肿瘤细胞方面给出优势(图16)。对于一名测试供体,在以1:1e:t比率共培养过夜之后,通过2000个cd34
细胞/ml效应细胞杀伤了28%的靶细胞,其中通过40000个cd34
细胞/ml效应细胞杀伤了14%(细胞毒性效力增加2倍)。此实例展示了培养条件的强烈减损(像血清剥夺与低细胞因子的组合)如何在不同程度上影响细胞扩增、分化和表型。然而,相比于高密度培育的cd34
干细胞,低密度下的初始培养赋予这些细胞一致的优势。
[0237]
表5-从新鲜脐带血(ucb)纯化且在2%血清、1x细胞因子且无ldc的培养基中培养
the graft on severe acute graft-versus-host disease after unrelated bone marrow transplantation.leukemia research 36,699-703(2012).
[0253]
14.r.kiessling,e.klein,h.pross,h.wigzell,“natural”killer cells in the mouse.ii.cytotoxic cells with specificity for mouse moloney leukemia cells.characteristics of the killer cell.eur j immunol 5,117-121(1975).
[0254]
15.r.b.herberman,m.e.nunn,d.h.lavrin,natural cytotoxic reactivity of mouse lymphoid cells against syngeneic acid allogeneic tumors.i.distribution of reactivity and specificity.int j cancer 16,216-229(1975).
[0255]
16.r.b.herberman,m.e.nunn,h.t.holden,d.h.lavrin,natural cytotoxic reactivity of mouse lymphoid cells against syngeneic and allogeneic tumors.ii.characterization of effector cells.int j cancer 16,230-239(1975).
[0256]
17.r.kiessling,e.klein,h.wigzell,“natural”killer cells in the mouse.i.cytotoxic cells with specificity for mouse moloney leukemia cells.specificity and distribution according to genotype.eur j immunol 5,112-117(1975).
[0257]
18.e.vivier,e.tomasello,m.baratin,t.walzer,s.ugolini,functions of natural killer cells.nat immunol 9,503-510(2008).
[0258]
19.m.a.caligiuri,human natural killer cells.blood 112,461-469(2008).
[0259]
20.m.a.cooper,t.a.fehniger,a.fuchs,m.colonna,m.a.caligiuri,nk cell and dc interactions.trends in immunology 25,47-52(2004).
[0260]
21.g.ferlazzo,c.munz,nk cell compartments and their activation by dendritic cells.j immunol 172,1333-1339(2004).
[0261]
22.m.j.robertson,j.ritz,biology and clinical relevance of human natural killer cells.blood 76,2421-2438(1990).
[0262]
23.l.l.lanier,r.testi,j.bindl,j.h.phillips,identity of leu-19(cd56)leukocyte differentiation antigen and neural cell adhesion molecule.j exp med 169,2233-2238(1989).
[0263]
24.l.l.lanier,a.m.le,c.i.civin,m.r.loken,j.h.phillips,the relationship of cd16(leu-11)and leu-19(nkh-1)antigen expression on human peripheral blood nk cells and cytotoxic t lymphocytes.j immunol 136,4480-4486(1986).
[0264]
25.l.l.lanier,nk cell recognition.annu rev immunol 23,225-274(2005).
[0265]
26.l.l.lanier,j.h.phillips,j.hackett,jr.,m.tutt,v.kumar,natural killer cells:definition of a cell type rather than a function.j immunol 137,2735-2739(1986).
[0266]
27.j.a.trapani,m.j.smyth,functional significance of the perforin/granzyme cell death pathway.nat rev immunol 2,735-747(2002).
[0267]
28.g.bossi,g.m.griffiths,ctl secretory lysosomes:biogenesis and secretion of a harmful organelle.semin immunol 17,87-94(2005).
[0268]
29.v.screpanti,r.p.wallin,a.grandien,h.g.ljunggren,impact of fasl-induced apoptosis in the elimination of tumor cells by nk cells.molecular immunology 42,495-499(2005).
[0269]
30.l.moretta,a.moretta,unravelling natural killer cell function:triggering and inhibitory human nk receptors.embo j 23,255-259(2004).
[0270]
31.d.h.raulet,interplay of natural killer cells and their receptors with the adaptive immune response.nature immunology 5,996-1002(2004).
[0271]
32.e.vivier,j.a.nunes,f.vely,natural killer cell signaling pathways.science 306,1517-1519(2004).
[0272]
33.l.l.lanier,nk cell receptors.annu rev immunol 16,359-393(1998).
[0273]
34.a.moretta et al.,activating receptors and coreceptors involved in human natural killer cell-mediated cytolysis.annu rev immunol 19,197-223(2001).
[0274]
35.r.willemze et al.,kir-ligand incompatibility in the graft-versus-host direction improves outcomes after umbilical cord blood transplantation for acute leukemia.leukemia 23,492-500(2009).
[0275]
36.n.d.huntington,c.a.vosshenrich,j.p.di santo,developmental pathways that generate natural-killer-cell diversity in mice and humans.nat rev immunol 7,703-714(2007).
[0276]
37.a.g.freud et al.,a human cd34( )subset resides in lymph nodes and differentiates into cd56bright natural killer cells.immunity 22,295-304(2005).
[0277]
38.a.g.freud et al.,evidence for discrete stages of human natural killer cell differentiation in vivo.j exp med 203,1033-1043(2006).
[0278]
39.t.a.fehniger et al.,cd56bright natural killer cells are present in human lymph nodes and are activated by t cell-derived il-2:a potential new link between adaptive and innate immunity.blood 101,3052-3057(2003).
[0279]
40.g.ferlazzo et al.,the abundant nk cells in human secondary lymphoid tissues require activation to express killer cell ig-like receptors and become cytolytic.j immunol 172,1455-1462(2004).
[0280]
41.d.n.eissens et al.,cd3 /cd19 -depleted grafts in hla-matched allogeneic peripheral blood stem cell transplantation lead to early nk cell cytolytic responses and reduced inhibitory activity of nkg2a.leukemia 24,583-591(2010).
[0281]
42.h.g.shilling et al.,reconstitution of nk cell receptor repertoire following hla-matched hematopoietic cell transplantation.blood 101,3730-3740(2003).
[0282]
43.j.p.di santo,natural killer cell developmental pathways:a question of balance.annu rev immunol 24,257-286(2006).
[0283]
44.s.kim et al.,licensing of natural killer cells by host major histocompatibility complex class i molecules.nature 436,709-713(2005).
[0284]
45.d.h.raulet,r.e.vance,self-tolerance of natural killer cells.nat rev immunol 6,520-531(2006).
[0285]
46.n.anfossi et al.,human nk cell education by inhibitory receptors for mhc class i.immunity 25,331-342(2006).
[0286]
47.n.c.fernandez et al.,a subset of natural killer cells achieves self-tolerance without expressing inhibitory receptors specific for self-mhc molecules.blood 105,4416-4423(2005).
[0287]
48.s.cooley et al.,a subpopulation of human peripheral blood nk cells that lacks inhibitory receptors for self-mhc is developmentally immature.blood 110,578-586(2007).
[0288]
49.t.a.fehniger et al.,differential cytokine and chemokine gene expression by human nk cells following activation with il-18 or il-15 in combination with il-12:implications for the innate immune response.j immunol 162,4511-4520(1999).
[0289]
50.m.a.cooper,t.a.fehniger,m.a.caligiuri,the biology of human natural killer-cell subsets.trends immunol 22,633-640(2001).
[0290]
51.a.g.freud,m.a.caligiuri,human natural killer cell development.immunol rev 214,56-72(2006).
[0291]
52.s.s.farag,m.a.caligiuri,human natural killer cell development and biology.blood rev 20,123-137(2006).
[0292]
53.i.douagi,f.colucci,j.p.di santo,a.cumano,identification of the earliest prethymic bipotent t/nk progenitor in murine fetal liver.blood 99,463-471(2002).
[0293]
54.h.yu et al.,flt3 ligand promotes the generation of a distinct cd34( )human natural killer cell progenitor that responds to interleukin-15.blood 92,3647-3657(1998).
[0294]
55.g.carayol et al.,nk cells differentiated from bone marrow,cord blood and peripheral blood stem cells exhibit similar phenotype and functions.eur j immunol 28,1991-2002(1998).
[0295]
56.m.o.muench et al.,differential effects of interleukin-3,interleukin-7,interleukin 15,and granulocyte-macrophage colony-stimulating factor in the generation of natural killer and b cells from primitive human fetal liver progenitors.exp hematol 28,961-973(2000).
[0296]
57.j.s.miller,k.a.alley,p.mcglave,differentiation of natural killer(nk)cells from human primitive marrow progenitors in a stroma-based long-term culture system:identification of a cd34 7 nk progenitor.blood 83,2594-2601(1994).
of blood and marrow transplantation:journal of the american society for blood and marrow transplantation 14,1305-1311(2008).
[0312]
73.l.e.shields,r.g.andrews,gestational age changes in circulating cd34 hematopoietic stem/progenitor cells in fetal cord blood.am j obstet gynecol 178,931-937(1998).
[0313]
74.k.vettenranta,i.piirto,u.m.saarinen-pihkala,the effects of the mode of delivery on the lymphocyte composition of a placental/cord blood graft.journal of hematotherapy 6,491-493(1997).
[0314]
75.d.grisaru et al.,placing the newborn on the maternal abdomen after delivery increases the volume and cd34 cell content in the umbilical cord blood collected:an old maneuver with new applications.am j obstet gynecol 180,1240-1243(1999).
[0315]
76.s.r.panch,j.szymanski,b.n.savani,d.f.stroncek,sources of hematopoietic stem and progenitor cells and methods to optimize yields for clinical cell therapy.biology of blood and marrow transplantation:journal of the american society for blood and marrow transplantation 23,1241-1249(2017).
[0316]
77.j.e.wagner,jr.et al.,phase i/ii trial of stemregenin-1 expanded umbilical cord blood hematopoietic stem cells supports testing as a stand-alone graft.cell stem cell 18,144-155(2016).
[0317]
78.m.e.horwitz et al.,umbilical cord blood expansion with nicotinamide provides long-term multilineage engraftment.j clin invest 124,3121-3128(2014).
[0318]
79.m.de lima et al.,cord-blood engraftment with ex vivo mesenchymal-cell coculture.n engl j med 367,2305-2315(2012).
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
