1.本发明涉及用于有机电子器件的化合物,例如有机发光器件。更特别地,涉及一种包含芳香族胺取代的芘化合物以及包含该化合物有机电致发光器件和化合物配方。
背景技术:
2.有机电子器件包括但是不限于下列种类:有机发光二极管(oleds),有机场效应晶体管(o-fets),有机发光晶体管(olets),有机光伏器件(opvs),染料-敏化太阳能电池(dsscs),有机光学检测器,有机光感受器,有机场效应器件(ofqds),发光电化学电池(lecs),有机激光二极管和有机电浆发光器件。
3.1987年,伊斯曼柯达的tang和van slyke报道了一种双层有机电致发光器件,其包括芳基胺空穴传输层和三-8-羟基喹啉-铝层作为电子传输层和发光层(applied physics letters,1987,51(12):913-915)。一旦加偏压于器件,绿光从器件中发射出来。这个发明为现代有机发光二极管(oleds)的发展奠定了基础。最先进的oleds可以包括多层,例如电荷注入和传输层,电荷和激子阻挡层,以及阴极和阳极之间的一个或多个发光层。由于oleds是一种自发光固态器件,它为显示和照明应用提供了巨大的潜力。此外,有机材料的固有特性,例如它们的柔韧性,可以使它们非常适合于特殊应用,例如在柔性基底制作上。
4.oled可以根据其发光机制分为三种不同类型。tang和van slyke发明的oled是荧光oled。它只使用单重态发光。在器件中产生的三重态通过非辐射衰减通道浪费了。因此,荧光oled的内部量子效率(iqe)仅为25%。这个限制阻碍了oled的商业化。1997年,forrest和thompson报告了磷光oled,其使用来自含络合物的重金属的三重态发光作为发光体。因此,能够收获单重态和三重态,实现100%的iqe。由于它的高效率,磷光oled的发现和发展直接为有源矩阵oled(amoled)的商业化作出了贡献。最近,adachi通过有机化合物的热激活延迟荧光(tadf)实现了高效率。这些发光体具有小的单重态-三重态间隙,使得激子从三重态返回到单重态的成为可能。在tadf器件中,三重态激子能够通过反向系统间穿越产生单重态激子,导致高iqe。
5.oled的发光颜色可以通过发光材料结构设计来实现。oled可以包括一个发光层或多个发光层以实现期望的光谱。绿色,黄色和红色oled磷光材料已成功实现商业化。目前磷光蓝光oled的寿命短,难以达到深蓝色,以及蓝色不饱和和工作电压高等问题。荧光蓝光oled比磷光蓝光oled具有更长的寿命,但有效率低等问题,因此非常需要提高荧光蓝色电致发光器件的效率等性能。
6.wo2009107596a1中公开报道了苯并脂肪环的三芳胺取代的芘类化合物,其通式为其中取代基r
21-r
24
可以成环形成如下结构
具体为以下结构
7.公开的具体结构有和但该专利申请中并未意识到芳胺中引入苯并环烃对器件性能带来的影响,也并未公开和教导具有苯并环烃和联芳基结构会提升器件性能。
8.cn107556239a中公开了一种含有吖啶结构的芘化合物,通式如下其中ar1和ar2可以为杂环基,具体结构有等,但该专利申请中主要针对一系列具有吖啶取代的芳香族胺的芘类化合物,并未关注到苯并杂环烃会对器件性能带来提升,也没有公开和教导芳胺中引入苯并环烃或苯并杂环烃以及芳胺中另一个芳基为联芳基会取得的器件效果。
9.这些文献中公开了一些以芘为核心的具有芳香胺结构的荧光发光材料。但是荧光发光材料仍需要更进一步的开发,以获得更高的器件性能。
技术实现要素:
10.本发明旨在提供一系列新型的具有取代或未取代的(杂)芳基并五元(杂)环烃和取代或未取代的联(杂)芳基的芳香族胺结构的芘类化合物来解决至少部分上述问题。
11.根据本发明的一个实施例,公开一种具有式1结构的化合物:
[0012][0013]
其中,在式1中,
[0014]
取代基r
1-r
10
中至少有一个具有式2结构:
[0015][0016]
并且取代基r
1-r
10
中剩余者每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0017]
其中,在式2中,
[0018]
l选自单键,取代或未取代的具有6-60个碳原子的亚芳基,取代或未取代的具有3-60个碳原子的亚杂芳基,或其组合;
[0019]
x
1-x3每次出现时相同或不同地选自cr
x
或n;
[0020]
y1和y5每次出现时相同或不同地选自cr
y1
或n;
[0021]
y
2-y4每次出现时相同或不同地选自cr
y2
、cr
y3
或n,且y
2-y4中至少有一个为cr
y2
;
[0022]
z每次出现相同或不同地选自c(r
z
)2,nr
z
,o,s或se;
[0023]
r
x
、r
y3
和r
z
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨
基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0024]
r
y1
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,及其组合;
[0025]
r
y2
每次出现时相同或不同地选自取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,或其组合;
[0026]
相邻的取代基r
x
、r
y1
、r
y3
能任选地连接形成环;
[0027]
取代基r
z
能任选地连接形成环;
[0028]
*代表具有式2结构的取代基连接式1的位置。
[0029]
根据本发明的另一个实施例,还公开了一种电致发光器件,其包含具有式1结构的所述化合物。所述化合物的具体结构见前述实施例所述。
[0030]
根据本发明的另一个实施例,还公开了一种化合物配方,其包含具有式1结构的所述化合物。所述化合物的具体结构前述实施例所述。
[0031]
本发明提供的一系列新型的具有取代或未取代的(杂)芳基并五元(杂)环烃和取代或未取代的联(杂)芳基的芳香族胺结构的芘类化合物,可用作有机电致发光器件中的发光材料。这些新型化合物能提供更好的器件性能,如更高的外部量子效率和更窄的半峰宽等。
附图说明
[0032]
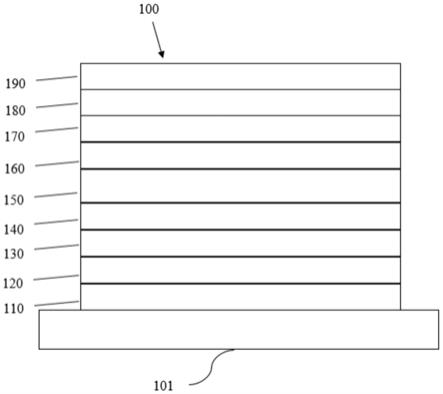
图1是可以含有本文所公开的化合物和化合物配方的有机发光装置示意图。
[0033]
图2是可以含有本文所公开的化合物和化合物配方的另一有机发光装置示意图。
具体实施方式
[0034]
oled可以在各种基板上制造,例如玻璃,塑料和金属。图1示意性、非限制性的展示了有机发光装置100。图不一定按比例绘制,图中一些层结构也是可以根据需要省略的。装置100可以包括基板101、阳极110、空穴注入层120、空穴传输层130、电子阻挡层140、发光层150、空穴阻挡层160、电子传输层170、电子注入层180和阴极190。装置100可以通过依序沉积所描述的层来制造。各层的性质和功能以及示例性材料在美国专利us7,279,704b2第6-10栏有更详细的描述,上述专利的全部内容通过引用并入本文。
[0035]
这些层中的每一个有更多实例。举例来说,以全文引用的方式并入的美国专利第5,844,363号中公开柔性并且透明的衬底-阳极组合。经p掺杂的空穴输送层的实例是以50:1的摩尔比率掺杂有f
4-tcnq的m-mtdata,如以全文引用的方式并入的美国专利申请公开案第2003/0230980号中所公开。以全文引用的方式并入的颁予汤普森(thompson)等人的美国专利第6,303,238号中公开主体材料的实例。经n掺杂的电子输送层的实例是以1:1的摩尔比率掺杂有li的bphen,如以全文引用的方式并入的美国专利申请公开案第2003/0230980号中所公开。以全文引用的方式并入的美国专利第5,703,436号和第5,707,745号公开了阴极的实例,其包括具有例如mg:ag等金属薄层与上覆的透明、导电、经溅镀沉积的ito层的复合阴极。以全文引用的方式并入的美国专利第6,097,147号和美国专利申请公开案第2003/0230980号中更详细地描述阻挡层的原理和使用。以全文引用的方式并入的美国专利申请公开案第2004/0174116号中提供注入层的实例。可以在以全文引用的方式并入的美国专利
申请公开案第2004/0174116号中找到保护层的描述。
[0036]
经由非限制性的实施例提供上述分层结构。oled的功能可以通过组合以上描述的各种层来实现,或者可以完全省略一些层。它还可以包括未明确描述的其它层。在每个层内,可以使用单一材料或多种材料的混合物来实现最佳性能。任何功能层可以包括几个子层。例如,发光层可以具有两层不同的发光材料以实现期望的发光光谱。
[0037]
在一个实施例中,oled可以描述为具有设在阴极和阳极之间的“有机层”。该有机层可以包括一层或多层。
[0038]
oled也需要封装层,如图2示意性、非限制性的展示了有机发光装置200,其与图1不同的是,阴极190之上还可以包括封装层102,以防止来自环境的有害物质,例如水分和氧气。能够提供封装功能的任何材料都可以用作封装层,例如玻璃或者有机-无机混合层。封装层应直接或间接放置在oled器件的外部。多层薄膜封装在美国专利us7,968,146b2中进行了描述,其全部内容通过引用并入本文。
[0039]
根据本发明的实施例制造的器件可以并入具有该器件的一个或多个电子部件模块(或单元)的各种消费产品中。这些消费产品的一些例子包括平板显示器,监视器,医疗监视器,电视机,广告牌,用于室内或室外照明和/或发信号的灯,平视显示器,完全或部分透明的显示器,柔性显示器,智能电话,平板计算机,平板手机,可穿戴设备,智能手表,膝上型计算机,数码相机,便携式摄像机,取景器,微型显示器,3-d显示器,车辆显示器和车尾灯。
[0040]
本文描述的材料和结构也可以用于前文列出的其它有机电子器件中。
[0041]
如本文所用,“顶部”意指离衬底最远,而“底部”意指离衬底最近。在将第一层描述为“设置”在第二层“上”的情况下,第一层被设置为距衬底较远。除非规定第一层“与”第二层“接触”,否则第一与第二层之间可以存在其它层。举例来说,即使阴极和阳极之间存在各种有机层,仍可以将阴极描述为“设置在”阳极“上”。
[0042]
如本文所用,“溶液可处理”意指能够以溶液或悬浮液的形式在液体介质中溶解、分散或输送和/或从液体介质沉积。
[0043]
当据信配位体直接促成发射材料的光敏性质时,配位体可以称为“光敏性的”。当据信配位体并不促成发射材料的光敏性质时,配位体可以称为“辅助性的”,但辅助性的配位体可以改变光敏性的配位体的性质。
[0044]
据相信,荧光oled的内部量子效率(iqe)可以通过延迟荧光超过25%自旋统计限制。延迟荧光一般可以分成两种类型,即p型延迟荧光和e型延迟荧光。p型延迟荧光由三重态-三重态消灭(tta)产生。
[0045]
另一方面,e型延迟荧光不依赖于两个三重态的碰撞,而是依赖于三重态与单重激发态之间的转换。能够产生e型延迟荧光的化合物需要具有极小单-三重态间隙以便能态之间的转化。热能可以激活由三重态回到单重态的跃迁。这种类型的延迟荧光也称为热激活延迟荧光(tadf)。tadf的显著特征在于,延迟分量随温度升高而增加。如果逆向系间穿越(irisc)速率足够快速从而最小化由三重态的非辐射衰减,那么回填充单重激发态的分率可能达到75%。总单重态分率可以是100%,远超过电致产生的激子的自旋统计的25%。
[0046]
e型延迟荧光特征可以见于激发复合物系统或单一化合物中。不受理论束缚,相信e型延迟荧光需要发光材料具有小单-三重态能隙(δe s-t
)。有机含非金属的供体-受体发光材料可能能够实现这点。这些材料的发射通常表征为供体-受体电荷转移(ct)型发射。这
些供体-受体型化合物中homo与lumo的空间分离通常产生小δe s-t
。这些状态可以包括ct状态。通常,供体-受体发光材料通过将电子供体部分(例如氨基或咔唑衍生物)与电子受体部分(例如含n的六元芳香族环)连接而构建。
[0047]
关于取代基术语的定义
[0048]
卤素或卤化物-如本文所用,包括氟,氯,溴和碘。
[0049]
烷基
–
包含直链和支链烷基。烷基的实例包括甲基,乙基,丙基,异丙基,正丁基,仲丁基,异丁基,叔丁基,正戊基,正己基,正庚基,正辛基,正壬基,正癸基,正十一烷基,正十二烷基,正十三烷基,正十四烷基,正十五烷基,正十六烷基,正十七烷基,正十八烷基,新戊基,1-甲基戊基,2-甲基戊基,1-戊基己基,1-丁基戊基,1-庚基辛基,3-甲基戊基。另外,烷基可以任选被取代。烷基链中的碳可被其它杂原子取代。在上述中,优选甲基,乙基,丙基,异丙基,正丁基,仲丁基,异丁基,叔丁基,正戊基和新戊基。
[0050]
环烷基-如本文所用包含环状烷基。优选的环烷基是含有4至10个环碳原子的环烷基,包括环丁基,环戊基,环己基,4-甲基环己基,4,4-二甲基环己基,1-金刚烷基,2-金刚烷基,1-降冰片基,2-降冰片基等。另外,环烷基可以任选被取代。环中的碳可被其它杂原子取代。
[0051]
链烯基-如本文所用,涵盖直链和支链烯烃基团。优选的烯基是含有2至15个碳原子的烯基。链烯基的例子包括乙烯基,烯丙基,1-丁烯基,2-丁烯基,3-丁烯基,1,3-丁二烯基,1-甲基乙烯基,苯乙烯基,2,2-二苯基乙烯基,1,2-二苯基乙烯基,1-甲基烯丙基,1,1-二甲基烯丙基,2-甲基烯丙基,1-苯基烯丙基,2-苯基烯丙基,3-苯基烯丙基,3,3-二苯基烯丙基,1,2-二甲基烯丙基,1-苯基-1-丁烯基和3-苯基-1-丁烯基。另外,烯基可以是任选取代的。
[0052]
炔基-如本文所用,涵盖直链和支链炔基。优选的炔基是含有2至15个碳原子的炔基。另外,炔基可以是任选取代的。
[0053]
芳基或芳族基-如本文所用,考虑非稠合和稠合体系。优选的芳基是含有6至60个碳原子,更优选6至20个碳原子,更优选6至12个碳原子的芳基。芳基的例子包括苯基,联苯,三联苯,三亚苯,四亚苯,萘,蒽,萉,菲,芴,芘,苣,苝和薁,优选苯基,联苯,三联苯,三亚苯,芴和萘。另外,芳基可以任选被取代。非稠合芳基的例子包括苯基,联苯-2-基,联苯-3-基,联苯-4-基,对三联苯-4-基,对三联苯-3-基,对三苯基-2-基,间三联苯-4-基,间三联苯-3-基,间三联苯-2-基,邻甲苯基,间甲苯基,对甲苯基,对-(2-苯基丙基)苯基,4'-甲基联二苯基,4
”-
叔丁基-对三联苯-4-基,邻-枯基,间-枯基,对-枯基,2,3-二甲苯基,3,4-二甲苯基,2,5-二甲苯基,均三甲苯基和间四联苯基。
[0054]
杂环基或杂环-如本文所用,考虑芳族和非芳族环状基团。异芳基也指杂芳基。优选的非芳族杂环基是含有3至7个环原子的那些,其包括至少一个杂原子如氮,氧和硫。杂环基也可以是具有至少一个选自氮原子,氧原子,硫原子和硒原子的杂原子的芳族杂环基。
[0055]
杂芳基-如本文所用,考虑了可以包含1至5个杂原子的非稠合和稠合杂芳族基团。优选的杂芳基是含有3至30个碳原子,更优选3至20个碳原子,更优选3至12个碳原子的杂芳基。合适的杂芳基包括二苯并噻吩,二苯并呋喃,二苯并硒吩,呋喃,噻吩,苯并呋喃,苯并噻吩,苯并硒吩,咔唑,吲哚咔唑,吡啶吲哚,吡咯并吡啶,吡唑,咪唑,三唑,恶唑,噻唑,恶二唑,恶三唑,二恶唑,噻二唑,吡啶,哒嗪,嘧啶,吡嗪,三嗪,恶嗪,恶噻嗪,恶二嗪,吲哚,苯并
咪唑,吲唑,茚并嗪,苯并恶唑,苯并异恶唑,苯并噻唑,喹啉,异喹啉,噌啉,喹唑啉,喹喔啉,萘啶,酞嗪,蝶啶,呫吨,吖啶,吩嗪,吩噻嗪,苯并噻吩并吡啶,噻吩并二吡啶,苯并噻吩并吡啶,噻吩并二吡啶,苯并硒吩并吡啶,硒苯并二吡啶,优选二苯并噻吩,二苯并呋喃,二苯并硒吩,咔唑,吲哚并咔唑,咪唑,吡啶,三嗪,苯并咪唑,1,2-氮杂硼烷,1,3-氮杂硼烷,1,4-氮杂硼烷,硼唑和其氮杂类似物。另外,杂芳基可以任选被取代。
[0056]
烷氧基-由-o-烷基表示。烷基例子和优选例子与上述相同。具有1至20个碳原子,优选1至6个碳原子的烷氧基的例子包括甲氧基,乙氧基,丙氧基,丁氧基,戊氧基和己氧基。具有3个以上碳原子的烷氧基可以是直链状,环状或支链状。
[0057]
芳氧基-由-o-芳基或-o-杂芳基表示。芳基和杂芳基例子和优选例子与上述相同。具有6至40个碳原子的芳氧基的例子包括苯氧基和联苯氧基。
[0058]
芳烷基-如本文所用,具有芳基取代基的烷基。另外,芳烷基可以任选被取代。芳烷基的例子包括苄基,1-苯基乙基,2-苯基乙基,1-苯基异丙基,2-苯基异丙基,苯基叔丁基,α-萘基甲基,1-α-萘基-乙基,2-α-萘基乙基,1-α-萘基异丙基,2-α-萘基异丙基,β-萘基甲基,1-β-萘基-乙基,2-β-萘基-乙基,1-β-萘基异丙基,2-β-萘基异丙基,对甲基苄基,间甲基苄基,邻甲基苄基,对氯苄基,间氯苄基,邻氯苄基,对溴苄基,间溴苄基,邻溴苄基,对碘苄基,间碘苄基,邻碘苄基,对羟基苄基,间羟基苄基,邻羟基苄基,对氨基苄基,间氨基苄基,邻氨基苄基,对硝基苄基,间硝基苄基,邻硝基苄基,对氰基苄基,间氰基苄基,邻氰基苄基,1-2-羟基-2-苯基异丙基和1-氯-2-苯基异丙基。在上述中,优选苄基,对氰基苄基,间氰基苄基,邻氰基苄基,1-苯基乙基,2-苯基乙基,1-苯基异丙基和2-苯基异丙基。
[0059]
氮杂芴,氮杂螺二芴环,氮杂二苯并呋喃,氮杂-二苯并噻吩等中的术语“氮杂”是指相应芳族片段中的一个或多个c-h基团被氮原子代替。例如,氮杂三亚苯包括二苯并[f,h]喹喔啉,二苯并[f,h]喹啉和在环系中具有两个或更多个氮的其它类似物。本领域普通技术人员可以容易地想到上述的氮杂衍生物的其它氮类似物,并且所有这些类似物被确定为包括在本文所述的术语中。
[0060]
在本公开中,除另有定义,当使用由以下组成的组中的任意一个术语时:取代的烷基,取代的环烷基,取代的杂烷基,取代的芳烷基,取代的烷氧基,取代的芳氧基,取代的烯基,取代的芳基,取代的杂芳基,取代的烷硅基,取代的芳基硅烷基,取代的氨基,取代的酰基,取代的羰基,取代的羧酸基,取代的酯基,取代的亚磺酰基,取代的磺酰基,取代的膦基,是指烷基,环烷基,杂烷基,芳烷基,烷氧基,芳氧基,烯基,芳基,杂芳基,烷硅基,芳基硅烷基,氨基,酰基,羰基,羧酸基,酯基,亚磺酰基,磺酰基和膦基中的任意一个基团可以被一个或多个选自氘,未取代的具有1-20个碳原子的烷基,未取代的具有3-20个环碳原子的环烷基,未取代的具有1-20个碳原子的杂烷基,未取代的具有7-30个碳原子数的芳烷基,未取代的具有1-20个碳原子的烷氧基,未取代的具有6-30个碳原子的芳氧基,未取代的具有2-20个碳原子的烯基,未取代的具有6-30个碳原子的芳基或优选的是未取代的具有6-12个碳原子的芳基,未取代的具有3-30个碳原子的杂芳基或优选的是未取代的具有3-12个碳原子的杂芳基,未取代的具有3-20个碳原子的烷硅基,未取代的具有6-20个碳原子的芳基硅烷基,未取代的具有0-20个碳原子的氨基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基及其组合所取代。
[0061]
应当理解,当将分子片段描述为取代基或以其他方式连接到另一部分时,可根据
它是否是片段(例如苯基,亚苯基,萘基,二苯并呋喃基)或根据它是否是整个分子(如苯,萘,二苯并呋喃)来书写它的名称。如本文所用,指定取代基或连接片段的这些不同方式被认为是等同的。
[0062]
在本公开中提到的化合物中,氢原子可以被氘部分或完全替代。其他原子如碳和氮也可以被它们的其他稳定的同位素代替。由于其增强器件的效率和稳定性,化合物中其它稳定同位素的替代可能是优选的。在本公开中提到的化合物中,氘代的取代基,如氘代甲基,是指所述取代基(甲基)中至少有一个氢原子被氘取代。
[0063]
在本公开中提到的化合物中,多重取代指包含二重取代在内,直到高达最多的可用取代的范围。当本公开中提到的化合物中某个取代基表示多取代(包括二取代、三取代、四取代等)时,即表示该取代基可以在其连接结构上的多个可用的取代位置上存在,在多个可用的取代位置上均存在的该取代基可以是相同的结构,也可以是不同的结构。
[0064]
在本公开中提到的化合物中,除非明确限定,例如相邻的取代基能任选地连接形成环,否则所述化合物中相邻的取代基不能连接形成环。在本公开中提到的化合物中,相邻的取代基能任选地连接形成环,既包含相邻的取代基可以连接形成环的情形,也包含相邻的取代基不连接形成环的情形。相邻的取代基能任选地连接形成环时,所形成的环可以是单环或多环,以及脂环、杂脂环、芳环或杂芳环。在这种表述中,相邻的取代基可以是指键合在同一个原子上的取代基、与彼此直接键合的碳原子键合的取代基、或与进一步远离的碳原子键合的取代基。优选的,相邻的取代基是指键合在同一个碳原子上的取代基以及与彼此直接键合的碳原子键合的取代基。
[0065]
两个相邻的取代基能任选地连接形成环的表述也旨在被认为是指键合在同一个碳原子上的两个取代基通过化学键彼此连接形成环,这可以由下式示例:
[0066][0067]
两个相邻的取代基能任选地连接形成环的表述也旨在被认为是指与彼此直接键合的碳原子键合的两个取代基通过化学键彼此连接形成环,这可以由下式示例:
[0068][0069]
此外,两个相邻的取代基能任选地连接形成环的表述也旨在被认为是指,在与彼此直接键合的碳原子键合的两个取代基之一表示氢的情况下,第二取代基键合在氢原子键合至的位置处,从而成环。这由下式示例:
[0070]
[0071]
根据本发明的一个实施例,公开一种具有式1结构的化合物:
[0072][0073]
其中,在式1中,
[0074]
取代基r
1-r
10
中至少有一个具有式2结构:
[0075][0076]
并且取代基r
1-r
10
中剩余者每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0077]
其中,在式2中,
[0078]
l选自单键,取代或未取代的具有6-60个碳原子的亚芳基,取代或未取代的具有3-60个碳原子的亚杂芳基,或其组合;
[0079]
x
1-x3每次出现时相同或不同地选自cr
x
或n;
[0080]
y1和y5每次出现时相同或不同地选自cr
y1
或n;
[0081]
y
2-y4每次出现时相同或不同地选自cr
y2
、cr
y3
或n,且y
2-y4中至少有一个为cr
y2
;
[0082]
z每次出现时相同或不同地选自c(r
z
)2,nr
z
,o,s或se;
[0083]
r
x
、r
y3
和r
z
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨
基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0084]
r
y1
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,及其组合;
[0085]
r
y2
每次出现时相同或不同地选自取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,或其组合;
[0086]
相邻的取代基r
x
、r
y1
、r
y3
能任选地连接形成环;
[0087]
取代基r
z
能任选地连接形成环;
[0088]
*代表具有式2结构的取代基连接式1的位置。
[0089]
在该实施例中,式1中的取代基r1至r
10
中至少有一个具有式2表示的结构,并且r1至r
10
中的剩余者每次出现时相同或不同地选自上述取代基组成的组。例如,当取代基r1具有式2表示的结构,则r1至r
10
中的剩余者,即r2至r
10
每次出现时相同或不同地选自上述取代基组成的组。当取代基r1和r6具有式2表示的结构,则r1至r
10
中的剩余者,即r2至r5和r7至r
10
每次出现时相同或不同地选自上述取代基组成的组。
[0090]
在该实施例中,相邻的取代基r
x
、r
y1
、r
y3
能任选连接形成环包含以下情况:一种情况是当x
1-x3中有多个选自cr
x
时,相邻的r
x
可以连接形成环,例如x1和x2选自cr
x
时,相邻的r
x
可以连接形成环;x1和x3选自cr
x
时,相邻的r
x
可以连接形成环;x2和x3选自cr
x
时,相邻的r
x
可以连接形成环。当y1和y5选自cr
y1
,y
2-y4中有多个选自cr
y3
时,相邻的取代基r
y3
可以连接形成环和/或相邻的取代基r
y1
和r
y3
可以连接形成环,例如y2和y3均选自cr
y3
时,这两个r
y3
可以连接形成环;y3和y4均选自cr
y3
时,这两个r
y3
可以连接形成环;y1选自cr
y1
且y2选自cr
y3
,此时r
y1
和r
y3
可以连接形成环;y5选自cr
y1
且y4选自cr
y3
,此时r
y1
和r
y3
可以连接形成环。另一种情况是相邻的取代基r
x
、r
y1
、r
y3
不连接形成环。
[0091]
在该实施例中,“取代基r
z
能任选地连接形成环”可以包含以下任一种或多种情况:一种情况是对于取代基r
z
之间存在连接形成环的情况,例如当同时存在两个或两个以上r
z
时,这些r
z
之间存在连接形成环的情况,例如r
z
之间连接成环后形成螺环或桥环结构。另一种情况是对于取代基r
z
之间也可以都不连接形成环。
[0092]
本发明所公开的化合物在芳胺的其中一芳基的n-间位或n-对位,即本发明式2中y
2-y4中至少一个带有(杂)芳基取代,将其应用于有机电致发光器件中可以提升器件性能;在此基础上可以进一步在该芳基的n-邻位,即本发明式2中y1和/或y5引入(环)烷基取代,可以进一步提升器件性能。本发明中y1和/或y5为无取代或(环)烷基取代时,在器件性能提升的同时,材料的蒸镀温度也比较温和,相对而言,如y1和/或y5是(杂)芳基取代,其蒸镀温度变高,不利产业对材料要求的热稳定性。
[0093]
根据本发明的一个实施例,其中取代基r1至r
10
中至少有两个具有式2的结构。
[0094]
根据本发明的一个实施例,其中取代基r1至r
10
中有两个具有式2的结构。
[0095]
根据本发明的一个实施例,其中取代基r1和r6具有式2的结构。
[0096]
根据本发明的一个实施例,其中取代基r2,r
4-r5,r7和r
9-r
10
为氢原子,取代基r3和r8每次出现时相同或不同地选自氢,氘,取代或未取代的具有1-20个碳原子的烷基,或者取代或未取代的具有3-20个环碳原子的环烷基。
[0097]
根据本发明的一个实施例,其中l在每次出现时相同或不同地选自单键、取代或未取代的具有6-30个碳原子的亚芳基,取代或未取代的具有3-30个碳原子的亚杂芳基,或其
组合。
[0098]
根据本发明的一个实施例,其中l在每次出现时相同或不同地选自单键、取代或未取代的具有6-12个碳原子的亚芳基,取代或未取代的具有3-12个碳原子的亚杂芳基,或其组合。
[0099]
根据本发明的一个实施例,其中l为单键。
[0100]
根据本发明的一个实施例,其中x1至x3每次出现时相同或不同地选自cr
x
,y1和y5每次出现时相同或不同地选自cr
y1
,y
2-y4每次出现时相同或不同地选自cr
y2
和cr
y3
,且y
2-y4中至少有一个为cr
y2
;
[0101]
r
x
和r
y3
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0102]
r
y1
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,及其组合;
[0103]
r
y2
每次出现时相同或不同地选自取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,或其组合;
[0104]
相邻的取代基r
x
、r
y1
、r
y3
能任选地连接形成环。
[0105]
根据本发明的一个实施例,其中r
x
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,及其组合。
[0106]
根据本发明的一个实施例,其中r
x
每次出现相同或不同地选自氢,氘,氟,甲基,乙基,异丙基,环戊基,环己基,苯基,甲基苯基,异丙基苯基,或其组合。
[0107]
根据本发明的一个实施例,其中y
2-y4每次出现时相同或不同地选自cr
y2
和cr
y3
,且y
2-y4中至少有一个为cr
y2
,其余为cr
y3
。
[0108]
在该实施例中,“y
2-y4中至少有一个为cr
y2
,其余为cr
y3”包含以下情况:当y
2-y4中有一个为cr
y2
时,其余的两个为cr
y3
;当y
2-y4中有两个为cr
y2
时,剩下的一个为cr
y3
;或者y
2-y4均为cr
y2
。例如当y2为cr
y2
时,则y3和y4为cr
y3
;当y3为cr
y2
时,则y2和y4为cr
y3
;当y4为cr
y2
时,则y1和y3为cr
y3
;当y2和y4为cr
y2
时,则y3为cr
y3
;当y3和y4为cr
y2
时,则y2为cr
y3
;y2、y3、y4均为cr
y2
。
[0109]
根据本发明的一个实施例,其中y
2-y4每次出现时相同或不同地选自cr
y2
和cr
y3
,且y
2-y4中有一个为cr
y2
,其余为cr
y3
。
[0110]
根据本发明的一个实施例,其中r
y3
每次出现相同或不同地选自氢,氘,卤素,取代或未取代的具有1-6个碳原子的烷基,取代或未取代的具有3-6个环碳原子的环烷基,取代或未取代的具有1-6个碳原子的杂烷基,取代或未取代的具有6-12个碳原子的芳基,取代或
未取代的具有3-12个碳原子的杂芳基,取代或未取代的具有3-6个碳原子的烷硅基,取代或未取代的具有6-12个碳原子的芳基硅烷基,及其组合。
[0111]
根据本发明的一个实施例,其中r
y3
每次出现时相同或不同地选自由以下组成的组:氢、氘、氟、甲基、乙基、正丙基、异丙基、环丙基、正丁基、异丁基、叔丁基、环戊基、环己基、苯基、三甲基硅基、及其组合。
[0112]
根据本发明的一个实施例,其中r
y2
每次出现相同或不同地选自取代或未取代的具有6-24个碳原子的芳基,取代或未取代的具有3-24个碳原子的杂芳基,或其组合。
[0113]
根据本发明的一个实施例,其中r
y2
每次出现相同或不同地选自取代或未取代的具有6-18个碳原子的芳基,取代或未取代的具有3-18个碳原子的杂芳基,或其组合。
[0114]
根据本发明的一个实施例,其中r
y2
每次出现相同或不同地选自取代或未取代的具有6-12个碳原子的芳基,取代或未取代的具有3-12个碳原子的杂芳基,或其组合。
[0115]
根据本发明的一个实施例,其中r
y2
每次出现相同或不同地选自苯基,2-甲基苯基,2-乙基苯基,2-异丙基苯基,2-叔丁基苯基,联苯,三联苯,四联苯,三亚苯基,四亚苯基,2-萘基,菲,蒽,茚,芴,吲哚,咔唑,苯并呋喃,二苯并呋喃,苯并噻咯,二苯并噻咯,苯并噻吩,二苯并噻吩,二苯并硒吩,氘代2-甲基苯基,氘代2-乙基苯基,氘代2-异丙基苯基,氘代2-叔丁基苯基,或其组合。
[0116]
根据本发明的一个实施例,其中y1和y5每次出现时相同或不同地选自cr
y1
,且所述r
y1
每次出现相同或不同地选自取代或未取代的具有1-12个碳原子的烷基,取代或未取代的具有3-12个环碳原子的环烷基,或其组合。
[0117]
根据本发明的一个实施例,其中y1和y5每次出现时相同或不同地选自cr
y1
,且所述r
y1
每次出现相同或不同地选自取代或未取代的具有1-6个碳原子的烷基,取代或未取代的具有3-6个环碳原子的环烷基,或其组合。
[0118]
根据本发明的一个实施例,其中y1和y5每次出现时相同或不同地选自cr
y1
,且所述r
y1
每次出现相同或不同地选自氢、氘、氟、甲基、乙基、正丙基、异丙基、环丙基、正丁基、异丁基、叔丁基、环戊基、新戊基、环己基,氘代甲基、氘代乙基、氘代正丙基、氘代异丙基、氘代环丙基、氘代正丁基、氘代异丁基、氘代叔丁基、氘代环戊基、氘代新戊基、氘代环己基,或其组合。
[0119]
根据本发明的一个实施例,其中z为c(r
z
)2,且所述r
z
每次出现时相同或不同地选自氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,或其组合。
[0120]
根据本发明的一个实施例,其中r
z
每次出现时相同或不同地选自氢、卤素、氘、甲基、乙基、正丙基、异丙基、环丙基、正丁基、异丁基、叔丁基、环戊基、环己基,或其组合。
[0121]
根据本发明的一个实施例,其中r
x
、r
y1
和r
y3
中至少有一个为氟。
[0122]
根据本发明的一个实施例,其中所述化合物选自由化合物bd1至化合物bd1267组成的组,化合物bd1至化合物bd1267的具体结构见权利要求13所示。
[0123]
根据本发明的一个实施例,还公开一种电致发光器件,包括:
[0124]
阳极,
[0125]
阴极,
[0126]
以及设置在所述阳极和阴极之间的有机层,所述有机层包含具有式1的化合物:
[0127][0128]
其中,在式1中,
[0129]
取代基r
1-r
10
中至少有一个具有式2结构:
[0130][0131]
并且取代基r
l-r
l0
中剩余者每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0132]
其中,在式2中,
[0133]
l选自单键,取代或未取代的具有6-60个碳原子的亚芳基,取代或未取代的具有3-60个碳原子的亚杂芳基,或其组合;
[0134]
x
1-x3为cr
x
或n;
[0135]
y1和y5每次出现时相同或不同地选自cr
y1
或n;
[0136]
y
2-y4每次出现时相同或不同地选自cr
y2
、cr
y3
或n,且y
2-y4中至少有一个为cr
y2
;
[0137]
z每次出现时相同或不同地选自c(r
z
)2,nr
z
,o,s或se;
[0138]
r
x
、r
y3
和r
z
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨
基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0139]
r
y1
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,及其组合;
[0140]
r
y2
每次出现时相同或不同地选自取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,或其组合;
[0141]
相邻的取代基r
x
、r
y1
、r
y3
能任选地连接形成环;
[0142]
取代基r
z
能任选地连接形成环;
[0143]
*代表具有式2结构的取代基连接式1的位置。
[0144]
根据本发明的一个实施例,其中所述有机电致发光器件中有机层包含发光层,其中所述发光层包含具有式1的化合物。
[0145]
根据本发明的一个实施例,其中所述发光层进一步包含具有式3的化合物:
[0146][0147]
其中,在式3中,
[0148]
r
g1
至r
g8
每次出现时相同或不同地选自由以下组成的组:氢,氘,卤素,取代或未取代的具有1-20个碳原子的烷基,取代或未取代的具有3-20个环碳原子的环烷基,取代或未取代的具有1-20个碳原子的杂烷基,取代或未取代的具有7-30个碳原子的芳烷基,取代或未取代的具有1-20个碳原子的烷氧基,取代或未取代的具有6-30个碳原子的芳氧基,取代或未取代的具有2-20个碳原子的烯基,取代或未取代的具有6-30个碳原子的芳基,取代或未取代的具有3-30个碳原子的杂芳基,取代或未取代的具有3-20个碳原子的烷硅基,取代或未取代的具有6-20个碳原子的芳基硅烷基,取代或未取代的具有0-20个碳原子的氨基,酰基,羰基,羧酸基,酯基,氰基,异氰基,巯基,亚磺酰基,磺酰基,膦基,及其组合;
[0149]
r
g9
和r
g10
每次出现时相同或不同地选自取代或未取代的具有6-30个碳原子的芳基,或者取代或未取代的具有3-30个碳原子的杂芳基。
[0150]
根据本发明的一个实施例,还公开了一种化合物配方,其包含具有式1结构的化合物,所述化合物的具体结构为前述任意实施例所示。
[0151]
与其他材料组合
[0152]
本发明描述的用于有机发光器件中的特定层的材料可以与器件中存在的各种其它材料组合使用。这些材料的组合在美国专利申请us2016/0359122a1中第0132-0161段有详细描述,其全部内容通过引用并入本文。其中描述或提及的材料是可以与本文所公开的化合物组合使用的材料的非限制性实例,并且本领域技术人员可以容易地查阅文献以鉴别可以组合使用的其它材料。
[0153]
本文描述为可用于有机发光器件中的具体层的材料可以与存在于所述器件中的多种其它材料组合使用。举例来说,本文所公开的发光掺杂剂可以与多种主体、输送层、阻挡层、注入层、电极和其它可能存在的层结合使用。这些材料的组合在美国专利申请us2015/0349273a1中的第0080-0101段有详细描述,其全部内容通过引用并入本文。其中描述或提及的材料是可以与本文所公开的化合物组合使用的材料的非限制性实例,并且本领
域技术人员可以容易地查阅文献以鉴别可以组合使用的其它材料。
[0154]
在材料合成的实施例中,除非另外说明,否则所有反应都在氮气保护下进行。所有反应溶剂都无水并且按从商业来源原样使用。合成产物使用本领域常规的一种或多种设备(包括但不限于bruker的核磁共振仪,shimadzu的液相色谱仪、液相色谱-质谱联用仪、气相色谱-质谱联用仪、差示扫描量热仪,上海棱光技术的荧光分光光度计,武汉科思特的电化学工作站,安徽贝意克的升华仪等),以本领域技术人员熟知的方法进行了结构确认和特性测试。在器件的实施例中,器件的特性也是使用本领域常规的设备(包括但不限于angstrom engineering生产的蒸镀机,苏州弗士达生产的光学测试系统、寿命测试系统,北京量拓生产的椭偏仪等),以本领域技术人员熟知的方法进行测试。由于本领域技术人员均知晓上述设备使用、测试方法等相关内容,能够确定地、不受影响地获得样品的固有数据,因此上述相关内容在本篇专利中不再展开赘述。
[0155]
材料合成实施例:
[0156]
本发明化合物的制备方法不做限制,典型但非限制地以下述化合物为示例,其合成路线和制备方法如下:
[0157]
合成实施例1:化合物bd32的合成
[0158]
第一步:
[0159][0160]
将lda(100ml,200mmol)置于250ml三口瓶中,置于干冰-乙醇下搅拌半小时,加入异丁酸甲酯(23ml,200mmol),继续搅拌半小时。将1-溴-2-(溴甲基)苯(25g,100mmol)加入其中,经硅藻土过滤。浓缩后得到粗产品中间体1,直接进行下一步反应。
[0161]
第二步:
[0162][0163]
将中间体1(27g,100mmol),氢氧化钾(56g,1mol)混合,加入水100ml,甲醇10ml,加热至100℃反应,直至tlc检测反应至结束。冷却,待反应恢复至室温,加入浓盐酸调节体系ph至酸性,使用乙酸乙酯萃取有机相,合并有机相,浓缩。
[0164]
将上述产品(27g,100mmol),溶于200ml二氯甲烷中,n2鼓气,加一滴dmf,逐渐滴加草酰氯(12.8ml,120mmol),待体系不再产生气泡后,将反应移至冰浴下,搅拌半小时,分批加入三氯化铝(14.3g,108mmol),tlc监测直至反应结束。通过柱层析纯化,使用pe洗脱,得白色固体中间体2(22g,91.6mmol,产率85%)。
[0165]
第三步:
[0166][0167]
将中间体2(22g,99mmol)使用300ml甲醇溶解,置于冰水浴下搅拌半小时,分批加入nabh4,直至反应完全后,硅藻土过滤,滤液浓缩。
[0168]
将上述产物溶解在二氯甲烷中,加入et3sih(22.5g,198mmol),置于冰水浴下搅拌半小时,逐渐滴入tfa(34g,297mmol),浓缩,通过柱层析提纯,得到无色油状物中间体3(7.7g,34.4mmol,产率35%)。
[0169]
第四步:
[0170][0171]
在室温、氮气保护下,将pd2(dba3)(1g,1.1mmol),中间体3(5.1g,22.7mmol),4-甲基-[1,1
′-
联苯]-3-胺(5g,27.2mmol),binap(1.4g,2.2mmol)和tbuona(4.7g,49.6mmol)加入二甲苯(100ml),体系加热到90℃反应过夜。反应结束后经柱层析纯化,得到白色固体中间体4(5.7g,17.4mmol,产率76%)。
[0172]
第五步:
[0173][0174]
在室温、氮气保护下,将1,6-二溴芘(2.6g,7.2mmol),中间体4(5.7g,17.4mmol),pd(oac)2(161mg,0.72mmol),tbu3ph
bf
4-(406mg,1.4mmol)和tbuona(2.7g,28.2mmol)加入二甲苯(20ml),体系加热到100℃直至反应完全。并经柱层析纯化,得到黄绿色固体化合物bd32(1.2g,1.41mmol,产率20%)。产物经鉴定为目标产物,分子量为852.4。
[0175]
合成实施例2:化合物bd1141的合成
[0176]
第一步
[0177][0178]
将2-溴-4-碘-1-甲基苯(100g,337mmol),苯硼酸(49g,404mmol),pd(pph3)4(7.8g,6.8mmol),k2co3(116g,843mmol)置于1000ml三口瓶中,加入甲苯340ml,thf 110ml,h2o 110ml,置换n2。加热至78℃反应。反应至原料反应完全,进行柱层析纯化,得无色油状液体
中间体5(80g,325mmol,产率97%)。
[0179]
第二步
[0180][0181]
将中间体5(81g,329mmol),nbs(61g,345mmol)置于2l两口瓶中,加入1.3l乙腈,置换n2,加热至80℃,搅拌反应。分批加入过氧化苯甲酰(8g,33mmol)。反应至原料反应完全,进行柱层析纯化得白色固体中间体6(82g,253mmol,产率77%)。
[0182]
第三步
[0183][0184]
将lda(130ml,260 mmol)置于500ml三口瓶中,置于干冰-乙醇下搅拌半小时,加入异丁酸甲酯(30ml,260mmol),继续搅拌半小时。加入中间体6(48g,148mmol)。反应至原料反应完全,进行柱层析纯化,得产品为浅黄色油状物中间体7(50g,145mmol,产率98%)。
[0185]
第四步
[0186][0187]
将中间体7(78g,227mmol),koh(88g,1.57mol)混合,加入h2o(230ml),甲醇(23ml),加热至100℃反应,直至tlc检测反应至结束。冷却,待反应恢复至室温,加入浓hcl调节体系ph至酸性,将析出得白色固体过滤得中间体(71g,227mmol)。
[0188]
将上述中间体(20g,60mmol),溶于200ml二氯甲烷中,向溶液中通n2,加一滴dmf,逐渐滴加草酰氯(30ml,60mmol),待体系不再产生气泡后,将反应移至冰水浴下搅拌半小时,分批加入三氯化铝(8g,60mmol),tlc监测直至反应结束。硅藻土过滤,浓缩。柱层析分离,得白色固体中间体8(6g,18.8mmol,产率31%)。
[0189]
第五步
[0190][0191]
将中间体8(18g,57mmol)用甲醇(180ml)溶解,置于冰水浴下搅拌半小时,分批加入nabh4,直至反应完全后,硅藻土过滤,滤液浓缩。
[0192]
将上述产物溶解在二氯甲烷中,加入et3sih(12.7g,111mmol),置于冰水浴下搅拌半小时,逐渐滴入tfa(18g,155mmol),反应至原料反应完全,进行柱层析纯化,得无色油状
物中间体9(12g,39.9mmol,产率70%)。
[0193]
第六步
[0194][0195]
在室温、氮气保护下,将pd2(dba)3(910mg,0.99mmol),binap(1.18g,1.99mmol),中间体9(6g,19.9mmol),[1,1
′-
联苯]-3-胺(5.5g,30mmol)和tbuona(3.8g,39.8mmol)加入甲苯(100ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化,得到无色油状物中间体10(6.7g,16.4mmol,产率83%)。
[0196]
第七步
[0197][0198]
在室温、氮气保护下,将1,6-二溴芘(2.2g,6.1mmol),中间体10(5.5g,14mmol),pd(oac)2(68mg,0.3mmol),tbu3ph
bf
4-(174mg,0.6mmol)和tbuona(1.3g,14mmol),加入二甲苯(30ml),体系加热到95℃。反应结束后,经柱层析纯化,得到黄绿色固体bd1141(5g,5.1mmol,产率84%)。产物经鉴定为目标产物,分子量为976.5。
[0199]
合成实施例3:化合物bd151的合成
[0200]
第一步
[0201][0202]
在-78℃、氮气保护下,将中间体11(50g,139mmol)加入到1l单口瓶中,加入thf(400ml),滴加iprmgcl(84ml,167mmol),半小时后滴加新戊醛(36g,418mmol),滴加完升至室温反应。反应体系用氯化铵淬灭,dcm萃取,除去溶剂得到中间体。将中间体溶于dcm(1400ml)中,体系降至0℃加入et3sih(24g,213mmol),半小时后滴加tfa(36g,320mmol),滴加完升至室温反应。反应结束后,经柱层析纯化,得到粗无色油状中间体12(36g,118mmol,产率85%)。
[0203]
第二步
[0204][0205]
在室温、氮气保护下,将pd(oac)2(0.5g,2.2mmol),中间体3(10g,44.2mmol),二苯甲酮亚胺(8.8g,48.7mmol),dppf(2.4g,4.4mmol)和tbuona(8.8g,88.4mmol)加入到250ml单口瓶中,加入邻二甲苯(100ml),体系加热到90℃反应过夜。反应溶液用碱性氧化铝和mgso4过滤,并用tol洗涤,除去溶剂得到粗产品用pe结晶得到中间体。将中间体溶于thf(30ml)中,加入hcl(10ml),反应过夜。反应结束后,经柱层析纯化,得到白色固体中间体13(6.2g,38.5mmol,产率87%)。
[0206]
第三步
[0207][0208]
在室温、氮气保护下,将pd2(dba)3(0.5g,0.55mmol),中间体12(4g,13.2mmol),中间体13(2.6g,16.1mmol),binap(685mg,1.1mmol)和tbuona(2.8g,29.1mmol)加入xylene(100ml),体系加热到90℃反应过夜。反应结束后,经柱层析纯化,得到白色固体中间体14(4.5g,11.7mmol,产率88%)。
[0209]
第四步
[0210][0211]
在室温、氮气保护下,将中间体14(4g,10.4mmol),1,6-二溴芘(1.56g,4.35mmol),pd(oac)2(63mg,0.28mmol),tbu3ph
bf
4-(162mg,0.56mmol)和tbuona(3.2g,33mmol)加入二甲苯(30ml),体系加热到100℃直至反应完全。反应结束后,经柱层析纯化,得到黄绿色固体化合物bd151(1.1g,1.14mmol,产率26%)。产物经鉴定为目标产物,分子量为964.6。
[0212]
合成实施例4:化合物bd250的合成
[0213]
第一步
[0214][0215]
在室温、氮气保护下,将醋酸钯(0.15g,0.67mmol),binap(0.83g,1.32mmol)加入
甲苯(70.0ml)。向此溶液中通入n220分钟,先后加入中间体3(5.0g,22.12mmol),5-氟-[1,1
′-
联苯]-3-胺(4.3g,23.23mmol),叔丁醇钠(6.4g,66.37mmol)。继续通入n210分钟,体系加热到110℃反应4h。反应结束后,经柱层析纯化,得到淡黄色油状中间体15(3.8g,11.41mmol,产率52%)。
[0216]
第二步
[0217][0218]
在室温、氮气保护下,将醋酸钯(35mg,0.16mmol),tbu3ph
bf
4-(91mg,0.32mmol)加入二甲苯(40.0ml)。向此溶液中通入n220分钟,先后加入1,6-二溴芘(2g,5.56mmol),中间体15(3.8g,11.41mmol),叔丁醇钠(2.1g,22.2mmol)。继续通入n210分钟,体系加热到95℃至反应完全。反应结束后,经柱层析纯化,得到黄色固体化合物bd250(4g,4.64mmol,产率84%)。产物经鉴定为目标产物,分子量为860.4。
[0219]
合成实施例5:化合物bd441的合成
[0220]
第一步
[0221][0222]
在0℃、氮气保护下,将2-甲基-5-氟硝基苯(200g,1.29mol)溶于硫酸中,分批加入nbs(252g,1.42mol),升至室温反应。反应结束后,经柱层析纯化,得到黄色液体中间体16(220g,936mmol,产率72%)。
[0223]
第二步
[0224][0225]
在室温下,将中间体16(50g,213mmol),fe(35g,638mmol)和nh4c1(1.1g,21.3mmol)加入到1l单口瓶中,加入etoh(400ml),水(100ml),体系加热到90℃反应。反应结束后经柱层析分离,得到淡黄色液体中间体17(41g,200mmol,产率94%)。
[0226]
第三步
[0227]
[0228]
在室温、氮气保护下,将pd(pph3)4(3.4g,3mmol),中间体17(31g,151mmol),2-甲基苯硼酸(21g,159mmol)和k2co3(52g,378mmol)加入到1l单口瓶中,加入甲苯(400ml),etoh(200ml),水(100ml),体系加热到90℃反应过夜。体系加热到90℃反应过夜。反应结束后经柱层析分离,得到淡黄色固体中间体18(27g,125mmol,产率83%)。
[0229]
第四步
[0230][0231]
在室温、氮气保护下,将pd2dba3(0.5g,0.55mmol),中间体18(5.7g,26.5mmol),中间体3(5g,22mmol),binap(685mg,1.1mmol)和tbuona(8.3g,86.9mmol)加入到250ml单口瓶中,加入xylene(100ml),体系加热到90℃反应过夜。反应结束后经柱层析分离,得到白色固体中间体19(7.3g,20.2mmol,产率91%)。
[0232]
第五步
[0233][0234]
在室温、氮气保护下,将中间体19(7.3g,20mmol),1,6-二溴芘(3g,8.4mmol),pd(oac)2(63mg,0.28mmol),tbu3ph
bf
4-(162mg,0.56mmol)和tbuona(3.2g,33mmol)加入二甲苯(30ml),体系加热到100℃直至反应完全。反应结束后经柱层析分离,得到黄绿色固体bd441(1.2g,1.30mmol,产率15.4%)。产物经鉴定为目标产物,分子量为916.5。
[0235]
合成实施例6:化合物bd1148的合成
[0236]
第一步
[0237][0238]
在室温、氮气保护下,将pd2(dba)3(9l0mg,0.99mmol),binap(1.18g,1.99mmol),中间体9(6g,19.9mmol),4-甲基-[1,1
′-
联苯基]-3-胺(5.5g,30mmol)和t-buona(3.8g,39.8mmol)加入甲苯(100ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化得白色固体中间体20(6.7g,16.4mmol,产率82.7%)。
[0239]
第二步
[0240][0241]
在室温、氮气保护下,将1,6-二溴芘(2.38g,6.6mmol),中间体6(6.2g,15.2mmol),pd(oac)2(74mg,0.33mmol),t-bu3p
·
h
bf
4-(191mg,0.66mmol)和t-buona(1.46g,15.2mmol),加入二甲苯(33ml),体系加热到95℃。反应结束后,经柱层析纯化得到产物化合物bd1148(6g,5.97mmol,产率90%)。产物经鉴定为目标产物,分子量为1004.5。
[0242]
合成实施例7:化合物bd257的合成
[0243]
第一步
[0244][0245]
在室温、氮气保护下,将pd(pph3)4(3.4g,3mmol),中间体17(55g,268mmol),苯硼酸(50g,282mmol)和k2co3(92g,670mmol)加入到1l单口瓶中,加入tol(400ml),etoh(200ml),水(100ml),体系加热到90℃反应过夜。反应结束后经柱层析分离得到淡黄色固体中间体21(42g,208mmol,产率77%)。
[0246]
第二步
[0247][0248]
在室温、氮气保护下,将pd2(dba)3(0.5g,0.55mmol),中间体21(5.4g,26.2mmol),中间体3(5g,22mmol),binap(685mg,1.1mmol)和tbuona(8.3g,86.9mmol)加入到250ml单口瓶中,加入二甲苯(100ml),体系加热到90℃反应过夜。反应结束后经柱层析分离,得到白色固体中间体22(5.8g,16.7mmol,产率76%)。
[0249]
第三步
[0250][0251]
在室温、氮气保护下,将中间体22(5.8g,16.7mmol),1,6-二溴芘(2.5g,7.0mmol),pd(oac)2(63mg,0.28mmol),tbu3ph
bf
4-(162mg,0.56mmol)和tbuona(3.2g,33mmol)加入到100ml单口瓶中,加入二甲苯(30ml),体系加热到100℃直至反应完全。反应结束后经柱层析分离,得到黄绿色固体化合物bd257(1.4g,1.57mmol,产率22%)。产物经鉴定为目标产物,分子量为888.4。
[0252]
合成实施例8:化合物bd261的合成
[0253]
第一步
[0254][0255]
在0℃下将1-溴-2-氟-4-甲基苯(94.5g,0.5mol)溶解于1l的浓硫酸中,缓慢滴加浓硝酸(37.8g,0.6mol)。反应升温至室温后搅拌过夜。反应结束后,加入大量的冰块后,用二氯甲烷萃取三次后合并有机相,通过柱层析分离得到中间体23(93.6g,0.4mol,产率80%)。
[0256]
第二步
[0257][0258]
在氮气保护下,于干燥的1l三口烧瓶加入中间体23(26.8g,114.6mmol),苯硼酸(21g,172mmol),四(三苯基膦)钯(6.7g,5.74mmol),k2co3(47.5g,344mmol),甲苯(240ml)和水(60ml),置换氮气三次,升温至100℃,过夜后停止反应,经柱层析分离,得到中间体24(23.1g,100mmol,产率89%)。
[0259]
第三步
[0260][0261]
将中间体24(23.1g,100mmol)溶解于1l的乙醇中,加入饱和氯化铵水溶液100ml。加入还原铁粉(16.8g,300mmol)后,反应升温至80℃搅拌3小时。冷却至室温后,将反应溶液
通过硅藻土进行过滤,旋蒸掉大部分乙醇后,加入水,用二氯甲烷萃取三次后,合并有机相。通过柱层析纯化得到中间体25(19g,95mmol,产率95%)。
[0262]
第四步
[0263][0264]
在室温、氮气保护下,将pd2(dba)3(910mg,0.99mmol),binap(1.18g,1.99mmol),中间体25(6.03g,30mmol),中间体3(4.48g,19.9mmol),和tbuona(3.8g,39.8mmol)加入甲苯(200ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化,得无色油状物中间体26(5.52g,16mmol,产率53%)。
[0265]
第五步
[0266][0267]
在室温、氮气保护下,将1,6-二溴芘(2.2g,6.1mmol),中间体26(5.52g,16mmol),pd(oac)2(68mg,0.3mmol),tbu3ph
bf
4-(174mg,0.6mmol)和t-buona(1.3g,14mmol),加入二甲苯(30ml),体系加热到95℃。反应结束后,经柱层析纯化,得到黄绿色固体bd261(2g,2.25mmol,产率37%)。产物经鉴定为目标产物,分子量为888.4。
[0268]
合成实施例9:化合物bd177的合成
[0269]
第一步
[0270][0271]
室温下,将2-溴-4-氟-1-甲基苯(120g,634.9mmol),过氧化苯甲酰(8g33mmol)加入到乙腈(1.5l)中,分批加入nbs(124g,698.4mmol),加热至80℃搅拌。反应完全后经柱层析纯化,得到白色固体中间体27(136g,507.46mmol,产率80%)。
[0272]
第二步
[0273]
[0274]
将lda(2m,380mmol)加入到四氢呋喃(300ml)中,置于干冰-乙醇下搅拌半小时,滴加异丁酸甲酯(87ml,761.19mmol),继续搅拌半小时后滴加中间体27(136.0g,507.46mmol in thf 200ml)。反应完全后加水淬灭,乙酸乙酯萃取,有机相浓缩后溶于甲醇(800ml)中,加入koh(78g,1402mmol in h2o 400ml)的水溶液,升温到40℃反应,反应完全后经柱层析纯化,得到浅黄色油状中间体28(116g,415.77mmol,产率82%)。
[0275]
第三步
[0276][0277]
0℃氮气保护下,将中间体28(116g,415.77mmol),溶于500ml二氯甲烷中,加n,n-二甲基甲酰胺(0.5ml),逐渐滴加氯化亚砜(32ml,436.56mmol),0℃下反应2h后浓缩,将浓缩后体系加入到二氯甲烷500ml中,0℃下加入三氯化铝(55g,415.77mmol),然后回到室温反应,反应完全后加水淬灭,分液。有机相浓缩,经柱层析纯化得透明油中间体29(40.0g,155.64mmol,产率37%)。
[0278]
第四步
[0279][0280]
0℃氮气保护下,将中间体29(55g,214.0lmmol)使用500ml甲醇溶解,分批加入硼氢化钠(9.7g,256.8mmol),直至反应完全后,硅藻土过滤,滤液浓缩。
[0281]
将上述产物溶解在二氯甲烷中,加入三乙基硅烷(62.0g,470.0mmol),置于冰水浴下搅拌半小时,逐渐滴入三氟乙酸(60ml,810.8mmol),回到室温反应72h浓缩,经柱层析纯化,得到淡黄色油状物中间体30(7.0g,28.92mmol,产率14%)。
[0282]
第五步
[0283][0284]
在室温、氮气保护下,将醋酸钯(148.0mg,0.67mmol),binap(826.0mg,1.32mmol),4-甲基-[1,1
′-
联苯]-3-胺(4.3g,23.23mmol),中间体30(5.0g,22.12mmol)和叔丁醇钠(6.4g,66.37mmol),加入到250ml单口瓶中,加入甲苯(100ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化,得到淡黄色油中间体31(3.8g,11.41mmol,产率52%)。
[0285]
第六步
[0286][0287]
在室温、氮气保护下,将醋酸钯(35mg,0.16mmol),tbu3ph
bf
4-(91mg,0.32mmol),加入二甲苯(40.0ml)。向此溶液中通入n220分钟,先后加入1,6-二溴芘(2.0g,5.56mmol),中间体31(3.8g,11.41mmol),叔丁醇钠(2.1g,22.2mmol)。继续通入n210分钟,体系加热到95℃。反应结束后,经柱层析纯化,得到黄绿色固体化合物bd177(2.0g,2.25mmol,产率40%)。产物经鉴定为目标产物,分子量为888.4。
[0288]
合成实施例10:化合物bd393的合成
[0289]
第一步
[0290][0291]
在室温、氮气保护下,将pd2(dba)3(910mg,0.99mmol),binap(1.18g,1.99mmol),中间体3(5g,22.7mmol),2
′-
4-甲基-[1,1
′-
联苯]-3-胺(5.4g,27.2mmol)和tbuona(4.3g,45mmol)加入甲苯(100ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化,得无色油状物中间体32(5.4g,15.8mmol,产率71%)。
[0292]
第二步
[0293][0294]
在室温、氮气保护下,将1,6-二溴芘(2g,6.28mmol),中间体32(4.9g,14.45mmol),pd(oac)2(70mg,0.31mmol),tbu3ph
bf
4-(180mg,0.62mmol)和tbuona(1.38g,14.45mmol),加入二甲苯(30ml),体系加热到95℃。反应结束后,经柱层析纯化,得到黄绿色固体bd393(4g,4.54mmol,产率72%)。产物经鉴定为目标产物,分子量为880.5。
[0295]
合成实施例11:化合物bd103的合成
[0296]
第一步
[0297][0298]
在氮气保护下,于干燥的1l单口烧瓶加入1-异丙基-2-硝基苯(25g,151.3mmol),tfa(500ml),浓硫酸(50ml),溶解后降温至0℃,分批加入nbs(27g,151.3mmol),恢复室温,过夜反应完全。经柱层析分离,得到中间体33(28g,114.6mmol,产率75.7%)。
[0299]
第二步
[0300][0301]
在氮气保护下,于干燥的1l三口烧瓶加入中间体33(28g,114.6mmol),苯硼酸(21g,172mmol),四三苯基膦钯(6.7g,5.74mmol),k2co3(47.5g,344mmol),二氧六环(240ml)和水(60ml),置换氮气三次,升温至100℃,过夜后停止反应,经柱层析分离,得到中间体34(25g,102.8mmol,产率89.6%)。
[0302]
第三步
[0303][0304]
在氮气保护下,于干燥的1l三口烧瓶加入中间体34(25g,100mmol),水合肼(6g),fecl3(2.5g),活性炭(2.5g),甲苯(275ml)和乙醇(275ml)。升温至90℃回流,每一小时补加水合肼(6ml),并tlc监测,一共加入水合肼42ml,24h后反应完全。降温,过滤硅藻土,dcm冲洗,萃取浓缩。柱层析分离得到目标产物中间体35(18g,84.5mmol,产率84.5%)。
[0305]
第四步
[0306][0307]
在室温、氮气保护下,将pd2(dba)3(910mg,0.99mmol),binap(1.18g,1.99mmol),中间体35(6.33g,30mmol),中间体3(4.48g,19.9mmol),和tbuona(3.8g,39.8mmol)加入甲苯(200ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化,得无色油状物中间体36(5.8g,16.4mmol,产率83%)。
[0308]
第五步
[0309][0310]
在室温、氮气保护下,将1,6-二溴芘(2.2g,6.1mmol),中间体36(5.8g,16.4mmol),pd(oac)2(68mg,0.3mmol),tbu3ph
bf
4-(174mg,0.6mmol)和tbuona(1.3g,14mmol),加入二甲苯(30ml),体系加热到95℃。反应结束后,经柱层析纯化,得到黄绿色固体bd103(4.6g,5.1mmol,产率84%)。产物经鉴定为目标产物,分子量为908.5。
[0311]
合成实施例12:化合物bd25的合成
[0312]
第一步
[0313][0314]
将4-嗅-1-茚酮(100g,57mmol)用甲醇(180ml)溶解,置于冰水浴下搅拌半小时,分批加入nabh4(22.8g,600mol),直至反应完全后,硅藻土过滤,滤液浓缩。
[0315]
将上述产物溶解在二氯甲烷中,加入et3sih(67.4g,592mmol),置于冰水浴下搅拌半小时,逐渐滴入tfa(103g,888mmol),反应至原料反应完全,进行柱层析纯化,得无色油状物中间体37(44g,225mmol,产率47%)。
[0316]
第二步
[0317][0318]
在室温、氮气保护下,将pd2(dba)3(910mg,0.99mmol),binap(1.18g,1.99mmol),中间体37(4g,20.5mmol),[1,1'-联苯]-3-胺(4.5g,24.6mmol)和tbuona(3.9g,41mmol)加入甲苯(100ml),体系加热到120℃反应2h。反应结束后,经柱层析纯化,得无色油状物中间体38(6.2g,20.15mmol,产率98%)。
[0319]
第三步
[0320][0321]
在室温、氮气保护下,将1,6-二溴芘(2.5g,7mmol),中间体38(5.5g,16.2mmol),pd(oac)2(78mg,0.35mmol),tbu3ph
bf
4-(200mg,0.7mmol)和tbuona(1.6g,16.2mmol),加入二甲苯(35ml),体系加热到95℃。反应结束后,经柱层析纯化,得到黄绿色固体bd25(4g,5.1mmol,产率69%)。产物经鉴定为目标产物,分子量为796.4。
[0322]
合成比较例1:对比化合物a的合成
[0323]
第一步:
[0324][0325]
在室温、氮气保护下,将pd2(dba3)(1g,1.1mmol),中间体3(5g,22.7mmol),2-甲基苯胺(2.9g,27.2mmol),binap(1.4g,2.2mmol)和t-buona(4.3g,45.4mmol)加入二甲苯(100ml),体系加热到90℃反应过夜。反应结束后经柱层析纯化,得到白色固体中间体39(4g,17.4mmol,产率76%)。
[0326]
第二步
[0327][0328]
在室温、氮气保护下,将1,6-二溴芘(2.5g,7.0mmol),中间体39(4g,16.2mmol),pd(oac)2(78mg,0.35mmol),tbu3ph
bf
4-(200mg,0.7mmol)和t-buona(1.6g,16.2mmol)加入二甲苯(35ml),体系加热到95℃直至反应完全。并经柱层析纯化,得到黄绿色固体化合物a(3.4g,4.86mmol,69%)。产物经鉴定为目标产物,分子量为700.4。
[0329]
合成比较例2:对比化合物b的合成
[0330]
第一步:
[0331]
[0332]
在室温、氮气保护下,将pd2(dba)3(910mg,0.99mmol),binap(1.18g,1.99mmol),中间体9(6g,19.9mmol),苯胺(2.79g,30mmol)和tbuona(3.8g,39.8mmol),加入甲苯(100ml),体系加热到120℃反应3h。反应结束后,经柱层析纯化,得无色油状物中间体40(5.3g,16.9mmol,产率85%)。
[0333]
第二步:
[0334][0335]
在室温、氮气保护下,将1,6-二嗅芘(2.38g,6.6mmo1),中间体40(4.76g,15.2mmo1),pd(oac)2(74mg,0.33mmol),t-bu3p
·
hbf4(191mg,0.66mmol)和t-buona(1.46g,15.2mmol)加入二甲苯(30ml),体系加热到95℃。反应结束后,经柱层析分离提纯,得到黄绿色固体对比化合物b(4.68g,5.67mmol,86%)。产物经鉴定为目标产物,分子量为824.4。
[0336]
本领域技术人员应该知晓,上述制备方法只是一个示例性的例子,本领域技术人员能够通过对其改进从而获得本发明的其他化合物结构。
[0337]
器件实施例1
[0338]
首先,清洗玻璃基板,其具有80nm厚的铟锡氧化物(ito)阳极,然后用氧等离子体和uv臭氧处理。处理后,将基板在手套箱中烘干以除去水分。然后将基板安装在基板支架上并装入真空室中。下面指定的有机层,在真空度约为10-8
托的情况下以0.2-2埃/秒的速率通过热真空蒸镀依次在ito阳极上进行来蒸镀。化合物hi用作空穴注入层(hil)。化合物ht用作空穴传输层(htl)。化合物eb用作电子阻挡层(ebl)。然后化合物bd32掺杂在化合物bh中,共蒸镀用作发光层(eml)。使用化合物hb作为空穴阻挡层(hbl)。在空穴阻挡层上,化合物et和8-羟基喹啉-锂(liq)共蒸镀作为电子传输层(etl)。最后,蒸镀1nm厚度的8-羟基喹啉-锂(liq)作为电子注入层,并且蒸镀120nm的铝作为阴极。然后将该器件转移回手套箱,并用玻璃盖和吸湿剂封装以完成该器件。
[0339]
器件实施例2
[0340]
器件实施例2的实施方式与器件实施例1相同,除了发光层(eml)中用化合物bd1141代替化合物bd32。
[0341]
器件实施例3
[0342]
器件实施例3的实施方式与器件实施例1相同,除了发光层(eml)中用化合物bd151代替化合物bd32。
[0343]
器件实施例4
[0344]
器件实施例4的实施方式与器件实施例1相同,除了发光层(eml)中用化合物bd1148代替化合物bd32。
[0345]
器件实施例5
[0346]
器件实施例5的实施方式与器件实施例1相同,除了发光层(eml)中用化合物bd250代替化合物bd32。
[0347]
器件实施例6
[0348]
器件实施例6的实施方式与器件实施例1相同,除了发光层(eml)中用化合物bd441代替化合物bd32。
[0349]
器件比较例1
[0350]
器件比较例1的实施方式与器件实施例1相同,除了发光层(eml)中用化合物a代替化合物bd32。
[0351]
器件比较例2
[0352]
器件比较例2的实施方式与器件实施例1相同,除了发光层(eml)中用化合物b代替化合物bd32。
[0353]
详细的器件层部分结构和厚度如表1所示。其中所用材料不止一种的层,是不同化合物以其记载的重量比例掺杂得到的。
[0354]
表1器件实施例和比较例的器件结构
[0355]
[0356]
器件中使用的材料结构如下所示:
[0357][0358][0359]
在不同电流密度和电压下测量所有实施例和比较例器件的ivl,同时测量了蒸镀
温度。在恒定电流1000cd/m2下,测量外部量子效率(eqe),最大发射波长(λ
max
),半峰宽(fwhm)和cie数据。
[0360]
表2实施例1、实施例2、比较例1和比较例2的器件数据
[0361]
器件编号cie(x,y)λmax(nm)fwhm(nm)eqe(%)实施例10.135,0.11746129.79.11实施例20.133,0.12946330.59.02比较例10.136,0.12746131.78.43比较例20.133,0.13346330.58.65
[0362]
讨论:
[0363]
表2中展示了实施例1、实施例2、比较例1和比较例2的器件数据。实施例1相较于比较例1来说,可以看出芳胺的一个芳基为联芳基时,eqe提高了近8.07%(9.11vs.8.43),半峰宽变窄了2nm(29.7nm vs.31.7nm),有效地提升了器件性能。
[0364]
另外,实施例2相较于比较例2来说,其eqe提高了近4.28%,半峰宽和最大发射波长维持不变。实施例2相较于比较例2,可以看出芳胺的一个芳基为联芳基时,能够实现eqe的提高,有效地增加蓝色发光性能。
[0365]
表3实施例3和实施例4的器件数据
[0366]
器件编号cie(x,y)λmax(nm)fwhm(nm)eqe(%)实施例30.133,0.12046228.59.48实施例40.135,0.11846129.79.12
[0367]
讨论:
[0368]
表3中展示了实施例3和实施例4的器件数据。实施例4中在芳胺n-邻位进一步引入了甲基,相较于实施例2中芳胺的n-邻位没有取代基,eqe提升了(9.12vs.9.02),半峰宽变窄了(29.7nm vs.30.5nm),最大发射波长也发生了蓝移(461nm vs.463nm)。结果表明,在芳胺的一个芳基为联芳基的基础上,在其芳基的n-邻位同时引入烷基取代基可以进一步提升蓝色发光性能。
[0369]
实施例3中芳胺n-邻位进一步引入了新戊基,相比于实施例1中芳胺n-邻位引入甲基,邻位取代基的加入并且随着邻位取代基分子体积的增大,eqe逐渐增加(9.48vs.9.11),半峰宽也随之变窄(28.5nm vs.29.7nm)。相较于对比例1,eqe和半峰宽均有改善。结果表明,在芳胺具有苯并五元环和联芳基取代基的双重结构基础上,在n-邻位同时引入取代基可以进一步提升蓝色发光性能,且这种影响随n-邻位取代基分子体积的增大而增大。
[0370]
表4实施例5和实施例6的器件数据
[0371]
器件编号cie(x,y)λmax(nm)fwhm(nm)eqe(%)实施例50.139,0.08945631.38.99实施例60.140,0.08945529.48.71
[0372]
讨论:
[0373]
表3中展示了实施例5和实施例6的器件数据。实施例5和实施例6在芳胺芳基的n-间位引入了氟取代,相比于实施例2和实施例1没有氟取代时,最大发射波长分别蓝移了7nm(456nm vs.463nm)和6nm(455nm vs.461nm)。结果表明,在芳胺具有苯并五元环和联芳基取
代基的双重结构基础上,引入氟取代可以使最大发射波长蓝移,达到深蓝的发光。
[0374]
表5器件实施例本发明化合物的蒸镀温度
[0375]
化合物bd31bd151bd441bd250蒸镀温度/℃228.5230.0236.0209.0
[0376]
器件实施例中本发明化合物的蒸镀温度数据如表5所示,该蒸镀温度是在真空度约为10-8
托下材料以0.04埃/秒的速率蒸镀测得。本发明所公开的化合物在提升器件性能的同时,材料蒸镀温度也比较温和,有利于产业对材料要求的热稳定性。
[0377]
综上所述,在芳香族胺取代的芘类化合物中,芳胺的一个取代基为取代或未取代的邻位(杂)芳基并五元(杂)环烃结构,另一个为取代或未取代的联(杂)芳基,尤其是不多于两个芳(苯)基的取代或未取代的联芳基,结合这样的结构得到的新型化合物应用于有机电致发光器件中能够实现较蓝的发射波长,较高的eqe,较窄的半峰宽,从而提升了器件的综合性能。同时,在另一个(杂)芳基引入氟取代或n-邻位引入取代基,可以进一步提升蓝色发光性能。本发明所公开的化合物在提升器件性能的同时,材料蒸镀温度也比较温和,有利于产业对材料要求的热稳定性。
[0378]
应当理解,这里描述的各种实施例仅作为示例,并无意图限制本发明的范围。因此,如本领域技术人员所显而易见的,所要求保护的本发明可以包括本文所述的具体实施例和优选实施例的变化。本文所述的材料和结构中的许多可以用其它材料和结构来取代,而不脱离本发明的精神。应理解,关于本发明为何起作用的各种理论无意为限制性的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。