一种用于沙门氏菌和志贺氏菌现场检测的方法及双色iipcr试剂盒
技术领域
1.本发明属于生物检测领域,具体涉及一种用于沙门氏菌和志贺氏菌现场检测的方法及双色iipcr试剂盒。
背景技术:
2.食源性疾病是发展中国家发病率和死亡率较高的一种常见疾病,人体一旦被感染,常引起发热、腹泻、呕吐等症状,并有可能将疾病传播给他人,造成较高的社会经济负担。食源性疾病的病原体主要包括病毒、细菌、寄生虫等,其中沙门氏菌和志贺氏菌因与粪-口传播有关,并常在餐饮单位引起大规模暴发,所以,作为一项防控措施,我国相关法律规定食品从业人员预防性健康体检的实验室检测项目中,沙门氏菌和志贺氏菌的筛查是每年的必检项目。目前我们对从业人员沙门志贺的检测,仍是采取传统的分离培养方法,比如公开号为cn105821133a的中国专利文献,其公开了一种同时检测副溶血弧菌、大肠杆菌o157:h7、沙门氏菌和志贺氏菌的试剂盒,该试剂盒包含:pcr反应预混液及对照品;检测方法是:首先采集样品,进行增菌培养,培养后提取dna,制备pcr反应管,置于pcr仪上进行pcr扩增,得pcr扩增产物进行检测结果判定。上述方法操作时间长、工作量大,灵敏度不高,且不适合现场检测。
技术实现要素:
3.本发明所要解决的技术问题是克服现有技术的不足,提供了一种用于沙门氏菌和志贺氏菌现场检测的方法及双色iipcr试剂盒,用于解决现有技术中操作时间长、工作量大、灵敏度不高、无法现场检测等影响结果有效性和时效性的技术问题。
4.本发明所采用的技术方案是:所述用于沙门氏菌和志贺氏菌现场检测的方法包括如下步骤:a、制备反应混合物,建立iipcr反应体系;b、反应混合物离心处理后,将反应混合物放入热对流pcr的容器中,并且控制容器底部的加热温度在92-95℃之间,当反应混合物流至容器底部时,就可以进行解离dna双股结构的反应,当反应混合物循环至容器顶端并且降温时,就可以进行引物结合,之后再循环至容器较热区域进行延伸反应,在热对流不间断进行的过程之中,pcr的反应也随之完成;c、采集荧光信号,将iipcr后采集的信号与iipcr前的信号进行比较,计算信噪比,使用默认的s/n阈值,结果会自动以 、
−
、的形式显示在屏幕上, 、
−
、对于的含义分别为阳性、阴性、未知;步骤a中的反应混合物包括pcr反应缓冲液、聚合酶、甲基亚砜、海藻糖、沙门氏菌正向引物sal-f、沙门氏菌反向引物sal-r、沙门氏菌探针sal-p、志贺氏菌正向引物shi-f、志贺氏菌反向引物shi-r、志贺氏菌探针shi-p、样品dna,上述引物的探针的碱基序列表示如下:
sal-f: 5
’‑ꢀ
gct tgt act ttc ctt att c-3’(seq id no:1);sal-r: 5
’‑ꢀ
agy gyc agc gac ctg aac-3’(seq id no:2);sal-p: 5
’‑
fam
‑ꢀ
acg cta tta gct gta aaa gag cgc tg-bhq-3’( seq id no:3);shi-f: 5
’‑ꢀ
tga agg aaa tgc gtt tct-3’(seq id no:4);shi-r: 5
’‑ꢀ
act tct gac cat ggc ttc-3’(seq id no:5);shi-p: 5
’‑
hex
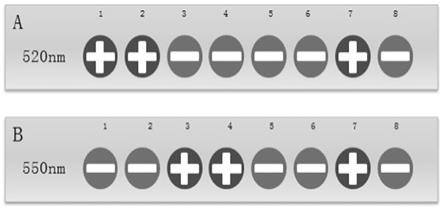
‑ꢀ
tgt cgg gag tga cag caa atg acc tcc gca-3’,(seq id no:6)。
5.进一步,pcr反应缓冲液为uni-ii缓冲液,聚合酶为iipcrtaq dna聚合酶,甲基亚砜为四亚甲基亚砜。
6.进一步,反应混合物包括25.0 ul uni-ii缓冲液、1.5 ul iipcrtaq dna聚合酶,0.25ul四亚甲基亚砜,0.5ul海藻糖、0.6 um沙门氏菌正向引物sal-f、 0.6 um沙门氏菌反向引物sal-r、0.3 um沙门氏菌探针sal-p、 0.6 um志贺氏菌正向引物shi-f、 0.6 um志贺氏菌反向引物shi-r、0.3 um志贺氏菌探针shi-p、 5 ul样品dna。
7.进一步,iipcrtaq dna聚合酶的浓度为5u/ l。
8.进一步,在步骤b中,将装盛有反应混合物的容器加载到pockit设备上,pockit设备默认程序为50℃加热10 min,然后95℃加热48 min。
9.一种用于沙门氏菌和志贺氏菌现场检测的双色iipcr试剂盒包括:扩增反应液、酶、阳性对照、阴性对照、空白对照;扩增反应液包括如下组分:tris-hcl、kcl、mgcl2、dtt、海藻糖、dntp、沙门氏菌正向引物sal-f、沙门氏菌反向引物sal-r、沙门氏菌探针sal-p、志贺氏菌正向引物shi-f、志贺氏菌反向引物shi-r、志贺氏菌探针shi-p;上述引物的探针的碱基序列表示如下:sal-f: 5
’‑ꢀ
gct tgt act ttc ctt att c-3’(seq id no:1);sal-r: 5
’‑ꢀ
agy gyc agc gac ctg aac-3’(seq id no:2);sal-p: 5
’‑
fam
‑ꢀ
acg cta tta gct gta aaa gag cgc tg-bhq-3’( seq id no:3);shi-f: 5
’‑ꢀ
tga agg aaa tgc gtt tct-3’(seq id no:4);shi-r: 5
’‑ꢀ
act tct gac cat ggc ttc-3’(seq id no:5);shi-p: 5
’‑
hex
‑ꢀ
tgt cgg gag tga cag caa atg acc tcc gca-3’,(seq id no:6)。
10.进一步,扩增反应液的各组分含量为100mm tris-hcl (ph8.3)、100mm kcl、20mm mgcl2、20mm dtt、0.5% dmso、1%海藻糖、0.4mm dntp、0.6μm引物sal-f、0.6μm引物sal-r、0.3μm探针sal-p、0.6μm引物shi-p、0.6μm引物shi-r、0.3μm探针shi-p;上述dmso和海藻糖的含量按照体积比,即0.5% dmso表示dmso占扩增反应液总体积的0.5%,1%海藻糖表示海藻糖占扩增反应液总体积的1%。
11.进一步,所述酶为7.5u iipcr taq dna聚合酶。
12.进一步,所述阳性对照为沙门氏菌dna和志贺氏菌dna。
13.进一步,所述阴性对照为无菌生理盐水,在核酸提取时与标本同时平行提取以作为阴性对照使用所述空白对照为depc处理的无核酸酶的超纯水。
um,每个探针(sal-p, shi-p) 0.3 um,和5 ul dna模板。短时间离心后,加载到pockit设备上。默认程序为50℃10 min, 95℃48 min。采集荧光信号,将iipcr后采集的信号与iipcr前的信号进行比较,计算信噪比。使用默认的s/n阈值,结果会自动以“ ”(阳性)、
“−”
(阴性)、
“”ꢀ
(未知)的形式显示在屏幕上。
20.一、对于特异性引物和探针设计首先从美国ncbi的基因库下载尽量多的沙门氏菌和志贺氏菌基因序列,然后利用分子生物学软件bioedit对下载的序列进行同源比对分析,寻找高度同源的保守序列作为引物和探针设计的候选区,同时结合软件primerselect进行引物设计。核心设计思想是:综合考虑对沙门氏菌和志贺氏菌检测的特异性和通用性、引物和探针设计应遵循的普遍性原则(如tm值、3’末端自由能、gc含量、避免出现内部二级结构及形成二聚体等),以及多重扩增反应时各引物和探针之间的相互影响等,并进一步与弧菌、葡萄球菌和弯曲杆菌等其他病原体进行比对,以避免出现任何不理想的匹配错配而导致非特异性扩增。探针的设计遵循iipcr推荐的原则,包括适度的gc含量和较短的长度。使用mfold程序对扩增子进行分析,避免那些带有次要二级结构的扩增子。最后本发明优选出如下引物和探针:沙门氏菌正向引物sal-f: 5
’‑ꢀ
gct tgt act ttc ctt att c-3’,反向引物sal-r: 5
’‑ꢀ
agy gyc agc gac ctg aac-3’,探针sal-p: 5
’‑
fam
‑ꢀ
acg cta tta gct gta aaa gag cgc tg-bhq-3’;志贺氏菌正向引物shi-f: 5
’‑ꢀ
tga agg aaa tgc gtt tct-3’,反向引物shi-r: 5
’‑ꢀ
act tct gac cat ggc ttc-3’,探针shi-p: 5
’‑
hex
‑ꢀ
tgt cgg gag tga cag caa atg acc tcc gca-3’。
21.二、带ipc和epc的一管双色rt-pcr检测试剂盒组成和检测方法1. 试剂盒的组成(保存于-20℃)(1)扩增反应液:其组分为:100mm tris-hcl (ph8.3)、100mm kcl、20mm mgcl2、20mm dtt、0.5% dmso、1%海藻糖、0.4mm dntp、0.6μm引物sal-f、0.6μm引物sal-r、0.3μm探针sal-p、0.6μm引物shi-p、0.6μm引物shi-r、0.3μm探针shi-p;上述dmso和海藻糖的含量按照体积比,即0.5% dmso表示dmso占扩增反应液总体积的0.5%,1%海藻糖表示海藻糖占扩增反应液总体积的1%;另外其中引物sal-f是序列编号为seq id no:1所示的核苷酸序列,引物sal-r是序列编号为seq id no:2所示的核苷酸序列,探针sal-p是序列编号为seq id no:3所示的核苷酸序列,引物shi-p是序列编号为seq id no:4所示的核苷酸序列,引物shi-r是序列编号为seq id no:5所示的核苷酸序列,探针shi-p是序列编号为seq id no:6所示的核苷酸序列;(2)酶:7.5u iipcr taq dna聚合酶;(3)阳性对照:沙门氏菌和志贺氏菌dna;(4)阴性对照:为无菌生理盐水,在核酸提取时与标本同时平行提取以作为阴性对照使用;(5)空白对照:为depc处理的无核酸酶的超纯水。
22.2. 试剂盒的检测方法如下:(1)提取样品的dna,即模板dna:根据样本类型选用合适的商品化试剂盒提取核酸,或者采用煮沸法提取核酸;
(2)按照以下方法配制反应液:反应体积为50ul;取40ul反应液、1.5ul酶、3.5ul超纯水加入0.2ml光学pcr反应管,再加入5ul待测样本或阳性对照、阴性对照和空白对照,振荡混匀后瞬时离心数秒;(3)上机检测:将反应管置于pockit检测仪上进行扩增和检测。反应条件是:50℃10 min, 95℃48 min;设备自动在fam通道(520nm)和hex通道(550nm)收集荧光信号。
23.(4)结果判定:设备会自动将iipcr后采集的信号与iipcr前的信号进行比较,计算信噪比。使用默认的s/n阈值,结果会自动以“ ”(阳性)、
“−”
(阴性)、
“”ꢀ
(未知)的形式显示在屏幕上。
24.(5)注意事项:实验全过程都应使用无粉手套。为了避免实验中的交叉污染,在加模板的过程中,应首先加空白和阴性对照,其次加待检样本,最后加阳性对照。
25.三、对检测方法的特异性评价1.样本:沙门氏菌(ab91111,ab91018),志贺氏菌(ab200061,ab200060),副溶血性弧菌(atcc17802),金黄色葡萄球菌(atcc25923)。
26.2.方法:使用本发明所述的检测试剂盒,采用实施例二所述方法对以上样本进行检测,观察该试剂盒是否会产生非特异性的检测结果。
27.3.结果:从图1(a)和图1(b)可以看出,在520 nm和550 nm的通道上分别只能检测到沙门氏菌和志贺氏菌,而副溶血性弧菌和金黄色葡萄球菌则无法被检测到。其他病原体,包括gii型诺如病毒、a群轮状病毒、蓝氏贾第鞭毛虫、空肠弯曲杆菌、小肠结尔森氏菌和o1霍乱弧菌,也为阴性。这些结果表明iipcr法具有较高的特异性。
28.四、对检测方法的灵敏性评价1.样本:梯度稀释的沙门氏菌和志贺氏菌标准菌株。
29.2. 方法:采用实施例二所述检测方法进行反应液配制,然后将反应管置于pockit检测仪上进行扩增和检测。反应完成后观察结果,分析本发明所述试剂盒所能检测到的模板浓度最低限。
30.3. 结果:如图2(a)和2(b)所示,沙门氏菌和志贺氏菌的检测下限分别为10
3 cfu /ml和10
1 cfu /ml。
31.五、对检测方法的重复性评价1.样本:沙门氏菌和志贺氏菌标准菌株,制作10份平行样本。
32.2.方法:使用本发明所述的检测试剂盒,采用实施例二所述方法对以上样本进行检测,观察该试剂盒的重复性。
33.3.结果:沙门氏菌和志贺氏菌在所有的十次测试中均能被检测到,表明该方法具有良好稳定性。
34.六、对检测方法的临床评价1.样本:214份粪便样本。
35.2.方法:使用本发明所述的检测试剂盒采用实施例二所述方法对以上样本进行检测,同时进行细菌培养,对该试剂盒进行临床评价。
36.3.结果:通过iipcr试验和培养,共检测出沙门氏菌阳性标本13份,志贺氏菌阳性标本8份。2份iipcr阳性标本经培养为阴性。因此,以细菌培养作为金标准,计算出iipcr法的灵敏度和特异性分别为100%和98.96%,阳性预测值和阴性预测值分别为91.30%和100%。
37.本发明可应用于临床和口岸的常规检测和疾病防控领域。
38.虽然本发明的实施例是以实际方案来描述的,但是并不构成对本发明含义的限制,对于本领域的技术人员,根据本说明书对其实施方案的修改及与其他方案的组合都是显而易见的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
