1.本发明涉及生物医药技术领域,尤其涉及一种可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶及其制备方法。
背景技术:
2.干细胞上清液是指从干细胞培养液中去除干细胞以及其他所有细胞成分所余留的液体,该液体中包含了培养基、细胞因子以及外泌体三部分。由于干细胞上清液中包含有大量细胞活性物质,因此其能够促进细胞活化,提高细胞存活率,加速伤口修复,从而达到“逆生长”的效果。将其添加在护肤品中使用,可以加快皮肤新陈代谢,增加皮肤功能性再生,具有抗衰老、抗氧化及美白嫩肤的功效,还可以用于丰胸、私密养护、生发,甚至可以改善身体的免疫疾患。因此,干细胞上清液被称为理想的生物医疗美容用品。间充质干细胞作为一种多能干细胞,具有分化潜力大、增殖能力强、免疫原性低、取材方便等优点,因此,具有不菲的应用价值。然而,现有的技术并不能很好的保存间充质干细胞上清液或负载间充质干细胞上清液成分,从而导致其活性成分快速流失或者被污染失效,并不能得到广泛的应用。
3.而水凝胶作为一种亲水的三维聚合物网络,可以保留大量的水或其他生物流体,由于其与天然细胞外基质(ecm)的高度相似性,可以作为良好且温和的生物载体。
4.可注射水凝胶是近年来出现的新型水凝胶体系,通过注射的方式将具有一定流动性的材料挤出,填充满不规则形状的缺损部位,并在化学、温度、ph或光照等触发下产生溶液-凝胶相转变,从而形成凝胶。这种可注射凝胶可以更有效地填充具有不规则形状的伤口缺陷,并为伤口提供适宜的湿润环境和微生物屏障,加速伤口愈合。近年来,由生物材料制成的可注射治疗剂越来越流行,并推动传统的临床实践走向微创化,可注射水凝胶由于其可调控的物理及化学特性、可控的降解性能、高含水量以及在微创方式下实现递送的能力,在组织工程和药物递送领域中变得越来越重要。由于水凝胶的可注射性以及高度多孔的网络结构,间充质干细胞上清液中的细胞活性物质,可在注射过程中实现递送并扩散,而对水凝胶聚合物进行化学修饰,则可以更好地将细胞活性物质包封、保留、递送、释放至目标部位。
5.尽管可注射水凝胶具有其独特的优点,但大多数可注射水凝胶的强度较低,凝胶时间也相对较长,从而一定程度上增加了活性物质失效的风险;较低的力学性能使得其在使用过程中容易受到损坏,从而导致活性物质的快速流失,不仅浪费了大量活性因子,还降低了其作用效果。因此迫切需要提高可注射水凝胶的力学性能,延长其使用寿命。
6.现有的延长凝胶使用寿命的方法一般有两种,一种是增强水凝胶的力学性能,另一种则是构建具有自愈合性能的水凝胶。尽管高强度、高韧性的水凝胶在一定程度上可以延长凝胶的使用寿命,但是一旦水凝胶受到破坏,凝胶就失去了其优异的性能和作用,且这个过程是不可逆的。而自愈合水凝胶虽然能自发修复其破损的结构和性能,但其中大部分
自愈合水凝胶为了拥有良好的自愈合性,牺牲了其力学性能,甚至有些凝胶的结构并不稳定,在短时间内会发生塌陷。因此凝胶很难同时兼具优异的自愈合性能和力学性能。
7.专利cn104910396a公开了一种可注射性双交联透明质酸水凝胶及其制备方法,将醛基化透明质酸和侧链中含有二硫键的氨基/甲基丙烯酰双功能化透明质酸与水溶性光引发剂一起混合均匀,经紫外光辐照即可得到可注射性双交联透明质酸水凝胶。制得的水凝胶由希夫碱交联和光交联两种交联机制形成,且这两种交联网络是连接在一起的。虽然这种方法在一定程度上提高了凝胶的力学性能,在细胞递送、组织工程和三维细胞培养等方面具有一定的应用前景,但其制得的水凝胶强度仍然不高,也不具有自愈合性能,一旦凝胶在使用过程中破裂,其优异的性能会完全消失。
8.专利cn109824917a公开了一种自愈合和可注射的水凝胶及其制备方法与应用。首先,它是将硫酸软骨素或硫酸软骨素的盐与氧化剂反应,从而获得醛基化硫酸软骨素,然后将醛基化硫酸软骨素与明胶在溶剂中混合,获得水凝胶预聚液;最后,将水凝胶预聚液与fe
3
溶液混合,获得自愈合和可注射的水凝胶。虽然基于硫酸软骨素、明胶和fe
3
的联合使用,使得该凝胶具有快速的自愈合能力,但是该凝胶相对柔软,力学性能较差,其应用范围仍然有限。
9.可见,在现有技术中,制备的可注射水凝胶存在无法兼顾力学性能和自愈合性能的问题。
技术实现要素:
10.为了克服上述现有技术的不足,本发明的目的在于提供一种可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶及其制备方法。将醛基化和马来酰化透明质酸、聚乙二醇二丙烯酸酯和3,3
’‑
二硫代二丙酰肼交联,利用醛基-酰肼“点击”反应以及紫外光聚合,加快凝胶成型速度,并提高凝胶的力学性和自愈合性能。
11.为实现上述发明目的,本发明提供了一种可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶的制备方法,包括以下步骤:
12.s1.将醛基化和马来酰化透明质酸溶于去离子水中,得到质量体积比为(10~15)g:100ml的溶液,然后加入光引发剂和聚乙二醇二丙烯酸酯,得到第一溶液;
13.s2.将3,3
’‑
二硫代二丙酰肼溶于间充质干细胞上清液中,得到质量体积比为(0.5~1.5)g:100ml的第二溶液;
14.s3.将所述第一溶液和所述第二溶液混合后,进行紫外光照射交联,得到可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶。
15.作为本发明的进一步改进,s1中所述醛基化和马来酰化透明质酸是先采用马来酸酐接枝,然后采用高碘酸钠氧化得到。
16.作为本发明的进一步改进,s1中所述醛基化和马来酰化透明质酸中马来酰基摩尔取代度为0.5~3,醛基化的氧化度为0.1~0.3。
17.作为本发明的进一步改进,s1中所述醛基化和马来酰化透明质酸的制备方法包括:
18.s101:在40~60℃的条件下,将透明质酸溶液和马来酸酐溶液反应12~48h,得到反应液,透明质酸与马来酸酐的质量比为1:(1~5);对反应液进行离心,将离心后的上层清
液加入到1mol/l的碱溶液中;调节液体的ph值至8~9,将调节后的溶液倒入丙酮中沉淀,沉淀5~10h后,抽滤得到沉淀物并使用透析膜进行透析;透析48h后将透析液在温度为-40℃、压强为20-50pa条件下,冷冻干燥48~72h,得到马来酰基摩尔取代度为0.5~3的马来酰化透明质酸;
19.s102:将所述马来酰化透明质酸完全溶解于磷酸盐缓冲溶液中,马来酰化透明质酸与磷酸盐缓冲溶液的质量体积比为1g:(50~200)ml;在马来酰化透明质酸溶液中加入高碘酸钠,马来酰化透明质酸与高碘酸钠的质量比为1:0.5~1.5;将马来酰化透明质酸溶液和高碘酸钠在25~60℃条件下反应1~24h后;将反应液透析2天形成醛基化和马来酰化透明质酸溶液,然后将其冷冻干燥,得到氧化度为0.1~0.3的醛基化和马来酰化透明质酸。
20.作为本发明的进一步改进,s101中所述透明质酸溶液由透明质酸在第一非质子溶剂中搅拌得到,第一非质子溶剂为二甲亚砜,透明质酸与非质子溶剂的质量体积比为1g:(100~150)ml;所述马来酸酐溶液由马来酸酐溶解于第二非质子溶剂中得到,马来酸酐与第二非质子溶剂的质量体积比为1g:(2~5)ml;所述透析膜的截留分子量为8000~14000da。
21.作为本发明的进一步改进,s101中所述碱溶液为碳酸氢钠溶液或碳酸氢钾溶液,s102中所述磷酸盐缓冲溶液为ph值为5.0的na2hpo4-nah2po4缓冲溶液、k2hpo4-kh2po4缓冲溶液或pbs缓冲溶液。
22.作为本发明的进一步改进,s1中所述第一溶液中聚乙二醇二丙烯酸酯与透明质酸溶液的体积比为(20~100)μl:1ml。
23.作为本发明的进一步改进,s2中所述3,3
’‑
二硫代二丙酰肼是由3,3
’‑
二硫代二丙酸二甲酯与水合肼在20~50℃下反应10~24h得到。
24.作为本发明的进一步改进,s3中所述第一溶液与第二溶液的体积比为1:1,光照时间为10~20min,光强为45mw/cm2,所述紫外光的波长为365nm。
25.本发明还提供一种根据上述方法制得的可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶,该水凝胶包括包含醛基化和马来酰化透明质酸与聚乙二醇二丙烯酸酯的第一溶液、以及包含3,3
’‑
二硫代二丙酰肼和间充质干细胞上清液成分的第二溶液。
26.本发明的有益效果是:
27.1.本发明提供的可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶,以透明质酸为原料,通过在透明质酸分子链上接枝马来酸酐引入碳碳双键,同时,利用高碘酸钠对其进行氧化从而引入了醛基,并且在该体系中混入pegda交联剂,利用醛基-酰肼“点击”反应以及紫外光聚合,进一步缩短了凝胶时间,有利于凝胶的快速成型。
28.2.本发明通过醛基化和马来酰化透明质酸与3,3
’‑
二硫代二丙酰肼之间的席夫碱反应构建了一种可逆动态网络,从而赋予了凝胶优异的自愈合性能;同时,利用醛基化和马来酰化透明质酸与pegda经紫外光聚合形成的化学网络,进一步提高凝胶的机械强度,使得该凝胶同时具有优异的自愈合性能和力学性能,拓宽了凝胶的应用范围。
29.3.pegda小分子交联剂加入后,能均匀地分布在透明质酸溶液中,提高了溶液中碳碳双键的含量,增加了化学网络的交联点,不仅能促进醛基化和马来酰化透明质酸上碳碳双键的反应,还有利于形成均匀的化学交联网络。因此,大幅度提高了凝胶的力学性能,增加了凝胶的稳定性。
30.4.本发明以透明质酸为原料,间充质干细胞上清液作为第二溶液的溶剂,具有良好的生物相容性,制备方法简单,凝胶成型快。由于水凝胶的可注射性以及高度多孔的网络结构,不仅能够有效地填充不规则的伤口及皮肤,也有利于间充质干细胞上清液中的细胞活性物质在注射过程中的递送;而通过对水凝胶聚合物进行化学修饰,该水凝胶中含有大量醛基、氨基、羧基,可以与多种细胞因子结合,能更好地将细胞活性物质包封、保留、递送、释放至目标部位,实现活性物质的缓慢长时间释放,可用最小剂量达到最大的疗效。
附图说明
31.图1中从左至右依次为实施例1制得的水凝胶样品切断前、切断后拼接3h自愈合后以及3h愈合后拉伸的宏观照片。
32.图2为实施例1制得凝胶的储能模量(g’)与损耗模量(g”)变化曲线图。
具体实施方式
33.为了使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例对本发明进行详细描述。
34.在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明,在具体实施例中仅仅示出了与本发明的方案密切相关的结构和/或处理步骤,而省略了与本发明关系不大的其他细节。
35.另外,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
36.本发明提供的可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶,包括以下步骤:
37.s1.将醛基化和马来酰化透明质酸溶于去离子水中,得到质量体积比为(10~15)g:100ml的透明质酸溶液;在该溶液中加入光引发剂和pegda(聚乙二醇二丙烯酸酯),得到第一溶液;
38.光引发剂为2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮,光引发剂的质量,与透明质酸溶液的体积之比为1g:(500~2000)ml;
39.s2.将3,3
’‑
二硫代二丙酰肼溶于间充质干细胞上清液中,得到质量体积比为(0.5~1.5)g:100ml的第二溶液;
40.s3.将s1中的第一溶液和s2中的第二溶液混合后,进行紫外光照射交联,得到可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶。
41.第一溶液与第二溶液的体积比优选为1:1。光照时间为10~20min,光强为45mw/cm2,所述紫外光的波长为365nm。
42.其中,步骤s1中的醛基化和马来酰化透明质酸通过以下步骤制备:
43.1)将一定量的透明质酸置于第一非质子溶剂中,充分搅拌得到透明质酸溶液;再将预定量的马来酸酐溶解于第二非质子溶剂(第一非质子溶剂和第二非质子溶剂成分相同)中,透明质酸与马来酸酐的质量比为1:(1~5),然后将马来酸酐溶液加入上述透明质酸
溶液中,在40~60℃下反应12~48h;
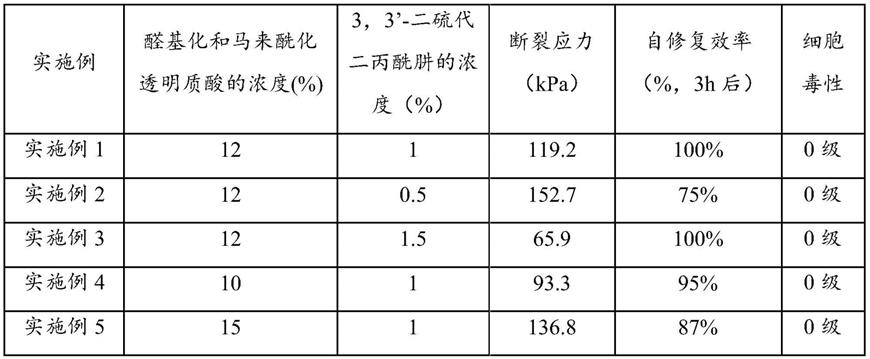
44.反应结束后,对反应液进行离心,将离心后的上层清液加入到1mol/l的碱溶液中,调节液体的ph值至8~9,将调节后的溶液倒入丙酮中沉淀,沉淀5~10h后,抽滤得到沉淀物并使用透析膜进行透析,透析48h后将透析液在温度为-40℃、压强为20-50pa条件下,冷冻干燥48~72h,得到马来酰基摩尔取代度为0.5~3的马来酰化透明质酸。
45.在步骤1)中,所述第一非质子溶剂优选为二甲亚砜,透明质酸与所述非质子溶剂的预设质量体积比为1g:(100~150)ml,马来酸酐与所述第二非质子溶剂的预设质量体积比为1g:(2~5)ml。
46.所述透析膜的截留分子量为8000~14000da。
47.2)将步骤1)得到的马来酰化透明质酸溶解于磷酸盐缓冲溶液中,马来酰化透明质酸与磷酸盐缓冲溶液的质量体积比为1g:(50~200)ml,室温下搅拌1~3h小时,使得马来酰化透明质酸完全溶解于磷酸盐缓冲溶液中;然后在马来酰化透明质酸溶液中加入预定量的高碘酸钠,马来酰化透明质酸与高碘酸钠的质量比为1:0.5~1.5,室温下搅拌均匀,在25~60℃条件下反应1~24h;反应结束后,将反应液用透析袋进行透析,透析2天形成醛基化和马来酰化透明质酸溶液,然后将其冷冻干燥,得到氧化度为0.1~0.3的醛基化和马来酰化透明质酸。
48.在步骤2)中,所述磷酸盐缓冲溶液为ph值为5.0的na2hpo
4-nah2po4缓冲溶液、k2hpo
4-kh2po4缓冲溶液或pbs缓冲溶液。碱溶液为碳酸氢钠溶液或碳酸氢钾溶液。
49.步骤s2中的3,3
’‑
二硫代二丙酰肼通过以下步骤制备:
50.将一定量的3,3
’‑
二硫代二丙酸二甲酯溶于乙醇中,再加入预定量的水合肼(n2h4·
h2o),在20~50℃下反应10~24h,反应结束后用大量乙醇进行洗涤,最后过滤得到3,3
’‑
二硫代二丙酰肼。
51.其中,所述3,3'-二硫代二丙酸二甲酯与所述水合肼的体积比为1:(1~9),所述水合肼中的肼含量为80~90%。
52.实施例1
53.一种可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶,通过以下步骤制备:
54.s1.将0.12g醛基化和马来酰化透明质酸溶解于1ml去离子水中,配制得到质量体积比为12%的透明质酸溶液1ml,并向透明质酸溶液中加入光引发剂2-羟基-4'-(2-羟乙氧基)-2-甲基苯丙酮,使光引发剂的浓度为0.1%,然后加入48μlpegda(聚乙二醇二丙烯酸酯),充分混合后将其作为第一溶液;
55.其中,醛基化和马来酰化透明质酸通过下述方法制备:
56.s11.马来酰化透明质酸的制备
57.将1g透明质酸置于100ml二甲亚砜溶液中,在25℃下搅拌1h得到透明质酸溶液,再将3.5g马来酸酐溶解于10ml二甲亚砜溶液中;然后将上述得到的马来酸酐溶液加入透明质酸溶液中,在45℃下反应24h,反应结束后,以11000r/min的速度对反应液进行离心,离心11min,然后将离心后的上层清液加入到1mol/l的碳酸氢钠溶液中,调节液体的ph值至8~9,将调节后的溶液倒入丙酮中沉淀,沉淀10h后,抽滤得到沉淀物并使用截留分子量为8000~14000da的透析膜进行透析,透析48h后,将透析液在温度为-40℃、压强为20-50pa条件
下,冷冻干燥48~72h,得到马来酰基摩尔取代度为1.2的马来酰化透明质酸。
58.s12.醛基化和马来酰化透明质酸的制备
59.将步骤s11得到的1g马来酰化透明质酸溶解于100mlph值为5.0的pbs的缓冲溶液中,室温下搅拌2h,使得马来酰化透明质酸完全溶解于pbs缓冲溶液中;然后在100ml马来酰化透明质酸溶液中加入1g的高碘酸钠粉末,在25℃下反应12h,反应结束后,将反应液倒入截留分子量为8000~14000da的透析膜中进行透析,透析2天得到透明质酸溶液,然后将其冷冻干燥,得到氧化度为0.19的醛基化和马来酰化透明质酸。
60.s2.将0.01g3,3
’‑
二硫代二丙酰肼溶解于一定量的间充质干细胞上清液中,配制得到质量体积比为1.0%的酰肼溶液1ml,将其作为第二溶液;
61.其中,3,3
’‑
二硫代二丙酰肼通过下述方法制备:
62.将1.68ml的3,3
’‑
二硫代二丙酸二甲酯溶于乙醇中,再加入4.5ml85%的水合肼(n2h4·
h2o),在30℃下反应12h,反应结束后用大量乙醇进行洗涤,最后过滤得到3,3
’‑
二硫代二丙酰肼。
63.s3.将第一溶液和第二溶液按1:1等体积混合,混合后立即用光强45mw/cm2,波长365nm的紫外光进行照射,照射15min得到一种基于透明质酸的可注射光增强自愈合水凝胶。
64.将实施例1制得的水凝胶样品沿中间切断后拼接,宏观上观察水凝胶的愈合状况。图1中从左至右依次为本实施例制得的水凝胶样品切断前、切断后、拼接3h自愈合后,以及3h愈合后拉伸的宏观照片。从图1中结果可以看出,水凝胶切断后拼接处的裂缝可在室温下逐渐消失,并且在拉伸的情况下不从切断处断开,由此说明本发明制得的水凝胶具备较好的自愈合能力。
65.图2为实施例1制得凝胶的储能模量(g’)与损耗模量(g”)变化曲线图。从图中可以看出,在40s时储能模量已经远大于损耗模量,即混合溶液在40s前已经凝胶化,并且随着时间的推移,g’、g”逐渐趋于水平,即形成稳定的三维网络结构水凝胶,而此时g’可以达到10000pa,这说明该凝胶具有较高的机械强度。
66.实施例2-5
67.实施例1相比,不同之处在于,改变第一溶液中醛基化和马来酰化透明质酸的浓度或第二溶液中3,3
’‑
二硫代二丙酰肼的浓度,除上述区别外,其他操作大致相同。
68.具体条件参数及制得的自愈合水凝胶的性能测试结果如表1所示。其中,自修复效率测试方法为:将本发明制得的可注射水凝胶前驱体倒入具有标准jis-k6251-7尺寸(25mm(l)
×
2-3mm(d)
×
5mm(w))的哑铃形模具中待其形成凝胶样本,使用instron-5967通用测试系统在空气中以60mm/min的变形速率进行拉伸测试得到其原始断裂应力q0,然后将原始凝胶从中间切开,待愈合3h后,以同样测试方法进行拉伸得到愈合后断裂应力q1,自修复效率=q1/q0;细胞毒性测试按照iso10993-5标准测试方法进行试验。
69.表1实施例1-5制备条件及性能测试结果
[0070][0071]
对比表1中实施例1~5可知,本发明通过醛基化和马来酰化透明质酸与3,3
’‑
二硫代二丙酰肼之间形成的动态席夫碱网络以及光引发自由基聚合形成的不可逆化学网络构建了一种可注射光增强自愈合水凝胶,两种网络的协同作用赋予了水凝胶良好的自愈合性能和机械性能,同时基于透明质酸的良好生物性能,使得该凝胶具有优异的生物相容性。
[0072]
随着3,3
’‑
二硫代二丙酰肼含量的增大,凝胶强度逐渐降低,自愈合效率逐渐提高;随着醛基化和马来酰化透明质酸含量的增大,凝胶强度逐渐增大,自愈合效率先增加后降低。
[0073]
实施例6-9
[0074]
实施例1相比,不同之处在于,改变了步骤s11中透明质酸与马来酸酐的质量比,其余步骤不变,从而制得马来酰基摩尔取代度不同的马来酰化透明质酸。各实施例对应的具体的透明质酸与马来酸酐的质量比以及马来酰基摩尔取代度如表2所示。
[0075]
表2实施例1及6-9的制备条件及性能测试结果
[0076][0077]
从表2可以看出,在一定的反应温度和反应时间下,随着马来酸酐用量的增加,马来酰化透明质酸的马来酰基摩尔取代度逐渐增加,使制得的水凝胶的机械性能逐渐提高,但自愈合性能相对降低。这主要是因为,随着马来酰基摩尔取代度的逐渐提高,第一溶液中的双键量逐渐增加,经紫外光照射后形成的化学交联网络的交联度逐渐增大,从而使得凝胶的断裂应力增大,机械强度提高;而同时,形成的化学网络限制了分子链的运动,使得醛基与酰肼的动态交联受到限制,反而会使水凝胶的自愈合性能降低。
[0078]
虽然马来酰化透明质酸的马来酰基摩尔取代度逐渐增加,甚至能达到3,但凝胶的机械强度提高并不多,这是因为,虽然醛基化和马来酰化透明质酸上带有大量双键,但由于
其分子链较大,分子链的运动由于缠绕受到限制,因此,大量双键被包裹在分子链中并没有反应形成化学交联网络,导致其力学性能提高较少。
[0079]
实施例10-11
[0080]
与实施例1相比,不同之处在于,改变了步骤s12中马来酰化透明质酸与高碘酸钠的质量比,从而制得不同氧化度的醛基化和马来酰化透明质酸,各实施例对应的具体反应参数及所得醛基化和马来酰化透明质酸的氧化度如表3所示。
[0081]
表3实施例1及10-11的制备条件及性能测试结果
[0082][0083]
如表3所示,随着马来酰化透明质酸与高碘酸钠质量比的提高,醛基化和马来酰化透明质酸的氧化度逐渐增加,醛基含量的增多,使得凝胶的交联点增多,强度增大。但由于交联点密度过大,限制了分子链的运动,反而降低了醛基与酰肼的接触率,导致水凝胶的自愈合效率降低。因此,为了使得到的水凝胶达到综合较优的机械强度和自愈合效率,本发明优选马来酰化透明质酸与高碘酸钠的质量比1:(0.5~1.5),醛基化和马来酰化透明质酸的氧化度为0.1~0.3。
[0084]
实施例12-16
[0085]
与实施例1相比,不同之处在于,改变了步骤s1中pegda的量,从而制得具有不同pegda含量的凝胶,除上述区别外,其他操作均相同。具体条件参数及制得的自愈合水凝胶的性能测试结果如下表4所示。
[0086]
表4实施例1及12-16的制备条件及性能测试结果
[0087][0088][0089]
从表4中可以看出,在体系中加入少量pegda,不仅提高了凝胶的机械强度,还能保证凝胶的自愈合性能。而随着pegda用量的进一步增加,制得的水凝胶的机械性能进一步提高,而自愈合性能逐渐降低。这主要是因为,在加入pegda这种交联剂后,该体系经紫外光照
射,醛基化和马来酰化透明质酸上的碳碳双键与pegda上的双键经引发剂引发形成化学交联网络,pegda的加入提高了体系中双键的含量,从而提高了交联点的密度,因此,凝胶的机械强度得到了提高。与此同时,醛基化和马来酰化透明质酸上的醛基与3,3
’‑
二硫代二丙酰肼上的酰肼基团通过席夫碱反应形成动态交联,使得凝胶具有较好的自愈合性能。所以,少量pegda的加入在增强了凝胶力学性能的同时,并不会损害凝胶的自愈合性能。而随着pegda量的进一步增加,大量化学交联网络形成,虽然凝胶的断裂应力进一步增大,但形成的大量化学网络限制了分子链的运动,反而会使水凝胶的自愈合性能降低。
[0090]
因此,为使制得的水凝胶具有综合较优的性能,本发明优选pegda的体积与透明质酸溶液的体积比为(20~100)μl:1ml。在此条件下,制得的自愈合水凝胶具有较好的机械强度和自愈合性能,并且无细胞毒性,能够满足实际应用的需求。由此可见,本发明通过改变加入的pegda的量,可以调控制得的水凝胶的机械性能以及自愈合性能。
[0091]
对比例1
[0092]
与实施例1相比,不同之处在于,在步骤s3中,第一溶液和第二溶液按1:1等体积混合,通过注射器挤出到模具后,不进行紫外光照,放置1h,使第一溶液和第二溶液充分反应,得到仅具有席夫碱交联网络的水凝胶。
[0093]
对比例2
[0094]
与实施例1相比,不同之处在于,在步骤s3中,将第二溶液替换成等量的间充质干细胞上清液,然后将第一溶液和第二溶液按1:1等体积混合,通过注射器挤出到模具后,立即用光强45mw/cm2,波长365nm的紫外光进行照射,照射15min,得到仅具有不可逆化学交联网络的水凝胶。
[0095]
对比例3
[0096]
与实施例1相比,不同之处在于在步骤s3中,第一溶液中不加入pegda,并且将第二溶液替换成等量的间充质干细胞上清液,然后将第一溶液和第二溶液按1:1等体积混合,通过注射器挤出到模具后,立即用光强45mw/cm2,波长365nm的紫外光进行照射,照射15min,得到仅具有醛基化和马来酰化透明质酸交联网络的水凝胶。
[0097]
对比例4
[0098]
与实施例1相比,不同之处在于,在步骤s3中,将透明质酸溶液换成等量去离子水,然后加入pegda,作为第一溶液,并且将第二溶液替换成等量的间充质干细胞上清液,然后将第一溶液和第二溶液按1:1等体积混合,通过注射器挤出到模具后,立即用光强45mw/cm2,波长365nm的紫外光进行照射,照射15min,得到仅由pegda交联的水凝胶。
[0099]
具体条件参数及制得的水凝胶的性能测试结果如表5所示。表中pegda的量以透明质酸溶液为1ml为标准。
[0100]
表5实施例1、12及对比例1-4的制备条件及性能测试结果
[0101][0102][0103]
由表5可以看出,对比例1、2的机械强度低于实施例1,这是由于实施例1中制备的凝胶是由动态席夫碱网络以及化学网络共同构成,两种网络的协同作用使得双网络凝胶的力学性能远大于任一单网络凝胶。
[0104]
对比例2制得的凝胶仅由光聚合形成的化学网络构成,因此,其完全没有自愈合性能。对比例1的凝胶是由醛基化和马来酰化透明质酸与3,3
’‑
二硫代二丙酰肼通过席夫碱反应制得,其凝胶网络是一种可逆的动态网络,自愈合效率可达100%,而实施例1在动态席夫碱网络中引入化学网络后,其自愈合效率仍然与对比例1相当,这说明化学网络的引入并没有影响凝胶的自愈合性能,反而使得该凝胶能够同时具有较好的自愈合性能和力学性能,大大扩宽了凝胶的应用范围。
[0105]
对比例4中仅含少量pegda,并不能凝胶。对比例3是将醛基化和马来酰化透明质酸直接进行紫外光照,其凝胶网络结构不稳定,在一段时间后便会坍塌。将对比例3与对比例2相比可知,在加入pegda进行光照后,不仅提高了凝胶的机械强度,增加了凝胶的稳定性,还缩短了凝胶的成型时间。这主要是因为,虽然醛基化和马来酰化透明质酸上有一定量的双键,但由于其分子链较长,在紫外光照射时,分子链的运动由于缠绕受到限制,因此,大量双键被包裹在分子链中并没有反应形成化学交联网络,导致其力学性能较差。而pegda作为一种小分子交联剂混入该体系中,不仅增加了溶液中碳碳双键的含量,还能均匀地分布在醛基化和马来酰化透明质酸的溶液中,经紫外光照射后,不仅能促进醛基化和马来酰化透明
质酸上碳碳双键的反应,还有利于形成均匀的化学交联网络,从而大大提高了凝胶的力学性能。
[0106]
将对比例1与实施例12相比也可知,对比例1的凝胶仅由席夫碱反应制得,而实施例12则是由醛基化和马来酰化透明质酸上的双键形成的化学网络以及醛基与酰肼形成的动态可逆网络构成,其断裂强度仅略大于对比例1,这也能说明醛基化和马来酰化透明质酸上的双键反应较少,形成的化学网络较为疏松,并不能大幅度提高凝胶的力学性能。
[0107]
与此同时,从表5中可以看出,对比例1和对比例2分别基于“schiff”点击反应和光聚合形成的凝胶,已经可以在很短的时间内形成,而实施例1和实施例12的凝胶基于光聚合与席夫碱反应的协同作用,其凝胶时间进一步缩短,而pegda小分子交联剂的加入使得凝胶时间缩短至30s,更有利于凝胶的快速形成,避免了凝胶溶液的延流。这拓宽了其在组织工程、药物释放、伤口愈合等领域的应用。
[0108]
综上所述,本发明提供的可负载间充质干细胞上清液成分的可注射光增强自愈合水凝胶,以透明质酸为原料,通过在透明质酸分子链上接枝马来酸酐引入碳碳双键,同时,利用高碘酸钠对其进行氧化从而引入了醛基,并且在该体系中混入pegda。通过醛基化和马来酰化透明质酸与3,3
’‑
二硫代二丙酰肼之间的席夫碱反应构建了一种可逆动态网络,从而赋予了凝胶优异的自愈合性能;同时,利用醛基化和马来酰化透明质酸与pegda经紫外光聚合形成的化学网络,进一步提高凝胶的机械强度,使得该凝胶同时具有优异的自愈合性能和力学性能。与此同时,由于水凝胶的可注射性以及高度多孔的网络结构,有利于负载间充质干细胞上清液中的成分,并在注射过程中递送细胞活性物质,而通过对水凝胶聚合物进行多种化学修饰,该水凝胶中含有大量醛基、氨基、羧基,可以与多种细胞因子结合,能更好地实现活性物质的缓慢长时间释放。
[0109]
以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。