新型冠状病毒mrna疫苗及其制备方法与应用
技术领域
1.本发明属于基因工程技术领域,具体而言是关于一种新型冠状病毒(sars-cov-2)mrna疫苗抗原设计、疫苗及其制备方法与应用。
背景技术:
2.冠状病毒(coronavirus)是自然界广泛存在的一类rna病毒,因该病毒形态在电镜下观察类似王冠而得名。冠状病毒是一个成员众多的大家族,仅感染脊椎动物,可引起人和动物呼吸道、消化道和神经系统疾病。新型冠状病毒(sars-cov-2)是2019年发现的一种新型冠状病毒。在发现sars-cov-2之前,已知感染人的冠状病毒有6种,其中4种在人群中较为常见,致病性较低,一般仅引起类似普通感冒的轻微呼吸道症状;而另外两种病毒,sars冠状病毒和mers冠状病毒,致病性较高。sars-cov-2传染性强,可造成肺部炎症,严重的可引发呼吸衰竭,进而死亡。
3.新型冠状病毒的结构蛋白由刺突(s)、包膜(e)、膜(m)和核衣壳(n)蛋白组成。其中s蛋白以三聚体的形式呈现在病毒表面,形成“冠状”刺突结构,并介导病毒与细胞受体结合及膜融合。s蛋白具有很高的免疫原性,可以激活t细胞免疫应答,并能够诱导中和抗体的产生。s蛋白是目前冠状病毒疫苗和药物研发的重要靶点。已有多项研究表明针对sars-cov和mers-cov s蛋白研发的疫苗可提供良好的免疫保护。相对于其他新冠病毒结构蛋白,s蛋白分子量较大,细胞外泌难度较大,通过结合高效外泌型信号肽能有效提高s蛋白外泌效率。同时,经过序列优化后能提高s蛋白在细胞中的表达量,增强有效抗原的表达。此外,通过在s蛋白c端插入foldon三聚化结构域获得翻译产物为融合前构象的s蛋白编码序列。融合前构象的s蛋白对应的mrna序列,可以在体内诱导高滴度的中和抗体,安全性更高。
4.mrna疫苗技术可以作为快速灵活的技术平台,有效应对各种新兴病毒的威胁。因此mrna疫苗被认为是对抗新型冠状病毒最有潜力的一种疫苗。传统的灭活疫苗、减毒疫苗以及多肽疫苗,研发周期长,生产工艺复杂,难以满足突发公共卫生事件的需求。此外,与dna疫苗相比,mrna疫苗有着明显优势。首先,mrna疫苗比dna疫苗药效更加明显。dna疫苗需要穿过细胞膜和核膜才能表达成抗原,因此当没有足够剂量的dna到达细胞核时,疫苗将无法激活体内免疫系统以及诱导抗体的产生。而mrna只需要穿过细胞膜在细胞质中就可以高效表达抗原蛋白。其次,mrna疫苗比dna疫苗生物安全性更高。外源dna有一定几率整合到人体基因组中,因此dna疫苗有引起基因组突变的风险。而mrna没有基因整合到基因组中的风险。其次,mrna被翻译成蛋白质后易被降解,其瞬时表达的特性不仅确保了mrna药物的安全性,而且使其剂量可控,避免了疫苗药物长期暴露引起的抗原免疫耐受(对特定抗原无反应的状态)。另外,由于不需要动物来源的病毒参与到疫苗研发过程中,规避了病毒和动物使用风险,同时可以短期内获得有效抗原。
5.总体而言,跟传统的疫苗相比,mrna疫苗生产周期短,生产工序更简单,成本更低。mrna疫苗从抗原序列设计到生产只需要6周时间,而传统疫苗的生产最快也要5-6个月。mrna疫苗可以冻干并在室温下保存6-18个月,而传统的疫苗需要保存在2-8℃。因此,mrna
疫苗保存时间更久,不需要冷链,运输成本更低。传统疫苗对很多新型病毒有心无力,而mrna疫苗适用性更广,序列可以灵活设计,以应对不同的病原体。
技术实现要素:
6.本发明的一个目的在于提供针对新型冠状病毒(sars-cov-2)的mrna疫苗的抗原。
7.本发明的另一目的在于提供针对新型冠状病毒(sars-cov-2)的疫苗。
8.本发明的另一目的在于提供针对新型冠状病毒(sars-cov-2)的mrna疫苗的制备方法。
9.本发明的另一目的在于提供用于制备针对新型冠状病毒(sars-cov-2)的疫苗的mrna。
10.本发明的另一目的在于提供用于制备所述针对新型冠状病毒(sars-cov-2)的mrna的dna。
11.本发明的另一目的在于提供用于制备所述针对新型冠状病毒(sars-cov-2)的mrna的载体。
12.本发明的另一目的在于提供针对新型冠状病毒(sars-cov-2)的mrna疫苗的应用。
13.新型冠状病毒(sars-cov-2)呈现球形椭球形,直径在80-120nm。在电子显微镜下,病毒粒表面有球棒状的突出部分,由三聚体刺突糖蛋白(spike,s)组成。病毒的包膜由膜糖蛋白(membrane glycoprotein,m)构成,通过三个跨膜结构域嵌入病毒包膜里中。此外,少量的小的跨膜蛋白-包膜(envelope,e)蛋白也出现在包膜中。最后,核衣壳(nucleocapsid,n)蛋白以串珠的形式结合到rna基因组上,形成螺旋对称的核衣壳。研究结果显示,s蛋白是冠状病毒引起机体免疫反应的主要成分。新型冠状病毒能利用一种紧密糖基化的、同源三聚体i类融合凸起蛋白(s蛋白)来进入宿主细胞中,s蛋白能以一种相对稳定的融合前构象存在,并经历剧烈的结构重排来促进病毒膜结构与宿主细胞膜进行融合,这一过程是由病毒s1亚单位与宿主受体的结合所诱发,其能破坏融合前三聚体的稳定性,从而导致s1亚单位脱落,并促使s2亚单位转变为高度稳定的融合后构象。为了能与宿主受体相结合,s1的受体结合结构域会经历链状样的构象运动,这种运动方式会暂时隐藏或暴露受体结合的决定因素,这两种状态被认为是“向上”或“向下”构象,其中向下的构象对应的是受体不可及的状态,而向上构象则对应着受体可达的状态,后者被认为具有不稳定。
14.本发明中,为提供针对新型冠状病毒(sars-cov-2)的mrna疫苗,在野生型s蛋白的基础上对其氨基酸序列进行了改造,设计了mrna编码的病毒抗原片段,然后合成编码病毒抗原片段的mrna,以实现对新型冠状病毒的免疫。具体而言,本发明采用基因工程技术来使s稳定在其融合前构象中,防止结构重排,并暴露出抗原性较佳的抗原表位可引起更高的中和抗体应答。通过生物信息学和基因工程学方法,本发明分别将s蛋白编码序列进行改造使其翻译产物稳定在融合前构象。相关抗原序列通过基因工程技术克隆到质粒中用于mrna合成。
15.一方面,本发明提供了如下(a)或(b)的蛋白:
16.(a)seq id no.1所示氨基酸序列组成的蛋白;
17.(b)由seq id no.1所示氨基酸序列经过取代、缺失和/或添加一个或几个氨基酸且与seq id no.1所示氨基酸序列组成的蛋白具有相同功能的衍生蛋白。
18.seq id no.1所示氨基酸序列组成的蛋白,为本发明的在野生型s蛋白基础上修饰改进后的蛋白,本发明中亦称其为融合前构型s蛋白。本发明根据新型冠状病毒(sars-cov-2)的基因组测序结果,设计并优化s序列,使得所表达出的s蛋白处于融合前构型,以实现人源细胞高效表达增加免疫源性。与野生型s蛋白氨基酸序列相比,本发明的融合前构型s蛋白更易诱导中和抗体的产生。
19.根据本发明的具体实施方案,本发明中,所述由seq id no.1所示氨基酸序列经过取代、缺失和/或添加一个或几个氨基酸且与seq id no.1所示氨基酸序列组成的蛋白具有相同功能的衍生蛋白,至少包含seq id no.1所示氨基酸序列c末端连续至少15个氨基酸的序列。
20.根据本发明的具体实施方案,所述与seq id no.1所示氨基酸序列组成的蛋白具有相同功能是指与seq id no.1所示氨基酸序列组成的蛋白具有“更易诱导中和抗体的产生”和/或“增加免疫源性”(与野生型s蛋白相比)的功能。
21.另一方面,本发明还提供了所述的改进的s蛋白(融合前构型s蛋白和/或其衍生蛋白)作为抗原在制备疫苗中的应用。
22.另一方面,本发明还提供了编码本发明所述的改进的s蛋白的dna。根据本发明的优选具体实施方案,所述dna的核苷酸序列包括seq id no.10、seq id no.11、seq id no.12或seq id no.13所示序列。
23.另一方面,本发明还提供了一种表达载体,其中含有本发明的所述的dna(编码本发明所述的改进的s蛋白的dna)。
24.另一方面,本发明还提供了编码本发明所述的改进的s蛋白的mrna。
25.根据本发明的优选具体实施方案,所述mrna是本发明前述的dna进行体外转录得到。
26.根据本发明的优选具体实施方案,本发明的mrna,其核苷酸序列包括seq id no.2、seq id no.3、seq id no.4或seq id no.5所示序列。
27.根据本发明的优选具体实施方案,本发明的mrna,其核苷酸序列5’端还可包括佐剂序列。例如,所述佐剂序列可以为促进蛋白分泌表达的核苷酸序列。根据本发明的优选实施方案,所述佐剂序列包括seq id no.6、seq id no.7、seq id no.8或seq id no.9所示序列。根据本发明的更具体实施方案,所述的mrna包括seq id no.6、seq id no.7、seq id no.8或seq id no.9所示序列分别与seq id no.2、seq id no.3、seq id no.4或seq id no.5组合序列所示的mrna(seq id no.6、seq id no.7、seq id no.8或seq id no.9任一所示序列位于seq id no.2、seq id no.3、seq id no.4或seq id no.5任一所示序列的5’端)。根据本发明的更优选的实施方案,所述的mrna包括seq id no.6、seq id no.7、seq id no.8或seq id no.9所示序列与seq id no.4组合序列所示的mrna。
28.另一方面,本发明还提供了所述mrna的制备方法。
29.根据本发明的具体实施方案,本发明的所述mrna的制备方法包括:
30.编码病毒抗原片段mrna的合成:合成编码融合前构象s蛋白的dna片段(可自行或商业化合成),并克隆到质粒作为模板进行体外转录(in vitro transcription,ivt)得到未加帽的mrna;
31.mrna的加帽:在加帽酶催化下,以给未加帽的mrna的5'端加上帽子结构,得到加帽
的mrna分子;
32.mrna的纯化:将所述加帽的mrna进行氯化锂/乙醇沉淀、离心柱、氯萃取/乙醇沉淀或凝胶纯化,以获得纯化后的mrna。
33.另一方面,本发明还提供了所述的mrna抗原设计在制备新型冠状病毒mrna疫苗中的应用。
34.另一方面,本发明还提供了一种疫苗,其中包括本发明所述的mrna中的一种或多种。
35.根据本发明的具体实施方案,本发明的疫苗是针对新型冠状病毒(sars-cov-2)的预防性疫苗,其中还可包括用于溶解mrna的pbs溶液。
36.本发明的有益效果:
37.本发明的技术,是先通过生物信息学方法设计新型冠状病毒(sars-cov-2)中融合前构象的s蛋白序列,以实现人源细胞高效表达增加免疫源性;然后通过体外转录方法合成编码病毒抗原片段的mrna,以实现对新型冠状病毒的免疫。整个mrna疫苗生产周期短、工艺操作简单、生产成本低,保存时间久,不需要冷链,便于运输。传统疫苗对很多新型病毒引起的公共卫生事件无法做到快速响应,而mrna疫苗适用性更广,序列可以灵活设计,以应对不同的病原体,针对急性传染病疫苗快速研发有及其重要的作用。
附图说明
38.图1为本发明的mrna疫苗示意图。
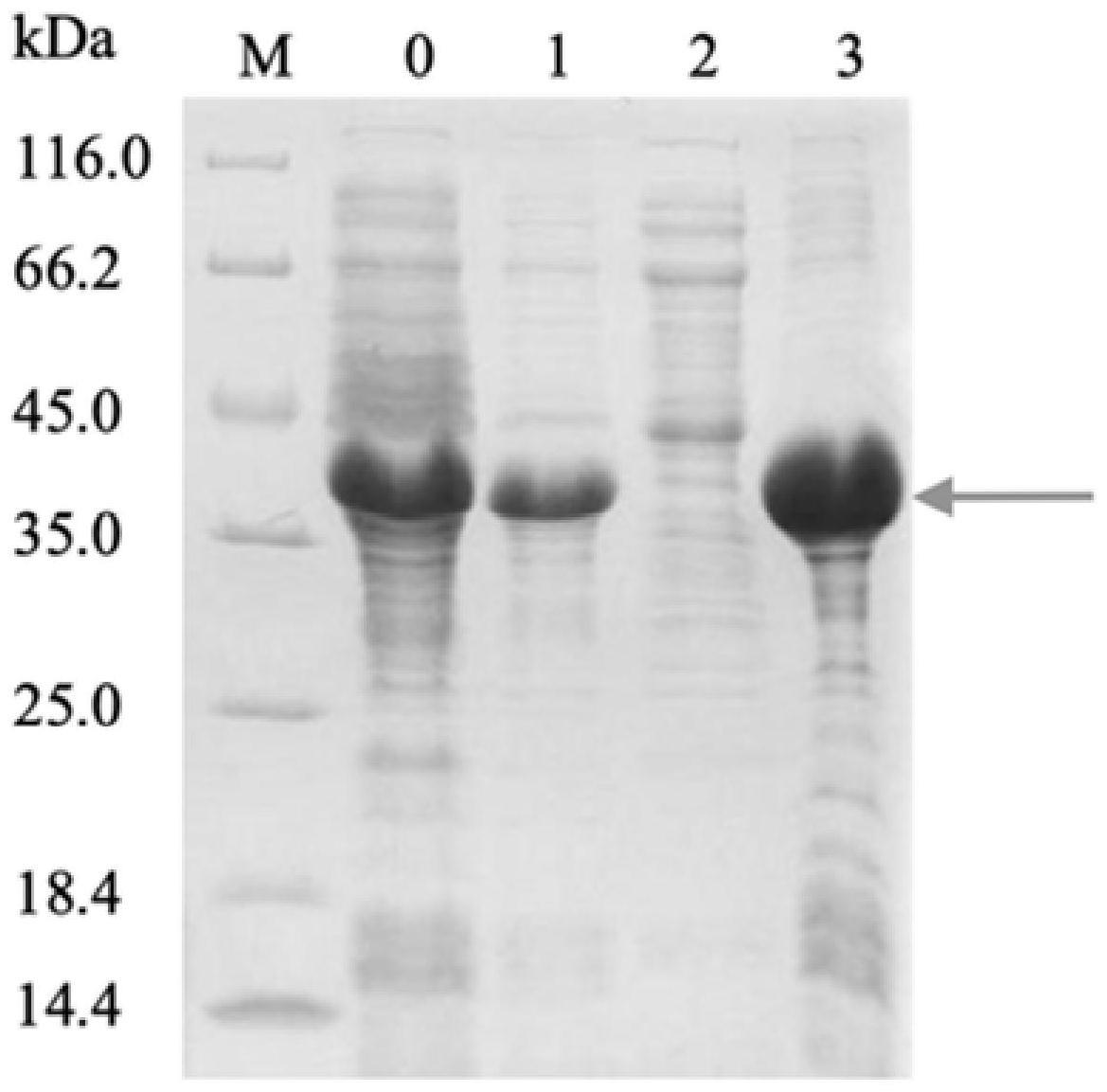
39.图2显示本发明实施例1中经序列优化后的编码融合前构型s蛋白抗原片段的不同mrna疫苗表达结果。其中,m:蛋白marker,1#:seq id no.2编码的融合前构型s蛋白,2#:seq id no.3编码的融合前构型s蛋白,3#:seq id no.4编码的融合前构型s(prefusion)蛋白,4#:seq id no.5编码的融合前构型s(prefusion)蛋白。
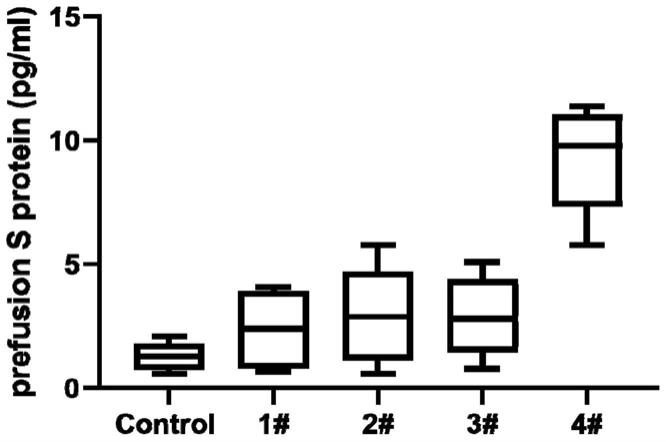
40.图3显示本发明实施例2中带有不同佐剂序列(seq id no.6-9)的mrna(seq id no.4)分别转染293t细胞24小时后细胞外泌结果。其中,control:对照组mrna(seq id no.4),1#:带有seq id no.6佐剂序列的mrna(seq id no.4),2#:带有seq id no.7佐剂序列的mrna(seq id no.4),3#:带有seq id no.8佐剂序列的mrna(seq id no.4),4#:带有seq id no.9佐剂序列的mrna(seq id no.4)。
41.图4显示本发明实施例3中不同佐剂与实施例2中优选方案mrna(seq id no.4)接种小鼠后s特异性抗体滴度结果。
42.图5显示本发明实施例4中不同佐剂与实施例2中优选方案mrna(seq id no.4)接种小鼠后中和抗体滴度结果。图中每条曲线代表一只小鼠。
具体实施方式
43.下面将结合本发明实施例及其附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
44.且下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已
aca aca tac tgt tcg aca aca tcg aca gac ttc cct aca aca tcg cga atg cac tct ttc ctg cct ctc acc cac aag gac act
75.实施例1
76.293t细胞传代后约24小时,观察6孔板内的细胞状态,汇合度在90%左右即可进行转染。取200μl opti-mem,加入10μg经密码子优化后编码s蛋白抗原片段的不同mrna,用枪头轻轻吹打混匀,再加入60μl pei(浓度1mg/ml),立即置于漩涡振荡器上振荡10次,每次1s,充分混匀,静置10min。将配制好的转染体系,直接均匀滴加进入培养的细胞中,再前后左右摇匀,使得转染体系均匀分布于细胞上。转染后6h换液,吸掉旧的培养基,每孔换为2ml新鲜培养基(90%dmem 10%fbs)。转染后30h收获。吸掉旧的培养基,用1ml pbs清洗一遍。吸掉pbs,继续用1ml pbs将细胞吹打下来,收集于1.5ml 离心管中,300g离心5min。将离心后的上清尽量吸去干净,沉淀的细胞进行裂解,提取总蛋白进行western blot检测。电泳转膜后进行抗体孵育,s蛋白一抗孵育:取3μl sars-cov-2(2019-ncov)spike antibody(义翘神州,p/n 40591-mm42)稀释到3ml 5%脱脂牛奶中(稀释比1:1000),置于4℃摇床过夜孵育,内参蛋白抗体为gapdh(proteintech,p/n 60004-1-ig);二抗孵育:s蛋白和gapdh蛋白的抗体均是mouse来源的,因此用相同的二抗:取1μlhrp-conjugated affinipure goat anti-mouse igg(h l)(proteintech,p/n sa00001-1)稀释到5ml 5%脱脂牛奶中(稀释比1:5000),常温孵育1h;
77.实验结果如图2所示,其中,m:蛋白marker,1#:seq id no.2编码的融合前构型s蛋白,2#:seq id no.3编码的融合前构型s蛋白,3#:seq id no.4编码的融合前构型s(prefusion)蛋白,4#:seq id no.5编码的融合前构型s(prefusion)蛋白。
78.结果显示,采用seq id no.4编码的融合前构型s蛋白表达量明显高于seq id no.2、seq id no.3和seq id no.5编码的融合前构型s蛋白。
79.实施例2
80.本实施例中,带有不同佐剂序列(seq id no.6-9)的mrna(seq id no.4)分别转染293t细胞24小时后提取细胞上清,见此上清中s蛋白外泌水平。具体步骤如下:
81.1、包被:将鼠抗s蛋白单抗sars-cov-2(2019-ncov)spike antibody(义翘神州,p/n 40591-mm42)用coating buffer稀释成1000x的溶液,加入到酶标板中,每孔加入的体积为100ul,每个稀释度重复3个孔,盖上封板膜,4℃过夜包被。
82.2、洗板:包被好的96孔板,倒出包被液,到扣吸水纸上,使劲扣板,直到孔中无残留为止。配制洗脱液,用去离子水稀释50x的washing buffer,加入到洗板机的进液瓶中,设置程序,每孔洗板体积设为300ul,重复洗4次。
83.3、封闭:洗好的板,扣干里面的溶液,按每孔250ul的体积加入blocking buffer,随后封上封板膜,室温封闭2h。
84.4、洗板:封闭好的酶标板按照步骤3完成洗板。
85.5、血清或标准品孵育:将血清或标准品(义翘神州,40591-v08h)梯度稀释,按照每孔100ul的体积加入洗好的96孔板中,随后封上封板膜室温下孵育1.5h。
86.6、洗板:按照步骤3完成洗板其中洗板次数增加为6次。
87.7、一抗孵育:用dilution buffer稀释兔抗s蛋白抗体sars-cov-2(2019-ncov)spike antibody(义翘神州,p/n 40589-t62)(1:5000),按照每孔100ul的体积加入洗好的
96孔板中,随后封上封板膜室温下孵育1.5h。
88.8、洗板:按照步骤3完成洗板其中洗板次数增加为6次。
89.9、加入二抗:用dilution buffer 稀释hrp标记山羊抗兔igg(abcam,ab6721),稀释倍数为10000x,稀释好的抗体按照每孔100ul的体积加入酶标板中,封上封板膜,室温下避光孵育1h。
90.10、洗板:按照步骤8完成洗板,此步骤务必洗干净板,扣干溶液。
91.11、显色:加入tmb buffer 100ul,避光显色20-30分钟,此时阳性样品显蓝色。
92.12、终止:加入stop buffer 100ul,10分钟内在酶标板上读数,设置吸收波长450nm。
93.13、根据标准品孔光吸收值绘制标准曲线,线性回归的相关系数应大于0.0995。根据供试品吸光度的大小计算样品中s蛋白的含量。
94.实验结果如图3所示。其中,control:对照组mrna(seq id no.4),1#:带有seq id no.6佐剂序列的mrna(seq id no.4),2#:带有seq id no.7佐剂序列的mrna(seq id no.4),3#:带有seq id no.8佐剂序列的mrna(seq id no.4),4#:带有seq id no.9佐剂序列的mrna(seq id no.4)。带有seq id no.7佐剂序列的mrna(seq id no.4)所编码的融合前构型s蛋白外泌效果明显高于带有seq id no.6/seq id no.8/seq id no.9佐剂序列的mrna(seq id no.4)所编码的融合前构型s蛋白。
95.实施例3
96.本实施例中,将分别带有seq id no.5-9佐剂序列的mrna(seq id no.4)分别在第1天和第14天两次注射接种6周龄balb/c小鼠,在第14天和第35天取小鼠血清,检测血清中抗s蛋白特异性抗体的滴度。
97.1、包被:将s蛋白(义翘神州,40591-v08h)用coating buffer稀释成200ng/ml的溶液,加入到酶标板中,每孔加入的体积为100ul,每个稀释度重复3个孔,盖上封板膜,4℃过夜包被。
98.2、洗板:包被好的96孔板,倒出包被液,到扣吸水纸上,使劲扣板,直到孔中无残留为止。配制洗脱液,用去离子水稀释50x的washing buffer,加入到洗板机的进液瓶中,设置程序,每孔洗板体积设为300ul,重复洗4次。
99.3、封闭:洗好的板,扣干里面的溶液,按每孔250ul的体积加入blocking buffer,随后封上封板膜,室温封闭2h。
100.4、洗板:封闭好的酶标板按照步骤3完成洗板。
101.5、血清孵育:用dilution buffer将小鼠血清稀释成40x,400x,4000x,40000x,400000x,4000000x,40000000x,按照每孔100ul的体积加入洗好的96孔板中,随后封上封板膜室温下孵育1.5h。
102.6、洗板:按照步骤3完成洗板其中洗板次数增加为6次。
103.7、加入二抗:用dilution buffer 稀释hrp标记山羊抗小鼠igg,稀释倍数为10000x,稀释好的抗体按照每孔100ul的体积加入酶标板中,封上封板膜,室温下避光孵育1h。
104.8、洗板:按照步骤8完成洗板,此步骤务必洗干净板,扣干溶液。
105.9、显色:加入tmb buffer 100ul,避光显色20-30分钟,此时阳性样品显蓝色。
106.10、终止:加入stop buffer 100ul,10分钟内在酶标板上读数,设置吸收波长450nm。
107.根据标准品孔光吸收值绘制标准曲线,线性回归的相关系数应大于0.0995。根据供试品吸光度的大小计算样品中s蛋白特异性抗体的残留含量。
108.实验结果如图4所示,其中control:对照组mrna(seq id no.4),1#:带有seq id no.6佐剂序列的mrna(seq id no.4),2#:带有seq id no.7佐剂序列的mrna(seq id no.4),3#:带有seq id no.8佐剂序列的mrna(seq id no.4),4#:带有seq id no.9佐剂序列的mrna(seq id no.4)。
109.结果显示,带有seq id no.9佐剂序列的mrna(seq id no.4)候选疫苗免疫效果优于带有seq id no.6/seq id no.7/seq id no.8佐剂序列的mrna(seq id no.4)的候选疫苗。
110.实施例4
111.在本实施例中,将带有seq id no.9佐剂序列的mrna(seq id no.4)分别以低剂量(1ug/只)和高剂量(30ug/只)在第1天和第14天两次注射接种6周龄balb/c小鼠,在第35天取小鼠血清,通过focus reduction neutralization tests(frnt)实验检测中和抗体滴度。通过将标准剂量的新冠病毒2019-ncov与56℃灭活血清的两倍连续稀释液混合在37℃下孵育1小时。然后将病毒-血清混合物(100μl)接种到培养的293t ace2过表达细胞。孵育3天后,通过与生物素偶联的s蛋白单克隆抗体,抗生蛋白链菌素-hrp和trueblue过氧化物酶底物(kpl)进行连续孵育,将板进行福尔马林固定,透化,封闭和染色。未加血清的阳性对照组焦点数目最高,实验组焦点计数≤50%时做为中和临界值,并且计算了几何平均值作为技术重复。
112.结果如图5显示,其中,图片a:带有seq id no.9佐剂序列的mrna(seq id no.4)低剂量组(1ug/只),图片b:带有seq id no.9佐剂序列的mrna(seq id no.4)高剂量组(30ug/只)。中和抗体滴度与候选疫苗接种剂量成正比例关系,高剂量(30ug/只)组中和抗体保护效果id50=260.4明显优于低剂量(1ug/只)组中和抗体保护效果id50=41.03。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。