1.本发明属于细胞生物学技术领域,具体涉及一种人神经祖细胞分化方法及其在毒性测试中的应用。
背景技术:
2.化学品安全涉及食品、环境和职业安全等领域,环境化学物污染、职业环境化学物超标、食品安全和环境相关健康问题等已成为目前社会经济发展的重大问题。传统化学品安全性评价以动物实验评价为主,具有花费高、时间长、种属差异以及动物福利等问题。动物替代试验方法应用是目前国际上化学品安全性评价的一种趋势和策略,可以减少实验动物使用、降低花费、缩短时间和提高评价效率等。目前已经有多个国家包括欧盟、美国、日本和中国等建立各自的替代实验方法研究中心。已有大量的替代方法经过开发验证,极大的减少了动物的使用和评价速度。
3.神经发育毒性评价由于其复杂性和特殊性,目前尚未有好的替代方法进行评价。传统的神经发育毒性需要涉及大量动物的使用,需要花费大量的成本和时间。美国环境保护署(oppts 870.630)和经济合作与发展组织(oecd tg 426)均有发布dnt研究指南,并且由美国环保署和加拿大卫生部联合开发杀虫剂登记系统中对dnt数据如何解释编写了相关指南,但目前在美国、欧盟或是其他地区并没有进行常规dnt测试。除非在成年啮齿类动物观察到化学物的神经毒性或内分泌影响,否则法律不要求进行dnt检测。与此同时成熟大脑中不存在某些神经发育过程,因此会错失很多导致dnt的有害物质。这些都是解释到目前为止为什么只有少数环境物质(总共12种)被归类为人类发育神经毒物。因此迫切需要开发一种快速、成本效益高的标准化dnt替代方法。因此迫切需要开发一种快速、成本效益高的标准化dnt替代方法。
4.在过去的15年中,人们一直在努力建立、科学验证和建立dnt体外评价的试验方法,已经取得了阶段性进展。人源干细胞如胚胎干细胞、多能干细胞、诱导多能干细胞、神经祖细胞等由于具有分化成为各种类型神经细胞的潜能,具有开发高通量检测的潜能且不存在物种之间外推的问题,因此被认为是开发dnt体外测试方法的首选细胞模型。目前研究者根据神经发育的各个阶段,采用不同发育阶段的人源干细胞模型建立一系列体外测试方法,然而到目前为止,尚未有一种标准的可用于神经发育毒性评价的细胞模型。
技术实现要素:
5.本发明旨在克服背景技术中的问题,提供一种人神经祖细胞分化方法及其在毒性测试中的应用,神经祖细胞分化为神经元的细胞模型,其神经元具有人源神经元的形态和特征,并可以将该细胞应用于神经发育毒性的体外检测。
6.为达到上述目的,本发明采用如下技术方案:一种人神经祖细胞分化方法,包括如下步骤:
7.s1:使用预冷枪头将matrigel吸取,加入至预冷的advanced dmem/f12培养基稀
释,制成matrigel包被液,并将matrigel包被液预冷;
8.s2:将预冷matrigel包被液转移至培养皿中,并放置于培养箱中静置,得matrigel包被培养皿;
9.s3:将融合度达到70-80%的hnpc细胞,使用pbs洗涤,再使用accutase消化酶进行消化,之后采用pbs冲洗转入离心管中;
10.s4:将离心管中的细胞离心去上清,采用npc维持培养基并加入rock inhibitor重悬细胞后,接种于matrigel包被培养皿中进行培养;
11.s5:第二天吸弃matrigel包被培养皿中液体,换新鲜的神经元分化培养基进行培养,每两天换液一次,培养至第七天出现神经元特征。
12.一种神经祖细胞分化为神经元细胞的应用,将权利要求1至8获得的神经元细胞应用于神经发育毒性检测,应用方法包括如下步骤:
13.步骤1、使用加入rock inhibitor的npc维持培养基重悬,接种于matrigel包被液包被好的96孔板中,放入培养箱中培养;
14.步骤2、第二天换液,将化学品溶于神经元分化培养基中,用于换液处理96孔板细胞48小时,每隔48小时换新鲜配置的化学品用于换液,处理至第7天;
15.步骤3、加入cck8孵育,孵育时间为30分钟到1个小时;
16.步骤4、用酶标仪测定在450nm处的吸光度。
17.在本发明的一种优选实施方式中,npc维持培养基的制备方法如下:
18.步骤一:将advanced dmem/f12培养基与neurobasal培养基按照体积比为1:1进行混合,得混合培养基;
19.步骤二:向混合培养基内添加1%的胎牛血清、0.4μg/ml皮质醇、b27添加剂、20ng/ml表皮生长因子、20ng/ml成纤维生长因子、100u/ml青霉素和100μg/ml链霉素,制得成品。
20.在本发明的一种优选实施方式中,神经元分化培养基的制备方法如下:
21.步骤a、advanced dmem/f12培养基与neurobasal培养基按照体积比为1:1进行混合,得混合培养物;
22.步骤b、向混合培养物内添加2%的胎牛血清、b27 plus添加剂,40ng/ml成纤维生长因子、2mmol/l谷胱甘肽、200μmol/l维生素c、100u/ml青霉素和100μg/ml链霉,制得成品。
23.在本发明的一种优选实施方式中,s1中,matrigel与advanced dmem/f12培养基的体积比为1:100。
24.在本发明的一种优选实施方式中,s2中,培养箱内的培养条件是37℃、5%co2。
25.在本发明的一种优选实施方式中,s3中,pbs和accutase消化酶使用前预温,预温的温度为37℃,并且时间不超过10分钟。
26.在本发明的一种优选实施方式中,s3中,pbs洗涤细胞的次数为1次,accutase分散酶消化的时间不超过5分钟,消化温度为37℃。
27.在本发明的一种优选实施方式中,s4中,离心条件为1200转4分钟,rock inhibitor加入终浓度为5μmol/l。
28.在本发明的一种优选实施方式中,步骤1中,hnpc细胞接种密度为8000个细胞/孔,rock inhibitor加入终浓度为5μmol/l,96孔板中每孔加入100μlmatrigel包被液,培养箱培养条件为37℃、5%co2。
29.本发明的原理及其有益效果:(1)本发明提供的一种ihpsc诱导为hnpc细胞培养扩增方法,获得的hnpc细胞能够稳定传代并保持npc的特征,培养方法简单易于操作;
30.(2)本发明提供的hnpc能够用于化学品神经发育毒性的检测。
31.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
32.本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
33.图1是hnpc细胞定向诱导为神经元流程图。
34.图2是神经元特征性标志物βiii-tublin表达的免疫荧光图。
具体实施方式
35.下面详细描述本发明的实施例,实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
36.在本发明的描述中,需要理解的是,术语“纵向”、“横向”、“竖向”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
37.在本发明的描述中,除非另有规定和限定,需要说明的是,术语“安装”、“相连”、“连接”应做广义理解,例如,可以是机械连接或电连接,也可以是两个元件内部的连通,可以是直接相连,也可以通过中间媒介间接相连,对于本领域的普通技术人员而言,可以根据具体情况理解上述术语的具体含义。
38.本技术提供一种人神经祖细胞分化方法,预先将ihpsc细胞(人体多功能干细胞)诱导为hnpc细胞(神经祖细胞),再将hnpc细胞定向分化为神经元细胞。
39.诱导方法如下:(1)采用1%ldev-free hesc-qualified reduced growth factor basement membrane matrix(matrix),使用预冷的advanced dmem/f12培养基稀释,稀释比例为1:100,matrix需使用预冷的枪头进行吸取,获得的稀释液进行铺板,37℃孵育1h;
40.(2)状态良好的融合度为70-80%ipsc细胞经消化液消化吹散成细胞团块(5-50个细胞)接种于包被好的6cm培养皿中,接种密度约为1:4左右,注意整个过程需轻柔;
41.(3)当ips的融合度达到20%左右,换液加入预温的psc诱导培养基进行培养,在培养过程中每天换液,观察细胞形态,使用枪头挑去死亡细胞团,第七天的时候完成分化。具体的分化过程所发生的变化见图1。
42.将hnpc细胞定向分化为神经元细胞,包括如下步骤:
43.s1:使用预冷200μl枪头进行吸取1%matrigel,并将1%matrigel加入至预冷的advanced dmem/f12培养基进行稀释,稀释体积比为1:100,制成matrigel包被液,再将
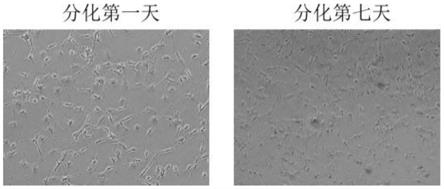
matrigel包被液预冷(预冷方式可以采用放置于冰块上或者其他冷源上)。
44.s2:将matrigel包被液,按照每个6cm培养皿3ml的量,送入至温度条件为37℃,co2浓度为5%的培养箱中孵育1h,试用前弃去液体,得matrigel包被培养皿;本实施例中,advanced dmem/f12培养基需提前预冷30分钟以上(如:放置于冰或其他冷源上),200μl枪头需在-20℃环境下(如:冰箱或其他冷源)预冷1小时以上,matrigel包被培养皿始终预冷(例如:放置于冰块上或者其他制冷设备上)。
45.s3:将状态良好的融合度为70-80%的hnpc细胞,使用pbs(无钙镁)洗1次,再使用accutase消化酶进行消化,消化时间最长为5分钟,之后采用pbs(无钙镁)进行冲洗转入15ml离心管中;pbs和accutase消化酶使用件进行预温,预温的温度为37℃。
46.s4:将收集好的细胞马上进行离心,1200转4分钟,弃去上清,使用加入rock inhibitor(终浓度为5μmol/l)的npc维持培养基重悬hnpc细胞接种于matrigel包被好的6cm培养皿中,放入37℃、5%co2培养箱中培养,6cm培养皿接种密度为1.5
×
106个细胞;
47.s5:第二天吸弃matrigel包被培养皿中液体,换新鲜的神经元分化培养基进行培养,每两天换液一次。
48.按照上述步骤培养细胞获得神经元,分化第一天时,每个细胞上的轴突较短并且平均为2-3个轴突,第七天时轴突边长并且每个细胞上的轴突为4-6个,如图1。
49.本实施例中,npc维持培养基的制备方法如下:将advanced dmem/f12培养基与neurobasal培养基按照体积比为1:1进行混合,同时添加1%的胎牛血清,以及0.4μg/ml皮质醇,b27添加剂,20ng/ml表皮生长因子,20ng/ml成纤维生长因子,100u/ml青霉素,100μg/ml链霉素。
50.本实施例中,神经元培养基的制备方法如下,步骤a、advanced dmem/f12培养基与neurobasal培养基按照体积比为1:1进行混合,得混合培养物;
51.步骤b、向混合培养物内添加2%的胎牛血清、b27 plus添加剂,40ng/ml成纤维生长因子、2mmol/l谷胱甘肽、200μmol/l维生素c、100u/ml青霉素和100μg/ml链霉,制得成品。
52.hnpc细胞特征性标志物检测方式如下:(1)使用预冷200μl枪头进行吸取1%matrigel,并将1%matrigel加入至预冷的advanced dmem/f12培养基进行稀释,稀释体积比为1:100,制成matrigel包被液,matrigel包被液按照24孔板每个孔加入300μl进行,送入至培养箱在温度为37℃,co2浓度5%的条件下孵育1h,试用前弃去液体;
53.(2)将生长状态良好的npc细胞用accutase消化,制备成单细胞悬液,重悬培养基为加入rock inhibitor(终浓度为5μmol/l)的npc维持培养基,接种于使用matrigel包被好的24孔板,每孔接种细胞悬液300μl,每孔约为10000个细胞,于37℃、5%co2培养箱培养;
54.(3)第二天吸弃培养皿中液体,换新鲜的神经元分化培养基进行培养,每两天换一次新鲜培养基;
55.(4)第七天时,吸弃培养基,37℃预温的pbs洗三次,吸弃后加入3.7%甲醛(用预温的pbs配制)室温固定15分钟;
56.(5)吸弃甲醛,加入pbs轻柔摇动,重复三次,吸干pbs,加入含有0.1%triton x-100的通透液(pbs配制),室温5min。
57.(6)吸弃通透液,加入pbs轻柔摇动,重复三次,吸干pbs,加入含有3%fbs的封闭液(pbs配制,fbs用高速离心后去除不溶物),37℃30min。
58.(7)用封闭液配制一抗,按1:1000的比例每毫升封闭液加入1μlβiii-tublin抗体,4℃孵育过夜。
59.(8)第二天回收一抗,用pbs洗三次,每次室温静置5min,加入红色荧光标记的rabbit二抗(稀释比为1:1000),温度控制在37℃,时间控制在1h。
60.(9)吸弃二抗,用pbs洗三次,吸干,加入dapi(稀释比为1:1000,pbs配制)染色5min,pbs洗一次。
61.(10)200
×
倒置荧光显微镜下观察,拍照。
62.按照上述步骤进行检测,结果如图2所示,我们获取的神经元能够表达特征性蛋白βiii-tublin,具有人源神经元的分子特征。
63.本技术提供一种神经祖细胞分化为神经元细胞的应用,将其应用于神经发育毒性检测,应用方法包括如下步骤:
64.步骤1、使用预冷200μl枪头进行吸取1%matrigel,并将1%matrigel加入至预冷的advanced dmem/f12培养基进行稀释,稀释体积比为1:100,制成matrigel包被液,matrigel包被液按照96孔板每个孔加入100μl,送入至培养箱在温度为37℃,co2浓度5%的条件下孵育1h,试用前弃去液体;
65.将生长状态良好的npc细胞用accutase消化,制备成单细胞悬液,重悬培养基为加入rockinhibitor(终浓度为5μmol/l)的npc维持培养基,接种于使用matrigel包被好的96孔板,每孔接种细胞悬液200μl,每孔约为8000个细胞,于37℃、5%co2培养箱培养。
66.步骤2、接种24小时后加药处理,使用的稀释培养基为神经元分化培养基,每孔加入不同浓度化学品,其中选择神经发育毒性阳性物质:醋酸铅、丙戊酸、氯化锰、毒死蜱、地塞米松和双酚a;神经发育毒性阴性物质:氟虫腈、扑热息痛、奥美拉唑、泊马度胺和维生素c。设计的浓度为醋酸铅浓度设计为400、200、100、50、25、12.5、6.25、3.125、0μmol/l;丙戊酸浓度设计为1000、500、250、125、62.5、31.25、15.63、7.81、0μmol/l;氯化锰浓度设计为400、200、100、50、25、12.5、6.25、3.125、0μmol/l;毒死蜱浓度设计为1000、500、250、125、62.5、31.25、15.63、7.81、0μmol/l;地塞米松浓度设计为400、200、100、50、25、12.5、6.25、3.125、0μmol/l;双酚a浓度设计为400、200、100、50、25、12.5、6.25、3.125、0μmol/l;氟虫腈浓度设计为400、200、100、50、25、12.5、6.25、0μmol/l;扑热息痛浓度设计为2000、1000、500、250、125、62.5、31.25、15.63、0μmol/l;奥美拉唑浓度设计为2000、1000、500、250、125、62.5、31.25、15.63、0μmol/l;泊马度胺浓度设计为2000、1000、500、250、125、62.5、31.25、15.63、0μmol/l;维生素c浓度设计为2000、1000、500、250、125、62.5、31.25、15.63、0μmol/l,每种药物的每个梯度设置6个复孔,同时设置细胞对照组(接种细胞不加药处理)及只加npc维持培养基的空白对照组,每组设置6个复孔,加入液体总量为每孔100μl。
67.步骤3、化学品处理(37℃、5%co2培养箱培养)48小时后,继续换新的化学品处理,每48小时换一次,第七天时每孔加入10μlckk-8检测试剂(dojindo,日本)。
68.在37℃、5%co2细胞培养箱内继续孵育30分钟至1小时,孵育时间跟细胞量的多少相关,具体时间根据预实验确定(可根据液体颜色变化来初步确定),未加药孔吸光度范围控制在1.0~1.5之间最好。
69.步骤4、用酶标仪测定在450nm处的吸光度。
70.按照上述步骤检测,结果如表1所示,我们发现阳性神经发育毒性物质和阴性物质
的ic50有很好的区分度,其中醋酸铅由于处理后高浓度出现结晶沉淀,需转移到新的96孔板进行检测,提示改模型可作为化学品神经发育毒性的测试模型。
71.表1
72.化学物ic50(cck8)阳性化学物 醋酸铅(lead acetate)null(88.34
±
12.43μmol/l)丙戊酸(valproic acid)168.34
±
21.46μmol/l氯化锰(manganese chloride)10.42
±
1.96μmol/l毒死蜱(chlorpyrifos)143.20
±
10.12μmol/l地塞米松(dexamethasone)28.14
±
4.69μmol/l双酚a(bpa)41.23
±
6.84μmol/l
ꢀꢀ
阴性化学物 氟虫腈(fipronil)666.23
±
55.48μmol/l扑热息痛(paracetamol)352.67
±
33.45μmol/l奥美拉唑(omeprazol)》4mmol/l泊马度胺(pomalidomide)448.67
±
31.23μmol/l维生素c(ascorbic acid)》4mmol/l
73.在本说明书的描述中,参考术语“优选的实施方式”、“一个实施例”、“一些实施例”、“示例”、“具体示例”或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
74.尽管已经示出和描述了本发明的实施例,本领域的普通技术人员可以理解:在不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。