1.本发明涉及海洋微生物培养技术领域,尤其涉及一种海洋硅藻培养液、培养方法及软骨藻酸的制备方法。
背景技术:
2.软骨藻酸(da,donomic acid)是一种失忆性贝类毒素,由海洋中拟菱形藻属(pseudo-nitzschia)、菱形藻属(nitzschia)的某些硅藻产生。该种毒素可在贝类中积累,并通过食物链传播,人类食用受软骨藻酸污染的食物可引起记忆丧失、眩晕、昏迷甚至死亡等症状。
3.目前,可产生da的拟菱形藻、菱形藻在中国沿海广泛分布,对水产品的安全形成了潜在的风险。目前,我国对软骨藻酸的检测方法主要有生物测定法、酶联免疫法、高效液相色谱法等,其中高效液相色谱法以其检测快速、重复性好、准确率高的优点被广泛应用。对软骨藻酸的检测常依赖于标准物质的对照,市场缺口很大。
4.而现有技术公开的多为软骨藻酸的检测方法,鲜有研究软骨藻酸制备方法,申请号为201811168447.4的专利公开了一种利用海洋硅藻共栖细菌发酵制备遗忘性贝毒软骨藻酸的方法,但是其是利用的培养基为常规培养基,包括以下质量百分数的组分:酵母膏3 6%,蛋白胨2 5%,葡萄糖0.5 1%,余量为天然海水,但是其产量低,采用的是不同于海洋硅藻的共生细菌进行发酵。此外,虽然曾有文献记录了一种大量浓缩海水(过滤其中的微藻)用于生产软骨藻酸的方法,但该方法盲目性高、效率低,培养液传统,不具备实际应用价值。
5.因此,目前缺少用于有效生产软骨藻酸的海洋硅藻,并且也缺少对应的培养效率高的藻类培养基,现有技术有待进一步改进。
技术实现要素:
6.针对上述问题,本发明提供了一种产软骨藻酸的海洋硅藻培养液及其培养方法,该培养液配方简单、成本低,并且软骨藻酸的产量高。
7.为解决上述问题,本发明提供以下技术方案:
8.第一方面,本发明提供一种产软骨藻酸的海洋硅藻培养液,其主要由以下成分配置而成:海水、添加有硅酸钠的f/2培养液、尿素和六水合硫酸镍。
9.优选地,所述海水为天然海水。
10.优选地,上述产软骨藻酸的海洋硅藻培养液中,尿素的浓度为1.8~180mg/l;六水合硫酸镍的浓度为1~10ug/l。
11.所述添加有硅酸钠的f/2培养液的稀释浓度为500-2000倍;优选地,所述f/2培养液在海洋硅藻培养液的稀释倍数为1000倍。
12.第二方面,本发明还提供一种产软骨藻酸的海洋硅藻的培养方法,其,包括以下步骤:
13.将指数期的海洋硅藻接种到前述的海洋硅藻培养液中,接种比例为1:5~1:10,培养温度为19.0~23.0℃,光照时长为14~18h/d;光照强度5000-6500lux。
14.优选地,所述产软骨藻酸的海洋硅藻的培养方法中,培养周期为10-16d。优选地,培养周期为14d。
15.第三方面,本发明还提供一种软骨藻酸的制备方法,其包括以下步骤:
16.a、按照前述的培养方法制备得到产软骨藻酸的海洋硅藻培养液;
17.b、细胞收集:对完成培养周期的海洋硅藻培养液进行离心,收集藻泥;
18.c、对藻泥进行破碎处理,再采用甲醇水溶液提取破碎的硅藻细胞中的软骨藻酸。
19.可选地,所述软骨藻酸的制备方法中,对藻泥的破碎处理方法为:对藻泥冷冻保存后在室温下进行缓冻,重复此操作至少两次。
20.可选地,所述软骨藻酸的制备方法中,步骤c中采用的甲醇水溶液的体积浓度为50%。
21.可选地,所述软骨藻酸的制备方法中,步骤c之后还包括以下步骤:软骨藻酸的纯化。
22.优选地,软骨藻酸的纯化方法为:
23.采用c18反向硅胶柱对上述毒素粗提物进行纯化,采用甲醇水体系梯度洗脱,色谱条件为:波长:242nm~254nm,流速为4ml/min、采用的色谱柱为10
×
250mm的18c柱子,收集保留时间在24分钟左右的主峰,最后对收集物进行浓缩至干,得到软骨藻酸纯化产品。
24.本发明具体实施方式采用的藻种为尖刺拟菱形藻pseudo-nitzschia pungens ccma139,以此作为示例,其他实施例中也可采用其他产软骨藻酸的拟菱形藻、菱形藻。可利用该海洋硅藻通过前述的培养方法进行发酵,制备软骨藻酸。
25.本发明的技术方案具有以下有益效果:
26.本发明提供的海洋硅藻培养液不仅配方简单,成本低廉,可有效降低培养成本,并且适合产软骨藻酸的海洋硅藻的生长需求,不仅能提高产软骨藻酸的海洋硅藻的生物量,并且该培养液可显著提高产软骨藻酸的海洋硅藻(如拟菱形藻)产软骨藻酸的能力,能大幅度地提高代谢产物软骨藻酸的产量。
27.本发明还提供相应的产软骨藻酸的海洋硅藻培养方法以及软骨藻酸的制备方法,该制备方法步骤简单,可用于高效生产软骨藻酸,为软骨藻酸的制备提供了一条全新适合产业发展的可行性方法。
附图说明
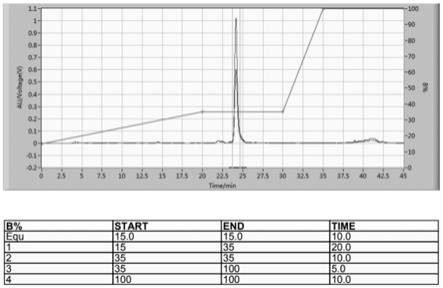
28.图1为实施例一的软骨藻酸粗提物的制备色谱阶段的色谱图;
29.图2为实施例一的软骨藻酸粗提物的分析色谱阶段的色谱图。
具体实施方式
30.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。在本发明中,若非特指,所采用的设备和原料等均可从市场购得或是本领域常用的。下述实
施例中的方法,如无特别说明,均为本领域的常规方法。
31.实施例一海洋硅藻培养液的优化
32.为了研究培养液中尿素对软骨藻酸的产量的影响,设计了本实施例。
33.1、培养液原料:
34.①
f/2培养液(1l):1ml 75g/l的nano3、1ml的5g/l的nah2po4·
h2o、1ml的30g/l的na2sio3·
9h2o、1ml的微量元素溶液以及0.5ml的维生素溶液,溶剂为天然海水。
35.其中,上述微量元素溶液(1l)的配方如下表1:
36.表1微量元素溶液的配方
[0037][0038]
其中,维生素溶液(1l)的配方如下表2:
[0039]
表1维生素溶液的配方
[0040][0041]
[0042]
②
尿素储备液:尿素(ch4n2o)18.00g,以蒸馏水溶解并定容至1l,采用过滤方式进行除菌处理,滤膜孔径为0.22um,最后得到尿素储备液。
[0043]
③
微量元素储备液:六水合硫酸镍(niso4·
6h2o)2.62*10-3
g,以蒸馏水溶解并定容至1l,采用高温高压灭菌处理,条件为:121.0℃,20min,灭菌后冷却至室温保存并使用,即微量元素储备液。
[0044]
④
海水:天然海水取自青岛石老人附近海域,经黑暗沉淀一周后,使用0.22um水系滤膜进行抽滤;对抽滤后的海水进行高温高压灭菌,灭菌条件为:121.0℃,20min。
[0045]
2、实验材料:
[0046]
藻种为硅藻pseudo-nitzschia pungens ccma139,购自海洋藻类保种中心(center for collections of marine algae,ccma),以海水f/2培养液培养至指数期作为种子液,细胞密度(按单体计)约为22.0*104cells/ml。
[0047]
3、实验方法
[0048]
(1)实验组的培养液设置:按照以下表格1的内容分别设置a、b、c、d、e五组培养液。
[0049]
表1实验组培养液的配置
[0050][0051][0052]
(2)将指数期的海洋硅藻分别接种到步骤(1)中的五组培养液中,接种比例统一为1:10,温度21.0-22.0℃,光周期14l:10d,光照强度4500-4900lux,静置培养,每日摇瓶5次,培养周期14d。
[0053]
(3)细胞收集与毒素提取
[0054]
对完成培养周期的样本进行细胞密度的检测,检测方法为:浮游植物计数框计数法。
[0055]
对完成培养周期的样本采用离心法收集细胞,条件为4000r/min,8min,离心后弃去上清液,保留藻泥。
[0056]
将得到的藻泥于-20℃条件下冷冻保存12h以上,再在室温条件下缓冻,重复上述操作两次以破碎细胞。
[0057]
(4)毒素的粗提:利用50%甲醇水溶液1ml对上一步破碎细胞进行处理,提取毒素粗提物。
[0058]
(5)毒素的纯化:
[0059]
采用c18反向硅胶柱对上述毒素粗提物进行纯化处理,具体步骤如下:
[0060]
①
反相硅胶柱净化
[0061]
准备:甲醇冲洗柱子后,吹气将柱子吹干。
[0062]
称量:称取100克18c填料。
[0063]
干法装柱:底部连接泵抽气,均匀地倾倒填料,轻轻敲打柱子使填料平整,抽气10分钟左右,在顶部加入约2-3厘米的石英砂。
[0064]
活化:使用漏斗均匀地添加1000ml甲醇活化柱子。
[0065]
润柱:使用漏斗均匀地添加1000ml水进行润柱。
[0066]
上样:da样品100ml旋蒸至约50ml后加入10ml的甲醇水,润柱结束后,使用吸管沿柱子内壁均匀地添加样品(底部接收瓶进行接收),等样品液面与石英砂平齐时,少量起始洗脱液冲刷柱子内壁。
[0067]
洗脱:用甲醇水体系梯度洗脱,收集产品组分,浓缩蒸干后加水超声溶解,过膜混匀待制备分离。
[0068]
②
制备色谱的条件:
[0069]
采用的流动相为:a相水,b相甲醇,波长:242nm~254nm,流速为4ml/min、采用的色谱柱为10
×
250mm的18c柱子,梯度洗脱:15%甲醇水溶液至35%甲醇水溶液,洗脱20分钟;35%甲醇水溶液洗脱10分钟;35%甲醇水溶液至无水甲醇,洗脱5分钟;无水甲醇平衡10分钟,柱温为30℃,收集保留时间在24分钟左右的主峰,最后进行浓缩至干得软骨藻酸纯化产品。图谱见图1。
[0070]
③
以液相色谱串联质谱法检验纯化产品中软骨藻酸的含量
[0071]
a、色谱条件
[0072]
色谱柱采用c18(内径2.1mm,柱长100mm,粒径3μm),流速为0.3ml/min,柱温为30℃,进样量为1ul,采用的流动相如下表。图谱结果见图2。
[0073][0074]
二、质谱条件
[0075]
离子源为esi离子源,气流量:反吹气1(arb)鞘气35(arb)辅助气10(arb);扫描模式为正离子;喷雾电压:3500v;采用的离子参数如下表。
[0076]
[0077][0078]
(6)毒素产量的检测方法
[0079]
da产量(ug/l藻液)=检测浓度(ppm,mg/l)/藻液浓缩比例(1000)
[0080]
4、实验结果及分析
[0081]
表2各实验组的毒素产量和检测浓度
[0082][0083]
从表2的实验结果可知,添加尿素和微量元素后可显著提高海洋硅藻的软骨藻酸产量;但是通过实验组d和e的结果可知,在实验设定的培养条件下,尿素储备液的过渡添加超过拟菱形藻的需求量后,可能造成拟菱形藻死亡,不利于软骨藻酸的产生。
[0084]
实施例二培养方法的进一步优化
[0085]
在实施例一的实验结果基础上,为了进一步明确培养液中六水合硫酸镍这种微量元素对软骨藻酸的产量的影响,设计了本实施例。
[0086]
1、培养液原料:同实施例一。
[0087]
2、实验材料:
[0088]
藻种为硅藻pn(sp.)-02,培养至指数期作为种子液,细胞密度(按单体计)约为26.0*104cells/ml。
[0089]
3、实验方法
[0090]
(1)实验组的培养液设置:按照以下表格1的内容分别设置a1、b1、c1、d1、e1五组培养液。
[0091]
表3实验组培养液的配置
[0092][0093]
(2)将指数期的海洋硅藻分别接种到步骤(1)中的五组培养液中,接种比例统一为:1:5,其他条件为:温度19.0-21.0℃,光周期14l:10d,光照强度4500-4900lux,静置培养,每日摇瓶5次,培养周期14d。
[0094]
(3)细胞收集与毒素提取
[0095]
完成培养周期的样本采用离心法收集细胞,条件为4000r/min,8min,离心后弃去上清液,保留藻泥。
[0096]
藻泥于-20℃条件下冷冻保存12h以上,再在室温条件下缓冻,重复上述操作两次以破碎细胞。
[0097]
(4)毒素的粗提:利用50%甲醇水溶液1ml对上一步破碎细胞进行处理,提取毒素粗提物。
[0098]
(5)毒素的纯化:方法参照实施例一。
[0099]
4、实验结果及分析
[0100]
表4各实验组的毒素产量和检测浓度
[0101][0102][0103]
实验结果显示:
[0104]
(1)对比a1组与b1组的结果可知,仅添加1ml的尿素储备液虽然可以提高该藻株da产量,但软骨藻酸产量的提高幅度较小。
[0105]
(2)对比a1、b1组与c1的结果可知,微量元素储备液是本发明配方中不可缺少的关键成分,通过b1与c1的比较得到,同时添加尿素储备液和微量元素储备液后,可将软骨藻酸
的产量提高近10倍。
[0106]
(3)c1组与d1组的对照结果表明,微量元素储备液的添加量在本发明设定条件下,可以有效促进软骨藻酸的产生,一定范围内的浮动不影响实际使用效果。
[0107]
(4)e1组的实验结果表明,若过量添加的微量元素储备液和尿素储备液超出拟菱形藻的需求量,其可能抑制拟菱形藻的生长,减少甚至抑制软骨藻酸的产生。
[0108]
虽然实施例一和实施例二的实验设置相似、培养条件基本相同,但是实施例二采用的实验材料的硅藻细胞密度(处于指数期)高于实施例一,因此相同培养周期得到的海洋硅藻的生物量以及软骨藻酸的产量更高。
[0109]
可以理解的是,对本领域普通技术人员来说,可以根据本发明的技术方案及本发明构思加以等同替换或改变,而所有这些改变或替换都应属于本发明所附的权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
![作为JAK激酶抑制剂的吡咯并[2,3-d]嘧啶类衍生物及制备方法和用途](/upload/img/20220409/swnhv59pl.jpg)