一株枯草芽孢杆菌纳豆亚种r3及其应用
技术领域
1.本技术涉及枯草芽孢杆菌技术领域,尤其涉及一株枯草芽孢杆菌纳 豆亚种r3及其应用。
背景技术:
2.纳豆芽抱杆菌(bacillus natto)属芽抱杆菌科、纳豆芽抱杆菌属,是纳 豆的生产菌种,目前已有2000多年的食用历史。纳豆菌在发酵过程中能 够分解蛋白质、碳水化合物、脂肪等大分子物质,因而纳豆菌发酵的产 品中含有大量的氨基酸、寡聚糖、有机酸等容易被人体消化吸收的营养 成分。纳豆菌(bacillus natto)是“公认安全”(gras)的微生物,发展和研究 纳豆菌发酵制品在抗肿瘤、降血压、抗氧化、溶血栓的保健作用具有非 常现实的意义。
技术实现要素:
3.有鉴于此,本技术的目的在于提供一种枯草芽孢杆菌纳豆亚种,以 开放其实际的应用场景和领域。
4.第一方面,本技术实施例公开了一种枯草芽孢杆菌纳豆亚种,保藏 于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.21709,分类命名为枯草芽抱杆菌bacillus subtilis subsp.natto r3,保 藏日期为2021年01月25,保藏地址为北京市朝阳区北辰西路1号院3 号。
5.第二方面,本技术实施例公开了所述的枯草芽孢杆菌纳豆亚种在发 酵水蛭低温干燥品中的应用。
6.第三方面,本技术实施例公开了所述的枯草芽孢杆菌纳豆亚种在制 备抗凝血制品中的应用。
7.第四方面,本技术实施例公开了所述的枯草芽孢杆菌纳豆亚种在制 备降血压制品中的应用。
8.第五方面,本技术实施例公开了所述的枯草芽孢杆菌纳豆亚种发酵 水蛭低温干燥品的方法,包括以下步骤:
9.配制种子培养液和发酵培养液,所述种子培养液包含1~8wt%水蛭低 温干燥品,所述发酵培养液包含1~5wt%水蛭低温干燥品;
10.制备种子悬液,所述种子悬液由保藏的如权利要求1所述的枯草芽 孢杆菌纳豆亚种进行菌种活化后,接种于所述种子培养液中进行培养得 到;
11.获得发酵液,所述发酵液是将所述种子悬液转接至所述发酵培养液 中,于34~45℃、150~180rpm搅拌条件下通气发酵,空气量与罐容积之 比为1:0.5~1(v/v.m),发酵36~72h得到;
12.得到干燥制品,所述干燥制品由所述发酵液进行纯化得到。
13.本技术实施例中,所述种子培养液还包含0.5~2g/l纳豆、1.5~3g/l 脱脂奶粉、
0.5g/l牛肉膏、15g/l蛋白胨和5g/l nacl,所述种子培养 液的ph为7.0~7.2;
14.所述发酵培养液还包含0.5~1.5g/l纳豆、10g/l葡萄糖、1.5~3g/l脱 脂奶粉、0.5g/l牛肉膏、15g/l蛋白胨和5g/l nacl,所述发酵培养液的 ph为7.0~7.2。
15.在本技术实施例中,所述纯化处理包括:
16.浸提:将向发酵液中加入5倍体积的水,于85℃以上条件下充分浸 提6~8h,离心取上清液;
17.超滤:先用5kd中空纤维柱处理后,收集浓缩液,低温干燥(或冻 干),即可得到干燥制品,-20℃保存。
18.本技术实施例中,所述干燥制品包括抗凝血肽和降血压肽,所述抗 凝胶肽的氨基酸序列如seq id no.4所示,所述降血压肽的氨基酸序列 如seq id no.5所示。
19.与现有技术相比,本技术至少具有以下有益效果:
20.本技术实施例通过的由纳豆作为筛选来源,经由初筛、复筛和终筛, 并在复筛中使用了脉冲光辐射处理,经过鉴定,最终筛选得到一种枯草 芽孢杆菌纳豆亚种r3,通过溶酶实验和ace活性检测,发现其同时具 有抗凝血和抑制ace酶活性,而常规的枯草芽孢杆菌纳豆亚种并不同时 具有此两种活性。
21.进一步的,本技术还通过r3菌株发酵水蛭低温干燥品,得到一种干 燥制品,经过鉴定发现其中包含两种活性多肽,分别对应产生抗凝血和 抑制ace酶活性的作用,并经过动物实验验证了利用r3发酵水蛭低温 干燥品得到的干燥制品同时具有对缺血再灌注脑损伤大鼠具有保护作 用,和降低sihr大鼠的血压水平。由此,说明本技术实施例还提供了将 r3菌株应用在制备抗凝血制品、或者制备降血压制品的应用前景。
附图说明
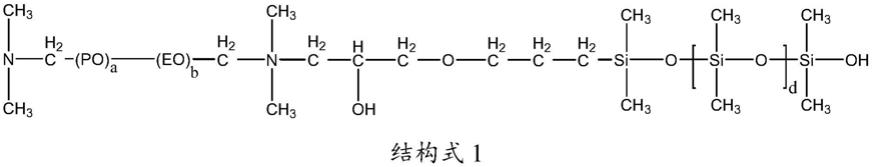
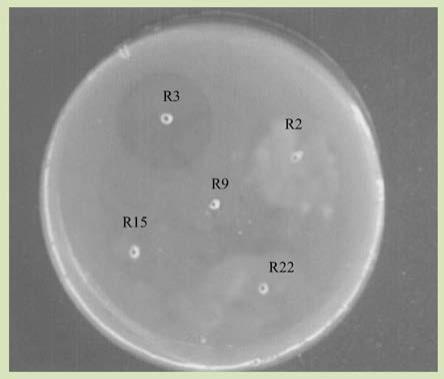
22.图1为本技术实施例提供的终筛平板结果图。
23.图2为本技术实施例提供的r3菌株的16s rdna电泳图,第1泳道 为marker,第2泳道为16s rdna。
24.图3为本技术实施例提供的抗凝血多肽的nano-uplc-ms谱图。
25.图4为本技术实施例提供的降血压肽的nano-uplc-ms谱图。
具体实施方式
26.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实 施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施 例仅仅用以解释本技术,并不用于限定本技术。
27.枯草芽孢杆菌纳豆亚种r3的筛选鉴定
28.1、筛选样品来源
29.取新鲜大豆500g,用新鲜晒干的荷叶包裹后,于夏季置于通风处发 酵15天,得到一种纳豆。取制得的纳豆0.34~1g,研碎后溶于的20ml l0.75%生理盐水中振荡1h,静置,上清液作为待筛选的原始菌悬液。
30.2、初筛
31.取原始菌悬液原倍溶液,10-1
~10-8
的稀释度的溶液分别涂布于的牛肉 膏蛋白脉
培养基平板,每处理设3个平行,涂匀稀释液;于37℃恒温培 养箱中倒置培养24h,观察菌落生长情况,选择菌落分布均匀、菌落数介 于30~80个的平板,挑取不同菌落形态的单菌落进行革兰氏染色,显微 镜下观察:对芽孢杆菌反复纯化,直到获得纯种。按照上述方法从7种 纳豆中分别分离纯化得到41个单菌落,依次命名为r1~r41。
32.3、复筛
33.将上述分离得到的r1~r41点种至脱脂牛奶固体培养基上,37℃倒 置培养至菌落数不低于200个后进行如下处理:
34.将平板放入脉冲强光杀菌设备fd2000(上海瑞玢智能科技有限公 司)中进行脉冲光照射处理,每次处理的条件为:脉冲电压2220v、脉 冲次数65次和照射距离5cm。共处理10次,每间隔1~2h处理1次, 将处理10次后平板上存活的菌落转接至新鲜平板,共转接3代,最终通 过3代转接仍然能够存活的菌株为r2、r3、r9、r15和r22。
35.4、终筛
36.将复筛得到的r2、r3、r9、r15和r22分别接种至分别点种于抗凝 血平板上,37℃培养24h,观察是否有溶酶圈产生,进行凝血酶活力的检 测。
37.其中,抗凝血平板的包含:3.0g/l牛肉膏、10.0g/l蛋白胨、5.0g/lnacl、20g/l琼脂和10v/v%20nih/ml凝血酶标准溶液;其中,20 nih/ml凝血酶标准溶液用ph5.0生理盐水配置,凝血酶制剂购自 sigma-aldrich,登记号p00734,150units。凝血酶标准溶液应在平板 冷却中至45℃以下时均匀倒入平板混匀,直至平板完全凝固。
38.将复筛得到的r2、r3、r9、r15和r22分别以5wt%的接种量接种 至终筛液体培养基中,转入37%摇床120rpm,培养30~35h后,取发酵 液进行ace抑制率为指标进行筛选。其中,ace抑制率活性参照下文。
39.其中,终筛培养液包含8wt%水蛭低温干燥品、2g/l纳豆、3g/l脱 脂奶粉、0.5g/l牛肉膏、5g/l蛋白胨和5g/l nacl,ph值为7.0~7.2。
40.结果如图1所示,产生了溶酶圈的平板仅有r3,而具有ace抑制 率菌株有r2、r3、r9、r15和r22。
41.5、ace抑制率活性检测
42.采用改良的cushman紫外比色法进行发酵液ace抑制率的测定。
43.hhl底物溶液配制:用ph8.3含0.lmol/l nacl的硼酸盐缓冲溶液 溶解ace底物hip-his-leu(hhl,sigma公司),配制成5mmol/l的 浓度。
44.取100μl 5.0mmol/l的hhl溶液和40μl离心后的扇贝裙边发酵液 混合,于37℃水浴中保温10min,加入0.l u/ml的ace酶液20μl,混 匀后于37℃恒温水浴中反应35min。
45.从水浴锅中取出,向反应体系中加入200μl lmol/l的hcl以终止反 应,再加入1.2ml冷冻乙酸乙醋提取产生的马尿酸,旋涡震荡混匀后, 以3500rpm离心5min,吸取1.0ml的乙酸乙醋层,在90℃烘箱中经1 小时烘干冷却后加入4ml的蒸馏水充分溶解,漩涡混合后于228nm处测 吸光值。平行对照管除在反应前先加入200μl l mol/l的hcl以终止反应 外,其余成分、操作步骤同反应管,吸光度值重复3次取平均值,进而 根据公式计算上述r2、r3、r9、r15和r22发酵液ace抑制率,结果 发酵48h,r2、r3、r9、r15和r22发酵液的ace抑制率分别为67.5%、 73.2%、73.1%、71.9%和68.3%。
46.6、r3菌株的鉴定
47.经过上述的初筛、复筛和终筛的步骤发现,仅有r3菌株既能产生对 凝血酶的溶酶圈,还能够通过发酵产生对ace抑制效果,因此,本技术 筛选得到的r3菌株进行鉴定。
48.提取菌株r3的基因组做模板,用细菌的通用引物(27f: agagtttgatcctggctcag,如seq id no.1所示;14928:ggttaccttgttacgactt,如 seq id no.2所示)进行pcr扩增,经1%的琼脂糖电泳检测显示,在900 bp左右有一明显条带,如图2所示,说明己经扩增出该菌株基因组的16 srdna片段,经测序得到的片段长度为867bp,如seq id no.3所示。
49.将菌株bn-3的序列在ncbi中用blast进行比对,其同源性较 高的菌株均属于芽抱杆菌属,说明筛选出的菌株r3是枯草芽孢杆菌 种,纳豆菌亚种,bacillus subtilis subsp.natto。将菌株r3命名为bacillussubtilis subsp.natto r3,保藏于中国微生物菌种保藏管理委员会普通微 生物中心,保藏编号为cgmcc no.21709,保藏日期为2021年01 月25,保藏地址为北京市朝阳区北辰西路1号院3号。
50.枯草芽孢杆菌纳豆亚种r3发酵水蛭低温干燥品
51.本技术实施例还公开了一种利用上述实施例公开的枯草芽孢杆菌纳 豆亚种发酵水蛭低温干燥品r3发酵水蛭低温干燥品的方法。该方法具体 包括以下步骤:
52.1)配制种子培养液和发酵培养液,所述种子培养液包含1~8wt%水 蛭低温干燥品,所述发酵培养液包含1~5wt%水蛭低温干燥品;
53.2)制备种子悬液,所述种子悬液由保藏的如权利要求1所述的枯草 芽孢杆菌纳豆亚种进行菌种活化后,接种于所述种子培养液中进行培养 得到;
54.3)获得发酵液,所述发酵液是将所述种子悬液转接至所述发酵培养 液中,于34~45℃,150~180rpm搅拌条件下通气发酵,空气量与罐容积 之比为1:0.5~1(v/v.m)36~72h得到;
55.4)得到干燥制品,所述干燥制品由所述发酵液进行纯化得到。
56.本技术实施例通过利用枯草芽孢杆菌纳豆亚种r3发酵水蛭低温干 燥品,不仅充分利用水蛭低温干燥品中自身含有的水蛭素,通过生物降 解合成了具有抗凝血的多肽。另外,还有由于r3菌株通过脉冲光处理产 生了某种变异,还合成了抑制ace的多肽。由此,通过该发酵方法得到 了一种干燥制品。
57.具体的实施例1,将保存的菌种r3转移至转接至斜面培养基,37℃ 培养24h,转接至种子培养液,于37℃150rpm摇瓶培养24h。其中,种 子培养液包含6.5wt%水蛭低温干燥品、1.5g/l纳豆、2.6g/l脱脂奶粉、 0.5g/l牛肉膏、15g/l蛋白胨和5g/l nacl,种子培养液的ph为7.0~7.2。 测定种子细胞悬浮液的吸光度od660,不低于0.8,并且采用活菌计数法 进行活菌检测,其活菌数不低于108cfu/ml。
58.具体的,将达到此要求的种子细胞悬液转接至发酵培养液中,于 34~45℃150~180rpm搅拌条件下通气发酵,空气量与罐容积之比为 1:0.5~1(v/v.m),发酵36~72h。其中,发酵培养液包含3.4wt%水蛭低 温干燥品、1.5g/l纳豆、10g/l葡萄糖、3g/l脱脂奶粉、0.5g/l牛肉膏、 15g/l蛋白胨和5g/l nacl,发酵培养液的ph为7.0~7.2。
59.检测发酵液吸光度od660,不低于0.8,进行纯化处理。具体的实施 例1的纯化处理步骤包括:
60.浸提:将向发酵液中加入5倍体积的水,于85℃以上条件下充分浸 提6~8h,离心取上清液;
61.超滤:先用5kd中空纤维柱处理后,收集浓缩液,低温干燥(或冻 干),即可得到干燥制品,-20℃保存。
62.对比例1:为此,本技术还提供了一种利用现有的枯草芽孢杆菌纳豆 亚种发酵水蛭低温干燥品的方法,以作为对比例1。其步骤与上述实施例 1相同,区别仅在于其发酵所用菌种为bacillus subtilis subsp.subtilis cicc 23916,购自中国工业微生物菌种保藏管理中心。并通过上述步骤,对发 酵液进行浸提和超滤,亦得到一种干燥制品。
63.干燥制品的检测
64.将制品溶于水,用1kd中空纤维柱处理,分别收集滤过液和浓缩液。 将浓缩液经过低温干燥(或冻干)后,得到组分1。将滤过液用中3kd 中空纤维柱浓缩后,低温干燥(或冻干),得到组分2。
65.对组分1和组分2分别先用葡聚糖凝胶sephadex-g25进行纯化,收 集主要成分在215nm吸光度高的主要成分,浓缩,冷冻杆子,以便进行 纳升级液相色谱-质谱(nano-uplc-ms)鉴定。
66.nano-uplc-ms鉴定方法如下:
67.色谱条件:c18色谱柱,样品进样体积10μl,柱温30℃,流速300 nl/min,检测波长215nm。流动相a:含100%的乙睛,流动相b:含 0.1%(v/v)甲酸的超纯水。
68.梯度分离条件:在0~40min,b流动相溶液由5%升到45%,40~50min 内由45%线性增加至80%,并在80%维持5min,最后降至5%平衡15min。
69.质谱条件:纳升级电喷雾电离方式((nano-esi),正离子模式扫描,扫 描范围m/z 350~1800。一级谱图扫描分辨率为120k,二级谱图扫描分辨 率为7.5k,串级碎裂能量为30%,碎裂模式为高能碰撞碎裂解离hcd。
70.质谱图如图3-4所示,将组分1和组分2得到nano-uplc-ms分子 量,经过分析和鉴定,并与biopep数据库比对发现,组分1中得到的 氨基酸序列为iprpqshndfdfeeipeeylq,如seq id no.4所示,分 子量为2637.8的多肽,组分2中的主要成分为氨基酸序列为kkkpe,如 seq id no.5所示,分子量为700.83da的多肽。
71.由此可知,本技术实施例提供的发酵制品包含上述两种干燥制品。
72.组分1和组分2多肽的活性检测
73.供试品溶液:配制上述制品的20mg/ml的10ml组分1溶液,配制 上述制备20mg/ml的10ml组分2溶液。
74.另外,提供水蛭低温干燥品(购自西安瑞林生物科技有限公司), 配制成20mg/ml的10ml溶液,作为对照。
75.称取纤维蛋白原10mg(购自sigma),用tris-hcl溶解至2ml; 分装好的凝血酶(sigma-aldrich,登记号p00734,150units)用纯水 稀释至1ml摇匀,得到浓度为40u/ml的凝血酶溶液;精密吸取供试品 溶液50μl置试管中,加入纤维蛋白原溶液100μl,摇匀,置37℃水浴中, 缓慢加入凝血酶溶液,每分钟5μl,边加边摇,观察凝血情况,直至凝 固,记录消耗凝血酶溶液的体积,按下式计算样品活性,样品活性 u=c1
×
vl/c2
×
v2;其中,u表示每1g含凝血酶活性单位u/mg;c1表示 凝血酶的活性浓度u/ml;c2表示供试品液的浓度20mg/ml;v1表示消 耗凝血酶的体积μl;v2表示供试品溶液的加入量μl。
76.同时将上述供试品采用上述实施例提供的ace抑制率活性检测,检 测结果如表1
所示。
77.表1
[0078][0079]
将纯化的组分2的ic
50
值的测定:配置不同浓度的冻干样品(0.1~2.0 mg/ml),按照上述实施例提供的方法测定样品的ace抑制率,以样品浓 度的对数值对ace抑制率做相关曲线,计算样品的ic
50
值。
[0080]
由表1可知,组分1含有高抗凝活性的分子量为2637.8的多肽成分, 组分2含有高ace抑制率的分子量为700.83da的多肽成分,由此证明 本技术实施例1提供的干燥制品同时含有此两种多肽成分,同时具有高 抗凝活性(远高于水蛭低温干燥品的抗凝活性)和高ace抑制率。而对 比例1的bacillus subtilis subsp.subtilis cicc 23916发酵水蛭低温干燥品 得到的干燥制品,仅具有抗凝活性,而不具有ace抑制性,另外还通过 对发酵培养液中其他的纳豆粉、葡萄糖和脱脂奶粉进行检测,排除了其 对抗凝活性和ace抑制性的影响。
[0081]
动物实验
[0082]
为进一步验证本技术实施例利用r3菌发酵所得干燥制品的效果,下 方将结合动物实验进行说。
[0083]
1、材料与方法
[0084]
1.1、实验动物及供试药品
[0085]
wistar大鼠120只,雌雄各半,体重250-280g,由山东大学实验动 物中心提供,合格证编号:scxk(鲁)-2003004a。
[0086]
供试药品,分别称取实施例1、对比例1和水蛭低温干燥品100mg 溶于2ml 0.75%生理盐水中,以作为供试品,并以血塞通注射液(100mg, 2ml,昆药集团股份有限公司)作为阳性对照品1,以。
[0087]
1.2、建立mcao模型大鼠
[0088]
大鼠手术造模:大鼠腹腔注射10%水合氯醛(350mg/kg体重)麻醉, 仰卧固定,取颈正中切口,切开皮肤,钝性分离各层组织,分离右颈总 动脉(cca)、颈内动脉(ica)及颈外
动脉(eca),结扎eca和cca,用静 脉夹夹闭ica远心端后,迅速于距eca与ica分叉处约0.5cm的颈总 动脉处作一切口,插入一端涂有石蜡的尼龙线(0.32mm),插入深度为 1.85
±
0.5mm,实现大脑中动脉阻塞导致脑缺血。结扎入口处,缝合切口, 留置尼龙线头尾端于体外。缺血1h后,再次麻醉大鼠,拉动尼龙线外留 线头至略有阻力以实现大脑中动脉再灌注。假手术与其他模型鼠一样分 离颈总动脉、颈内动脉及颈外静脉,但只结扎右侧颈总动脉cca,术后 大鼠保温,mcao模型大鼠建立完成。对建立的mcao模型大鼠进行神 经病学检查评分参照zea longa 5分制评分,评分达到3或4分,即表明 造模成功。
[0089]
1.3、对于mcao大鼠的作用
[0090]
观察神经症状及组织生化指标测定试验:将wistar大鼠分为空白组、 模型组和给药组。将建立的mcao模型鼠腹腔注射给药供试品,供试品 为实施例1、对比例1和水蛭低温干燥品制备的供试品和阳性对照品1。 注射积累均为20mg/kg体重。空白组与模型组给予等量的生理盐水,空 白组机未进行上述手术的正常健康wistar大鼠。
[0091]
1.4、脑梗塞范围测定:
[0092]
动物于缺血1小时再灌注23小时后断头,迅速置于冰盘上取脑,去 掉嗅球、小脑和低位脑干,置于-20℃冷冻20min,取出,将大脑均匀切 成6片,放入盛有ttc的瓶中,闭光,置37 0c孵箱孵育30min孵育后 将其转入4%多聚甲醛溶液固定。非缺血部分染成玫红色,缺血部位呈白 色。脑组织固定后仔细将缺血部分分开并称重,按以下公式确定脑梗塞 范围(%)=梗塞区重量/全脑重量
×
100%。
[0093]
1.5、脑组织生化指标测定
[0094]
指标包括超氧化歧化酶(sod)、丙二醛(mda)、乳酸脱氢酶(ldh)、 谷光甘肤(gsh)、谷光甘肽过氧化物酶(gsh-px)、一氧化氮(no)、 na
-k
-atpase和ca
-mg
-atpase。
[0095]
检测方法:按照上述方法值得的10%脑匀浆,4000rpm离心10min, 取上清20μl,按ldh测定试剂盒(abcam中国)说明测定ldh含量; 分别取30μl,按sod、gsh测定试剂盒(abcam中国)说明测定sod 和gsh含量;取上清100μl,按mda测定试剂盒(北京盒子生工科技 有限公司)说明测定mda含量;取上清200μl,按gsh-px测定试剂盒 (上海研尊生物科技有限公司)说明测定gsh-px含量;取上清500μl, 按no测定试剂盒(上海仁捷生物科技有限公司)说明测定no含量。
[0096]
1.6、应激性高血压大鼠(sihi)动物模型的建立
[0097]
采用高盐饮食复合冷应激方法进行造模。将上述的wistar大鼠,每 天饲喂含10%氯化钠的高盐大鼠饲料(协同生物)和饮用0.85%氯化钠 溶液,同时每天将大鼠每天置于5
±
2℃的面壁为玻璃板、含一定水的暴 露箱中4h,连续处理2周后,用bp-6型动物无创血压测试系统测量大鼠 血压,连测3次,取其均值,直至血压达到最高(与正常wistar大鼠比较), 并且血压在高水平维持相对稳定后开始实验,判定标准为应激后血压与 应激前血压应具有显著差异(p《0.01)。
[0098]
1.7、大于sihi大鼠的作用
[0099]
将sihr大鼠随机分为给药组、阳性对照组和模型组。给药组给予 sihr大鼠灌胃实施例1、对比例1和水蛭低温干燥品分别提供的供试品, 给药剂量为20mg/kg体重。阳性对照组给药sihr大鼠灌胃厄贝沙坦(法 国赛诺菲),剂量为16.5mg/kg。模型组即为sihr大鼠,不给予供试品。 另外还设立正常wistar大鼠作为空白对照。连续4周,第5周停止给药, 继续
观察待大鼠血压稳定后,以间接测压法测量大鼠尾动脉血压,并记 录测量结果。
[0100]
1.8、数据处理
[0101]
实验数据采用excel 2013和spss 22.0统计软件进行数据分析进行统 计整理,每个数据均测量多次,并通过平均值与其标准偏差进行表示, 并以spss 22.0分别进行单因素方差分析(one-way anova)和duncan’s 多重比较,并进行显著性差异标记。
[0102]
2、结果
[0103]
表2
[0104][0105]
由表2所示,空白组大鼠脑组织正常,而模型组、给药组大鼠均有 不同程度梗塞灶,给药组在给药供试品后,其大鼠脑梗范围相对于模型 组均由显著降低,其中实施例1提供的供试品,即采用上述本技术实施 例公开的r3菌株发酵水蛭低温干燥品得到的干燥制品,对于大鼠梗塞程 度具有最明显减轻作用。
[0106]
表3
[0107][0108]
由表2、3所示,大鼠经大脑中动脉缺血再灌后,脑组织中mda、 gsh、sod、gsh-px、ldh和no均有明显变化,模型组大鼠ldh、 mda和no含量明显高于假空白组,sod、gsh和gsh-px明显低于 空白组。给药组中,实施例1提供的供试品在给药模型大鼠后,大鼠脑 组织中ldh、mda和no含量显著降低,而sod、gsh和gsh-px含 量显著升高,并且其中,sod和gsh-px含量几乎恢复至与空白组相当。 而给药组中,对比例1和水蛭低温干燥品提供的供试品给药模型大鼠后, 大鼠脑组织中mda、gsh、sod、gsh-px、ldh和no含量虽有部分 改变,但是都难以恢复至正常水平。并且,对比例1和水蛭低温干燥品 提供的供试品几乎对模型大鼠脑组织中sod、gsh-px和ldh含量无显 著改变。由此表明,本技术实施例1提供的供试品,即即采用上述本申 请实施例公开的r3菌株发酵水蛭低温干燥品得到的干燥制品,对于模型 大鼠脑组织抵抗酸中毒和抗自由基损伤起到了保护作用。
[0109]
表4
[0110][0111]
由表4可知,大鼠经大脑中动脉缺血再灌注后,脑组织中 na
-k
-atpase和ca
2 -mg
2 -atpase活性均明显空白组。给药组中,实施 例1提供的供试品给药模型大鼠后,大鼠脑组织中na
-k
-atpase和 ca
2 -mg
2 -atpase活性均相对于模型组大鼠显著升高,并且显著高于阳性 对照组。而给药组中,对比例1和水蛭低温干燥品提供的供试品给药模 型大鼠后,大鼠脑组织中na
-k
-atpase和ca
2 -mg
2 -atpase活性均相 对模型组大鼠无显著改变。由此说明,对比例1和和水蛭低温干燥品提 供的供试品对大于na
-k
-atpase和ca
2 -mg
2 -atpase缺血损伤无明显 作用,而本技术实施例1提供的由本技术实施例公开的r3菌株发酵水蛭 低温干燥品得到的干燥制品能够提供明显的改善作用。
[0112]
表5
[0113][0114][0115]
由表5可知,建立的sihr模型大鼠的稳定收缩压和舒张压均显著高 于空白组,说明造模成功,而阳性对照组给予sihr模型大鼠厄贝沙坦后, 其舒张压和收缩压均显著降低,确实起到降压作用,但是其大鼠血压甚 至低于正常wistar大鼠,对于大鼠可能产生低血压的副作用。而给药组 中,实施例1提供的本技术实施例公开的r3菌株发酵水蛭低温干燥品得 到的干燥制品给药sihr模型大鼠,其舒张压和收缩压均显著降低,且与 空白组的正常wistar大鼠血压水平相当,这表明本技术实施例公开的r3 菌株发酵水蛭低温干燥品得到的干燥制品对于大鼠不仅具有降血压的作 用,还无明显的低血压副作用。而给药组中,对比例1和水蛭低温干燥 品提供的供试品给药sihr模型大鼠后,其并未起到明显降血压作用。
[0116]
综上,本技术实施例1通过的由纳豆作为筛选来源,经由初筛、复 筛和终筛,并在复筛中使用了脉冲光辐射处理,经过鉴定,最终筛选得 到一种枯草芽孢杆菌纳豆亚种r3,通过溶酶实验和ace活性检测,发 现其同时具有抗凝血和抑制ace酶活性,而常规的枯草芽孢杆菌纳豆亚 种(对比例1)并不同时具有此两种活性。
[0117]
进一步的,本技术还通过r3菌株发酵水蛭低温干燥品,得到一种干 燥制品,经过鉴定发现其中包含两种活性多肽,分别对应产生抗凝血和 抑制ace酶活性的作用,并经过动物实验验证了利用r3发酵水蛭低温 干燥品得到的干燥制品同时具有对缺血再灌注脑损伤大鼠具有保护作 用,和降低sihr大鼠的血压水平。由此,说明本技术实施例还提供了将r3菌株应用在制备抗凝血制品、或者制备降血压制品的应用前景。
[0118]
以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围 并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范 围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。