一种缩酚酸环醚类化合物、菌株、制备方法及应用
(一)技术领域
1.本发明涉及一种缩酚酸环醚类化合物、菌株、制备方法及应用。
(二)
背景技术:
2.海洋真菌是一类生活在海洋中的能形成孢子且有真核结构的微生物。大多数真菌栖于某种基物而生活,真菌在海洋中的分布主要取决于寄主的分布,在潮间带高潮线、河口、浅海沙滩、深海沉积物及众多海洋生物中均有分布。海洋真菌次级代谢产物具有结构丰富多样、生物活性谱广且强度高的特点,是海洋活性天然产物的重要来源。生物活性主要有抗菌、抗肿瘤、抗氧化、酶抑制活性等。如现已广泛用于临床的抗生素头孢菌素c,是从海洋真菌中分离获得。
3.chen等人曾报道的tenellic acid a methyl ester为缩酚酸环醚类化合物,分离自海洋软木软柳珊瑚来源的真菌talaromyces sp.的发酵液中,该化合物对hepg2、hep3b、mcf-7、pc-3和hct-116细胞系表现出细胞毒性。但从海洋微生物中获得具有抗幽门螺旋杆菌的化合物文献报道较少。
4.本发明筛选得到一株菌株-海洋来源的篮状真菌whuf0362,经发酵培养获得的新缩酚酸环醚类化合物,迄今在国内外尚未见有与此雷同的化合物及活性的相关专利或文献报道。
(三)
技术实现要素:
5.本发明目的是提供一种式(ⅰ)所示具有酯基的新缩酚酸环醚类化合物及其制备方法和在制备抗菌药物中的应用,该化合物利用篮状真菌whuf0362发酵培养制备,具有抑制幽门螺旋杆菌26695或幽门螺旋杆菌g27活性,为治疗幽门螺旋杆菌感染提供了新的途径。
6.本发明采用的技术方案是:
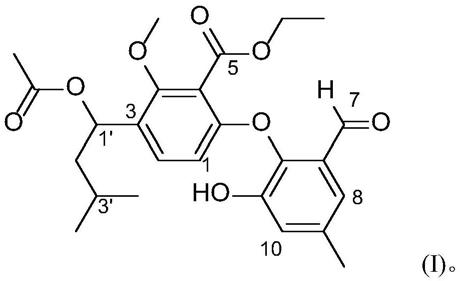
7.第一方面,本发明提供了一种式(ⅰ)所示缩酚酸环醚类化合物:
[0008][0009]
第二方面,本发明提供了一种式(ⅰ)所示缩酚酸环醚类化合物的制备方法,所述方法包括如下步骤:
[0010]
(1)发酵培养:篮状真菌(talaromyces sp.)whuf0362接种至大米培养基中,室温(25-30℃)静置发酵10-15天(优选15天),得到发酵物;所述大米培养基是将大米与水以质
量比1:1-10混合而成,优选1:1.5;所述大米可以是可食用稻米,优选东北大米;所述篮状真菌(talaromyces sp.)whuf0362保藏于中国典型培养物保藏中心,保藏日期2021年11月30日,保藏编号cctcc no:m20211516,地址:中国武汉武汉大学;
[0011]
(2)粗提物:将发酵物搅拌分散,加入等体积的乙酸乙酯超声提取,过滤,滤液减压浓缩至无液体冷凝,干燥(优选60℃干燥5h),得到粗提物;
[0012]
(3)分离提取:
[0013]
a、粗提物用乙酸乙酯溶解后采用正相硅胶色谱柱分离,依次用体积比10:1、1:1石油醚-乙酸乙酯,体积比30:1、5:1二氯甲烷-甲醇,纯甲醇作为洗脱剂进行洗脱,洗脱速度均为10-30ml/min(优选20ml/min),洗脱体积均为2-6个(优选5个)柱体积,每瓶接500ml流出液,经薄层层析(tlc,展开剂为二氯甲烷-甲醇9:1,v/v)点板监测,合并rf为0.71-1.0的流出液,记为组分a1;合并rf为0.61-0.7的流出液,记为组分a2;合并rf为0.51-0.6的流出液,记为组分a3;合并rf为0.41-0.5的流出液,记为组分a4;合并rf为0.31-0.4的流出液,记为组分a5;合并rf为0.21-0.3的流出液,记为组分a6;合并rf为0.1-0.2的流出液,记为组分a7;
[0014]
b、组分a3再经mci填料开放色谱柱分离,以体积浓度20%、40%、60%、70%、80%、85%、90%、95%、100%的甲醇-水做为洗脱剂进行洗脱,洗脱速度均为10-30ml/min(优选20ml/min),洗脱体积均为2-6个(优选5个)柱体积,合并20%甲醇-水的流出液,记为组分c1;合并40%甲醇-水的流出液,记为组分c2;合并60%甲醇-水的流出液,记为组分c3;合并70%甲醇-水的流出液,记为组分c4;合并80%甲醇-水的流出液,记为组分c5;合并85%甲醇-水的流出液,记为组分c6;合并90%甲醇-水的流出液,记为组分c7;合并95%甲醇-水的流出液,记为组分c8;合并100%甲醇-水的流出液,记为组分c9;
[0015]
c、组分c9经正相硅胶色谱柱分离,依次用体积比10:1、5:1石油醚-乙酸乙酯作为洗脱剂进行洗脱,洗脱速度均为5-15ml/min(优选10ml/min),洗脱体积均为2-6个(优选5个)柱体积,每瓶接500ml流出液,经tlc(展开剂为石油醚-乙酸乙酯2:1,v/v)点板,合并rf为0.91-1.0的流出液,记为组分c
9-1;合并rf为0.81-0.9的流出液,记为组分c
9-2;合并rf为0.71-0.8的流出液,记为组分c
9-3;合并rf为0.61-0.7的流出液,记为组分c
9-4;合并rf为0.51-0.6的流出液,记为组分c
9-5;合并rf为0.41-0.5的流出液,记为组分c
9-6;合并rf为0.21-0.4的流出液,记为组分c
9-7;合并rf为0-0.2的流出液,记为组分c
9-8;
[0016]
d、步骤c收集的c
9-3组分再经半制备型高效液相色谱分离,以体积比69:31的甲醇-水等度洗脱,收集27.5min处的馏分,浓缩蒸干(优选40-60℃),得到式(i)所示缩酚酸环醚类化合物。
[0017]
进一步,步骤(1)中篮状真菌whuf0362发酵前先进行活化和种子扩大培养,再将种子液以体积浓度5%的接种量接种至大米培养基中,所述活化和种子扩大培养为:将篮状真菌whuf0362接种到平板培养基中,于28℃培养箱培养3-5d,优选3d天,至菌落长至成熟;取孢子接种于isp4液体培养基中,于28-30℃、180-220rpm摇床振荡培养3-5d(优选28℃、200rpm、4d),作为种子液;平板培养基终浓度组成为土豆200g/l、葡萄糖20g/l、琼脂15~20g/l、溶剂为水,自然ph;isp4液体培养基终浓度组成为:可溶性淀粉15g/l、葡萄糖5g/l、蛋白胨(肉胨)5g/l、酵母粉5g/l、(nh4)2so
4 0.5g/l、k2hpo
4 0.5g/l、nacl 0.5g/l、mgso4·
7h2o 0.5g/l、caco
3 1g/l,溶剂为水,ph 7.2。
[0018]
进一步,步骤(2)中,发酵物用玻璃棒搅拌分散;所述超声提取条件为70khz频率常温20min,提取次数为1-3次。
[0019]
进一步,步骤(3)的a和c中,硅胶色谱柱的硅胶均采用青岛海洋化工,型号为200~300目,层析柱高50cm,内经3cm;硅胶高度为30cm。
[0020]
进一步,步骤(3)的b中,mci色谱柱,mci色谱柱填料为日本mitsubishi化学公司的mci gel chp20p型,层析柱高60cm,内径5cm,mci填料高度为40cm。
[0021]
进一步,步骤(3)的d中半制备型高效液相色谱的色谱柱型号为agilent zorbax sb-c18(5μm,9.6
×
150mm),高效液相色谱系统为agilent 1260,检测波长为220nm、254nm,进样量为50μl。
[0022]
第三方面,本发明提供了式(i)所示缩酚酸环醚类化合物在制备抗菌药物中的应用。
[0023]
进一步,所述的抗菌药物为抑制幽门螺旋杆菌26695或幽门螺旋杆菌g27的药物。
[0024]
第四方面,本发明还提供用于制备式(i)所示缩酚酸环醚类化合物的篮状真菌(talaromyces sp.)whuf0362,保藏于中国典型培养物保藏中心,保藏日期2021年11月30日,保藏编号cctcc no:m20211516,地址:中国武汉,武汉大学。
[0025]
与现有技术相比,本发明的有益效果主要体现在:本发明筛选的篮状真菌whuf0362培养方便易存活,利用该篮状真菌whuf0362发酵提取的化合物(i),结构新颖,且对幽门螺旋杆菌具有一定的抑制作用,mic值为16μg/ml,其提取分离方法简易,便于对其进行进一步的药理和临床研究,为开发疗效好且毒副作用小的新型抗菌药物创造条件。
(四)附图说明
[0026]
图1:式(i)化合物的制备流程。
[0027]
图2:式(i)化合物的高分辨esi质谱。
[0028]
图3:式(i)化合物的氢谱。
[0029]
图4:式(i)化合物的碳谱。
[0030]
图5:式(i)化合物的hsqc谱。
[0031]
图6:式(i)化合物的hmbc谱。
(五)具体实施方式
[0032]
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
[0033]
实施例1:菌株whuf0362的筛选及鉴定
[0034]
1、菌株筛选
[0035]
(1)将2018年12月采集自中国海南三亚市亚龙湾的红树林秋茄根际土壤样品分别用无菌水逐级稀释为10-1
,10-2
,10-3
不同梯度,每个稀释度再进行下一步稀释前,涡旋震荡3-5分钟;将不同稀释梯度的样品分别用涂布棒均匀涂布在mea固体培养基,放入30℃恒温培养箱倒置培养。每个样品设3个平行试验。
[0036]
(2)随后的l至7天,观察步骤(1)培养物并挑取不同类型的单菌落重复步骤(1)划线分离,直到确定为纯单一菌落。
[0037]
(3)将步骤(2)不同的单菌落分别接种在pda固体培养基,28℃培养24h后,将菌丝切块,采用琼脂块法进行抗菌活性检测,具体为:将菌丝用无菌水悬浮制成10-6
的菌悬液,接种至pda平板培养基,30℃培养96h后,用无菌打孔器制备琼脂块,并在30℃培养72h,放置在接种有指示菌(大肠杆菌cctcc ab 93154)的lb培养基平板表面,30℃培养24h,检测抑菌圈直径。阳性对照药为硫酸卡那霉素,用无菌水配成64、32、16、8、4μg/ml。挑选抗菌活性相当于32μg/ml阳性药的菌株,记为菌株whuf0362。
[0038]
(4)挑取步骤(3)菌株whuf0362单菌落接种至pda固体培养基斜面上,28℃培养7天,获得菌株whuf0362孢子,加20%甘油,保存于-80℃冰箱。
[0039]
mea固体培养基组成:麦芽提取物17g/l,蛋白胨3g/l,海盐15g/l,琼脂20g/l,溶剂为双蒸水,ph自然。
[0040]
pda固体培养基组成:马铃薯提取物5g/l,葡萄糖20g/l,海盐15g/l,琼脂20g/l,溶剂为双蒸水,ph 6
±
0.2。
[0041]
lb固体培养基组成:氯化钠10g/l,酵母提取物5g/l,胰蛋白胨10g/l,琼脂20g/l,溶剂为双蒸水,ph 5.0-5.5。
[0042]
2、菌株whuf0362鉴定
[0043]
(1)菌落形态特征
[0044]
将菌株whuf0362接种至mea固体培养基中,于28℃培养箱培养7天,至菌落长至成熟。菌落形态为:菌落呈白色菌丝,绒状,孢子呈现浅黄色。
[0045]
(2)its rdna测定
[0046]
采用核酸提取仪快速提取的方法,于核酸提取管中事先填装少量石英砂并灭菌,使用灭菌的竹签挑取肉眼可见的新鲜菌丝于核酸提取管中,菌丝没于石英砂内部。向核酸提取管中加入400μl无菌水,旋紧盖子后使用核酸提取仪震荡30s
×
3次,加入400μl酚/氯仿/异戊醇(25:24:1)混合液,用涡旋仪混匀核酸提取管内容物,以13300rpm离心5min,吸取上清液置于新的1.5ml离心管中,4℃冷藏备用。
[0047]
采用通用引物对its条形码区域进行pcr扩增,its的正向引物its1:5'-tcc gta ggt gaa cct gcg g-3',反向引物为its4:5'-tcc tcc gct tat tga tat gc-3'。由武汉擎科公司合成。pcr反应采用50μl体系,25μl 2
×
es taq master mix(dye),2μl上游引物,2μl下游引物,2μl模板,19μl水。pcr反应条件:95℃预变性2min,94℃变性30s,55℃退火30s,72℃延伸50s,30个循环,72℃终延伸5min。使用0.8%琼脂糖凝胶电泳验证目的序列是否扩增成功,所使用的电泳条件为110v,40min。将含有目的dna序列的菌液交由华大基因有限公司进行测序,获得its rdna(seq id no.1所示)。
[0048]
its rdna(seq id no.1所示)序列:
[0049]
cttgtttcctcccgccttattgatatgcttaagttcagcgggtaactcctacctgatccgaggtcaaccttgtaaaaaagatgtggtggtgaccaacctccgcaggtccttcccgagcgagtgacagagccccatacgctcgaggaccagacggacgtcgccgctgcctttcgggcaggtccccggagggaccacacccaacacacaagccgtgcttgagggcagaaatgacgctcggacaggcatgccccccggaatgccagggggcgcaatgtgcgttcaaagattcgatgattcacggaattctgcaattcacattacttatcgcatttcgctgcgttcttcatcgatgccggaaccaagagattcgttgttgaaagttttgacaattttcatatcactcagacagcccatcttcatcagggttcaaagggcgctccggcgggcgcgggcccggggacagacgtcccccggcgaccaggtggccccggtgggcccgccgaagcaacaggtatatgagacaa
gggtgggaggttgggccgcgagggccctcactcggtaatgatccttccgcaggtcacccttacggaaggtttttttgtgtgg。
[0050]
上游引物(f)its1序列:5
’‑
tccgtaggtgaacctgcgg-3’[0051]
下游引物(r)its4序列:5
’‑
tcctccgcttattgatatgc-3’[0052]
基于its序列,与柄篮状菌(ncbi参考序列:nr_147424.1)有96.13%的相似性,菌株whuf0362被鉴定为篮状真菌(talaromyces sp.),命名为篮状真菌(talaromyces sp.)whuf0362,保藏于中国典型培养物保藏中心,保藏日期2021年11月30日,保藏编号cctcc no:m20211516。
[0053]
实施例2、式(i)化合物的制备
[0054]
1、发酵培养
[0055]
挑取保存在冻存管中的篮状真菌whuf0362菌株,接种到平板培养基中,于28℃培养箱培3天,至菌落长至成熟。取孢子接种于isp4液体培养基中,于28℃、200rpm摇床振荡培养4天,作为种子液。将种子液以体积浓度5%的接种量分别接入灭菌后的含有200g大米培养基的1l锥形瓶中,共计60瓶。室温静置培养15d,获得发酵物。
[0056]
平板培养基终浓度组成为:土豆200g/l、葡萄糖20g/l、琼脂18g/l、溶剂为水,自然ph。
[0057]
isp4液体培养基终浓度组成为:可溶性淀粉15g/l、葡萄糖5g/l、蛋白胨(肉胨)5g/l、酵母粉5g/l、(nh4)2so
4 0.5g/l、k2hpo
4 0.5g/l、nacl 0.5g/l、mgso4·
7 h2o 0.5g/l、caco
3 1g/l,溶剂为水,ph 7.2。
[0058]
每200g大米培养基终浓度组成为:80g大米(东北大米)、120g水。
[0059]
2、分离提取
[0060]
(1)将每瓶发酵物用玻璃棒搅拌至大米分散,加入等体积乙酸乙酯,在70khz条件下超声辅助萃取20min,重复三次。过滤,将滤液(即60瓶发酵物中的乙酸乙酯层)合并,减压浓缩至无液体冷凝,60℃干燥5h,得到粗提物83.77g。
[0061]
(2)83.77g粗提物用100ml乙酸乙酯溶解后,采用干法上样进行正向硅胶色谱柱分离(硅胶选用青岛海洋化工,200~300目,硅胶柱高50cm、内径3cm,硅胶高度为30cm),依次用体积比10:1、1:1的石油醚-乙酸乙酯,体积比30:1、5:1的二氯甲烷-甲醇,纯甲醇作为洗脱剂进行洗脱,洗脱速度均为20ml/min,每个洗脱剂洗脱量均为5个柱体积,每500ml收集一瓶流出液,经薄层色谱法(tlc,二氯甲烷-甲醇9:1,v/v)点板监测,合并rf值为0.71-1.0的流出液,记为组分a1;合并rf值为0.61-0.7的流出液,记为组分a2;合并rf值为0.51-0.6的流出液,记为组分a3;合并rf值为0.41-0.5的流出液,记为组分a4;合并rf值为0.31-0.4的流出液,记为组分a5;合并rf值为0.21-0.3的流出液,记为组分a6;合并rf值为0.1-0.2的流出液,记为组分a7;
[0062]
(3)组分a3再进行mci色谱柱(填料为日本mitsubishi化学公司的mci gel chp20p型,柱高60cm,内径5cm,mci填料高度为40cm)分离,以体积浓度20%、40%、60%、70%、80%、85%、90%、95%、100%的甲醇-水做为洗脱剂进行洗脱,洗脱速度均为20ml/min,每个浓度洗脱剂洗脱量均为5个柱体积,合并20%甲醇-水的流出液,记为组分c1;合并40%甲醇-水的流出液,记为组分c2;合并60%甲醇-水的流出液,记为组分c3;合并70%甲醇-水的流出液,记为组分c4;合并80%甲醇-水的流出液,记为组分c5;合并85%甲醇-水的流出液,
记为组分c6;合并90%甲醇-水的流出液,记为组分c7;合并95%甲醇-水的流出液,记为组分c8;合并100%甲醇-水的流出液,记为组分c9;
[0063]
(4)组分c9进行正相硅胶色谱柱分离(硅胶选用青岛海洋化工,200~300目,硅胶柱高50cm、内径3cm,硅胶高度为30cm),依次用体积比10:1、5:1的石油醚-乙酸乙酯作为洗脱剂进行洗脱,洗脱速度均为10ml/min,每个浓度洗脱量均为5个柱体积,每500ml收集流出液,经tlc(石油醚-乙酸乙酯2:1,v/v)点板,合并rf为0.91-1.0的流出液,记为组分c
9-1;合并rf为0.81-0.9的流出液,记为组分c
9-2;合并rf为0.71-0.8的流出液,记为组分c
9-3;合并rf为0.61-0.7的流出液,记为组分c
9-4;合并rf为0.51-0.6的流出液,记为组分c
9-5;合并rf为0.41-0.5的流出液,记为组分c
9-6;合并rf为0.21-0.4的流出液,记为组分c
9-7;合并rf为0-0.2的流出液,记为组分c
9-8;
[0064]
(5)步骤(4)组分c
9-3再进行半制备型高效液相色谱分离,色谱柱型号为agilent zorbax sb-c18(5μm,9.6
×
150mm),高效液相色谱系统为agilent 1260,检测波长为220nm、254nm,进样量为50μl,以体积比69:31的甲醇-水等度洗脱,收集27.5min处的馏分,浓缩蒸干(40-60℃),得到式(i)所示的缩酚酸环醚类化合物(13.4mg)。
[0065]
3、化合物(i)结构鉴定
[0066]
所得化合物(i)利用高分辨质谱(hresims)、核磁共振谱(1h nmr、
13
c nmr、2d nmr)进行结构鉴定,结果见图2-图6所示。
[0067]
(1)hresims
[0068]
高分辨质谱(hresims)检测条件:仪器型号:agilent 6210tof ms离子源参数esi-:vcap:3000v gas temp:325℃drying gas:7l/min nebulizer:45psig
[0069]
化合物i为无色油状物,hresims(图2)给出准分子离子峰m/z 457.1879[m-h]-,确定化合物分子式为c
25h30
o8。
[0070]
(2)1h nmr
[0071]1h nmr(cdcl3,600mhz)谱(图3)给出1个醛基质子δ
h 10.20(s,1h,h-7),4个芳香质子δ
h 7.27(d,j=8.8hz,1h,h-2),7.26(d,j=2.1hz,1h,h-8),7.10(d,j=2.1hz,1h,h-10),6.49(d,j=8.7hz,1h,h-1),1个甲氧基质子δ
h 3.97(s,3h,4-ome),5个甲基质子2.35(s,3h,9-me),2.03(s,3h,1
’‑
oac),1.47(t,j=7.2hz,3h,5-oet),0.94(d,j=4.0hz,3h,h-4’),0.93(d,j=4.1hz,3h,h-5’),2组亚甲基质子δ
h 4.53(q,j=7.1hz,2h,5-oet),1.73(ddd,j=14.3,9.4,5.3hz,1h,h-2’a),1.47(m,1h,h-2’b),2个次甲基质子δ
h 6.10(dd,j=9.4,4.5hz,1h,h-1’),1.62(m,1h,h-3’)。
[0072]
(3)
13
c nmr、2d nmr、hmbc
[0073]
13
c nmr(cdcl3,150mhz)谱(图4)并结合hsqc谱(图5)给出25个碳信号,包括1个醛羰基c-7(δ
c 189.5),2个酯羰1
’‑
oac(δ
c 170.4),c-5(167.5);4个芳香碳c-1(δ
c 112.0),c-2(129.9),c-8(119.7),c-10(124.9);8个sp2季碳c-3(δ
c 131.4),c-4(155.6),c-4a(118.4),c-11a(142.6),c-12a(155.8),c-7a(130.2),c-9(137.4),c-11(149.8);1个甲氧基4-ome(δ
c 63.1);5个甲基5-oet(14.3),9-me(21.2),1
’‑
oac(21.3),c-5’(23.2),c-4’(22.0);2个亚甲基5-oet(δ
c 63.0),c-2’(45.6);2个次甲基c-1’(δ
c 68.6),c-3’(25.0),与化合物secopenicillide b结构相似,除了c-5位上的取代基不同;1h-1
hcosy谱图显示亚甲基质子δ
h 4.53与甲基质子δ
h 1.47相关,说明其为乙基,结合亚甲基碳δ
c 63.0,说明该乙基
与氧原子相连;hmbc谱图(图6)显示,c-5与亚甲基质子δ
h 4.53相关,说明该乙氧基与c-5相连。将式i化合物的1h和
13
c nmr信号进行了归属(表1)。
[0074]
通过上述解析,最终确定化合物结构式如式(i)所示:
[0075][0076]
表1.式(i)化合物1h和
13
c nmr化学位移值(溶剂为cdcl3)
[0077][0078][0079]
实施例3:式(i)化合物在体外对革兰氏幽门螺旋杆菌26695(h.pylori 26695)和幽门螺旋杆菌g27(h.pylori g27)的抑菌活性,具体步骤如下:
[0080]
(1)试验菌液的准备:
[0081]
幽门螺旋杆菌26695菌液:选取生长在固体培养基上的幽门螺旋杆菌26695(h.pylori 26695,购自美国菌种保藏中心actt)单克隆菌落,将其接种至哥伦比亚平板培养基上,37℃培养2天生长到稳定期,然后体积比1:100的接种量接种至新鲜的含体积浓度10%小牛血清bhi培养基,37℃培养1天至对数中后期(od
600nm
=0.8-1.0),获得幽门螺旋杆菌26695菌液,浓度106cfu/ml。
[0082]
幽门螺旋杆菌g27菌液:将幽门螺旋杆菌26695菌液制备过程中幽门螺旋杆菌26695替换为幽门螺旋杆菌g27(h.pylori g27,购自美国菌种保藏中心actt),其他操作相同,获得幽门螺旋杆菌g27菌液,浓度106cfu/m。
[0083]
哥伦比亚平板组成:酪蛋白胰酶消化物10g/l,肉胃酶消化物5g/l,心胰酶消化物3g/l,淀粉1g/l,氯化钠5g/l,琼脂15g/l,酵母浸出粉5g/l,溶剂为纯净水,ph值自然。
[0084]
bhi培养基组成:牛脑200g/l,牛心浸出汁250g/l,蛋白胨10g/l,葡萄糖2g/l,nacl 5g/l,溶剂为蒸馏水,ph 6.8-7.2。
[0085]
(2)药物的准备:
[0086]
化合物入库:实施例2制备的式(i)化合物按药物要求0.5mg,分装保存;药物溶解与稀释配置成原液,原液浓度常为测定最高浓度的20倍以上。原液配置好后,小量分装备用,保存至-80℃冰箱。
[0087]
将实施例2制备的式(i)化合物用二甲基亚砜(dmso)溶解至浓度为1.6mg/ml,即为药液。
[0088]
(3)体外抗菌活性初筛
[0089]
在96孔板中,加入89.5μl含体积浓度10%小牛血清的bhi培养基,再用排枪加入0.5μl步骤(2)制备的药液和10μl步骤(1)制备的菌液,使得药物加入终浓度为16μg/ml,震荡混合后,放入37℃培养箱培养24h,用肉眼观测菌体是否生长。
[0090]
同样条件下,以不含药物且不接种菌液的培养孔作为无菌质控(仅含培养基),以接种菌液但不含药物的培养孔作为细菌是否生长的质控(含菌液 培养基)。每个样品重复3次。
[0091]
若无生长,表明初筛结果阳性,待测化合物可能有抗菌活性,进行如下复筛工作。
[0092]
(4)体外抗菌活性复筛
[0093]
在96孔板中,每排的第一孔先加含体积浓度10%小牛血清的bhi培养基179μl和1μl步骤(2)制备的药液(使得药物加入终浓度为16μg/ml);第2-9孔各孔先加含体积浓度10%小牛血清的bhi培养基90μl,第2孔再加入第一孔培养液90μl,后续每孔分别加入前一孔培养液90μl,依次倍比稀释至第9孔,第2孔至第9孔药物浓度分别为8、4、2、1、0.5、0.25、0.125、0.0625μg/ml,第10孔不加药,保留90μl含体积浓度10%小牛血清的bhi培养基,作为加菌不加药对照;第11孔加100μl无菌水。取10μl步骤(1)制备的菌液加至第1-10(每孔菌液浓度为2
×
105cfu/ml),第11孔加无菌水作为不加菌对照。震荡混合后放入培养箱,37℃培养24h,用肉眼观测菌体是否生长。
[0094]
(5)结果判读
[0095]
抗菌药物的mic结果判读:细菌接种于含药物孔中,经步骤(4)适当条件下培养下,可判读结果。以未见细菌生长的最低药物浓度为最小抑菌浓度(mic)值。每接种点上只有薄薄的一层膜时,认为该细菌没有生长。当在微量稀释法出现单一的跳孔时,应记录抑制细菌
生长的最高药物浓度。如出现多处跳孔,则不应报告结果,需重复试验。
[0096]
式(i)化合物作为样品,对幽门螺旋杆菌的mic值结果如表2所示。
[0097]
表2
[0098][0099]
体外实验结果表明式(i)化合物在体外对幽门螺旋杆菌26695和幽门螺旋杆菌g27具有抑制活性,其mic值为16μg/ml,有望开发其在抗幽门螺旋杆菌抑制剂中的用途。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。