使用噬菌体复制起点生产载体
1.相关申请的交叉引用
2.根据35 u.s.c.
§
119(e),本技术要求2019年6月21日提交的美国临时申请号62/864,689的权益,以引用的方式将其内容整体并入本文。
技术领域
3.本发明涉及用于生成用于基因表达的载体的方法和细胞系。
背景技术:
4.将外源dna引入细胞使其提供由该外源dna编码的蛋白质的长期表达是期望的。已经开发了基于病毒的方案,其中使用病毒载体将外源dna引入细胞,随后可以将引入的dna整合到靶细胞的基因组中或保持游离。发现使用的基于病毒的载体包括逆转录病毒载体(例如基于莫洛尼鼠白血病病毒的载体)、腺病毒衍生的载体、腺相关病毒(aav)衍生的载体、hsv衍生的载体、辛德毕斯(sindbis)衍生的载体等。很多兴趣集中在使用aav载体。然而,对于大规模aav生产有效的方法仍然难以捉摸。
5.噬菌粒(phagemid)使用噬菌体衍生的复制起点(ori)制造重组展示蛋白。噬菌体ori以非常高的效率复制单链环状dna。然而,噬菌体ori复制需要由辅助噬菌体提供的额外蛋白质来创建展示重组蛋白的噬菌体颗粒。辅助噬菌体对于噬菌粒系统至关重要,因为它们供应制造功能性噬菌体所需的所有其它蛋白质。辅助噬菌体是具有多个修饰的正常ff噬菌体:它们含有额外的复制起点,它们通常携带抗生素抗性基因,并且它们的包装信号严重失能。
6.当细菌被辅助噬菌体感染时,失能的包装信号不阻止噬菌体颗粒的产生。然而,当细菌感染噬菌粒和辅助噬菌体两者时,噬菌粒dna(包含最优包装信号)被优先包装。因此,噬菌粒制剂在表型和基因型上都是异质的:展示蛋白可以为野生型(衍生自辅助噬菌体)或重组的(衍生自噬菌粒),而所包装的基因组可以是噬菌体或噬菌粒。理论上,失能的包装信号应该会显著减少任何噬菌粒制剂中辅助噬菌体颗粒的数量。然而,辅助噬菌体的数量有时会等于或超过噬菌粒颗粒的数量,这可严重损害后续的选择。本文描述了利用噬菌粒的效率来生成用于病毒生产中的核酸但不需要辅助噬菌体的方法。
技术实现要素:
7.本文描述的本发明的一个方面提供了制造含有转基因的环状核酸载体的方法,所述方法包括:(a)使宿主系统与模板接触,其中,所述模板包含至少一个侧翼切割位点,以及在这些位点内的:(i)至少一个噬菌体复制起点(ori),(ii)至少一个末端重复(tr),和(iii)与转基因可操作地连接的启动子序列;(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收产生的所述环状核酸,其中,所述环状核酸自退火。
8.在任意方面的一个实施方式中,所述模板包含至少两个切割位点。在任意方面的一个实施方式中,所述模板进一步包含紧邻所述至少一个ori的下游的至少一个额外的切
割位点(参见例如图5)。在任意方面的一个实施方式中,所述方法进一步包括对回收的环状核酸的至少一个切割位点进行剪切的步骤(参见例如图5)。
9.在任意方面的一个实施方式中,在回收之后,所述方法进一步包括例如所述环状核酸的体外复制的步骤。
10.在任意方面的一个实施方式中,所述模板进一步包含至少一个衔接子序列或至少两个衔接子序列。在任意方面的一个实施方式中,所述衔接子序列诱导经切割的dna的闭合(参见例如图1-图5、图7和图9)。在任意方面的一个实施方式中,所述衔接子序列进一步包含切割位点。
11.在任意方面的一个实施方式中,回收的环状核酸用于递送所述转基因。
12.在任意方面的一个实施方式中,回收的环状核酸用于重组病毒载体的生产。在任意方面的一个实施方式中,所述病毒载体为腺相关病毒(aav)、慢病毒(lv)、单纯疱疹病毒(hsv)、腺病毒(av)或痘病毒(pv)。在任意方面的一个实施方式中,所述载体为dna病毒或rna病毒。在任意方面的一个实施方式中,所述病毒为aav并且具有突变的itr,其中,所述突变的itr为双d突变itr(double d mutant itr)。
13.在任意方面的一个实施方式中,所述环状核酸自退火(self-annealed)并是双链的。在任意方面的一个实施方式中,所述载体是单链的。
14.在任意方面的一个实施方式中,存在第二tr,并且与转基因可操作地连接的启动子序列的两侧以tr为侧翼。
15.在任意方面的一个实施方式中,所述ori位于左tr的上游。在任意方面的一个实施方式中,所述ori以tr为侧翼,并且处于与转基因可操作地连接的启动子序列的上游。
16.在任意方面的一个实施方式中,所述宿主系统为细菌包装细胞。在任意方面的一个实施方式中,所述宿主系统为无细胞系统。在任意方面的一个实施方式中,所述宿主系统为无细胞系统并且含有辅助噬菌体颗粒。
17.在任意方面的一个实施方式中,所述宿主系统为宿主细胞。示例性宿主细胞包括哺乳动物细胞、细菌细胞或昆虫细胞。
18.在任意方面的一个实施方式中,所述至少一个tr为突变的itr、合成的itr、野生型itr或非功能性itr。
19.在任意方面的一个实施方式中,所述载体具有侧翼dd-itr,并且在侧翼之间为与转基因的有义链可操作地连接的启动子、复制缺陷型itr和所述转基因的反义互补物。
20.在任意方面的一个实施方式中,其中,所述itr为aav itr
21.在任意方面的一个实施方式中,所述ori位于itr的上游,并且紧邻上游itr的下游。
22.在任意方面的一个实施方式中,所述至少一个噬菌体ori为m13来源的ori、f1来源的ori或fd来源的ori。
23.在任意方面的一个实施方式中,所述模板进一步包含第二ori,所述第二ori为不启动复制的截短的ori。在任意方面的一个实施方式中,所述截短的ori为oriδ29。
24.在任意方面的一个实施方式中,所述至少两个切割位点为限制性位点。在任意方面的一个实施方式中,所述至少两个限制性位点相同或不同。在任意方面的一个实施方式中,在所述转基因序列内未发现所述限制性位点。
25.在任意方面的一个实施方式中,所述切割位点由核酸酶切割。
26.在任意方面的一个实施方式中,所述启动子选自于由以下所组成的组:组成型启动子、阻抑型启动子、遍在启动子(ubiquitous promoter)、诱导型启动子、病毒启动子、组织特异性启动子和合成启动子。
27.在任意方面的一个实施方式中,所述转基因为治疗性基因。
28.本文所述的本发明的另一方面提供了制造含有转基因的环状核酸载体的方法,所述方法包括:(a)用质粒模板转化宿主系统,其中,所述质粒模板包含:(i)噬菌体复制起点(ori),(ii)截短的噬菌体ori(例如,oriδ29),(iii)至少一个末端重复(tr),以及(iv)与转基因可操作地连接的启动子序列,其中,所述质粒模板以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火;(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收产生的所述环状核酸,其中,所述环状核酸自退火。
29.在任意方面的一个实施方式中,所述质粒模板进一步包含在ori侧翼的接头和自互补接头。
30.在任意方面的一个实施方式中,所述转基因包含由接头序列隔开的有义序列及其反义互补物,所述接头序列将允许有义链和反义链结合为双链。例如,接头是holliday序列或复制缺陷型tr。
31.本文所述的本发明的另一方面提供了通过本文所述的方法中的任一种制造的环状核酸载体。
32.本文所述的本发明的另一方面提供了环状核酸载体,所述环状核酸载体包含至少一个侧翼切割位点,以及在这些位点内的:(i)至少一个噬菌体复制起点(ori),(ii)至少一个末端重复(tr),和(iii)与转基因可操作地连接的启动子序列。
33.本文所述的本发明的又一方面提供了环状核酸载体,所述环状核酸载体包含:(i)噬菌体复制起点(ori);(ii)截短的噬菌体ori(例如,oriδ29);(iii)至少一个末端重复(tr);以及(iv)与转基因可操作地连接的启动子序列,其中,所述载体以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火。
34.定义
35.为了方便起见,在说明书、实施例和所附的权利要求中使用的一些术语和短语的含义提供如下。除非另有说明或由上下文隐含的,下列术语和短语包含下面所提供的含义。提供这些定义以帮助描述特定的实施方式,而并不打算限制所要求保护的技术,因为本技术的范围仅通过权利要求加以限定。除非另有定义,本文所使用的所有技术术语和科学术语具有与本技术所属技术领域中的普通技术人员通常理解的含义相同的含义。如果在本领域中的术语的使用与本文所提供的定义之间存在明显的差异,则应以本说明书中提供的定义为准。
36.免疫学和分子生物学中的常见术语的定义可见于:the merck manual of diagnosis and therapy,第19版,由merck sharp&dohme corp.出版,2011(isbn 978-0-911910-19-3);robert s.porter等(编著),the encyclopedia of molecular cell biology and molecular medicine,由blackwell science ltd.出版,1999-2012(isbn 9783527600908);以及robert a.meyers(编著),molecular biology and biotechnology:
a comprehensive desk reference,由vch publishers,inc.出版,1995(isbn1-56081-569-8);immunology by werner luttmann,由elsevier出版,2006;janeway's immunobiology,kenneth murphy,allan mowat,casey weaver(编著),taylor&francis limited,2014(isbn 0815345305,9780815345305);lewin's genes xi,由jones&bartlett publishers出版,2014(isbn-1449659055);michael richard green和joseph sambrook,molecular cloning:a laboratory manual,第4版,cold spring harbor laboratory press,cold spring harbor,n.y.,usa(2012)(isbn1936113414);davis等,basic methods in molecular biology,elsevier science publishing inc.,new york,usa(2012)(isbn 044460149x);laboratory methods in enzymology:dna,jon lorsch(编著),elsevier,2013(isbn 0124199542);current protocols in molecular biology(cpmb),frederick m.ausubel(编著),john wiley and sons,2014(isbn 047150338x,9780471503385);current protocols in protein science(cpps),john e.coligan(编著),john wiley and sons,inc.,2005;以及current protocols in immunology(cpi)(john e.coligan,ada m kruisbeek,david h margulies,ethan m shevach,warren strobe(编著),john wiley and sons,inc.,2003(isbn 0471142735,9780471142737);以引用的方式将它们的内容以其整体全部并入本文。
37.如本文所使用的,术语“治疗性基因”是指编码具有期望的治疗效果的分子的基因或其功能片段。例如,由于其缺失或突变引起病理性细胞生长或细胞增殖增加的基因。如本文所使用的治疗性基因将替代此类缺失或突变的基因。治疗性基因可以通过以下方式来产生它们的治疗效果:保持在染色体外以使基因将从染色体外位置由细胞表达,或者可以将基因并入细胞的基因组中以使其与内源基因重组。
38.如本文所使用的,“接触”泛指将模板或质粒模板置于宿主系统中,使得其存在于宿主系统中。较不广泛地,接触是指将模板或质粒模板置于本文所述的宿主系统中的任何适当方式。接触可以通过使得模板适当地转运到细胞内部的方式进行,例如使得通过宿主细胞体系产生环状核酸。此类接触可以涉及例如转化、转染、电穿孔或脂质体转染。
39.如本文所使用的,术语“核苷酸序列”、“核酸序列”和“dna序列”在本文中可互换使用,并指核酸的序列,例如,将被递送到靶细胞中的环状核酸的序列。通常,核酸包含编码感兴趣的多肽或非翻译rna的开放阅读框(例如,用于递送至细胞或受试者)。核酸序列可进一步包含调节序列,其组合可称为转基因或表达构建体。优选地,核酸为异源的,即与itr的结合不是天然存在的(例如,不是天然存在于itr所衍生自的病毒中)。此类核酸被称为异源的。
40.如本文所使用的,术语“启动子”是指启动和调节多核苷酸转录的核苷酸序列。启动子可以包括诱导型启动子(其中与该启动子可操作地连接的多核苷酸序列的表达由分析物、辅因子、调节蛋白等进行诱导)、阻抑型启动子(其中与该启动子可操作地连接的多核苷酸序列的表达由分析物、辅因子、调节蛋白等进行阻抑)和组成型启动子。术语“启动子”或“控制元件”旨在包括全长启动子区域和这些区域的功能(例如对转录或翻译进行控制)区段。
41.如本文所使用的,术语“可操作地连接”是指元件的布置,其中如此描述的组分被配置从而执行它们的通常功能。因此,当存在适当的酶时,与具有编码序列的核酸序列可操
作地连接的给定启动子能够影响该序列的表达。只要启动子发挥指导序列表达的功能,其不必与序列连续。因此,例如,在启动子序列和核酸序列之间可以存在间插(intervening)的不翻译但转录的序列,并且启动子序列仍然可以被认为与具有编码序列的核酸“可操作地连接”。因此,术语“可操作地连接”旨在涵盖在转录复合物识别启动子元件时使感兴趣的编码序列转录得以起始的启动子元件和感兴趣的编码序列的任何间距或取向。
42.如本文所使用的,术语“表达”是指参与产生rna和蛋白质的细胞过程,包括(如果适用的话)但不限于例如转录、转录物加工、翻译和蛋白质折叠、修饰和加工。“表达产物”包括转录自基因的rna以及通过转录自基因的mrna的翻译而获得的多肽。术语“基因”意为当可操作地连接至合适的调节序列时,在体外或体内转录(dna)成rna的核酸序列。基因可包括或可不包括编码区域之前和之后的区域,例如,5’未翻译(5’utr)或“前导”序列以及3’utr或“尾随(trailer)”序列、以及单独的编码区段(外显子)之间的间插序列(内含子)。
43.如本文所使用的,术语“互补物”是指具有与dna的给定实例(例如其所产生自的模板)的碱基互补的碱基的dna序列。应当理解的是,t与a互补,c与g互补。
44.如本文所使用的,“自互补”是指具有如下dna序列的单链dna:其中从5'端读取的序列和从3'-端读取的序列互补。此类序列自身可以形成双链dna。例如,5
′‑
gcttcgatcgaagc-3
′
(seq id no:234)为自互补序列。
45.如本文所使用的,“质粒片段”是指通过剪切至少两个切割位点而切下的质粒的双链线性dna。例如,本发明的质粒片段是含有至少两个切割位点内所含有的所有元件(例如ori、itr和与转基因可操作地连接的启动子)的单链线性dna。当至少一个衔接子退火至至少一端时,质粒片段被认为是“模板”。
46.在本文所述的多种实施方式中,在进一步考虑之列的是涵盖所描述的任何具体多肽的变体(天然存在的或其它的)、等位基因、同源物、保守修饰变体和/或保守置换变体。对于氨基酸序列,本领域普通技术人员将认识到,当改变引起将氨基酸置换为化学上类似的氨基酸并保留了多肽的期望活性时,对经编码的序列中的单个氨基酸或少部分的氨基酸进行改变的核酸、肽、多肽或蛋白序列的各个置换、删除或添加是“保守修饰变体”。此类保守修饰变体是对与本公开相一致的多态变体、种间同源物和等位基因的补充,并且不排除与本公开相一致的多态变体、种间同源物和等位基因。
47.如本文所使用的,“一个/一种(a/an)”或“该/所述(the)”可为单数或复数,取决于此类使用的上下文。例如,“一个细胞”可以表示单个细胞,也可以表示多个细胞。
48.同样如本文所使用的,“和/或”是指并涵盖相关列出的项目中一个或多个的任何和所有可能的组合,以及在解释为替代方式时(“或”)缺少组合。
49.此外,本文所使用的术语“约”当指可测量的值(例如本发明的组合物的量、剂量、时间、温度等)时意在涵盖指定量的
±
20%、
±
10%、
±
5%、
±
1%、
±
0.5%或甚至
±
0.1%的变化。
50.如本文所使用的,术语“包括/包含”用于指对于方法或组合物而言必不可少的组合物、方法及其各自的组成部分,但对于未指定的要素(无论是否必不可少)的包含保持开放。
51.如本文所使用的,术语“基本上由
……
组成”是指给定实施方式所需的那些要素。该术语允许不实质影响该实施方式的基本和新颖或功能特征的要素的存在。术语“由
……
组成”是指如本文所述的组合物、方法及其各自的组成部分,其排除在该实施方式的描述中未列举的任何要素。
附图说明
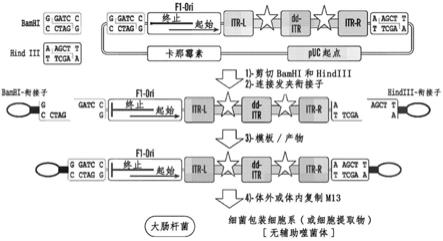
52.图1呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、f1 ori、itr-l、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、itr-r和hindiii限制性位点,并且通过限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌(e.coli)细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
53.图2呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、f1 ori、itr-l、连接至转基因的启动子(用星形表示)、itr-r和hindiii限制性位点,并且通过所述限制性位点而具有连联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
54.图3呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、itr-l、f1 ori、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、itr-r和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
55.图4呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、itr-l、f1 ori、连接至转基因的启动子(用星形表示)、itr-r和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
56.图5呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、f1 ori、pvuii限制性位点、itr-l、连接至转基因的启动子(用星形表示)、itr-r和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。复制后,用pvuii限制性酶进一步剪切环状核酸,移除衔接子序列和ori,并产生一个开放末端和一个闭合末端。
57.图6呈现闭环线性raav基因组的生物生产示意图。质粒模板被转化到大肠杆菌细胞中并经历复制。对aav核酸载体进行复制,所述aav核酸载体为自退火成闭合线性dna的闭合环状ssdna。
58.图7呈现了制造载体的示意图,所述载体以5'至3'的方向具有sfi1或pvuii限制性
位点、f1 ori、itr-l、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、itr-r和第二sfi1或pvuii限制性位点,通过限制性位点而具有联接至末端的衔接子序列。在联接衔接子序列之前,通过用sfi1或pvuii限制性酶剪切来将载体切下。该载体可以在体外复制,例如在细菌包装细胞中。
59.图8呈现了制造自互补单链dna载体的示意图,所述载体以5'至3'的方向具有f1 ori、itr-l、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、itr-r、发夹序列、互补的itr-r、连接至转基因的互补的启动子(用星形表示)、互补的dd-itr(突变体)、连接至转基因的互补的启动子(用星形表示)、互补的itr-l和oriδ29。该方法使用细菌包装细胞和辅助噬菌体。星号表示互补序列,例如互补的tr或转基因序列。
60.图9呈现了产生单链载体的示意图。(1)示出具有侧翼pvuii限制性位点、f1 ori(例如m13)、itr的载体,包括至少一个双链itr,具有通过限制性位点而联接至末端的衔接子序列。将质粒用pvuii限制性酶剪切,并且衔接子序列退火,使dna环化。(2)示出了来自宿主细胞中具有m13 ori的模板的病毒基因组复制的中间二聚体也可以通过hirt提取进行分离,用作更多复制的模板,并用于raav病毒生产或转基因的体内递送。双d itr(dd-tr)是优选的底物。(3)表明可以进行下游体内应用。
61.图10呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、f1 ori、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
62.图11呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、f1 ori、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
63.图12呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、dd-itr(突变体)、f1 ori、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
64.图13呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、dd-itr(突变体)、f1 ori、连接至转基因的启动子(用星形表示)、dd-itr(突变体)和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子
序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。
65.图14呈现了用于制造环状核酸的示意图,所述环状核酸以5'至3'的方向具有bamhi限制性位点、f1 ori、pvuii限制性位点、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)和hindiii限制性位点,并且通过所述限制性位点而具有联接在每一端的衔接子序列。通过用bamhi和hindiii限制性酶剪切从质粒切下质粒片段。将衔接子序列联接至该质粒片段,形成模板。该模板可以在体外或体内进行复制,例如在大肠杆菌细胞、细胞提取物(例如大肠杆菌细胞提取物)或细菌包装细胞中。复制后,用pvuii限制性酶进一步剪切该环状核酸,移除衔接子序列和ori,并产生一个开放末端和一个闭合末端。
66.图15呈现了用于制造载体的示意图,所述载体以5'至3'的方向具有sfi1或pvuii限制性位点、f1 ori、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、和第二sfi1或pvuii限制性位点,通过限制性位点而具有联接至末端的衔接子序列。在联接衔接子序列之前,通过用sfi1或pvuii限制性酶剪切来将载体切下。该载体可以在体外复制,例如在细菌包装细胞中。
67.图16呈现了用于制造自互补单链dna载体的示意图,所述载体以5'至3'的方向具有f1 ori、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、连接至转基因的启动子(用星形表示)、dd-itr(突变体)、发夹序列、互补的dd-itr(突变体)、连接至转基因的互补的启动子(用星形表示)、互补的dd-itr(突变体)、连接至转基因的互补的启动子(用星形表示)、互补的dd-itr(突变体)和oriδ29。该方法使用细菌包装细胞和辅助噬菌体。星号表示互补序列,例如互补的tr或转基因序列。
具体实施方式
68.本文所述的本发明的一个方面提供了制造含有转基因的环状核酸载体的方法,所述方法包括:(a)使宿主系统与模板接触,其中,所述模板包含至少一个侧翼切割位点,以及(i)至少一个噬菌体复制起点(ori),(ii)至少一个末端重复(tr),和(iii)与转基因可操作地连接的启动子序列;(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收产生的环状核酸,其中,所述环状核酸自退火。
69.本文所述的本发明的另一方面提供了制造含有转基因的环状核酸载体的方法,所述方法包括:(a)用质粒模板转化宿主系统,其中,所述质粒模板包含:(i)噬菌体复制起点(ori),(ii)截短的噬菌体ori(例如,oriδ29),(iii)至少一个末端重复(tr),以及(iv)与转基因可操作地连接的启动子序列,其中,所述质粒模板以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火;(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收产生的环状核酸,其中,所述环状核酸自退火。
70.在一个实施方式中,用于产生环状核酸的模板通过以下方式生成:用特异性靶向存在于质粒上的切割位点的核酸酶(例如限制性酶)剪切包含模板的组分的双链质粒dna(例如,参见图1-图5、图7和图9)。在替代实施方式中,双链质粒模板可用于产生环状核酸。
可以使用本领域已知的标准克隆技术产生本文所述的包含模板的组分的质粒或质粒模板。对切割位点进行剪切将质粒片段切下,即存在于两个切割位点之间的单链线性dna。在一个实施方式中,质粒片段随后在剪切末端处退火至衔接子蛋白。例如,如果用限制性酶对切割位点进行剪切,产生“粘性”末端(即一条链的若干个未配对核苷酸延伸到另一条之外的dna双螺旋的末端)。使用本领域已知的标准技术(例如使用t4连接酶和atp的联接反应),具有互补粘性末端的衔接子序列将能够退火至该粘性末端。将衔接子序列退火至质粒片段的末端使dna环化,创建末端闭合的dna结构,本文中称为模板。
71.模板可以在宿主系统中进行体外或体内复制。例如,在大肠杆菌细胞中使用标准方法,例如shepherd等,scientific reports 9,文章编号:6121(2019)中所述;在细胞提取物,例如大肠杆菌细胞提取物中,如wang,g.等,cell research 7,1
–
12(1997)中所述;或在本领域已知的细菌包装细胞系中(以引用的方式将这些引文的内容以其整体并入本文)。细菌包装细胞系可以表达基于m13的辅助质粒,例如,chastenn,l.等,nucleic acids res.2006dec;34(21):e145中所述,以引用的方式将其内容以其整体并入本文。
72.或者,本文所述的模板不需要经历复制,并且可以用于直接接触宿主系统(例如体外细胞系)。
73.位于模板上的噬菌体ori启动单链的互补环状dna(本文称为环状核酸)的复制。在一个实施方式中,将所述模板在宿主系统中孵育足以复制环状核酸的时间。在一个实施方式中,噬菌体ori启动复制而无需任何额外的组分(例如辅助噬菌体)。在替代实施方式中,噬菌体ori启动的复制在存在额外的组分(例如辅助噬菌体)的情况下发生。用于环状核酸复制的宿主系统可为例如体外或体内宿主系统。
74.在一个实施方式中,所述模板为单链的并且所述模板的体外或体内复制生成单链环状核酸。单链环状dna可以例如在转基因序列处自退火,并变成双链。
75.当ori存在于质粒模板的两侧时,例如,具有在模板其它元件侧翼的f1 ori和oriδ29的质粒模板(参见例如图8),单链环状核酸含有自互补的转基因,例如治疗性转基因。在一个实施方式中,单链环状核酸在一条链上含有转基因的有义序列和该转基因的反义序列。在一个实施方式中,有义序列和反义序列由接头(例如holliday接头或缺陷型itr)隔开,以允许链弯曲并发生有义序列和反义序列的结合。本文特别考虑的是,接头可以是允许链弯曲的任何序列,这有助于转基因的有义序列和反义序列的结合。在一个实施方式中,所述单链环状核酸进一步包含以ori为侧翼的互补区和自互补区。参见例如图8。
76.使用对于特定宿主系统而言已知的标准技术(例如机械介导的释放(超声)或化学介导的释放(去污剂)),将环状核酸从宿主系统中释放(即使其游离)。释放后,使用标准方法(例如通过使用柱层析的纯化)回收环状核酸。
77.本文产生的环状核酸可为末端闭合的、末端开放的、或末端开放和末端闭合二者皆有的。在一个实施方式中,所述环状核酸为末端闭合的。末端闭合的dna载体可以具有任何构型,例如狗骨形(doggie bone)、哑铃形(dumbbell)、圆形、末端闭合的线性双链体等。
78.在一个实施方式中,所述环状核酸在ori下游且临近该ori处含有至少第三个独特的切割位点。在环状核酸复制后,可对这个独特的切割位点进行剪切,从环状核酸中移除该ori并产生开放末端。这种核酸是末端开放和末端闭合二者皆有的。可以向受试者给予末端开放和末端闭合的核酸,用于例如通过转基因表达进行基因递送。
79.使用本文所述的方法产生的环状核酸复制物可用于递送其表达的转基因,或用于产生更多环状核酸,例如通过额外的体外或体内复制。环状核酸复制物还可用于重组病毒载体的生产,例如,用于在hek293细胞中生产腺相关病毒载体。
80.此外,可以将环状核酸包装到例如衣壳或脂质体中,用于下游应用。
81.在一个实施方式中,使用本文所述的方法制造的环状核酸可用于生产重组载体,例如重组病毒载体。举例来说,具有至少一个itr的环状核酸可用于代替aav载体的生产中表达至少一种itr的质粒。使用模板重组质粒复制aav基因组进一步讨论于例如samulski,rj等,journal of viol.oct.1987,以引用的方式将其内容以其整体并入本文。产生重组载体和使用载体进行核酸递送的方案可见于例如current protocols in molecular biology,ausubel,f.m.等(编著),greene publishing associates,(1989);以及其它实验室标准手册(例如vectors for gene therapy.in:current protocols in human genetics.john wiley and sons,inc.:1997)。此外,aav载体的产生进一步描述于例如美国专利号9,441,206,以引用的方式将其内容以其整体并入本文。
82.本发明的方法中采用的载体的非限制性实例包括用于将核酸递送到细胞中的任何核苷酸构建体,例如质粒、模板、非病毒载体或病毒载体,例如可以包装重组逆转录病毒基因组的逆转录病毒载体(参见例如,pastan等,proc.natl.acad.sci.u.s.a.85:4486(1988);miller等,mol.cell.biol.6:2895(1986))。例如,然后可将重组逆转录病毒载体用于感染并由此将本发明的治疗性转基因递送至受感染的细胞。将改变的核酸引入哺乳动物细胞的确切方法当然不限于使用逆转录病毒载体。其它技术对于该程序广泛可用,包括使用腺病毒载体((mitani等,hum.gene ther.5:941-948,1994)、腺相关病毒(aav)载体(goodman等,blood84:1492-1500,1994)、慢病毒载体(naldini等,science 272:263-267,1996)、假型逆转录病毒载体(agrawal等,exper.hematol.24:738-747,1996)、以及现在已知或以后鉴别的任何其它载体系统。还包括本领域公知的嵌合病毒颗粒,其可以以任何组合包含来自两种以上的不同病毒的病毒蛋白和/或核酸以产生功能性病毒载体。本发明的嵌合病毒颗粒还可包含非病毒来源的氨基酸序列和/或核苷酸序列(例如,用以促进载体对特定细胞或组织的靶向和/或诱导特定免疫应答)。关于给定条件的孵育条件(例如,时间、气候、培养基等)在本领域中是已知的并且可以由熟练的从业者容易地鉴别。
83.可以使用任何标准技术来释放细胞中产生的病毒载体(即,使其从产生该载体的细胞中游离)。例如,可以通过机械方法(例如微射流(microfluidization)、离心或超声)或化学方法(例如裂解缓冲液和去污剂)来释放病毒载体。然后,使用本领域的标准方法回收(即收集)和纯化所释放的病毒载体以获得纯的群体。例如,可以通过纯化方法将病毒载体从所述病毒载体被释放入其中的缓冲液中回收,包括使用深度过滤或切向流过滤(tff)的澄清步骤。如本文实施例中所述,可以通过超声将病毒载体从细胞中释放,并通过使用柱层析对澄清的裂解物进行纯化来回收。
84.在一个实施方式中,载体可为但不限于非病毒载体或病毒载体。在任意方面的一个实施方式中,所述载体为dna病毒或rna病毒。本发明的病毒载体的非限制性实例包括aav载体、腺病毒载体、慢病毒载体、逆转录病毒载体、疱疹病毒载体、甲病毒载体、痘病毒载体、杆状病毒载体和嵌合病毒载体。
85.本领域已知的任何病毒载体均可用于本发明。此类病毒载体的实例包括但不限于
来源于以下的载体:腺病毒科(adenoviridae);双rna病毒科(birnaviridae);布尼亚病毒科(bunyaviridae);杯状病毒科(caliciviridae),发形病毒(capillovirus)组;香石竹潜隐病毒(carlavirus)组;香石竹斑驳病毒(carmovirus)病毒组;花椰菜花叶病毒(caulimovirus)组;长线形病毒(closterovirus)组;鸭跖草黄斑驳病毒(commelina yellow mottle virus)组;豇豆花叶病毒(comovirus)病毒组;冠状病毒科(coronaviridae);pm2噬菌体组;corcicoviridae;隐潜病毒(cryptic virus)组;潜病毒(cryptovirus)组;黄瓜花叶病毒(cucumovirus)病毒组家族([phgr]6噬菌体组;cysioviridae;香石竹环斑病毒(carnation ringspot)组;香石竹病毒(dianthovirus)病毒组;蚕豆萎蔫病毒(broad bean wilt)组;蚕豆病毒(fabavirus)病毒组;丝状病毒科(filoviridae);黄病毒科(flaviviridae);真菌传杆状病毒(furovirus)组;双生病毒(germinivirus)组;贾第鞭毛虫病毒(giardiavirus)组;嗜肝dna病毒科(hepadnaviridae);疱疹病毒科(herpesviridae);大麦病毒(hordeivirus)病毒组;illarvirus病毒组;丝杆状病毒科(inoviridae);虹彩病毒科(iridoviridae);光滑噬菌体科(leviviridae);脂毛噬菌体科(lipothrixviridae);黄症病毒(luteovirus)组;玉米雷亚朵非纳病毒(marafivirus)病毒组;玉米褪绿矮缩病毒组(maize chlorotic dwarf virus group);微小噬菌体科(icroviridae);肌尾噬菌体科(myoviridae);坏死病毒(necrovirus)组;线虫传多面体病毒(nepovirus)病毒组;野田村病毒科(nodaviridae);正粘病毒科(orthomyxoviridae);乳多空病毒科(papovaviridae);副粘病毒科(paramyxoviridae);欧防风黄点病毒(parsnip yellow fleck virus)组;双分病毒科(partitiviridae);细小病毒科(parvoviridae);豌豆耳突花叶病毒(pea enation mosaic virus)组;藻dna病毒科(phycodnaviridae);小rna病毒科(picornaviridae);芽生噬菌体科(plasmaviridae);prodoviridae;polydnaviridae;马铃薯x病毒(potexvirus)组;马铃薯y病毒属(potyvirus);痘病毒科(poxviridae);呼肠孤病毒科(reoviridae);逆转录病毒科(retroviridae);弹状病毒科(rhabdoviridae);根前毛菌病毒(rhizidiovirus)组;长尾噬菌体科(siphoviridae);南方菜豆花叶病毒(sobemovirus)组;ssv 1型噬菌体;复层噬菌体科(tectiviridae);纤细病毒(tenuivirus);四病毒科(tetraviridae);烟草花叶病毒(tobamovirus)组;烟草脆裂病毒(tobravirus)组;披膜病毒科(togaviridae);番茄丛矮病毒(tombusvirus)组;环曲病毒(torovirus)组;totiviridae;芜菁黄花叶病毒(tymovirus)组;以及植物病毒卫星。
[0086]
通过本发明的方法产生的病毒载体可以部分地或完全地包含任何天然存在的和/或重组的病毒载体核苷酸序列(例如,aav、av、lv等)或变体的基因组。病毒载体变体可具有在核酸和氨基酸水平上显著同源的基因组序列,产生通常为物理和功能等效物的病毒载体,通过相似机制进行复制,并通过相似机制进行组装。
[0087]
变体病毒载体序列可用于在本文所述的宿主系统中产生病毒载体。例如,与给定载体(例如,aav、av、lv等)具有至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约99%、或更多的核苷酸序列同一性和/或氨基酸序列同一性的更多序列(例如,具有约75-99%核苷酸序列同一性的序列)。
[0088]
将理解的是,病毒表达系统将被进一步修饰以包括在使用本文所述的方法生产给定病毒载体期间补充给定病毒载体所需的任何必要元件。例如,在某些实施方式中,核酸盒
侧翼有末端重复序列。在一个实施方式中,对于raav载体的生产,aav表达系统将进一步包含重组aav质粒、表达rep的质粒、表达cap的质粒和腺病毒辅助质粒中的至少一种。给定病毒载体的补充性元件是本领域公知的,并且熟练的从业者将能够相应地修改本文所述的病毒表达系统。
[0089]
用于制造aav载体的病毒表达系统(例如,aav表达系统)可以进一步包含例如处于诱导型启动子控制下的处于反式的复制(rep)基因和/或衣壳(cap)基因。rep和cap的表达可处于一个诱导型启动子的控制下使得这些基因的表达一起“开启”;或处于两个单独的诱导型启动子的控制下,由不同的诱导剂“开启”。在aav基因组的左侧有称为p5和p19的两个启动子,不同长度的两种重叠的信使核糖核酸(mrna)可以由其产生。这些信使核糖核酸各包含内含子(可以剪接去或不剪接去),产生四个潜在的rep基因;rep78、rep68、rep52和rep40。rep基因(特别是rep 78和rep 68)结合在自启动行为(self-priming act)中由itr形成的发夹,并在发夹内的指定末端解析位点处切割。它们对于aav基因组的aavs1特异性整合是必需的。经证实所有四种rep蛋白均结合atp并具有解旋酶活性。正义(positive-sensed)aav基因组的右侧编码三种衣壳蛋白vp1、vp2和vp3的重叠序列,它们从一个启动子开始,称为p40。cap基因产生额外的非结构蛋白,称为组装激活蛋白(aap)。这种蛋白质由orf2产生,并对衣壳组装过程至关重要。用于制造aav载体的必要元件在本领域中是已知的,并且可进一步综述于,例如,美国专利号us5478745a;us5622856a;us5658776a;us6440742b1;us6632670b1;us6156303a;us8007780b2;us6521225b1;us7629322b2;us6943019b2;us5872005a;和美国专利申请号us 2017/0130245;us20050266567a1;us20050287122a1;以引用的方式将它们各自的内容以其整体并入本文。
[0090]
在一个实施方式中,用于产生aav载体的细胞悬浮培养。在另一实施方式中,细胞在无动物成分的条件下培养。无动物成分培养基可为与给定细胞系(例如hek293细胞)相容的任何无动物成分培养基(例如无血清培养基)。本领域已知的能够繁殖aav载体的任何细胞系都可以用于使用本文所述的方法的aav生产。可用于生成aav载体的示例性细胞系包括但不限于hek293、cho、cos-7和nso。
[0091]
在一个实施方式中,用于产生aav载体的细胞系稳定表达aav载体产生所需的任何组分,例如rep、cap、vp1等。在一个实施方式中,用于产生aav载体的细胞系瞬时表达aav载体产生所需的任何组分,例如rep、cap、vp1等。
[0092]
在用于产生aav载体的细胞系未稳定地或瞬时地表达rep或cap的事件中,这些序列将被提供给aav表达系统,例如通过使用本文所述的方法产生的环状核酸。aav rep和cap序列可以通过本领域已知的任何方法提供。目前的方案通常在单个质粒上表达aav rep/cap基因。aav复制和包装序列不需要一起提供,尽管这样做可能是方便的。aav rep和/或cap序列可以由任何病毒载体或非病毒载体提供。例如,rep/cap序列可以由杂交腺病毒或疱疹病毒载体提供(例如,插入缺失型腺病毒载体的ela或e3区)。ebv载体也可用于表达aav cap和rep基因。这种方法的一个优点在于ebv载体是游离的,但在连续的细胞分裂整个过程中将保持高拷贝数(即作为染色体外元件稳定整合到细胞中,称为“基于ebv的核游离基因”,参见margolski,curr.top.microbial.immun.158:67(1992))。
[0093]
通常,aav rep/cap序列将不以tr为侧翼,以防止这些序列的挽救和/或包装维持。
[0094]
用于使用本文所述的方法制造慢病毒的病毒表达系统将进一步包含在核酸盒侧
翼的长末端重复(ltr)。ltr是相同的dna序列,其在由逆转录病毒rna逆转录形成的前病毒dna或逆转录转座子的任一端处重复数百或数千次。ltr通过ltr特异性整合酶介导逆转录病毒dna整合到宿主染色体。用于制造慢病毒载体的ltr和方法进一步描述于例如美国专利号us7083981b2;us6207455b1;us6555107b2;us8349606b2;us7262049b2;和美国专利申请号us20070025970a1;us20170067079a1;us20110028694a1;以引用的方式将它们各自的内容以其整体并入本文。
[0095]
用于使用本文所述的方法制造腺病毒的病毒表达系统将进一步包含在核酸盒侧翼的约90-140个碱基对(确切长度取决于血清型)的相同反向末端重复(itr)。病毒复制起点位于恰好在基因组末端的itr内。腺病毒基因组为约36000个碱基对的线性双链dna分子。通常,用于基因疗法中的腺病毒载体在e1区有缺失,在该处可以引入新的遗传信息;e1缺失使重组病毒复制有缺陷。用于制造腺病毒载体的itr和方法进一步描述于例如美国专利号us7510875b2;us7820440b2;us7749493b2;us7820440b2;us10041049b2;国际专利申请号wo2000070071a1;以及美国专利申请号wo2000070071a1;us20030022356a1;us20080050770a1,以引用的方式将它们各自的内容以其整体并入本文。
[0096]
在一个实施方式中,病毒表达系统可为宿主细胞,例如病毒、哺乳动物细胞或昆虫细胞。示例性的昆虫细胞包括但不限于sf9、sf21、hi-5和s2昆虫细胞系。例如,用于制造aav载体的病毒表达系统可以进一步包括杆状病毒表达系统,例如,如果病毒表达系统为昆虫细胞。杆状病毒表达系统被设计用于从杆状病毒感染的昆虫细胞中进行高效的大规模病毒生产和表达重组蛋白。杆状病毒表达系统进一步描述于例如美国专利号us6919085b2;us6225060b1;us5194376a;以引用的方式将它们各自的内容以其整体并入本文。
[0097]
在另一实施方式中,病毒表达系统为无细胞系统。用于病毒载体生产的无细胞系统进一步描述于例如cerqueira a.等,journal of virology,2016;sheng j.等,the royal society of chemistry,2017;以及svitkin y.v.和sonenberg n.journal of virology,2003;以引用的方式将其内容以其整体并入本文。
[0098]
本文提供的一个方面为使用本文所述的任何方法制造的载体。
[0099]
本文提供的另一方面为环状核酸载体,所述环状核酸载体包含:至少一个侧翼切割位点,和(i)至少一个噬菌体复制起点(ori);(ii)至少一个末端重复(tr);以及(iii)与转基因可操作地连接的启动子序列。
[0100]
本文提供的另一方面为环状核酸载体,所述环状核酸载体包含:(i)噬菌体复制起点(ori);(ii)截短的噬菌体ori(例如,oriδ29);(iii)至少一个末端重复(tr);以及(iv)与转基因可操作地连接的启动子序列,其中,所述载体以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火。
[0101]
理解的是,宿主系统将进一步包含给定载体所必需的组分。例如,aav的生产需要存在至少一个复制(rep)基因和/或至少一个衣壳(cap)基因。在一个实施方式中,所述载体为aav并且宿主系统组成型表达至少一个复制(rep)基因和/或至少一个衣壳(cap)基因。在另一实施方式中,所述载体为aav,并且在本文所述方法的步骤(a)之前将表达至少一个rep基因的核酸和表达至少一个cap基因的核酸转化到宿主系统中,或与本文所述方法的步骤(a)一起共转化。在aav基因组的左侧有称为p5和p19的两个启动子,不同长度的两种重叠的信使核糖核酸(mrna)可以由其产生。这些信使核糖核酸各包含内含子(可以剪接去或不剪
接去),产生四个潜在的rep基因;rep78、rep68、rep52和rep40。rep基因(特别是rep 78和rep 68)结合在自启动行为中由itr形成的发夹,并在发夹内的指定末端解析位点处切割。它们对于aav基因组的aavs1特异性整合是必需的。经证实所有四种rep蛋白均结合atp并具有解旋酶活性。正义aav基因组的右侧编码三种衣壳蛋白vp1、vp2和vp3的重叠序列,它们从一个启动子开始,称为p40。cap基因产生额外的非结构蛋白,称为组装激活蛋白(aap)。这种蛋白质由orf2产生,并对衣壳组装过程至关重要。用于制造aav载体的必要元件在本领域中是已知的,并且可进一步综述于,例如,美国专利号us5478745a;us5622856a;us5658776a;us6440742b1;us6632670b1;us6156303a;us8007780b2;us6521225b1;us7629322b2;us6943019b2;us5872005a;和美国专利申请号us 2017/0130245;us20050266567a1;us20050287122a1;以引用的方式将它们各自的内容以其整体并入本文。在多种实施方式中,使用标准方法(例如,通过质粒、病毒、脂质体、微囊、非病毒载体或作为裸dna)对表达rep和/或cap基因的核酸进行转化。
[0102]
在一个实施方式中,宿主系统可为宿主细胞(例如昆虫细胞、哺乳动物细胞)、病毒或细菌包装细胞。例如,用于制造aav载体的宿主系统可以进一步包括杆状病毒表达系统,例如,如果宿主系统是昆虫细胞。杆状病毒表达系统被设计用于从杆状病毒感染的昆虫细胞中进行高效的大规模病毒生产和表达重组蛋白。杆状病毒表达系统进一步描述于例如美国专利号us6919085b2;us6225060b1;us5194376a;以引用的方式将它们各自的内容以其整体并入本文。示例性的昆虫细胞包括但不限于sf9、sf21、hi-5和s2昆虫细胞系。
[0103]
在另一实施方式中,宿主系统为无细胞系统。例如,所述载体可以在体外系统中合成和组装。可以制备将表达必需的酶蛋白(例如慢病毒为pol;对于aav为rep)的盒。在一个实施方式中,无细胞系统包含辅助噬菌体颗粒。辅助噬菌体颗粒(例如m13k07)在使用噬菌体载体时为颗粒形成提供必要的基因产物。辅助噬菌体颗粒进一步综述于例如(2005)helper phage.in:encyclopedic reference of genomics and proteomics in molecular medicine.springer,berlin,heidelberg;以引用的方式将其内容以其整体并入本文。
[0104]
可以组装将表达必需的结构蛋白(例如对于慢病毒为gag和env;对于aav为表达vp1、vp2和vp3的cap基因)的其它盒。将合成具有与期望的转基因可操作地连接的基因的另一载体,其最终位于包装序列(例如ltr或itr)之间的一侧。实现这一点的各种方法在本领域中是已知的。用于载体生产的无细胞系统进一步描述于例如cerqueira a.等,journal of virology,2016;sheng j.等,the royal society of chemistry,2017;以及svitkin y.v.和sonenberg n.journal of virology,2003;以引用的方式将其内容以其整体并入本文。
[0105]
复制起点
[0106]
本文所述的模板包含衍生自丝状噬菌体(ff噬菌体)的至少一个复制起点(ori),即复制起始的位点。众所周知,丝状噬菌体ori是噬菌体基因组的区域,它限定了复制起始、复制终止和复制产生的复制形式的包装的位点。具有仅衍生自噬菌体的ori(即不包含衍生于除噬菌体以外的生物体的ori)的质粒被称为噬菌粒。通过丝状ori复制噬菌粒进一步综述于例如specthrie,l等,journal of mol biol.v.228(3),1992;以及nafisi,pm等,synthetic biol.2018,以引用的方式将它们各自的内容以其整体并入本文。适用于本发明
的丝状噬菌体ori为m13、f1或fd噬菌体复制起点。
[0107]
本文所述的噬菌体ori的使用是有利的,因为它不一定需要辅助噬菌体的存在来启动复制,从而消除了复制中辅助噬菌体污染的可能性。本文所述的噬菌体ori独立地启动单链环(即环状核酸)的复制。
[0108]
本发明的ori对于其在模板上的位置不受限制。ori可以位于至少一个itr或至少一个切割位点的上游或下游。在一个实施方式中,ori在左tr的上游。在一个实施方式中,ori侧翼于tr,并且处于与转基因可操作地连接的启动子序列的上游。
[0109]
在一个实施方式中,所述模板含有f1 ori。f1是噬菌体衍生的ori,它允许ssdna复制和包装入噬菌体颗粒。在一个实施方式中,衍生自f1的ori具有seq id no:235的核苷酸序列。
[0110][0111]
在另一实施方式中,ori衍生自m13。m13 ori促进了模板的m13辅助依赖性复制。在一个实施方式中,衍生自m13的ori具有seq id no:236的核苷酸序列。
[0112][0113]
在一个实施方式中,所述至少一个ori包括与野生型ori相比发生突变的第二ori。突变的ori可包含单核苷酸突变(例如核苷酸删除、插入或置换)或可经截短以缺少野生型ori序列的至少一部分(例如至少五个核苷酸)。突变的ori可为非功能性ori。例如,非功能性ori将具有降低的野生型ori的功能(例如启动复制)或完全丧失野生型ori的功能(例如启动复制)。
[0114]
在一个实施方式中,突变的ori为突变的f1 ori,f1-oriδ29。突变体oriδ29为截短的f1 ori,其缺乏启动复制的能力。oriδ29进一步综述于例如specthrie,l等,journal of mol biol.v.228(3),1992。在一个实施方式中,oriδ29具有seq id no:237的核苷酸序列。
[0115][0116]
在一个实施方式中,突变的ori为突变的m13 ori,m13-oriδ29。突变体oriδ29为截短的m13 ori,其缺乏启动复制的能力。在一个实施方式中,oriδ29具有seq id no:238的核苷酸序列。
[0117][0118]
本文所述的环状核酸不包含其它类型或种类的ori,例如,载体不包含细菌ori或哺乳动物ori。
[0119]
在某些情况下,ori在复制后被从模板中切除。在一个实施方式中,ori侧翼有至少两个切割位点,即一个切割位点恰好位于ori的上游,并且第二切割位点恰好位于ori的下游。复制后对具有此配置的模板进行剪切以从模板中移除ori。本文特别考虑的是,用于向受试者递送转基因的模板将不包含噬菌体ori。
[0120]
某些ori需要存在额外的细胞组分以启动复制。例如,m13 ori需要m13衍生的辅助噬菌体。在一个实施方式中,噬菌体来源的ori需要辅助噬菌体的存在,例如在单链模板的体外复制过程中。在一个实施方式中,宿主系统瞬时表达辅助噬菌体。例如,辅助噬菌体可以在模板表达之前、之后或基本上同时在宿主系统中表达。在替代实施方式中,宿主系统组成型地表达辅助噬菌体。本领域技术人员将能够评估在特定ori启动复制是否需要额外的组分,例如辅助基因。
[0121]
末端重复
[0122]
本文所述的模板包含至少一个末端重复(tr),例如反向末端重复(itr)。例如,所述模板可以包含至少1个、至少2个、至少3个、至少4个、至少5个或更多个tr。在一个实施方式中,存在第二tr,并且与转基因可操作地连接的启动子序列的两侧以tr为侧翼。
[0123]
在多种实施方式中,tr为itr。itr包括形成发夹结构并作为反向末端重复发挥作用(即,介导期望的功能,例如复制、整合和/或原病毒挽救等)的任何病毒末端重复或合成序列。itr可为aav itr或非aav itr。例如,非aav itr序列(例如其它细小病毒的非aav itr序列,如犬细小病毒、牛细小病毒、小鼠细小病毒、猪细小病毒、人细小病毒b-19)或用作sv40复制起点的sv40发夹可以用作itr,其可通过截短、置换、删除、插入和/或添加而被进一步修饰。此外,itr可以是部分或完全合成的,例如,如u.s.pat.no.9,169,494中所述,以引用的方式将其内容以其整体并入。通常,itr为145个核苷酸。末端125个核苷酸形成回文双链t形发夹结构。在该结构中,a-a'回文形成茎,而两个较小的回文b-b'和c-c'形成了t的
交叉臂。d序列中的其它20个核苷酸保持单链。在aav基因组的背景下,将有两个itr,在基因组的每一端各一个。
[0124]
aav itr可以来自任何aav,包括但不限于血清型1、血清型2、血清型3a、血清型3b、血清型4、血清型5、血清型6、血清型7、血清型8、血清型9、血清型10、血清型11或血清型13、蛇aav、禽aav、牛aav、犬aav、马aav、绵羊aav、山羊aav、虾aav、或现在已知或以后发现的任何其它aav。只要末端重复介导期望的功能(例如复制或者整合),aav itr不需要具有天然末端重复序列(例如,可以通过插入、删除、截短和/或错义突变对天然aav itr序列进行改变)。
[0125]
在一个实施方式中,itr为野生型itr。在另一实施方式中,itr为突变的itr。突变的itr可为非功能性itr。例如,非功能性itr将具有降低或完全丧失的野生型itr的功能(例如介导复制、整合和/或前病毒挽救)。
[0126]
在一个实施方式中,突变的itr为dd突变itr(dd-itr)。dd-itr具有与其所衍生自的itr相同的序列,但在临近a序列处包含第二d序列,因此有d和d'。d和d'可以退火(例如,如u.s.pat.no.5,478,745中所述,以引用的方式将其内容并入本文)。每个d的长度通常约为20nt,但可以小至5个核苷酸。较短的d区保留a-d接合点(junction)(例如,由保留a-d接合点的3'端缺失产生)。优选地,d区保留切口位点和/或a-d接合点。dd-itr通常为约165个核苷酸。dd-itr具有为dna构建体的复制以顺式提供信息的能力。因此,dd-itr具有以d和d'元件为侧翼的反向回文序列,例如具有5'-dabb'cc'a'd'-3'的5'至3'序列的( )链和具有5'-dacc'bb'a'd'-3'的5'至3'序列的与( )链互补的(-)链可以形成holiday结构,例如如图1所示。在某些实施方式中,dd-itr可以在其组分(例如a-c)中具有缺失,同时仍保留d和d'元件。在某些实施方式中,itr包含缺失,同时仍保留形成holliday结构的能力并保留d元件的两个拷贝(d和d')。dd-itr可以由天然aav itr或由合成itr生成。在某些实施方式中,缺失位于b区元件中。在某些实施方式中,缺失位于c区元件中。在某些实施方式中,缺失位于itr的b区和c区元件两者内。在一个实施方式中,整个b和/或c元件缺失,例如替换为单个发夹元件。在一个实施方式中,所述模板包含至少两个dd-itr。
[0127]
合成itr是指由于一个或多个删除、添加、置换或它们的任意组合而在核苷酸序列上与野生型itr(例如aav血清型2itr(itr2)序列)不同的非天然存在的itr。合成itr和野生型itr(例如itr2)序列之间的差异可能小至一个核苷酸变化,例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、30个、35个、40个、45个、50个、60个、60个、70个、80个、90个或100个或更多个核苷酸的变化,或其中的任何范围。在一些实施方式中,合成itr和野生型itr(例如,itr2)序列之间的差异可不超过约100个、90个、80个、70个、60个、50个、45个、40个、35个、30个、25个、20个、15个、10个、9个、8个、7个、6个、5个、4个、3个、2个或1个核苷酸或其中的任何范围。
[0128]
在本发明中可以使用额外的tr,例如长末端重复(ltr)。
[0129]
在一个实施方式中,存在于模板上的itr可用于例如产生aav载体。上文描述了生产aav载体的方法。
[0130]
切割位点
[0131]
本文所述的模板包含至少一个切割位点,所述切割位点位于所述模板的其它元件侧翼。切割位点是其中磷酸二酯骨架被选择性断裂的核苷酸序列。例如,被核酸酶识别的核
苷酸序列为切割位点,因为酶将在该序列内的选择性位点处剪切磷酸二酯骨架。取决于核酸内切酶,此类切割位点可为单链或双链。还包括化学切割位点(例如在maxam和gilbert测序中进行的嘧啶和嘌呤切割反应)或通过化学方法进行切割(例如美国专利号4,795,700中描述的氧化,以引用的方式将其并入本文)。
[0132]
在一个实施方式中,所述模板进一步包含至少第二切割位点,并且位点内为所述模板上所含的额外的元件,例如至少一个ori、至少一个tr和与治疗性转基因可操作地连接的启动子,使得至少两个切割位点位于这些元件侧翼。在一个实施方式中,第三切割位点紧邻ori的下游。
[0133]
在一个实施方式中,切割位点被核酸酶剪切。如本文所使用的,术语“核酸酶”是指具有dna切割活性的分子。核酸酶试剂的具体实例包括锌指蛋白、大范围核酸酶、tal结构域、talen、酵母组装、重组酶、亮氨酸拉链、crispr/cas、核酸内切酶、和本领域技术人员已知的其它核酸酶。可以针对在给定靶位点(例如切割位点)进行切割的特异性而选择或设计核酸酶。例如,可以对核酸酶进行选择用于在靶位点进行切割,在经切割的多核苷酸和不同的多核苷酸之间产生重叠末端。如本文所使用的,术语“核酸酶的识别位点”是指在该处核酸酶诱导切口或双链断裂的dna序列。
[0134]
在一个实施方式中,核酸酶为端粒酶原(protelomerase)并且切割位点为端粒酶原靶序列,例如teln识别位点。端粒酶原靶序列是其在dna模板中的存在使其能够通过端粒酶原的酶活性转化为闭合的线性dna的任何dna序列。换言之,端粒酶原靶序列是端粒酶原切割和重新连接双链dna以形成共价闭合的线性dna所必需的。
[0135]
通常,端粒酶原靶序列包含任何完美回文序列,即具有双重旋转对称性的任何双链dna序列,在本文中也描述为完美反向重复序列。如美国专利号9,109,250(以引用的方式将其内容以其整体并入)中所示,来自各种嗜温(mesophilic)细菌噬菌体的端粒酶原靶序列和细菌质粒都共享包含完美反向重复这一共同特征。完美反向重复的长度因具体生物体而异。在伯氏疏螺旋体(borrelia burgdorferi)中,完美反向重复的长度为14个碱基对。在各种嗜温细菌噬菌体中,完美反向重复的长度为22个碱基对或更长。此外,在一些情况下,例如大肠杆菌n15,中央的完美反向回文以反向重复序列为侧翼,即形成较大的不完美反向回文的一部分。
[0136]
在一个实施方式中,端粒酶原具有seq id no:239的序列。
[0137]
seq id no:239是端粒酶原的核苷酸序列。
[0138][0139]
在一个实施方式中,核酸酶为限制性核酸内切酶并且切割位点为核酸内切酶的识别位点(即,限制性位点)。限制性核酸内切酶是能够催化dna分子的位点特异性切割的水解酶。限制性核酸内切酶作用的位置由特定核苷酸序列的存在决定。此类序列被称为限制性核酸内切酶的识别位点。已经从多种来源分离出了限制性核酸内切酶,并根据其识别位点(即限制性位点)的核苷酸序列对其进行了表征。一些限制性核酸内切酶在同一点水解两条链上的磷酸二酯键,产生平末端。其它限制性核酸内切酶催化彼此相隔若干个核苷酸的键的水解,在经切割分子的每一端产生游离的单链区域。这种单链末端是自我互补的,因此具有粘性,可用于重新连结经水解的dna。由于任何易于被此类酶切割的dna都必须含有相同
的识别位点,因此将产生相同的粘末端,从而可以将已经用限制性核酸内切酶处理的异源dna序列连结至经类似处理的其它序列。参见roberts,r.j.,crit.rev.biochem.4,123(1976)。限制性位点相对少见,但限制性核酸内切酶的一般用途已通过化学合成带有限制性位点序列的双链寡核苷酸而得到极大扩展。因此,几乎任何dna区段都可以简单地通过以下方式而偶联至任何其它区段:将适当的限制性寡核苷酸附着至分子的末端,并使产物经受适当的限制性核酸内切酶的水解作用,从而产生所需的粘末端。参见heyneker,h.l.等,nature 263,748(1976)以及scheller,r.h.等,science 196,177(1977)。限制性核酸内切酶识别位点分布的重要特征是它们相对于阅读框而言随机分布。因此,通过限制性核酸内切酶进行的切割可能发生在临近密码子之间,或者可能发生在密码子内。
[0140]
限制性位点可以通过其识别位点中的碱基数量进行分类,例如,通常在4个到8个碱基之间。序列中的碱基数量将决定该位点将在任何给定基因组中偶然出现的频率,例如,4个碱基对的序列理论上讲每44或256bp出现一次,6个碱基对的序列将为46或4,096bp,并且8个碱基对的序列将为48或65,536bp。限制性位点通常是回文的,这意味着碱基序列向后和向前读取相同。镜像样的回文类似于在普通文本中发现的那些,其中序列在单链dna上向前和向后读取相同,例如gtaatg(seq id no:240)。反向重复回文也是正向和反向读取相同的序列,但正向和反向序列以互补的dna链出现(即双链dna的互补dna链),例如与catatg(seq id no:242)互补的gtatac(seq id no:241)。与镜像样回文相比,反向重复回文更为常见并且具有更大的生物学重要性。
[0141]
在一个实施方式中,所述模板中的限制性位点是不常见的限制性位点,即它不常发现于转基因序列中。例如,限制位点是镜像样回文限制位点,或8个碱基对的限制性位点。在一个实施方式中,模板中使用的限制性位点未发现于本发明的转基因(即治疗性转基因)中。本领域技术人员可以评估是否在特定转基因序列中存在特定限制性位点,例如,通过使用basic local alignment search tool(blast)对限制性位点和转基因序列进行核苷酸比对。
[0142]
在一个实施方式中,限制性位点选自表1。当限制性位点选自表1时,相应的限制性酶用于切割所述限制性位点。
[0143]
[0144]
[0145]
[0146]
[0147]
[0148]
[0149]
[0150]
[0151][0152]
在表1中,所有限制性位点均使用单字母代码命名法以5
′
至3
′
书写,切割点由“/”表示。括号中的数字表示非回文酶的切割点。例如,ggtctc(1/5)表示在5
′
...ggtctcn/...3
′
及其互补物3
′
...ccagagnnnnn/...5’处切割。
[0153]
在一个实施方式中,所述模板包含至少一个swai限制性位点,例如,至少1个、至少2个或更多个swai限制性位点。swai限制性位点具有5
′‑
atttaaat-3
′
(seq id no:27)的八核苷酸序列。swai限制性酶在限制性序列的中央切割,产生平端dna片段。
[0154]
在一个实施方式中,所述至少两个限制性位点是相同的。例如,模板可以包含两个sf1限制性位点。或者,所述至少两个限制性位点是不同的。例如,模板可具有sfi1限制性位点和mwoi限制性位点。在一个实施方式中,至少两个互补的swai序列退火形成模板序列内的环。swai环可以用swai限制性酶进行切割。
[0155]
通常,为了对切割位点进行剪切,核酸与激活切割位点的酶(例如端粒酶原或限制性酶)在足以对切割位点进行剪切的条件下接触一段时间。本领域技术人员可以确定用于给定酶的正确条件,例如温度、反应中试剂的浓度和接触时间。例如,可以在万维网www.enzymefinder.neb.com上找到已知限制性酶的正确条件。
[0156]
衔接子序列
[0157]
衔接子序列是短的、合成的、单链或双链的寡核苷酸,可以联接至其它dna或rna分子的末端。在一个实施方式中,本文所述的衔接子序列是单链的并且使它所联接至的dna末端闭合,例如通过发夹环。将衔接子序列添加到经剪切的质粒片段的一端或两端作为使dna环化的手段。在一个实施方式中,将衔接子序列联接至质粒片段,并在其联接至的经切割的dna的末端引导闭合(参见例如图1-图5、图7或图9)。可用于将dna末端闭合的示例性衔接子蛋白包括进一步描述于以下中的发夹环:例如美国申请号2009/0098612;以及美国专利号6,369,038;6,451,563;6,849,725;以引用的方式将它们的内容以其整体并入本文。设想当添加至从质粒切下的质粒片段的经剪切末端时可以使dna环化的任何序列都可为衔接子序列。
[0158]
在各种实施方式中,将衔接子序列或互补衔接子序列联接至被核酸酶(例如限制性酶)剪切的质粒片段的粘性末端。衔接子序列可以通过本文描述的方法杂交至任何质粒
片段。在一个实施方式中,衔接子序列进一步包含限制性位点序列,该限制性位点序列促进其与具有相同或互补的限制性位点的质粒片段(在其从质粒中切下后)的联接/杂交。本领域技术人员将知晓如何将限制性位点序列添加至衔接子序列,例如,使用标准的亚克隆方法或基于pcr的技术。为了联接具有限制性位点序列的衔接子序列,必须对限制性位点进行剪切,例如通过使衔接子序列与相应的限制性酶接触。用于联接限制性位点和互补限制性位点的方法在本领域是公知的,并且可以在例如万维网上在www.neb.com处找到。例如,在存在连接酶(例如t4连接酶)和atp的情况下,将切下的载体和衔接子蛋白体外孵育。
[0159]
举例来说,具有seq id no:243序列的发夹环衔接子序列可进一步包含sfi1限制性位点序列(例如,seq id no:161)。具有sfi1限制性位点序列的衔接子序列可以用限制性酶sfi1消化足够的时间以剪切限制性位点。这将在衔接子序列上产生“粘性末端”,可用于将衔接子蛋白杂交至由sfi1限制性酶切下的质粒片段。
[0160]
seq id no:243为发夹环衔接子蛋白的核苷酸序列。
[0161][0162]
启动子
[0163]
在一个实施方式中,转基因可操作地连接至启动子。本文描述了指导转基因表达的各种启动子。实例包括但不限于组成型启动子、阻抑型启动子和/或诱导型启动子,它们的一些非限制性实例包括病毒启动子(例如cmv、sv40)、组织特异性启动子(例如肌肉(mck)、心(例如nse)、眼(例如msk))和合成启动子(sp1元件)和鸡β肌动蛋白启动子(cb或cba)。启动子可以存在于它与核酸酶序列可操作联结的任何位置上。
[0164]
诱导型启动子
[0165]
诱导型启动子可为由诱导物的存在、阻遏物的不存在、或诱导由诱导型启动子进行转录的任何其它合适的物理或化学条件诱导的启动子。术语“诱导物”、“诱导条件”等应相应地理解。
[0166]
作为非限制性实例,用于本发明实施方式的诱导型启动子可为小分子诱导型启动子、四环素可调节(例如诱导型或阻抑型)的启动子、醇诱导型启动子、类固醇诱导型启动子、米非司酮(ru486)诱导型启动子、蜕皮激素诱导型启动子、雷帕霉素诱导型启动子、金属硫蛋白诱导型启动子、激素诱导型启动子、cumate诱导型启动子、温度诱导型启动子、ph诱导型启动子和金属诱导型启动子。
[0167]
温度诱导型启动子——诱导型启动子可以通过降低温度进行诱导,例如冷休克响应性启动子。在一些实施方式中,诱导型启动子为合成的冷休克响应性启动子,其来衍生自cho细胞的s1006a基因(钙周期蛋白)。s1006a基因(钙周期蛋白)启动子的温度敏感性由thaisuchat等,2011鉴别出(thaisuchat,h.等,(2011)
‘
identification of a novel temperature sensitive promoter in cho cells’,bmc biotechnology,11.doi:10.1186/1472-6750-11-51),以引用的方式将其并入本文。在一些实施方式中,诱导型启动子为thaisuchat等,2011的图2中所示的合成冷休克响应性启动子之一。这些启动子通过降低温度进行诱导,如thaisuchat等,2011的图3所示。大多数这些合成启动子构建体在37℃时表现出与已知启动子sv40相似的表达,而当温度降低到33℃时诱导了2-3倍。在一些实施方式中,诱导型启动子为来自thaisuchat等,2011的图2的sps5。在一些优选的实施方式中,诱导型启动子为来自thaisuchat等,2011的图2的sps8。
[0168]
ph诱导型启动子——诱导型启动子可以通过降低或增加包含该启动子的细胞所暴露的ph进行诱导。合适地,所述诱导型启动子可以通过降低ph进行诱导,即在酸性条件下可诱导的启动子。合适的酸诱导型启动子描述于hou等,2016(hou,j.等,(2016)
‘
isolation and functional validation of salinity and osmotic stress inducible promoter from the maize type-ii h -pyrophosphatase gene by deletion analysis in transgenic tobacco plants’,plos one,11(4),pp.1
–
23.doi:10.1371/journal.pone.0154041),以引用的方式将其并入本文。
[0169]
在一些实施方式中,所述诱导型启动子是衍生自ygp1基因或ccw14基因的在酸性条件下可诱导的合成启动子。rajkumar等,2016(rajkumar,a.s.等,(2016)
‘
engineering of synthetic,stress-responsive yeast promoters’,44(17).doi:10.1093/nar/gkw553)通过修饰转录因子结合位点,研究并改进了ygp1基因或ccw14基因在酸性条件下的可诱导性,以引用的方式将其并入本文。在一些实施方式中,所述诱导型启动子是rajkumar等,2016的图1a、图2a、图3a和图4a中在酸性条件下可诱导的合成启动子之一。如rajkumar等,2016的图1b、图2b、图3b和图4b所示,这些启动子通过降低ph进行诱导。当从ph 6降低到ph3时,这些合成启动子中的大多数诱导多达10-15倍。在一些优选的实施方式中,所述诱导型启动子是来自rajkumar等,2016的图1的ygp1pr。在其它优选的实施方式中,所述诱导型启动子是来自rajkumar等,2016的图1的ygp1pr。
[0170]
渗透压诱导型启动子——诱导型启动子可为渗透压诱导的。zhang等描述了由渗透压诱导的合适的启动子(molecular biology reports,第39卷,第7347-7353页(2012)),以引用的方式将其并入本文。
[0171]
碳源诱导型启动子——诱导型启动子可以通过添加特定的碳源(例如非糖碳源)进行诱导。或者,该诱导型启动子可通过收回或缺乏碳源进行诱导。由多种碳源的存在或不存在诱导的合适的启动子描述于weinhandl等,2014(weinhandl,k.等,(2014)
‘
carbon source dependent promoters in yeasts’,microbial cell factories,13(1),pp.1
–
17.doi:10.1186/1475-2859-13-5),以引用的方式将其并入本文。
[0172]
醇(例如乙醇)诱导型启动子——诱导型启动子可以通过添加乙醇进行诱导。由乙醇诱导的合适的启动子描述于matsuzawa等(applied microbiology and biotechnology,第97卷,第6835-6843页(2013)),以引用的方式将其并入本文。
[0173]
氨基酸诱导型启动子——诱导型启动子可以通过添加一种或多种氨基酸进行诱导。适当地,氨基酸可为芳香族氨基酸。适当地,氨基酸可为gaba(γ氨基丁酸),其也为一种神经递质。由芳香族氨基酸和gaba诱导的合适启动子描述于kim等(applied microbiology and biotechnology,第99卷,第2705
–
2714页(2015)),以引用的方式将其并入本文。
[0174]
激素(例如蜕皮激素)诱导型启动子——诱导型启动子可由类固醇激素进行诱导。适当地,类固醇激素可为蜕皮激素。由no、yao和evans创建了哺乳动物蜕皮激素诱导型系统(no,d.,yao,t.p.and evans,r.m.(1996)
‘
ecdysone-inducible gene expression in mammalian cells and transgenic mice’,proceedings of the national academy of sciences of the united states of america,93(8),pp.3346
–
3351.doi:10.1073/pnas.93.8.3346),以引用的方式将其并入本文。哺乳动物细胞中经修饰的蜕皮激素受体的表达使得能够在添加蜕皮激素后诱导由蜕皮激素响应性启动子进行的表达,如no、yao和
of the national academy of sciences of the united states of america,97(14),pp.7963
–
7968.doi:10.1073/pnas.130192197),以引用的方式将其并入本文。urlinger等,2000的图3中显示变体rtta-s2和rtta-m2具有较低的基础活性,这表明在不存在四环素或其衍生物的情况下来自tta依赖性启动子的最小背景表达。此外,如urlinger等,2000的图3中所示,rtta-m2显示出对四环素及其衍生物的增加的敏感性,并且以比rtta低10倍的浓度发挥作用。在一些优选实施方式中,rtta的改进的变体为来自urlinger等,2000的rtta-m2。
[0180]
替代的改进的变体描述于zhou等,2006的表1中(zhou,x.等(2006)
‘
optimization of the tet-on system for regulated gene expression through viral evolution’,gene therapy,13(19),pp.1382
–
1390.doi:10.1038/sj.gt.3302780),以引用的方式将其并入本文。如zhou等,2006的图3中所述,这些变体中的大多数显示出相比rtta而言具有更高的转录活性和多西环素敏感性。性能最高的变体对多西环素的活性高7倍,敏感性高100倍。在一些优选实施方式中,rtta的改进变体为来自zhou等,2006的v14、v15或v16。
[0181]
合适的可商购四环素诱导型系统为来自life-technologies的t-rex系统(参见例如life-technologies(2014)'inducible protein expression using the t-rextm system',1,pp.1-12,于以下可得到:www.lifetechnologies.com/de/de/home/references/protocols/proteins-expression-isolation-and-analysis/protein-expression-protocol/inducible-protein-expression-using-the-trex-system.reg.us.html/)。
[0182]
通过例如四环素的不存在和雌激素的存在进行的诱导——诱导型启动子可因分子的不存在和不同分子的存在而被诱导。在一些实施方式中,可通过移除四环素和添加雌激素来对诱导型启动子进行诱导,如iida等,1996所述(iida,a.等,(1996)
‘
inducible gene expression by retrovirus-mediated transfer of a modified tetracycline-regulated system.’,journal of virology,70(9),pp.6054
–
6059.doi:10.1128/jvi.70.9.6054-6059.1996),以引用的方式并入本文。这种特异性可诱导性是通过将雌激素受体的配体结合结构域添加到tta反式激活因子的羧基末端来实现的。如iida等,1996的图3所示,这种修饰的反式激活因子在四环素不存在且雌激素存在的情况下引起感兴趣的基因的高表达。
[0183]
通过小分子增强剂进行诱导——诱导型启动子可由小分子增强剂进行诱导。由小分子增强剂(如芳香族羧酸、异羟肟酸和乙酰胺)诱导的合适的启动子描述于allen等(biotechnol.bioeng.2008;100:1193
–
1204),以引用的方式将其并入本文。
[0184]
米非司酮(ru-486)诱导型启动子——诱导型启动子可由合成类固醇进行诱导。在一些实施方式中,所述诱导型启动子可由米非司酮(也称为ru-486)进行诱导。杂合米非司酮响应性转录因子lexpr反式激活因子由emelyanov和parinov,2008(emelyanov,a.和parinov,s.(2008)
‘
mifepristone-inducible lexpr system to drive and control gene expression in transgenic zebrafish’,developmental biology,320(1),pp.113
–
121.doi:10.1016/j.ydbio.2008.04.042,以引用的方式将其并入本文)通过融合细菌lexa阻遏物的dna结合结构域、人孕酮受体的截短的配体结合结构域和人nf-kb/p65蛋白的激活结构域而创建。在添加米非司酮后,lexpr诱导由含有lexa结合位点的启动子序列进行的表达,如emelyanov和parinov,2008的图1和图2中所示。合适的可商购的米非司酮诱导型系统
a natural metabolite-responsive ribozyme’,nature,428(6980),pp.281
–
286.doi:10.1038/nature02362),以引用的方式将其并入本文。如图2c所示,核酶被葡萄糖胺-6-磷酸以浓度依赖性方式激活,并切割glms基因的信使rna。经修饰后,这种天然系统能够应用于控制glms基因之外的感兴趣的基因。
[0194]
配体诱导型适体酶也可以下调蛋白质表达。蛋白质表达可以被适体酶下调,所述适体酶通过小分子诱导的核酶自切割从而产生mrna降解来下调蛋白质表达,见zhong等,2016(zhong,g.等,(2016)
‘
rational design of aptazyme riboswitches for efficient control of gene expression in mammalian cells’,elife,5(november2016).doi:10.7554/elife.18858),以引用的方式将其并入本文。合适的适体酶在(zhong等,2016)的图4a中示出。这些适体酶降低了感兴趣基因的相对表达,如(zhong等,2016)的图4所示。
[0195]
蛋白质表达也可以被小分子依赖性核酶上调。核酶可为四环素依赖性的。beilstein等描述了合适的四环素依赖性核酶,其可以通过阻止核酶切割来开启蛋白质表达,所述核酶切割否则在没有配体的情况下切割mrna(acs synth.biol.2015,4,5,526-534),以引用的方式将其并入本文。
[0196]
蛋白质表达也可以通过鸟嘌呤依赖性适体酶来调节,如nomura等所述(chem.commun.,2012,48,7215-7217),以引用的方式将其并入本文。
[0197]
此外,kumar等中描述了将药物诱导型变构核酶与microrna前体类似物相结合的rna结构,该结构允许在哺乳动物细胞中化学诱导rnai(j.am.chem.soc.2009,131,39,13906-13907),以引用的方式将其并入本文。
[0198]
金属硫蛋白诱导型启动子——金属硫蛋白诱导型启动子已在文献中有所描述。参见例如shinichiro takahashi“positive and negative regulators of the metallothionein gene”molecular medicine reports march 9,2015,p795-799,以引用的方式将其并入本文。
[0199]
雷帕霉素诱导型启动子——诱导型启动子可由小分子药物(如雷帕霉素)进行诱导。使用雷帕霉素对基因表达进行药理学控制的人源化系统描述于rivera等,1996(rivera等nature medicine第2卷,第1028-1032页(1996)),以引用的方式将其并入本文。雷帕霉素结合至fkbp12的天然能力以及反过来的这种复合物结合至frap的能力被rivera等,1996使用以诱导感兴趣基因的雷帕霉素特异性表达。这是通过将fkbp12/frap蛋白中的一个融合至dna结合结构域并将另一个蛋白融合至激活结构域来实现的。如果fkbp与dna结合结构域融合,且frap融合至激活结构域,则在不存在雷帕霉素的情况下,将没有感兴趣的基因的转录,因为fkbp和frap不相互作用,如图1b所示。在雷帕霉素存在的情况下,fkbp和frap相互作用,并使dna结合结构域和激活结构域紧密接触,引起感兴趣的基因的转录,如图2和图3所示。
[0200]
化学诱导的接近诱导型启动子——诱导型启动子可通过化学诱导的接近进行控制。用于控制蛋白质丰度或活性的合适的基于小分子的系统描述于liang等(sci signal.2011mar 15;4(164):rs2.doi:10.1126/scisignal.2001449),以引用的方式将其并入本文。
[0201]
基因表达可以通过化学诱导的接近进行诱导,所述化学诱导的接近通过联合两个蛋白质结合表面的分子进行,如belshaw等,1996所示(belshaw,p.j.等,(1996)
‘
controlling protein association and subcellular localization with a synthetic ligand that induces heterodimerization of proteins’,proceedings of the national academy of sciences of the united states of america,93(10),pp.4604
–
4607),以引用的方式将其并入本文。belshaw等的图3示出了通过化学诱导的接近的感兴趣基因的转录激活,所述化学诱导的接近通过联合两个蛋白质结合表面的分子进行。
[0202]
诱导型启动子——诱导型启动子可由小的合成分子诱导。在一些实施方式中,这些小的合成分子可为双酰肼配体。用于诱导型上调和下调基因表达的合适系统描述于cress等(第66卷,第8期增刊,pp.27)或barrett等(cancer gene therapy,第25卷,第106-116页(2018)),以引用的方式将其并入本文。系统由衍生自蜕皮激素受体(ecr)和rxr的两种嵌合蛋白组成,它们分别融合至dna结合结构域和酸性转录激活结构域。在结合小分子合成配体时,核受体可以异二聚化以创建功能性转录因子,并激活由连接至感兴趣的基因的响应性启动子进行的转录。
[0203]
crispr诱导型启动子——基因表达可由基于crispr的转录调节物进行诱导。核酸酶缺陷的cas9可以通过设计其相关的单向导rna(sgrna)而定向至感兴趣的序列,并且它可以通过sgrna-cas9复合物上的效应结构域的拴系来调制基因表达,如,ferry、lyutova和fulga,2017的图1所示(ferry,q.r.v.,lyutova,r.和fulga,t.a.(2017)
‘
rational design of inducible crispr guide rnas for de novo assembly of transcriptional programs’,nature communications.nature publishing group,8,pp.1
–
10.doi:10.1038/ncomms14633),以引用的方式将其并入本文。ferry、lyutova和fulga,2017中描述了基于sgrna最小工程化的合适的多功能诱导型crispr-tr平台。
[0204]
基于crispr的转录调控可转而由药物诱导。合适的药物诱导型的基于crispr的转录调控系统示出于zhang等,2019(zhang,j.等,(2019)
‘
drug inducible crispr/cas systems’,computational and structural biotechnology journal.elsevier b.v.,17,pp.1171
–
1177.doi:10.1016/j.csbj.2019.07.015),以引用的方式将其并入本文。
[0205]
在一个实施方式中,使细胞与诱导剂接触或对细胞施加合适的诱导条件引起可操作地连接至诱导型启动子的基因的表达。
[0206]
本文所述的诱导型启动子可以进一步控制诱导型启动子的诱导物或阻遏物(例如,第二不同的启动子的诱导物或阻遏物,或自身的诱导物或阻遏物)的表达。在一个实施方式中,所述细胞包含第一诱导型启动子,所述第一诱导型启动子可操作地连接至可阻止蛋白质表达的阻抑型元件。
[0207]
在一个实施方式中,第一诱导型启动子进一步编码阻抑第一诱导型启动子的表达的蛋白质。
[0208]
在一个实施方式中,所述细胞包含第一诱导型启动子,所述第一诱导型启动子进一步编码诱导第二诱导型启动子的表达的蛋白质。
[0209]
组织特异性启动子
[0210]
在本文公开的方法和组合物的一些实施方式中,启动子为肝特异性启动子,并且可以选自包括但不限于表2中公开的那些启动子的启动子。“肝特异性”或“肝特异性表达”是指与其它组织(例如脾、肌肉、心脏、肺和脑)相比,顺式调节元件、顺式调节模块或启动子
731中所公开)、α-1抗胰蛋白酶基因启动子(如rettenger,proc.natl.acad.sci.91(1994)1460-1464中所公开)、纤维蛋白原基因启动子、apo-a1(载脂蛋白a1)基因启动子和肝转移酶(例如,如sgot、sgpt和γ-谷氨酰转移酶)的启动子基因。还参见2001/0051611和pct专利公开wo 90/07936和wo 91/02805,以引用的方式将其整体并入本文。在一些实施方式中,肝特异性启动子为重组肝特异性启动子,例如,如us20170326256a1中所公开,以引用的方式将其整体并入本文。
[0216]
在一些实施方式中,肝特异性启动子为乙型肝炎x基因启动子和乙型肝炎核心蛋白启动子。在一些实施方式中,肝特异性启动子可以与它们各自的增强子一起使用。增强子元件可以连接于编码溶酶体酶的核酸的5'或3'末端。乙型肝炎x基因启动子及其增强子可以采用twu,j virol.61(1987)3448-3453中描述的方法从病毒基因组中以332个碱基对的ecorv-ncoi dna片段而获得。乙型肝炎核心蛋白启动子可以采用gerlach,virol 189(1992)59-66中描述的方法从病毒基因组中以584个碱基对的bamhi-bgiii dna片段而获得。在插入bamhi-bgiii片段之前,可能需要移除其中的负调节序列。
[0217]
肝特异性启动子的功能变体
[0218]
在一些实施方式中,肝特异性启动子的功能变体可被视为启动子元件,所述启动子元件当在启动子中替代参考启动子元件时基本上保持其活性。例如,包含表2中公开的给定启动子的功能变体的肝特异性启动子的功能变体优选保留其活性的至少35%、或至少40%、或至少45%、或至少50%,或至少55%、或至少60%、或至少70%或至少80%,更优选其活性的至少90%,更优选未改变的启动子活性的至少95%,以及还更优选100%的活性(与包含未修饰的启动子元件的未改变的启动子序列相比)。
[0219]
在一些实施方式中,表2中公开的肝特异性启动子的功能变体或功能片段具有与原始未修饰的序列至少约75%的序列同一性、或至少约80%的序列同一性、至少约90%的序列同一性、至少约95%的序列同一性、至少约98%的序列同一性,以及同时具有相应未修饰的启动子序列的至少35%的启动子活性、或至少约45%的启动子活性、或至少约50%的启动子活性、或至少约60%的启动子活性、或至少约75%的启动子活性、或至少约80%的启动子活性、或至少约85%的启动子活性、或至少约90%的启动子活性、或至少约95%的启动子活性。可以对肝特异性进行鉴别,其中可操作地连接至启动子的基因(例如治疗性基因或报告基因)的表达优先或主要发生在肝来源的细胞中。例如,可以定义优先或主要表达,其中肝来源的细胞中的表达水平显著高于其它类型的细胞(即非肝来源的细胞)。
[0220]
例如,seq id no:247的功能变体或功能片段具有与seq id no:247至少约75%的序列同一性,或与seq id no:247至少约80%的序列同一性、与seq id no:247至少约90%的序列同一性、与seq id no:247至少约95%的序列同一性、与seq id no:247或原始未修饰的序列至少约98%的序列同一性,以及同时具有seq id no:247的相应未修饰的启动子序列的至少35%的启动子活性、或至少约45%的启动子活性、或至少约50%的启动子活性、或至少约60%的启动子活性、或至少约75%的启动子活性、或至少约80%的启动子活性、或至少约85%的启动子活性、或至少约90%的启动子活性、或至少约95%的启动子活性。
[0221]
适当地,启动子元件的功能变体与参考启动子元件保持显著水平的序列同一性。合适的功能变体包含以下序列:与参考启动子元件至少70%相同,更优选与参考启动子元件至少80%、90%、95%或99%相同的序列。
[0222]
应当注意,可以对如表2中本文所公开的肝特异性启动子的序列进行修改而不引起活性的显著丧失。因此,下文讨论的肝特异性启动子的功能变体可以通过对表2中公开的肝特异性启动子的序列进行修饰来制备,条件是避免显著损害肝特异性启动子的活性的修饰。鉴于本公开中提供的信息,对表2中本文公开的肝特异性启动子进行修饰以提供功能变体是容易的。此外,本公开提供了用于简单地评估任何给定的肝特异性启动子变体的功能性的方法。
[0223]
转基因
[0224]
使用本发明的方法制造的环状核酸或载体对于在体外、离体和体内将核酸递送至细胞而言有用。具体而言,该环状核酸或载体可有利地用于将核酸递送或转移至动物(包括哺乳动物)细胞。
[0225]
可以在使用本发明制造的dna构建体中递送任何感兴趣的核酸序列。在一个实施方式中,感兴趣的核酸包括编码多肽的核酸,所述多肽包括病毒多肽(例如,由病毒表达和/或病毒颗粒产生所需的任何多肽,例如cap、rep、ad辅助多肽等)、治疗性多肽(例如,用于医学或兽医用途)、免疫原性多肽(例如,用于疫苗)或诊断性多肽。在一个实施方式中,感兴趣的核酸包括编码基因编辑多肽的那些核酸,所述基因编辑多肽例如crispr、cas、talen、大范围核酸酶等。在一个实施方式中,感兴趣的核酸包括rna干扰核酸,例如,mirna、shrna、sirna、dsrna、抑制性寡核苷酸等。
[0226]
在一个实施方式中,转基因为治疗性基因。治疗性基因包括但不限于囊性纤维化跨膜调节蛋白(cftr)、肌营养不良蛋白(dystrophin,包括微小肌营养不良蛋白和微型肌营养不良蛋白(参见例如vincent等,(1993)nature genetics 5:130;美国专利申请号2003/017131;国际公开wo/2008/088895;wang等,proc.natl.acad.sci.usa 97:13714-13719(2000);以及gregorevic等,mol.ther.16:657-64(2008))、肌生长抑制素前肽、卵泡抑素、激活素ii型可溶性受体、igf-1、抗炎多肽(例如iκb显性突变体)、sarcospan、utrophin(tinsley等,(1996)nature 384:349)、mini-utrophin、凝血因子(例如,因子viii、因子ix、因子x等)、促红细胞生成素、血管抑素、内皮抑素、过氧化氢酶、酪氨酸羟化酶、超氧化物歧化酶、瘦素、ldl受体、脂蛋白脂酶、鸟氨酸转氨甲酰酶、β-珠蛋白、α-珠蛋白、血影蛋白、α
1-抗胰蛋白酶、腺苷脱氨酶、次黄嘌呤鸟嘌呤磷酸核糖基转移酶、β-葡萄糖脑苷脂酶、鞘磷脂酶、溶酶体己糖胺酶a、支链酮酸脱氢酶、rp65蛋白、细胞因子(例如,α-干扰素、β-干扰素、干扰素-γ、白介素-2、白介素-4、粒细胞-巨噬细胞集落刺激因子、淋巴毒素等)、肽生长因子、神经营养因子和激素(例如,生长激素、胰岛素、胰岛素样生长因子1和胰岛素样生长因子2、血小板源生长因子、表皮生长因子、成纤维细胞生长因子、神经生长因子、神经营养因子-3和神经营养因子-4、脑源性神经营养因子、骨形态发生蛋白[包括rankl和vegf]、胶质源性生长因子、转化生长因子-α和转化生长因子-β等)、溶酶体酸α-葡萄糖苷酶、α-半乳糖苷酶a、受体(例如,肿瘤坏死生长因子性可溶性受体)、s100a1、小白蛋白(parvalbumin)、6型腺苷酸环化酶、影响g蛋白偶联受体激酶2型敲减的分子(如截短的组成型活性barket)、抗炎因子(例如trap)、抗肌生长抑制素蛋白、天冬氨酸酰化酶和单克隆抗体(包括单链单克隆抗体;示例性mab为mab)。其它示例性异源核酸序列编码自杀基因产物(例如胸苷激酶、胞嘧啶脱氨酶、白喉毒素和肿瘤坏死因子)、赋予对用于癌症疗法的药物的耐性的蛋白质、肿瘤抑制基因产物(例如p53、rb、wt-1)、trail、fas-配体以及在有需要的受试者中具
有治疗效果的任何其它多肽。细小病毒载体也可用于递送单克隆抗体和抗体片段,例如针对肌生长抑制素的抗体或抗体片段(参见例如,fang等,nature biotechnol.23:584-590(2005))。
[0227]
编码多肽的核酸序列包括编码报告多肽(例如酶)的那些核酸序列。报告多肽是本领域已知的并且包括但不限于绿色荧光蛋白、β-半乳糖苷酶、碱性磷酸酶、荧光素酶和氯霉素乙酰转移酶基因。
[0228]
或者,在本发明的具体实施方式中,核酸(例如转基因)可以编码反义核酸、核酶(例如,如u.s.pat.no.5,877,022中所述)、影响剪接体介导的反式剪接的rna(参见,puttaraju等,(1999)nature biotech 17:246;u.s.pat.no.6,013,487;u.s.pat.no.6,083,702)、干扰rna(rnai)(包括介导基因沉默的sirna、shrna或mirna)(参见sharp等,(2000)science 287:2431),以及其它非翻译rna,例如“向导”rna(gorman等,(1998)proc.nat.acad.sci.usa 95:4929;u.s.pat.no.5,869,248,yuan等)等。示例性的非翻译rna包括针对多重耐药(mdr)基因产物的rnai(例如,用以治疗和/或预防肿瘤和/或用于向心脏进行给予以防止化学疗法的损害),针对肌生长抑制素的rnai(例如,用于杜兴氏肌营养不良),针对vegf的rnai(例如,用以治疗和/或预防肿瘤),针对受磷蛋白的rnai(例如,用以治疗心血管疾病,参见例如,andino等,j.gene med.10:132-142(2008)以及li等,acta pharmacol sin.26:51-55(2005));受磷蛋白抑制性或显性负性(dominant-negative)分子(例如受磷蛋白s16e)(例如,用以治疗心血管疾病,参见例如,hoshijima等,nat.med.8:864-871(2002)),针对腺苷激酶的rnai(例如,用于癫痫),针对肌蛋白聚糖(例如,α、β、γ)的rnai,针对肌生长抑制素、肌生长抑制素前肽、卵泡抑素或激活素ii型可溶性受体的rnai,针对抗炎多肽(例如iκb显性突变体)的rnai,以及针对病原生物体和病毒(例如乙型肝炎病毒、人类免疫缺陷病毒、cmv、单纯疱疹病毒、人类乳头瘤病毒等)的rnai。
[0229]
或者,在本发明的具体实施方式中,治疗性转基因可以编码蛋白磷酸酶抑制剂i(i-1),serca2a,调节受磷蛋白基因的锌指蛋白,barkct,β2-肾上腺素能受体,β2-肾上腺素能受体激酶(bark),磷酸肌醇-3激酶(pi3激酶),影响g蛋白偶联受体激酶2型敲减的分子(例如截短的组成型活性barkct);calsarcin,针对受磷蛋白的rnai;受磷蛋白的抑制性或显性负性分子(例如受磷蛋白s16e),enos,inos或骨形态发生蛋白(包括bnp 2、bnp 7等,rankl和/或vegf)。
[0230]
环状核酸或载体还可以包含与宿主染色体上的基因座共享同源性并与其进行重组的核酸。例如,这种方法可用于修正宿主细胞中的遗传缺陷。
[0231]
作为进一步的替代方式,环状核酸或载体可以在体外、离体或体内编码期望在细胞中产生的任何多肽。例如,可以将所述环状核酸或载体引入培养的细胞并从中分离表达的基因产物。
[0232]
在一个实施方式中,治疗性基因可操作地连接至启动子。本文描述了指导治疗性转基因表达的各种启动子。实例包括但不限于组成型启动子、阻抑型启动子和/或诱导型启动子,它们的一些非限制性实例包括病毒启动子(例如cmv、sv40)、组织特异性启动子(例如肌肉(mck)、心(例如nse)、眼(例如msk))和合成启动子(sp1元件)和鸡β肌动蛋白启动子(cb或cba)。启动子可以存在于它与核酸酶序列可操作联结的任何位置上。
[0233]
此外,一种或多种启动子(可以相同或不同)可以存在于同一核酸分子中,其在一
起或者位于所述核酸分子上的不同位置处。此外,内部核糖体进入信号(ires)和/或其它核糖体通读元件(ribosome-readthrough element)可以存在于核酸分子上。一种或多种此类ires和/或核糖体通读元件(可以相同或不同)可以存在于同一核酸分子中,其在一起和/或位于所述核酸分子上的不同位置。当核酸分子上存在多个核酸酶序列时,此类ires和核糖体通读元件可用于通过独立于cap的机制翻译信使rna序列。
[0234]
与标准dna载体相比,本发明的环状核酸载体提供了提高核酸在广范围的细胞中的转导效率的方法,所述细胞包括分裂细胞、非分裂细胞、肝细胞、肾细胞、cns细胞、皮肤细胞、视网膜细胞、心脏细胞等。在一些实施方式中,本文所述的环状核酸载体的转导效率相对于标准dna载体增加至少约10%,例如与质粒载体或非闭合末端的线性载体相比增加至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、500%或更多。如本文所使用的,“转导”是指将遗传物质转移到细胞中。转导效率可以通过本领域公知的技术进行测量,例如,技术人员可以通过基于pcr的测定或蛋白质印迹来测量和确定已经转移至细胞中的遗传物质的水平。在一个实施方式中,转导效率可以针对含有类似核酸(例如启动子、转基因等)的病毒载体进行测量。病毒载体可以是本领域已知的任何载体,包括aav、慢病毒载体、腺病毒载体、细小病毒载体等。
[0235]
本文引用的所有出版物、专利申请、专利、专利公开和其它参考文献以引用的方式以其整体被并入,以用于与其中呈现该参考文献的句子和/或段落相关的教导。
[0236]
下面的实施例被列出用于说明本发明,而不应解释为对本发明的限制。
[0237]
在以asklepios biopharmaceuticals,inc.和richard jude samulski的名义于2019年6月21日提交的国际申请号pct/us2019/038515(pct案卷号046192-092620wopt)中的任何公开落入如在本技术的任何一项或多项权利要求中限定的发明内,或落入在将来可能在本技术中或由其衍生的任何专利中提交的经修改的权利要求中限定的任何发明内的程度上,以及在本权利要求或上述那些权利要求所适用的任何相关一个或多个国家的法律规定提供,国际申请号pct/us2019/038515(pct案卷号046192-092620wopt)的公开内容在所述一个或多个国家中或对于所述一个或多个国家是针对本权利要求的或上述那些权利要求的现有技术的一部分的程度上,我们由此保留以下权利:在防止本技术或由其衍生的任何专利的无效的必要的范围内,从本技术或由其衍生的任何专利的权利要求中免于请求保护所述公开。
[0238]
例如并且不受限地,我们保留从本技术或由其衍生的任何专利的任何权利要求(现在或将来修改的)中免于请求保护以下任何一项或多项主题的权利:
[0239]
a.国际申请号pct/us2019/038515(pct案卷号046192-092620wopt)的实施例7和实施例8中公开的任何主题;或
[0240]
b.国际申请号pct/us2019/038515(pct案卷号046192-092620wopt)的图11-图14中公开的任何主题;或
[0241]
c.一种制造环状核酸载体的方法,所述方法包括(a)使宿主系统与模板接触,其中,所述模板包含至少一个侧翼切割位点以及:(i)至少一个噬菌体复制起点(ori),(ii)至少一个末端重复(tr),以及(iii)与转基因可操作地连接的启动子序列,其中,至少一个tr为aav双d-itr(dd-itr);(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收环状核酸产生物,其中,所述环状核酸自退火;或
[0242]
d.一种制造环状核酸载体的方法,所述方法包括(a)使宿主系统与模板接触,其中,所述模板包含至少两个侧翼切割位点,并且所述位点内为:(i)至少一个噬菌体复制起点(ori),(ii)至少一个末端重复(tr),以及(iii)与转基因可操作地连接的启动子序列,其中,所述至少一个tr为aav双d-itr(dd-itr);(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收环状核酸产生物,其中,所述环状核酸自退火;或
[0243]
e.一种制造含有转基因的环状核酸载体的方法,所述方法包括:(a)用质粒模板转化宿主系统,其中,所述质粒模板包含:(i)噬菌体复制起点(ori),(ii)截短的噬菌体ori(例如,oriδ29),(iii)至少一个末端重复(tr),以及(iv)与转基因可操作地连接的启动子序列,其中,所述质粒模板以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火,并且其中,所述至少一个tr为aav双d-itr(dd-itr);(b)将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及(c)回收产生的环状核酸,其中,所述环状核酸自退火。
[0244]
f.选自以下的任一种环状核酸:
[0245]
a.从5'到3'以任意顺序具有至少一个切割位点、噬菌体ori、至少一个dd-itr和连接至转基因的至少一个启动子;或者
[0246]
b.在至少两个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少一个dd-itr和连接至转基因的至少一个启动子;或者
[0247]
c.在至少三个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少一个dd-itr和连接至转基因的至少一个启动子;或者
[0248]
d.从5'到3'以任意顺序具有至少一个切割位点、至少两个噬菌体ori、至少一个dd-itr和连接至转基因的至少一个启动子;或者
[0249]
e.在至少两个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少一个dd-itr和连接至转基因的至少一个启动子;或者
[0250]
f.在至少三个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少一个dd-itr和连接至转基因的至少一个启动子;或者
[0251]
g.从5'到3'以任意顺序具有至少一个切割位点、噬菌体ori、至少两个dd-itr和连接至转基因的至少一个启动子;或者
[0252]
h.在至少两个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少两个dd-itr和连接至转基因的至少一个启动子;或者
[0253]
i.在至少三个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少两个dd-itr和连接至转基因的至少一个启动子;或者
[0254]
j.从5'到3'以任意顺序具有至少一个切割位点、至少两个噬菌体ori、至少两个dd-itr和连接至转基因的至少一个启动子;或者
[0255]
k.在至少两个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少两个dd-itr和连接至转基因的至少一个启动子;或者
[0256]
l.在至少三个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少两个dd-itr和连接至转基因的至少一个启动子;或者
[0257]
m.从5'到3'以任意顺序具有至少一个切割位点、噬菌体ori、至少三个dd-itr和连接至转基因的至少一个启动子;或者
[0258]
n.在至少两个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少三个dd-itr和连接至转基因的至少一个启动子;或者
[0259]
o.在至少三个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少三个dd-itr和连接至转基因的至少一个启动子;或者
[0260]
p.从5'到3'以任意顺序具有至少一个切割位点、至少两个噬菌体ori、至少三个dd-itr和连接至转基因的至少一个启动子;或者
[0261]
q.在至少两个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少三个dd-itr和连接至转基因的至少一个启动子;或者
[0262]
r.在至少三个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少三个dd-itr和连接至转基因的至少一个启动子;或者
[0263]
s.从5'到3'以任意顺序具有至少一个切割位点、噬菌体ori、至少四个dd-itr和连接至转基因的至少一个启动子;或者
[0264]
t.在至少两个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少四个dd-itr和连接至转基因的至少一个启动子;或者
[0265]
u.在至少三个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少四个dd-itr和连接至转基因的至少一个启动子;或者
[0266]
v.从5'到3'以任意顺序具有至少一个切割位点、至少两个噬菌体ori、至少四个dd-itr和连接至转基因的至少一个启动子;或者
[0267]
w.在至少两个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少四个dd-itr和连接至转基因的至少一个启动子;或者
[0268]
x.在至少三个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少四个dd-itr和连接至转基因的至少一个启动子;或者
[0269]
y.从5'到3'以任意顺序具有至少一个切割位点、噬菌体ori、至少五个dd-itr和连接至转基因的至少一个启动子;或者
[0270]
z.在至少两个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少五个dd-itr和连接至转基因的至少一个启动子,其中,所述至少两个切割位点位于其它组分侧翼;或者
[0271]
aa.在至少三个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少五个dd-itr和连接至转基因的至少一个启动子;或者
[0272]
bb.从5'到3'以任意顺序具有至少一个切割位点、至少两个噬菌体ori、至少五个dd-itr和连接至转基因的至少一个启动子;或者
[0273]
cc.在至少两个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少五个dd-itr和连接至转基因的至少一个启动子;或者
[0274]
dd.在至少三个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少五个dd-itr和连接至转基因的至少一个启动子;或者
[0275]
ee.从5'到3'以任意顺序具有至少一个切割位点、噬菌体ori、至少六个dd-itr和连接至转基因的至少一个启动子;或者
[0276]
ff.在至少两个切割位点中从5'到3'以任意顺序具有噬菌体ori、至少六个dd-itr和连接至转基因的至少一个启动子;或者
[0277]
gg.在至少三个切割位点中具有噬菌体ori、至少六个dd-itr和连接至转基因的至
少一个启动子,其中,所述至少两个切割位点位于其它组分侧翼,并且第三切割位点处于至少一个噬菌体ori的下游;
[0278]
hh.从5'到3'以任意顺序具有至少一个切割位点、至少两个噬菌体ori、至少六个dd-itr和连接至转基因的至少一个启动子;或者
[0279]
ii.在至少两个切割位点中从5'到3'以任意顺序具有至少两个噬菌体ori、至少六个dd-itr和连接至转基因的至少一个启动子;或者
[0280]
jj.在至少三个切割位点中以任意顺序具有至少两个噬菌体ori、至少六个dd-itr和连接至转基因的至少一个启动子。
[0281]
g.来自[e]的任意环状核酸,所述环状核酸进一步包含不是dd-itr的至少一个额外的itr。
[0282]
h.来自[e]的任意环状核酸,所述环状核酸进一步包含至少一个衔接子序列。
[0283]
i.来自[e]的任意环状核酸,所述环状核酸进一步包含至少两个衔接子序列。
[0284]
j.来自[e]的任意环状核酸,所述环状核酸进一步包含与转基因可操作地连接的至少一个额外的启动子。
[0285]
不受限制地,我们声明上述免于请求保护的权利的保留至少适用于本技术所附的权利要求1-73和在[0150]中列出的第1-75段。
[0286]
本文描述的发明可以在以下编号的段落中进一步描述:
[0287]
1.一种制造含有转基因的环状核酸载体的方法,所述方法包括:
[0288]
a.使宿主系统与模板接触,其中,所述模板包含至少一个侧翼切割位点,以及:
[0289]
i.至少一个噬菌体复制起点(ori);
[0290]
ii.至少一个末端重复(tr);以及
[0291]
iii.与转基因可操作地连接的启动子序列;
[0292]
b.将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及
[0293]
c.回收产生的所述环状核酸,
[0294]
其中,所述环状核酸自退火。
[0295]
2.如段落1所述的方法,其中,所述模板进一步包含第二侧翼切割位点,并且所述两个位点内为(i)-(iii)。
[0296]
3.如前述段落中任一段所述的方法,其中,所述模板进一步包含紧邻所述至少一个ori的下游的至少一个额外的切割位点(参见例如图5)。
[0297]
4.如前述段落中任一段所述的方法,所述方法进一步包括对所回收的环状核酸的至少一个切割位点进行剪切的步骤(参见例如图5)。
[0298]
5.如前述段落中任一段所述的方法,所述方法进一步包括在回收之后对所述环状核酸进行体外复制的步骤。
[0299]
6.如前述段落中任一段所述的方法,其中,所述模板进一步包含至少一个衔接子序列。
[0300]
7.如前述段落中任一段所述的方法,其中,所述模板进一步包含至少两个衔接子序列。
[0301]
8.如前述段落中任一段所述的方法,其中,所述衔接子序列诱导经切割的dna的闭合(参见例如图1-图5、图7和图9)。
[0302]
9.如前述段落中任一段所述的方法,其中,所述衔接子序列进一步包含切割位点。
[0303]
10.如前述段落中任一段所述的方法,其中,所述回收的环状核酸用于递送所述转基因。
[0304]
11.如前述段落中任一段所述的方法,其中,所述回收的环状核酸用于重组病毒载体的生产。
[0305]
12.如前述段落中任一段所述的方法,其中,所述环状核酸是自退火的并且为双链的。
[0306]
13.如前述段落中任一段所述的方法,其中,所述载体为单链的。
[0307]
14.如前述段落中任一段所述的方法,其中,存在第二tr,并且所述与转基因可操作地连接的启动子序列的两侧以tr为侧翼。
[0308]
15.如前述段落中任一段所述的方法,其中,所述ori位于左tr的上游。
[0309]
16.如前述段落中任一段所述的方法,其中,所述ori以所述tr为侧翼,并且处于所述与转基因可操作地连接的启动子序列的上游。
[0310]
17.如前述段落中任一段所述的方法,其中,所述宿主系统为细菌包装细胞。
[0311]
18.如前述段落中任一段所述的方法,其中,所述宿主系统为无细胞系统。
[0312]
19.如前述段落中任一段所述的方法,其中,所述宿主系统为无细胞系统并且含有辅助噬菌体颗粒。
[0313]
20.如前述段落中任一段所述的方法,其中,所述宿主系统为宿主细胞。
[0314]
21.如前述段落中任一段所述的方法,其中,所述宿主细胞为哺乳动物细胞、细菌细胞或昆虫细胞。
[0315]
22.如前述段落中任一段所述的方法,其中,所述病毒载体为腺相关病毒(aav)、慢病毒(lv)、单纯疱疹病毒(hsv)、腺病毒(av)或痘病毒(pv)。
[0316]
23.如前述段落中任一段所述的方法,其中,所述载体为dna病毒或rna病毒。
[0317]
24.如前述段落中任一段所述的方法,其中,所述病毒为aav并且具有突变的itr,其中,所述突变的itr为双d突变itr。
[0318]
25.如前述段落中任一段所述的方法,其中,所述至少一个tr为突变的itr、合成的itr、野生型itr或非功能性itr。
[0319]
26.如前述段落中任一段所述的方法,其中,所述载体具有侧翼dd-itr,并且所述侧翼之间为与所述转基因的有义链可操作地连接的启动子、复制缺陷型itr和所述转基因的反义互补物。
[0320]
27.如前述段落中任一段所述的方法,其中,所述itr为aav itr。
[0321]
28.如前述段落中任一段所述的方法,其中,所述ori位于itr的上游,并且紧邻上游itr的下游。
[0322]
29.如前述段落中任一段所述的方法,其中,所述至少一个噬菌体ori选自于由以下所组成的组:m13来源的ori、f1来源的ori或fd来源的ori。
[0323]
30.如前述段落中任一段所述的方法,其中,所述模板进一步包含第二ori,所述第二ori为不启动复制的截短的ori。
[0324]
31.如前述段落中任一段所述的方法,其中,所述截短的ori为oriδ29。
[0325]
32.如前述段落中任一段所述的方法,其中,所述至少两个切割位点为限制性位
点。
[0326]
33.如前述段落中任一段所述的方法,其中,所述至少两个限制性位点相同或不同。
[0327]
34.如前述段落中任一段所述的方法,其中,所述转基因序列内未发现所述限制性位点。
[0328]
35.如前述段落中任一段所述的方法,其中,所述切割位点被核酸酶切割。
[0329]
36.如前述段落中任一段所述的方法,其中,所述启动子选自于由以下所组成的组:组成型启动子、阻抑型启动子、遍在启动子、诱导型启动子、病毒启动子、组织特异性启动子和合成启动子。
[0330]
37.如前述段落中任一段所述的方法,其中,所述转基因为治疗性基因。
[0331]
38.一种制造含有转基因的环状核酸载体的方法,所述方法包括:
[0332]
a.用质粒模板转化宿主系统,其中,所述质粒模板包含:
[0333]
i.噬菌体复制起点(ori);
[0334]
ii.截短的噬菌体ori(例如,oriδ29);
[0335]
iii.至少一个末端重复(tr);以及
[0336]
iv.与转基因可操作地连接的启动子序列,
[0337]
其中,所述质粒模板以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火;
[0338]
b.将所述宿主系统孵育足以发生复制的时间,引起环状核酸产生;以及
[0339]
c.回收所产生的环状核酸,
[0340]
其中,所述环状核酸自退火。
[0341]
39.如前述段落中任一段所述的方法,所述方法进一步包含在所述ori侧翼的接头和自互补接头。
[0342]
40.如前述段落中任一段所述的方法,其中,所述转基因含有由接头序列隔开的所述有义序列及其反义互补物,所述接头序列将允许有义链和反义链结合为双链。
[0343]
41.如前述段落中任一段所述的方法,其中,所述截短的ori为oriδ29。
[0344]
42.一种通过段落1-41中任一段所述的方法制造的环状核酸载体。
[0345]
43.一种环状核酸载体,所述环状核酸载体包含:
[0346]
至少一个侧翼切割位点,以及:
[0347]
i.至少一个噬菌体复制起点(ori);
[0348]
ii.至少一个末端重复(tr);以及
[0349]
iii.与转基因可操作地连接的启动子序列。
[0350]
44.如前述段落中任一段所述的载体,其中,所述模板进一步包含第二侧翼切割位点,并且所述两个位点内为(i)-(iii)。
[0351]
45.如前述段落中任一段所述的载体,其中,所述载体进一步包含紧邻所述至少一个ori的下游的至少一个额外的切割位点(参见例如图5)。
[0352]
46.如前述段落中任一段所述的载体,其中,所述载体进一步包含至少一个衔接子序列。
[0353]
47.如前述段落中任一段所述的载体,其中,所述载体进一步包含至少两个衔接子
序列。
[0354]
48.如前述段落中任一段所述的载体,其中,所述衔接子序列诱导经切割的dna的闭合(参见例如图1-图5、图7和图9)。
[0355]
49.如前述段落中任一段所述的载体,其中,所述衔接子序列进一步包含切割位点。
[0356]
50.如前述段落中任一段所述的载体,其中,所述载体用于递送所述转基因。
[0357]
51.如前述段落中任一段所述的载体,其中,所述载体用于重组病毒载体的生产。
[0358]
52.如前述段落中任一段所述的载体,其中,所述载体是自退火的并且为双链的。
[0359]
53.如前述段落中任一段所述的载体,其中,所述载体为单链的。
[0360]
54.如前述段落中任一段所述的载体,其中,存在第二tr,并且所述与转基因可操作地连接的启动子序列的两侧以tr为侧翼。
[0361]
55.如前述段落中任一段所述的载体,其中,所述ori位于左tr的上游。
[0362]
56.如前述段落中任一段所述的载体,其中,所述ori以tr为侧翼,并且处于所述与转基因可操作地连接的启动子序列的上游。
[0363]
57.如前述段落中任一段所述的载体,其中,所述至少一个tr为突变的itr、合成的itr、野生型itr或非功能性itr。
[0364]
58.如前述段落中任一段所述的载体,其中,所述载体具有侧翼dd-itr,并且所述侧翼之间为与所述转基因的有义链可操作地连接的启动子、复制缺陷型itr和所述转基因的反义互补物。
[0365]
59.如前述段落中任一段所述的载体,其中,所述itr为aav itr。
[0366]
60.如前述段落中任一段所述的载体,其中,所述ori位于itr的上游,并且紧邻上游itr的下游。
[0367]
61.如前述段落中任一段所述的载体,其中,所述噬菌体ori选自于由以下所组成的组:m13来源的ori、f1来源的ori或fd来源的ori。
[0368]
62.如前述段落中任一段所述的载体,其中,所述模板进一步包含第二ori,所述第二ori是不启动复制的截短的ori。
[0369]
63.如前述段落中任一段所述的载体,其中,所述截短的ori为oriδ29。
[0370]
64.如前述段落中任一段所述的载体,其中,所述至少两个切割位点为限制性位点。
[0371]
65.如前述段落中任一段所述的载体,其中,所述至少两个限制性位点相同或不同。
[0372]
66.如前述段落中任一段所述的载体,其中,所述转基因序列内未发现所述限制性位点。
[0373]
67.如前述段落中任一段所述的载体,其中,所述切割位点被核酸酶切割。
[0374]
68.如前述段落中任一段所述的载体,其中,所述启动子选自于由以下所组成的组:组成型启动子、阻抑型启动子、遍在启动子、诱导型启动子、病毒启动子、组织特异性启动子和合成启动子。
[0375]
69.如前述段落中任一段所述的载体,其中,所述转基因为治疗性基因。
[0376]
70.一种环状核酸载体,所述环状核酸载体包含:
[0377]
i.噬菌体复制起点(ori);
[0378]
ii.截短的噬菌体ori(例如,oriδ29);
[0379]
iii.至少一个末端重复(tr);以及
[0380]
iv.与转基因可操作地连接的启动子序列,
[0381]
其中,所述载体以5'至3'的方向包含由发夹序列隔开的有义序列和反义序列,所述发夹序列允许有义链和反义链的退火。
[0382]
71.如前述段落中任一段所述的载体,所述载体进一步包含在所述ori侧翼的接头和自互补接头。
[0383]
72.如前述段落中任一段所述的载体,其中,所述转基因包含由接头序列隔开的所述有义序列及其反义互补物,所述接头序列将允许有义链和反义链结合为双链。
[0384]
73.如前述段落中任一段所述的载体,其中,所述截短的ori为oriδ29。
[0385]
74.如前述段落中任一段所述的载体,其中,所述核酸酶为端粒酶原。
[0386]
75.如前述段落中任一段所述的载体,其中,所述核酸酶为端粒酶原。
[0387]
实施例
[0388]
实施例1:制作生产环状核酸的模板
[0389]
本文举例说明了制备模板的方法,该模板可用于生成用于在受试者中表达人因子ix微基因(minigene)的载体。将质粒在37℃下用bamhi和hindiii限制性酶消化24小时,所述质粒从5'到3'具有bamhi限制性位点、f1 ori、pvuii限制性位点、itr-l、与因子ix的编码区可操作地连接的肝特异性启动子seq id no:247、itr-r和hindiii限制性位点。将消化物在电泳凝胶上运行以可视化和分离质粒片段。从凝胶中切下质粒片段并纯化。对具有bamhi限制性位点序列的衔接子序列和具有hindiii限制性位点序列的衔接子序列以相同方式另外进行消化和纯化。
[0390]
为了形成环状核酸模板,将衔接子序列退火至质粒片段的切口。纯化的质粒片段和衔接子序列在存在连接酶(例如t4连接酶)和atp的情况下在室温下联接至少1小时。联接反应在65℃下热灭活10分钟以使连接酶灭活。
[0391]
将环状核酸模板转化至大肠杆菌细胞中,并在37℃下振荡生长14-16小时以诱导环状核酸的复制。使用细菌裂解试剂以引起细胞裂解,从大肠杆菌细胞中释放编码因子ix转基因的环状核酸。释放后,使用标准方法(例如通过使用柱层析的纯化)回收因子ix环状核酸。该自退火的环状核酸可被回收并直接用于体内转基因递送,或用于病毒生产(参见实施例2)。
[0392]
用pvuii限制性酶在25℃下对回收的因子ix环状核酸进一步消化24小时,以剪切pvuii切割位点(参见例如图5)。剪切pvuii移除ori并在因子ix核酸构建体上形成开放末端。该末端开放的环状核酸可用于转基因的体内递送或用于重组病毒dna的生产。环状核酸无需用pvuii进行消化以用于重组病毒的生产或用于转基因的体内递送。
[0393]
实施例2:环状核酸持续存在于受体细胞中
[0394]
为了证明临床相关性,使用不同的载体(本发明的自退火的环状核酸,于实施例1中所产生)、相应的线性dna和相应的质粒dna,将含有由肝特异性启动子(seq id no:247)驱动的人因子ix微基因的表达盒递送至血友病b小鼠的肝脏。通过在注射后的不同时间(3周、4周、5周、6周、7周、8周、9周、10周和3个月、5个月、10个月、超过一年等)分析血清人因子
ix浓度来对小鼠的载体存在和因子ix的基因表达进行分析。
[0395]
与ss线性dna和质粒dna对照的受体相比,预计含有因子ix表达盒的环状核酸的受体随时间具有更高量的载体存在,并且具有更高浓度的因子ix。预计在环状核酸受体中,存在的载体量和人因子ix的浓度随时间而持续存在,而在对照的受体中则随时间降低。此外,随着时间,与对照的受体中因子ix的表达相比,预计受体小鼠中环状核酸中因子ix的表达以显著更高的水平和显著更长的时间段持续存在。这通过以下得以确定:在载体给予后不同时间,通过elisa分析对血清中的人因子ix进行定量、鉴别其出血倾向(bleeding diathesis)的校正、以及还通过southern印迹分析对经处理小鼠肝脏中的载体进行定量。此外,通过肝脏切片的原位杂交确定经处理小鼠中含有载体的肝细胞核的数量,以验证含有载体的肝细胞核的相对数量相似。
[0396]
所递送的dna在体内的分子结构
[0397]
预计载体在受体组织细胞中形成多联体(concatemer),所述多联体随着时间的推移而持续存在。多联体在染色体外持续存在,或整合到宿主细胞基因组中。为了证明这一点,通过southern印迹分析对受体小鼠肝组织关于载体dna的分子结构进行了分析。分离dna,然后用限制性核酸内切酶进行消化,该酶不在载体内剪切或者在表达盒内剪切一次。对经剪切的dna进行分析以确定dna整合到小鼠基因组中或保持在染色体外。用不能在载体dna内剪切的核酸内切酶消化的所有样品中产生的高分子量条带与dna载体整合到小鼠基因组中或体内多联体的快速形成相一致。通过用在整个表达盒中剪切一次的限制性核酸内切酶消化肝脏dna样品,来对这两种可能性进行区别。通过这种消化将高分子dna信号转化为dna梯状物将表明体内多联体化。
[0398]
大部分高分子量dna可能来源自多联体。然而,为了确定这是染色体外的还是整合到基因组中的,对小鼠注射本发明的环状核酸或整合因子ix转座子(yant等,nat.genet.25:35-41)进行2/3部分肝切除术。在转座子组中,由一个质粒表达的转座酶介导来自第二质粒的具有转座子itr侧翼的人因子ix表达盒的释放以及将所释放的转基因表达盒插入小鼠基因组。如果部分肝切除术的结果是一或两轮肝细胞分裂和染色体外dna的显著丢失,这将表明与注入整合质粒的小鼠(其转基因表达应不被肝细胞增殖的诱导而改变)相比,在同一时间段内,经载体dna处理的小鼠在部分肝切除术后将显示出基因表达的10倍下降。这些数据就表明本发明的转录活性环状核酸在肝脏中主要保持在染色体外。别的结果将表明活性环状核酸整合到肝细胞染色体中。
[0399]
方法
[0400]
动物研究。八至十周龄的雌性c57bl/6小鼠获取自taconic farms,inc.(germantown,ny)。所有动物程序均按照斯坦福大学和美国国立卫生研究院制定的指南进行。如先前所述,将处于2ml 0.85%盐水中的四十微克dna注射到小鼠尾静脉中(liu等,(1999)gene ther.6:1258-1266;zhang等,(1999)human gene therapy 10:1735-1737)。对于每次注射,dna的质量相同,而摩尔比可变化(例如,变化两倍)。在其它研究中,摩尔比的小的改变预计不会显著影响基因表达。小鼠通过眶后技术定期放血。在一些情况下,如先前所述(park等,nat.genet.24:49-52(2000))对小鼠进行外科2/3部分肝切除术。如先前所述(yant等,(2000)nat.genet.25:35-41),通过测量血液从2mm到3mm尾部剪断进行凝血所需的时间来确定小鼠的出血时间。
[0401]
原位杂交。在通过尾静脉输注接受40μg相应构建体dna后2至3周,对小鼠的石蜡包埋肝脏的5微米切片进行处理,以根据先前描述的方案进行原位杂交(miao等,(2000)j.virol.74:3793-3803)。在脱蜡、再水化、变性和用蛋白酶消化后,使用来自roche molecular biochemicals(indianapolis,in)的dig标记试剂盒,将切片与对标记有地高辛(digoxigenin)的载体具有特异性的变性dna探针进行孵育。杂交后,将切片与缀合有碱性磷酸酶的山羊抗地高辛抗体一起孵育,并通过氯化硝基四氮唑蓝-5-4-氯-3-吲哚磷酸盐(roche molecular biochemicals)对碱性磷酸酶结合的载体dna进行可视化。
[0402]
elisa定量。dna递送后,定期收集小鼠血液,并通过elisa对人因子ix(hfix)(walter等,(1996)pnas usa 93:3056-3061)进行定量。
[0403]
southern印迹分析。在dna注射后的一段时间处死小鼠,并通过盐析(salting-out)程序制备总肝脏dna。用限制性酶消化20微克的肝dna,通过凝胶电泳进行分离,并使用cdna作为探针通过southern印迹杂交进行分析。放射性dna条带通过phosphoimager分析进行定量。
[0404]
本发明的范围不受本文所公开的示例性实施方式限制,这些示例性实施方式旨在说明本发明的单个方面,并且功能上等效的任何克隆、dna或氨基酸序列都在本发明的范围内。实际上,除了本文中所示和描述的实施方式之外,本发明的各种修改将由前述的描述和附图而对本领域技术人员而言变得显而易见。此类修改旨在落入所附权利要求的范围内。
[0405]
实施例3:环状核酸具有增强的转导
[0406]
与表达核酸构建体的标准载体(例如慢病毒载体)相比,实施例1中生产的表达因子ix的自退火的环状核酸表现出增强的转导。通过尾静脉注射将各构建体注射到小鼠内。因子ix转基因的表达由肝特异性启动子驱动,因此预计表达仅局限于肝脏。注射后7天(dpi),处死小鼠,获得肝脏并通过蛋白质印迹对因子ix转基因的蛋白质表达进行探测。发现来自环状核酸的转基因表达相对于标准载体增强了70倍。所有结果在多个实验中使用通过多种方法(例如,密度超速离心、亲和色谱)纯化的独立载体制剂进行了证实,以确保测量的效果不是特定于批次或纯化方法。与表达类似核酸构建体的aav载体的转导相比,进一步发现表达因子ix的环状核酸的转导显著增强。用表达人酸性-α1,4-葡萄糖苷酶(gaa)的环状核酸重复这些实验,并且与标准载体相比,类似地观测到增强的转导。
[0407]
为了进一步确保检查了适当的时间点,进行了来自环状核酸和标准核酸载体的转基因表达的时间进程,在7、14、21和42dpi收集测量结果。表达动力学看起来相同,在7dpi观测到稳健的表达,在注射标准载体后的第7天和第42天之间增加了7.5倍,在注射环状核酸后的同一时间段内增加了12倍。在所有时间点,环状核酸均优于标准载体约两个数量级(第7天100倍,第14天176倍,第21天81倍,以及第42天159倍)。总之,这些数据表明本发明的环状核酸是增强转基因转导的高效载体。
[0408]
实施例4:使用环状核酸制造病毒载体
[0409]
实施例1中生产的末端开放的和末端闭合的ix因子核酸构建体用于在用于aav生产的稳定细胞系pro10细胞中制造病毒载体。这些用于aav生产的稳定pro10细胞(例如,如美国专利号9,441,206中所述)对于可规模生产aav载体是理想的。该细胞系通过转染与因子ix核酸构建体接触以表达环状核酸。因子ix核酸构建体的表达通过使用质粒特异性引物的基于pcr的测定来确认。
[0410]
转染。用因子ix核酸构建体转染稳定的pro10细胞,同时用编码rep2和血清型特异性cap2的包装质粒进行转染:或者,aav-rep/cap也作为通过本文所述方法制作的自退火环状核酸提供,和/或ad-辅助质粒(xx680:编码腺病毒辅助序列)也作为通过本文所述方法制作的自退火环状核酸提供。
[0411]
在转染当天,使用vicell xr活力分析仪(beckman coulter)对细胞进行计数并稀释用于转染。按以下顺序将以下试剂添加到锥形管中以混合转染混合剂:质粒dna、i(gibco)或optipro sfm(gibco)或其它无血清的相容的转染介质,以及随后的与质粒dna呈特定比例的转染试剂。在室温下孵育之前,将混合剂颠倒混合。将转染混合剂移液到烧瓶中并放回摇床/培养箱中。所有优化研究均在30ml培养体积下进行,然后在更大培养体积下进行验证。转染后48小时收获细胞。
[0412]
使用wave生物反应器系统生产raav。wave袋在转染前2天进行播种。wave袋播种后两天,进行细胞培养物计数,然后在所述转染前扩增/稀释该细胞培养物。然后,对wave生物反应器细胞培养物进行转染。在转染后至少48小时从wave生物反应器袋中收获细胞培养物。
[0413]
滴度:在dnase消化后,使用针对标准曲线(aav itr特异性)的qpcr和对因子ix核酸构建体具有特异性的引物计算aav滴度。
[0414]
从摇瓶和60wave生物反应器袋中收获悬浮细胞。转染后48小时,通过从摇瓶中倾倒或从wave生物反应器袋中泵送,将细胞培养物收集到500ml聚丙烯锥形管(corning)中。然后使用sorvall rc3c plus离心机和h6000a转子将细胞培养物以655
×
g离心10min。弃去上清液,将细胞重新悬浮在1
×
pbs中,转移到50ml锥形管中,并以655
×
g离心10mm。在该处,可以将沉淀储存在nlt-60℃中或继续进行纯化。
[0415]
使用qpcr从细胞裂解物中滴定raav。取出10ml细胞培养物并使用sorvall rc3c plus离心机和h6000a转子以655
×
g离心10min。从细胞沉淀中倾倒上清液。然后将细胞沉淀重新悬浮在5ml的dnase缓冲液(5mm cac12、5mm mgc12、50mm tris-hcl ph 8.0)中,然后进行超声以高效地裂解细胞。然后取出300ul并放入1.5ml微量离心管中。然后,将140单位的dnase i添加到每个样品中并在37℃下孵育1小时。为了确定dnase消化的效力,将4-5mg因子ix核酸构建体掺入添加和不添加dnase的未转染的细胞裂解物中。将50μl edta/sarkosyl溶液(6.3%sarkosyl,62.5mm edta ph 8.0)添加到各管中,并在70℃下孵育20分钟。然后,添加50μl蛋白酶k(10mg/ml)并在55℃下孵育至少2小时。将样品煮沸15分钟以使蛋白酶k失活。从每个样品中取出等分试样以通过qpcr进行分析。为了有效地确定每个细胞生成多少raav载体,进行两种qpcr反应。使用一组引物2s建立一种qpcr反应,所述引物2s设计为结合至质粒xx680、pxr2和因子ix核酸构建体的骨架上的同源序列。第二种qpcr反应使用结合并扩增因子ix微基因内的区域的一组引物建立。qpcr使用sybr green试剂和来自30roche的light cycler 480进行。样品在95℃变性10分钟,随后进行45个循环(90℃下10sec、62℃下10sec和72℃下10sec)以及熔解曲线(1个循环99℃下30秒,65℃持续1分钟)。
[0416]
从粗裂解物中纯化raav。将各细胞沉淀调整到10ml的最终体积。将沉淀短暂涡旋并以30%的产率以一秒开、一秒关的脉冲超声4分钟。超声后,添加550u dnase并在37℃下孵育45分钟。然后,使用sorvall rcsb离心机和hs-4转子以9400
×
g对沉淀进行离心以使细胞碎片沉淀,并将澄清的裂解物转移到type70ti离心管(beckman 361625)。关于收获和裂
解悬浮hek293细胞以分离raav,本领域技术人员可以使用机械方法(例如微射流)或化学方法(例如去污剂)等,然后使用深度过滤或切向流过滤(tff)进行澄清步骤。
[0417]
aav载体纯化。澄清的aav裂解物通过柱层析方法纯化,如本领域技术人员所知晓并在以下手稿中描述的(allay等、davidoff等、kaludov等、zolotukhin等、zolotukin等,等),以引用的方式将其整体并入本文。
[0418]
实施例5:多联体dna扩增
[0419]
将含有编码人因子ix基因的核酸、dd-itr和包含端粒酶原teln的结合序列的端粒末端的环状核酸用作dna模板。与包含模板端粒末端的回文序列的一半的部分互补的单个回文寡核苷酸用作特异性引物。引物结合至dna模板上的两个相同位点。
[0420]
环状核酸的变性和单引物的退火在退火/变性缓冲液中进行,所述退火/变性缓冲液含有例如30mm tris-hcl ph 7.5、20mm kcl、2.5mm mgcl2。通过加热至95℃1min并在此温度下保持1至10分钟来进行变性,然后仔细控制冷却曲线,所述冷却曲线对于特异性引物与模板的最大结合进行优化。然后,将温度降低到通过合适的dna聚合酶进行dna扩增的最优温度。一种此类合适的酶是从枯草芽孢杆菌(bacillus subtilis)噬菌体phi29分离的phi29,它在30℃下最优地工作。
[0421]
然后,将含有酶phi29和ppi(酵母无机焦磷酸酶)的合适体积的反应缓冲液添加到退火的dna/引物反应中。将反应混合物在约30℃下孵育5至20小时或更长时间。合适的反应缓冲液通常含有35mm tris-hcl、50mm kcl、2.5mm mgcl2、10mm(nh4)2so4、4mm dtt、1mm dntp。
[0422]
然后,将通过rca扩增的多联体dna与端粒酶原teln在30℃下在合适的缓冲液(例如10mm tris hcl ph 7.6、5mm cacl2、50mm谷氨酸钾、0.1mm edta、1mm dtt)中进行孵育,直至反应完成。所得闭合线性dna产物可根据待纯化的量通过例如凝胶电泳或合适的色谱法进行纯化。
[0423]
这些方法提供循环反应,其中产物与模板相同。通过执行额外的方法步骤的循环,该反应容易从非常少量的模板进行放大。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。