1.本发明涉及细胞结构体及其制造方法。本发明还涉及含有细菌的组织模型及其制造方法以及对细胞结构体和/或细菌的行为进行评价的方法。
背景技术:
2.作为人工地制作模拟生物体组织的结构体的方法,例如已知有一种制造三维组织体的方法(专利文献1),其包含三维地配置由含有胶原的被膜覆盖的细胞而形成三维组织体的工序;一种立体性细胞组织的制造方法(专利文献2),其包含将细胞与阳离子性物质和细胞外基质成分混合而得到混合物,从得到的混合物收集细胞,在基材上形成细胞集合体的工序;等。另外,本发明者们还提出了下述方法(专利文献3):通过使细胞与经片段化的外源性胶原接触,从而以较少的细胞数制造厚度为1mm以上的尺寸大的三维组织体的方法。这些三维组织体期待作为实验动物的替代品、移植材料等的用途。
3.现有技术文献
4.专利文献
5.专利文献1:国际公开第2015/072164号
6.专利文献2:国际公开第2017/146124号
7.专利文献3:国际公开第2018/143286号
技术实现要素:
8.发明所要解决的课题
9.本发明的目的在于提供一种更接近生物体组织的细胞结构体及其制造方法。
10.用于解决课题的手段
11.即,本发明涉及例如以下的各发明。
12.[1]一种细胞结构体,其具备结缔组织结构体和配置于该结缔组织结构体上的上皮结构体,其中,结缔组织结构体包含经片段化的细胞外基质成分和包含间充质细胞的第一细胞,经片段化的细胞外基质成分的至少一部分配置于第一细胞间,上皮结构体包含上皮细胞。
[0013]
[2]根据[1]所述的细胞结构体,其中,间充质细胞包含成纤维细胞。
[0014]
[3]根据[1]或[2]所述的细胞结构体,其中,经片段化的细胞外基质成分包含经片段化的胶原成分。
[0015]
[4]根据[1]~[3]中任一项所述的细胞结构体,其中,第一细胞还包含血管内皮细胞,结缔组织结构体在细胞间具有血管网。
[0016]
[5]根据[4]所述的细胞结构体,其中,结缔组织结构体在间充质细胞间具有血管网。
[0017]
[6]一种含有细菌的组织模型,其具备[1]~[5]中任一项所述的细胞结构体、和配置在细胞结构体的内部或以与细胞结构体的上皮结构体接触的方式配置的细菌。
[0018]
[7]根据[6]所述的含有细菌的组织模型,其中,细菌为牙周病菌。
[0019]
[8]一种细胞结构体的制造方法,其具备:
[0020]
第一工序,通过进行使经片段化的细胞外基质成分与包含间充质细胞的第一细胞接触的工序、以及培养第一细胞的工序,形成结缔组织结构体;和
[0021]
第二工序,通过进行使包含上皮细胞的第二细胞与结缔组织结构体接触的工序、以及培养结缔组织结构体和第二细胞的工序,在结缔组织结构体上形成上皮结构体,得到细胞结构体。
[0022]
[9]根据[8]所述的细胞结构体的制造方法,其中,第一细胞包含血管内皮细胞。
[0023]
[10]根据[8]或[9]所述的细胞结构体的制造方法,其中,与第一细胞接触时的经片段化的细胞外基质成分的量相对于1.0
×
106cells的细胞为0.1~100mg。
[0024]
[11]一种含有细菌的组织模型的制造方法,其具备使细菌与通过[8]~[10]中任一项所述的制造方法得到的细胞结构体的上皮结构体接触的工序。
[0025]
[12]根据[11]所述的含有细菌的组织模型的制造方法,其中,在使细菌接触的工序之后,具备培养细胞结构体和细菌、使细菌移动到细胞结构体的内部的工序。
[0026]
[13]一种对细胞结构体和/或细菌的行为进行评价的方法,其包含在使细菌与[1]~[5]中任一项所述的细胞结构体的上皮结构体接触后、对细胞结构体和/或细菌的行为进行评价的工序。
[0027]
发明效果
[0028]
根据本发明,能够提供更接近生物体组织的细胞结构体及其制造方法。
附图说明
[0029]
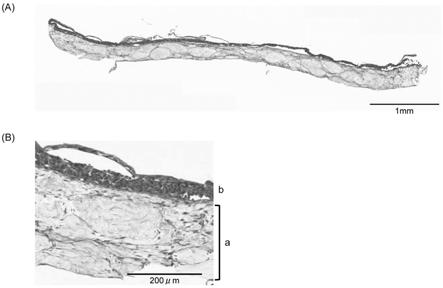
图1是表示苏木精-伊红(he)染色后的细胞结构体的显微镜观察结果的照片。
[0030]
图2是表示细胞结构体中的结缔组织中的血管网的形成的照片。
[0031]
图3是表示牙周病菌的植入及浸润的确认结果(image analysis,图像分析)的照片。
[0032]
图4是表示牙龈卟啉单胞菌(p.gingivalis)对具有血管网的细胞结构体的植入及浸润的确认结果的照片。
[0033]
图5是表示与血管网一起局部存在的牙龈卟啉单胞菌的定量评价结果的图表。
[0034]
图6是表示浸润到牙龈组织模型内部的牙龈卟啉单胞菌的数量的定量评价结果的图表。
[0035]
图7是表示牙龈卟啉单胞菌感染后的il-6分泌量的评价结果的图表。
[0036]
图8是表示牙龈卟啉单胞菌透过上皮结构体的行为的评价方法的图。
[0037]
图9是表示牙龈卟啉单胞菌透过上皮结构体的行为的评价结果的图表。
具体实施方式
[0038]
以下,对用于实施本发明的方式详细地进行说明。但是,本发明并不限定于以下的实施方式。
[0039]
《细胞结构体》
[0040]
本实施方式的细胞结构体具备结缔组织结构体和配置在该结缔组织结构体上的
上皮结构体。在本实施方式的细胞结构体中,结缔组织结构体包含经片段化的细胞外基质成分和包含间充质细胞的第一细胞,经片段化的细胞外基质成分的至少一部分配置于第一细胞间。在本实施方式的细胞结构体中,上皮结构体包含上皮细胞。
[0041]
细胞结构体例如可以用作生物体组织模型。作为生物体组织模型的具体例,例如可举出牙龈模型、口腔粘膜模型、皮肤模型、角膜模型等。
[0042]
在本说明书中,“细胞结构体”是指细胞经由细胞外基质成分三维地配置的细胞的集合体,是指通过细胞培养而人工制作的集合体。对细胞结构体的形状没有特别限制,例如可举出片状、球体状、椭圆体状、长方体状等。在此,生物体组织包含汗腺、淋巴管、脂腺等,构成比细胞构造体更复杂。因此,能够容易地区分细胞结构体和生物体组织。
[0043]
(细胞)
[0044]
在本说明书中,“细胞”没有特别限定,例如可以是人、猴、狗、猫、兔、猪、牛、小鼠、大鼠等哺乳类动物来源的细胞。细胞的来源部位也没有特别限定,可以是骨、肌肉、内脏、神经、脑、骨、皮肤、血液等来源的体细胞,也可以是生殖细胞。此外,细胞可以是干细胞,另外也可以是原代培养细胞、传代培养细胞及细胞株细胞等培养细胞。
[0045]
在本说明书中,“干细胞”是指具有自我复制能力及多分化能力的细胞。干细胞中包括具有分化为任意的细胞种的能力的多能性干细胞、和具有分化为特定的细胞种的能力的组织干细胞(也称为体性干细胞)。作为多能性干细胞,例如可举出胚胎干细胞(es细胞)、体细胞来源es细胞(ntes细胞)及人工多能性干细胞(ips细胞)。作为组织干细胞,例如可举出间充质干细胞(例如脂肪干细胞、骨髓来源干细胞)、造血干细胞及神经干细胞。作为脂肪干细胞,例如可举出人脂肪干细胞(adsc)。
[0046]
细胞结构体在胰蛋白酶的浓度为0.25%、温度为37℃、ph为7.4、反应时间为15分钟的条件下进行胰蛋白酶处理后的残存率可以为70%以上,可以为80%以上,也可以为90%以上。这样的细胞结构体在培养中或培养后不易发生由酶引起的分解,是稳定的。上述残存率例如可以根据胰蛋白酶处理前后的细胞结构体的质量来计算。
[0047]
上述细胞结构体在胶原酶的浓度为0.25%、温度为37℃、ph为7.4、反应时间为15分钟的条件下进行胶原酶处理后的残存率可以为70%以上,可以为80%以上,也可以为90%以上。这样的细胞结构体在培养中或培养后不易发生由酶引起的分解,是稳定的。
[0048]
上述细胞结构体的厚度优选为10μm以上,更优选为100μm以上,进一步优选为1000μm以上。这样的细胞结构体是更接近生物体组织的结构,适合作为实验动物的替代品和移植材料。细胞结构体的厚度的上限没有特别限制,例如可以为10mm以下,可以为3mm以下,可以为2mm以下,可以为1.5mm以下,也可以为1mm以下。
[0049]
在此,“细胞结构体的厚度”在细胞结构体为片状或长方体状的情况下,是指与主面垂直的方向上的两端的距离。在上述主面存在凹凸的情况下,厚度是指上述主面的最薄部分处的距离。
[0050]
在细胞结构体为球体状的情况下,厚度是指其直径。在细胞结构体为椭圆体状的情况下,厚度是指其短径。在细胞结构体为大致球体状或大致椭圆体状且表面存在凹凸的情况下,厚度是指从细胞结构体的重心通过的直线与上述表面交叉的2点间的距离中最短的距离。
[0051]
[结缔组织结构体]
[0052]
结缔组织结构体包含经片段化的细胞外基质成分和第一细胞。经片段化的细胞外基质成分的至少一部分配置于第一细胞间。在细胞结构体中,通过使用经片段化的细胞外基质成分,能够形成更高密度的包含细胞外基质分子的结缔组织结构体,容易形成更厚的结缔组织结构体。
[0053]
(经片段化的细胞外基质成分)
[0054]
在本说明书中,“细胞外基质成分”是指由多个细胞外基质分子形成的细胞外基质分子的集合体。细胞外基质是指生物中存在于细胞外的物质。作为细胞外基质,只要不对细胞的生长及细胞集合体的形成产生不良影响,就可以使用任意的物质。作为具体例,可举出胶原、弹性蛋白、蛋白聚糖、纤连蛋白、透明质酸、层粘连蛋白、波连蛋白、细胞粘合素、巢蛋白和原纤蛋白等,但并不限定于这些。细胞外基质成分可以单独使用它们中的1种,也可以组合使用。细胞外基质成分例如可以包含胶原成分,也可以是胶原成分。本实施方式中的细胞外基质成分优选为存在于动物细胞外的物质、即动物的细胞外基质成分。需要说明的是,只要不对细胞的生长及细胞集合体的形成产生不良影响,细胞外基质分子可以是上述的细胞外基质分子的修饰体及突变体,也可以是化学合成肽等多肽。
[0055]“片段化”是指使细胞外基质成分的集合体成为更小的尺寸。经片段化的细胞外基质成分可以包含经解纤的细胞外基质成分。经解纤的细胞外基质成分是通过物理性的力的施加而对上述的细胞外基质成分进行解纤而得到的成分。例如,解纤是在不切断细胞外基质分子内的键的条件下进行的。
[0056]
经片段化的细胞外基质成分的形状可以设为任意的形状。作为具体例,可举出纤维状、纺锤状、不定形、球状、粒状、粉状、扁平状及片状,但并不限定于这些。优选为与生物内的细胞外基质成分的形状相同或类似的形状。例如,当细胞外基质成分为胶原时,优选为纤维状。
[0057]
将胶原成分等细胞外基质成分片段化的方法没有特别限制,可以通过施加物理性的力来进行片段化。将细胞外基质成分片段化的方法例如可以是将块状的细胞外基质成分细细切碎的方法。细胞外基质成分可以直接片段化。即,细胞外基质成分可以在固相中被片段化。另外,细胞外基质成分也可以在水性介质中被片段化。通过施加物理性的力进行的细胞外基质成分的片段化例如可以使用超声波式均化器、搅拌式均化器、及高压式均化器等来进行。在使用搅拌式均化器的情况下,可以将细胞外基质成分直接均化,也可以在生理盐水等水性介质中均化。另外,通过调整进行均化的时间、次数等,也可以得到毫米尺寸、纳米尺寸的经片段化的细胞外基质成分。
[0058]
经片段化的细胞外基质成分的尺寸例如可以通过利用电子显微镜对各个经片段化的细胞外基质成分进行分析而求出。纤维状的经片段化的细胞外基质成分的尺寸可以为长度方向的长度,对于除纤维状以外的形状的经片段化的细胞外基质成分,可以为将经片段化的细胞外基质成分的一端与另一端连接的直线的最大长度。
[0059]
经片段化的细胞外基质成分的平均尺寸可以为100nm以上且400μm以下,也可以为100nm以上且200μm以下。在一个实施方式中,从容易形成厚的组织的观点出发,经片段化的细胞外基质成分的平均尺寸可以为5μm以上且400μm以下,可以为10μm以上且400μm以下,也可以为100μm以上且400μm以下。在另一实施方式中,经片段化的细胞外基质成分的平均尺寸可以为100μm以下,可以为50μm以下,可以为30μm以下,可以为15μm以下,可以为10μm以
下,也可以为1μm以下,且可以为100nm以上。优选经片段化的细胞外基质成分整体中大部分的经片段化的细胞外基质成分的平均尺寸在上述数值范围内。具体而言,优选经片段化的细胞外基质成分整体中50%以上的经片段化的细胞外基质成分的平均尺寸在上述数值范围内,更优选95%的经片段化的细胞外基质成分的平均尺寸在上述数值范围内。经片段化的细胞外基质成分优选为平均尺寸在上述范围内的经片段化的胶原成分。
[0060]
经片段化的细胞外基质成分的平均长度可以为100nm以上且400μm以下,也可以为100nm以上且200μm以下。在一个实施方式中,从容易形成厚的组织的观点出发,经片段化的细胞外基质成分的平均长度可以为5μm以上且400μm以下,可以为10μm以上且400μm以下,也可以为100μm以上且400μm以下。在另一实施方式中,经片段化的细胞外基质成分的平均长度可以为100μm以下,可以为50μm以下,可以为30μm以下,可以为15μm以下,可以为10μm以下,也可以为1μm以下,且可以为100nm以上。优选经片段化的细胞外基质成分整体中大部分的经片段化的细胞外基质成分的平均长度在上述数值范围内。具体而言,优选经片段化的细胞外基质成分整体中50%以上的经片段化的细胞外基质成分的平均长度在上述数值范围内,更优选95%的经片段化的细胞外基质成分的平均长度在上述数值范围内。经片段化的细胞外基质成分优选为平均长度在上述范围内的经片段化的胶原成分。
[0061]
经片段化的细胞外基质成分的平均直径可以为50nm~30μm、可以为4μm~30μm、也可以为5μm~30μm。经片段化的细胞外基质成分优选为平均直径在上述范围内的经片段化的胶原成分。
[0062]
经片段化的细胞外基质成分的平均长度及平均直径可通过利用光学显微镜等对各个片段化的细胞外基质成分进行测定并进行图像分析而求出。在本说明书中,“平均长度”是指所测定的试样的长度方向的长度的平均值,“平均直径”是指与所测定的试样的长度方向正交的方向的长度的平均值。
[0063]
在细胞外基质成分为胶原成分的情况下,经片段化的细胞外基质成分也被称为“片段化胶原成分”。“片段化胶原成分”是指将纤维性胶原成分等胶原成分片段化而得到的物质,其维持三重螺旋结构。片段化胶原成分的平均长度优选为100nm~200μm,更优选为22μm~200μm,更进一步优选为100μm~200μm。片段化胶原成分的平均直径优选为50nm~30μm,更优选为4μm~30μm,更进一步优选为20μm~30μm。
[0064]
经片段化的细胞外基质成分的至少一部分可以在分子间或分子内交联。细胞外基质成分可以在构成细胞外基质成分的细胞外基质分子的分子内或分子间交联。
[0065]
作为进行交联的方法,例如可举出通过施加热、紫外线、放射线等进行的物理交联,通过交联剂、酶反应等进行的化学交联等方法,其方法没有特别限定。从不妨碍细胞生长的观点出发,优选物理交联。交联(物理交联和化学交联)可以是经由共价键的交联。
[0066]
在细胞外基质成分包含胶原成分的情况下,交联可以在胶原分子(三重螺旋结构)之间形成,也可以在由胶原分子形成的胶原细纤维之间形成。交联可以是通过热进行的交联(热交联)。热交联例如可以通过使用真空泵在减压下进行加热处理来实施。在进行胶原成分的热交联的情况下,细胞外基质成分可以通过胶原分子的氨基与同一或其他胶原分子的羧基形成肽键(-nh-co)而交联。
[0067]
通过使用交联剂也可以使细胞外基质成分交联。交联剂例如可以为能够使羧基与氨基交联的交联剂、或者能够使氨基彼此交联的交联剂。作为交联剂,例如从经济性、安全
性及操作性的观点出发,优选醛类、碳二亚胺类、环氧化物类和咪唑类交联剂,具体而言,可举出戊二醛、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐、1-环己基-3-(2-吗啉基-4-乙基)碳二亚胺磺酸盐等水溶性碳二亚胺。
[0068]
交联度的定量可以根据细胞外基质成分的种类、进行交联的手段等来适当选择。交联度可以为1%以上、2%以上、4%以上、8%以上、或12%以上,且可以为30%以下、20%以下、或15%以下。通过使交联度在上述范围内,细胞外基质分子能够适度地分散,并且干燥保存后的再分散性良好。
[0069]
在细胞外基质成分中的氨基用于交联的情况下,交联度可以基于acta biomaterialia,2015,vol.25,pp.131-142等中记载的tnbs(2,4,6-三硝基苯磺酸)法进行定量。基于tnbs法的交联度也可以在上述的范围内。基于tnbs法的交联度是细胞外基质所具有的氨基中用于交联的氨基的比例。在细胞外基质成分包含胶原成分的情况下,优选通过tnbs法测定的交联度在上述范围内。
[0070]
交联度也可以通过对羧基进行定量来计算。例如,在为水不溶性的细胞外基质成分的情况下,可以通过tbo(甲苯胺蓝o)法进行定量。基于tbo法的交联度可以在上述的范围内。
[0071]
细胞结构体中的细胞外基质成分含有率以结缔组织结构体的干燥重量为基准计,可以为0.01~90质量%、优选为10~90质量%、优选为10~80质量%、优选为10~70质量%、更优选为10~60质量%、优选为1~50质量%、优选为10~50质量%、更优选为10~30质量%、更优选为20~30质量%。
[0072]
在此,“细胞结构体中的细胞外基质成分”是指构成细胞结构体的细胞外基质成分,可以来自内源性细胞外基质成分,也可以来自外源性细胞外基质成分。
[0073]“内源性的细胞外基质成分”是指由细胞外基质产生细胞产生的细胞外基质成分。作为细胞外基质产生细胞,例如可举出上述的成纤维细胞、软骨细胞、成骨细胞等间充质细胞。内源性细胞外基质成分可以为纤维性,也可以为非纤维性。
[0074]“外源性的细胞外基质成分”是指从外部供给的细胞外基质成分。本实施方式的细胞结构体包含属于外源性的细胞外基质成分的经片段化的细胞外基质成分。外源性的细胞外基质成分的作为来源的动物种可以与内源性的细胞外基质成分相同也可以不同。作为来源的动物种,例如可举出人、猪、牛等。另外,外源性的细胞外基质成分也可以是人工的细胞外基质成分。
[0075]
在细胞外基质成分为胶原成分的情况下,外源性的细胞外基质成分也被称为“外源性胶原成分”,是指从外部供给的胶原成分。“外源性胶原成分”是由多个胶原分子形成的胶原分子的集合体,具体而言,可举出纤维性胶原、非纤维性胶原等。外源性胶原成分优选为纤维性胶原。上述纤维性胶原是指作为胶原纤维的主成分的胶原成分,例如可举出i型胶原、ii型胶原、iii型胶原。上述纤维性胶原可以使用市售的胶原,作为其具体例,可举出nippon ham株式会社制的猪皮来源i型胶原。作为外源性的非纤维性胶原,例如可举出iv型胶原。
[0076]
在外源性的细胞外基质成分中,所来源的动物种可以与细胞不同。另外,在细胞包含细胞外基质产生细胞的情况下,在外源性的细胞外基质成分中,所来源的动物种可以与细胞外基质产生细胞不同。即,外源性的细胞外基质成分可以是异种细胞外基质成分。
[0077]
即,在细胞结构体包含内源性细胞外基质成分及经片段化的细胞外基质成分的情况下,构成上述细胞结构体的细胞外基质成分含有率是指内源性细胞外基质成分及经片段化的细胞外基质成分的合计量。上述细胞外基质含有率可以根据得到的细胞结构体的体积和脱细胞化后的细胞结构体的质量来计算。
[0078]
例如,在细胞结构体所包含的细胞外基质成分为胶原成分的情况下,作为对细胞结构体中的胶原成分进行定量的方法,例如可举出以下那样的对羟基脯氨酸进行定量的方法。在溶解有细胞结构体的溶解液中混合盐酸(hcl),在高温下孵育规定的时间后恢复至室温,将离心分离后的上清液稀释至规定的浓度,由此制备样品。将羟基脯氨酸标准溶液与样品同样地进行处理后,阶段性地稀释而制备标准溶液。对样品和标准溶液分别用羟基脯氨酸分析缓冲液和检测试剂进行规定的处理,测定570nm的吸光度。通过将样品的吸光度与标准溶液比较来计算胶原成分量。另外,也可以将细胞结构体直接悬浮在高浓度的盐酸中,将溶解后的溶解液离心分离而回收上清液,用于胶原成分定量。另外,待溶解的细胞结构体可以为从培养液中直接回收的状态,也可以在回收后进行干燥处理,在除去液体成分的状态下使其溶解。但是,在将从培养液中直接回收的状态的细胞结构体溶解而进行胶原成分定量的情况下,因为预测由于细胞结构体所吸收的培养基成分和实验手法的问题所引起的培养基的残留的影响,细胞结构体重量的测量值会产生偏差,因此从稳定地测量组织体的重量和胶原成分在每单位重量中所占的量的观点出发,优选以干燥后的重量为基准。
[0079]
作为对胶原成分量进行定量的方法,更具体而言,例如可举出如下的方法。
[0080]
(样品的制备)
[0081]
将进行了冷冻干燥处理的细胞结构体的总量与6mol/l hcl混合,用加热块在95℃下孵育20小时以上后,恢复至室温。用13000g离心分离10分钟后,回收样品溶液的上清液。在后述的测定中,以结果收束在标准曲线的范围内的方式用6mol/l hcl进行适当稀释后,用100μl的超纯水稀释200μl,由此制备样品。样品使用35μl。
[0082]
(标准溶液的制备)
[0083]
在螺口试管中加入125μl的标准溶液(1200μg/ml的乙酸溶液)和125μl的12mol/l hcl进行混合,用加热块在95℃下孵育20小时后,恢复至室温。用13000g离心分离10分钟后,用超纯水稀释上清液,制作300μg/ml的s1,将s1阶段性地稀释,制作s2(200μg/ml)、s3(100μg/ml)、s4(50μg/ml)、s5(25μg/ml)、s6(12.5μg/ml)、s7(6.25μg/ml)。也准备仅有90μl 4mol/hcl的s8(0μg/ml)。
[0084]
(分析)
[0085]
将35μl的标准溶液和样品分别加入到平板(quickzyme total collagen assay试剂盒附带、quickzyme biosciences公司)中。将75μl的分析缓冲区(上述试剂盒附带)加入到各孔中。用密封件封闭平板,在摇动20分钟的同时在室温下孵育。将密封件剥离,将75μl的检测试剂(试剂a:b=30μl:45μl,上述试剂盒附带)加入到各孔中。用密封件封闭平板,通过摇动将溶液混合,在60℃下孵育60分钟。在冰上充分冷却,将密封件剥离,测定570nm的吸光度。通过将样品的吸光度与标准溶液比较来计算胶原成分量。
[0086]
细胞结构体中所占的胶原成分可以通过其面积比或体积比来确定。“通过面积比或体积比确定”是指,例如在使细胞结构体中的胶原成分处于能够通过已知的染色方法(例如使用了抗胶原抗体的免疫染色或马松三色染色)等与其他组织构成物区别的状态下,使
用肉眼观察、各种显微镜和图像分析软件等,计算胶原成分的存在区域在细胞结构体整体中所占的比率。在通过面积比确定的情况下,并不限定通过细胞结构体中的怎样的截面或表面来确定面积比,例如在细胞结构体为球状体等的情况下,可以由从其大致中心部通过的截面图来确定。
[0087]
例如,在通过面积比确定细胞结构体中的胶原成分的情况下,其面积的比例以上述细胞结构体整体的面积为基准计,为0.01~99%,优选为1~99%,优选为5~90%,优选为7~90%,优选为20~90%,更优选为50~90%。“细胞结构体中的胶原成分”如上所述。构成细胞结构体的胶原成分的面积的比例是指将内源性胶原成分和外源性胶原成分合起来的面积的比例。胶原成分的面积的比例例如可以将所得到的细胞结构体用马松三色染色,以蓝色染色的胶原成分的面积与从细胞结构体的大致中心部通过的截面的整体面积的比例来计算。
[0088]
(第一细胞)
[0089]
第一细胞是在本实施方式的细胞结构体中构成结缔组织结构体的细胞。第一细胞至少包含间充质细胞。作为间充质细胞,可举出成纤维细胞、骨细胞、软骨细胞、成骨细胞、肌肉细胞、肌腱细胞、脂肪细胞、毛乳头细胞、牙髓细胞等结缔组织的细胞、以及具有分化为上述细胞的能力的细胞等。从内源性的细胞外基质成分分泌、结缔组织结构体的结合力进一步增强的观点出发,间充质细胞优选包含成纤维细胞。
[0090]
间充质细胞的含有率相对于结缔组织结构体中的总细胞数例如可以为5%以上、10%以上、15%以上、20%以上、25%以上或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0091]
本实施方式的细胞结构体通过具备包含经片段化的细胞外基质成分和间充质细胞的结缔组织结构体,例如能够表现出细胞间的高粘附性。作为其结果,本实施方式的细胞结构体可以是更接近生物体组织的结构体。
[0092]
第一细胞还可以包含除间充质细胞以外的其他细胞。作为该其他细胞,可举出血管内皮细胞、大肠癌细胞(例如人大肠癌细胞(ht29))、肝癌细胞等癌细胞、心肌细胞、淋巴管内皮细胞、神经细胞、树突状细胞、肝细胞、黏附性细胞(例如免疫细胞)、平滑肌细胞(例如大动脉平滑肌细胞(aorta-smc))、胰岛细胞、角化细胞(例如人表皮角化细胞)等。从能够形成更接近生物体组织的细胞结构体的观点出发,第一细胞可以包含血管内皮细胞。
[0093]
在本说明书中,“血管内皮细胞”是指构成血管内腔表面的扁平状的细胞。作为血管内皮细胞,例如可举出人脐带静脉来源的血管内皮细胞(huvec)。
[0094]
血管内皮细胞的含有率相对于结缔组织结构体中的总细胞数,例如可以为5%以上、10%以上、15%以上、20%以上、25%以上或30%以上,且可以为95%以下、90%以下、80%以下或75%以下。
[0095]
(细胞间的血管网)
[0096]
在第一细胞包含血管内皮细胞的情况下,结缔组织结构体可以在细胞间具有血管网。结缔组织结构体优选在间充质细胞间具有血管网。“在细胞间具有血管网”是指与生物体组织同样地具有分支的血管按照包围细胞的方式在细胞与细胞之间延伸的结构。
[0097]
本实施方式的细胞结构体能够如生物体组织那样在细胞间形成血管网,因此期待即使是具有厚度的细胞结构体也能够长期维持。另外,能够具有血管网的细胞结构体也期
待在移植到哺乳类等时变得容易植入。
[0098]
关于是否形成有与生物体组织同样的血管网,例如可以基于生物体组织中的血管的分支数和/或血管的分支间的长度和/或血管的直径的多样性来判断。例如,在细胞结构体中的血管的分支数相对于生物体组织中的血管的分支数的平均值为80%以上且150%以下、85%以上且130%以下、或90%以上且120%以下的情况下,可以判断为与生物体组织中的血管的分支数类似。
[0099]
例如,在结缔组织结构体中的血管的分支数的平均值为2.5以上且4.5以下、或3.0以上且4.2以下的情况下,可以判断为与生物体组织中的血管的分支数类似。例如,在结缔组织结构体中的血管的分支间的长度的平均值相对于生物体组织中的血管的分支间的长度的平均值为80%以上且150%以下、85%以上且130%以下、或90%以上且120%以下的情况下,可以判断为与生物体组织中的血管的分支间的长度类似。在生物体组织中,观察到粗的血管以及细的血管这两者。因此,例如在与生物体组织同样地观察到直径粗的血管(例如10μm以上且小于25μm)和细的血管(例如超过0μm且小于10μm)这两者的情况下,可以判断为具有与生物体组织中的血管的直径同样的多样性。另外,例如在血管直径整体的60%以上、70%以上或80%以上分布在超过0μm且小于25μm的情况下,可以判断为具有与生物体组织中的血管的直径同样的多样性。
[0100]
[上皮结构体]
[0101]
上皮结构体包含第二细胞。第二细胞是在本实施方式的细胞结构体中构成上皮结构体的细胞。第二细胞至少包含上皮细胞。作为上皮细胞,例如可举出人牙龈上皮细胞。上皮细胞例如可以是人牙龈上皮细胞转化而成的永生化上皮细胞。
[0102]
第二细胞可以进一步包含除上皮细胞以外的其他细胞。作为该其他细胞,可举出血管内皮细胞、脂肪细胞、大肠癌细胞(例如人大肠癌细胞(ht29))、肝癌细胞等癌细胞、心肌细胞、淋巴管内皮细胞、神经细胞、树突状细胞、肝细胞、黏附性细胞(例如免疫细胞)、平滑肌细胞(例如大动脉平滑肌细胞(aorta-smc))、胰岛细胞、角化细胞(例如人表皮角化细胞)等。
[0103]
上皮细胞的含有率相对于上皮结构体中的总细胞数,例如可以为5%以上、10%以上、15%以上、20%以上、25%以上或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0104]
《细胞结构体的制造方法》
[0105]
本实施方式的细胞结构体的制造方法具备:第一工序,通过进行使经片段化的细胞外基质成分与包含间充质细胞的第一细胞接触的工序、以及培养第一细胞的工序,形成结缔组织结构体;和第二工序,通过进行使包含上皮细胞的第二细胞与结缔组织结构体接触的工序、以及培养结缔组织结构体和第二细胞的工序,在结缔组织结构体上形成上皮结构体,得到细胞结构体。
[0106]
[第一工序]
[0107]
在第一工序中,通过依次进行使经片段化的细胞外基质成分与包含间充质细胞的第一细胞接触的工序(第一接触工序)、以及培养第一细胞的工序(第一培养工序),形成结缔组织结构体。
[0108]
结缔组织结构体包含经片段化的细胞外基质成分和第一细胞。经片段化的细胞外
基质成分和第一细胞可以如上所述。
[0109]
经片段化的细胞外基质成分通过分散在水性介质中,在水性介质中可变得容易与细胞接触而促进结缔组织结构体的形成。
[0110]
(第一接触工序)
[0111]
经片段化的细胞外基质成分与第一细胞可以在水性介质中接触。作为使经片段化的细胞外基质成分与第一细胞接触的方法,可举出将含有经片段化的细胞外基质成分的水性介质与含有第一细胞的水性介质混合的方法、在含有经片段化的细胞外基质成分的水性介质中添加第一细胞的方法、在含有第一细胞的培养液中加入含有经片段化的细胞外基质成分的水性介质的方法、在含有经片段化的细胞外基质成分的水性介质中加入第一细胞的方法、在预先准备的水性介质中分别加入经片段化的细胞外基质成分及第一细胞的方法等方法,但不限于这些。
[0112]
水性介质例如可以是液态的培养基。培养基没有特别限制,可以根据所要培养的细胞的种类选择合适的培养基。作为培养基,例如可举出eagle’s mem培养基、dmem、modified eagle培养基(mem)、minimum essential培养基、rpmi、及glutamax培养基等。培养基可以是添加有血清的培养基,也可以是无血清培养基。培养基可以是混合了两种培养基的混合培养基。
[0113]
经片段化的细胞外基质成分与第一细胞的接触可以在水性介质中形成第一细胞的层之后进行。即,第一接触工序可以通过在水性介质中形成第一细胞的层之后、使经片段化的细胞外基质成分接触来进行。通过在与细胞外基质成分接触之前形成第一细胞的层,能够制作下层部的细胞密度高的结缔组织结构体。
[0114]
经片段化的细胞外基质成分可以通过上述方法得到。经片段化的细胞外基质成分可以通过将细胞外基质成分在水性介质中片段化来得到。即,本实施方式的制造方法可以具备在第一工序之前将细胞外基质成分在水性介质中片段化的工序(片段化工序)。水性介质可以与上述含有片段化的细胞外基质成分的水性介质相同。
[0115]
经片段化的细胞外基质成分可以是上述例示的成分,也可以包含经片段化的胶原成分。
[0116]
本实施方式的制造方法可以具备在片段化工序之前对细胞外基质成分进行加热而使细胞外基质成分的至少一部分交联的工序,也可以具备在片段化工序之后且接触工序之前对细胞外基质成分进行加热而使细胞外基质成分的至少一部分交联的工序。
[0117]
在进行交联的工序中,加热细胞外基质成分时的温度(加热温度)和时间(加热时间)可以适当确定。加热温度例如可以为100℃以上,且可以为200℃以下,也可以为220℃以下。加热温度具体而言可以为例如100℃、110℃、120℃、130℃、140℃、150℃、160℃、170℃、180℃、190℃、200℃、220℃等。加热时间(在上述加热温度下进行保持的时间)可以根据加热温度适当设定。例如在100℃~200℃下进行加热的情况下,加热时间可以为6小时以上且72小时以下,更优选为24小时以上且48小时以下。在进行交联的工序中,可以在不存在溶剂的条件下进行加热,另外也可以在减压条件下进行加热。
[0118]
本实施方式的制造方法可以具备在片段化工序之后将经片段化的细胞外基质成分干燥的干燥工序。
[0119]
在干燥工序中,将经片段化的细胞外基质成分干燥。干燥例如可以通过冷冻干燥
法实施。在片段化工序之后,通过进行干燥工序,从包含经片段化的细胞外基质成分及水性介质的液体中除去水性介质。所谓除去水性介质并不是指在经片段化的细胞外基质成分中没有附着任何水分,而是指通过上述的常用干燥方法,以常识性地可达到的程度未附着有水分。
[0120]
间充质细胞的含有率相对于第一接触工序中的第一细胞的总细胞数,可以为5%以上、10%以上、15%以上、20%以上、25%以上、或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0121]
在第一接触工序中,第一细胞优选进一步包含血管内皮细胞。通过使用进一步包含血管内皮细胞的第一细胞和经片段化细胞外基质成分,能够形成在细胞间具有血管网的结缔组织结构体。
[0122]
血管内皮细胞的含有率相对于第一接触工序中的第一细胞的总细胞数,可以为5%以上、10%以上、15%以上、20%以上、25%以上、或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0123]
间充质细胞与血管内皮细胞的细胞数之比(间充质细胞/血管内皮细胞)没有特别限制,例如可以为100/1~1/100、可以为50/1~1/50、可以为20/1~1/1、可以为10/1~1/1、可以为8/1~1/1、可以为7/1~1.2/1、可以为6/1~1.5/1、可以为5/1~2/1、也可以为3/1~2/1。
[0124]
第一接触工序中的细胞外基质成分的浓度可根据目标结缔组织结构体的形状及厚度、细胞结构体的形状及厚度、以及培养箱的尺寸等适当确定。例如,第一接触工序中的水性介质中的细胞外基质成分的浓度可以为0.1~90质量%,也可以为1~30质量%。
[0125]
与第一细胞接触时的经片段化的细胞外基质成分的量相对于1.0
×
106cells的细胞,例如可以为0.1~100mg、0.5~50mg、0.8~25mg、1.0~10mg、1.0~5.0mg、1.0~2.0mg、或1.0~1.8mg,可以为0.7mg以上、1.1mg以上、1.2mg以上、1.3mg以上或1.4mg以上,且可以为7.0mg以下、3.0mg以下、2.3mg以下、1.8mg以下、1.7mg以下、1.6mg以下或1.5mg以下。
[0126]
在第一接触工序中,经片段化的细胞外基质成分与第一细胞的质量比(细胞外基质成分/细胞)优选为1/1~1000/1,更优选为9/1~900/1,进一步优选为10/1~500/1。
[0127]
(第一培养工序)
[0128]
培养第一细胞的方法没有特别限制,可以根据所要培养的细胞的种类通过合适的培养方法进行。例如,培养温度可以为20℃~40℃,也可以为30℃~37℃。培养基的ph可以为6~8、也可以为7.2~7.4。培养时间可以为1天~2周,也可以为1周~2周。
[0129]
第一培养工序中的培养基中的细胞密度可以根据目标结缔组织结构体的形状、厚度、培养箱的尺寸等适当确定。例如,第一培养工序中的培养基中的细胞密度可以为1~108cells/ml,也可以为103~107cells/ml。另外,第一培养工序中的培养基中的细胞密度可以与第一接触工序中的水性介质中的细胞密度相同。
[0130]
在第一接触工序之后且第一培养工序之前也可以进一步包含使水性介质中的细胞外基质成分与第一细胞一起沉降的工序。通过进行这样的工序,结缔组织结构体中的细胞外基质成分和细胞的分布变得更为均匀。作为具体的方法,没有特别限制,例如可举出对包含细胞外基质成分和细胞的培养液进行离心操作的方法。
[0131]
[第二工序]
[0132]
在第二接触工序中,通过进行使包含上皮细胞的第二细胞与结缔组织结构体接触的工序(第二接触工序)、和培养结缔组织结构体和第二细胞的工序(第二培养工序),在结缔组织结构体上形成上皮结构体,得到细胞结构体。
[0133]
在使包含上皮细胞的第二细胞与结缔组织结构体接触之前,根据需要,可以使胶原(例如iv型胶原)与结缔组织结构体接触。在该情况下,可更容易形成在结缔组织结构体上配置有上皮结构体的细胞结构体。例如,通过在含有胶原的溶液(胶原溶液)中保持结缔组织结构体,能够使胶原与结缔组织结构体接触。结缔组织结构体例如可以在37℃下保持在胶原溶液中20分钟以上。胶原溶液中的胶原浓度例如可以为0.01~0.10mg/ml或0.02~0.06mg/ml。
[0134]
结缔组织结构体与第二细胞可以在水性介质中接触。作为使结缔组织结构体与第二细胞接触的方法,可举出将含有结缔组织结构体的水性介质与含有第二细胞的水性介质混合的方法、在含有结缔组织结构体的水性介质中添加第二细胞的方法、在含有第二细胞的培养液中加入含有结缔组织结构体的水性介质的方法、在含有结缔组织结构体的水性介质中加入第二细胞的方法、在预先准备的水性介质中分别加入结缔组织结构体和细胞的方法等方法,但不限于这些。
[0135]
水性介质例如可以是液态的培养基。培养基没有特别限制,可以根据所要培养的细胞的种类选择合适的培养基。培养基可以是与在第一工序中使用的培养基同种的培养基,也可以是不同种的培养基。作为培养基,例如可举出eagle’s mem培养基、dmem、modifide eagle培养基(mem)、minimum essential培养基、rpmi、及glutamax培养基等。培养基可以是添加有血清的培养基,也可以是无血清培养基。培养基可以是混合了两种培养基的混合培养基。
[0136]
在第二接触工序中,上皮细胞的含有率相对于第二细胞的总细胞数,可以为5%以上、10%以上、15%以上、20%以上、25%以上、或30%以上,且可以为95%以下、90%以下、80%以下、或75%以下。
[0137]
(第二培养工序)
[0138]
培养结缔组织结构体和第二细胞的方法没有特别限制,可以根据所要培养的细胞的种类通过适当的培养方法进行。例如,培养温度可以为20℃~40℃,也可以为30℃~37℃。培养基的ph可以为6~8、也可以为7.2~7.4。培养时间可以为1天~2周,也可以为1周~2周。
[0139]
培养基没有特别限制,可以根据所要培养的细胞的种类选择合适的培养基。培养基例如可以是上述的培养基。
[0140]
第二培养工序中的培养基中的细胞密度可以根据目标细胞结构体的形状、厚度、培养箱的尺寸等适当确定。例如,第二培养工序中的培养基中的细胞密度可以为1~108cells/ml,也可以为103~107cells/ml。另外,第二培养工序中的培养基中的细胞密度可以与第二接触工序中的水性介质中的细胞密度相同。
[0141]
通过本实施方式的制造方法制造的细胞结构体在培养中的收缩率优选为20%以下,更优选为15%以下,进一步优选为10%以下。上述收缩率例如可以通过以下的式子计算。式中,l1表示培养后第1天的细胞结构体的最长部分的长度,l3表示培养后第3天的细胞结构体中的对应部分的长度。
[0142]
收缩率(%)={(l1-l3)/l1}
×
100
[0143]
在上述的例子中,收缩率通过培养后第1天的细胞结构体和培养第3天的细胞结构体计算,但也可以通过包括培养的结束时刻在内的培养期间的任意时刻的细胞结构体计算。例如,可以通过培养后第1天的细胞结构体和培养第2天的细胞结构体计算,可以通过培养后第1天的细胞结构体和培养第5天的细胞结构体计算,也可以通过培养后第1天的细胞结构体和培养第8天的细胞结构体计算。
[0144]
在第二培养工序之后,可以进一步包含使第三细胞接触的工序、以及培养第三细胞的工序。第三细胞可以与上述细胞为同种,也可以为不同种。由此,能够制作三层结构的细胞结构体。另外,通过进一步反复包含接触工序和培养工序,能够制作多层的细胞结构体,还能够制作更接近复杂的生物体的组织。
[0145]
在第二接触工序之后且第二培养工序之前,可以进一步包含使水性介质中的结缔组织结构体与第二细胞一起沉降的工序。通过进行这样的工序,细胞结构体中的细胞外基质成分及细胞的分布变得更均匀。作为具体的方法,没有特别限制,例如可举出对包含结缔组织结构体和第二细胞的培养液进行离心操作的方法。
[0146]
《细胞结构体的用途》
[0147]
本实施方式的细胞结构体例如可以为移植用。本实施方式的细胞结构体能够如生物体组织那样在细胞间具有血管网。由此,还可期待在移植到哺乳类等动物时变得容易植入。
[0148]
作为移植对象的动物没有特别限制,例如可以是哺乳类,可以是人,也可以是猴、狗、猫、兔、猪、牛、小鼠以及大鼠等非人动物。
[0149]
本实施方式的移植方法包含将本实施方式的细胞结构体移植到动物的工序。在进行移植之前,可以进一步包含准备所要移植的动物的工序和/或通过上述方法制作细胞结构体的工序。移植方法没有特别限制,可以根据移植对象等适当采用公知的外科方法等进行。本实施方式的细胞结构体例如可以用于组织重建。
[0150]
本实施方式的制造非人动物模型的方法包含将本实施方式的细胞结构体移植到非人动物的工序。在进行移植的工序之前,可以进一步包含准备所要移植的非人动物的工序和/或通过上述方法制作细胞结构体的工序。本实施方式的非人动物模型可以用于将在动物实验中使用而得到的数据应用于人。为了制造非人动物模型,优选使用抑制了对移植物(移植片)的排斥的非人动物,例如免疫力降低或免疫缺陷的非人动物。
[0151]
本实施方式的细胞结构体本身也可以用作实验动物的替代品、移植材料等,作为具体例,可以应用于如上所述的组织重建、病理学的体内模型、医药品、化妆品或药用化妆品的筛选(药剂的评价)、医药品、化妆品或药用化妆品的分析筛选等。
[0152]
《含有细菌的组织模型》
[0153]
由于本实施方式的细胞结构体更接近生物体组织,因此通过在该细胞结构体中配置细菌,可以适用作用于评价生物体组织中的细菌的行为(例如细菌的植入和/或浸润)和/或细菌对细胞结构体造成的影响(例如,位于与细胞结构体中的细菌接触的细胞的周围的细胞的行为)的组织模型。
[0154]
作为本发明的一个实施方式,提供一种含有细菌的组织模型,其具备本实施方式的细胞结构体、和配置在细胞结构体的内部或以与细胞结构体的上皮结构体接触的方式配
置的细菌。
[0155]
细菌只要是可附着于牙龈、口腔、皮肤以及角膜等组织并作用于组织的细菌就没有特别限定。作为细菌的具体例,例如可以是牙周病菌、口腔细菌等。例如,在细菌为牙周病菌的情况下,含有细菌的组织模型还可以用作牙周病菌评价模型。作为牙周病菌,例如可举出牙龈卟啉单胞菌(prophyromonas gingivalis)、齿垢密螺旋体(treponema denticola)、中间普雷沃菌(prevotella intermedia)、伴放线凝聚杆菌(aggregatibacter actinomycetemcomitans)、伴放线嗜血杆菌(actinobacicclus actino-mycetemcomitans)、福氏拟杆菌(bacteroides forsythus)等。
[0156]
《含有细菌的组织模型的制造方法》
[0157]
本实施方式的含有细菌的组织模型的制造方法具备使细菌与上述的细胞结构体的上皮结构体接触的工序。
[0158]
该含有细菌的组织模型的制造方法在使细菌接触的工序之后,可以进一步具备培养细胞结构体和细菌、使细菌移动到细胞结构体的内部的工序。在使其移动的工序中,可以使细菌移动到细胞结构体的上皮结构体内部和/或细胞结构体的结缔组织结构体的内部。
[0159]
《对细胞结构体和/或细菌的行为进行评价的方法》
[0160]
作为本发明的一个实施方式,提供一种对细胞结构体和/或细菌的行为进行评价的方法,其包含在使细菌与上述的细胞结构体的上皮结构体接触之后、对细胞结构体和/或细菌的行为进行评价的工序(评价工序)。该方法在评价工序之前可以包含使细菌与上述的细胞结构体的上皮结构体接触的工序(接触工序)。
[0161]
在对细胞结构体和/或细菌的行为进行评价的方法中,评价工序和/或接触工序可以在化学物质(例如医药品)的存在下进行。例如,评价工序可以在将细胞结构体暴露于医药品等的环境下、或者在向细胞结构体给予医药品等的环境下进行。在评价工序中,也可以评价对位于与细菌接触的细胞周围的细胞的影响。在评价工序中,可以对细菌的植入和/或浸润进行评价。例如,在评价工序中,可以对细菌浸润到细胞结构体的路径进行评价。
[0162]
评价工序例如可以通过将使细菌与细胞结构体的上皮结构体刚接触后的细胞结构体和/或细菌与使细菌接触后经过规定时间(例如1~72小时、2~48小时、2~24小时、3~8小时或4~6小时)后的细胞结构体和/或细菌进行比较来进行。例如,通过对细菌中所含的核酸进行染色,获得与细菌接触的细胞结构体的截面图像,对所获得的截面图像进行比较,由此可以对细菌是否移动到细胞结构体的内部进行评价。根据本实施方式的评价方法,例如,可以对是否移动到上皮结构体或结缔组织结构体的内部、或移动到细胞结构体的血管网进行评价。
[0163]
在评价工序中,例如,作为细胞结构体的行为,可以对从细胞结构体分泌的炎症性细胞因子量进行评价。炎症性细胞因子例如可以是白细胞介素-6(il-6)。作为对炎症性细胞因子量进行评价的方法,例如可以使用后述的实施例中记载的方法。
[0164]
[实施例]
[0165]
以下,举出实施例更具体地对本发明进行说明。但是,本发明并不限定于这些实施例。
[0166]
《试验例1:经解纤的胶原成分的制作》
[0167]
将作为冷冻干燥物的猪皮来源i型胶原(nippon ham株式会社制)分散于10倍浓度
的磷酸缓冲生理盐水(
×
10pbs)中,制备i型胶原的分散液。使用均化器将i型胶原的分散液均化5分钟,得到经解纤的胶原(以下也称为“cmf”)。得到的cmf的平均长度为22.5μm,平均直径为约4.4μm。
[0168]
cmf的长度方向的长度及与长度方向正交的方向的长度通过利用电子显微镜分别对各cmf进行分析来求出。平均长度及平均直径表示测定391个样品时的平均值。
[0169]
将得到的cmf用无血清培养基(dmem)清洗,得到cmf的培养基分散液。得到的cmf的培养基分散液在室温下保存1周。在后述的实施例中使用的cmf使用通过同样的方法得到的cmf。
[0170]
《试验例2:细胞结构体的制作》
[0171]
在细胞结构体的制作中使用的细胞、试剂及制作方法等如下所述。
[0172]
·
永生化人牙龈上皮细胞(epi4)
[0173]
·
培养基:humedia-kg2(kurabo kk2150s)
[0174]
·
人牙龈成纤维细胞(hgf)
[0175]
·
培养基:dmem 10%fbs p/s
[0176]
·
人脐静脉来源的血管内皮细胞(huvec):lonza制cc-2517
[0177]
·
培养基:egm2mv(lonza cc-3202)
[0178]
·
牙龈卟啉单胞菌(gingivalis):atcc制33277
[0179]
·
培养基:5%羊血琼脂培养基(becton dickinson,252201)
[0180]
·
牙龈卟啉单胞菌(gingivalis)的蛋白酶缺陷株:对atcc的株进行基因敲减
[0181]
·
抗-cd31抗体(dako、m0823)
[0182]
·
dapi(invitrogen 62248)
[0183]
·
alexa fluor 647鬼笔环肽(invitrogen a22287)
[0184]
·
抗-牙龈卟啉单胞菌(prophyromonas gingivlis(p.gingivlis))抗体
[0185]
牙龈来源的上皮细胞(epi4)、hgf、牙龈卟啉单胞菌(atcc)的蛋白酶缺陷株(对atcc株进行基因敲减)使用由大阪大学齿学部提供的细胞和菌株。细胞类的预培养全部按照标准的方法实施。
[0186]
(结缔组织结构体的制作)
[0187]
将nippon ham株式会社制的猪皮来源的i型胶原4mg(通过5分钟的均化进行解纤而得到的胶原)、正常人牙龈成纤维细胞(hgf)1.0
×
106cells、和huvec 5.0
×
105cells悬浮在以1:1混合有d-mem(和光纯药工业株式会社制)和egm2mv的混合培养基中,将得到的悬浮液添加到24孔插入式细胞培养器(corning公司制)中,在插入式细胞培养器外侧添加混合培养基,培养过夜。由此制作结缔组织结构体。然后,每天进行培养基更换,进行培养。
[0188]
(上皮结构体的制作)
[0189]
从结缔组织结构体的形成起7天后吸取插入式细胞培养器的培养基,用0.04mg/ml的iv型胶原(sigma-aldrich制)覆盖结缔组织结构体的表面,将永生化人牙龈上皮细胞(epi4)调整为1.0
×
106cells/300μl/插入式细胞培养器,在结缔组织结构体上接种epi4。在插入式细胞培养器的外侧加入1ml的以1:1:1混合有d-mem、egm2mv和humedia(仓敷纺织株式会社制)的混合培养基,在37℃下孵育1小时后,在插入式细胞培养器的外侧追加1ml混合培养基,培养过夜。由此,制作具备结缔组织结构体和上皮结构体的细胞结构体。将该细
胞结构体用作后述的植入及浸润评价用的细胞结构体。
[0190]
接种epi4后,培养1天后,在用多聚甲醛固定细胞结构体后进行薄切切片化,实施苏木精-伊红(he)染色。将基于he染色的细胞结构体的观察结果示于图1。确认到所制作的细胞结构体由结缔组织结构体(图1的a)和配置在结缔组织结构体上的上皮结构体(图1的b)构成。在所制作的细胞结构体中,未确认到组织收缩及组织破裂。
[0191]
确认到在所制作的细胞结构体的结缔组织结构体的细胞间配置有cmf。通过基于抗cd31抗体(dako制)的免疫染色,在所制作的细胞结构体的结缔组织结构体中确认到血管网的形成(图2)。
[0192]
《试验例3:细胞结构体的制作及浸润评价》
[0193]
对除了细胞结构体不包含huvec(在形成结缔组织结构体时未使用huvec)以外、与试验例2中记载的方法同样地得到的评价用的细胞结构体,接种2.0
×
107cells的牙龈卟啉单胞菌(p.gingivalis)。将在琼脂培养基上培养的牙龈卟啉单胞菌从培养基上剥离后,悬浮在从与制作上皮结构体时相同的混合培养基中除去抗生素后的培养基中,接种到上皮结构体上。
[0194]
图3表示刚接种细菌后和接种后(感染后)经过了4小时的时间点的评价用结构体的观察结果。图3的a表示结缔组织结构体,图3的b表示上皮结构体。图3(b)中的箭头表示细菌。图3中的标尺表示50μm。
[0195]
如图3所示,显示了细菌移动到结缔组织结构体和上皮结构体的内部。
[0196]
《试验例4:牙龈卟啉单胞菌的植入及浸润的确认》
[0197]
使用除了细胞结构体不包含huvec(在形成结缔组织结构体时未使用huvec)以外、与试验例2中记载的方法同样地得到的评价用的细胞结构体。对于该评价用的细胞结构体,除了将接种量设为2.4
×
107cells以外,与试验例3中记载的方法同样地接种牙龈卟啉单胞菌。
[0198]
将接种牙龈卟啉单胞菌后经过了24小时及48小时的细胞结构体从插入式细胞培养器剥离,实施dna提取及实时pcr。dna提取是使用zymo reserch制r2081按照其说明书所述的方法来实施。实时pcr是使用试剂盒(thunderbirdr probe qpcr rt set(toyobo制))按照其说明书所述的方法来实施。
[0199]
牙龈卟啉单胞菌使用野生型(wild type)和使蛋白酶缺陷的突变型(δkpg rgpa rgpb)这2种。将结果示于表1。表1中的“n.d”表示未检测到。
[0200]
已知生物体中的牙龈组织由于细胞间的牢固的粘附而具有阻隔性,因此在牙周病菌(牙龈卟啉单胞菌)浸润到牙龈组织时,需要由蛋白酶分解有助于细胞间粘附的蛋白质。根据本试验的结果,如表1所示,在使用了蛋白酶缺陷的牙周病菌的情况下,浸润的细菌数显著性地减少。由此显示了,在使用cmf制作的细胞结构体中,牙周病菌良好浸润需要蛋白酶的表达,除此以外,使用cmf制作的细胞结构体是更接近生物体的组织模型。
[0201]
表1
[0202][0203]
《试验例5:粘附因子的表达状态的确认(qrt-pcr)>
[0204]
使用除了细胞结构体不包含huvec(在形成结缔组织结构体时未使用huvec)以外、与试验例2中记载的方法同样地得到的评价用的细胞结构体作为有cmf的样品。
[0205]
使用除了不使用cmf、以及细胞结构体不包含huvec(形成结缔组织结构体时未使用huvec)以外、与试验例2中记载的方法同样地得到的评价用的细胞结构体作为无cmf的样品。
[0206]
将接种epi4后培养了1天的细胞结构体从插入式细胞培养器剥离,实施mrna提取及实时pcr。mrna的提取是使用invitrogen制purelink
tm rna mini kit按照其说明书所述的方法来实施。实时pcr是使用试剂盒(sybrr green realtime pcr master mix(toyobo制))按照其说明书所述的方法来实施。
[0207]
将粘附因子的表达状态的确认结果示于表2。如表2所示,显示了在使用cmf的情况下,与未使用cmf的情况相比,粘附因子的表达量提高,成为更接近生物体的牙龈模型。另外,0
*1
表示0.00004596,0
*2
表示0.000008649,0
*3
表示0.0000406。
[0208]
表2
[0209][0210]
《试验例6:具有血管网的细胞结构体的制作》
[0211]
1.i型胶原溶液(10mg/ml)的制备
[0212]
向离心管分取50mg经冷冻干燥的猪皮来源的i型胶原(nippon ham株式会社提供),加入5ml的10xpbs(ph为7.4),使其均化6分钟。以10000rpm离心3分钟,进行用吸量管吹吸和voltex,再次以10000rpm离心3分钟。抽吸上清液后,加入dmem(不含血清)5ml,将沉淀充分地用吸量管吹吸,以10000rpm离心3分钟。之后,抽吸除去上清液,按照均化后的i型胶原的含量达到10mg/ml的方式添加含有8%fbs的dmem。悬浮后,向微量管分取必要量。得到的经解纤的胶原(cmf)的平均长度为22.5μm,平均直径为约4.4μm。
[0213]
2.具有血管网的结缔组织结构体(结缔组织层)的构建
[0214]
将hgf(1.0
×
106cells/tissue)和huvec(5.0
×
105cells/tissue)与以10mg/ml的
浓度含有i型胶原的i型胶原溶液混合,接种于插入式细胞培养器。在插入式细胞培养器的外侧加入8%fbs/dmem和egm-2(lonza)混合培养基(1:1)0.5ml,以1100xg离心15分钟,在37℃下培养。第二天,将24孔插入式细胞培养器移动至6孔板,在含有8%fbs的dmem和egm-2混合培养基(1:1)12ml中培养1周。
[0215]
3.上皮结构体(上皮细胞层)的构建
[0216]
抽吸结缔组织结构体的插入式细胞培养器内侧的培养基,在插入式细胞培养器内侧加入以0.04mg/ml的浓度含有iv型胶原的pbs(iv型胶原溶液),在37℃下孵育20分钟以上。在此期间,使用以含有8%fbs的dmem:egm-2:含有2%fbs的humedia-kg2(kurabo)=1:1:1混合有ihge cells的细胞悬浮液的培养基来制备。抽吸插入式细胞培养器内侧的iv型胶原溶液和外侧的培养基后,向内侧接种上皮细胞,向外侧添加混合培养基,在37℃静置1小时。然后,进一步向外侧添加混合培养基,在24孔插入式细胞培养器的情况下,将内侧与外侧连接,培养过夜。由此,构建了由在结缔组织结构体上配置有上皮结构体的细胞结构体构成的牙龈组织模型。
[0217]
4.牙龈卟啉单胞菌的培养
[0218]
将牙龈卟啉单胞菌atcc 33277接种于血液琼脂培养基(bd),在37℃、厌氧条件下进行维持培养。向对数生长期的增殖培养使用添加有氯化血红素(heamin,5μg/ml,sigma-aldrich)和甲萘醌(menadione,1μg/ml,sigma-aldrich)的trypticase soybroth(tbs)培养基(bd)进行。
[0219]
5.牙龈卟啉单胞菌的感染
[0220]
用不含抗生素而含有8%fbs的dmem:egm-2:含有2%fbs的humedia-kg2(kurabo)=1:1:1混合培养基对牙龈卟啉单胞菌进行调整,使其达到2.4
×
107cells/tissue,给予牙龈组织模型。给予后,在37℃的5%co2培养箱内培养。
[0221]
6.牙龈卟啉单胞菌的免疫组织化学分析
[0222]
将牙龈卟啉单胞菌感染牙龈组织模型的切片用兔抗牙龈卟啉单胞菌抗体(anti-p.gingivalis antibody produced in rabbit(sigma-aldrich))在4℃下孵育过夜。然后,用辣根过氧化物酶标记山羊抗兔igg(horse radish peroxidase conjugated goat anti-rabbit igg,株式会社nichirei biosciences)处理后,用3,3
’‑
二氨基联苯胺底物溶液(diaminobenzidine substrate solution(dako)使其显色。对比染色用苏木精进行。
[0223]
7.牙龈卟啉单胞菌侵入分析
[0224]
牙龈卟啉单胞菌使用-bacstain-ctc rapid staining kit(株式会社同仁化学研究所)进行染色。将牙龈卟啉单胞菌悬浮于pbs中,将悬浮液与5-氰基-2,3-二(4-甲基苯基)四唑氯化物(ctc)及增强试剂b一起在37℃下孵育30分钟。将牙龈组织模型用pbs清洗后,将染色后的牙龈卟啉单胞菌给予牙龈组织模型,在37℃的5%co2培养箱内进行共培养。
[0225]
牙龈卟啉单胞菌在给予牙龈组织模型前用荧光色素进行了标记。标记使用-bacstain-ctc rapid staining kit(显微镜检查用)。本试剂盒通过代表呼吸活性的电子传输来检测在细胞内产生的nad(p)h。ctc被该nad(p)h还原而成为荧光性甲瓒(λex=430,480nm附近,λem=620~640nm)。该荧光性甲瓒由于沉积在细胞中而被观察到,因此能够在各个细胞中进行观察。试剂盒中所含的增强子促进基于nad(p)h的ctc的还原反应,因此能够进行高灵敏度的检测。
[0226]
图4是抗-cd31抗体和用ctc标记的牙龈卟啉单胞菌的图像。图4示出了牙龈卟啉单胞菌与血管网结构一起局部存在。由图4所示的照片可知,牙龈卟啉单胞菌侵入到了牙龈组织模型的血管网结构。即使在感染了具有胰蛋白酶活性的酶即牙龈蛋白酶缺损的细胞株(牙龈卟啉单胞菌δkgp rgpa rgpb)的牙龈组织模型中也观察到了表示一起局部存在的信号,但为水平比感染了牙龈卟啉单胞菌wt的模型低的信号。上述的结果启示,牙龈蛋白酶与牙龈卟啉单胞菌向牙龈组织深部的移动和毛细血管的浸润相关的可能性高。
[0227]
除了图4所示的图像以外,获得2张同样的图像(共计3张),分别使用image j对牙龈卟啉单胞菌与血管网结构一起局部存在的区域的面积值进行分析,计算平均值。将计算结果示于图5。如图5所示,与根据图4的图像确认到的结果同样,确认到牙龈卟啉单胞菌浸润到血管网内部。对于牙龈卟啉单胞菌向血管网内部的浸润,wt比牙龈蛋白酶缺陷株更为显著。图5中,*表示有显著性差异(p<0.05)。
[0228]
图6表示浸润到牙龈组织模型内部的牙龈卟啉单胞菌的数量的定量评价结果。通过实时pcr测量试验例6的“5.牙龈卟啉单胞菌的感染”后的牙龈组织模型中的牙龈卟啉单胞菌的数量。实时pcr通过与试验例4同样的方法实施。*表示有显著性差异(p<0.05)。
[0229]
图7表示牙龈卟啉单胞菌感染后的il-6的分泌量的评价结果。在试验例6的“5.牙龈卟啉单胞菌的感染”后的牙龈组织模型中,测定从组织分泌的il-6的量,进行比较。il-6是通常被用作炎症指标的细胞因子。通常,il-6量的上升表示发生了炎症,即有感染。
[0230]
根据图7所示的图表,接种了wt的情况与没有接种牙龈卟啉单胞菌的情况、以及牙龈蛋白酶缺陷株相比,il-6量降低,考虑这是因为牙龈蛋白酶具有分解il-6的作用。牙龈蛋白酶缺陷株与未接种牙龈卟啉单胞菌的情况相比,il-6上升,与图4所示的数据以及图6所示的牙龈卟啉单胞菌的数量的定量评价结果一起考虑时,显示发生了感染。
[0231]
il-6通过elisa进行定量。使牙龈卟啉单胞菌感染牙龈组织模型后,在6小时后、24小时后、48小时后回收培养上清液,使用elisamax kits(biolegend)按照手册测定培养上清液中的il-6量。图7中,*表示有显著性差异(p<0.05)。
[0232]
图8~9是分别表示牙龈卟啉单胞菌透过上皮细胞层的行为的观察方法和观察结果的图。
[0233]
在生物体中,牙龈卟啉单胞菌为了从牙龈组织的表面向结缔组织层移动,需要贯通上皮细胞层。已知一部分细菌与脂筏相互作用而促进向宿主细胞的侵入。通过以下的实验,确认了脂筏有可能与牙龈卟啉单胞菌向上皮细胞层的渗透相关,以及作为牙龈卟啉单胞菌向牙龈组织更深的区域移动的主要路径,有可能不是经由细胞间而是经由细胞内。
[0234]
图8表示观察牙龈卟啉单胞菌透过上皮细胞层的行为的方法。在该方法中,使用了能够从细胞的细胞膜可逆地除去胆固醇的物质即甲基-β-环糊精(mβcd)。
[0235]
首先,将1.0
×
106个ihge细胞接种于3μm气孔率的24孔板transwell(corning制),在humedia-kg2培养基中培养1天,制作仅由上皮细胞层构成的上皮结构体(上皮细胞层组织)(图8的a)。
[0236]
接着,将mβcd溶解于二甲基亚砜(dmso),得到mβcd的终浓度为50mm或100mm的mβcd溶液。接着,将上述的mβcd溶液混合在humedia-kg2培养基中(培养基中的mβcd的终浓度:0.5mm或1.0mm)。用pbs清洗上皮细胞层组织后,将含有上述mβcd的humedia-kg2培养基添加到transwell内的上皮细胞层组织中,将上皮细胞层组织在humedia-kg2培养基中在37℃下
孵育30分钟。
[0237]
接着,按照与上述同样的顺序准备ctc标记牙龈卟啉单胞菌,使ctc标记牙龈卟啉单胞菌感染上皮细胞层组织(图8的b)。感染后在含有mβcd的humedia-kg2培养基中在37℃下进行孵育,在感染的24小时及48小时后,使用分光荧光光度计fp-8500(jasco制)对ctc标记牙龈卟啉单胞菌从上部transwell向贯通上皮细胞层组织向下部的24孔板渗透的量进行分析(图8的c)。将分析结果示于图9。
[0238]
在用mβcd处理上皮细胞层组织后的结构体中,与未进行处理的结构体相比,牙龈卟啉单胞菌的渗透量大幅增加。确认了该效果浓度依赖性地增强。这些结果表明脂筏与牙龈卟啉单胞菌在上皮细胞层中的游走相关。另外还启示了,作为牙龈卟啉单胞菌向牙龈组织深部区域移动的主要路径,有可能不使用细胞间路径而使用细胞内路径。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。