抗组织因子抗体-药物缀合物及相关方法
1.相关申请的交叉引用
2.本技术要求2019年7月3日提交的美国临时专利申请号62/870,644的优先权和权益,所述申请的全部内容出于所有目的以引用方式并入本文。
背景技术:
3.血液凝固涉及导致血液凝结的一系列复杂过程。组织因子(tf)在这些凝固过程中起重要作用。tf是丝氨酸蛋白酶因子viia(fviia)的细胞表面受体。tf/fviia复合物催化非活性蛋白酶因子x(fx)转化为活性蛋白酶因子xa(fxa)。fxa及其辅因子fva形成凝血酶原酶复合物,所述凝血酶原酶复合物从凝血酶原生成凝血酶。凝血酶将可溶性纤维蛋白原转化为不溶性纤维蛋白链,并且催化许多其他凝固相关的过程。
4.tf在多种类型的实体瘤上过表达。在癌症中,tf/fviia信号传导可支持血管生成、肿瘤进展和转移。
技术实现要素:
5.本文提供了抗tf抗体-药物缀合物和相关方法。
6.本文提供了一种抗体-药物缀合物,其包含:
7.a.结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab),其中所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
8.i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
9.ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
10.iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
11.iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
12.v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
13.vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体;
14.和
15.b.一个或多个由式iv表示的连接子-毒素部分:
[0016][0017]
其中:
[0018]
x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式iv中所示的相应连接点,或x不存在;
[0019]
l是连接子;
[0020]
!表示l与ab的连接点,其中l通过共价键连接至ab;
[0021]
r1选自由以下组成的组:
[0022][0023]
其中#和%表示式iv中所示的相应连接点;并且
[0024]
r2是苯基。
[0025]
在一些实施方案中,r1选自由以下组成的组:
[0026][0027]
在一些实施方案中,x不存在。
[0028]
在一些实施方案中,式iv的连接子-毒素部分由式v表示:
[0029][0030]
在一些实施方案中,r1选自由以下组成的组:
[0031][0032]
在一些实施方案中,r1选自由以下组成的组:
[0033][0034]
在一些实施方案中,r1是:
[0035][0036]
在一些实施方案中,l是可裂解的连接子。
[0037]
在一些实施方案中,l是含肽的连接子。
[0038]
在一些实施方案中,l是蛋白酶可裂解的连接子。
[0039]
在一些实施方案中,l是选自以下之一的连接子:n-(β-马来酰亚胺丙氧基)-n-羟基琥珀酰亚胺酯(bmps)、n-(ε-马来酰亚胺己酰氧基)琥珀酰亚胺酯(emcs)、n-[γ-马来酰亚胺丁酰氧基]琥珀酰亚胺酯(gmbs)、1,6-己烷-双-乙烯砜(hbvs)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧基-(6-酰胺基己酸酯)(lc-smcc)、间马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、4-(4-n-马来酰亚胺基苯基)丁酸肼(mpbh)、琥珀酰亚胺基3-(溴乙酰胺基)丙酸酯(sbap)、琥珀酰亚胺基碘乙酸酯(sia)、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、n-琥珀酰亚胺基-4-(2-吡啶硫代)戊酸酯(spp)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧酸酯(smcc)、琥珀酰亚胺基4-(对马来酰亚胺基苯基)丁酸酯(smpb)、琥珀酰亚胺基6-[(β-马来酰亚胺基丙酰胺基)己酸酯](smph)、亚氨基硫烷(it)、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯(svsb)。
[0040]
在一些实施方案中,l包含下式的聚(乙二醇)链:
[0041][0042]
其中g是1-20的整数。
[0043]
在一些实施方案中,g是3。
[0044]
本文提供了一种式vi的抗体-药物缀合物:
[0045][0046]
其中:
[0047]
ab表示组织因子(tf)抗体;
[0048]
n为大于或等于1的整数;
[0049]
x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式vi中所示的相应连接点,或x不存在;
[0050]
l是连接子;
[0051]
r1选自由以下组成的组:
[0052][0052][0053]
其中#和%表示式vi中所示的相应连接点;并且
[0054]
r2是苯基;其中
[0055]
所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0056]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0057]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[0058]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0059]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0060]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0061]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1
的抗体。
[0062]
在一些实施方案中,r1选自由以下组成的组:
[0063][0064]
在一些实施方案中,x不存在。
[0065]
在一些实施方案中,r1选自由以下组成的组:
[0066][0067]
在一些实施方案中,r1是:
[0068][0069]
在一些实施方案中,l是可裂解的连接子。
[0070]
在一些实施方案中,l是含肽的连接子。
[0071]
在一些实施方案中,l是蛋白酶可裂解的连接子。
[0072]
在一些实施方案中,l是选自以下之一的连接子:n-(β-马来酰亚胺丙氧基)-n-羟基琥珀酰亚胺酯(bmps)、n-(ε-马来酰亚胺己酰氧基)琥珀酰亚胺酯(emcs)、n-[γ-马来酰亚胺丁酰氧基]琥珀酰亚胺酯(gmbs)、1,6-己烷-双-乙烯砜(hbvs)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧基-(6-酰胺基己酸酯)(lc-smcc)、间马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、4-(4-n-马来酰亚胺基苯基)丁酸肼(mpbh)、琥珀酰亚胺基3-(溴乙酰胺基)丙酸酯(sbap)、琥珀酰亚胺基碘乙酸酯(sia)、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、n-琥珀酰亚胺基-4-(2-吡啶硫代)戊酸酯(spp)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧酸酯(smcc)、琥珀酰亚胺基4-(对马来酰亚胺基苯基)丁酸酯(smpb)、琥珀酰亚胺基6-[(β-马来酰亚胺基丙酰胺基)己酸酯](smph)、亚氨基硫烷(it)、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯(svsb)。
[0073]
在一些实施方案中,l包含下式的聚(乙二醇)链:
[0074][0075]
其中g是1-20的整数。
[0076]
在一些实施方案中,g是3。
[0077]
在一些实施方案中,l由式vii表示:
[0078][0079]
其中:
[0080]
z表示与tf抗体的靶标基团结合的官能团;
[0081]
d表示与式vi中所示的氨基的连接点;
[0082]
str是延伸物(stretcher);
[0083]
aa1和aa2各自独立地为氨基酸,其中aa
1-[aa2]m形成蛋白酶裂解位点;
[0084]
x1为自降解基团;
[0085]
s是选自0和1的整数;
[0086]
m是选自由1、2、3和4组成的组的整数;
[0087]
o是选自0、1和2的整数。
[0088]
在一些实施方案中,n是选自由1、2、3、4和5组成的组的整数。
[0089]
在一些实施方案中,[str]s选自由以下组成的组:亚烷基、基于脂肪族酸的延伸物、基于脂肪族二酸的延伸物、基于脂肪族胺的延伸物和基于脂肪族二胺的延伸物。
[0090]
在一些实施方案中,[str]s选自由以下组成的组:基于二甘醇酸酯的延伸物、基于丙二酸酯的延伸物、基于己酸酯的延伸物和基于己酰胺的延伸物。
[0091]
在一些实施方案中,[str]s选自由以下组成的组:基于甘氨酸的延伸物、基于聚乙二醇的延伸物和基于单甲氧基聚乙二醇的延伸物。
[0092]
在一些实施方案中,[str]s是:
[0093][0094]
其中
[0095]
h是1-20的整数,
[0096]
cc是指与aa1的连接点;并且
[0097]
dd是指与z的连接点。
[0098]
在一些实施方案中,[str]s选自:
[0099][0100]
其中:
[0101]
ee和ff分别表示与z和aa1的连接点;
[0102]
r选自氢和c
1-c6烷基;
[0103]
每次出现的p独立地为2至10的整数;并且
[0104]
每次出现的q独立地为1至10的整数。
[0105]
在一些实施方案中,[str]s选自由以下组成的组:
[0106][0107]
其中:
[0108]
ee和ff分别表示与z和aa1的连接点;
[0109]
每次出现的p独立地为2至10的整数;并且
[0110]
每次出现的q独立地为1至10的整数。
[0111]
在一些实施方案中,[str]s选自:
[0112][0113]
其中:
[0114]
ee和ff分别表示与z和aa1的连接点;
[0115]
每次出现的p独立地为2至6的整数,并且
[0116]
q为2至8的整数。
[0117]
在一些实施方案中,aa
1-[aa2]m选自val-lys、ala-lys、phe-lys、val-cit、phe-cit、leu-cit、ile-cit、trp-cit、phe-arg、ala-phe、val-ala、met-lys、asn-lys、ile-pro、ile-val、asp-val、his-val、met-(d)lys、asn-(d)lys、val-(d)asp、norval-(d)asp、ala-(d)asp、me3lys-pro、苯基gly-(d)lys、met-(d)lys、asn-(d)lys、pro-(d)lys、met-(d)lys、met-cit-val、gly-cit-val、(d)phe-phe-lys、(d)ala-phe-lys、gly-phe-leu-gly和ala-leu-ala-leu。
[0118]
在一些实施方案中,m选自1、2和3。
[0119]
在一些实施方案中,m是1。
[0120]
在一些实施方案中,aa
1-[aa2]m是选自val-lys、ala-lys、phe-lys、val-cit、phe-cit、leu-cit、ile-cit和trp-cit的二肽。
[0121]
在一些实施方案中,每个x1独立地选自对氨基苄氧羰基(pabc)、对氨基苄基醚(pabe)和甲基化乙二胺(med)。
[0122]
在一些实施方案中,s为1并且h为3。
[0123]
在一些实施方案中,s是1。
[0124]
在一些实施方案中,o是0。
[0125]
本文提供了一种抗体药物缀合物,其包含式viii的连接子-毒素部分:
[0126][0127]
其中##表示连接子-毒素部分与tf抗体的连接点,并且连接子-毒素部分通过共价键连接至tf抗体。
[0128]
本文提供了一种式ix的抗体-药物缀合物:
[0129][0130]
其中:
[0131]
ab是组织因子(tf)抗体,其中所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0132]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0133]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3
的抗体,
[0134]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0135]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0136]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0137]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体,
[0138]
n为大于或等于1的整数,并且
[0139]
琥珀酰亚胺基通过共价键连接到ab。
[0140]
在一些实施方案中,n选自由1、2、3、4和5组成的组。
[0141]
在一些实施方案中,n选自由2、3和4组成的组。
[0142]
本文提供了一种抗体-药物缀合物,其包含由式x表示的连接子:
[0143][0144]
其中:
[0145]
##是与抗体的连接点,并且琥珀酰亚胺基通过共价键连接至抗体;
[0146]
y是一个或多个另外的连接子组分,或不存在;并且
[0147]
d1是与细胞毒性剂的连接点,并且其中
[0148]
所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0149]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0150]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[0151]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0152]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0153]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0154]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1
的抗体。
[0155]
本文提供了一种抗体-药物缀合物,其包含由式xi表示的连接子:
[0156][0157]
其中:
[0158]
##是与抗体的连接点,并且琥珀酰亚胺基通过共价键连接至抗体;
[0159]
y是一个或多个另外的连接子组分,或不存在;并且
[0160]
d1是与细胞毒性剂的连接点,并且其中
[0161]
所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0162]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0163]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[0164]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0165]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0166]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0167]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体。
[0168]
在一些实施方案中,细胞毒性剂选自由以下组成的组:诊断剂、金属螯合剂、酶、荧光化合物、生物发光化合物或化学发光化合物。
[0169]
在一些实施方案中,细胞毒性剂是具有改进的安全性特征的细胞毒性有效载荷。
[0170]
在一些实施方案中,ab包含:
[0171]
a.vh序列seq id no:868和vl序列seq id no:869,
[0172]
b.vh seq id no:151和vl序列seq id no:152,
[0173]
c.vh序列seq id no:113和vl序列seq id no:114,
[0174]
d.vh序列seq id no:189和vl序列seq id no:190,
[0175]
e.vh序列seq id no:836和vl序列seq id no:837,或者
[0176]
f.vh序列seq id no:265和vl序列seq id no:266。
[0177]
在一些实施方案中,ab包含:
[0178]
a.重链序列qvqlvqsgaevkkpgasvkvsckasgytfdx[v/a]ygiswvrqapgqglewmgwiapyx[n/s]gntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcx[r/q]asx[q/e]six[s/n]x[s/n]wlawyqqkpgkapklliykax[s/y]x[s/n]lex[s/y]gvpsrfsgsgsgteftltisslqpddfatyycqx[q/l]fqx[s/k]lppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0179]
b.重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0180]
c.重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrasqsisswlawyqqkpgkapklliykasslesgvpsrfsgsgsgteftltisslqpddfatyycqqfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0181]
d.重链序列qvqlvqsgaevkkpgasvkvsckasgytfdaygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrasesisnwlawyqqkpgkapklliykaysleygvpsrfsgsgsgteftltisslqpddfatyycqqfqklppftfgggtkveikrtvaapsvfifppsdeqlks
gtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0182]
e.重链序列qvqlvqsgaevkkpgasvkvsckasgytfrsygiswvrqapgqglewmgwvapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspygygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrashsidswlawyqqkpgkapklliykasylesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,或者
[0183]
f.重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrasesisnwlawyqqkpgkapklliykaysleygvpsrfsgsgsgteftltisslqpddfatyycqqfqklppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0184]
本文提供了一种式ix的抗体-药物缀合物:
[0185][0186]
其中:
[0187]
ab是组织因子(tf)抗体,其中所述ab包含来自命名为25a3的抗体的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,并且
[0188]
n为大于或等于1的整数。
[0189]
在一些实施方案中,n选自由1、2、3、4和5组成的组。
[0190]
在一些实施方案中,n选自由2、3和4组成的组。
[0191]
在一些实施方案中,ab包含vh序列seq id no:151和vl序列seq id no:152。
[0192]
在一些实施方案中,ab包含完全重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0193]
本文提供了一种式ix的抗体-药物缀合物:
[0194][0195]
式ix
[0196]
其中:
[0197]
ab是组织因子(tf)抗体,其中所述ab包含重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,并且
[0198]
n为大于或等于1的整数。
[0199]
在一些实施方案中,n选自由1、2、3、4和5组成的组。
[0200]
在一些实施方案中,n选自由2、3和4组成的组。
[0201]
本文提供了一种抗体-药物缀合物,其包含抗体(ab)和一个或多个具有以下结构的连接子-毒素:
[0202][0203]
其中:
[0204]
ab是组织因子(tf)抗体,其中所述ab包含来自命名为25a3的抗体的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3;
[0205]
所述一个或多个连接子-毒素通过共价键连接至所述ab;并且
[0206]
##表示连接子-毒素与ab的连接点。
[0207]
本文提供了一种抗体-药物缀合物组合物,其包含本文公开的抗体-药物缀合物,其中所述组合物包含多种药物-抗体比率(dar)种类,其中所述组合物的平均dar为2-4。
[0208]
本文提供了一种抗体-药物缀合物,其包含抗体(ab)和一个或多个具有以下结构的连接子-毒素:
[0209][0210]
其中:
[0211]
ab是组织因子(tf)抗体,其中所述ab包含重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,并且
[0212]
所述一个或多个连接子-毒素通过共价键连接至所述ab;并且
[0213]
##表示连接子-毒素与ab的连接点。
[0214]
本文提供了一种抗体-药物缀合物组合物,其包含本文公开的抗体-药物缀合物,其中所述组合物包含多种药物-抗体比率(dar)种类,其中所述组合物的平均dar为2-4。
[0215]
在一些实施方案中,ab是多特异性的。
[0216]
在一些实施方案中,ab为fab、fab’、f(ab’)2、fv、scfv、(scfv)2、单链抗体分子、双可变结构域抗体、单可变结构域抗体、线性抗体或v结构域抗体。
[0217]
在一些实施方案中,抗体包含支架,任选地其中支架为fc,任选地为人fc。
[0218]
在一些实施方案中,抗体包含选自igg、iga、igd、ige和igm的类别的重链恒定区。
[0219]
在一些实施方案中,抗体包含igg类别的重链恒定区,其中所述重链恒定区来自选自igg1、igg2、igg3和igg4的亚类。
[0220]
在一些实施方案中,抗体包含igg1的重链恒定区。
[0221]
在一些实施方案中,fc包含一个或多个修饰,其中与不具有一个或多个修饰的fc相比,一个或多个修饰导致半衰期增加、抗体依赖性细胞毒性(adcc)增加、抗体依赖性细胞吞噬作用(adcp)增加、补体依赖性细胞毒性(cdc)增加或效应子功能降低。
[0222]
本文提供了一种药物组合物,其包含本文公开的抗体-药物缀合物和药学上可接受的载体。
[0223]
本文提供了一种治疗或预防有需要的受试者中的疾病或病症的方法,其包括向受试者施用有效量的本文公开的抗体-药物缀合物或如本文公开的药物组合物。
[0224]
在一些实施方案中,疾病或疾患为癌症。
[0225]
在一些实施方案中,癌症选自由以下组成的组:头颈癌、卵巢癌、胃癌、食管癌、宫颈癌、前列腺癌、胰腺癌、雌激素受体阴性(er-)乳腺癌、孕激素受体阴性(pr-)乳腺癌、her2阴性(her2-)三阴性乳腺癌、胶质母细胞瘤、肺癌、膀胱癌、黑色素瘤和肾癌。
[0226]
在一些实施方案中,疾病或疾患涉及新生血管。
[0227]
在一些实施方案中,涉及新生血管的疾病或疾患为癌症。
[0228]
在一些实施方案中,疾病或疾患涉及血管炎症。
[0229]
在一些实施方案中,方法还包括向受试者施用一种或多种另外的治疗剂。
[0230]
在一些实施方案中,组合物还包含一种或多种另外的治疗剂。
[0231]
在一些实施方案中,另外的治疗剂被配制在不同的药物组合物中。
[0232]
在一些实施方案中,在施用组合物之前施用另外的治疗剂。
[0233]
在一些实施方案中,在施用组合物之后施用另外的治疗剂。
[0234]
在一些实施方案中,同时施用另外的治疗剂与组合物。
[0235]
在一些实施方案中,受试者为人受试者。
[0236]
本文提供了一种用于制备抗体-药物缀合物的方法,所述方法包括:
[0237]
(a)使结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团与双官能连接子反应以形成ab-连接子中间体,并使ab-连接子中间体与通式i的-nh2基团反应
[0238][0239]
其中:
[0240]
x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式i中所示的相应连接点,或x不存在;
[0241]
r1选自由以下组成的组:
[0242][0243]
其中#和%表示式i中所示的相应连接点;并且r2为苯基,
[0244]
以提供抗体药物缀合物;或者
[0245]
(b)使通式i的瑞奥西汀(auristatin)衍生物上的-nh2基团与双官能连接子反应以形成连接子-毒素中间体,并使连接子-毒素中间体与结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团反应,以提供抗体-药物缀合物,其中,在(a)或(b)中,
[0246]
(a)所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0247]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0248]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[0249]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0250]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0251]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0252]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体;并且
[0253]
(b)所述抗体-药物缀合物包含一个或多个由式iv表示的部分:
[0254]
[0255]
其中:
[0256]
x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式iv中所示的相应连接点,或x不存在;
[0257]
l是连接子;
[0258]
!表示l与ab的连接点,其中l通过共价键连接至ab;
[0259]
r1选自由以下组成的组:
[0260][0261]
其中#和%表示式vi中所示的相应连接点;并且
[0262]
r2是苯基。
[0263]
本文提供了一种用于制备抗体-药物缀合物的方法,所述方法包括:
[0264]
(a)使结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团与包含两个或更多个连接子组分的双官能连接子的第一连接子组分反应,随后依次添加其余一个或多个连接子组分,以形成ab-连接子中间体,并使ab-连接子中间体与通式i化合物的-nh2基团反应:
[0265][0266]
其中:
[0267]
x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式i中所示的相应连接点,或x不存在;
[0268]
r1选自由以下组成的组:
[0269][0270][0271]
其中#和%表示式i中所示的相应连接点;并且r2为苯基,
[0272]
以提供抗体药物缀合物;或者
[0273]
(b)使通式i化合物上的-nh2基团与包含两个或更多个连接子组分的双官能连接子的第一连接子组分反应,随后依次添加其余一个或多个连接子组分,以形成连接子-毒素中间体,并使连接子-毒素中间体与结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团反应,以提供抗体-药物缀合物,其中,在(a)或(b)中,
[0274]
(a)所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0275]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0276]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[0277]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0278]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0279]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0280]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体;并且
[0281]
(b)所述抗体-药物缀合物包含一个或多个由式iv表示的部分:
[0282][0283]
其中:
[0284]
x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式iv中所示的相应连接点,或x不存在;
[0285]
l是连接子;
[0286]
!表示l与ab的连接点,其中l通过共价键连接至ab;
[0287]
r1选自由以下组成的组:
[0288][0289]
其中#和%表示式vi中所示的相应连接点;并且
[0290]
r2是苯基。
[0291]
在一些实施方案中,ab上的亲核基团或亲电基团是硫醇或胺。
[0292]
在一些实施方案中,所述方法还包括用还原剂处理ab以使ab中的一个或多个二硫键联还原,以提供亲核硫醇基团。
[0293]
在一些实施方案中,l由以下表示:
[0294][0295]
其中:
[0296]
z表示与ab的靶标基团结合的官能团;
[0297]
d表示与式x中所示的氨基的连接点;
[0298]
str是延伸物(stretcher);
[0299]
aa1和aa2各自独立地为氨基酸,其中aa
1-[aa2]m形成蛋白酶裂解位点;
[0300]
x为自降解基团;
[0301]
s是选自0和1的整数;
[0302]
m是选自由1、2、3和4组成的组的整数;并且
[0303]
o是选自0、1和2的整数。
[0304]
本文提供了一种药盒,其包括本文公开的抗体-药物缀合物或本文公开的药物组合物和使用说明书。
附图说明
[0305]
参考以下描述和附图将更好地理解本发明的这些和其他特征、方面和优点,其中:
[0306]
图1示出了称为连接子-毒素a(本文也称为lt-a)的连接子-毒素的结构。
[0307]
图2a示出了连接到抗体的连接子-毒素a(lt-a)的连接子-毒素部分的结构,其中##表示与组织因子(tf)抗体的连接点。图2b示出了包含连接子-毒素a(lt-a)的连接子-毒素部分和tf抗体的抗体药物缀合物的描述。
[0308]
图3a示出了tf阳性a431细胞在与同型对照或25a3-lt-a孵育4h、随后洗脱并培养68h后由ctg发光指示的细胞活力和计算的ic
50
。图3b示出了tf阳性a431细胞在与同型对照或25a3-lt-a孵育3天后由ctg发光指示的细胞活力和计算的ic
50
。
[0309]
图4a示出了免疫受损小鼠中mda-mb231三阴性乳腺癌细胞系异种移植物研究的结
果。用抗tf抗体药物缀合物25a3-lt-a、同型对照lt-a或媒介物对照腹膜内(ip)治疗动物,每周一次,持续2周,并且每两周一次评估体重和肿瘤大小。图4b示出了免疫受损小鼠中hpaf-ii胰腺癌细胞系异种移植物研究的结果。用抗tf抗体药物缀合物25a3-lt-a、同型对照lt-a或媒介物对照腹膜内(ip)治疗动物,每周一次,持续2周,并且每两周一次评估体重和肿瘤大小。
[0310]
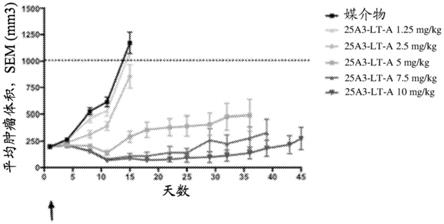
图5a-5d示出了单次施用的剂量范围研究的结果。当平均肿瘤大小为200mm3(箭头)时,用指定剂量的抗tf抗体药物缀合物25a3-lt-a或媒介物对照腹膜内治疗一次具有tf阳性hpaf-ii胰腺癌细胞异种移植物的免疫受损小鼠。图5a示出了每个实验组的平均肿瘤体积测量值
±
平均值的标准误差(sem)。图5b示出了用5mg/kg 25a3-lt-a治疗的个别小鼠的肿瘤体积测量值。图5c示出了用7.5mg/kg 25a3-lt-a治疗的个别小鼠的肿瘤体积测量值。图5d示出了用10mg/kg 25a3-lt-a治疗的个别小鼠的肿瘤体积测量值。
[0311]
图6示出了免疫受损小鼠中hpaf-ii胰腺癌细胞系异种移植物研究的平均浓度-时间曲线。用2.5mg/kg或10mg/kg的抗tf抗体-药物缀合物25a3-lt-a腹膜内治疗一次动物,并使用检测完整分子的pk测定测量25a3-lt-a的浓度。
[0312]
图7a-7d示出了晚期干预研究的结果,其中当平均肿瘤大小为500mm3时用7.5mg/kg或10mg/kg抗tf抗体药物缀合物25a3-lt-a或媒介物对照(pbs)腹膜内治疗一次tf阳性hpaf-ii胰腺癌细胞异种移植物。图7a示出了每个实验组的平均肿瘤体积测量值
±
sem。图7b示出了用媒介物对照(pbs)治疗的个别小鼠的肿瘤体积测量值。图7c示出了用7.5mg/kg 25a3-lt-a治疗的个别小鼠的肿瘤体积测量值。图7d示出了用10mg/kg 25a3-lt-a治疗的个别小鼠的肿瘤体积测量值。
[0313]
图8a-8e示出了具有患者来源的异种移植物的免疫受损小鼠的结果,当平均肿瘤大小为200mm3时,用10mg/kg的25a3-lt-a或媒介物对照(pbs)腹膜内治疗一次所述小鼠。每两周一次进行肿瘤大小评估。所述图示出了平均肿瘤体积
±
sem。图8a示出了ctg-0353小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入胃肿瘤碎片。图8b示出了ctg-0707小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入胃肿瘤碎片。图8c示出了ctg-0786小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入头颈癌肿瘤碎片。图8d示出了ctg-1076小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入膀胱肿瘤碎片。图8e示出了ctg-1130小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入头颈癌肿瘤碎片。
[0314]
图9a-9e示出了从免疫受损小鼠收集的患者来源的异种移植物肿瘤样品的免疫染色。对活检标本进行切片并染色以检测tf表达。图9a示出了已植入胃肿瘤碎片的ctg-0353小鼠的代表性免疫染色。图9b示出了已植入胃肿瘤碎片的ctg-0707小鼠的代表性免疫染色。图9c示出了已植入头颈癌肿瘤碎片的ctg-0786小鼠的代表性免疫染色。图9d示出了已植入膀胱肿瘤碎片的ctg-1076小鼠的代表性免疫染色。图9e示出了已植入头颈癌肿瘤碎片的ctg-1130小鼠的代表性免疫染色。
[0315]
图10a-10e示出了从免疫受损小鼠收集的患者来源的异种移植物肿瘤样品的结果。所述图示出了平均肿瘤体积
±
sem。图10a示出了hn2574小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入头颈癌肿瘤碎片。图10b示出了es0147小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入食管肿瘤碎片。图10c示出了es0214小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入食管肿瘤碎片。图10d示出了pa1332小鼠的肿瘤体积测量
值。在治疗之前,这些小鼠已被植入胰腺肿瘤碎片。图10e示出了pa6262小鼠的肿瘤体积测量值。在治疗之前,这些小鼠已被植入胰腺肿瘤碎片。
[0316]
图11a-11e示出了从免疫受损小鼠收集的患者来源的异种移植物肿瘤样品的免疫染色。对活检标本进行切片并染色以检测tf表达。图11a示出了已植入头颈癌肿瘤碎片的hn2574小鼠的代表性免疫染色。图11b示出了已植入食管肿瘤碎片的es0147小鼠的代表性免疫染色。图11c示出了已植入食管肿瘤碎片的es0214小鼠的代表性免疫染色。图11d示出了已植入胰腺肿瘤碎片的pa1332小鼠的代表性免疫染色。图11e示出了已植入胰腺肿瘤碎片的pa6262小鼠的代表性免疫染色。
[0317]
图12示出了三个卵巢癌或宫颈癌肿瘤患者来源的异种移植物的tf免疫染色和h评分,正如所示。
[0318]
图13a示出了免疫受损小鼠中tf阳性胃癌患者来源的异种移植物研究的结果。用25a3-lt-a或同型对照-lt-a腹膜内治疗一次动物,并且每两周一次评估体重和肿瘤大小。图13b示出了免疫受损小鼠中tf阳性肺癌患者来源的异种移植物研究的结果。用25a3-lt-a或同型对照-lt-a腹膜内治疗一次动物,并且每两周一次评估体重和肿瘤大小。
[0319]
图14a示出了在研究的第1、22和36天用指定剂量的25a3-lt-a或25a3-mmae治疗的食蟹猴(“cyno”)中的平均天冬氨酸转氨酶(ast)水平。图14b示出了在研究的第1、22和36天用指定剂量的25a3-lt-a或25a3-mmae治疗的食蟹猴中的平均丙氨酸转氨酶(alt)水平。
[0320]
图15a示出了在研究的第1、22和36天用指定剂量的25a3-mmae治疗的食蟹猴的平均嗜中性粒细胞计数。图15b示出了在研究的第1、22和36天用指定剂量的25a3-lt-a治疗的食蟹猴的平均嗜中性粒细胞计数。历史平均值来自从查尔斯河猴群收集的基线值(n个猴子》500)。
[0321]
图16a-16c示出了在指定治疗组中用指定剂量的25a3-mmae治疗的个别食蟹猴的嗜中性粒细胞计数。历史平均值来自从查尔斯河猴群收集的基线值(n个猴子》500)。图16a示出了用1.5mg/kg 25a3-mmae治疗的猴子的嗜中性粒细胞计数。图16b示出了用3mg/kg 25a3-mmae治疗的猴子的嗜中性粒细胞计数。图16c示出了用6mg/kg 25a3-mmae治疗的猴子的嗜中性粒细胞计数。
[0322]
图17a-17d示出了在指定治疗组中用指定剂量的25a3-lt-a治疗的个别食蟹猴的嗜中性粒细胞计数。历史平均值来自从查尔斯河猴群收集的基线值(n个猴子》500)。图17a示出了用3mg/kg 25a3-lt-a治疗的猴子的嗜中性粒细胞计数。图17b示出了用6mg/kg 25a3-lt-a治疗的猴子的嗜中性粒细胞计数。图17c示出了用12mg/kg 25a3-lt-a治疗的猴子的嗜中性粒细胞计数。图17d示出了用18mg/kg 25a3-lt-a治疗的猴子的嗜中性粒细胞计数。图18示出了在研究的第1、22和36天用指定剂量的25a3-lt-a或25a3-mmae治疗的食蟹猴的单核细胞计数。
具体实施方式
[0323]
1.定义
[0324]
除非另有定义,否则本文所用的所有领域术语、符号和其它科学术语旨在具有本领域技术人员通常所理解的含义。在一些情况下,为清楚和/或便于参考起见,本文定义了具有通常理解的含义的术语,并且本文此类定义的包括不必被解释为与本领域通常所理解
的相比表示出不同。本文所描述或引用的技术和程序通常被很好地理解,且通过使用常规方法被本领域技术人员通常采用,诸如,例如,广泛使用的分子克隆技术描述于sambrook等人,molecular cloning:a laboratory manual第4版(2012)cold spring harbor laboratory press,cold spring harbor,ny。适当时,通常根据制造商规定的方案和条件来实施包括使用市售试剂盒和试剂的程序,除非另外说明。
[0325]
如本文所用,单数形式“一个/种(a/an)”和“所述”包括复数个指示物,除非上下文中另外明确指示。除非另外明确指出,否则术语“包括”、“诸如”等旨在传达包括而不受限制。
[0326]
如本文所用,除非另外明确指出,否则术语“包括”还具体包括实施方案“由所列举的要素组成”和“基本上由所列举的要素组成”。
[0327]
术语“约”指示并涵盖指示值以及高于和低于该值的范围。在某些实施方案中,术语“约”表示指定值
±
10%、
±
5%或
±
1%。在某些实施方案中,在适用的情况下,术语“约”指示一个或多个指定值
±
该一个或多个值的一个标准偏差。
[0328]
术语“组织因子”、“tf”、“血小板组织因子”、“因子iii”、“凝血活酶”和“cd142”在本文中可互换用于指代tf或由细胞自然表达或由tf基因转染的细胞表达的tf的任何变体(例如,剪接变体和等位基因变体)、同工型和物种同系物。在一些方面,tf蛋白是由灵长类动物(例如,猴子或人)、啮齿动物(例如,小鼠或大鼠)、狗、骆驼、猫、牛、山羊、马、猪或绵羊自然表达的tf蛋白。在一些方面,tf蛋白为人tf(htf;seq id no:809)。在一些方面,tf蛋白为食蟹猴tf(ctf;seq id no:813)。在一些方面,tf蛋白为小鼠tf(mtf;seq id no:817)。在一些方面,tf蛋白为猪tf(ptf;seq id no:824)。tf是丝氨酸蛋白酶因子viia的细胞表面受体。它通常由血管周围和一些疾病环境中的某些细胞组成性表达。
[0329]
术语“抗体-药物缀合物”或“adc”是指包含任选地通过一个或多个连接子与一种或多种细胞毒性剂缀合的抗体的缀合物。术语“抗tf抗体-药物缀合物”或“抗tf adc”是指包含任选地通过一个或多个连接子与一种或多种细胞毒性剂缀合的抗tf抗体的缀合物。
[0330]
如本文所用,术语“tf抗体”、“抗tf抗体”是同义词。
[0331]
本文所用的术语“细胞毒性剂”是指抑制或阻止细胞功能和/或引起细胞死亡或破坏的物质。细胞毒性剂可为抗血管生成剂、促凋亡剂、抗有丝分裂剂、抗激酶剂、烷化剂、激素、激素激动剂、激素拮抗剂、趋化因子、药物、前药、毒素、酶、抗代谢药、抗生素、生物碱或放射性同位素。示例性细胞毒性剂包括:刺孢霉素、喜树碱、卡铂、伊立替康、sn-38、卡铂、喜树碱、环磷酰胺、阿糖胞苷、达卡巴嗪、多西他赛、更生霉素、柔红霉素、多柔比星、多柔比星、依托泊苷、伊达比星、拓扑替康、长春花生物碱、美登木素生物碱、美登木素生物碱类似物、吡咯并苯二氮杂紫杉烷类、多米卡星、多拉司他汀、奥里斯他汀及其衍生物。
[0332]“连接子”是指将一种组合物连接到另一种组合物(例如,将抗体连接到剂)的分子。本文所述的连接子可将抗体缀合至细胞毒性剂。示例性连接子包括不稳定的连接子、酸不稳定的连接子、光不稳定的连接子、带电荷的连接子、含二硫键的连接子、肽酶敏感的连接子、β-葡萄糖醛酸苷连接子、二甲基连接子、硫醚连接子和亲水连接子。连接子可为可裂解或不可裂解的。
[0333]
术语“免疫球蛋白”是指一类结构上相关的蛋白质,其通常包含两对多肽链:一对轻(l)链和一对重(h)链。在“完整的免疫球蛋白”中,所有这四条链由二硫键相互连接。免疫
球蛋白的结构已被很好地表征。参见,例如,paul,fundamental immunology第7版,第5章(2013)lippincott williams&wilkins,philadelphia,pa。简言之,每条重链通常包含重链可变区(vh)和重链恒定区(ch)。重链恒定区通常包含三个结构域,缩写为c
h1
、c
h2
和c
h3
。每条轻链通常包括轻链可变区(v
l
)和轻链恒定区。轻链恒定区通常包含一个结构域,缩写为c
l
。
[0334]
术语“抗体”在本文中以它的最广泛意义使用,并且包括包含一个或多个特异性结合抗原或表位的抗原结合结构域的某些类型的免疫球蛋白分子。抗体具体包括完整抗体(例如完整免疫球蛋白)、抗体片段和多特异性抗体。
[0335]
术语“替代支架”是指分子,其中一个或多个区域可多样化以产生一个或多个特异性结合抗原或表位的抗原结合结构域。在一些实施方案中,抗原结合结构域以类似于抗体的特异性和亲和力结合抗原或表位。示例性替代支架包括来源于以下的那些:纤连蛋白(例如,adnectinstm)、β三明治(例如,imab)、脂质运载蛋白(例如,抗)、eeti-ii/agrp、bpti/laci-d1/iti-d2(例如,kunitz结构域)、硫氧还蛋白肽适体、蛋白质a(例如,)、锚蛋白重复序列(例如,darpins)、γ-b-晶体蛋白/泛素(例如,人泛素(affilins))、ctld3(例如,四连接素(tetranectins))、fynomers和(ldlr-a模块)(例如,高亲和性多聚体(avimers))。关于替代支架的其他信息提供于binz等人,nat.biotechnol.,2005 23:1257-1268;skerra,current opin.in biotech.,2007 18:295-304;以及silacci等人,j.biol.chem.,2014,289:14392-14398;所述文献各自以引用的方式整体并入。
[0336]
术语“抗原结合结构域”意指能够与抗原或表位特异性结合的抗体的部分。抗原结合结构域的一个实例是由抗体的v
h-v
l
二聚体形成的抗原结合结构域。抗原结合结构域的另一个实例是通过由adnectin的第十纤连蛋白iii型结构域的某些环多样化而形成的抗原结合结构域。可在各种情况下发现抗原结合结构域,包括抗体和嵌合抗原受体(car),例如来源于抗体或抗体片段(诸如scfv)的car。
[0337]
术语“全长抗体”、“完整抗体”和“完全抗体”在本文中可互换用于指代具有与天然存在的抗体结构基本上类似的结构,以及具有包含fc区的重链的抗体。例如,当用于指代igg分子时,“全长抗体”是包含两条重链和两条轻链的抗体。
[0338]
术语“fc区”意指免疫球蛋白重链的c端区域,其在天然存在的抗体中与fc受体和补体系统的某些蛋白质相互作用。各种免疫球蛋白的fc区的结构以及其中包含的糖基化位点在本领域中已知。参见schroeder和cavacini,j.allergy clin.immunol.,2010,125:s41-52,其以引用的方式整体并入。fc区可为天然存在的fc区,或如本领域或本公开别处所述修饰的fc区。
[0339]
可将vh和v
l
区进一步细分为散布在更保守的区域中的高变的区域(“高变区(hvr)”;也称为“互补决定区”(cdr))。更保守的区域称为框架区(fr)。每个vh和v
l
通常包含三个cdr和四个fr,其以以下顺序(从n端到c端)排列:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。cdr参与抗原结合,并且影响抗原特异性和抗体的结合亲和力。参见kabat等人,sequences of proteins of immunological interest第5版(1991)public health service,national institutes of health,bethesda,md,其以引用的方式整体并入。
[0340]“互补决定区(cdr)”是指免疫球蛋白(ig或抗体)vhβ-片层框架的非框架区内的三个高变区(h1、h2或h3)中的一个,或抗体vlβ-片层框架的非框架区内的三个高变区(l1、l2或l3)中的一个。cdr是散布在框架区序列内的可变区序列。cdr在本领域中是众所周知的,
并且已被例如kabat定义为抗体可变(v)结构域内最具高变性的区域。参见kabat等人,j biol chem,1977,252:6609-6616和adv protein chem,1978,32:1-75,其各自以引用的方式整体并入。cdr在结构上也被chothia定义为不是保守的β-片层框架的部分的那些残基,并且因此能够适应不同的构象。参见chothia和lesk,j mol biol,1987,196:901-917,其以引用的方式整体并入。kabat和chothia命名法在本领域中是众所周知的。abm、contact和imgt也定义了cdr。通过比较许多结构已确定了标准抗体可变结构域内的cdr位置。参见morea等人,methods,2000,20:267-279和al-lazikani等人,j mol biol,1997,273:927-48,其各自以引用的方式整体并入。由于高变区内的残基数在不同的抗体中不同,因此相对于标准位置的其他残基通常在标准可变结构域编号方案中的残基编号旁边用a、b、c等编号(al-lazikani等人,同上)。此种术语是本领域技术人员众所周知的。
[0341]
许多高变区描述正被使用,并且包括在本文中。kabat cdr基于序列变异性,并且是最常用的。参见kabat等人(1992)sequences of proteins of immunological interest,diane publishing:2719,其以引用的方式整体并入。相反,chothia是指结构环的位置(chothia和lesk,同上)。abm高变区表示kabat cdr和chothia结构环之间的折衷,并且被oxford molecular的abm抗体建模软件使用。接触高变区基于对可用复杂晶体结构的分析。来自这些高变区中的每个的残基在表1中指出。
[0342]
最近,通用编号系统immunogenetics(imgt)information systemtm已被开发和广泛采用。参见lefranc等人,dev comp immunol,2003,27:55-77,其以引用的方式整体并入。imgt是集成的信息系统,所述信息系统专门研究人和其他脊椎动物的免疫球蛋白(ig)、t细胞受体(tr)和主要组织相容性复合体(mhc)。imgt cdr是指氨基酸序列和在轻链或重链内的位置。由于免疫球蛋白可变结构域的结构内cdr的“位置”在物种之间是保守的,并且存在于称为环的结构中,所以通过使用根据结构特征排列可变结构域序列的编号系统,cdr和框架残基易于识别。kabat、chothia和imgt编号之间的对应关系在本领域中也是众所周知的(lefranc等人,同上)。本文所示的exemplary系统组合了kabat和chothia cdr定义。
[0343]
表1
[0344][0345]
来自任何脊椎动物物种的轻链可基于其恒定结构域的序列被分配为两种类型(kappa(κ)和lambda(λ))中的一种。
[0346]
来自任何脊椎动物物种的重链可被分配为五种不同类别(或同型)中的一种:iga、igd、ige、igg和igm。这些类别还分别定名为α、δ、ε、γ和μ。根据序列和功能的差异,igg和iga类别被进一步分为亚类。人类表达以下子类:igg1、igg2、igg3、igg4、iga1和iga2。
[0347]
术语“恒定区”或“恒定结构域”是指轻链和重链的羧基端部分,其不直接参与抗体与抗原的结合,但是表现出各种效应子功能,诸如与fc受体的相互作用。术语是指免疫球蛋白分子的部分,相对于免疫球蛋白的另一部分(含有抗原结合位点的可变结构域)具有更保守的氨基酸序列。恒定结构域含有重链的c
h1
、c
h2
和c
h3
结构域以及轻链的c
l
结构域。
[0348]
当提及抗体重链恒定区中的残基时,通常使用“eu编号方案”(例如,如报告于kabat等人,同上中)。除非另外说明,否则eu编号方案用于提及本文所述的抗体重链恒定区中的残基。
[0349]“抗体片段”包含完整抗体的一部分,诸如完整抗体的抗原结合区或可变区。抗体片段包括例如fv片段、fab片段、f(ab')2片段、fab'片段、scfv(sfv)片段和scfv-fc片段。
[0350]“fv”片段包含一个重链可变结构域和一个轻链可变结构域的非共价连接二聚体。
[0351]
除了重链和轻链可变结构域,“fab”片段还包含轻链的恒定结构域和重链的第一恒定结构域(c
h1
)。fab片段可例如通过重组方法或通过木瓜蛋白酶消化全长抗体来产生。
[0352]“f(ab’)
2”片段含有两个在铰链区附近由二硫键接合的fab’片段。f(ab’)2片段可例如通过重组方法或通过胃蛋白酶消化完整抗体来产生。f(ab’)片段可例如通过用β-巯基乙醇处理来解离。
[0353]“单链fv”或“sfv”或“scfv”抗体片段包含单个多肽链中的vh结构域和v
l
结构域。vh和v
l
通常通过肽连接子连接。参见pl
ü
ckthun a.(1994)。可使用任何适合连接子。在一些实施方案中,连接子为(ggggs)n(seq id no:823)。在一些实施方案中,n=1、2、3、4、5或6。参见antibodies from escherichia coli。于rosenberg m.和moore g.p.(编辑),the pharmacology of monoclonal antibodies第113卷(第269-315页).springer-verlag,new york,其以引用的方式整体并入。
[0354]“scfv-fc”片段包含scfv连接于fc结构域。例如,fc结构域可连接于scfv的c端。视scfv中的可变结构域的定向(即v
h-v
l
或v
l-vh)而定,fc结构域可在vh或v
l
之后。可使用本领域中已知或本文所述的任何适合fc结构域。
[0355]
术语“单结构域抗体”是指其中抗体的一个可变结构域在不存在另一可变结构域下特异性结合抗原的分子。单结构域抗体及其片段描述于arabi ghahroudi等人,febs letters,1998,414:521-526以及muyldermans等人,trends in biochem.sci.,2001,26:230-245中,其各自以引用的方式整体并入。单结构域抗体也被称为sdab或纳米抗体。
[0356]“多特异性抗体”是包含两个或更多个共同地特异性结合两个或更多个不同表位的不同抗原结合结构域的抗体。两个或更多个不同表位可为同一抗原(例如由细胞表达的单一tf分子)上或不同抗原(例如tf分子和非tf分子)上的表位。在一些方面,多特异性抗体结合两个不同表位(即“双特异性抗体”)。在一些方面,多特异性抗体结合三个不同表位(即“三特异性抗体”)。在一些方面,多特异性抗体结合四个不同表位(即“四特异性抗体”)。在一些方面,多特异性抗体结合五个不同表位(即“五特异性抗体”)。在一些方面,多特异性抗体结合6个、7个、8个或更多个不同表位。每种结合特异性可以任何适合效价存在。在本公开别处提供了多特异性抗体的实例。
[0357]“单特异性抗体”是包含一个或多个特异性结合单一表位的结合位点的抗体。单特异性抗体的实例是天然存在的igg分子,所述igg分子虽然是二价的(即具有两个抗原结合结构域),但在两个抗原结合结构域中的每个处识别相同表位。结合特异性可以任何适合效
价存在。
[0358]
术语“单克隆抗体”是指来自基本上同质抗体的群体的抗体。基本上同质抗体的群体包含基本上类似,并且结合一种或多种相同表位的抗体,例外之处是可通常在单克隆抗体的产生期间产生的变体。此类变体通常仅少量存在。单克隆抗体通常通过包括从多种抗体选择单一抗体的方法获得。例如,选择方法可为从多种克隆诸如杂交瘤克隆、噬菌体克隆、酵母克隆、细菌克隆或其他重组dna克隆的汇合物选择独特克隆。所选抗体可加以进一步改变,例如以使对靶标的亲和力改进(“亲和力成熟”),以使抗体人源化,以使它在细胞培养中的产生改进,和/或以使它在受试者中的免疫原性降低。
[0359]
术语“嵌合抗体”是指其中重链和/或轻链的一部分源于特定来源或物种,而重链和/或轻链的其余部分源于不同来源或物种的抗体。
[0360]
非人抗体的“人源化”形式是含有源于非人抗体的最小序列的嵌合抗体。人源化抗体大体上是人抗体(接受者抗体),其中来自一个或多个cdr的残基被来自非人抗体(供者抗体)的一个或多个cdr的残基替代。供者抗体可为具有所需特异性、亲和力或生物作用的任何适合非人抗体,诸如小鼠、大鼠、兔、鸡或非人灵长类动物抗体。在一些情况下,接受者抗体的所选框架区残基被来自供者抗体的相应框架区残基替代。人源化抗体还可包含不见于接受者抗体或供者抗体中的残基。可进行此类修饰以进一步改进抗体功能。关于更多详情,参见jones等人,nature,1986,321:522-525;riechmann等人,nature,1988,332:323-329;以及presta,curr.op.struct.biol.,1992,2:593-596,所述文献各自以引用的方式整体并入。
[0361]“人抗体”是具有对应于由人或人细胞产生或源于非人来源的抗体的氨基酸序列的氨基酸序列的抗体,所述非人来源利用人抗体谱系或人抗体编码序列(例如从人来源获得或重新设计)。人抗体明确排除人源化抗体。
[0362]“经分离的抗体”或“经分离的核酸”是已经从其天然环境的组分中分离和/或回收的抗体或核酸分子。天然环境的组分可包括酶、激素和其他蛋白质或非蛋白质物质。在一些实施方案中,例如通过使用旋转杯测序仪,将经分离的抗体纯化至足以获得n端或内部氨基酸序列的至少15个残基的程度。在一些实施方案中,在还原或非还原条件下通过凝胶电泳(例如,sds-page)将经分离的抗体纯化至同质,并其中通过考马斯蓝染色或银染色检测。在一些实施方案中,经分离的抗体可包括在重组细胞内原位的抗体,因为抗体天然环境的至少一种组分不存在。在一些方面,通过至少一个纯化步骤制备经分离的抗体或经分离的核酸。在一些实施方案中,将经分离的抗体或经分离的核酸纯化至至少80重量%、85重量%、90重量%、95重量%或99重量%。在一些实施方案中,将经分离的抗体或经分离的核酸纯化至至少80体积%、85体积%、90体积%、95体积%或99体积%。在一些实施方案中,将经分离的抗体或经分离的核酸提供为包含至少85重量%、90重量%、95重量%、98重量%、99重量%至100重量%的抗体或核酸的溶液。在一些实施方案中,将经分离的抗体或经分离的核酸提供为包含85体积%、90体积%、95体积%、98体积%、99体积%至100体积%的抗体或核酸的溶液。
[0363]“亲和力”是指分子(例如抗体)的单一结合位点与它的结合配偶体(例如抗原或表位)之间的非共价相互作用的总和的强度。除非另外指示,否则如本文所用,“亲和力”是指反映结合对的成员(例如抗体和抗原或表位)之间的1:1相互作用的固有结合亲和力。分子x对
它的配偶体y的亲和力可由解离平衡常数(kd)表示。以下更详细描述促成解离平衡常数的动力学分量。亲和力可通过本领域中已知的常用方法测量,所述方法包括本文所述的那些,诸如表面等离子体共振(spr)技术(例如)或生物层干涉测量术(例如)。
[0364]
关于抗体与靶标分子的结合,术语“结合”特定抗原(例如多肽靶标)或特定抗原上的表位、与特定抗原(例如多肽靶标)或特定抗原上的表位“特异性结合”、“特异性结合”特定抗原(例如多肽靶标)或特定抗原上的表位、“对特定抗原(例如多肽靶标)或特定抗原上的表位具有特异性”、“选择性结合”特定抗原(例如多肽靶标)或特定抗原上的表位和“对特定抗原(例如多肽靶标)或特定抗原上的表位具有选择性”意指结合在可测量程度上不同于非特异性或非选择性相互作用(例如与非靶标分子的相互作用)。特异性结合可例如通过测量与靶标分子的结合以及将它和与非靶标分子的结合进行比较来测量。特异性结合还可通过与模拟在靶标分子上识别的表位的对照分子的竞争来测定。在那个情况下,如果抗体与靶标分子的结合由对照分子竞争性抑制,那么指示特异性结合。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约50%。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约40%。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约30%。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约20%。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约10%。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约1%。在一些方面,tf抗体对非靶标分子的亲和力小于对tf的亲和力的约0.1%。
[0365]
如本文所用的术语“k
d”(s-1
)是指特定抗体-抗原相互作用的解离速率常数。这个值也被称为k
解离
值。
[0366]
如本文所用的术语“k
a”(m-1
×
s-1
)是指特定抗体-抗原相互作用的缔合速率常数。这个值也被称为k
缔合
值。
[0367]
如本文所用的术语“k
d”(m)是指特定抗体-抗原相互作用的解离平衡常数。kd=kd/ka。在一些实施方案中,抗体的亲和力以关于此种抗体与它的抗原之间的相互作用的kd描述。为明晰起见,如本领域中所知,较小kd值指示较高亲和相互作用,而较大kd值指示较低亲和相互作用。
[0368]
如本文所用的术语“k
a”(m-1
)是指特定抗体-抗原相互作用的缔合平衡常数。ka=ka/kd。
[0369]“亲和力成熟的”抗体是相对于亲本抗体(即衍生或设计改变的抗体的抗体)具有一种或多种改变(例如,在一个或多个cdr或fr中)的抗体,与不具有一种或多种改变的亲本抗体相比,所述抗体导致抗体对其抗原的亲和力提高。在一些实施方案中,亲和力成熟的抗体对靶抗原具有纳摩尔或皮摩尔的亲和力。亲和力成熟的抗体可使用本领域已知的多种方法来产生。例如,marks等人(bio/technology,1992,10:779-783,其以引用的方式整体并入)描述了通过vh和v
l
结构域改组的亲和力成熟。cdr和/或框架残基的随机诱变描述于例如barbas等人,proc.nat.acad.sci.u.s.a.,1994,91:3809-3813;schier等人,gene,1995,169:147-155;yelton等人,j.immunol.,1995,155:1994-2004;jackson等人,j.immunol.,1995,154:3310-33199;以及hawkins等人,j.mol.biol.,1992,226:889-896;其各自以引用的方式整体并入。
[0370]“fc效应子功能”是指由抗体的fc区介导的那些生物活性,所述活性可视抗体同型
而变化。抗体效应子功能的实例包括用以使补体依赖性细胞毒性(cdc)活化的c1q结合、用以使抗体依赖性细胞性细胞毒性(adcc)和抗体依赖性细胞性吞噬(adcp)活化的fc受体结合。
[0371]
当在本文中在两个或更多个抗体的情形下使用时,术语“与
……
竞争”或“与
……
交叉竞争”指示所述两个或更多个抗体竞争结合抗原(例如tf)。在一个示例性测定中,将tf包被在表面上,并且使其与第一tf抗体接触,此后,添加第二tf抗体。在另一示例性测定中,将第一tf抗体包被在表面上,并且使其与tf接触,接着添加第二tf抗体。如果在任一测定中,第一tf抗体的存在使第二tf抗体的结合降低,那么抗体彼此竞争。术语“与
……
竞争”还包括抗体的组合,其中一种抗体使另一抗体的结合降低,但其中在以相反顺序添加抗体时无竞争被观察到。然而,在一些实施方案中,第一抗体和第二抗体抑制彼此的结合,无论添加它们的顺序如何。在一些实施方案中,一种抗体使另一抗体与它的抗原的结合降低至少25%、至少50%、至少60%、至少70%、至少80%、至少85%、至少90%或至少95%。熟练技术人员可基于抗体对tf的亲和力以及抗体的效价来选择抗体的在竞争测定中使用的浓度。这个定义中所述的测定是说明性的,并且熟练技术人员可利用任何适合测定来确定抗体是否彼此竞争。适合测定例如描述于cox等人,“immuno assay methods”,assay guidance manual[internet],2014年12月24日更新(www.ncbi.nlm.nih.gov/books/nbk92434/;2015年9月29日访问);silman等人,cytometry,2001,44:30-37;以及finco等人,j.pharm.biomed.anal.,2011,54:351-358中;其各自以引用的方式整体并入。如2019年1月4日提交的pct/us2019/12427的实施例8中提供的,第25组的抗体和第43组的抗体相互竞争结合到人tf,而来自第1组、第29组、第39组和第54组的抗体并不与第25组和第43组的抗体竞争结合到人tf。
[0372]
如本文所用,当可在fortebio octet上用小鼠抗原测量kd值时,认为特异性结合人抗原的抗体与小鼠来源的相同抗原结合。当小鼠抗原的kd值不大于相应人抗原的对应kd值的20倍时,认为特异性结合人抗原的抗体与小鼠来源的相同抗原“交叉反应”。例如,以下抗体不结合小鼠tf:抗体m1593,所述抗体m1593描述于美国专利号8,722,044、8,951,525和8,999,333中,其各自出于所有目的以引用的方式整体并入本文;人源化5g9抗体,所述人源化5g9抗体描述于ngo等人,2007,int j cancer,120(6):1261-1267,其以引用的方式整体并入;以及嵌合alt-836抗体,所述嵌合alt-836抗体描述于hong等人,2012,j nucl med,53(11):1748-1754,其以引用的方式整体并入。如2019年1月4日提交的pct/us2019/12427的实施例1和实施例2中所提供的,来自第25组和第43组的tf抗体结合小鼠tf,例如,tf抗体25g、25g1、25g9和43d8与小鼠tf交叉反应。
[0373]
如本文所用,当食蟹猴抗原的kd值不大于相应人抗原的对应kd值的15倍时,认为特异性结合人抗原的抗体与食蟹猴来源的相同抗原“交叉反应”。如2019年1月4日提交的pct/us2019/12427的实施例1中所提供的,来自第1组、第25组、第29组、第39组、第43组和第54组的所有测试抗体与食蟹猴tf交叉反应。
[0374]
术语“表位”意指抗原的由抗体特异性结合的部分。表位常常包括表面可及氨基酸残基和/或糖侧链,并且可具有特定三维结构特征以及特定电荷特征。构象性表位和非构象性表位的区别在于在变性溶剂存在下,与前者而非与后者的结合可丧失。表位可包含直接涉及于结合中的氨基酸残基以及不直接涉及于结合中的其他氨基酸残基。抗体结合的表位
可使用用于表位确定的已知技术来确定,诸如像测试抗体与具有不同点突变的tf变体或与嵌合tf变体的结合。
[0375]
多肽序列与参考序列之间的“同一性”百分比被定义为在比对序列并引入空位(如果需要的话)以实现最大百分比的序列同一性之后,多肽序列中与参考序列中的氨基酸残基相同的氨基酸残基的百分比。出于确定氨基酸序列同一性百分比的目的的比对可以属于本领域中的技能的各种方式实现,例如使用可公开获得的计算机软件,诸如blast、blast-2、align、megalign(dnastar)、clustalw、clustal omega或muscle软件。本领域技术人员可以确定用于比对序列的适当参数,包括实现在所比较序列的全长上实现最大比对所需的任何算法。
[0376]“保守性取代”或“保守性氨基酸取代”是指用化学或功能类似的氨基酸取代氨基酸。提供类似氨基酸的保守性取代表在本领域中是众所周知的。以举例的方式,在一些实施方案中,表2-4中提供的氨基酸基团被认为是彼此的保守性取代。
[0377]
表2:在某些实施方案中,被认为是彼此的保守性取代的所选氨基酸组。
[0378]
酸性残基d和e碱性残基k、r和h亲水性不带电残基s、t、n和q脂族不带电残基g、a、v、l和i非极性不带电残基c、m和p芳族残基f、y和w
[0379]
表3:在某些实施方案中,被认为是彼此的保守性取代的另外所选氨基酸组。
[0380]
第1组a、s和t第2组d和e第3组n和q第4组r和k第5组i、l和m第6组f、y和w
[0381]
表4:在某些实施方案中,被认为是彼此的保守性取代的进一步选择的氨基酸组。
[0382]
第a组a和g第b组d和e第c组n和q第d组r、k和h第e组i、l、m、v第f组f、y和w第g组s和t第h组c和m
[0383]
其他保守性取代可见于例如creighton,proteins:structures and molecular properties第2版(1993)w.h.freeman&co.,new york,ny。通过对亲本抗体中的氨基酸残基进行一个或多个保守性取代而产生的抗体称为“保守性修饰的变体”。
[0384]
术语“氨基酸”是指二十种常见的天然存在的氨基酸。天然存在的氨基酸包括丙氨酸(ala;a)、精氨酸(arg;r)、天冬酰胺(asn;n)、天冬氨酸(asp;d)、半胱氨酸(cys;c);谷氨酸(glu;e)、谷氨酰胺(gln;q)、甘氨酸(gly;g);组氨酸(his;h)、异亮氨酸(ile;i)、亮氨酸(leu;l)、赖氨酸(lys;k)、蛋氨酸(met;m)、苯丙氨酸(phe;f)、脯氨酸(pro;p)、丝氨酸(ser;s)、苏氨酸(thr;t)、色氨酸(trp;w)、酪氨酸(tyr;y)和缬氨酸(val;v)。
[0385]
如本文所用,术语“载体”是指能够使与其连接的另外的核酸增殖的核酸分子。术语包括作为自我复制的核酸结构的载体以及并入已经引入载体的宿主细胞的基因组内的载体。某些载体能够引导与其可操作性连接的核酸的表达。本文将此类载体称为“表达载体”。
[0386]
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用并且是指已经引入外源核酸的细胞,以及此类细胞的后代。宿主细胞包括“转化体”(或“转化的细胞”)和“转染子”(或“转染的细胞”),其各自包括原代转化或转染的细胞及其衍生的后代。此类后代的核酸含量不可能与亲代细胞完全相同,并且可能含有突变。
[0387]
术语“治疗(treating)”(及其变体,诸如“治疗(treat)”或“治疗(treatment)”)是指试图改变有需要的受试者中疾病或疾患的自然进程的临床干预。可在预防上和在临床病理过程期间进行治疗。理想的治疗效果包括:防止疾病的发生或复发、缓解症状、消除疾病的任何直接或间接的病理学后果、防止转移、降低疾病进展的速率、改善或减轻疾病状态以及缓解或改善预后。
[0388]
如本文所用,术语“治疗有效量”或“有效量”是指当向受试者施用时有效治疗疾病或病症的抗体或药物组合物的量。
[0389]
如本文所用,术语“受试者”意指哺乳动物受试者。示例性受试者包括人、猴子、狗、猫、小鼠、大鼠、牛、马、骆驼、山羊、兔子、猪和绵羊。在某些实施方案中,受试者为人。在一些实施方案中,受试者患有可用本文提供的抗体治疗的疾病或疾患。在一些方面,疾病或疾患为癌症。在一些方面,疾病或疾患涉及新生血管或血管炎症。在某些方面,涉及新生血管的疾病或疾患为癌症。
[0390]
使用术语“包装说明书”是指通常在治疗或诊断产品(例如,试剂盒)的商业包装中包括的说明,其含有关于使用此类治疗或诊断产品的适应症、用法、剂量、施用、联合疗法、禁忌症和/或警告的信息。
[0391]“化学治疗剂”是指用于治疗癌症的化合物。化学治疗剂包括“抗激素剂”或“内分泌治疗剂”,其作用是调节、减少、阻断或抑制可促进癌症生长的激素的作用。
[0392]
术语“细胞抑制剂”是指体外或体内阻滞细胞生长的化合物或组合物。在一些实施方案中,细胞抑制剂是减少s期细胞百分比的剂。在一些实施方案中,细胞抑制剂将s期细胞百分比减少至少约20%、至少约40%、至少约60%、或至少约80%。
[0393]
术语“药物组合物”是指以允许包含在其中的活性成分的生物活性对治疗受试者有效的形式的制剂,并且在药物组合物中提供的量中,其不含有对受试者具有不可接受的毒性的其它组分。
[0394]
术语“调节(modulate/modulation)”是指降低或抑制,或替代地,活化或增加所叙述变量。
[0395]
术语“增加”和“活化”是指所叙述变量增加10%、20%、30%、40%、50%、60%、
70%、75%、80%、85%、90%、95%、100%、2倍、3倍、4倍、5倍、10倍、20倍、50倍、100倍或更大。
[0396]
术语“降低”和“抑制”是指所叙述变量降低10%、20%、30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、2倍、3倍、4倍、5倍、10倍、20倍、50倍、100倍或更多。
[0397]
术语“激动”是指使受体信号传导活化以诱导与受体的活化相关的生物响应。“激动剂”是结合受体以及使受体激动的实体。
[0398]
术语“拮抗”是指使受体信号传导抑制以抑制与受体的活化相关的生物响应。“拮抗剂”是结合受体以及使受体拮抗的实体。
[0399]“烷基”是指具有1至20个碳原子的直链或支链饱和烃基(“c
1-20
烷基”)的基团。在一些实施方案中,烷基具有1至12个碳原子(“c
1-12
烷基”)。在一些实施方案中,烷基具有1至10个碳原子(“c
1-10
烷基”)。在一些实施方案中,烷基具有1至9个碳原子(“c
1-9
烷基”)。在一些实施方案中,烷基具有1至8个碳原子(“c
1-8
烷基”)。在一些实施方案中,烷基具有1至7个碳原子(“c
1-7
烷基”)。在一些实施方案中,烷基具有1至6个碳原子(“c
1-6
烷基”,在本文中也称为“低级烷基”)。在一些实施方案中,烷基具有1至5个碳原子(“c
1-5
烷基”)。在一些实施方案中,烷基具有1至4个碳原子(“c
1-4
烷基”)。在一些实施方案中,烷基具有1至3个碳原子(“c
1-3
烷基”)。在一些实施方案中,烷基具有1至2个碳原子(“c
1-2
烷基”)。在一些实施方案中,烷基具有1个碳原子(“c1烷基”)。在一些实施方案中,烷基具有2至6个碳原子(“c
2-6
烷基”)。c
1-6
烷基的实例包括甲基(c1)、乙基(c2)、正丙基(c3)、异丙基(c3)、正丁基(c4)、叔丁基(c4)、仲丁基(c4)、异丁基(c4)、正戊基(c5)、3-戊基(c5)、戊基(c5)、新戊基(c5)、3-甲基-2-丁烷基(c5)、叔戊基(c5)和正己基(c6)。烷基的其他实例包括正庚基(c7)、正辛基(c8)等。除非另外指明,否则烷基的每个实例独立地任选地被取代,即未取代(“未取代的烷基”)或被一个或多个取代基取代(“被取代的烷基”);例如,例如1至5个取代基、1至3个取代基或1个取代基的实例。在某些实施方案中,烷基是未取代的c
1-10
烷基(例如,-ch3)。在某些实施方案中,烷基是取代的c
1-10
烷基。常见的烷基缩写包括me(-ch3)、et(-ch2ch3)、ipr(-ch(ch3)2)、npr(-ch2ch2ch3)、n-bu(-ch2ch2ch2ch3)或i-bu(-ch2ch(ch3)2)。
[0400]“亚烷基”是指其中两个氢被去除以提供二价基团并且可为取代或未取代的烷基。未取代的亚烷基包括但不限于亚甲基(-ch
2-)、亚乙基(-ch2ch
2-)、亚丙基(-ch2ch2ch
2-)、亚丁基(-ch2ch2ch2ch
2-)、亚戊基(-ch2ch2ch2ch2ch
2-)、亚己基(-ch2ch2ch2ch2ch2ch
2-)等。示例性取代的亚烷基(例如,被一个或多个烷基(甲基)取代)包括但不限于取代的亚甲基(-ch(ch3)-、(-c(ch3)
2-)、取代的亚乙基(-ch(ch3)ch
2-、-ch2ch(ch3)-、-c(ch3)2ch
2-、-ch2c(ch3)
2-)、取代的亚丙基(-ch(ch3)ch2ch
2-、-ch2ch(ch3)ch
2-、-ch2ch2ch(ch3)-、-c(ch3)2ch2ch
2-、-ch2c(ch3)2ch
2-、-ch2ch2c(ch3)
2-)等。
[0401]“卤基”或“卤素”是指氟(f)、氯(cl)、溴(br)和碘(i)。在某些实施方案中,卤基是氟或氯。
[0402]
如本文所用,术语“自降解基团”是指在化合物或缀合物的两个基团之间提供稳定键形成的部分或残基,但其在活化(例如亲核攻击)后变得不稳定,导致所述部分或残基快速裂解以及两个基团的分离。自降解基团的化学描述于例如alouane,a.等人,“self-immolative spacers:kinetic aspects,structure-property relationships,and applications”,angew.chem.int.ed.,2015,54,7492-7509以及kolakowski,r.v.等人,“the methylene alkoxy carbamate self-immolative unit:utilization of the targeted delivery of alcohol-containing payloads with antibody-drug conjugates”,angew.chem.int.ed.,2016,55,7948-7951。
[0403]
2.tf抗体
[0404]
2.1.tf结合
[0405]
本文提供了特异性结合tf的经分离的抗体。在一些方面,tf为htf(seq id no:809)。在一些方面,tf为ctf(seq id no:813)。在一些方面,tf为mtf(seq id no:817)。在一些方面,tf为兔tf(seq id no:832)。在一些方面,tf为ptf(seq id no:824)。在一些实施方案中,本文提供的抗体特异性结合htf(seq id no:809)、ctf(seq id no:813)、mtf(seq id no:817)、兔tf(seq id no:832)和ptf(seq id no:824)。在一些实施方案中,本文提供的抗体特异性结合htf(seq id no:809)、ctf(seq id no:813)、mtf(seq id no:817)和ptf(seq id no:824)。在一些实施方案中,本文提供的抗体特异性结合htf(seq id no:809)、ctf(seq id no:813)和mtf(seq id no:817)。在一些实施方案中,本文提供的抗体特异性结合htf(seq id no:809)和ctf(seq id no:813)。在一些实施方案中,本文提供的抗体不结合mtf(seq id no:817)。在一些实施方案中,本文提供的抗体不结合ptf(seq id no:824)。在一些实施方案中,本文提供的抗体不结合兔tf(seq id no:832)。
[0406]
在各种实施方案中,本文提供的抗体特异性结合人tf的胞外结构域(seq id no:810)。
[0407]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,seq id no:810所示序列的氨基酸残基149处的突变为k149n。
[0408]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与包含seq id no:810所示序列的氨基酸残基68处的突变的变体tf胞外结构域之间的结合大于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,seq id no:810所示序列的氨基酸残基68处的突变为k68n。
[0409]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,seq id no:810所示序列的氨基酸残基171和197处的突变为n171h和t197k。
[0410]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0411]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨
基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0412]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0413]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0414]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至219被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至224替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0415]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至189被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至194替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0416]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0417]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基167至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基172至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0418]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0419]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与包含seq id no:810所示序列的氨基酸残基68处的突变的变体tf胞外结构域之间的结合大于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构
域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且本文提供的抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,seq id no:810所示序列的氨基酸残基149处的突变为k149n;并且seq id no:810所示序列的氨基酸残基68处的突变为k68n。
[0420]
在一些实施方案中,如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,本文提供的抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与包含seq id no:810所示序列的氨基酸残基68处的突变的变体tf胞外结构域之间的结合大于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至219被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至224替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至189被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至194替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:
810所示序列的氨基酸残基159至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;本文提供的抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基167至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基172至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且本文提供的抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于本文提供的抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,seq id no:810所示序列的氨基酸残基149处的突变为k149n;seq id no:810所示序列的氨基酸残基68处的突变为k68n;并且seq id no:810所示序列的氨基酸残基171和197处的突变为n171h和t197k。
[0421]
在一些实施方案中,与参考抗体m1593相比,如由凝血酶生成测定法(tga)确定的,本文提供的抗体在抑制人凝血酶生成上是惰性的,其中参考抗体m1593包含seq id no:821的vh序列和seq id no:822的v
l
序列。
[0422]
在一些实施方案中,如由凝血酶生成测定法(tga)确定的,本文提供的抗体不抑制人凝血酶生成。在某些实施方案中,如由凝血酶生成测定法(tga)确定的,本文提供的抗体允许人凝血酶生成。
[0423]
在一些实施方案中,本文提供的抗体在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf。在某些实施方案中,本文提供的抗体不干扰tf:fviia将fx转化为fxa的能力。
[0424]
在一些实施方案中,本文提供的抗体在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf。在某些实施方案中,本文提供的抗体不与人fviia竞争结合到人tf。
[0425]
在一些实施方案中,本文提供的抗体结合人tf的胞外结构域;在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;并且如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成。
[0426]
在一些实施方案中,本文提供的抗体结合人tf的胞外结构域;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;不干扰tf:fviia将fx转化为fxa的能力;并且不与人fviia竞争结合到人tf。
[0427]
在一些实施方案中,本文提供的抗体在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf的胞外结构域;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;不干扰tf:fviia将fx转化为fxa的能力;并且不与人fviia竞争结合到人tf。
[0428]
在一些实施方案中,本文提供的抗体抑制fviia依赖性tf信号传导。
[0429]
在一些实施方案中,本文提供的抗体在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf的胞外结构域;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;不干扰tf:fviia将fx转化为fxa的能力;不与
人fviia竞争结合到人tf;并且结合到食蟹猴和小鼠tf。
[0430]
在一些实施方案中,本文提供的抗体在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf的胞外结构域;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;不干扰tf:fviia将fx转化为fxa的能力;不与人fviia竞争结合到人tf;结合到食蟹猴、小鼠和猪tf。
[0431]
在一些实施方案中,本文提供的抗体结合人tf的胞外结构域;抑制fviia依赖性tf信号传导;并且结合到食蟹猴tf。
[0432]
2.2.tf抗体序列
[0433]
2.2.1.重链
[0434]
在一些实施方案中,本文提供的抗体包含重链序列。说明性重链序列提供于表22中。重链序列可以是来自鉴定为25a的抗体克隆的重链序列。重链序列可以是来自鉴定为25a3的抗体克隆的重链序列。重链序列可以是来自鉴定为25a5的抗体克隆的重链序列。重链序列可以是来自鉴定为25a5t的抗体克隆的重链序列。重链序列可以是来自鉴定为25g的抗体克隆的重链序列。重链序列可以是来自鉴定为25g1的抗体克隆的重链序列。重链序列可以是来自鉴定为25g9的抗体克隆的重链序列。
[0435]
2.2.2.轻链
[0436]
在一些实施方案中,本文提供的抗体包含轻链序列。说明性轻链序列提供于表22中。轻链序列可以是来自鉴定为25a的抗体克隆的轻链序列。轻链序列可以是来自鉴定为25a3的抗体克隆的轻链序列。轻链序列可以是来自鉴定为25a5的抗体克隆的轻链序列。轻链序列可以是来自鉴定为25a5t的抗体克隆的轻链序列。轻链序列可以是来自鉴定为25g的抗体克隆的轻链序列。轻链序列可以是来自鉴定为25g1的抗体克隆的轻链序列。轻链序列可以是来自鉴定为25g9的抗体克隆的轻链序列。
[0437]
2.2.3.vh结构域
[0438]
在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:113的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:151的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:189的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:836的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:227的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:265的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:303的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:763的vh序列。在一些实施方案中,本文提供的抗体包含seq id no:868的vh序列。
[0439]
在一些实施方案中,本文提供的抗体包含与选自seq id no:113、151、189、836、227、265、303、763、868和870的说明性vh序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的vh序列。在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh序列,其具有多至1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变
体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0440]
2.2.4.v
l
结构域
[0441]
在一些实施方案中,本文提供的抗体包含选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:114的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:152的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:190的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:837的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:228的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:266的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:304的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:764的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:869的v
l
序列。在一些实施方案中,本文提供的抗体包含seq id no:871的v
l
序列。
[0442]
在一些实施方案中,本文提供的抗体包含与选自seq id no:114、152、190、837、228、266、304、764、869和871的说明性v
l
序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的v
l
序列。在一些实施方案中,本文提供的抗体包含选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
序列,其具有多至1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0443]
2.2.5.v
h-v
l
组合
[0444]
在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh序列和选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
序列。
[0445]
在一些实施方案中,本文提供的抗体包含seq id no:113的vh序列和seq id no:114的vl序列。在一些实施方案中,本文提供的抗体包含seq id no:151的vh序列和seq id no:152的vl序列。在一些实施方案中,本文提供的抗体包含seq id no:189的vh序列和seq id no:190的vl序列。
[0446]
在一些实施方案中,本文提供的抗体包含seq id no:836的vh序列和seq id no:837的vl序列。在一些实施方案中,本文提供的抗体包含seq id no:227的vh序列和seq id no:228的vl序列。在一些实施方案中,本文提供的抗体包含seq id no:265的vh序列和seq id no:266的vl序列。
[0447]
在一些实施方案中,本文提供的抗体包含seq id no:303的vh序列和seq id no:304的vl序列。在一些实施方案中,本文提供的抗体包含seq id no:763的vh序列和seq id no:764的vl序列。在一些实施方案中,本文提供的抗体包含seq id no:868的vh序列和seq id no:869的vl序列。
[0448]
在一些实施方案中,本文提供的抗体包含seq id no:870的vh序列和seq id no:
871的vl序列。
[0449]
在一些实施方案中,本文提供的抗体包含与选自seq id no:113、151、189、836、227、265、303、763、868和870的说明性vh序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的vh序列,以及与选自seq id no:114、152、190、837、228、266、304、764、869和871的说明性vl序列具有至少约50%、60%、70%、80%、90%、95%或99%同一性的v
l
序列。在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh序列,其具有多达1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸取代,以及选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
序列,其具有多达1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0450]
2.2.6.cdr
[0451]
在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的一至三个cdr。在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的两至三个cdr。在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的三个cdr。在一些方面,cdr为exemplary cdr。在一些方面,cdr为kabat cdr。在一些方面,cdr为chothia cdr。在一些方面,cdr为abm cdr。在一些方面,cdr为接触cdr。在一些方面,cdr为imgt cdr。
[0452]
在一些实施方案中,cdr是与seq id no:113、151、189、836、227、265、303、763、868和870的cdr-h1、cdr-h2或cdr-h3具有至少约50%、75%、80%、85%、90%或95%同一性的cdr。在一些实施方案中,cdr-h1是选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的cdr-h1,其具有多达1、2、3、4或5个氨基酸取代。在一些实施方案中,cdr-h2是选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的cdr-h2,其具有多达1、2、3、4、5、6、7或8个氨基酸取代。在一些实施方案中,cdr-h3是选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的cdr-h3,其具有多达1、2、3、4、5、6、7或8个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0453]
在一些实施方案中,本文提供的抗体包含选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的一至三个cdr。在一些实施方案中,本文提供的抗体包含选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的两至三个cdr。在一些实施方案中,本文提供的抗体包含选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的三个cdr。在一些方面,cdr为exemplary cdr。在一些方面,
cdr为kabat cdr。在一些方面,cdr为chothia cdr。在一些方面,cdr为abm cdr。在一些方面,cdr为接触cdr。在一些方面,cdr为imgt cdr。
[0454]
在一些实施方案中,cdr是与seq id no:114、152、190、837、228、266、304、764、869和871的cdr-l1、cdr-l2或cdr-l3具有至少约50%、75%、80%、85%、90%或95%同一性的cdr。在一些实施方案中,cdr-l1是选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的cdr-l1,其具有多达1、2、3、4或5个氨基酸取代。在一些实施方案中,cdr-l2是选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的cdr-l2,其具有多达1、2、3、4、5、6、7或8个氨基酸取代。在一些实施方案中,cdr-l3是选自seq id no:114、152、190、837、228、266、304、764、869和871的vl结构域的cdr-l3,其具有多达1、2、3、4、5、6、7或8个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0455]
在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的一至三个cdr和选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的一至三个cdr。在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的两至三个cdr和选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的两至三个cdr。在一些实施方案中,本文提供的抗体包含选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的三个cdr和选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的三个cdr。在一些方面,cdr为exemplary cdr。在一些方面,cdr为kabat cdr。在一些方面,cdr为chothia cdr。在一些方面,cdr为abm cdr。在一些方面,cdr为接触cdr。在一些方面,cdr为imgt cdr。
[0456]
在一些实施方案中,cdr是与seq id no:113、151、189、836、227、265、303、763、868和870的cdr-h1、cdr-h2或cdr-h3具有至少约50%、75%、80%、85%、90%或95%同一性并与seq id no:114、152、190、837、228、266、304、764、869和871的cdr-l1、cdr-l2或cdr-l3具有至少约50%、75%、80%、85%、90%或95%同一性的cdr。在一些实施方案中,cdr-h1是选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的cdr-h1,其具有多达1、2、3、4或5个氨基酸取代;cdr-h2是选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的cdr-h2,其具有多达1、2、3、4、5、6、7或8个氨基酸取代;cdr-h3是选自seq id no:113、151、189、836、227、265、303、763、868和870的vh结构域的cdr-h3,其具有多达1、2、3、4、5、6、7或8个氨基酸取代;cdr-l1是选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的cdr-l1,其具有多达1、2、3、4、5或6个氨基酸取代;cdr-l2是选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的cdr-l2,其具有多达1、2、3或4个氨基酸取代;并且cdr-l3是选自seq id no:114、152、190、837、228、266、304、764、869和871的v
l
结构域的cdr-l3,其具有多达1、2、3、4或5个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱
变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0457]
25a cdr
[0458]
在一些实施方案中,抗体包含来自抗体克隆25a的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25a cdr序列示出在表7中。在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25a的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0459]
在一些实施方案中,抗体包含来自抗体克隆25a的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25a的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0460]
在一些实施方案中,抗体包含与来自抗体克隆25a的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25a的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0461]
25a3 cdr
[0462]
在一些实施方案中,抗体包含来自抗体克隆25a3的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25a3 cdr序列示出在表8中。在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a3的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0463]
在一些实施方案中,抗体包含来自抗体克隆25a3的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a3的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0464]
在一些实施方案中,抗体包含与来自抗体克隆25a3的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25a3的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a3的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0465]
25a5 cdr
[0466]
在一些实施方案中,抗体包含来自抗体克隆25a5的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25a5 cdr序列示出在表9中。在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a5的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0467]
在一些实施方案中,抗体包含来自抗体克隆25a5的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a5的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0468]
在一些实施方案中,抗体包含与来自抗体克隆25a5的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25a5的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a5的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0469]
25a5-t cdr
[0470]
在一些实施方案中,抗体包含来自抗体克隆25a5-t的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25a5-t cdr序列示出在表10中。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0471]
在一些实施方案中,抗体包含来自抗体克隆25a5-t的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0472]
在一些实施方案中,抗体包含与来自抗体克隆25a5-t的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25a5-t的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25a5-t的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0473]
25g cdr
[0474]
在一些实施方案中,抗体包含来自抗体克隆25g的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25g cdr序列示出在表11中。在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25g的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0475]
在一些实施方案中,抗体包含来自抗体克隆25g的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-l2序列具有
50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25g的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0476]
在一些实施方案中,抗体包含与来自抗体克隆25g的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25g的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25g的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0477]
25g1 cdr
[0478]
在一些实施方案中,抗体包含来自抗体克隆25g1的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25g1 cdr序列示出在表12中。在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g1的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0479]
在一些实施方案中,抗体包含来自抗体克隆25g1的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g1的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0480]
在一些实施方案中,抗体包含与来自抗体克隆25g1的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25g1的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25g1的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0481]
25g9 cdr
[0482]
在一些实施方案中,抗体包含来自抗体克隆25g9的重链cdr序列。通过exemplary、kabat、chothia、abm、contact和imgt编号系统确定的抗体25g9 cdr序列示出在表13中。在
一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的相应两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g9的三个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0483]
在一些实施方案中,抗体包含来自抗体克隆25g9的轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的相应两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体克隆25g9的三个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0484]
在一些实施方案中,抗体包含与来自抗体克隆25g9的cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体克隆25g9的cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体克隆25g9的相应六个cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0485]
25个共有cdr
[0486]
在一些实施方案中,抗体包含来自鉴定为第25组的抗体组的重链共有cdr序列。通过kabat和chothia编号系统确定的第25抗体组共有cdr序列示出在表14中。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的cdr-h3共有序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的共有cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的共有cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的相应两个共有重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的三个共有重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0487]
在一些实施方案中,抗体包含来自鉴定为第25组的抗体组的轻链共有cdr。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的共有cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的共有cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的共有
cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的相应两个共有轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的相应三个共有轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0488]
在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的共有cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自鉴定为第25组的抗体组的共有cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自鉴定为第25组的抗体组的相应六个共有cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0489]
25a共有cdr
[0490]
在一些实施方案中,抗体包含来自抗体组谱系25a的重链共有cdr序列。通过kabat和chothia编号系统确定的抗体组谱系25a的共有cdr序列示出在表21中。在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的相应共有两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体组谱系25a的三个共有重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0491]
在一些实施方案中,抗体包含来自抗体组谱系25a的轻链cdr。在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的相应共有两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体组谱系25a的三个轻链共有cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0492]
在一些实施方案中,抗体包含与来自抗体组谱系25a的共有cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体组谱系25a的共有cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体组谱系25a的相应六个共有cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0493]
25g共有cdr
[0494]
在一些实施方案中,抗体包含来自抗体组谱系25g的重链共有cdr序列。通过kabat和chothia编号系统确定的抗体组谱系25g的共有cdr序列示出在表21中。在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-h3序列具有50%、75%、80%、85%、90%、
95%或100%同一性的cdr-h3序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-h2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h2序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-h1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h1序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的相应共有两个重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个重链cdr。在一些实施方案中,抗体包含与来自抗体组谱系25g的三个共有重链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个重链cdr。
[0495]
在一些实施方案中,抗体包含来自抗体组谱系25g的轻链cdr。在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-l2序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l2序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-l1序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l1序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的相应共有两个轻链cdr具有50%、75%、80%、85%、90%、95%或100%同一性的两个轻链cdr。在一些实施方案中,抗体包含与来自抗体组谱系25g的三个轻链共有cdr具有50%、75%、80%、85%、90%、95%或100%同一性的三个轻链cdr。
[0496]
在一些实施方案中,抗体包含与来自抗体组谱系25g的共有cdr-h3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-h3序列和与来自抗体组谱系25g的共有cdr-l3序列具有50%、75%、80%、85%、90%、95%或100%同一性的cdr-l3序列。在一些实施方案中,抗体包含与来自抗体组谱系25g的相应六个共有cdr具有50%、75%、80%、85%、90%、95%或100%同一性的六个cdr序列。
[0497]
变体cdr
[0498]
在本文提供的任何抗体的一些实施方案中,抗体cdr可以包含对本文所述的任何cdr序列的多达1、2、3、4、5、6、7或8个氨基酸取代。在一些方面,氨基酸取代是保守性氨基酸取代。在一些实施方案中,这个段落中所述的抗体在本文中被称为“变体”。在一些实施方案中,此类变体例如通过亲和力成熟、定点诱变、随机诱变或本领域中已知或本文所述的任何其他方法来由本文提供的序列获得。在一些实施方案中,此类变体不由本文提供的序列获得,并且可例如根据本文提供的用于获得抗体的方法来重新分离。
[0499]
2.2.7.抗体变体的功能特性
[0500]
如上所述,以及在本公开别处所述,本文提供了基于与本文提供的说明性抗体序列的同一性百分比或与本文提供的说明性抗体序列相比氨基酸残基的取代定义的抗体变体。
[0501]
在一些实施方案中,本文提供的抗体的变体对htf具有特异性。在一些实施方案中,本文提供的抗体的变体对ctf具有特异性。在一些实施方案中,本文提供的抗体的变体对mtf具有特异性。在一些实施方案中,本文提供的抗体的变体对htf和ctf具有特异性。在一些实施方案中,本文提供的抗体的变体对htf和mtf具有特异性。在一些实施方案中,本文提供的抗体的变体对ctf和mtf具有特异性。在一些实施方案中,本文提供的抗体的变体对htf、ctf和mtf具有特异性。
[0502]
在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对htf
的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对ctf的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对mtf的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对htf和ctf的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对htf和mtf的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对ctf和mtf的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。在一些实施方案中,来源于本文提供的说明性抗体序列的抗体的变体保留对htf、ctf和mtf中的所有三个的亲和力,如通过kd所测量的,所述亲和力在此种说明性抗体的亲和力的约1.5倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍或约10倍内。
[0503]
在一些实施方案中,本文提供的抗体的变体保留抑制tf信号传导的能力,如通过本文所述的一种或多种测定法或生物学效应所测量的。在一些实施方案中,本文提供的抗体的变体保留血液凝固过程中tf的正常功能。
[0504]
在一些实施方案中,本文提供的抗体的变体与选自25a、25a3、25a5、25a5-t、25g、25g1和25g9的抗体竞争结合tf,所述抗体各自如本公开的表5中提供。
[0505]
在一些实施方案中,如由凝血酶生成测定法(tga)确定的,本文提供的抗体的变体允许人凝血酶生成。在一些实施方案中,如由凝血酶生成测定法(tga)确定的,本文提供的抗体的变体不抑制人凝血酶生成。
[0506]
在一些实施方案中,本文提供的抗体的变体在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf。在一些实施方案中,本文提供的抗体的变体不干扰tf:fviia将fx转化为fxa的能力。
[0507]
在一些实施方案中,本文提供的抗体的变体在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf。在一些实施方案中,本文提供的抗体的变体不与人fviia竞争结合到人tf。
[0508]
在一些实施方案中,本文提供的抗体的变体抑制fviia依赖性tf信号传导。
[0509]
在一些实施方案中,本文提供的抗体的变体结合小鼠tf(seq id no:817)。在一些实施方案中,本文提供的抗体的变体以比抗体对htf的亲和力低的亲和力(如由较高的kd所指示)结合小鼠tf。在一些实施方案中,本文提供的抗体的变体不结合mtf。
[0510]
在一些实施方案中,本文提供的抗体的变体结合猪tf(seq id no:824)。在一些实施方案中,本文提供的抗体的变体以比抗体对htf的亲和力低的亲和力(如由较高的kd所指示)结合猪tf。在一些实施方案中,本文提供的抗体的变体不结合ptf。
[0511]
在一些实施方案中,本文提供的抗体的变体结合与此种抗体相同的tf表位。
[0512]
2.2.8.抗体的其他功能特性
[0513]
在一些实施方案中,本文提供的抗体具有以下(a)至(dd)中列出的一个或多个特征:(a)在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;(b)如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;(c)与同型对照相比,不降低凝血酶生成曲线上的凝血酶峰值(峰值iia);(d)与同型对照相比,不增加从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(e)与同型对照相比,不降低由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(f)如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;(g)与同型对照相比,保持凝血酶生成曲线上的凝血酶峰值(峰值iia);(h)与同型对照相比,保持从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(i)与同型对照相比,保留由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(j)在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;(k)不干扰tf:fviia将fx转化为fxa的能力;(l)不与人fviia竞争结合到人tf;(m)抑制fviia依赖性tf信号传导;(n)结合到食蟹猴tf;(o)结合到小鼠tf;(p)结合到兔tf;(q)结合到猪tf;(s)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(t)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基68处的突变的变体tf胞外结构域之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(u)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(v)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(w)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(x)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(y)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(z)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至219被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基
164至224替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(aa)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至189被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至194替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(bb)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(cc)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基167至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基172至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且(dd)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的两个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的三个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的四个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的五个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的六个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的七个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的八个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的九个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十一个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十二个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十三个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十四个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十五个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十六个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十七个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十八个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十九个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十一个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十二个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十三个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十四个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十五个特征。在一些实施方案中,本
文提供的抗体具有前述(a)至(dd)中列出的二十六个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十七个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十八个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十九个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的所有三十个特征。
[0514]
在一些实施方案中,本文提供的抗体具有以下(a)至(dd)中列出的一个或多个特征:(a)在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;(b)如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;(c)与同型对照相比,不降低凝血酶生成曲线上的凝血酶峰值(峰值iia);(d)与同型对照相比,不增加从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(e)与同型对照相比,不降低由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(f)如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;(g)与同型对照相比,保持凝血酶生成曲线上的凝血酶峰值(峰值iia);(h)与同型对照相比,保持从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(i)与同型对照相比,保留由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(j)在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;(k)不干扰tf:fviia将fx转化为fxa的能力;(l)不与人fviia竞争结合到人tf;(m)抑制fviia依赖性tf信号传导;(n)结合到食蟹猴tf;(o)结合到小鼠tf;(p)结合到兔tf;(q)结合到猪tf;(s)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k149n的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(t)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k68n的变体tf胞外结构域之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(u)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(v)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(w)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(x)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(y)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合
的50%;(z)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至219被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至224替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(aa)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至189被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至194替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(bb)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(cc)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基167至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基172至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且(dd)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的两个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的三个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的四个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的五个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的六个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的七个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的八个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的九个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十一个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十二个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十三个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十四个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十五个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十六个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十七个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十八个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的十九个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十一个或更多个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十二个或更多个特征。在一些实施方案
中,本文提供的抗体具有前述(a)至(dd)中列出的二十三个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十四个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十五个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十六个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十七个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十八个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的二十九个特征。在一些实施方案中,本文提供的抗体具有前述(a)至(dd)中列出的所有三十个特征。
[0515]
在一些实施方案中,本文提供的抗体表现出包括以下(a)至(dd)中列出的两个或更多个特征的特征的组合:(a)在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;(b)如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;(c)与同型对照相比,不降低凝血酶生成曲线上的凝血酶峰值(峰值iia);(d)与同型对照相比,不增加从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(e)与同型对照相比,不降低由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(f)如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;(g)与同型对照相比,保持凝血酶生成曲线上的凝血酶峰值(峰值iia);(h)与同型对照相比,保持从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(i)与同型对照相比,保留由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(j)在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;(k)不干扰tf:fviia将fx转化为fxa的能力;(l)不与人fviia竞争结合到人tf;(m)抑制fviia依赖性tf信号传导;(n)结合到食蟹猴tf;(o)结合到小鼠tf;(p)结合到兔tf;(q)结合到猪tf;(s)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(t)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基68处的突变的变体tf胞外结构域之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(u)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(v)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(w)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(x)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域
之间的结合的50%;(y)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(z)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至219被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至224替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(aa)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至189被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至194替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(bb)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(cc)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基167至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基172至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且(dd)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0516]
在一些实施方案中,本文提供的抗体表现出包括以下(a)至(dd)中列出的两个或更多个特征的特征的组合:(a)在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;(b)如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;(c)与同型对照相比,不降低凝血酶生成曲线上的凝血酶峰值(峰值iia);(d)与同型对照相比,不增加从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(e)与同型对照相比,不降低由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(f)如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;(g)与同型对照相比,保持凝血酶生成曲线上的凝血酶峰值(峰值iia);(h)与同型对照相比,保持从测定开始到凝血酶生成曲线上的凝血酶峰值的时间(ttpeak);(i)与同型对照相比,保留由凝血酶生成曲线下面积确定的内源性凝血酶潜能(etp);(j)在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf;(k)不干扰tf:fviia将fx转化为fxa的能力;(l)不与人fviia竞争结合到人tf;(m)抑制fviia依赖性tf信号传导;(n)结合到食蟹猴tf;(o)结合到小鼠tf;(p)结合到兔tf;(q)结合到猪tf;(s)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k149n的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(t)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k68n的变体tf胞外结构域之间的结合大于抗体与seq id no:810所示序列的tf的胞外
结构域之间的结合的50%;(u)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(v)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基1至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基1至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(w)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基39至77被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基38至76替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(x)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基94至107被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基99至112替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(y)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基146至158被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基151至163替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(z)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至219被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至224替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(aa)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至189被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至194替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(bb)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基159至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基164至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;(cc)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与人tf胞外结构域(其中seq id no:810所示序列的氨基酸残基167至174被seq id no:838所示序列的大鼠tf胞外结构域氨基酸残基172至179替代)之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且(dd)如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与大鼠tf胞外结构域(其中seq id no:838所示序列的氨基酸残基141至194被seq id no:810所示序列的人tf胞外结构域氨基酸残基136至189替代)之间的结合大于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0517]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;并且如通过在活细胞染色测定法中抗体相对于同型对照的
中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0518]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0519]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0520]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0521]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0522]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k149n的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0523]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人
fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0524]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k149n的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0525]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;结合到食蟹猴tf;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0526]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,不抑制人凝血酶生成;结合到食蟹猴tf;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k149n的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0527]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;结合到食蟹猴tf;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基149处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值
荧光强度值所确定的,抗体与包含seq id no:810所示序列的氨基酸残基171和197处的突变的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0528]
在一些实施方案中,本文提供的抗体表现出以下中列出的特征的组合:在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf;如由凝血酶生成测定法(tga)确定的,允许人凝血酶生成;结合到食蟹猴tf;如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变k149n的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%;并且如通过在活细胞染色测定法中抗体相对于同型对照的中值荧光强度值所确定的,抗体与包含seq id no:810所示序列的突变n171h和t197k的变体tf胞外结构域之间的结合小于抗体与seq id no:810所示序列的tf的胞外结构域之间的结合的50%。
[0529]
2.3.tf抗体的亲和力和其他特性
[0530]
2.3.1.tf抗体的亲和力
[0531]
在一些实施方案中,如由kd所指示,本文提供的抗体对tf的亲和力小于约10-5
m、小于约10-6
m、小于约10-7
m、小于约10-8
m、小于约10-9
m、小于约10-10
m、小于约10-11
m或小于约10-12
m。在一些实施方案中,抗体的亲和力在约10-7
m和10-12
m之间。在一些实施方案中,抗体的亲和力在约10-7
m和10-11
m之间。在一些实施方案中,抗体的亲和力在约10-7
m和10-11
m之间。在一些实施方案中,抗体的亲和力在约10-7
m和10-10
m之间。在一些实施方案中,抗体的亲和力在约10-7
m和10-9
m之间。在一些实施方案中,抗体的亲和力在约10-7
m和10-8
m之间。在一些实施方案中,抗体的亲和力在约10-8
m和10-12
m之间。在一些实施方案中,抗体的亲和力在约10-8
m和10-11
m之间。在一些实施方案中,抗体的亲和力在约10-9
m和10-11
m之间。在一些实施方案中,抗体的亲和力在约10-10
m和10-11
m之间。
[0532]
在一些实施方案中,本文提供的抗体对ctf的kd值不大于针对htf的抗体的kd值的15倍。在一些实施方案中,本文提供的抗体对ctf的kd值不大于针对htf的抗体的kd值的10倍。在一些实施方案中,本文提供的抗体对ctf的kd值不大于针对htf的抗体的kd值的8倍。在一些实施方案中,本文提供的抗体对ctf的kd值不大于针对htf的抗体的kd值的5倍。在一些实施方案中,本文提供的抗体对ctf的kd值不大于针对htf的抗体的kd值的3倍。在一些实施方案中,本文提供的抗体对ctf的kd值不大于针对htf的抗体的kd值的2倍。
[0533]
在一些实施方案中,本文提供的抗体对mtf的kd值不大于针对htf的抗体的kd值的20倍。在一些实施方案中,本文提供的抗体对mtf的kd值不大于针对htf的抗体的kd值的15倍。在一些实施方案中,本文提供的抗体对mtf的kd值不大于针对htf的抗体的kd值的10倍。在一些实施方案中,本文提供的抗体对mtf的kd值不大于针对htf的抗体的kd值的5倍。在一些实施方案中,本文提供的抗体对mtf的kd值不大于针对htf的抗体的kd值的2倍。
[0534]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表5中所阐述的,如由biacore测量的kd所指示,本文提供的抗体对htf的亲和力选自约0.31nm、约6.20nm、约0.36nm、约0.08nm、约23.0nm、约0.94nm、约13.3nm、约0.47nm、约0.09nm、约1.75nm、约0.07nm、约0.14nm、约2.09nm、约0.06nm、约0.15nm、约1.46nm、约1.60nm和约0.42nm。在一些实施方案中,由kd所指示的此种亲和力在约23.0nm至约0.06nm的范围内。在一些实施方案中,此种为约23.0nm或更小。
[0535]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表5中所阐述的,如由fortebio测量的kd所指示,本文提供的抗体对htf的亲和力选自约1.28nm、约2.20nm、约8.45nm、约1.67nm、约0.64nm、约21.9nm、约3.97nm、约35.8nm、约3.30nm、约2.32nm、约0.83nm、约2.40nm、约0.96nm、约0.86nm、约3.84nm、约1.02nm、约1.61nm、约2.52nm、约2.28nm和约1.59nm。在一些实施方案中,由kd所指示的此种亲和力在约35.8nm至约0.64nm的范围内。在一些实施方案中,此种kd为约35.8nm或更小。
[0536]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表5中所阐述的,如由biacore测量的kd所指示,本文提供的抗体对ctf的亲和力选自约0.26nm、约5.42nm、约0.21nm、约0.04nm、约18.0nm、约0.78nm、约16.4nm、约5.06nm、约0.08nm、约5.64nm、约0.12nm、约0.24nm、约5.66nm、约0.39nm、约5.69nm、约6.42nm和约1.83nm。在一些实施方案中,由kd所指示的此种亲和力在约18.0nm至约0.04nm的范围内。在一些实施方案中,此种kd为约18.0nm或更小。
[0537]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表5中所阐述的,如由fortebio测量的kd所指示,本文提供的抗体对ctf的亲和力选自约1.43nm、约2.70nm、约7.65nm、约1.36nm、约0.76nm、约17.5nm、约4.99nm、约42.9nm、约12.0nm、约15.0nm、约0.57nm、约3.40nm、约1.05nm、约0.94nm、约4.12nm、约1.11nm、约1.96nm、约4.07nm、约2.71nm和约4.16nm。在一些实施方案中,由kd所指示的此种亲和力在约42.9nm至约0.57nm的范围内。在一些实施方案中,此种kd为约42.9nm或更小。
[0538]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表5中所阐述的,如由biacore测量的kd所指示,本文提供的抗体对mtf的亲和力选自约5.4nm、约2.9nm、约21nm和约2.4nm。在一些实施方案中,由kd所指示的此种亲和力在约21nm至约2.4nm的范围内。在一些实施方案中,此种kd为约21nm或更小。
[0539]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表5中所阐述的,如由fortebio测量的kd所指示,本文提供的抗体对mtf的亲和力选自约263nm、约131nm、约188nm、约114nm、约34.2nm、约9.16nm、约161nm、约72.1nm、约360nm、约281nm、约41.4nm、约6.12nm、约121nm和约140nm。在一些实施方案中,由kd所指示的此种亲和力在约360nm至约6.12nm的范围内。在一些实施方案中,此种kd为约360nm或更小。
[0540]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的图1a和图1b中所阐述的,如由用人tf阳性hct-116细胞测量的ec
50
所指示,本文提供的抗体对htf的亲和力选自约50pm、约58pm、约169pm、约77pm、约88pm、约134pm、约85pm、约237pm、约152pm、约39pm、约559pm、约280pm、约255pm、约147pm、约94pm、约117pm、约687pm、约532pm和约239pm。在一些实施方案中,此种亲和力在约687pm至约39pm的范围内。在一些实施方案中,此种ec
50
为约687pm或更小。
[0541]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的图2a和图2b中所阐述的,如由用小鼠tf阳性cho细胞测量的ec
50
所指示,本文提供的抗体对mtf的亲和力选自约455nm、约87nm、约11nm、约3.9nm、约3.0nm、约3.4nm、约255nm、约2.9nm、约3.6nm和约4.0nm。在一些实施方案中,此种亲和力在约455nm至约2.9nm的范围内。在一些实施方案中,此种ec
50
为约455pm或更小。
[0542]
在一些实施方案中,本文提供的抗体对ptf的kd值不大于针对htf的抗体的kd值的
20倍。在一些实施方案中,本文提供的抗体对ptf的kd值不大于针对htf的抗体的kd值的15倍。在一些实施方案中,本文提供的抗体对ptf的kd值不大于针对htf的抗体的kd值的10倍。在一些实施方案中,本文提供的抗体对ptf的kd值不大于针对htf的抗体的kd值的5倍。在一些实施方案中,本文提供的抗体对ptf的kd值不大于针对htf的抗体的kd值的2倍。
[0543]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表40中所阐述的,如由biacore测量的kd所指示,本文提供的抗体对ptf的亲和力为约3.31nm或12.9nm。
[0544]
2.3.2.tf抗体存在下的凝血酶生成
[0545]
在一些实施方案中,如由凝血酶生成测定法(tga)确定的,本文提供的tf抗体不抑制人凝血酶生成。在某些实施方案中,如由凝血酶生成测定法(tga)确定的,本文提供的tf抗体允许人凝血酶生成。
[0546]
在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,凝血酶生成的峰值百分比(峰值iia%)为至少40%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少50%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少60%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少95%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少99%。
[0547]
在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少40%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少50%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少60%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少95%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少99%。
[0548]
在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少60%。在一些实施方案中,与不
含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少95%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,峰值iia%为至少99%。
[0549]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表6和表37中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,在无需抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,峰值iia%选自约99%、约100%、约103%、约64%、约52%、约87%、约96%、约98%和约53%。在一些实施方案中,此种峰值iia%在约52%至约103%的范围内。在一些实施方案中,此种峰值iia%为约52%或更高。
[0550]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表6和表37中所阐述的,与不含抗体的对照条件相比,在50nm tf抗体的存在下,在无抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,峰值iia%选自约99%、约100%、约103%、约67%、约58%、约89%、约96%、约98%、约68%、约62%和约88%。在一些实施方案中,此种峰值iia%在约58%至约103%的范围内。在一些实施方案中,此种峰值iia%为约58%或更高。
[0551]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表6和表37中所阐述的,与不含抗体的对照条件相比,在10nm tf抗体的存在下,在无抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,峰值iia%选自约100%、约99%、约103%、约87%、约83%、约95%、约98%、约86%和约96%。在一些实施方案中,此种峰值iia%在约83%至约103%的范围内。在一些实施方案中,此种峰值iia%为约83%或更高。
[0552]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表7和表38中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,在10min抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,峰值iia%选自约108%、约105%、约111%、约58%、约47%、约91%、约103%、约109%、约107%和约45%。在一些实施方案中,此种峰值iia%在约45%至约111%的范围内。在一些实施方案中,此种峰值iia%为约45%或更高。
[0553]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表7和表38中所阐述的,与不含抗体的对照条件相比,在50nm tf抗体的存在下,在10min抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,峰值iia%选自约107%、约104%、约114%、约62%、约49%、约87%、约105%、约109%、约55%和约92%。在一些实施方案中,此种峰值iia%在约49%至约114%的范围内。在一些实施方案中,此种峰值iia%为约49%或更高。
[0554]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表7和表38中所阐述的,与不含抗体的对照条件相比,在10nm tf抗体的存在下,在10min抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,峰值iia%选自约105%、约114%、约76%、约68%、约94%、约108%、约104%、约74%和约93%。在一些实施方案中,此种峰值iia%在约68%至约114%的范围内。在一些实施方案中,此种峰值iia%为约68%或更高。
[0555]
在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在
下,如由凝血酶生成测定法(tga)确定的,内源性凝血酶潜能百分比(etp%)为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少95%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少99%。
[0556]
在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少95%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少99%。
[0557]
在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少95%。在一些实施方案中,与不含抗体的对照条件相比,在不小于10nm tf抗体的存在下,如由凝血酶生成测定法(tga)确定的,etp%为至少99%。
[0558]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表6和表37中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,在无抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,etp%选自约108%、约103%、约109%、约100%、约96%、约102%、约105%和约92%。在一些实施方案中,此种etp%在约92%至约109%的范围内。在一些实施方案中,此种etp%为约92%或更高。
[0559]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表6和表37中所阐述的,与不含抗体的对照条件相比,在50nm tf抗体的存在下,在无需抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,etp%选自约108%、约103%、约111%、约101%、约97%、约104%、约106%、约93%、约96%和约105%。在一些实施方案中,此种etp%在约93%至约111%的范围内。在一些实施方案中,此种etp%为约93%或更高。
[0560]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表6和表37中所阐述的,与不含抗体的对照条件相比,在10nm tf抗体的存在下,在无抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,etp%选自约106%、约109%、约105%、约104%、约107%、约99%、约101%和约102%。在一些实施方案中,此种etp%在约99%至约109%的范围内。在一些实施方案中,此种etp%为约99%或更高。
[0561]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表7和表38中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,在10min抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,etp%选自约110%、约104%、约106%、约98%、约95%、约108%、约107%、约96%、约92%和约103%。在一些实施方案中,此种etp%在约
92%至约110%的范围内。在一些实施方案中,此种etp%为约92%或更高。
[0562]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表7和表38中所阐述的,与不含抗体的对照条件相比,在50nm tf抗体的存在下,在10min抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,etp%选自约110%、约106%、约108%、约103%、约96%、约109%、约102%、约104%、约94%和约98%。在一些实施方案中,此种etp%在约94%至约110%的范围内。在一些实施方案中,此种etp%为约94%或更高。
[0563]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表7和表38中所阐述的,与不含抗体的对照条件相比,在10nm tf抗体的存在下,在10min抗体预孵育的情况下,如由凝血酶生成测定法(tga)确定的,etp%选自约107%、约106%、约110%、约103%、约100%、约105%、约102%和约101%。在一些实施方案中,此种etp%在约100%至约110%的范围内。在一些实施方案中,此种etp%为约100%或更高。
[0564]
2.3.3.tf抗体存在下的fxa转化
[0565]
在一些实施方案中,本文提供的抗体在与由人fx结合的人tf结合位点不同的人tf结合位点处结合人tf。在某些实施方案中,本文提供的抗体不干扰tf:fviia将fx转化为fxa的能力。
[0566]
在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,fxa转化的百分比(fxa%)为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,fxa%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,fxa%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,fxa%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,fxa%为至少95%。
[0567]
在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,fxa%为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,fxa%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,fxa%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,fxa%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于50nm tf抗体的存在下,fxa%为至少95%。
[0568]
在一些实施方案中,与不含抗体的对照条件相比,在不小于25nm tf抗体的存在下,fxa%为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于25nm tf抗体的存在下,fxa%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于25nm tf抗体的存在下,fxa%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于25nm tf抗体的存在下,fxa%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于25nm tf抗体的存在下,fxa%为至少95%。
[0569]
在一些实施方案中,与不含抗体的对照条件相比,在不小于12.5nm tf抗体的存在下,fxa%为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于12.5nm tf抗体的存在下,fxa%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于12.5nm tf抗体的存在下,fxa%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于12.5nm tf抗体的存在下,fxa%为至少90%。在一些实施方案中,与不含
抗体的对照条件相比,在不小于12.5nm tf抗体的存在下,fxa%为至少95%。
[0570]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表8中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,fxa%选自约89%、约96%、约116%、约108%、约117%、约105%、约112%、约106%、约103%、约111%、约98%和约101%。在一些实施方案中,此种fxa%在约89%至约117%的范围内。在一些实施方案中,此种fxa%为约89%或更高。
[0571]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表8中所阐述的,与不含抗体的对照条件相比,在50nm tf抗体的存在下,fxa%选自约94%、约93%、约78%、约102%、约99%、约104%、约105%、约108%、约107%、约97%和约106%。在一些实施方案中,此种fxa%在约78%至约108%的范围内。在一些实施方案中,此种fxa%为约78%或更高。
[0572]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表8中所阐述的,与不含抗体的对照条件相比,在25nm tf抗体的存在下,fxa%选自约81%、约89%、约85%、约109%、约96%、约97%、约108%、约104%、约103%、约112%和约89%。在一些实施方案中,此种fxa%在约81%至约112%的范围内。在一些实施方案中,此种fxa%为约81%或更高。
[0573]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表8中所阐述的,与不含抗体的对照条件相比,在12.5nm tf抗体的存在下,fxa%选自约87%、约89%、约82%、约99%、约101%、约98%、约113%、约106%、约115%、约110%、约120%、约85%和约108%。在一些实施方案中,此种fxa%在约82%至约120%的范围内。在一些实施方案中,此种fxa%为约82%或更高。
[0574]
2.3.4.tf抗体存在下的fviia结合
[0575]
在一些实施方案中,本文提供的抗体在与由人fviia结合的人tf结合位点不同的人tf结合位点处结合人tf。在某些实施方案中,本文提供的抗体不与人fviia竞争结合到人tf。
[0576]
在一些实施方案中,与不含抗体的对照条件相比,在不小于250nm tf抗体的存在下,fviia结合的百分比(fviia%)为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于250nm tf抗体的存在下,fviia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于250nm tf抗体的存在下,fviia%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于250nm tf抗体的存在下,fviia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于250nm tf抗体的存在下,fviia%为至少95%。
[0577]
在一些实施方案中,与不含抗体的对照条件相比,在不小于83nm tf抗体的存在下,fviia%为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于83nm tf抗体的存在下,fviia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于83nm tf抗体的存在下,fviia%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于83nm tf抗体的存在下,fviia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于83nm tf抗体的存在下,fviia%为至少95%。
[0578]
在一些实施方案中,与不含抗体的对照条件相比,在不小于28nm tf抗体的存在
下,fviia%为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于28nm tf抗体的存在下,fviia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于28nm tf抗体的存在下,fviia%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于28nm tf抗体的存在下,fviia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于28nm tf抗体的存在下,fviia%为至少95%。
[0579]
在一些实施方案中,与不含抗体的对照条件相比,在不小于9.25nm tf抗体的存在下,fviia%为至少75%。在一些实施方案中,与不含抗体的对照条件相比,在不小于9.25nm tf抗体的存在下,fviia%为至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于9.25nm tf抗体的存在下,fviia%为至少85%。在一些实施方案中,与不含抗体的对照条件相比,在不小于9.25nm tf抗体的存在下,fviia%为至少90%。在一些实施方案中,与不含抗体的对照条件相比,在不小于9.25nm tf抗体的存在下,fviia%为至少95%。
[0580]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表9中所阐述的,与不含抗体的对照条件相比,在250nm tf抗体的存在下,fviia%选自约98%、约87%、约80%、约92%、约95%、约89%、约91%、约97%、约94%、约101%和约96%。在一些实施方案中,此种fviia%在约80%至约101%的范围内。在一些实施方案中,此种fviia%为约80%或更高。
[0581]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表9中所阐述的,与不含抗体的对照条件相比,在83nm tf抗体的存在下,fviia%选自约97%、约88%、约77%、约93%、约94%、约91%、约98%、约100%和约92%。在一些实施方案中,此种fviia%在约77%至约100%的范围内。在一些实施方案中,此种fviia%为约77%或更高。
[0582]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表9中所阐述的,与不含抗体的对照条件相比,在28nm tf抗体的存在下,fviia%选自约101%、约87%、约79%、约96%、约93%、约95%、约98%、约100%、约102%、约99%、约92%和约91%。在一些实施方案中,此种fviia%在约79%至约102%的范围内。在一些实施方案中,此种fviia%为约79%或更高。
[0583]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表9中所阐述的,与不含抗体的对照条件相比,在9.25nm tf抗体的存在下,fviia%选自约100%、约90%、约76%、约97%、约93%、约99%、约98%、约102%、约101%和约95%。在一些实施方案中,此种fviia%在约76%至约102%的范围内。在一些实施方案中,此种fviia%为约76%或更高。
[0584]
2.3.5.tf抗体存在下的fviia依赖性tf信号传导
[0585]
在一些实施方案中,本文提供的抗体抑制fviia依赖性tf信号传导。在一些实施方案中,通过减少il8来测量对fviia依赖性tf信号传导的抑制。在一些实施方案中,通过减少gm-csf来测量对fviia依赖性tf信号传导的抑制。
[0586]
在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,白细胞介素8浓度(il8浓度)为至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,il8浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,il8浓度降低至少90%。
[0587]
在一些实施方案中,与不含抗体的对照条件相比,在不小于40nm tf抗体的存在
下,il8浓度降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于40nm tf抗体的存在下,il8浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于40nm tf抗体的存在下,il8浓度降低至少90%。
[0588]
在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,il8浓度降低至少60%。在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,il8浓度降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,il8浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,il8浓度降低至少90%。
[0589]
在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,il8浓度降低至少50%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,il8浓度降低至少60%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,il8浓度降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,il8浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,il8浓度降低至少90%。
[0590]
在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,粒细胞-巨噬细胞集落刺激因子浓度(gm-csf浓度)降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,gm-csf浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于100nm tf抗体的存在下,gm-csf浓度降低至少90%。
[0591]
在一些实施方案中,与不含抗体的对照条件相比,在不小于40nm tf抗体的存在下,gm-csf浓度降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于40nm tf抗体的存在下,gm-csf浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于40nm tf抗体的存在下,gm-csf浓度降低至少90%。
[0592]
在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,gm-csf浓度降低至少60%。在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,gm-csf浓度降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,gm-csf浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于16nm tf抗体的存在下,gm-csf浓度降低至少90%。
[0593]
在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,gm-csf浓度降低至少50%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,gm-csf浓度降低至少60%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,gm-csf浓度降低至少70%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,gm-csf浓度降低至少80%。在一些实施方案中,与不含抗体的对照条件相比,在不小于6.4nm tf抗体的存在下,gm-csf浓度降低至少90%。
[0594]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表10中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,白介素8(il8)的百分比选自约2%、约9%、约8%、约6%、约13%、约1%、约3%、约4%和约5%。在一些实施方案中,此种
il8%在约1%至约13%的范围内。在一些实施方案中,此种il8%为约13%或更少。
[0595]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表10中所阐述的,与不含抗体的对照条件相比,在40nm tf抗体的存在下,il8%选自约2%、约8%、约7%、约10%、约14%、约4%、约5%和约6%。在一些实施方案中,此种il8%在约2%至约14%的范围内。在一些实施方案中,此种il8%为约14%或更少。
[0596]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表10中所阐述的,与不含抗体的对照条件相比,在16nm tf抗体的存在下,il8%选自约2%、约3%、约10%、约8%、约7%、约16%、约9%、约15%、约5%和约6%。在一些实施方案中,此种il8%在约2%至约16%的范围内。在一些实施方案中,此种il8%为约16%或更少。
[0597]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表10中所阐述的,与不含抗体的对照条件相比,在6.4nm tf抗体的存在下,il8%选自约3%、约4%、约11%、约9%、约14%、约22%、约12%、约6%、约5%、约15%、约21%和约8%。在一些实施方案中,此种il8%在约3%至约22%的范围内。在一些实施方案中,此种il8%为约22%或更少。
[0598]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表11中所阐述的,与不含抗体的对照条件相比,在100nm tf抗体的存在下,粒细胞-巨噬细胞集落刺激因子的百分比(gm-csf%)选自约6%、约7%、约22%、约20%、约12%、约19%、约17%、约25%、约5%、约14%、约11%和约10%。在一些实施方案中,此种gm-csf%在约5%至约25%的范围内。在一些实施方案中,此种gm-csf%为约25%或更少。
[0599]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表11中所阐述的,与不含抗体的对照条件相比,在40nm tf抗体的存在下,gm-csf%选自约6%、约7%、约19%、约15%、约18%、约16%、约26%、约5%、约13%、约11%和约10%。在一些实施方案中,此种gm-csf%在约5%至约26%的范围内。在一些实施方案中,此种gm-csf%为约26%或更少。
[0600]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表11中所阐述的,与不含抗体的对照条件相比,在16nm tf抗体的存在下,gm-csf%选自约6%、约7%、约22%、约19%、约14%、约32%、约17%、约26%、约5%、约12%、约13%、约9%、约11%和约15%。在一些实施方案中,此种gm-csf%在约5%至约32%的范围内。在一些实施方案中,此种gm-csf%为约32%或更少。
[0601]
在一些实施方案中,如2019年1月4日提交的pct/us2019/12427的表11中所阐述的,与不含抗体的对照条件相比,在6.4nm tf抗体的存在下,gm-csf%选自约8%、约9%、约24%、约20%、约18%、约39%、约34%、约15%、约21%、约16%、约17%和约10%。在一些实施方案中,此种gm-csf%在约8%至约39%的范围内。在一些实施方案中,此种gm-csf%为约39%或更少。
[0602]
2.4.种系
[0603]
本文提供的抗体可包含任何适合vh和v
l
种系序列。
[0604]
在一些实施方案中,本文提供的抗体的vh区来自vh3种系。在一些实施方案中,本文提供的抗体的vh区来自vh1种系。在一些实施方案中,本文提供的抗体的vh区来自vh4种系。
[0605]
在一些实施方案中,本文提供的抗体的vh区来自vh3-23种系。在一些实施方案中,本文提供的抗体的vh区来自vh1-18种系。在一些实施方案中,本文提供的抗体的vh区来自vh3-30种系。在一些实施方案中,本文提供的抗体的vh区来自vh1-69种系。在一些实施方案中,本文提供的抗体的vh区来自vh4-31种系。在一些实施方案中,本文提供的抗体的vh区来自vh4-34种系。在一些实施方案中,本文提供的抗体的vh区来自vh1-46种系。
[0606]
在一些实施方案中,本文提供的抗体的v
l
区来自vk1种系。在一些实施方案中,本文提供的抗体的v
l
区来自vk4种系。在一些实施方案中,本文提供的抗体的v
l
区来自vk3种系。
[0607]
在一些实施方案中,本文提供的抗体的v
l
区来自vk1-05种系。在一些实施方案中,本文提供的抗体的v
l
区来自vk4-01种系。在一些实施方案中,本文提供的抗体的v
l
区来自vk3-15种系。在一些实施方案中,本文提供的抗体的v
l
区来自vk3-20种系。在一些实施方案中,本文提供的抗体的v
l
区来自vk1-33种系。
[0608]
2.5.单特异性和多特异性tf抗体
[0609]
在一些实施方案中,本文提供的抗体为单特异性抗体。
[0610]
在一些实施方案中,本文提供的抗体为多特异性抗体。
[0611]
在一些实施方案中,本文提供的多特异性抗体结合多于一个抗原。在一些实施方案中,多特异性抗体结合两个抗原。在一些实施方案中,多特异性抗体结合三个抗原。在一些实施方案中,多特异性抗体结合四个抗原。在一些实施方案中,多特异性抗体结合五个抗原。
[0612]
在一些实施方案中,本文提供的多特异性抗体结合tf抗原上的多于一个表位。在一些实施方案中,多特异性抗体结合tf抗原上的两个抗原。在一些实施方案中,多特异性抗体结合tf抗原上的三个抗原。
[0613]
许多特异性抗体构建体在本领域中是已知的,并且本文提供的抗体可以任何适合多特异性适合构建体的形式提供。
[0614]
在一些实施方案中,多特异性抗体包含免疫球蛋白,所述免疫球蛋白包含至少两个不同的重链可变区,所述重链可变区各自与共有轻链可变区(即,“共有轻链抗体”)配对。共有轻链可变区与两个不同的重链可变区中的每个形成不同的抗原结合结构域。参见merchant等人,nature biotechnol.,1998,16:677-681,其以引用的方式整体并入。
[0615]
在一些实施方案中,多特异性抗体包含免疫球蛋白,所述免疫球蛋白包含连接于此种免疫球蛋白的重链或轻链的n端或c端中的一个或多个的抗体或其片段。参见coloma和morrison,nature biotechnol.,1997,15:159-163,其以引用的方式整体并入。在一些方面,此种抗体包含四价双特异性抗体。
[0616]
在一些实施方案中,多特异性抗体包含杂交免疫球蛋白,所述杂交免疫球蛋白包含至少两个不同的重链可变区和至少两个不同的轻链可变区。参见milstein和cuello,nature,1983,305:537-540;以及staerz和bevan,proc.natl.acad.sci.usa,1986,83:1453-1457;所述文献各自以引用的方式整体并入。
[0617]
在一些实施方案中,多特异性抗体包含免疫球蛋白链,其具有改变以减少不具有多特异性的副产物的形成。在一些方面,抗体包含一种或多种“杵臼(knobs-into-hole)”修饰,如描述于美国专利号5,731,168中,其以引用的方式整体并入。
[0618]
在一些实施方案中,多特异性抗体包含具有一种或多种静电修饰以促进fc异源多聚体组装的免疫球蛋白链。参见wo 2009/089004,其以引用的方式整体并入。
[0619]
在一些实施方案中,多特异性抗体包含双特异性单链分子。参见traunecker等人,embo j.,1991,10:3655-3659;和gruber等人,j.immunol.,1994,152:5368-5374;其各自以引用的方式整体并入。
[0620]
在一些实施方案中,多特异性抗体包含通过多肽连接子连接的重链可变结构域和轻链可变结构域,其中选择连接子的长度以促进具有所需多特异性的多特异性抗体的组装。例如,当重链可变结构域和轻链可变结构域通过具有超过12个氨基酸残基的多肽连接子连接时,通常形成单特异性scfv。参见美国专利号4,946,778和5,132,405,所述文献各自以引用的方式整体并入。在一些实施方案中,将多肽连接子的长度减少到少于12个氨基酸残基防止同一多肽链上的重链和轻链可变结构域的配对,从而使来自一条链的重链和轻链可变结构域与另一条链上的互补结构域配对。因此,所得的抗体具有多特异性,其中每个结合位点的特异性由多于一个多肽链贡献。包含由3到12个氨基酸残基之间的连接子连接的重链和轻链可变结构域的多肽链主要形成二聚体(称为双抗体)。具有0到2个氨基酸残基之间的连接子,三聚体(称为三抗体)和四聚体(称为四抗体)是有利的。然而,寡聚的确切类型似乎取决于氨基酸残基组合物和每个多肽链中可变结构域的顺序(例如,v
h-连接子-v
l
比v
l-连接子-vh),除了连接子的长度。技术人员可基于所需多特异性选择适当的连接子长度。
[0621]
在一些实施方案中,多特异性抗体包含双抗体。参见hollinger等人,proc.natl.acad.sci.usa,1993,90:6444-6448,其以引用的方式整体并入。在一些实施方案中,多特异性抗体包含三抗体。参见todorovska等人,j.immunol.methods,2001,248:47-66,其以引用的方式整体并入。在一些实施方案中,多特异性抗体包含四抗体。参见同上,其以引用的方式整体并入。
[0622]
在一些实施方案中,多特异性抗体包含三特异性f(ab’)3衍生物。参见tutt等人j.immunol.,1991,147:60-69,其以引用的方式整体并入。
[0623]
在一些实施方案中,多特异性抗体包含交联抗体。参见美国专利号4,676,980;brennan等人,science,1985,229:81-83;staerz等人nature,1985,314:628-631;和ep 0453082;其各自以引用的方式整体并入。
[0624]
在一些实施方案中,多特异性抗体包含由亮氨酸拉链组装的抗原结合结构域。参见kostelny等人,j.immunol.,1992,148:1547-1553,其以引用的方式整体并入。
[0625]
在一些实施方案中,多特异性抗体包含互补蛋白结构域。在一些方面,互补蛋白质结构域包含锚定结构域(ad)以及二聚化和对接结构域(ddd)。在一些实施方案中,ad和ddd彼此结合,并从而能够通过“对接和锁定”(dnl)方法组装多特异性抗体结构。可组装具有许多特异性的抗体,包括双特异性抗体、三特异性抗体、四特异性抗体、五特异性抗体和六特异性抗体。包含互补蛋白结构域的多特异性抗体描述于例如美国专利号7,521,056;7,550,143;7,534,866和7,527,787中;其各自以引用的方式整体并入。
[0626]
在一些实施方案中,多特异性抗体包含双重作用fab(daf)抗体,如描述于美国专利公布号2008/0069820中,其以引用的方式整体并入。
[0627]
在一些实施方案中,多特异性抗体包含通过还原两个亲本分子之后混合两个亲本分子并再氧化以组装杂化结构而形成的抗体。参见carlring等人,plos one,2011,6:
e22533,其以引用的方式整体并入。
[0628]
在一些实施方案中,多特异性抗体包含dvd-ig
tm
。dvd-ig
tm
是可结合两种或更多种抗原的双重可变结构域免疫球蛋白。dvd-igs
tm
描述于美国专利号7,612,181中,其以引用的方式整体并入。
[0629]
在一些实施方案中,多特异性抗体包含dart
tm
。darts
tm
描述于moore等人,blood,2011,117:454-451中,其以引用的方式整体并入。
[0630]
在一些实施方案中,多特异性抗体包含描述于labrijn等人,proc.natl.acad.sci.usa,2013,110:5145-5150;gramer等人,mabs,2013,5:962-972;和labrijn等人,nature protocols,2014,9:2450-2463中;其各自以引用的方式整体并入。
[0631]
在一些实施方案中,多特异性抗体包含连接于另一抗体或片段的抗体片段。连接可为共价或非共价的。当连接为共价时,其可呈融合蛋白的形式或通过化学连接子。包含连接于其他抗体的抗体片段的多特异性抗体的说明性实例包括四价双特异性抗体,其中scfv从igg与c
h3
的c端融合。参见coloma和morrison,nature biotechnol.,1997,15:159-163。其他实例包括抗体,其中fab分子连接于免疫球蛋白的恒定区。参见miler等人,j.immunol.,2003,170:4854-4861,其以引用的方式整体并入。可使用任何适合片段,包括本文所述或本领域已知的任何片段。
[0632]
在一些实施方案中,多特异性抗体包含covx-body。covx-bodies描述于例如doppalapudi等人,proc.natl.acad.sci.usa,2010,107:22611-22616中,其以引用的方式整体并入。
[0633]
在一些实施方案中,多特异性抗体包含fcab抗体,其中一个或多个抗原结合结构域被引入fc区。fcab抗体描述于wozniak-knopp等人,protein eng.des.sel.,2010,23:289-297中,其以引用的方式整体并入。
[0634]
在一些实施方案中,多特异性抗体包含抗体。抗体描述于kipriyanov等人,j.mol.biol.,1999,293:41-56和zhukovsky等人,blood,2013,122:5116中,其各自以引用的方式整体并入。
[0635]
在一些实施方案中,多特异性抗体包含串联fab。串联fab描述于wo2015/103072中,其以引用的方式整体并入。
[0636]
在一些实施方案中,多特异性抗体包含zybody
tm
。zybodies
tm
描述于lafleur等人,mabs,2013,5:208-218中,其以引用的方式整体并入。2.6.糖基化变体
[0637]
在某些实施方案中,可改变本文提供的抗体以提高、降低或消除其糖基化的程度。多肽的糖基化通常为“n-连接的”或“o-连接的”。
[0638]“n-连接的”糖基化是指碳水化合物部分与天冬酰胺残基侧链的连接。三肽序列天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸(其中x是除脯氨酸以外的任何氨基酸)是将碳水化合物部分酶促连接到天冬酰胺侧链的识别序列。因此,多肽中这些三肽序列中任一个的存在创建潜在的糖基化位点。
[0639]“o-连接的”糖基化是指糖n-乙酰基半乳糖胺、半乳糖或木糖中的一种与羟基氨基酸(最常见的为丝氨酸或苏氨酸)的连接,虽然也可使用5-羟基脯氨酸或5-羟基赖氨酸。
[0640]
可通过改变氨基酸序列以使得创建或除去上述三肽序列中的一个或多个来实现
对本文提供的抗体或来自本文提供的抗体的n-连接的糖基化位点的添加或缺失。可通过在抗体序列中或到(视情况而定)一个或多个丝氨酸或苏氨酸残基的添加、缺失或取代来实现o-连接的糖基化位点的添加或缺失。
[0641]
在一些实施方案中,本文提供的抗体包含不同于天然存在的抗体的糖基化基序。可在本文提供的抗体中修饰任何适合天然存在的糖基化基序。例如,免疫球蛋白的结构和糖基化性质在本领域中已知,并且总结于例如schroeder和cavacini,j.allergy clin.immunol.,2010,125:s41-52,其以引用的方式整体并入。
[0642]
在一些实施方案中,本文提供的抗体包含对连接于天冬酰胺297(asn297)的寡糖进行修饰的igg1 fc区。由哺乳动物细胞产生的天然存在的igg1抗体通常包含分支的、双触角寡糖,其一般通过n键连接于fc区的c
h2
结构域的asn 297。参见wright等人,tibtech,1997,15:26-32,其以引用的方式整体并入。连接于asn 297的寡糖可包括各种碳水化合物,诸如甘露糖、n-乙酰葡糖胺(glcnac)、半乳糖和唾液酸,以及连接于双触角寡糖结构“主干”中的glcnac的岩藻糖。
[0643]
在一些实施方案中,修饰连接于asn 297的寡糖以创建具有改变的adcc的抗体。在一些实施方案中,改变寡糖以改进adcc。在一些实施方案中,改变寡糖以减少adcc。
[0644]
在一些方面,本文提供的抗体包含相较于天然存在的igg1结构域,在位置asn 297处具有降低的海藻糖含量的igg1结构域。已知所述fc结构域具有改进的adcc。参见shields等人,j.biol.chem.,2002,277:26733-26740,其以引用的方式整体并入本文。在一些方面,此类抗体在位置asn 297处不包含任何海藻糖。海藻糖的量可使用任何适合方法测定,例如如以引用的方式整体并入本文的wo 2008/077546中所述。
[0645]
在一些实施方案中,本文提供的抗体包含二等分寡糖,诸如连接于抗体的fc区的由glcnac二等分的双触角寡糖。此类抗体变体可具有降低的海藻糖基化和/或改进的adcc功能。此类抗体变体的实例例如描述于wo 2003/011878;美国专利号6,602,684;和美国专利公布号2005/0123546;所述专利中的每一者以引用的方式整体并入。
[0646]
可并入本文提供的抗体中的其他说明性糖基化变体例如描述于美国专利公布号2003/0157108、2004/0093621、2003/0157108、2003/0115614、2002/0164328、2004/0093621、2004/0132140、2004/0110704、2004/0110282、2004/0109865;国际专利公布号2000/61739、2001/29246、2003/085119、2003/084570、2005/035586、2005/035778;2005/053742、2002/031140;okazaki等人,j.mol.biol.,2004,336:1239-1249;以及yamane-ohnuki等人,biotech.bioeng.,2004,87:614-622中,所述专利和文献中的每一者以引用的方式整体并入。
[0647]
在一些实施方案中,本文提供的抗体包含在连接于fc区的寡糖中具有至少一个半乳糖残基的fc区。此类抗体变体可具有改进的cdc功能。所述抗体变体的实例例如描述于wo 1997/30087;wo 1998/58964;以及wo 1999/22764中;所述专利中的每一者以引用的方式整体并入。
[0648]
能够产生脱岩藻糖基化抗体的细胞系的实例包括lec13 cho细胞,所述lec13 cho细胞是蛋白质岩藻糖基化缺陷的(参见ripka等人,arch.biochem.biophys.,1986,249:533-545;美国专利公布号2003/0157108;wo 2004/056312;所述文献和专利中的每一者以引用的方式整体并入),以及剔除细胞系诸如α-1,6-海藻糖基转移酶基因或fut8剔除cho细
胞(参见yamane-ohnuki等人,biotech.bioeng.,2004,87:614-622;kanda等人,biotechnol.bioeng.,2006,94:680-688;以及wo 2003/085107;所述文献和专利中的每一者以引用的方式整体并入)。
[0649]
在一些实施方案中,本文提供的抗体是糖基化抗体。可使用本领域已知或本文所述的任何方法来产生无糖基化的抗体。在一些方面,通过修饰抗体以去除所有糖基化位点来产生无糖基化抗体。在一些方面,仅从抗体的fc区去除糖基化位点。在一些方面,通过在不能够糖基化的生物体诸如大肠埃希氏菌中表达抗体或通过在无细胞反应混合物中表达抗体来产生无糖基化抗体。
[0650]
在一些实施方案中,与天然igg1抗体相比,本文提供的抗体具有恒定区,所述恒定区具有降低的效应子功能。在一些实施方案中,本文提供的抗体的fc区的恒定区对fc受体的亲和力小于天然igg1恒定区对此种fc受体的亲和力。
[0651]
2.7.恒定区、fc区和氨基酸序列变体
[0652]
在一些实施方案中,本文提供的抗体包含一个或多个恒定区。
[0653]
在一些实施方案中,抗体包含人ig恒定结构域。在一些实施方案中,抗体包含来自人iga、igg、ige、igd或igm抗体的恒定区。在一些实施方案中,抗体包含来自人igg的恒定区。人igg可以是人igg1、人igg2、人igg3或人igg4。
[0654]
在一些实施方案中,抗体包含人igg1 ch1结构域。在一些实施方案中,人igg1 ch1结构域序列如下:astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkv。
[0655]
在一些实施方案中,人igg1 ch1结构域来自特定的同种异型。适用于本文中的任何抗体的人igg1同种异型描述于http://www.imgt.org/imgtrepertoire/proteins/allotypes/human/igh/ighc/g1m_allotypes.html中,其以引用的方式整体并入本文。在特定实施方案中,同种异型是g1m3,在本文中也称为ighg1*03。g1m3,也称为ighg1*03同种异型,描述于http://www.imgt.org/imgtrepertoire/proteins/allotypes/human/igh/ighc/g1m_allotypes.html中,其以引用的方式整体并入。
[0656]
在一些实施方案中,同种异型ighg1*03的人igg1 ch1区包含ch1结构域序列astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrv。
[0657]
在一些实施方案中,本文提供的抗体包含fc区。fc区可以来自人iga、igg、ige、igd或igm抗体。
[0658]
在一些实施方案中,抗体包含人igg fc区。人igg fc区可以是人igg1 fc区、人igg2 fc区、人igg3 fc区、人igg4 fc区。
[0659]
在特定实施方案中,抗体包含人igg1 fc区。人igg1 fc区可包含铰链序列。在一些实施方案中,铰链序列为epkscdkthtcp。
[0660]
人igg1 fc区可包含人igg1 ch2结构域序列。在一些实施方案中,人igg1 ch2结构域序列如下:pcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak。
[0661]
人igg1 fc区可包含人igg1 ch3结构域序列。人igg1 ch3结构域序列如下:gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgn
vfscsvmhealhnhytqkslslspg。在一些实施方案中,人igg1 ch3结构域序列还包含c末端赖氨酸(k)。
[0662]
在一些实施方案中,人igg1 fc区包含以下序列:pcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。在一些实施方案中,人igg1 fc区序列还包含c末端赖氨酸(k)。
[0663]
在一些实施方案中,人igg1 fc区包含以下序列:epkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak gqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。在一些实施方案中,人igg1 fc区序列还包含c末端赖氨酸(k)。
[0664]
在一些实施方案中,人igg1 fc区具有特定的同种异型。适用于本文中的任何抗体的人igg1同种异型描述于http://www.imgt.org/imgtrepertoire/proteins/allotypes/human/igh/ighc/g1m_allotypes.html中,其以引用的方式整体并入本文。在特定实施方案中,同种异型是g1m3,在本文中也称为ighg1*03。g1m3,也称为ighg1*03同种异型,描述于http://www.imgt.org/imgtrepertoire/proteins/allotypes/human/igh/ighc/g1m_allotypes.html中,其以引用的方式整体并入。
[0665]
在一些实施方案中,人igg1同种异型ighg1*03fc区包含以下ch2序列:pcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskak。
[0666]
在一些实施方案中,人igg1同种异型ighg1*03fc区包含以下ch3序列:gqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。在一些实施方案中,人igg1同种异型ighg1*03fc区的ch3区还包含c末端赖氨酸(k)。
[0667]
在一些实施方案中,人igg1同种异型ighg1*03fc区包含以下fc序列:pcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。在一些实施方案中,人igg1同种异型ighg1*03fc区序列还包含c-末端赖氨酸(k)。
[0668]
在一些实施方案中,人igg1同种异型ighg1*03fc区包含以下fc序列:epkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg。在一些实施方案中,人igg1同种异型ighg1*03fc区序列还包含c-末端赖氨酸(k)。
[0669]
在某些实施方案中,本文提供的抗体包含与天然存在的fc区相比具有一个或多个氨基酸取代、插入或缺失的fc区。在一些方面,此类取代、插入或缺失产生具有改变的稳定性、糖基化或其他特征的抗体。在一些方面,此类取代、插入或缺失产生糖基化抗体。
[0670]
在一些方面,对本文提供的抗体的fc区进行修饰以产生对fc受体具有改变的亲和
力的抗体、或更具免疫惰性的抗体。在一些实施方案中,本文提供的抗体变体具有一些但不是所有的效应子功能。例如,当抗体的半衰期在体内很重要,但是当某些效应子功能(例如,补体激活和adcc)不必要或有害时,此类抗体可为有用的。
[0671]
在一些实施方案中,本文提供的抗体的fc区是包含铰链稳定突变s228p和l235e中的一个或多个的人igg4 fc区。参见aalberse等人,immunology,2002,105:9-19,其以引用的方式整体并入。在一些实施方案中,igg4 fc区包含以下突变中的一个或多个:e233p、f234v和l235a。参见armour等人,mol.immunol.,2003,40:585-593,其以引用的方式整体并入。在一些实施方案中,igg4 fc区包含位置g236处的缺失。
[0672]
在一些实施方案中,本文提供的抗体的fc区是包含一个或多个突变以降低fc受体结合的人igg1 fc区。在一些方面,一个或多个突变在选自s228(例如,s228a)、l234(例如,l234a)、l235(例如,l235a)、d265(例如,d265a)和n297(例如,n297a)的残基中。在一些方面,抗体包含pva236突变。pva236意指来自igg1的氨基酸位置233至236的氨基酸序列ellg或igg4的eflg被pva替代。参见美国专利号9,150,641中,其以引用的方式整体并入。
[0673]
在一些实施方案中,对本文提供的抗体的fc区进行修饰,如描述于armour等人,eur.j.immunol.,1999,29:2613-2624;wo 1999/058572;和/或英国专利申请号98099518中;其各自以引用的方式整体并入。
[0674]
在一些实施方案中,本文提供的抗体的fc区是包含突变a330s和p331s中的一个或多个的人igg2 fc区。
[0675]
在一些实施方案中,本文提供的抗体的fc区在选自238、265、269、270、297、327和329的一个或多个位置具有氨基酸取代。参见美国专利号6,737,056中,其以引用的方式整体并入。此类fc突变体包括在氨基酸位置265、269、270、297和327中的两处或更多处具有取代的fc突变体,包括用丙氨酸取代残基265和297的所谓的“dana”fc突变体。参见美国专利号7,332,581中,其以引用的方式整体并入。在一些实施方案中,抗体包含氨基酸位置265处的丙氨酸。在一些实施方案中,抗体包含氨基酸位置297处的丙氨酸。
[0676]
在某些实施方案中,本文提供的抗体包含具有一个或多个使adcc改进的氨基酸取代的fc区,所述氨基酸取代诸如是在fc区的位置298、333和334中的一者或多者处的取代。在一些实施方案中,本文提供的抗体包含具有在位置239、332和330处的一个或多个氨基酸取代的fc区,如lazar等人,proc.natl.acad.sci.usa,2006,103:4005-4010中所述,所述文献以引用的方式整体并入。
[0677]
在一些实施方案中,本文提供的抗体包含一个或多个使c1q结合和/或cdc改进或减弱的改变。参见美国专利号6,194,551;wo 99/51642;以及idusogie等人,j.immunol.,2000,164:4178-4184;所述专利和文献中的每一者以引用的方式整体并入本文。
[0678]
在一些实施方案中,本文提供的抗体包含一个或多个增加半衰期的改变。具有增加的半衰期和改进的与新生儿fc受体(fcrn)结合的抗体描述于例如hinton等人,j.immunol.,2006,176:346-356;和美国专利公布号2005/0014934中,其各自以引用的方式整体并入。此类fc变体包括在igg的fc区残基238、250、256、265、272、286、303、305、307、311、312、314、317、340、356、360、362、376、378、380、382、413、424、428和434中的一处或多处具有取代的那些变体。
[0679]
在一些实施方案中,本文提供的抗体包含一种或多种fc区变体,如描述于美国专
利号7,371,826、5,648,260和5,624,821;duncan和winter,nature,1988,322:738-740;和wo 94/29351中;其各自以引用的方式整体并入。
[0680]
2.8.焦谷氨酸
[0681]
如本领域中已知的,重组蛋白n端处的谷氨酸(e)和谷氨酰胺(q)在体外和体内可自发地环化以形成焦谷氨酸(pe)。参见liu等人,j.biol.chem.,2011,286:11211-11217,其以引用的方式整体并入本文。
[0682]
在一些实施方案中,本文提供了包含在n端位置具有pe残基的多肽序列的抗体。在一些实施方案中,本文提供了包含多肽序列的抗体,其中n端残基已从q转化为pe。在一些实施方案中,本文提供了包含多肽序列的抗体,其中n端残基已从e转化为pe。
[0683]
2.9.经半胱氨酸工程改造的抗体变体
[0684]
在某些实施方案中,本文提供了经半胱氨酸工程改造的抗体,也称为“thiomab”,其中抗体的一个或多个残基用半胱氨酸残基取代。在具体的实施方案中,取代的残基存在于抗体的溶剂可接近位点。通过用半胱氨酸取代此类残基,反应性硫醇基团被引入抗体的可接近位点,并且可用于将抗体与其它部分(诸如药物部分或连接子-药物部分)缀合,以例如创建免疫缀合物。
[0685]
在某些实施方案中,可用半胱氨酸取代下列残基中的任一个或多个:轻链的v205;重链fc区的a118;和重链fc区的s400。可生成经半胱氨酸工程改造的抗体,如描述于例如美国专利号7,521,541中,其以引用的方式整体并入。
[0686]
3.抗tf抗体-药物缀合物
[0687]
本文提供了抗体-药物缀合物(adc),所述抗体-药物缀合物包含与tf和细胞毒性剂特异性结合的抗体。在一些实施方案中,细胞毒性剂直接连接到抗tf抗体。在一些实施方案中,细胞毒性剂间接连接到抗tf抗体。
[0688]
在一些实施方案中,adc还包含连接子。在一些实施方案中,连接子将抗tf抗体连接到细胞毒性剂。
[0689]
adc中与抗体缀合的细胞毒性剂的数量被定义为药物-抗体比率或dar。如本领域已知的,大多数缀合方法产生包括各种dar种类的adc组合物,其中报告的dar是各个dar种类的平均值。因此,当本文所述的adc被定义为具有特定的dar时,应理解所提供的数字表示adc组合物中各个dar种类的平均值。在一些实施方案中,本文提供的adc具有的药物-抗体比率(dar)为1。在一些实施方案中,本文提供的adc具有的dar为2。在一些实施方案中,本文提供的adc具有的dar为3。在一些实施方案中,本文提供的adc具有的dar为4。在一些实施方案中,本文提供的adc具有的dar为5。在一些实施方案中,本文提供的adc具有的dar为1至2、1至3、1至4、1至5、2至3、2至4、2至5、3至4、3至5、4至5、1、2、3、4或5。在一些实施方案中,本文提供的adc具有的dar大于5。在一些实施方案中,通过uv/vis光谱、疏水相互作用色谱(hic)和/或具有飞行时间检测和质量表征的反相液相色谱分离(rp-uplc/质谱)来测量dar。在一些实施方案中,药物连接形式的分布(例如,dar0、dar1、dar2等种类的分数)也可以通过本领域已知的各种技术进行分析,包括ms(有或没有伴随的色谱分离步骤)、疏水相互作用色谱、反相hplc或等电聚焦凝胶电泳(ief)(参见例如sun等人,bioconj chem.,28:1371-81(2017);wakankar等人,mabs,3:161-172(2011))。
[0690]
4.用于制备tf抗体的方法
[0691]
4.1.tf抗原制备
[0692]
用于分离本文提供的抗体的tf抗原可为完整tf或tf的片段。tf抗原可为例如经分离蛋白质或在细胞表面上表达的蛋白质的形式。
[0693]
在一些实施方案中,tf抗原为tf的非天然存在的变体,诸如具有自然界中不存在的氨基酸序列或翻译后修饰的tf蛋白。
[0694]
在一些实施方案中,通过去除例如细胞内或跨膜序列或信号序列来截短tf抗原。在一些实施方案中,tf抗原在其c端融合至人igg1 fc结构域或聚组氨酸标签。
[0695]
4.2.单克隆抗体的制备方法
[0696]
单克隆抗体可例如使用kohler等人,nature,1975,256:495-497(以引用的方式整体并入)首先描述的杂交瘤方法获得,和/或通过重组dna方法(参见例如,美国专利号4,816,567,其以引用的方式整体并入)。单克隆抗体也可例如使用噬菌体展示文库(参见例如,美国专利号8,258,082,其以引用的方式整体并入),或另选地,使用基于酵母的文库(参见例如,美国专利号8,691,730,其以引用的方式整体并入)。
[0697]
在杂交瘤方法中,对小鼠或其他适当的宿主动物进行免疫以引发产生或能够产生将与用于免疫的蛋白特异性结合的抗体的淋巴细胞。另选地,可在体外免疫淋巴细胞。然后使用适合融合剂诸如聚乙二醇将淋巴细胞与骨髓瘤细胞融合,以形成杂交瘤细胞。参见goding j.w.,monoclonal antibodies:principles and practice第3版(1986)academic press,san diego,ca,其以引用的方式整体并入。
[0698]
将杂交瘤细胞接种于适合培养基中并在其中生长,所述培养基含有抑制未融合的亲代骨髓瘤细胞生长或生存的一种或多种物质。例如,如果亲代骨髓瘤细胞缺乏次黄嘌呤鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),则杂交瘤的培养基通常将包括次黄嘌呤、氨基蝶呤和胸腺嘧啶(hat培养基),这些物质阻止hgprt缺陷型细胞的生长。
[0699]
有用的骨髓瘤细胞是有效融合、支持由所选抗体产生细胞稳定地高水平产生抗体、并且具有敏感培养基条件(诸如存在或不存在hat培养基)的那些骨髓瘤细胞。其中,优选的骨髓瘤细胞系是鼠类骨髓瘤细胞系,诸如来源于mop-21和mc-11小鼠肿瘤(可购自salk institute cell distribution center,san diego,ca)以及sp-2或x63-ag8-653细胞(可购自american type culture collection,rockville,md)的那些。还描述了用于产生人单克隆抗体的人骨髓瘤和小鼠-人异源骨髓瘤细胞系。参见例如,kozbor,j.immunol.,1984,133:3001,其以引用的方式整体并入。
[0700]
在鉴定出产生所需特异性、亲和力和/或生物学活性的抗体的杂交瘤细胞后,可通过限制稀释程序来对所选克隆进行亚克隆,并通过标准方法生长。参见goding,同上。用于此目的的适合培养基包括例如d-mem或rpmi-1640培养基。此外,杂交瘤细胞可在动物中作为腹水肿瘤在体内生长。
[0701]
编码单克隆抗体的dna可被容易地分离并使用常规程序(例如,通过使用能够特异性结合编码单克隆抗体的重链和轻链的基因的寡核苷酸探针)进行测序。因此,杂交瘤细胞可充当编码具有所需特性的抗体的dna的有用来源。一旦分离,可将dna置于表达载体中,然后将其转染到宿主细胞中,诸如细菌(例如,大肠埃希氏菌(e.coli))、酵母(例如,酿酒酵母(saccharomyces)或毕赤酵母(pichia sp.))、cos细胞、中国仓鼠卵巢(cho)细胞或本身不产生抗体的骨髓瘤细胞中,以产生单克隆抗体。
[0702]
4.3.嵌合抗体的制备方法
[0703]
制备嵌合抗体的说明性方法描述于例如美国专利号4,816,567;和morrison等人,proc.natl.acad.sci.usa,1984,81:6851-6855;其各自以引用的方式整体并入。在一些实施方案中,通过使用重组技术将非人可变区(例如,来源于小鼠、大鼠、仓鼠、兔或非人灵长类诸如猴的可变区)与人恒定区组合来制备嵌合抗体。
[0704]
4.4.人源化抗体的制备方法
[0705]
可通过用相应的人抗体序列取代非人单克隆抗体的大部分或所有结构部分来生成人源化抗体。因此,生成了杂交分子,其中仅抗原特异性变量或cdr由非人序列组成。获得人源化抗体的方法包括描述于例如以下中的那些:winter和milstein,nature,1991,349:293-299;rader等人,proc.nat.acad.sci.u.s.a.,1998,95:8910-8915;steinberger等人,j.biol.chem.,2000,275:36073-36078;queen等人,proc.natl.acad.sci.u.s.a.,1989,86:10029-10033;以及美国专利号5,585,089、5,693,761、5,693,762和6,180,370;其各自以引用的方式整体并入。
[0706]
4.5.人抗体的制备方法
[0707]
人抗体可通过本领域已知的多种技术生成,例如通过使用转基因动物(例如,人源化小鼠)。参见例如jakobovits等人,proc.natl.acad.sci.u.s.a.,1993,90:2551;jakobovits等人,nature,1993,362:255-258;bruggermann等人,year in immuno.,1993,7:33;以及美国专利号5,591,669、5,589,369和5,545,807;其各自以引用的方式整体并入。人抗体还可源自噬菌体展示文库(参见例如,hoogenboom等人,j.mol.biol.,1991,227:381-388;marks等人,j.mol.biol.,1991,222:581-597;以及美国专利号5,565,332和5,573,905;其各自以引用的方式整体并入)。还可由体外激活的b细胞来生成人抗体(参见例如,美国专利号5,567,610和5,229,275,其各自以引用的方式整体并入)。人抗体还可源自基于酵母的文库(参见例如美国专利号8,691,730,其以引用的方式整体并入)。
[0708]
4.6.抗体片段的制备方法
[0709]
本文提供的抗体片段可通过任何适合方法制备,包括本文所述的说明性方法或本领域已知的那些方法。适合方法包括重组技术和整个抗体的蛋白水解消化。制备抗体片段的说明性方法描述于例如hudson等人,nat.med.,2003,9:129-134中,其以引用的方式整体并入。制备scfv抗体的方法描述于例如pl
ü
ckthun中,the pharmacology of monoclonal antibodies,第113卷,rosenburg和moore编,springer-verlag,new york,第269-315页(1994);wo 93/16185;以及美国专利号5,571,894和5,587,458中;其各自以引用的方式整体并入。
[0710]
4.7.替代性骨架的制备方法
[0711]
本文提供的替代性骨架可通过任何适合方法制备,包括本文所述的说明性方法或本领域已知的那些方法。例如,adnectins
tm
的制备方法描述于emanuel等人,mabs,2011,3:38-48中,其以引用的方式整体并入。imab的制备方法描述于美国专利公布号2003/0215914中,其以引用的方式整体并入。的制备方法描述于vogt和skerra,chem.biochem.,2004,5:191-199中,其以引用的方式整体并入。kunitz结构域的制备方法描述于wagner等人,biochem.&biophys.res.comm.,1992,186:118-1145中,其以引用的方式整体并入。硫氧还蛋白肽适体的制备方法提供于geyer和brent,meth.enzymol.,2000,
328:171-208中,其以引用的方式整体并入。亲和体的制备方法提供于fernandez,curr.opinion in biotech.,2004,15:364-373中,其以引用的方式整体并入。darpins的制备方法提供于zahnd等人,j.mol.biol.,2007,369:1015-1028中,其以引用的方式整体并入。人泛素的制备方法提供于ebersbach等人,j.mol.biol.,2007,372:172-185中,其以引用的方式整体并入。四连接素的制备方法提供于graversen等人,j.biol.chem.,2000,275:37390-37396中,其以引用的方式整体并入。高亲和性多聚体的制备方法提供于silverman等人,nature biotech.,2005,23:1556-1561中,其以引用的方式整体并入。fynomers的制备方法提供于silacci等人,j.biol.chem.,2014,289:14392-14398中,其以引用的方式整体并入。
[0712]
关于替代性骨架的其他信息提供于binz等人,nat.biotechnol.,200523:1257-1268;和skerra,current opin.in biotech.,2007 18:295-304中,其各自以引用的方式整体并入。
[0713]
4.8.多特异性抗体的制备方法
[0714]
本文提供的多特异性抗体可通过任何适合方法制备,包括本文所述的说明性方法或本领域已知的那些方法。常见轻链抗体的制备方法描述于merchant等人,nature biotechnol.,1998,16:677-681中,其以引用的方式整体并入。四价双特异性抗体的制备方法描述于coloma和morrison,nature biotechnol.,1997,15:159-163中,其以引用的方式整体并入。杂化免疫球蛋白的制备方法描述于milstein和cuello,nature,1983,305:537-540;以及staerz和bevan,proc.natl.acad.sci.usa,1986,83:1453-1457中;其各自以引用的方式整体并入。具有杵臼修饰的免疫球蛋白的制备方法描述于美国专利号5,731,168中,其以引用的方式整体并入。具有静电修饰的免疫球蛋白的制备方法提供于wo 2009/089004中,其以引用的方式整体并入。双特异性单链抗体的制备方法描述于traunecker等人,embo j.,1991,10:3655-3659;和gruber等人,j.immunol.,1994,152:5368-5374中;其各自以引用的方式整体并入。连接子长度可变化的单链抗体的制备方法描述于美国专利号4,946,778和5,132,405中,其各自以引用的方式整体并入。双抗体的制备方法描述于hollinger等人,proc.natl.acad.sci.usa,1993,90:6444-6448中,其以引用的方式整体并入。三抗体和四抗体的制备方法描述于todorovska等人,j.immunol.methods,2001,248:47-66中,其以引用的方式整体并入。三特异性f(ab’)3衍生物的制备方法描述于tutt等人j.immunol.,1991,147:60-69,其各自以引用的方式整体并入。交联抗体的制备方法描述于美国专利号4,676,980;brennan等人,science,1985,229:81-83;staerz等人nature,1985,314:628-631;以及ep 0453082中,其以引用的方式整体并入。由亮氨酸拉链组装的抗原结合结构域的制备方法描述于kostelny等人,j.immunol.,1992,148:1547-1553中;其各自以引用的方式整体并入。通过dnl方法制备抗体的方法描述于美国专利号7,521,056;7,550,143;7,534,866和7,527,787中;其以引用的方式整体并入,以用于此种抗体的实例。抗体和非抗体分子的杂化物的制备方法描述于wo 93/08829中,其以引用的方式整体并入。daf抗体的制备方法描述于美国专利公布号2008/0069820中,其以引用的方式整体并入。通过还原和氧化制备抗体的方法描述于carlring等人,plos one,2011,6:e22533中,其以引用的方式整体并入。dvd-igs
tm
的制备方法描述于美国专利号7,612,181中,其以引用的方式整体并入。darts
tm
的制备方法描述于moore等人,blood,2011,117:454-451中,其以引用的方式整体并
入。的制备方法描述于labrijn等人,proc.natl.acad.sci.usa,2013,110:5145-5150;gramer等人,mabs,2013,5:962-972;和labrijn等人,nature protocols,2014,9:2450-2463中;其各自以引用的方式整体并入。包含从igg融合到c
h3
的c端的scfv的抗体的制备方法描述于coloma和morrison,nature biotechnol.,1997,15:159-163中,其以引用的方式整体并入。fab分子连接到免疫球蛋白的恒定区的抗体的制备方法描述于miler等人,j.immunol.,2003,170:4854-4861中,其以引用的方式整体并入。covx-bodies的制备方法描述于doppalapudi等人,proc.natl.acad.sci.usa,2010,107:22611-22616中,其以引用的方式整体并入。fcab抗体的制备方法描述于wozniak-knopp等人,protein eng.des.sel.,2010,23:289-297中,其以引用的方式整体并入。抗体的制备方法描述于kipriyanov等人,j.mol.biol.,1999,293:41-56和zhukovsky等人,blood,2013,122:5116中,其各自以引用的方式整体并入。串联fab的制备方法描述于wo2015/103072中,其以引用的方式整体并入。zybodies
tm
的制备方法描述于lafleur等人,mabs,2013,5:208-218中,其以引用的方式整体并入。
[0715]
4.9.制备变体的方法
[0716]
在一些实施方案中,本文提供的抗体是亲本抗体的亲和力成熟的变体,其可例如使用基于噬菌体文库的亲和力成熟技术来生成。简言之,可对一个或多个cdr残基进行突变,并且将变体抗体或其部分在噬菌体上展示并筛选亲和力。可在cdr“热点”或由密码子编码的残基中进行此类改变,所述残基在体细胞成熟过程期间经历高频突变(参见chowdhury,methods mol.biol.,2008,207:179-196,其以引用的方式整体并入)和/或与抗原接触的残基。
[0717]
可使用任何适合方法将可变性引入编码抗体的一个或多个多核苷酸序列中,包括易错pcr、链改组和寡核苷酸定向诱变,诸如三核苷酸定向诱变(trim)。在一些方面,数个cdr残基(例如,一次4至6个残基)是随机的。可例如使用丙氨酸扫描诱变或建模来特异性鉴定涉及抗原结合的cdr残基。特别是cdr-h3和cdr-l3通常是突变的靶。
[0718]
将多样性引入可变区和/或cdr中可用于产生次级文库。然后,筛选次级文库以鉴定具有改进的亲和力的抗体变体。通过次级文库的构建和再选择进行的亲和力成熟已经描述于例如hoogenboom等人,methods in molecular biology,2001,178:1-37中,其以引用的方式整体并入。
[0719]
4.10.载体、宿主细胞和重组方法
[0720]
还提供了编码tf抗体的经分离的核酸、包含核酸的载体以及包含载体和核酸的宿主细胞、以及用于产生抗体的重组技术。
[0721]
为了重组制备抗体,可将编码其的一个或多个核酸分离并插入可复制载体中以便进一步克隆(即dna扩增)或进行表达。在一些方面,可通过同源重组产生核酸,例如,如描述于美国专利号5,204,244中,其以引用的方式整体并入。
[0722]
许多不同的载体在本领域中是已知的。载体组分通常包括但不限于以下一种或多种:信号序列、复制起点、一个或多个标记基因、增强子元件、启动子和转录终止序列,例如如描述于美国专利号5,534,615中,其以引用的方式整体并入。
[0723]
下面提供了适合宿主细胞的说明性实例。这些宿主细胞并不意味着是限制性的,并且任何适合宿主细胞可用于产生本文提供的抗体。
[0724]
适合宿主细胞包括任何原核(例如,细菌)、低等真核(例如,酵母)或高等真核(例如,哺乳动物)细胞。适合原核细胞包括真细菌,诸如革兰氏阴性或革兰氏阳性生物体,例如肠杆菌科诸如埃希氏菌属(escherichia)(大肠埃希氏菌)、肠杆菌属(enterobacter)、欧文氏菌属(erwinia)、克雷伯氏菌属(klebsiella)、变形杆菌属(proteus)、沙门氏菌属(salmonella)(鼠伤寒沙门氏菌(s.typhimurium))沙雷氏菌属(serratia)(粘质沙雷氏菌(s.marcescans)、和志贺氏菌属(shigella)、芽孢杆菌属(bacilli)(枯草芽孢杆菌(b.subtilis)和地衣芽孢杆菌(b.licheniformis))、假单胞菌菌(pseudomonas)(铜绿假单胞菌(p.aeruginosa)),和链霉菌属(streptomyces)。一种有用的大肠埃希氏菌克隆宿主是大肠埃希氏菌294,但其他菌株诸如大肠埃希氏菌b、大肠埃希氏菌x1776和大肠埃希氏菌w3110也是适合。
[0725]
除原核生物外,真核微生物诸如丝状真菌(filamentous fungi)或酵母也是tf抗体编码载体的适合克隆或表达宿主。酿酒酵母或普通面包酵母(common baker's yeast)是低等真核宿主微生物中常用的。然而,许多其他属、种和菌株是可获得并且有用的,诸如粟酒裂殖酵母(schizosaccharomyces pombe);克鲁维酵母属宿主(kluyveromyces)(乳酸克鲁维酵母(k.lactis)、脆壁克鲁维酵母(k.fragilis)、保加利亚克鲁维酵母(k.bulgaricus)、威肯克鲁维酵母(k.wickeramii)、克鲁雄酵母(k.waltii)、果蝇克鲁维酵母(k.drosophilarum)、耐热克鲁维酵母(k.thermotolerans)和马克斯克鲁维酵母(k.marxianus));耶氏酵母属(yarrowia)、巴氏毕赤酵母(pichia pastoris)、假丝酵母属(candida)(白假丝酵母(c.albicans))、瑞氏木霉(trichoderma reesia)、粗糙链孢霉(neurospora crassa)、许旺酵母属(schwanniomyces)(西方许旺酵母(s.occidentalis));和丝状真菌诸如例如青霉菌属(penicillium)、弯颈霉属(tolypocladium)和曲霉属(aspergillus)(构巢曲霉(a.nidulans)和黑曲霉(a.niger))。
[0726]
有用的哺乳动物宿主细胞包括cos-7细胞、hek293细胞、幼仓鼠肾(bhk)细胞、中国仓鼠卵巢(cho)、小鼠睾丸支持细胞、非洲绿猴肾细胞(vero-76)等。
[0727]
用于产生本发明的tf抗体的宿主细胞可在多种培养基中培养。市售的培养基,诸如例如ham's f10、最小必需培养基(minimal essential medium)(mem)、rpmi-1640以及达尔伯克氏改良伊格尔培养基(dulbecco’s modified eagle’s medium)(dmem),适于培养宿主细胞。此外,可使用描述于ham等人,meth.enz.,1979,58:44;barnes等人,anal.biochem.,1980,102:255;以及美国专利号4,767,704、4,657,866、4,927,762、4,560,655和5,122,469;或wo 90/03430和wo 87/00195中的任何培养基。上述参考文献各自以引用的方式整体并入。
[0728]
这些培养基中的任何一种可根据需要用激素和/或其它生长因子(例如胰岛素、转铁蛋白或表皮生长因子)、盐(例如氯化钠、钙、镁及磷酸盐)、缓冲液(例如hepes)、核苷酸(例如腺嘌呤核苷和胸腺嘧啶核苷)、抗生素、微量元素(定义为通常以微摩尔范围的最终浓度存在的无机化合物),以及葡萄糖或等量的能量源进行补充。也可以本领域技术人员已知的适当浓度包含任何其它必需补充剂。
[0729]
培养条件,诸如温度、ph等,是先前与选择用于表达的宿主细胞一起使用的那些条件,并且对于普通技术人员而言是显而易见的。
[0730]
当使用重组技术时,抗体可在细胞内、周质空间中产生、或直接分泌到培养基中。
如果抗体在细胞内产生,则作为第一步,例如通过离心或超滤去除颗粒碎片(宿主细胞或裂解片段)。例如,carter等人(bio/technology,1992,10:163-167,其以引用的方式整体并入)描述了分离分泌至大肠埃希氏菌的周质空间的抗体的程序。简言之,在乙酸钠(ph 3.5)、edta和苯甲基磺酰氟(pmsf)的存在下解冻细胞体约30分钟。可通过离心去除细胞碎片。
[0731]
在一些实施方案中,抗体在无细胞体系中产生。在一些方面,无细胞体系是体外的转录和翻译系统,如描述于yin等人,mabs,2012,4:217-225中,其以引用的方式整体并入。在一些方面,无细胞体系利用来自真核细胞或原核细胞的无细胞提取物。在一些方面,原核细胞为大肠埃希氏菌。抗体的无细胞表达可为有用的,例如,在抗体以不溶性聚集体形式在细胞中积累或周质表达的收率较低的情况下。
[0732]
在将抗体分泌到培养基中的情况下,通常首先使用可商购获得的蛋白质浓缩过滤器(例如,或超滤单元)浓缩来自此类表达体系的上清液。蛋白酶抑制剂诸如pmsf可包括在上述任何步骤中以抑制蛋白水解,并且可包括抗生素以防止不定污染物的生长。
[0733]
可使用例如羟磷灰石色谱、凝胶电泳、透析和亲和色谱来纯化由细胞制备的抗体组合物,其中亲和色谱是特别有用的纯化技术。蛋白a作为亲和配体的适用性取决于抗体中存在的任何免疫球蛋白fc结构域的种类和同型。蛋白a可用于纯化包含人γ1、γ2或γ4重链的抗体(lindmark等人,j.immunol.meth.,1983,62:1-13,其以引用的方式整体并入)。蛋白g可用于所有小鼠同型和人γ3(guss等人,embo j.,1986,5:1567-1575,其以引用的方式整体并入)。
[0734]
亲和配体所连接的基质最通常是琼脂糖,但也可使用其他基质。机械稳定的基质(诸如受控孔玻璃或聚(苯乙烯二乙烯基)苯)可实现比琼脂糖更快的流速和更短的处理时间。在抗体包含c
h3
结构域的情况下,bakerbond 树脂可用于纯化。
[0735]
用于蛋白质纯化的其他技术,诸如离子交换柱上的分馏、乙醇沉淀、反相hplc、硅胶色谱法、肝素色谱法、色谱聚焦、sds-page和硫酸铵沉淀也是可用的,并且可由本领域技术人员应用。
[0736]
在任何初步纯化步骤之后,可使用ph在约2.5至约4.5之间的洗脱缓冲液对包含受关注的抗体和污染物的混合物进行低ph疏水相互作用色谱法,通常在低盐浓度下(例如,约0至约0.25m盐)进行。
[0737]
5.细胞毒性剂
[0738]
在一些实施方案中,本文提供的adc包含细胞毒性剂。本文提供的细胞毒性剂包括本领域已知的各种抗肿瘤剂或抗癌剂。在一些实施方案中,细胞毒性剂引起癌细胞的破坏。在一些实施方案中,细胞毒性剂抑制癌细胞的生长或增殖。
[0739]
适合细胞毒性剂包括抗血管生成剂、促凋亡剂、抗有丝分裂剂、抗激酶剂、烷化剂、激素、激素激动剂、激素拮抗剂、趋化因子、药物、前药、毒素、酶、抗代谢药、抗生素、生物碱和放射性同位素。
[0740]
在一些实施方案中,细胞毒性剂包含以下中的至少一种:刺孢霉素、喜树碱、卡铂、伊立替康、sn-38、环磷酰胺、阿糖胞苷、达卡巴嗪、多西他赛、更生霉素、柔红霉素、多柔比
星、依托泊苷、伊达比星、拓扑替康、长春花生物碱、美登木素生物碱、美登木素生物碱类似物、吡咯并苯二氮杂紫杉烷类、多米卡星、多拉司他汀、奥里斯他汀及其衍生物。
[0741]
在某些实施方案中,细胞毒性剂为澳瑞他汀衍生物。在某些实施方案中,澳瑞他汀衍生物为单甲基澳瑞他汀e部分(mmae)。在某些实施方案中,澳瑞他汀衍生物为单甲基澳瑞他汀f(mmaf)。在一些实施方案中,澳瑞他汀衍生物是国际专利申请公开号wo 2016/041082中描述的澳瑞他汀衍生物之一。在一些实施方案中,澳瑞他汀衍生物是衍生自通式i化合物的部分:
[0742][0743]
其中:x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式i中所示的相应连接点,或x不存在;r1选自由以下组成的组:
[0744][0745]
其中#和%表示式i中所示的相应连接点;并且r2为苯基。
[0746]
在一些实施方案中,在通式i化合物中,r1选自由以下组成的组:
[0747][0748]
在一些实施方案中,在通式i化合物中,化合物由式ii表示:
[0749][0749][0750]
在一些实施方案中,在通式ii化合物中,r1选自由以下组成的组:
[0751][0752]
在一些实施方案中,在通式ii化合物中,r1选自由以下组成的组:
[0753][0754]
在一些实施方案中,在通式ii化合物中,r1是:
[0755][0756]
在一些实施方案中,在通式i化合物中,化合物由式iii表示:
[0757][0758]
在一些实施方案中,在通式iii化合物中,r1选自由以下组成的组:
[0759][0760]
在一些实施方案中,在通式iii化合物中,r1选自由以下组成的组:
[0761][0762]
在一些实施方案中,在通式iii化合物中,r1为:
[0763][0764]
在某些实施方案中,式i化合物为化合物9:
[0765][0766]
应当理解,在本公开的其余部分中,在各种实施方案中,对通式i化合物的提及包括通式ii化合物和通式iii化合物,其程度与特别叙述单独叙述这些式中的每一个的实施方案一样。
[0767]
在一些实施方案中,细胞毒性剂为诊断剂,诸如放射性同位素、金属螯合剂、酶、荧光化合物、生物发光化合物或化学发光化合物。
[0768]
在一些实施方案中,细胞毒性剂为经改进的安全性简档的细胞毒性有效载荷,例如xmt-1267和描述于trail等人,pharmacol ther,2018,181:126-142中的其他细胞毒性有效载荷。
[0769]
在某些实施方案中,本公开的adc包含经由连接子(l)缀合至澳瑞他汀衍生物(毒素)的tf抗体。在某些实施方案中,adc包含:(tf)结合人组织因子(tf)的胞外结构域的抗原结合蛋白(ab),其中所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中(i)所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,(ii)所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,(iii)所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,(i)所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、
vl-cdr2和vl-cdr3来自命名为25a5的抗体,(v)所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者(vi)所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体;以及(b)一个或多个由式iv表示的连接子-毒素部分:
[0770][0771]
其中:x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式iv中所示的相应连接点,或x不存在;l为连接子;!表示l与ab的连接点,其中l通过共价键连接至ab;r1选自由以下组成的组:
[0772][0773][0774]
其中#和%表示式iv中所示的相应连接点;并且r2为苯基。
[0775]
在一些实施方案中,在通式iv的连接子-毒素部分中,x不存在。
[0776]
在一些实施方案中,在通式iv的连接子-毒素部分中,l是可裂解的连接子。
[0777]
在一些实施方案中,在通式iv的连接子-毒素部分中,l是含肽的连接子。
[0778]
在一些实施方案中,通式iv的连接子-毒素部分由通式v表示:
[0779][0780]
其中r1、l和!是如上文对于通式iv所定义的。
[0781]
在一些实施方案中,在通式v的连接子-毒素部分中,r1选自:
[0782][0783]
在一些实施方案中,在通式v的连接子-毒素部分中,r1选自:
[0784][0785]
在一些实施方案中,在通式v的连接子-毒素部分中,r1是:
[0786][0787]
在一些实施方案中,在通式v的连接子-毒素部分中,l是可裂解的连接子。
[0788]
在一些实施方案中,在通式v的连接子-毒素部分中,l是含肽的连接子。
[0789]
在一些实施方案中,在通式v的连接子-毒素部分中,l是蛋白酶可裂解的连接子。
[0790]
在一些实施方案中,在通式iv或通式v的连接子-毒素部分中,l是选自以下之一的连接子:n-(β-马来酰亚胺丙氧基)-n-羟基琥珀酰亚胺酯(bmps)、n-(ε-马来酰亚胺己酰氧基)琥珀酰亚胺酯(emcs)、n-[γ-马来酰亚胺丁酰氧基]琥珀酰亚胺酯(gmbs)、1,6-己烷-双-乙烯砜(hbvs)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧基-(6-酰胺基己酸酯)(lc-smcc)、间马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、4-(4-n-马来酰亚胺基苯基)丁酸肼(mpbh)、琥珀酰亚胺基3-(溴乙酰胺基)丙酸酯(sbap)、琥珀酰亚胺基碘乙酸酯(sia)、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、n-琥珀酰亚胺基-4-(2-吡啶硫代)戊酸酯(spp)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧酸酯(smcc)、琥珀酰亚胺基4-(对马来酰亚胺基苯基)丁酸酯(smpb)、琥珀酰亚胺基6-[(β-马来酰亚胺基丙酰胺基)己酸酯](smph)、亚氨基硫烷(it)、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯(svsb)。
[0791]
在一些实施方案中,在通式iv或通式v的连接子-毒素部分中,l包含下式的聚(乙二醇)链:
[0792][0793]
其中g是1-20的整数。
[0794]
在一些实施方案中,在通式iv或通式v的连接子-毒素部分中,g为3。
[0795]
本文还涵盖包含缀合至通式iv或通式v的连接子-毒素的tf抗体的adc,其中连接子具有如下所述的通式viii或通式ix。
[0796]
在某些实施方案中,本公开的adc包含经由连接子(l)缀合至澳瑞他汀衍生物(毒素)的组织因子(tf)抗体,具有通式vi:
[0797][0798]
其中:ab表示tf抗体;n为大于或等于1的整数;x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式vi中所示的相应连接点,或x不存在;l为连接子,其中l通过共价键连接至ab;r1选自由以下组成的组:
[0799][0800]
其中#和%表示式vi中所示的相应连接点;并且r2为苯基。
[0801]
在一些实施方案中,在通式vi的adc中,n是1至10的整数。在一些实施方案中,在通式vi的adc中,n是选自由1、2、3、4和5组成的组的整数。在一些实施方案中,在通式vi的adc中,n是选自由2、3和4组成的组的整数。
[0802]
在一些实施方案中,在通式vi的adc中,r1选自由以下组成的组:
[0803][0804]
在一些实施方案中,在通式vi的adc中,x不存在。
[0805]
在一些实施方案中,在通式vi的adc中,r1选自由以下组成的组:
[0806]
并且x不存在。
[0807]
在一些实施方案中,在通式vi的adc中,r1选自由以下组成的组:
[0808][0809]
在一些实施方案中,在通式vi的adc中,r1选自由以下组成的组:
[0810]
并且x不存在。
[0811]
在一些实施方案中,在通式vi的adc中,r1是:
[0812][0813]
在一些实施方案中,在通式vi的adc中,r1是:
[0814]
并且x不存在。
[0815]
在一些实施方案中,在通式vi的adc中,l是可裂解的连接子。在一些实施方案中,在通式vi的adc中,l是含肽的连接子。在一些实施方案中,在通式vi的adc中,l是蛋白酶可裂解的连接子。
[0816]
在一些实施方案中,在通式vi的adc中,l是选自以下之一的连接子:n-(β-马来酰亚胺丙氧基)-n-羟基琥珀酰亚胺酯(bmps)、n-(ε-马来酰亚胺己酰氧基)琥珀酰亚胺酯(emcs)、n-[γ-马来酰亚胺丁酰氧基]琥珀酰亚胺酯(gmbs)、1,6-己烷-双-乙烯砜(hbvs)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧基-(6-酰胺基己酸酯)(lc-smcc)、间马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、4-(4-n-马来酰亚胺基苯基)丁酸肼(mpbh)、琥珀酰亚胺基3-(溴乙酰胺基)丙酸酯(sbap)、琥珀酰亚胺基碘乙酸酯(sia)、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、n-琥珀酰亚胺基-4-(2-吡啶硫代)戊酸酯(spp)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧酸酯(smcc)、琥珀酰亚胺基4-(对马来酰亚胺基苯基)丁酸酯(smpb)、琥珀酰亚胺基6-[(β-马来酰亚胺基丙酰胺基)己酸酯](smph)、亚氨基硫烷(it)、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯(svsb)。
[0817]
在一些实施方案中,在通式vi或通式v的连接子-毒素部分中,l包含下式的聚(乙二醇)链:
[0818][0819]
其中g是1-20的整数。
[0820]
在一些实施方案中,在通式vi的adc中,g为3。
[0821]
在通式vi的adc的某些实施方案中,l由通式vii的连接子表示:
[0822]2][0823]
其中:z表示与tf抗体的靶标基团(例如,半胱氨酸的硫醇或赖氨酸基团的伯胺)结合的官能团;d表示与式vi中所示的氨基的连接点;str是延伸物;aa1和aa2各自独立地为氨基酸,其中aa
1-[aa2]m形成蛋白酶裂解位点;x1为自降解基团;s是选自0和1的整数;m是选自由1、2、3和4组成的组的整数;并且o是选自0、1和2的整数。
[0824]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s选自由以下组成的组:亚烷基、基于脂肪族酸的延伸物、基于脂肪族二酸的延伸物、基于脂肪族胺的延伸物和基于脂肪族二胺的延伸物。
[0825]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s选自由以下组成的组:基于二甘醇酸酯的延伸物、基于丙二酸酯的延伸物、基于己酸酯的延伸物和基于己酰胺的延伸物。
[0826]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s选自由以下组成的组:基于甘氨酸的延伸物、基于聚乙二醇的延伸物和基于单甲氧基聚乙二醇的延伸物。
[0827]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s是:
[0828][0829]
其中h是1-20的整数,cc是指与aa1的连接点;并且dd是指与z的连接点。
[0830]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s选自:
[0831][0832]
其中:ee和ff分别表示与z和aa1的连接点;r选自氢和c
1-c6烷基;每次出现的p独立地为2至10的整数;并且每次出现的q独立地为1至10的整数。
[0833]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s选自由以下组成的组:
[0834][0835]
其中:ee和ff分别表示与z和aa1的连接点;每次出现的p独立地为2至10的整数;并且每次出现的q独立地为1至10的整数。
[0836]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,[str]s选自:
[0837][0838]
其中:ee和ff分别表示与z和aa1的连接点;每次出现的p独立地为2至6的整数;并且q为2至8的整数。
[0839]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,aa
1-[aa2]m选自val-lys、ala-lys、phe-lys、val-cit、phe-cit、leu-cit、ile-cit、trp-cit、phe-arg、ala-phe、val-ala、met-lys、asn-lys、ile-pro、ile-val、asp-val、his-val、met-(d)lys、asn-(d)lys、val-(d)asp、norval-(d)asp、ala-(d)asp、me3lys-pro、苯基gly-(d)lys、met-(d)lys、asn-(d)lys、pro-(d)lys、met-(d)lys、met-cit-val、gly-cit-val、(d)phe-phe-lys、(d)ala-phe-lys、gly-phe-leu-gly和ala-leu-ala-leu。
[0840]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,s是1。
[0841]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,o是0。
[0842]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,m选自1、2和3。
[0843]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,m是1。
[0844]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,aa
1-[aa2]m是选自val-lys、ala-lys、phe-lys、val-cit、phe-cit、leu-cit、ile-cit和trp-cit的二肽。
[0845]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,每个x1独立地选自对氨基苄氧羰基(pabc)、对氨基苄基醚(pabe)和甲基化乙二胺(med)。
[0846]
在一些实施方案中,在通式vi的adc中,其中l是通式vii的连接子,并且[str]s是:
[0847][0848]
s是1并且h是3。
[0849]
在某些实施方案中,adc包含具有式viii结构的连接子-毒素部分:
[0850][0851]
其中##表示连接子-毒素部分与tf抗体的连接点,并且连接子-毒素部分通过共价键连接至tf抗体。
[0852]
在一些实施方案中,本文提供式ix的抗体-药物缀合物:
[0853][0854]
其中:
[0855]
ab为组织因子(tf)抗体,并且n为大于或等于1的整数。在一些实施方案中,在式ix的adc中,n是1至10的整数。在式ix的adc的一些实施方案中,n选自由1、2、3、4和5组成的组。在一些实施方案中,在式ix的adc中,n是选自由2、3和4组成的组的整数。在一些实施方案中,在式ix的adc中,琥珀酰亚胺基通过共价键连接至ab。
[0856]
在式ix的adc的一些实施方案中,ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0857]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[0858]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[0859]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[0860]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[0861]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[0862]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体,n是大于或等于1的整数。
[0863]
在式ix的adc的一些实施方案中,ab包含来自命名为25a3的抗体的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3。
[0864]
在一个实施方案中,本文所述的adc包含一种抗体,其包含:
[0865]
完全重链序列qvqlvqsgaevkkpgasvkvsckasgytfdx[v/a]ygiswvrqapgqglewmgwiapyx[n/s]gntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcx[r/q]asx[q/e]six[s/n]x[s/n]wlawyqqkpgkapklliykax[s/y]x[s/n]lex[s/y]gvpsrfsgsgsgteftltisslqpddfatyycqx[q/l]fqx[s/k]lppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0866]
重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0867]
重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplap
sskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrasqsisswlawyqqkpgkapklliykasslesgvpsrfsgsgsgteftltisslqpddfatyycqqfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0868]
重链序列qvqlvqsgaevkkpgasvkvsckasgytfdaygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrasesisnwlawyqqkpgkapklliykaysleygvpsrfsgsgsgteftltisslqpddfatyycqqfqklppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,
[0869]
重链序列qvqlvqsgaevkkpgasvkvsckasgytfrsygiswvrqapgqglewmgwvapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspygygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrashsidswlawyqqkpgkapklliykasylesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,或者
[0870]
完全重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcrasesisnwlawyqqkpgkapklliykaysleygvpsrfsgsgsgteftltisslqpddfatyycqqfqklppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0871]
在一个实施方案中,本文所述的adc包含一种抗体,其包含:
[0872]
重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec。
[0873]
在一个实施方案中,本文描述了一种抗体-药物缀合物,其包含抗体(ab)和一种或多种具有式viii结构的连接子-毒素:
[0874][0875]
其中:ab是组织因子(tf)抗体,其中ab包含来自命名为25a3的抗体的vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3;一个或多个连接子-毒素通过共价键连接至ab;并且##表示连接子-毒素与ab的连接点。
[0876]
在一些实施方案中,本文提供一种包含adc的组合物,所述adc包含抗体(ab)和一种或多种式viii的连接子-毒素。在一个实施方案中,组合物包含多种药物-抗体比率(dar)种类。在一些实施方案中,组合物的平均dar为2-4。
[0877]
在一个实施方案中,本文提供了一种抗体-药物缀合物,其包含抗体(ab)和一种或多种具有式viii结构的连接子-毒素:
[0878][0879]
其中:
[0880]
ab是组织因子(tf)抗体,其中所述ab包含重链序列qvqlvqsgaevkkpgasvkvsckasgytfdvygiswvrqapgqglewmgwiapysgntnyaqklqgrvtmttdtststaymelrslrsddtavyycardagtyspfgygmdvwgqgttvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckv
snkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg和轻链序列diqmtqspstlsasvgdrvtitcqasqsinnwlawyqqkpgkapklliykaynlesgvpsrfsgsgsgteftltisslqpddfatyycqlfqslppftfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec,一个或多个连接子-毒素通过共价键连接至ab;并且##表示连接子-毒素与ab的连接点。
[0881]
在另一个实施方案中,本文描述了一种包含本公开的adc的抗体-药物缀合物组合物,其中所述组合物包含多种药物-抗体比率(dar)种类,其中所述组合物的平均dar为2-4。
[0882]
连接子
[0883]
在一些实施方案中,本文提供的adc包含连接子。在一些实施方案中,未结合的连接子包含两个反应性末端:抗体缀合反应性末端和细胞毒性剂缀合反应性末端。例如,连接子可以通过抗体上的半胱氨酸硫醇或赖氨酸胺基团与抗体缀合,在这种情况下,抗体缀合反应性末端通常是硫醇反应性基团(例如双键)、离去基团(例如氯、溴或碘)、r-硫烷基或磺酰基、或胺反应性基团(诸如羧基)。连接子的细胞毒性剂缀合反应性末端可例如通过与细胞毒素上的碱性胺或羧基形成酰胺键而与细胞毒性剂缀合。
[0884]
在一些实施方案中,连接子为不可裂解的连接子。在一些实施方案中,连接子为可裂解的连接子。在一些实施方案中,细胞毒性剂从细胞中的adc释放。
[0885]
adc的适合连接子包括不稳定的连接子、酸不稳定的连接子(例如,腙连接子)、光不稳定的连接子、带电荷的连接子、含二硫键的连接子、肽酶敏感的连接子(例如,包含氨基酸(例如缬氨酸和/或瓜氨酸诸如瓜氨酸-缬氨酸或苯丙氨酸-赖氨酸)的肽连接子)、β-葡糖醛酸苷连接子(参见例如,graaf等人,curr pharm des,2002,8:1391-1403)、二甲基连接子(参见例如,chari等人,cancer research,1992,52:127-131;美国专利号5,208,020)、硫醚连接子或亲水连接子(参见例如,kovtun等人,cancer res.,2010,70:2528-2537)。
[0886]
其他连接子包括具有允许桥接抗体上的两个链间半胱氨酸的官能团的连接子,例如thiobridge
tm
连接子(badescu等人,bioconjug.chem.,25:1124
–
1136(2014))、二硫代马来酰亚胺(dtm)连接子(behrens等人,mol.pharm.,12:3986
–
3998(2015))、基于二硫代芳基(tcep)哒嗪二酮的连接子(lee等人,chem.sci.,7:799-802(2016))、基于二溴哒嗪二酮的连接子(maruani等人,nat.commun.,6:6645(2015))和本领域已知的其他连接子。
[0887]
连接子可包含一种或多种连接子组分。通常,连接子将包含两个或更多个连接子组分。示例性连接子组分包括用于与抗体反应的官能团、用于与毒素反应的官能团、延伸物、肽组分、自降解基团、自消除基团、亲水部分等。各种连接子组分是本领域已知的,其中一些如下描述。
[0888]
某些有用的连接子组分可从各种商业来源获得,例如pierce biotechnology,inc.(现在thermo fisher scientific,waltham,ma)和molecular biosciences inc.(boulder,colo.),或可根据本领域所述的程序合成(参见例如toki等人,j.org.chem.,67:1866-1872(2002);dubowchik等人,tetrahedron letters,38:5257-60(1997);walker,m.a.,j.org.chem.,60:5352-5355(1995);frisch等人,bioconjugate chem.,7:180-186(1996);美国专利号6,214,345和7,553,816,以及国际专利公布号wo 02/088172)。
[0889]
连接子组分的实例包括但不限于:n-(β-马来酰亚胺丙氧基)-n-羟基琥珀酰亚胺
酯(bmps)、n-(ε-马来酰亚胺己酰氧基)琥珀酰亚胺酯(emcs)、n-[γ-马来酰亚胺丁酰氧基]琥珀酰亚胺酯(gmbs)、1,6-己烷-双-乙烯砜(hbvs)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧基-(6-酰胺基己酸酯)(lc-smcc)、间马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、4-(4-n-马来酰亚胺基苯基)丁酸肼(mpbh)、琥珀酰亚胺基3-(溴乙酰胺基)丙酸酯(sbap)、琥珀酰亚胺基碘乙酸酯(sia)、琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、n-琥珀酰亚胺基-4-(2-吡啶硫代)戊酸酯(spp)、琥珀酰亚胺基4-(n-马来酰亚胺基甲基)环己烷-1-羧酸酯(smcc)、琥珀酰亚胺基4-(对马来酰亚胺基苯基)丁酸酯(smpb)、琥珀酰亚胺基6-[(β-马来酰亚胺基丙酰胺基)己酸酯](smph)、亚氨基硫烷(it)、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯(svsb)。
[0890]
其他实例包括双马来酰亚胺试剂,例如二硫代双马来酰亚胺乙烷(dtme)、双马来酰亚胺三氧基乙二醇(bmpeo)、1,4-双马来酰亚胺丁烷(bmb)、1,4-双马来酰亚胺基-2,3-二羟基丁烷(bmdb)、双马来酰亚胺己烷(bmh)、双马来酰亚胺基乙烷(bmoe)、bm(peg)2和bm(peg)3;亚胺酯(诸如己二酸二甲酯)、活性酯(诸如辛二酸二琥珀酰亚胺酯)、醛类(诸如戊二醛)、双叠氮化合物(诸如双(对叠氮基苯甲酰基)己二胺)、双重氮衍生物(诸如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(诸如甲苯2,6-二异氰酸酯)和双活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)的双官能衍生物。
[0891]
在某些实施方案中,连接子包含下式的聚(乙二醇)链:
[0892][0893]
其中g是1-20的整数。在一些实施方案中,g是3。
[0894]
在某些实施方案中,连接子是包含肽组分的可裂解连接子,所述肽组分包含两个或更多个氨基酸并且可被细胞内蛋白酶例如溶酶体蛋白酶或核内体蛋白酶裂解。肽组分可包含天然存在的氨基酸残基和/或次要氨基酸和/或非天然存在的氨基酸类似物,例如瓜氨酸。肽组分可以被设计并优化用于特定酶例如肿瘤相关蛋白酶、组织蛋白酶b、组织蛋白酶c或组织蛋白酶d或纤溶酶蛋白酶的酶促裂解。
[0895]
在某些实施方案中,adc中包含的连接子可以是含有二肽的连接子,例如含有缬氨酸-瓜氨酸(val-cit)或苯丙氨酸-赖氨酸(phe-lys)的连接子。包含在连接子中的合适二肽的其他实例包括val-lys、ala-lys、me-val-cit、phe-homolys、phe-cit、leu-cit、ile-cit、trp-cit、phe-arg、ala-phe、val-ala、met-lys、asn-lys、ile-pro、ile-val、asp-val、his-val、met-(d)lys、asn-(d)lys、val-(d)asp、norval-(d)asp、ala-(d)asp、me3lys-pro、phenylgly-(d)lys、met-(d)lys、asn-(d)lys、pro-(d)lys和met-(d)lys。可裂解连接子还可包括更长的肽组分,例如三肽、四肽或五肽。实例包括但不限于三肽met-cit-val、gly-cit-val、(d)phe-phe-lys和(d)ala-phe-lys,以及四肽gly-phe-leu-gly和ala-leu-ala-leu。
[0896]
在某些实施方案中,细胞毒性剂使用包含缬氨酸-瓜氨酸(vc)的连接子缀合到抗体。
[0897]
可裂解连接子可以任选地还包含一种或多种另外组分,例如自降解和自消除基团、延伸物或亲水部分。
[0898]
可用于连接子的自降解基团和自消除基团包括例如对氨基苄氧羰基(pabc)和对氨基苄基醚(pabe)基团,以及甲基化乙二胺(med)。自降解基团的其他实例包括但不限于在电子学上与pabc或pabe基团相似的芳族化合物,例如杂环衍生物,例如美国专利号7,375,078中描述的2-氨基咪唑-5-甲醇衍生物。其他实例包括在酰胺键水解时发生环化的基团,例如取代和未取代的4-氨基丁酸酰胺(rodrigues等人,chemistry biology,2:223-227(1995))和2-氨基苯基丙酸酰胺(amsberry等人,j.org.chem.,55:5867-5877(1990))。
[0899]
可用于adc的连接子中的延伸物包括例如亚烷基和基于脂肪族酸、二酸、胺或二胺的衍生物,例如二甘醇酸酯、丙二酸酯、己酸酯和己酰胺。其他延伸物包括例如基于甘氨酸的延伸物、聚乙二醇(peg)延伸物和单甲氧基聚乙二醇(mpeg)延伸物。peg和mpeg延伸物也起到亲水部分的作用。
[0900]
在一些实施方案中可用于本公开的adc的可裂解连接子中常见的组分的实例包括但不限于spbd、磺基-spbd、腙、val-cit、马来酰己酰基(mc或mc)、mc-val-cit、mc-val-cit-pabc、phe-lys、mc-phe-lys、mc-phe-lys-pabc、马来酰亚胺三甘醇酸酯(mt)、mt-val-cit、mt-phe-lys和己二酸酯(ad)。
[0901]
在某些实施方案中,包含在本公开的adc中的连接子是具有通式vii的基于肽的连接子:
[0902][0903]
其中:str是延伸物;aa1和aa2各自独立地为氨基酸,其中aa
1-[aa2]m形成蛋白酶裂解位点;x1为自降解基团;z为与结合抗体上的靶标基团(例如,半胱氨酸的硫醇或赖氨酸基团的伯胺)的官能团的连接点;d是与细胞毒性剂的连接点;s为0或1;m是1与4之间的整数,并且o是0、1或2。
[0904]
在一些实施方案中,在通式vii的连接子中,z是:
[0905][0906]
其中##表示琥珀酰亚胺基与tf抗体的连接点,并且琥珀酰亚胺基通过共价键连接至tf抗体,并且&表示与[str]s的连接点。
[0907]
在一些实施方案中,在通式vii的连接子中,[str]s选自由以下组成的组:亚烷基、基于脂肪族酸的延伸物、基于脂肪族二酸的延伸物、基于脂肪族胺的延伸物和基于脂肪族二胺的延伸物。
[0908]
在一些实施方案中,在通式vii的连接子中,[str]s选自由以下组成的组:基于二甘醇酸酯的延伸物、基于丙二酸酯的延伸物、基于己酸酯的延伸物和基于己酰胺的延伸物。
t的抗体,或者
[0952]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体。
[0953]
在一些实施方案中,y是[x1]o,其中x1是自降解基团并且o是选自1和2的整数。在一些实施方案中,每个x1选自由以下组成的组:对氨基苄氧羰基(pabc)、对氨基苄基醚(pabe)和甲基化乙二胺(med)。在一些实施方案中,y不存在。在式x或式xi的连接子的一些实施方案中,细胞毒性剂选自由以下组成的组:诊断剂、金属螯合剂、酶、荧光化合物、生物发光化合物或化学发光化合物。
[0954]
在式x或式xi的连接子的一些实施方案中,细胞毒性剂是具有改进的安全性特征的细胞毒性有效载荷。
[0955]
在另一个实施方案中,包含通式xii的连接子的化合物能够与组织因子(tf)抗体上的靶标基团(例如,半胱氨酸的硫醇或赖氨酸基团的伯胺)化学结合以形成本公开的adc:
[0956][0957]
其中:str是延伸物;aa1和aa2各自独立地为氨基酸,其中aa
1-[aa2]m形成蛋白酶裂解位点;x1为自降解基团;d2为与细胞毒性剂的连接点;z2为能够与tf抗体上的靶标基团反应的官能团;s为0或1;m是1与4之间的整数,并且o是0、1或2。
[0958]
在一些实施方案中,在通式xii的连接子中,z2是:
[0959][0960]
并且&表示与[str]s的连接点。
[0961]
在一些实施方案中,在通式xii的连接子中,[str]s选自由以下组成的组:亚烷基、基于脂肪族酸的延伸物、基于脂肪族二酸的延伸物、基于脂肪族胺的延伸物和基于脂肪族二胺的延伸物。
[0962]
在一些实施方案中,在通式xii的连接子中,[str]s选自由以下组成的组:基于二甘醇酸酯的延伸物、基于丙二酸酯的延伸物、基于己酸酯的延伸物和基于己酰胺的延伸物。
[0963]
在一些实施方案中,在通式xii的连接子中,[str]s选自由以下组成的组:基于甘氨酸的延伸物、基于聚乙二醇的延伸物和基于单甲氧基聚乙二醇的延伸物。
[0964]
在一些实施方案中,在通式xii的连接子中,[str]s是:
phe-leu-gly和ala-leu-ala-leu。
[0978]
在一些实施方案中,在通式xii的连接子中,m是1(即aa
1-[aa2]m是二肽)。
[0979]
在一些实施方案中,在通式xii的连接子中,aa
1-[aa2]m是选自val-lys、ala-lys、phe-lys、val-cit、phe-cit、leu-cit、ile-cit和trp-cit的二肽。
[0980]
在一些实施方案中,在通式xii的连接子中,每个x1独立地选自对氨基苄氧羰基(pabc)、对氨基苄基醚(pabe)和甲基化乙二胺(med)。
[0981]
在一些实施方案中,在通式xii的连接子-毒素化合物中,m是1、2或3。
[0982]
在一些实施方案中,在通式xii的连接子中,s是1。
[0983]
在一些实施方案中,在通式xii的连接子中,o是0。
[0984]
在一些实施方案中,在通式xii的连接子中:
[0985]
z是
[0986]
&表示与[str]s的连接点;
[0987]
[str]s选自
[0988]
ee和ff分别表示与z和aa1的连接点;p是2与6之间的整数;q是2与8之间的整数;m为1;aa
1-aa2是选自由由val-lys、ala-lys、phe-lys、val-cit、phe-cit、leu-cit、ile-cit和trp-cit组成的组的二肽:s是1;并且o是0。
[0989]
在某些实施方案中,包含通式xii的连接子的化合物具有以下结构:
[0990][0991]
用于制备抗体-药物缀合物的方法
[0992]
adc可以使用本领域公开的任何合适的方法采用本领域技术人员已知的有机化学反应、条件和试剂来制备,参见例如bioconjugate techniques,第2版,g.t.hermanson编,elsevier,san francisco,2008。
[0993]
例如,缀合可以通过以下方式实现:(1)使抗体的亲核基团或亲电基团与双官能连接子反应以通过共价键形成抗体-连接子中间体ab-l,然后与活化的细胞毒性剂(d)反应,或(2)使细胞毒性剂的亲核基团或亲电基团与双官能连接子反应以通过共价键形成连接子-毒素d-l,然后与抗体的亲核基团或亲电基团反应。
[0994]
在某些实施方案中,本文描述了一种用于制备抗体-药物缀合物的方法,所述方法包括:(a)使结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团与双官能连接子反应以形成ab-连接子中间体,并使ab-连接子中间体与通式i的澳瑞他汀衍生物上的-nh2基团反应
[0995][0996]
其中:x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式i中所示的相应连接点,或x不存在;r1选自由以下组成的组:
[0997][0998]
其中#和%分别表示式i所示的相应连接点;并且r2为苯基,以提供抗体药物缀合物;或者(b)使通式i的瑞奥西汀衍生物上的-nh2基团与双官能连接子反应以形成连接子-毒素中间体,并使连接子-毒素中间体与结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团反应,以提供抗体-药物缀合物,其中在(a)或(b)中,(a)所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[0999]
i.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[1000]
ii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[1001]
iii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[1002]
iv.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[1003]
v.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[1004]
vi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1
的抗体;并且
[1005]
(b)所述抗体-药物缀合物包含一个或多个由式iv表示的部分:
[1006][1007]
其中:x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式iv中所示的相应连接点,或x不存在;l为连接子;!表示l与ab的连接点,其中l通过共价键连接至ab;r1选自由以下组成的组:
[1008][1009]
其中#和%表示式iv中所示的相应连接点;并且r2为苯基。
[1010]
在某些实施方案中,本文描述了一种用于制备抗体-药物缀合物的方法,所述方法包括:(a)使结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团与包含两个或更多个连接子组分的双官能连接子的第一连接子组分反应,随后依次添加其余一个或多个连接子组分,以形成ab-连接子中间体,并使ab-连接子中间体与通式i的澳瑞他汀衍生物上的-nh2基团反应:
[1011][1012]
其中:x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式i中所示的相应连接点,或x不存在;r1选自由以下组成的组:
[1013][1014]
其中#和%分别表示式i所示的相应连接点;并且r2为苯基,以提供抗体药物缀合物;或者(b)使通式i的瑞奥西汀衍生物上的-nh2基团与包含两个或更多个连接子组分的双官能连接子的第一连接子组分反应,随后依次添加其余一个或多个连接子组分,以形成连接子-毒素中间体,并使连接子-毒素中间体与结合人组织因子(tf)的胞外结构域(seq id no:810)的抗原结合蛋白(ab)上的亲核基团或亲电基团反应,以提供抗体-药物缀合物,其中在(a)或(b)中,(a)所述ab包含vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3,其中
[1015]
vii.所述vh-cdr1包含seq id no:872,所述vh-cdr2包含seq id no:873,所述vh-cdr3包含seq id no:874,所述vl-cdr1包含seq id no:875,所述vl-cdr2包含seq id no:876,并且所述vl-cdr3包含seq id no:877,
[1016]
viii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a3的抗体,
[1017]
ix.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a的抗体,
[1018]
x.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5的抗体,
[1019]
xi.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25a5-t的抗体,或者
[1020]
xii.所述vh-cdr1、vh-cdr2、vh-cdr3、vl-cdr1、vl-cdr2和vl-cdr3来自命名为25g1的抗体;并且
[1021]
(b)所述抗体-药物缀合物包含一个或多个由式iv表示的部分:
[1022][1023]
其中:x为
*-c(o)nhch(ch2(r2))-
,其中*和 表示式iv中所示的相应连接点,或x不存在;l为连接子;!表示l与ab的连接点,其中l通过共价键连接至ab;r1选自由以下组成的
组:
[1024][1025]
其中#和%表示式iv中所示的相应连接点;并且r2为苯基。
[1026]
在某些实施方案中,ab上的亲核基团或亲电基团是硫醇或胺。在用于制备adc的方法的某些实施方案中,所述方法还包括用还原剂处理ab以使ab中的一个或多个二硫键联还原,以提供亲核硫醇基团。在用于制备adc的方法的某些实施方案中,l由式vii表示:
[1027][1028]
其中:z表示与ab的靶标基团结合的官能团;d表示与式vi中所示的氨基的连接点;str是延伸物;aa1和aa2各自独立地为氨基酸,其中aa
1-[aa2]m形成蛋白酶裂解位点;x1为自降解基团;s是选自0和1的整数;m是选自由1、2、3和4组成的组的整数;并且o是选自0、1和2的整数。
[1029]
在其中细胞毒性剂是通式i化合物的某些实施方案中,adc可以通过包括以下的方法制备:(a)(i)使抗体上的亲核基团或亲电基团与双官能连接子反应以形成抗体-连接子中间体,或(ii)使抗体上的亲核基团或亲电基团与包含两个或更多个连接子组分的双官能连接子的第一个连接子成分反应,随后依次添加其余一个或多个连接子组分,以形成抗体-连接子中间体,以及(b)使抗体-连接子中间体与通式i化合物上的-nh2基团反应以提供adc。
[1030]
在其中细胞毒性剂是通式i化合物的某些实施方案中,adc可以通过包括以下的方法来制备:(a)(i)使通式i化合物上的nh2基团与双官能连接子反应以形成连接子-毒素中间体,或(ii)使通式i化合物上的nh2基团与包含两个或更多个连接子组分的双官能连接子的第一连接子组分反应,随后依次添加其余一个或多个连接子组分,以形成连接子-毒素中间体,以及(b)使连接子-毒素中间体与抗体上的亲核基团或亲电基团反应以提供抗体-药物缀合物。
[1031]
在一些实施方案中,抗体上的亲电基团或亲核基团是硫醇(例如来自抗体上的半胱氨酸残基)或胺(例如来自抗体上的赖氨酸残基)。在一些实施方案中,双官能连接子具有通式vii、通式x或通式xi。通式i化合物和构成通式i化合物的连接子-毒素可以通过标准合成有机化学方案由市售原料制备。示例性方法提供于国际专利申请公布号wo 2016/041082和以下实施例部分中。
[1032]
在某些实施方案中,本公开的adc通过将连接子-细胞毒性剂缀合至已通过减少抗
体上的一个或多个链间二硫键联而释放的半胱氨酸残基来制备。合适的还原剂是本领域已知的并且包括例如二硫苏糖醇(dtt)、三(2-羧乙基)膦(tcep)、2-巯基乙醇、半胱胺和许多水溶性膦。
[1033]
在一些实施方案中,adc是用位点特异性缀合技术制备的,导致均匀的药物负载并避免具有改变的抗原结合或药代动力学的adc亚群。在一些实施方案中,对重链和轻链上的位置处包含半胱氨酸取代的“硫单抗”进行工程化改造以提供不破坏免疫球蛋白折叠和组装或改变抗原结合的反应性硫醇基(junutula等人,j.immunol.meth.,2008,332:41-52;junutula等人,nat.biotechnol.,2008,26:925-932,)。在一些实施方案中,通过重新编码从终端到硒代半胱氨酸插入的终止密码子uga,将硒代半胱氨酸共翻译插入到抗体序列中,从而允许在其他天然氨基酸的存在下,在硒代半胱氨酸的亲核硒醇基团处进行位点特异性共价缀合(参见例如,hofer等人,proc.natl.acad.sci.usa,2008,105:12451-12456;hofer等人,biochemistry,2009,48(50):12047-12057)。或者,可以修饰抗体以包括提供反应性手柄的其他非天然氨基酸,例如对乙酰苯丙氨酸、甲酰甘氨酸或对叠氮甲基-l-苯丙氨酸(参见例如axup等人,pnas,109:16101-16106(2012);wu等人,pnas,106:3000-3005(2009);zimmerman等人,bioconj.chem.,25:351-361(2014))。在某些实施方案中,如behrens等人,mol pharm,2015,12:3986-98中所述合成adc。
[1034]
6.测定
[1035]
本领域已知的各种测定法可用于鉴定和表征本文提供的抗tf抗体和抗tf adc。
[1036]
6.1.结合、竞争和表位作图测定
[1037]
如本公开别处所述,可通过任何适合方法来评估本文提供的抗体的特异性抗原结合活性,所述方法包括使用spr、bli、ria和msd-set。此外,可通过elisa测定法和蛋白质印迹测定法评估抗原结合活性。
[1038]
用于测量两种抗体或一种抗体与另一种分子(例如,tf的一个或多个配体)之间的竞争的测定法描述于本公开的别处,例如,harlow和lane,antibodies:a laboratory manual第14章,1988,cold spring harbor laboratory,cold spring harbor,n.y中,其以引用的方式整体并入。
[1039]
用于对本文提供的抗体所结合的表位作图的测定法描述于,例如,morris“epitope mapping protocols,”在methods in molecular biology第66卷,1996,humana press,totowa,n.j.中,其以引用的方式整体并入。在一些实施方案中,通过肽竞争确定表位。在一些实施方案中,通过质谱分析确定表位。在一些实施方案中,通过晶体学确定表位。
[1040]
6.2.凝血酶生成、fxa转化和tf信号传导测定
[1041]
如本公开别处所述,可通过凝血酶生成测定法(tga)来确定在本文提供的抗体存在下的凝血酶生成。
[1042]
本公开别处描述了用于在本文提供的抗体存在下测量fxa转化的测定法。
[1043]
可通过测量由tf信号传导调节的细胞因子(诸如il8和gm-csf)的产生来确定tf信号传导的抑制。用于确定il8和/或gm-csf水平的测定法提供于本公开别处,并且例如,hjortoe等人,blood,2004,103:3029-3037中。
[1044]
6.3.用于效应子功能的测定法
[1045]
可使用本领域已知的多种体外和体内测定法评估用本文提供的抗体治疗后的效
应子功能,所述测定法包括描述于以下中的那些:ravetch和kinet,annu.rev.immunol.,1991,9:457-492;美国专利号5,500,362、5,821,337;hellstrom等人,proc.nat’l acad.sci.usa,1986,83:7059-7063;hellstrom等人,proc.nat’l acad.sci.usa,1985,82:1499-1502;bruggemann等人,j.exp.med.,1987,166:1351-1361;clynes等人,proc.nat’l acad.sci.usa,1998,95:652-656;wo 2006/029879;wo 2005/100402;gazzano-santoro等人,j.immunol.methods,1996,202:163-171;cragg等人,blood,2003,101:1045-1052;cragg等人blood,2004,103:2738-2743;和petkova等人,int’l.immunol.,2006,18:1759-1769;其各自以引用的方式整体并入。
[1046]
6.4.细胞毒性测定和体内研究
[1047]
本公开别处描述了用于评估本文提供的抗体-药物缀合物(adc)的细胞毒性的测定法。
[1048]
本公开别处描述了对免疫受损小鼠的异种移植物研究以用于评估本文提供的adc的体内功效。
[1049]
本公开包括对免疫活性小鼠的同基因研究以用于评估adc的体内功效。
[1050]
6.5.免疫组织化学(ihc)测定法
[1051]
本公开别处描述了用于评估患者样品中tf表达的免疫组织化学(ihc)测定法。
[1052]
6.6.嵌合构建体作图和表位鉴定测定
[1053]
如本公开别处所述,可通过嵌合tf构建体作图实验和表位结合测定法来确定本文提供的抗人tf抗体之间的表位鉴定差异。
[1054]
7.药物组合物
[1055]
可将本文提供的抗体或adc配制成任何适当的药物组合物,并且通过任何适合施用途径来施用。适合施用途径包括但不限于玻璃体内、动脉内、真皮内、肌肉内、腹膜内、静脉内、经鼻、肠胃外、经肺和皮下途径。
[1056]
药物组合物可包含一种或多种药物赋形剂。可使用任何适合药物赋形剂,并且本领域普通技术人员能够选择适合药物赋形剂。因此,以下提供的药物赋形剂旨在说明而非限制。另外的药物赋形剂包括例如描述于以下中的那些:handbook of pharmaceutical excipients,rowe等人(编)第6版(2009),其以引用的方式整体并入。
[1057]
7.1.肠胃外剂型
[1058]
在某些实施方案中,本文提供的抗体或adc被配制为肠胃外剂型。肠胃外剂型可以通过各种途径向受试者施用,所述途径包括但不限于皮下、静脉内(包括输注和推注)、肌肉内和动脉内。因为它们的施用通常绕过受试者对污染物的天然防御,所以肠胃外剂型通常是无菌的或能够在施用于受试者之前被消毒。肠胃外剂型的实例包括但不限于准备注射的溶液、准备溶解或悬浮于药学上可接受的注射用媒介物中的干燥(例如,冻干)产品、准备注射的悬浮液以及乳剂。
[1059]
8.剂量和单位剂量形式
[1060]
在人类疗法中,医生将根据预防性或治疗性治疗并且根据年龄、体重、状况和要治疗对象的其他特定因素来确定他认为最适当的剂量。
[1061]
在某些实施方案中,本文提供的组合物为药物组合物或单一单位剂型。本文提供的药物组合物和单一单位剂型包含预防或治疗有效量的一种或多种预防性或治疗性抗体
invest.,2009,27:430-434;abdulkadir等人,hum pathol.,2009,31:443-447;其各自以引用的方式整体并入)、胰腺癌(参见zhang等人,oncotarget,2017,8:59086-59102,其以引用的方式整体并入)、三阴性乳腺癌(参见zhang等人,oncotarget,2017,8:59086-59102,其以引用的方式整体并入)、胶质母细胞瘤(参见guan等人,clin biochem.,2002,35:321-325;carneiro-lobo等人,j thromb haemost,2009,7:1855-1864;其各自以引用的方式整体并入)、肺癌(参见yeh等人,plos one,2013,8:e75287;regina等人,clin chem.,2009,55:1834-42;其各自以引用的方式整体并入)、胃癌(参见lo等人,br j cancer.,2012,107:1125-1130,其以引用的方式整体并入)、食管癌(参见chen等人,acta histochem.,2010,3:233-239,其以引用的方式整体并入)、膀胱癌(参见patry等人,int j cancer.,2008,122:1592-1597,其以引用的方式整体并入)、黑色素瘤(参见bromberg等人,proc natl acad sci u s a.,1995,92:8205-8209,其以引用的方式整体并入)和肾癌(参见silva等人,int braz j urol.,2014,40:499-506,其以引用的方式整体并入)。
[1072]
任何适合癌症都可用本文提供的抗体或adc治疗。在一些实施方案中,癌症为头颈癌。在一些实施方案中,癌症为卵巢癌。在一些实施方案中,癌症为胃癌。在一些实施方案中,癌症为食管癌。在一些实施方案中,癌症为宫颈癌。在一些实施方案中,癌症为前列腺癌。在一些实施方案中,癌症为胰腺癌。在一些实施方案中,癌症为雌激素受体阴性(er-)、孕激素受体阴性(pr-)和her2阴性(her2-)三阴性乳腺癌。在一些实施方案中,癌症为胶质母细胞瘤。在一些实施方案中,癌症为肺癌。在一些实施方案中,癌症为膀胱癌。在一些实施方案中,癌症为黑色素瘤。在一些实施方案中,癌症为肾癌。在一些实施方案中,癌症为眼部黑色素瘤。关于可用抗tf抗体或adc治疗的癌症类型的其他信息提供于van den berg等人,blood,2012,119:924-932中,其以引用的方式整体并入。
[1073]
在一些实施方案中,本文提供了一种延迟有需要的受试者的癌症发作的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。在一些实施方案中,本文提供了一种用于晚期介入治疗有需要的受试者的癌症的方法。例如,adc可以减小有需要的受试者的肿瘤大小(例如,肿瘤体积)或抑制有需要的受试者的肿瘤生长。
[1074]
在一些实施方案中,本文提供了一种阻止有需要的受试者的癌症发作的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1075]
在一些实施方案中,本文提供了一种减小有需要的受试者的肿瘤大小(例如肿瘤体积)的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。在一些实施方案中,本文提供的adc使肿瘤大小(例如肿瘤体积)减小至少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或约99%。在一些实施方案中,本文提供的adc将肿瘤生长抑制至少约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%或约99%。
[1076]
在一些实施方案中,本文提供了一种减少有需要的受试者的转移数量的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1077]
在一些实施方案中,本文提供了一种用于延长有需要的受试者中总体生存期、中间生存期或无进展生存期的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1078]
在一些实施方案中,本文提供了一种用于治疗已对护理治疗标准产生抗性的受试者的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1079]
在一些实施方案中,可受益于用抗tf抗体或adc治疗的疾病或疾患是涉及新生血管的疾病或疾患。在某些实施方案中,涉及新生血管的疾病或疾患为癌症。在一些实施方案中,可受益于用抗tf抗体或adc治疗的疾病或疾患是涉及血管炎症的疾病或疾患。
[1080]
在一些实施方案中,提供本文提供的抗tf抗体和adc以用作用于治疗涉及新生血管的疾病或疾患的药物。在一些实施方案中,提供本文提供的抗tf抗体和adc以用于药物的制造或制备,所述药物用于治疗涉及新生血管的疾病或疾患。在某些实施方案中,涉及新生血管的疾病或疾患为癌症。在一些实施方案中,提供本文提供的抗tf抗体和adc以用作用于治疗涉及血管炎症的疾病或疾患的药物。在一些实施方案中,提供本文提供的抗tf抗体和adc以用于药物的制造或制备,所述药物用于治疗涉及血管炎症的疾病或疾患。
[1081]
在一些实施方案中,本文提供了一种治疗有需要的受试者中涉及新生血管的疾病或疾患的方法,其通过向受试者施用有效量的本文提供的抗tf抗体或adc来进行。在某些实施方案中,涉及新生血管的疾病或疾患为癌症。在一些实施方案中,本文提供了一种治疗有需要的受试者中涉及血管炎症的疾病或疾患的方法,其通过向受试者施用有效量的本文提供的抗tf抗体或adc来进行。
[1082]
在一些实施方案中,本文提供了一种延迟有需要的受试者中涉及新生血管的疾病或疾患发作的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1083]
在一些实施方案中,本文提供了一种延迟有需要的受试者中年龄相关性黄斑变性(amd)发作的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1084]
在一些实施方案中,本文提供了一种延迟有需要的受试者中涉及血管炎症的疾病或疾患发作的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1085]
在一些实施方案中,本文提供了一种阻止有需要的受试者中涉及血管炎症的疾病或疾患发作的方法,其通过向受试者施用有效量的本文提供的抗体或adc来进行。
[1086]
在一些实施方案中,本文提供的adc在施用于受试者后,受试者耐受良好。在一些实施方案中,相对于其他抗tf-adc例如与mmae相关的克隆25a3,本文提供的adc在施用于受试者后,具有更好的耐受性。例如,例如相对于其他抗tf-adc,adc可导致皮肤毒性降低。皮肤毒性的指标包括但不限于皮肤刺激、皮肤溃疡、皮疹、皮肤炎症、瘙痒、划伤、皲裂、酸痛、对光或阳光照射的敏感性增加、麻木、烧灼感、刺痛、肿块、水泡、荨麻疹、脱皮和疼痛。
[1087]
在一些实施方案中,本文提供的一种或多种adc在施用于受试者后,不需要施用一种或多种抗炎剂(例如类固醇,例如局部或全身)。在一些方面,本文提供的一种或多种adc在施用于受试者后,导致对一种或多种抗炎剂(例如类固醇,例如局部或全身性)的施用的需要相对于其他抗tf-adc例如与mmae相关的克隆25a3减少。
[1088]
在一些实施方案中,本文提供的adc在施用于受试者后,导致例如相对于基线或相对于不同抗tf adc的肝毒性低或无肝毒性。在一些实施方案中,本文提供的adc在施用于受试者后,导致肝毒性相对于其他抗tf adc例如与mmae相关的克隆25a3有所降低。这可以例如使用肝损伤的标志物来评估。肝损伤标志物的非限制性实例包括白蛋白、胆红素、球蛋白、γ-谷氨酰转移酶(γgt或ggt)、谷氨酸丙酮酸转氨酶(gpt)、碱性磷酸酶(alp)、丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、ast与血小板比率指数(apri)、增强型肝纤维化
(elf)、纤维化-4(fib-4)和fibro指数。例如,肝损伤的减轻或肝损伤进展的减轻通过alp、ast、alt、γgt或胆红素的血清水平的降低来测量。
[1089]
在一些实施方案中,本文提供的adc在施用于受试者后,相对于基线水平,抗体-药物缀合物不增加受试者中的天冬氨酸转氨酶(ast)水平。在一些实施方案中,本文提供的adc在施用于受试者后,导致受试者的天冬氨酸转氨酶(ast)水平相对于基线水平或相对于不同的抗tfadc降低。在一些实施方案中,本文提供的adc在施用于受试者后,相对于基线水平,不增加受试者的丙氨酸转氨酶水平。在一些实施方案中,本文提供的adc在施用于受试者后,导致受试者中的丙氨酸转氨酶水平相对于基线水平或相对于不同抗tf adc有所降低。
[1090]
在一些实施方案中,本文提供的adc在施用于受试者后,导致中性粒细胞减少症例如相对于基线减少、降低或不存在。这可以是相对于不同的抗tf抗体-药物缀合物,例如与mmae相关的克隆25a3。
[1091]
在一些实施方案中,本文提供的adc在施用于受试者后,例如相对于基线,不改变、增加或减少受试者中单核细胞的数量。这可以是相对于不同的抗tf抗体-药物缀合物,例如与mmae相关的克隆25a3。
[1092]
抗炎药的非限制性实例包括非甾体抗炎药(nsaid)、甾体抗炎药、β-激动剂、抗胆碱能药、抗组胺药(例如乙醇胺、乙二胺、哌嗪和吩噻嗪)和甲基黄嘌呤。nsaid的实例包括但不限于阿司匹林、布洛芬、水杨酸盐、对乙酰氨基酚、塞来昔布、双氯芬酸、依托度酸、非诺洛芬、吲哚美辛、酮咯酸、奥沙普嗪、萘丁酮、舒林酸、托美丁、罗非昔布、萘普生、酪洛芬和纳布美通。此类nsaid通过抑制环氧化酶(例如cox-1和/或cox-2)起作用。甾体抗炎药的实例包括但不限于糖皮质激素、地塞米松、可的松、氢化可的松、泼尼松、泼尼松龙、曲安西龙、柳氮磺胺吡啶和类二十烷酸,例如前列腺素、血栓烷和白三烯。这些抗炎剂可以是局部的或全身的。
[1093]
抗炎剂及其剂量、施用途径和推荐用法是本领域已知的并且已在诸如physician's desk reference(第60版,2006)等文献中进行了描述。
[1094]
10.组合疗法
[1095]
在一些实施方案中,本文提供的抗体或adc与至少一种另外的治疗剂一起施用。任何适合另外的治疗剂都可与本文提供的抗体或adc一起施用。在一些方面,另外的治疗剂选自辐射剂、细胞毒性剂、化学治疗剂、细胞抑制剂、抗激素剂、免疫刺激剂、抗血管生成剂及其组合。
[1096]
另外的治疗剂可通过任何适合手段施用。在一些实施方案中,本文提供的抗体或adc和另外的治疗剂被包括在同一药物组合物中。在一些实施方案中,本文提供的抗体或adc和另外的治疗剂被包括在不同药物组合物中。
[1097]
在其中本文提供的抗体或adc和另外的治疗剂被包括在不同药物组合物中的实施方案中,所述抗体或adc的施用可发生在所述另外的治疗剂的施用之前、同时、和/或之后。
[1098]
11.诊断方法
[1099]
还提供了用于检测来自受试者的细胞上tf的存在的方法。此类方法可用于例如预测和评估对用本文提供的抗体或adc治疗的反应性。
[1100]
在一些实施方案中,方法可用于检测患有或被怀疑患有疾病或疾患的受试者中的
tf。在一些实施方案中,方法包括:(a)接收来自受试者的样品;以及(b)通过使样品与本文提供的抗体接触来检测样品中tf的存在性或水平。在一些实施方案中,方法包括:(a)向受试者施用本文提供的抗体;以及(b)检测受试者中tf的存在性或水平。在一些实施方案中,疾病或疾患为癌症。在一些实施方案中,癌症为头颈癌。在一些实施方案中,癌症为卵巢癌。在一些实施方案中,癌症为胃癌。在一些实施方案中,癌症为食管癌。在一些实施方案中,癌症为宫颈癌。在一些实施方案中,癌症为前列腺癌。在一些实施方案中,癌症为胰腺癌。在一些实施方案中,癌症为雌激素受体阴性(er-)、孕激素受体阴性(pr-)和her2阴性(her2-)三阴性乳腺癌。在一些实施方案中,癌症为胶质母细胞瘤。在一些实施方案中,癌症为肺癌。在一些实施方案中,癌症为膀胱癌。在一些实施方案中,癌症为黑色素瘤。在一些实施方案中,癌症为肾癌。在一些实施方案中,疾病或疾患涉及新生血管。在某些实施方案中,涉及新生血管的疾病或疾患为癌症。在一些实施方案中,疾病或疾患涉及血管炎症。
[1101]
在一些实施方案中,方法包括:(a)向受试者施用本文提供的adc;以及(b)检测受试者中tf的存在性或水平。在一些实施方案中,疾病或疾患为癌症。在一些实施方案中,癌症为头颈癌。在一些实施方案中,癌症为卵巢癌。在一些实施方案中,癌症为胃癌。在一些实施方案中,癌症为食管癌。在一些实施方案中,癌症为宫颈癌。在一些实施方案中,癌症为前列腺癌。在一些实施方案中,癌症为胰腺癌。在一些实施方案中,癌症为雌激素受体阴性(er-)、孕激素受体阴性(pr-)和her2阴性(her2-)三阴性乳腺癌。在一些实施方案中,癌症为胶质母细胞瘤。在一些实施方案中,癌症为肺癌。在一些实施方案中,癌症为膀胱癌。在一些实施方案中,癌症为黑色素瘤。在一些实施方案中,癌症为肾癌。
[1102]
在一些实施方案中,本文提供的抗体与荧光标记缀合。在一些实施方案中,本文提供的抗体与放射性标记缀合。在一些实施方案中,本文提供的抗体与酶标记缀合。
[1103]
在一些实施方案中,本文提供的adc包含荧光标记。在一些实施方案中,本文提供的adc包含放射性标记。在一些实施方案中,本文提供的adc包含酶标记。
[1104]
在一些实施方案中,确定由此类细胞表达的tf的相对量。表达tf的细胞的比例和由此类细胞表达的tf的相对量可通过任何适合方法来确定。在一些实施方案中,使用流式细胞术进行此类测量。在一些实施方案中,使用荧光辅助细胞分选(facs)进行此种测量。
[1105]
12.试剂盒
[1106]
还提供了包含本文提供的抗体或adc的试剂盒。试剂盒可用于如本文所述治疗、预防和/或诊断疾病或疾患。
[1107]
在一些实施方案中,药盒包括容器和在所述容器上或与所述容器相关联的标签或包装说明书。适合容器包括例如瓶、小瓶、注射器和iv溶液袋。容器可由诸如玻璃或塑料的各种材料形成。容器容纳本身有效或与其他组合物组合时有效治疗、预防和/或诊断疾病或疾患的组合物。容器可具有无菌进入口。例如,如果容器是静脉输液袋或小瓶,则其可能具有可被针头刺穿的端口。组合物中的至少一种活性剂为本文提供的抗体或adc。标签或包装说明书指示所述组合物用于治疗所选疾患。
[1108]
在一些实施方案中,药盒可包含(a)第一容器和其中包含的第一组合物,其中第一组合物包含本文提供的抗体或adc;以及(b)第二容器和其中包含的第二组合物,其中第二组合物包含另外的治疗剂。本发明的此实施方案中的药盒还可包括包装说明书,其指示所述组合物可用于治疗特定疾患。
[1109]
替代地或另外地,药盒还可包括第二(或第三)容器,所述第二(或第三)容器包含药学上可接受的赋形剂。在一些方面,赋形剂为缓冲液。药盒还可包括在商业和使用者看来所需的其它材料,包括过滤器、针头和注射器。
[1110]
实施例
[1111]
下面是本发明的方法和组合物的实施例。应当理解,考虑到本文的一般性描述,可实施各种其它实施方案。
[1112]
以下是用于进行本发明的特定实施方案的实施例。实施例仅出于说明性目的而提供,并且不意图以任何方式限制本发明的范围。已努力确保关于所用数值(例如数量、温度等)的准确性,但当然应虑及一些实验误差和偏差。
[1113]
除非另外指示,否则本发明的实施将采用属于本领域的技能的常规蛋白质化学、生物化学、重组dna技术和药理学方法。此类技术充分说明于文献中。参见,例如,t.e.creighton,proteins:structures and molecular pro perties(w.h.freeman and company,1993);a.l.lehninger,biochemistry(worth publishers,inc.,本期新增);sambrook等人,molecular cloning:a l aboratory manual(第2版,1989);methods in enzymology(s.colowick和n.kaplan编,academic press,inc.);remington's pharmaceutical sciences,第18版(easton,pennsylvania:mack publishing company,1990);carey和s undberg advanced organic chemistry第3版(plenum press)第a和b卷(1992)。
[1114]
实施例1:抗体-药物缀合物(adc)的合成
[1115]
如下所述制备抗tf抗体和连接子-毒素a(本文也称为“lt-a”)的抗体-药物缀合物(adc)。未连接的连接子-毒素a的结构示出于图1中。抗tf抗体描述于2019年1月4日提交的pct/us2019/12427;所述文献出于所有目的以引用的方式整体并入本文。
[1116]
简言之,通过添加三(2-羧乙基)膦(2.0-2.5或3.2摩尔当量)和最终浓度为0.8mm的二乙三胺五乙酸来还原磷酸盐缓冲盐水(pbs)ph 7.4中的5至10mg/ml 25a3抗体(对于克隆25a3的cdr和v区序列,参见表8)。在37℃下2h后,将部分还原的抗体在冰上冷却10分钟,然后在冰上与8摩尔当量的连接子-毒素a缀合1h。用过量的n-乙酰基-l-半胱氨酸淬灭反应物。将淬灭的反应物在冰上静置30分钟,之后纯化。根据制造商的方案,分别通过两轮40kda mwco zeba
tm spin desalting柱(10ml柱,产品编号8772,批号rl240689)对adc进行纯化。在纯化之前,两组柱都用无菌pbs灌注。首先通过一组pbs灌注柱纯化adc,然后收集样品并通过另一组柱第二次纯化。在第二次纯化后,将adc重新汇集在一起并进行无菌过滤并在-80℃下冷冻。
[1117]
可以通过uv/vis光谱、疏水相互作用色谱(hic)和/或具有飞行时间检测和质量表征的反相液相色谱分离(rp-uplc/质谱)来测量药物抗体比率(dar),如wo 2016/041082中所述。药物连接形式的分布(例如,dar0、dar1、dar2等种类的分数)也可以通过本领域已知的各种技术进行分析,包括ms(有或没有伴随的色谱分离步骤)、疏水相互作用色谱、反相hplc或等电聚焦凝胶电泳(ief),也如wo 2016/041082中所述。
[1118]
对于此实施例,所得adc的药物抗体比率(dar)为约3。dar通过疏水相互作用色谱法测定:平均dar=(0x(dar0面积%) 2x(dar2面积%) 4x(dar4面积%) 6x(dar6面积%) 8x(dar8面积%)/100。使用尺寸排阻色谱确保adc制剂至少为95%单体。
[1119]
图2示出了包含lt-a的adc的描绘。包含25a3和lt-a的adc(例如,如此实施例中制备的)用于以下实施例2-8的测定和研究。
[1120]
实施例2:抗体-药物缀合物(adc)的细胞毒性测定
[1121]
为了评价adc的细胞毒性,将tf阳性a431细胞以每孔4x103个细胞涂铺于384孔板(greiner bio-one,monroe,nc,usa)中的40μl培养基内。如实施例1中所述制备包含与连接子-毒素a缀合的抗tf抗体25a3或同型对照抗体的adc,然后从5nm开始连续稀释。将细胞与adc孵育4h,然后冲洗并在新鲜培养基中再培养68h,或与adc孵育3天。随后通过在celltiter-glo(ctg)测定试剂(promega,madison,wi,usa)中裂解来评估细胞活力。在envision读板仪上测量ctg发光,并且在prism中绘制4次重复实验的平均值和标准偏差。对于每个adc,使用4参数结合模型在prism中计算ic
50
。
[1122]
图3a示出了tf阳性a431细胞在与同型对照或25a3-lt-a孵育4h、随后洗脱并培养68h后由ctg发光指示的细胞活力和计算的ic
50
。图3b示出了tf阳性a431细胞在与同型对照或25a3-lt-a孵育3天后由ctg发光指示的细胞活力和计算的ic
50
。仅抗tf adc在tf阳性a431细胞中导致细胞毒性。
[1123]
这些数据表明抗tf抗体-药物缀合物降低了tf阳性细胞的体外活力。
[1124]
实施例3:抗tf adc在mda mb213异种移植物模型中的作用
[1125]
在免疫受损小鼠中进行异种移植物研究,以评价adc在体内的功效。将tf阳性mda-mb231三阴性乳腺癌细胞系皮下植入无胸腺裸小鼠(charles river laboratories,wilmington,ma)的侧腹。当肿瘤达到150-200mm3平均大小时将动物随机分组并用指定剂量的如实施例1中所述制备的抗tf抗体-药物缀合物25a3-lt-a、同型对照lt-a或媒介物(pbs)腹膜内(ip)治疗,每周一次,持续2周。每两周进行一次体重和肿瘤大小评估。一旦肿瘤大小达到1200mm3或皮肤溃疡明显,就将动物从研究中移出并对其实施安乐死。结果描绘在图4a中。与任一剂量的同型对照lt-a相比,用5mg/kg25a3-lt-a治疗减小了肿瘤体积并延迟了肿瘤生长。与任一剂量的同型对照lt-a相比,用15mg/kg 25a3-lt-a治疗减小了肿瘤体积并阻止了肿瘤生长。这些数据表明抗tf抗体-药物缀合物25a3-lt-a在体内有效减小肿瘤大小。
[1126]
实施例4:抗tf adc在hpaf-ii异种移植物模型中的作用
[1127]
在免疫受损小鼠中进行异种移植物研究,以评价adc在体内的功效。将tf阳性hpaf-ii胰腺癌细胞皮下植入无胸腺裸小鼠(charles river laboratories,wilmington,ma)的侧面。当肿瘤达到150-200mm3平均大小时将动物随机分组至治疗组并用指定剂量的如实施例1中所述制备的抗tf抗体-药物缀合物25a3-lt-a、同型对照lt-a或媒介物(pbs)腹膜内(ip)治疗,每周一次,持续2周。每两周进行一次体重和肿瘤大小评估。一旦肿瘤大小达到1200mm3或皮肤溃疡明显,就将动物从研究中移出并对其实施安乐死。结果描绘在图4b中。与媒介物治疗组或同型对照lt-a治疗组相比,包含缀合至lt-a的抗tf抗体25a3的adc减小了肿瘤大小。这些数据表明抗tf抗体-药物缀合物25a3-lt-a在体内有效减小肿瘤大小。
[1128]
对于剂量反应研究,当肿瘤达到200mm3大小时,腹膜内施用一次指定剂量的抗tf抗体-药物缀合物25a3-lt-a。图5a-5d示出了以1.25mg/kg至10mg/kg的剂量范围施用的25a3-lt-a对肿瘤体积的影响。用1.25mg/kg或媒介物治疗的小鼠在接受治疗的15天内具有超过1000mm3的肿瘤。相比之下,用5mg/kg、7.5mg/kg或10mg/kg 25a3-lt-a治疗的小鼠在治疗后的前五周内显示出较慢的肿瘤生长。
[1129]
对于药代动力学(pk)研究,从肿瘤达到200mm3大小时开始,用2.5mg/kg或10mg/kg的抗tf抗体-药物缀合物25a3-lt-a腹膜内治疗小鼠一次。简言之,通过下颌出血(0.1ml)每24小时收集一次样品,持续5天。在pk测定中测量25a3-lt-a的浓度,其中htf是涂覆试剂,并且二级抗higg是检测剂。pk测定的结果示出在图6和表23中。数据显示抗tf抗体-药物缀合物25a3-lt-a具有线性药代动力学。
[1130]
表23.用25a3-lt-a治疗的小鼠的pk测定结果。
[1131][1132]
为了评估在后期干预期间施用的抗tf adc的作用,一旦在肿瘤达到500mm3大小时开始,就用7.5mg/kg或10mg/kg的抗tf抗体-药物缀合物25a3-lt-a腹膜内治疗小鼠。结果示出在图7a-7d中。相对于对照组(媒介物)中的小鼠,用7.5mg/kg 25a3-lt-a治疗的小鼠显示出肿瘤生长减少。数据还显示,相对于对照组(媒介物)中的小鼠,用10mg/kg的较高剂量治疗的小鼠出现肿瘤负生长(即,肿瘤体积减小)。
[1133]
实施例5:抗tf adc在各种患者来源的异种移植物模型中的作用
[1134]
在无胸腺裸小鼠(envigo,indianapolis,in)中进行了患者来源的异种移植物(pdx)研究,以评估25a3-lt-a adc的体内功效。简言之,肿瘤在家畜中传代并收集以再植入。将研究动物左侧单侧植入肿瘤片段,并且在肿瘤达到150-200mm3平均大小时将其随机分为治疗组。用10mg/kg的25a3-lt-a或媒介物对照(pbs)腹膜内治疗动物一次。每两周进行一次体重和肿瘤体积测量。一旦肿瘤大小达到1200mm3或当皮肤溃疡明显时,就将动物从研究中移出并在30天后对其实施安乐死。随时间推移绘制平均肿瘤体积(mtv)和平均标准误差(sem)。通过在媒介物组中的任何动物由于肿瘤大小≥1200mm3被安乐死之前计算肿瘤生长抑制率(tgi%=100%x[1-(治疗组的最终mtv-初始mtv)/(对照组的最终mtv
–
初始mtv)])确定治疗功效。
[1135]
免疫组织化学(ihc)分析用于检测tf表达和细胞定位(膜与细胞质)。使用rip tide(mosaic laboratories,lake forest,ca)在水浴中在95-97℃下对未治疗小鼠的组织进行预处理40min,在工作台上冷却10min,用蒸馏水冲洗3次,并且然后使用splash-t buffer(mosaic laboratories)冲洗5min。将组织切片在envision过氧化物酶封闭试剂(envision mouse hrp detection kit,agilent,carpinteria,ca)中封闭5min,之后在splash-t buffer中漂洗2次,每次5min。接下来,将组织切片用抗tf抗体(小鼠克隆htf-1)或小鼠阴性对照试剂染色30min,之后在splash-t缓冲液中漂洗2次,每次5min。用envision 小鼠hrp(envision 小鼠hrp检测试剂盒)对组织切片进行第二染色步骤30min,然后在splash-t缓冲液中漂洗2次,每次5min。为了使抗tf染色可视化,用dab色原(envision 小鼠hrp检测试剂盒)将组织切片显影5min,之后浸入10次,并且在蒸馏水中冲洗5min。将组织切
片用苏木精复染5min,之后在蒸馏水中漂洗3次。
[1136]
由合格的解剖病理学家在半定量整数量表内(从0(负)到3(或“3 ”)上对染色强度进行评分。记录每个强度水平上阳性染色的细胞百分比。评分基于tf在细胞膜上的定位。h评分将染色强度分量与阳性细胞百分比组合。它具有的值在0和300之间,并且定义为:1
×
(1 强度处染色的细胞百分比) 2
×
(2 强度处染色的细胞百分比) 3
×
(3 强度处染色的细胞百分比)=h评分。3 是强染色,2 是中等染色,1 是弱染色,并且0是无染色。
[1137]
pdx研究1
[1138]
使用上文公开的方法,评估了五只小鼠(模型)的25a3-lt-a adc的功效。结果示出于表24-29和图8a-8e中。如图所示,五个模型中有四个表现出显著肿瘤生长抑制。这些数据表明在多种肿瘤类型和表达tf的癌症中具有高功效。模型的ihc分析揭示了不同肿瘤模型之间具有相当的h评分(全部在100和200之间),这表明tf表达水平相当和tf分布不均匀(图9a-9e)。
[1139]
表24.pdx研究1中报告的肿瘤生长抑制。
[1140]
模型#肿瘤类型肿瘤生长抑制ctg-0353胃癌97%ctg-0707胃癌10%ctg-0786头颈癌100%ctg-1076膀胱癌88%ctg-1130头颈癌101%
[1141]
图9a和表25示出了ctg-0707胃癌模型的ihc分析结果。在下表中,scl=亚细胞定位。m=膜染色;c=细胞质染色;mc=膜/细胞质染色;cm=细胞质/膜染色。
[1142]
表25.ctg-0707胃癌模型的h评分测定。
[1143][1144]
图9b和表26示出了ctg-0353胃癌模型的ihc分析结果。
[1145]
表26.ctg-0353胃癌模型的h评分测定。
[1146][1147]
图9c和表27示出了ctg-1076膀胱癌的ihc分析结果。
[1148]
表27.ctg-1076膀胱癌模型的h评分测定
[1149][1150]
图9d和表28示出了ctg-0786头颈癌模型的ihc分析结果。
[1151]
表28.ctg-0786头颈癌模型的h评分测定。
[1152][1153]
图9e和表29示出了ctg-1130头颈癌模型的ihc分析结果。
[1154]
表29.ctg-1130头颈癌模型的h评分测定。
[1155][1156]
pdx研究2
[1157]
使用上文公开的方法,评估了五只小鼠的25a3-lt-a adc的功效。结果示出于下表30-35和图10a-10e中。如图所示,五个模型中有两个表现出显著肿瘤生长抑制。在pdx研究2中测试的模型相对于由不同第三方供应商进行的pdx研究1中测试的模型之间存在更大的差异。具体地,两种食管癌模型和一种胰腺癌模型(pa6262)表现出低的肿瘤生长抑制。在这些模型中观察到的低肿瘤生长抑制的一些潜在解释包括:
[1158]
·
相对于其他模型,植入后tf表达低或不存在;和/或
[1159]
·
肿瘤内坏死;和/或
[1160]
·
实验变差或误差。
[1161]
模型的ihc分析揭示了不同肿瘤模型之间具有相当的h评分,这表明tf表达水平相当和tf分布不均匀(图11a-12)。
[1162]
表30.pdx研究2中报告的肿瘤生长抑制。
[1163]
模型#肿瘤类型肿瘤生长抑制hn2574hn-头颈癌90%es0147es-食管癌36%es0214es-食管癌-4%pa1332pa-胰腺癌60%pa6262pa-胰腺癌30%
[1164]
图11a和表31示出了来自hn 2574头颈癌模型的ihc分析结果。
[1165]
表31.hn 2574头颈癌模型的h评分测定。
[1166][1167]
图11b和表32示出了来自es0214食管癌模型的ihc分析结果。
[1168]
表32.es0214食管癌模型的h评分测定。
[1169]
[1170]
图11c和表33示出了来自es0147食管癌模型的ihc分析结果。
[1171]
表33.es0147食管癌模型的h评分测定。
[1172][1173]
图11d和表34示出了pa1332胰腺癌模型的ihc分析结果。
[1174]
表34.pa1332胰腺癌模型的h评分测定。
[1175][1176]
图11e和表35示出了pa6262胰腺癌模型的ihc分析结果。
[1177]
表35.pa6262胰腺癌模型的h评分测定。
[1178][1179]
图12示出了来自三个另外的小鼠模型的免疫染色,这些小鼠模型中植入了卵巢癌或宫颈癌肿瘤患者来源的异种移植物,并使用上文在实施例5中公开的方法进行了ihc分析。
[1180]
实施例6:抗tf adc在胃癌患者来源的异种移植物模型中的作用
[1181]
在免疫受损小鼠中进行异种移植物研究,以评价adc在体内的功效。将tf阳性胃癌患者来源的异种移植物皮下植入无胸腺裸鼠(envigo,indianapolis,in)的侧面。当肿瘤达到150-200mm3平均大小时将动物随机分组并用指定剂量的如实施例1中所述制备的抗tf抗体-药物缀合物25a3-lt-a、同型对照lt-a或媒介物(pbs)腹膜内(ip)治疗,每周一次,持续2周。每两周进行一次体重和肿瘤大小评估。一旦肿瘤大小达到1200mm3或皮肤溃疡明显,就将动物从研究中移出并对其实施安乐死。结果描绘在图13a中。与媒介物治疗组或同型对照lt-a治疗组相比,包含缀合至lt-a的抗tf抗体25a3(25a3-lt-a)的adc减小了肿瘤大小。与12mg/kg的同型对照lt-a相比,用4mg/kg 25a3-lt-a治疗减小了肿瘤体积并延迟了肿瘤生长。与12mg/kg的同型对照lt-a相比,用12mg/kg 25a3-lt-a治疗减小了肿瘤体积并阻止了肿瘤生长。这些数据表明抗tf抗体-药物缀合物25a3-lt-a在体内有效减小肿瘤大小。
[1182]
实施例7:抗tf adc在肺癌患者来源的异种移植物模型中的作用
[1183]
在免疫受损小鼠中进行异种移植物研究,以评价adc在体内的功效。将tf阳性肺癌患者来源的异种移植物皮下植入到nsg
tm
(nod.cg-prkdc
scid il2rgt
m1wjl
/szj)小鼠(jackson laboratories,sacramento,ca)的侧面。当肿瘤达到150-200mm3平均大小时将动物随机分组并用指定剂量的如实施例1中所述制备的抗tf抗体-药物缀合物25a3-lt-a或同型对照lt-a腹膜内(ip)治疗,每周一次,持续2周。每两周进行一次体重和肿瘤大小评估。一旦肿瘤大小达到1200mm3或皮肤溃疡明显,就将动物从研究中移出并对其实施安乐死。结果描绘在图13b中。与同型对照lt-a治疗组相比,包含缀合至lt-a的抗tf抗体25a3的adc延迟了肿瘤
生长。这些数据表明抗tf抗体-药物缀合物25a3-lt-a在体内有效延迟肿瘤进展。
[1184]
实施例8:初步食蟹猴毒理学研究:25a3-lt-a对比25a3-mmae
[1185]
本研究的目的是评估adc 25a3-lt-a相对于抗tf抗体-药物缀合物25a3-mmae的毒性参数,并确定前者是否相对于包含mmae的另一种抗tf抗体药物缀合物(tisotumab vedotin(genmab))的公开获得的数据表现出类似(如果不是更好的话)中靶毒性。tisotumab vedotin是缀合至mmae且具有蛋白酶可裂解的连接子的抗tf完全人单克隆抗体。(chenard-poirier等人,annals of oncology 28.suppl_5(2017))。tisotumab vedotin已在之前的研究中显示,当以2.2mg/kg的剂量施用时,会引起剂量限制性毒性(例如,中性粒细胞减少症)。(de bono等人,the lancet oncology 20.3(2019):383-393)。使用tisotumab vedotin在3mg/kg剂量下也观察到中性粒细胞减少症和皮肤毒性。其在6mg/kg下导致剂量限制性毒性,此时受试者表现出4级中性粒细胞减少症和严重皮肤刺激和皮肤溃疡。(parren,p.,advancing towards the clinic as soon as possible:pre-clinical development of a therapeutic adc targeting tissue factor.world adc conference,october 16,2013;geoij,b.e.c.g.antibody-drug conjugates in cancer.diss.faculty of medicine,leiden university medical center(lumc),leiden university,2016。)使用缀合至lt-a的her-2靶向抗体的先前研究表明,her-2-lt-a在高达18mg/kg下不会导致显著中性粒细胞减少症。此外,据报告,tisotumab vedotin会出现短暂的alt和ast升高。
[1186]
为了进行当前的初步毒理学研究,雌性食蟹猴(“cyno”)(每组n=3)使用(通过静脉注射)25a3-lt-a或25a3-mmae治疗并在研究的第1、22和36天接受指定剂量。用25a3-mmae治疗的动物接受每剂量1.5mg/kg、3mg/kg或6mg/kg,而用25a3-lt-a治疗的动物接受每剂量3mg/kg、6mg/kg或18mg/kg。所有存活到研究第43天的猴子都接受了预定的安乐死。
[1187]
临床观察:皮肤毒性
[1188]
表36提供了关于在研究结束时不同治疗组中的皮肤毒性的定性数据。如图所示,用25a3-mmae治疗的动物的皮肤刺激比用25a3-lt-a治疗的动物严重。例如,三只动物中仅一只需要在6.0mg/kg 25a3-lt-a中进行局部类固醇治疗,而在6.0mg/kg 25a3-mmae组中三只动物中有两只需要局部和全身类固醇来对抗皮肤刺激。在所有25a3lt-a治疗组(n=12)中,仅一只动物需要全身性类固醇,并且该动物接受了最高测试剂量18.0mg/kg,这是25a3-mmae群组中测试的最高剂量的3倍。这些数据表明,与对应物基于lt-a的抗tf抗体adc相比,使用基于mmae的抗tf adc具有更大的皮肤毒性(和更低的耐受性)。
[1189]
表36.关于皮肤毒性的临床观察。
[1190][1191][1192]
临床化学:肝毒性
[1193]
为了评估与25a3-mmae和25a3-lt-a治疗相关的肝毒性参数,测量了球蛋白、白蛋白、丙氨酸转氨酶(alt)和天冬氨酸转氨酶(ast)。在研究的第0(预治疗)、8、15、29和36天以及在安乐死之前从每只猴子收集血液样品。图14a和14b分别示出了指定治疗组的ast和alt水平。这些数据表明,在研究过程中在用12mg/kg25a3-lt-a和18mg/kg 25a3-lt-a治疗的猴子中,ast短暂增加。这两个治疗组均表现出2级ast升高。此外,12mg/kg25a3-lt-a和18mg/kg 25a3-lt-a治疗组显示球蛋白略微增加并且白蛋白略微增加。25a3-mmae和25a3-lt-a均未导致短暂alt升高。
[1194]
血液学
[1195]
为了进一步评估25a3-mmae和25a3-lt-a的潜在脱靶效应,测量猴子的中性粒细胞和单核细胞。在研究的第0(预治疗)、4、8、15、25、29、36和43天以及在安乐死之前从每只猴子收集血液样品。使用样品完成血细胞计数,血细胞计数确定血液学参数,包括但不限于单核细胞计数和中性粒细胞计数。
[1196]
图15a-17d示出了研究过程中的嗜中性粒细胞水平。在3mg/kg25a3-mmae和6mg/kg 25a3-mmae组中,所有动物的中性粒细胞显着减少。相比之下,25a3-lt-a组中的大多数猴子都保持在历史平均水平以上或有单次下降。唯一的例外是猴子4502;然而,应当注意猴子4502以非常低的中性粒细胞计数开始(图17a)。数据显示,用6mg/kg 25a3-mmae治疗的猴子
出现3级和4级中性粒细胞减少症,并且25a3-lt-a治疗组的猴子没有中性粒细胞减少症。这表明用25a3-mmae治疗时而非在用25a3-lt-a治疗时出现6mg/kg的剂量限制性中性粒细胞减少症。
[1197]
除了18mg/kg 25a3-lt-a治疗组以外,25a3-mmae和25a3-lt-a治疗组的单核细胞水平相当(图18)。在18mg/kg 25a3-lt-a治疗组中,短暂单核细胞升高归因于患有眼部感染的猴子7503。
[1198]
pk和免疫原性
[1199]
为了检查adc pk,在施用第一剂量和第二剂量后从猴子身上收集血液样品,并使用单克隆抗体(mab)测定和完整adc测定进行评估。mab测定使用htf作为涂覆试剂并使用二级抗higg作为检测剂。完整adc检测使用抗毒素mab作为涂覆试剂并使用抗igg作为检测剂。表37和38示出了mab测定和完整adc测定的结果。
[1200]
表37.具有标准偏差的平均mab测定结果。
[1201][1202][1203]
表38.具有标准偏差的平均完整adc测定结果
[1204][1205]
对于25a3-mmae和25a3-lt-a,如通过mab和完整adc测定确定的,时间浓度曲线类似。这表明每个adc都不会快速降解。
[1206]
分析pk和免疫原性数据的结果总结在表39中。在25a3-mmae的情况下,pk在第一剂量的情况下近似线性增加,并且第二剂量施用后的浓度显著低于第一剂量施用后的浓度。在25a3-lt-a的情况下,在各组中,第二剂量施用后的浓度与第一次施用后观察到的浓度类似(3mg/kg剂量除外)。数据表明轻微的靶标介导的药物处置,其随着剂量的增加而降低。数据还表明,与25a3-lt-a相比,在3和6mg/kg下,25a3-mmae清除速度更快,这表明非靶标介导的吸收。
[1207]
如表39所示,所有猴子都产生了抗药抗体(ada)。虽然观察到免疫原性,但通常食蟹猴的ada不能预测人类的ada。
[1208]
表39.pk和免疫原性结果。
[1209][1210]
实施例9:连接子-毒素a的合成
[1211]
以下实施例描述了示例性连接子-毒素(连接子-毒素a,也称为lt-a)的制备,所述连接子-毒素包括瑞奥西汀衍生物化合物9:
[1212][1213]
可以采用类似方案来制备包括如本文所述的通式i的其他瑞奥西汀衍生物的连接子-毒素(也参见国际专利申请公布号wo 2016/041082)。
[1214]
7.1(2r,3r)-3-甲氧基-2-甲基-3-((s)-吡咯烷-2-基)丙酸乙酯(化合物1)
[1215]
[1216]
在0℃下向(2r,3r)-3-((s)-1-(叔丁氧基羰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸(boc-dap-oh,4.31g,15.0mmol)于无水乙醇(27.0ml)中的已搅拌溶液中以逐滴方式添加亚硫酰氯(3.0ml)。使所得溶液升温至室温并通过hplc-ms监测进展。18h后,没有检测到剩余的起始材料,并将溶液在减压下浓缩至干燥。将所得油状物悬浮于甲苯(10ml)中并在减压下浓缩两次,然后悬浮于乙醚(5ml)中并在减压下浓缩两次,得到呈白色固体泡沫状的标题化合物(3.78g,定量产率%)。ms m/z观测值=216.5(m 1)。
[1217]
7.2(3r,4s,5s)-4-((s)-2-((((苄氧基)羰基)氨基)-n,3-二甲基丁酰氨基)-3-甲氧基-5-甲基庚酸(化合物3)
[1218][1219]
如国际专利申请公布号wo 2016/041082中所述制备化合物2。
[1220]
向化合物2(6.965g,14.14mmol)于二氯甲烷(20ml)中的已搅拌溶液中添加三氟乙酸(5.0ml)。通过hplc-ms监测反应完成并且40h后没有起始材料残留。将反应物在减压下浓缩,与甲苯(2x10ml)和二氯甲烷(2x10ml)共蒸发,以获得泡沫状白色固体(6.2g,定量产率,残留tfa)。将此材料溶解在200ml热的1:3etoac:己烷中并使其冷却至室温。在冷却期间,形成沉淀物以及一些小晶体。添加5ml etoac并再次加热悬浮液,以完全溶解沉淀物。冷却至室温时形成更多晶体,并将烧瓶置于-30℃过夜。第二天早上倾析母液,并用2x50ml己烷冲洗晶体并在高真空下干燥。回收5.67g结晶产物形式的标题化合物。ms m/z观测值=405.7(m 1)。
[1221]
7.3(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-(((苄氧基)羰基)氨基)-n,3-二甲基丁酰氨基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸乙酯(化合物4)
[1222][1223]
在室温下向化合物3(6.711g,15.37mmol,1.025当量)于二氯甲烷(5.0ml)和n,n-二甲基甲酰胺(5.0ml)的混合物中的已搅拌溶液中添加hatu(5.732g,15.07mmol,1.005当量)和n,n-二异丙基乙胺(7.84ml,3当量)。在室温下搅拌30分钟后,逐滴添加化合物1(3.776g,15.00mmol,1.0当量)于二氯甲烷(1.0ml)和n,n-二甲基甲酰胺(1.0ml)的混合物中的溶液并用另外3ml 1:1二氯甲烷:n,n-二甲基甲酰胺冲洗残留物化合物1。通过hplc-ms监测反应并且在15分钟后没有观察到剩余的化合物1。将反应物在减压下浓缩,用乙酸乙酯(约125ml)稀释,并将有机相用1m hcl(2x50ml)、1 x dh2o(1x50ml)、饱和的nahco3(3x50ml)、盐水(25ml)萃取。用25ml etoac洗涤酸性和碱性水层。然后将所有有机物合并并用mgso4干燥,过滤并浓缩,以得到红色油状物。将残余物溶解在最小量的二氯甲烷(约10ml)中,加载到snap ultra 360g硅胶柱(isolera
tm flash system;biotage ab,sweden)上以用于纯化(己烷中的20-100%etoac,超过10个柱体积)。将含有纯产物的级
分合并,以回收7.9g泡沫状白色固体。在snap ultra100g硅胶柱上对不纯级分进行第二次纯化并将其与纯产物合并,以回收呈白色泡沫固体的标题化合物(8.390g,88.3%)。ms m/z观测值=634.7(m 1)。
[1224]
7.4(2r,3r)-3-((s)-1-((3r,4s,5s)-4-((s)-2-(((苄氧基)羰基)氨基)-n,3-二甲基丁酰氨基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酸(化合物5)
[1225][1226]
向化合物4(8.390g,13.24mmol)于1,4-二噁烷(158ml)中的已搅拌溶液中添加dh2o(39.7ml)和氢氧化锂一水合物(h2o中的1m,39.7ml,3当量)。将反应物在4℃下搅拌并通过hplc-ms监测起始材料的消耗,这花费3天时间直至仅残留痕量化合物4。在反应过程期间,除了所需材料之外,还形成了少量百分比的新产物,其对应于甲醇的损失(β-消除,《2%)。通过添加1m hcl水溶液(50ml)将反应物酸化并在减压下浓缩以除去二噁烷。将剩余的反应混合物用乙酸乙酯(4x50ml)萃取,并且将有机相合并,用盐水(15ml 2ml 2m hcl)洗涤,用mgso4干燥,过滤并在减压下浓缩,得到浅色油状物。将油状物重新溶解在乙醚(约50ml)中并在减压下浓缩(3x),以促进去除残留的二噁烷,得到呈硬油状的标题产物(7.81g,97%收率,带有一些残留的二噁烷和化合物4)。ms m/z观测值=606.7(m 1)。
[1227]
7.5((s)-1-(((3r,4s,5s)-3-甲氧基-1-((s)-2-((1r,2r)-1-甲氧基-2-甲基-3-氧代)-3-((4-(2,2,2-三氟乙酰胺基)苯基)磺酰胺基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)(甲基)氨基)-3-甲基-1-氧代丁-2-基)氨基甲酸苄酯(化合物7)
[1228][1229]
如国际专利申请公布号wo 2016/041082中所述制备化合物6。
[1230]
向化合物5(7.12g,11.754mmol)于二氯甲烷(20ml)中的已搅拌溶液中添加2,2,2-三氟-n-(4-氨磺酰基苯基)乙酰胺(化合物6,4.095g,1.3当量,溶于3ml dmf)、n,n-二甲基吡啶(1.867g,1.3当量)和n,n-二甲基甲酰胺(1.5ml),以生成浅黄色悬浮液。进一步添加5ml dmf未使溶液澄清。一次性添加n-(3-二甲基氨基丙基)-n'-乙基碳化二亚胺盐酸盐(edci)(2.817克,1.25当量),并通过hplc-ms监测反应物。48h后,反应不再进行,并另外添加400mg edci。18h后,没有观察到剩余的起始材料,并且将反应物在减压下浓缩,得到黄色油状物。将油状物溶解于乙酸乙酯(约150ml)和1m hcl(20ml)中,并将有机相用冷的2m hcl(2x10ml)、饱和nahco3(1x10ml)、盐水(20ml 5ml 2m hcl)洗涤。将酸性和碱性水性级分用etoac(1x20ml)萃取,将所有有机级分合并,用mgso4干燥并在减压下浓缩,以产生油状粗制固体(13g)。将残余物溶解于二氯甲烷(约10ml)中,加载到snap ultra 360g硅胶柱上并在12个柱体积的己烷中的10-100%etoac(2%acoh)和50%etoac的3个柱体积稳态下纯化。将含有纯产物的级分合并,在减压下浓缩,溶解于甲苯(2x10ml)和乙醚(2x10ml)中
并浓缩,得到所需产物7.1g白色泡沫固体。在isolera
tm
仪器上使用snap ultra 100g硅胶柱在较浅梯度条件下对不纯级分进行重复纯化。将所有纯级分合并,以回收呈白色泡沫固体的纯产物(标题化合物)(8.60g,86%)。ms m/z观测值=856.7(m 1)。
[1231]
7.6(s)-2-氨基-n-((3r,4s,5s)-3-甲氧基-1-((s)-2-((1r,2r)-1-甲氧基-2-甲基-3-氧代-3-((4-(2,2,2-三氟乙酰胺基)苯基)磺酰胺基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-n,3-二甲基丁酰胺(化合物7a)
[1232][1233]
在含有磁力搅拌器并配有3路气体管线接合器的圆底烧瓶中,将化合物7(3.71g,4.33mmol)溶解于乙酸乙酯(30ml)中的10%n,n-二甲基甲酰胺。在减压下将容器抽真空两次并充入氮气。一次性添加10%钯碳(0.461g,0.1当量),将3路接合器安装到烧瓶上,将氢气球安装到接合器上,并在减压下将容器抽真空两次并充入氢气。将反应物搅拌2天,在此期间偶尔再填充氢气球。大约48h后,hplc-ms分析表明没有起始材料残留。将反应物用甲醇(20ml)稀释并通过硅藻土塞过滤。将硅藻土用甲醇(2x50ml)洗涤。将所有滤液合并并在减压下浓缩,并且将所得油状物溶解于二氯甲烷中并浓缩。在减压下干燥后,分离出无色粉末状标题化合物(3.10g,99%)。ms m/z观测值=722.6(m 1)。
[1234]
7.7(s)-2-((s)-2-(二甲氨基)-3-甲基丁酰氨基)-n-((3r,4s,5s)-3-甲氧基-1-((s)-2-((1r),2r)-1-甲氧基-2-甲基-3-氧代-3-(((4-(2,2,2-三氟乙酰胺基)苯基)磺酰胺基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-n,3-二甲基丁酰胺(化合物8)
[1235][1236]
向n,n-(l)-二甲基缬氨酸(1.696g,9.35mmol)于n,n-二甲基甲酰胺(10ml)中的已搅拌溶液中添加hatu(3.216g,8.46mmol)和二异丙基乙胺(3.10ml,17.8mmol)。5分钟后得到澄清的黄色溶液。再继续搅拌10分钟,然后一次性添加化合物7a(3.213g,4.45mmol)。再搅拌1h后,hplc-ms表明残留痕量化合物7a并且反应进行16h。然后将反应物在减压下浓缩,用乙酸乙酯(120ml)和40ml 1:1nahco3(饱和):5%licl稀释并转移到分液漏斗中。除去水层,并将有机相用licl(1x20ml)、nahco3(饱和,2x20ml)洗涤。将水层合并并用etoac(3x50ml)萃取。将有机层合并并用盐水(1x20ml)洗涤,用硫酸钠干燥,过滤并浓缩,以得到含dmf的油状物,通过旋转蒸发器浓缩所述油状物,以除去残留的dmf,得到7g粗稻草色油状物。将油状物溶解于二氯甲烷的最小量的10%甲醇(约11ml)中,并加载到snap ultra 360g硅胶柱上以用于纯化(ch2cl2中的2-20%meoh,15个柱体积,产物洗脱约10-13%)。将含有所需产物的级分合并并在减压下浓缩,得到呈无色泡沫状的标题化合物。将不纯的级分合并,蒸发,并在isolera
tm
仪器上的snap ultra 100g硅胶柱上进行重复纯化并且将其与来自第一柱的纯产物合并,得到无色泡沫状固体(3.78g)。ms m/z观测
值=850.6(m 1)。
[1237]
7.8(s)-n-((3r,4s,5r)-1-((s)-2-((1r,2r)-3-((4-氨基苯基)磺酰胺基)-1-甲氧基-2-甲基-3-氧代丙基)吡咯烷-1-基)-3-甲氧基-5-甲基-1-氧代庚烷-4-基)-2-((s)-2-(二甲氨基)-3-甲基丁酰胺基)-n,3-二甲基丁酰胺(化合物9)
[1238][1239]
向化合物8(0.980g,1.154mmol)于1,4-二噁烷(15ml)中的已搅拌溶液中添加水(3.5ml)和1m氢氧化锂一水合物(3当量,3.46ml)。将所得轻悬浮液在4℃下搅拌并通过hplc-ms监测其起始材料的消耗。当转化完成时(约5天),用3.46ml的1m hcl中和反应物,并在减压下浓缩,以除去二噁烷。将所得水相用60ml etoac和5ml盐水稀释,然后用乙酸乙酯(2x30ml)萃取。将有机级分合并,用na2so4干燥,过滤并蒸发,得到呈棕褐色固体的标题化合物(0.930g)。rf=0.5(ch2cl2中的8%meoh)。ms m/z观测值=753.7(m 1)。
[1240]
7.9 3-(2-(2-(2-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)乙氧基)乙氧基)乙氧基)丙酸2,3,5,6-四氟苯酯(化合物15)
[1241][1242]
在干燥的50ml锥形瓶中,将3-(2-(2-(2-氨基乙氧基)乙氧基)乙氧基)丙酸(化合物14,1.000g,4.52mmol)和马来酸酐(0.443g,4.52mmol)溶解于无水n,n-二甲基甲酰胺(5ml)中。将反应物在室温下在n2下搅拌6h,然后冷却至0℃并逐滴添加顺-三甲吡啶(1.263ml,2.1当量)。在单独的干燥50ml锥形烧瓶中,将四氟苯酚(3.002g,4当量)溶解于无水n,n-二甲基甲酰胺(10ml)中。将烧瓶在冰浴中冷却至0℃并逐滴添加三氟乙酸酐(2.548ml,4当量)。搅拌15分钟后,逐滴添加顺-三甲吡啶(2.407ml,4当量)。将烧瓶再搅拌15分钟,并且然后通过注射器将内容物逐滴添加到第一烧瓶中。使反应物升温至室温并在n2下继续搅拌。通过hplc-ms监测反应的起始材料的消耗。6天后,反应完成,化合物14全部消耗,仅留下化合物15和少量(约5%)的双tfp马来酰胺中间体。将反应物转移到分液漏斗中,用乙醚(75ml)稀释并用5%licl(1x20ml)、1m hcl(2x20ml)、饱和nahco3(5x20ml)和盐水(1x20ml)洗涤。将有机层用na2so4干燥,过滤并蒸发,得到具有残留dmf的棕色粗制油状物。将粗制油状物溶解于8ml 1:1dmf:h2o 0.1%tfa,将其加载到60gsnap ultra c18柱(biotage ab,uppsala,sweden)并且在8个柱体积的acn/h2o 0.1%tfa的线性30-100%梯度下纯化。将纯级分合并并用盐水(20ml)稀释,然后用3x50ml et2o萃取。将合并的有机物用mgso4干燥,过滤并蒸发,以回收呈浅黄色油状的标题化合物(1.34g,66%产率)。
[1243]
7.10((s)-1-(((s)-1-((4-(n-((2r,3r)-3-((s)-1-((3r,4s,5s))-4-((s)-2-((s)-2-(二甲氨基)-3-甲基丁酰氨基)-n,3-二甲基丁酰氨基)-3-甲氧基-5-甲基庚酰)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)氨磺酰基)苯基)氨基)-1-氧代-5-脲基戊烷-2-基)
氨基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸叔丁酯(化合物12)
[1244][1245]
如国际专利申请公布号wo 2016/041082中所述制备化合物11。
[1246]
向空的25ml梨形烧瓶中添加化合物11(1.342g,3.58mmol,3.0当量)、1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(0.664g,3.46mmol,2.9当量)和7-羟基-氮杂苯并三唑(hoat)(0.472g,3.46mmol,2.9当量)。将这些固体溶解于n,n-二甲基甲酰胺(0.5ml)和二氯甲烷(4.5ml)的混合物中,在室温下搅拌30分钟。单独地,将化合物9(0.900g,1.20mmol)溶解于n,n-二甲基甲酰胺(0.2ml)和二氯甲烷(1.8ml)的混合物中并添加到梨形烧瓶中,用二氯甲烷(1.0ml)冲洗。将搅拌速率增加到1000rpm,产生涡流。在添加化合物9后2分钟内,通过窄粉末漏斗将氯化铜(ii)(0.514g,3.83mmol,3.2当量)一次性直接添加到涡旋中心。最初的浅黄色溶液变成深棕色悬浮液,10分钟后变成深绿色悬浮液。通过hplc-ms监测反应的完成,并且在30分钟和1h(约95%完成)采集的样品之间没有观察到反应进程的变化。将反应物在室温下搅拌过夜,然后将2-(2-氨基乙基氨基)乙醇(0.483ml,4.781mmol,4当量)、etoac(10ml)和dh2o(5ml)添加到搅拌的悬浮液中,其颜色变成深蓝色。随着悬浮的固体逐渐溶解到双相混合物中,将悬浮液剧烈搅拌4h。将该混合物转移到分液漏斗中并用etoac(100ml)和盐水(10ml)稀释,并且使用10%ipoh/etoac(4x50ml)萃取水层。将有机层合并并用盐水(10ml)洗涤,用na2so4干燥,并蒸发,以产生淡蓝色粗制固体。将该粗制固体溶解于甲醇(0.5ml)和二氯甲烷(6ml)的混合物中,并在snap ultra 100g硅胶柱(ch2cl2中的2-20%meoh,10个柱体积,随后20%meoh的8个柱体积稳态)上纯化。在1-2个柱体积的ch2cl2中的约20%meoh之后,产物洗脱为宽峰。将含有所需物质的级分合并并在减压下浓缩,得到呈白色固体的标题化合物(1.105g,83%)。ms m/z观测值=555.9((m 2)/2),1109.8(m 1)。
[1247]
7.11(s)-2-((s)-2-氨基-3-甲基丁酰氨基)-n-(4-(n-((2r,3r)-3-((s)-1-((3r,4s),5r)-4-((s)-2-((s)-2-(二甲氨基)-3-甲基丁酰氨基)-n,3-二甲基丁酰氨基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)氨磺酰基)苯基)-5-脲基戊酰胺(化合物13)
[1248][1249]
向化合物12(0.926g,0.834mmol)的溶液中添加二氯甲烷(10ml)和三氟乙酸(2.0ml)的混合物。通过hplc-ms监测反应的起始材料的消耗(约45分钟)。在减压下将反应物与乙腈(2x10ml)和二氯甲烷(2x10ml)共蒸发,以除去过量的三氟乙酸。将所得残余物溶解于最少量的二氯甲烷和甲醇(3:1,v/v,约2ml)中,并通过移液管逐滴添加到乙醚(200ml)和己烷(100ml)的已搅拌溶液中,产生浅白色固体悬浮液。过滤固体并在真空下干燥,得到呈白色粉末形式、呈三氟乙酸盐形式的标题化合物(1.04g,定量产率,带有一些残留溶剂)。ms m/z观测值=505.8((m 2)/2)。
[1250]
7.12(s)-n-(4-(n-((2r,3r)-3-((s)-1-((3r,4s,5r)-4-((s)-2-((s)-2-(二甲氨基)-3-甲基丁酰氨基)-n,3-二甲基丁酰氨基)-3-甲氧基-5-甲基庚酰)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰)氨磺酰)苯基)-2-((s)-1-(2,5-二氧代-2,5-二氢-1h-吡咯-1-基)-14-异丙基-12-氧代-3,6,9-三氧杂-13-氮杂十五烷酰胺基)-5-脲基戊酰胺(连接子-毒素a)
[1251]
[1252]
向化合物13(0.722g,0.584mmol)于n,n-二甲基甲酰胺(4ml)中的已搅拌溶液中添加化合物15(0.314g,1.2当量)和二异丙基乙胺(0.305ml,3.0当量)。2h时的hplc-ms分析表明没有剩余的起始材料。将反应物用tfa(300μl)酸化,并且然后用dih2o 0.1%tfa(9ml)稀释。将所得溶液装载到120gsnap ultra c18柱(biotage,uppsala,sweden)上并且在以下acn/h2o 0.1%tfa梯度下纯化:10个柱体积的20-60%acn、5个柱体积的60-100%acn。产物以将近40%acn洗脱。将通过lcms鉴定的纯级分合并并冻干。从冻干机回收白色粉末固体。在更高浓度(在2:1h2o/acn中的大约50mg/ml)下重复冻干到小瓶中,以产生呈更稠密、更少絮凝的冻干固体的标题化合物(754.2mg,91%)。ms m/z观测值=647.4((m 2)/2),1292.8(m 1)。
[1253]
尽管本发明已参考优选实施方案和各种替代性实施方案加以特定显示和描述,但相关领域技术人员将了解可在不脱离本发明的精神和范围下在其中进行各种形式和细节变化。
[1254]
在本说明书的主体内引用的所有参考文献、授权专利和专利申请都据此出于所有目的以引用的方式整体并入本文。
[1255]
序列
[1256]
表5:可变区序列
[1257]
[1258][1259]
表6:共有可变区序列
[1260][1261]
[1262]
[1263]
[1264]
[1265]
[1266]
[1267]
[1268]
[1269][1270]
表15:人、食蟹猴和小鼠tf序列
[1271]
[1272]
[1273][1274]
表16:抗tf抗体序列
[1275]
[1276][1277]
表17:猪tf序列
[1278][1279]
[1280]
表18:兔tf序列
[1281][1282]
[1283]
表19:大鼠tf ecd和嵌合构建体ecd序列
[1284]
[1285]
[1286]
[1287]
[1288]
[1289]
[1290][1291]
表20:共有可变区序列
[1292][1293]
表21:共有cdr
[1294]
[1295]
*exemplary cdr序列涵盖了由kabat加chothia确定的氨基酸
[1296]
表22:抗体序列
[1297]
可变区呈粗体;参与药物缀合的半胱氨酸加下划线
[1298]
[1299]
[1300]
[1301]
[1302]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。