1.本发明涉及生物工程技术领域,尤其涉及一种调控冷冻牛卵母细胞的发育能力的方法及其应用。
背景技术:
2.哺乳动物卵母细胞玻璃化冷冻,对于濒危动物和优秀品种种质资源保存有着重要意义,更有助于解除家畜胚胎体外生产和移植的时间和空间限制(quaas&pennings,2018)。同时,该技术可以为有生殖隐患及推迟生育的女性保存生育能力,是女性生殖力保存的有效途径(stevenson et al.,2019)。由此可见,卵母细胞玻璃化冷冻保存技术有着重要的经济价值和社会效益。该技术从1985年诞生以来(rall&fahy,1985),已经成功用于小鼠、大鼠、猪、牛、羊、马等数十种动物及人类卵母细胞和胚胎的冷冻保存。尽管如此,玻璃化冷冻卵母细胞的发育潜力仍不理想,一直是本领域的研究焦点。
3.为了进一步优化冷冻保护剂和程序、最终提高冷冻效率,研究人员一直关注于玻璃化冷冻对卵母细胞的细胞和分子生物事件所造成的影响(de munck&vajta,2017;ahmadi et al.,2019;matilla et al.,2019),玻璃化冷冻对卵母细胞表观遗传性状造成的影响逐渐成为了本领域的研究热点和发展趋势(wang et al.,2018;chen et al.,2019)。基因印迹是一种精确的表观遗传学现象,它使基因呈现出亲本依赖性的差异表达,对个体的生长和发育起到了关键的调控作用。研究表明,牛基因组存在28个印迹基因(tian et al.,2014),包括单胺氧化酶a(maoa)胰岛素样生长因子2受体(igf2r)基因等。maoa基因位于x染色体,主要调控胚胎床进程,其dna甲基化状态与x染色体失活密切关联,而后者对胚胎正常发育至关重要(ferreira et al.,2010)。igf2r是igf2的受体,在胎儿发育中发挥着重要作用(reik et al.,2003),与印迹紊乱疾病密切相关(debaun,2003)。有研究证实,反刍动物体外生产胚胎igf2r基因印迹丢失,会直接导致其后代的巨胎症(young et al.,2001)。
技术实现要素:
4.为了解决现有技术存在的问题,本发明提供一种调控冷冻牛卵母细胞的发育能力的方法及其应用,采用β-烟酰胺单核苷酸处理冷冻牛卵母细胞可以显著提高其成熟率和ivf后的胚胎发育能力。并且在将其igf2r基因的启动子进行甲基化处理后,可以进而提高冷冻牛卵母细胞经过ivf后得到的胚胎的发育能力,甚至超过新鲜牛卵母细胞。
5.第一方面,本发明提供一种调控冷冻牛卵母细胞的发育能力的方法,包括:
6.采用20~40μmβ-烟酰胺单核苷酸处理所述冷冻牛卵母细胞。
7.进一步地,包括:
8.在对牛卵母细胞进行冷冻之前的体外成熟过程中采用20~40μmβ-烟酰胺单核苷酸进行处理;和/或,
9.针对牛卵母细胞在体外受精后形成的ivf胚胎采用20~40μmβ-烟酰胺单核苷酸进行处理。
10.进一步地,所述进行处理可以采用多种形式,例如在培养液中直接加入20~40μmβ-烟酰胺单核苷酸。
11.β-酰胺单核苷酸(nicotinamide mononucleotide,nmn)又称为烟酰胺单核苷酸,是合成辅酶i——烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,nad )的关键前体之一。在促进脂代谢方面,nmn也具有巨大的应用潜能。wang lf(2017)等报道烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,nampt)可通过激活sirt1信号通路抑制fasn和acc等成脂基因的表达进而减少脂质沉积;nmn作为nampt的酶产物,也可有效抑制fk866(nampt抑制剂)诱导的肝脏细胞脂质沉积(wang lf,2017)。与之相似,uddin gm(2020)发现nmn可通过下调脂肪合成(脂肪酸合酶fasn;乙酰辅酶a羧化酶1acc1)、转运(脂肪酸转运蛋白cd36)相关基因的表达,上调脂肪分解代谢相关基因(肉碱脂酰转移酶1cpt1)的表达抑制肝脏脂肪沉积。
12.本发明推测酰胺单核苷酸可能会通过卵母细胞去脂物质以提高其耐冻性,最终提高冷冻卵母细胞冷冻效率,而在解冻之后的培养液中加入β-烟酰胺单核苷酸,同样由于其的去脂特性,可以显著提高冷冻卵母细胞ivf胚胎的发育能力。
13.进一步地,还包括:
14.调控所述冷冻牛卵母细胞在体外受精后形成的ivf胚胎的igf2r基因的甲基化水平。
15.进一步地,通过针对所述ivf胚胎的igf2r基因的启动子进行甲基化处理,提高其甲基化水平。
16.进一步地,所述甲基化处理为针对所述ivf胚胎的igf2r基因的启动子的chr9:96195982-96196481位核苷酸序列的区域进行甲基化处理。
17.进一步地,采用如下sgrna针对所述ivf胚胎的igf2r基因的启动子进行甲基化处理:
18.sgrna:5
’‑
atgactcaactcttcgcatg-3’。
19.进一步地,通过将所述sgrna和dcas9-dnmt 3a mrna置于所述ivf胚胎中进行甲基化处理。
20.在前期研究中,本发明采用单细胞全基因组甲基化测序技术,对新鲜、冷冻卵母细胞体外受精(ivf)囊胚进行了全基因组甲基化测序。结果表明,与新鲜组相比,冷冻组maoa甲基化水平异常升高40%,而igf2r水平异常降低50%,因此本发明推测这两种基因的甲基化水平对于冷冻卵母细胞ivf后的胚胎发育过程具有调控作用。在后续实验过程中,本发明也发现,仅igf2r的甲基化水平会影响冷冻卵母细胞ivf后的胚胎发育能力,maoa甲基化不会影响其胚胎发育能力。
21.本发明发现将igf2r基因的甲基化调控和β-酰胺单核苷酸处理之后取得了显著更高的效果(显著提升了经过玻璃化冻存的牛卵母细胞ivf的囊胚率和卵裂率,甚至超过了新鲜的牛卵母细胞iv囊胚),本发明推测可能是β-酰胺单核苷酸的去脂作用促进了igf2r基因的甲基化调控流程,提高了其甲基化水平。而igf2r基因的甲基化同时促进了去脂效率。
22.进一步地,所述igf2r基因包括如seq id no.1所示的核苷酸序列。
23.进一步地,所述冷冻牛卵母细胞为经过玻璃化冷冻的牛卵母细胞。
24.本发明进一步提供一种sgrna,所述sgrna包括如下核苷酸序列:
25.sgrna:5
’‑
atgactcaactcttcgcatg-3’。
26.本发明进一步提供包括所述sgrna的试剂盒。
27.本发明进一步提供所述sgrna,或所述试剂盒在提高冷冻牛卵母细胞的发育能力中的应用;
28.所述发育能力优选为成熟能力,或经过受精形成胚胎后的发育能力。
29.本发明具备如下有益效果:
30.本发明在牛卵母细胞的体外成熟阶段,以及冷冻-解冻后的体外培养流程中加入一定浓度的β-烟酰胺单核苷酸,发现其可以显著提高牛卵母细胞的发育能力。在此基础上,本发明进一步采用dcas9-dnmt3a dna甲基化调控技术对igf2r的甲基化模式进行精准调减、调增,提升了牛卵母细胞igf2r基因启动子的甲基化水平,进而提高了牛卵母细胞的发育能力。而且当两种技术共用时,可以进一步显著提高牛卵母细胞ivf后的胚胎发育能力。
附图说明
31.图1位本发明实施例1提供的脂滴尼罗红染色结果示意图。
32.图2为本发明实施例3提供的igf2r调控和nmn联合处理对玻璃化冷冻牛卵母细胞经过ivf后的胚胎的发育基因表达水平的影响示意图。
具体实施方式
33.以下实施例用于说明本发明,但不用来限制本发明的范围。
34.实施例1
35.本实施例研究nmn处理对于玻璃化冷冻牛卵母细胞ivf胚胎发育能力的影响,具体流程如下:
36.1、牛卵母细胞ivm
37.从卵巢表面抽取直径2-8mm卵泡中的卵母细胞,选择带有完整致密的卵丘-卵母细胞复合体(cocs)放置于ivm液中成熟22-24h。ivm结束后,cocs去除颗粒细胞后,挑选具有第一极体且胞质均匀的卵母细胞用于后续研究。
38.2、卵母细胞ops玻璃化冷冻-解冻
39.抗冻保护剂配制和玻璃化冷冻程序如下:
40.i.抗冻保护剂配制:
41.10%eg:eg、fbs、dpbs(-ca
2
、mg
2
)按1:2:7(v/v)比例配制。
42.10%dmso:dmso、fbs、dpbs(-ca
2
、mg
2
)按1:2:7(v/v)比例配制。
43.10%eg 10%dmso:eg、dmso、fbs、dpbs(-ca
2
、mg
2
)按1:1:2:6(v/v)比例配制。
44.edfsf40:eg、dmso、fsf按2:2:6(v/v)比例配制。
45.fsf:300g/l聚蔗糖添加0.5m蔗糖,经dpbs(-ca
2
、mg
2
)液溶解后,加入20%fbs后制成fsf溶液。
46.ii.玻璃化冷冻程序
47.冷冻程序:将室温调至25
±
1℃,使试验用具及试剂得到充分平衡。试验在38-39℃恒温台上操作。将卵母细胞用ops管移入预处理液(10%eg 10%dmso)中平衡30s后,然后移入冷冻液(edfsf40)中平衡25s,然后将卵母细胞吸入ops管中直接投入液氮冷冻保存。
48.解冻程序:ops管由液氮中取出后,立即卵母细胞放入含有0.25m蔗糖解冻液的表面皿中平衡1min,然后移入0.15m蔗糖解冻液中平衡5min。卵母细胞再用ivm液洗涤2次,解冻后形态正常者(根据膜完整性和细胞光泽度)判定为存活,移入ivm液中待用。
49.3、脂滴染色
50.卵母细包或胚胎采用4%多聚甲醛固定;含0.1%pva的pbs洗涤3遍,置于尼罗红染色液中,37℃避光孵育10min;0.1%pva的pbs清洗2遍,置于荧光显微镜下观察脂滴含量变化并拍照。采用nikon ez-c1 free viewr软件分析尼罗红荧光强度。
51.4、新鲜、冷冻牛卵母细胞ivf
52.将液氮中的冻精在水浴锅(38℃)中解冻,移入超净台,将精液加入15ml离心管中,用洗精液离心(1500r/min,5min/次)、洗涤精子2次,弃上清,最后加入受精液调整精子密度(5
×
106个/ml),将20μl精液与80μl受精滴混合(精子密度变为1
×
106个/ml),成100μl受精滴,放入co2培养箱(5%co2、38.5℃、饱和湿度)平衡1.5h,将卵母细胞移至受精滴,20~30枚/滴,放入co2培养箱中受精6~8h。受精卵放入体外培养液(ivc液,前期液)48h后记录卵裂率,并将卵裂的胚胎换到ivc液,后期液中培养,以后隔48h换一次液(半量),统计第7天的囊胚率。
53.5、实验设计
54.在卵母细胞体外成熟过程中,在ivm中添加不同浓度nmn(2μm、20μm、200μm),或是ivf胚胎的ivc培养液(包括前期液和后期液)中添加不同浓度nmn(2μm、20μm、200μm),进而研究nmn处理对玻璃化冷冻牛卵母细胞ivf胚胎发育能力的影响。在此基础之上,研究nmn和igf2r甲基化调控对玻璃化冷冻牛卵母细胞ivf胚胎发育能力的影响。
55.6、实验结果
56.6.1、ivm液中nmn添加对牛卵母细胞核成熟和脂滴含量的影响
57.为了提高卵母细胞冷冻效率,本发明在卵母细胞ivm液中添加了去脂物质nmn。如表1所示,在牛卵母细胞ivm液中添加20μm nmn时,核成熟率(93.13
±
8.48%)显著高于其他组(83.02
±
6.09%)。脂滴尼罗红染色如图1所示,200μm nmn组脂滴水平显著低于其他组。由此可见,在卵母细胞ivm液中添加20μm nmn,能够降低卵母细胞中脂滴水平,并同时提高卵母细胞核成熟效率。其中,新鲜对照组为不进行冷冻-解冻,且不进行nmn处理的卵母细胞。
58.表1 ivm液中添加nmn对牛卵母细胞核成熟率的影响
59.组别卵母细胞数核成熟率脂滴水平ivm 2μm nmn120101(84.17
±
7.76%)b42.15
±
3.52b(n=30)ivm 20μm nmn131122(93.13
±
8.48%)a34.59
±
2.63c(n=30)ivm 200μm nmn142122(85.92
±
7.47%)b21.73
±
3.27d(n=30)新鲜对照组10688(83.02
±
6.09%)b53.06
±
4.39a(n=30)
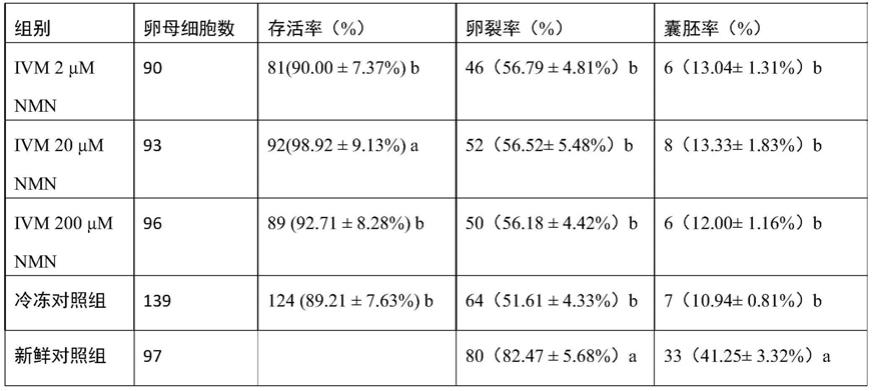
60.6.2、ivm液中nmn添加对牛卵母细胞玻璃化冷冻后发育能力的影响
61.如表2所示,本发明验证ivm液中添加不同浓度nmn对牛卵母细胞玻璃化冷冻后发育能力的影响。ivm 20μm nmn组卵母细胞冷冻存活率(98.92
±
9.13%)显著高于其他冷冻组(89.21
±
7.63%-92.71
±
8.28%)。结果表明,ivm 20μm nmn组卵母细胞玻璃化冷冻后进行ivf,卵裂率和囊胚率(65.22
±
5.48%,21.67
±
1.83%)与冷冻对照组(51.61
±
4.33%,
10.94
±
0.81%),但仍显著低于新鲜对照组(82.47
±
5.68%,41.25
±
3.32%)。其中,冷冻对照组为采用相同的冷冻-解冻方式处理但不进行nmn处理,新鲜对照组为不进行冷冻-解冻,且不进行nmn处理。后续表格中的冷冻对照组和新鲜对照组处理方式相同。
62.表2 ivm液中添加nmn对牛卵母细胞玻璃化冷冻后发育能力的影响
[0063][0064]
6.3、ivm、ivc液中nmn添加对牛卵母细胞玻璃化冷冻后发育能力的影响
[0065]
本发明同时在卵母细胞ivm液和ivf胚胎的ivc液中加入(2μm、20μm、200μm)的nmn,研究其对于冷冻牛卵母细胞ivf胚胎的发育能力的影响,结果如下:
[0066]
从表3结果中,在牛卵母细胞ivm液、ivc培养液中添加20μm nmn的卵裂率、囊胚率(59.15
±
3.02%,20.24
±
1.86%)显著高于冷冻对照组(49.59
±
3.98%,11.86
±
0.89%;p《0.05),但仍显著低于新鲜对照组(83.44
±
7.02%,40.44
±
3.38;p《0.05)。
[0067]
表3 nmn处理对玻璃化冷冻牛卵母细胞ivf胚胎发育能力的影响
[0068]
组别卵母细胞数卵裂率囊胚率ivm ivc 2μm nmn11359(52.21
±
3.24%)c7(12.50
±
1.10%)civm ivc 20μm nmn14284(59.15
±
3.02%)b17(20.24
±
1.86%)bivm ivc 200μm nmn15481(52.60
±
4.83%)c10(12.35
±
1.03%)c冷冻对照组11959(49.59
±
3.98%)c7(11.86
±
0.89%)c新鲜对照组163136(83.44
±
7.02%)a55(40.44
±
3.38%)a
[0069]
实施例2 igf2r甲基化调控对于玻璃化冷冻牛卵母细胞ivf胚胎发育能力影响的研究
[0070]
1、牛卵母细胞ivm
[0071]
从卵巢表面抽取直径2-8mm卵泡中的卵母细胞,选择带有完整致密的卵丘-卵母细胞复合体(cocs)放置于ivm中成熟22-24h。ivm结束后,cocs去除颗粒细胞后,挑选具有第一极体且胞质均匀的卵母细胞用于后续研究。
[0072]
2、卵母细胞ops玻璃化冷冻-解冻
[0073]
抗冻保护剂配制和玻璃化冷冻程序如下:
[0074]
i.抗冻保护剂配制:
[0075]
10%eg:eg、fbs、dpbs(-ca
2
、mg
2
)按1:2:7(v/v)比例配制。
[0076]
10%dmso:dmso、fbs、dpbs(-ca
2
、mg
2
)按1:2:7(v/v)比例配制。
[0077]
10%eg 10%dmso:eg、dmso、fbs、dpbs(-ca
2
、mg
2
)按1:1:2:6(v/v)比例配制。
[0078]
edfsf40:eg、dmso、fsf按2:2:6(v/v)比例配制。
[0079]
fsf:300g/l聚蔗糖添加0.5m蔗糖,经dpbs(-ca
2
、mg
2
)液溶解后,加入20%fbs后制成fsf溶液。
[0080]
ii.玻璃化冷冻程序
[0081]
冷冻程序:将室温调至25
±
1℃,使试验用具及试剂得到充分平衡。试验在38-39℃恒温台上操作。将卵母细胞用ops管移入预处理液(10%eg 10%dmso)中平衡30s后,然后移入冷冻液(edfsf40)中平衡25s,然后将卵母细胞吸入ops管中直接投入液氮冷冻保存。
[0082]
解冻程序:ops管由液氮中取出后,立即卵母细胞放入含有0.25m蔗糖解冻液的表面皿中平衡1min,然后移入0.15m蔗糖解冻液中平衡5min。卵母细胞再用ivm液洗涤2次,解冻后形态正常者(根据膜完整性和细胞光泽度)判定为存活,移入ivm液中待用。
[0083]
3、新鲜、冷冻牛卵母细胞ivf
[0084]
将液氮中的冻精在水浴锅(38℃)中解冻,移入超净台,将精液加入15ml离心管中,用洗精液离心(1500r/min,5min/次)、洗涤精子2次,弃上清,最后加入受精液调整精子密度(5
×
106个/ml),将20μl精液与80μl受精滴混合(精子密度变为1
×
106个/ml),成100μl受精滴,放入co2培养箱(5%co2、38.5℃、饱和湿度)平衡1.5h,将卵母细胞移至受精滴,20~30枚/滴,放入co2培养箱中受精6~8h。受精卵培养6~8h后,放入前期液中洗涤,去除周围精子,再放入前期液中培养,48h后,记录卵裂率,并将卵裂的胚胎换到后期液中培养,以后隔48h换一次液(半量),统计第7天的囊胚率。
[0085]
4、maoa、igf2r基因启动子甲基化水平精准调控
[0086]
调控质粒mrna制备:通过pcr将dcas-gcn片段从pplattet-grna2(addgene#82559)扩增下来,并通过胶回收纯化获得dcas-gcn片段。将dcas-gcn片段、质粒scfv-sfgfp-dnmt3a1(addgene#102278),质粒pcag-scfvgcn4sfgfptet1cd(addgene#82561)通过ecor i/not i双酶切链接在pcdna3.1( ),成为pcdna3.1-dcas-gcn-、scfv-tet1cd、pcdna3.1-scfv-tet1cd和pcdna3.1-scfv-dnmt3a1。体外转录dcas-gcn、scfv-tet1cd、scfv-dnmt3a mrna,采用trizol(invitrogen)试剂纯化mrna。
[0087]
sgrna制备:从ucsc查找出牛maoa、igf2r基因的启动子区序列,在网站设计grna靶点,在启动子2000bp内分别设计3个sgrna。体外合成牛igf2r、maoa基因的启动子区grna的模板,并进行体外转录。采用trizol试剂纯化,最后用nanodrop测定浓度,-80℃保存。
[0088]
针对maoa基因,采用显微操作仪将dcas9-tet1 mrna(20、40、60ng/μl)和sgrna(20、40、60ng/μl)注射到受精卵的胞质中,注射量大约在20pl(胞质体积增大10%)。注射完成后,受精卵放入cr1aa中继续培养。48h后,将卵裂的胚胎放到cr1aa 10%fbs中继续培养120h,间隔48h半量换液,获得的囊胚进行maoa甲基化模式分析,探明dcas9-tet1甲基化调减效果。
[0089]
针对igf2r基因,采用显微操作仪将dcas9-dnmt 3a mrna(20、40、60ng/μl)和sgrna(20、40、60ng/μl)注射到受精卵的胞质中,显微注射和胚胎培养流程如上所述,获得的囊胚进行igf2r甲基化模式分析,探明dcas9-dnmt3 a甲基化调增效果。
[0090]
5、甲基化模式分析:
[0091]
(1)亚硫酸盐氢盐转化
[0092]
利用ez dna mthylation-direct
tm
kit试剂盒说明书提取胚胎dna,随后进行dna的亚硫酸氢盐修饰及纯化。
[0093]
(2)引物设计及合成
[0094]
采用如下引物对进行检测:
[0095]
基因名称:igf2r,登录号:nm_174352.2,产物长度:500,产物包含cg位点:10,引物序列:
[0096]
f:5
’‑
tgaaagagattagttttgggat-3’,
[0097]
r:5
’‑
ccaaaaaccatattctaaataaaaa-3’。
[0098]
扩增产物的序列如seq id no.1所示。
[0099]
(3)重亚硫酸盐聚合酶链反应(bsp-pcr)
[0100]
采用25μl的pcr体系进行扩增,模板为1μl经过亚硫酸氢盐修饰过后的dna溶液,12.5μl 2
×
easytaq pcr supermix(tran),上下游引物各1μl,补足水至总反应体积25μl。反应条件为94℃预变性5min,然后于94℃30s;55℃退火30s;72℃延伸30s,此过程循环35次,最后于72℃延伸7min。
[0101]
(4)pcr产物胶回收和甲基化测序
[0102]
使用ezna gel extraction kit对产物进行回收,具体步骤参照说明书
[0103]
甲基化测序:连接和转化:将pcr产物与pmd-19t vector载体连接,将连接好的载体转化到大肠杆菌里,把大肠杆菌涂板培养,挑取10个菌落送测序。在超净台中用无菌枪头挑取单克隆菌落作为模板,以通用引物进行扩增,随后利用琼脂糖凝胶电泳进行检测,以确定阳性克隆后送往公司进行测序。将测序的序列在http://quma.cdb.riken.jp/上比对得到甲基化结果,检验dcas9-dnmt3a的dna甲基化水平调增/降效果。
[0104]
表4克隆载体连接体系
[0105][0106]
6、采用原核注射的方法分别向玻璃化冷冻卵母细胞进行ivf原核胚注射不同浓度的maoa sgrna、igf2r sgrna,研究maoa、igf2r甲基化调控对玻璃化冷冻卵母细胞ivf胚胎发育能力的影响,筛选出最佳调控组。
[0107]
6.1maoa sgrna设计位点
[0108]
针对maoa启动子区域,本发明设计了3个sgrna,信息如下表所示。
[0109]
表5 maoa基因sgrna引物序列
[0110][0111]
6.2 igf2r sgrna设计位点
[0112]
针对igf2r启动子区域,本发明设计了3个sgrna,信息如下表所示。
[0113]
表6 igf2r基因sgrna引物序列
[0114][0115][0116]
6.3得到结果如下:
[0117]
如表7所示maoa甲基化调控组的卵裂率、囊胚率(50.44
±
4.32%-53.39
±
5.06%,12.28
±
0.98%-14.29
±
1.27%),与冷冻对照组(51.33
±
5.08%,12.06
±
1.13%)无显著性差异(p》0.05),均显著低于新鲜对照组(85.13
±
7.32%,41.75
±
4.01%)(p《0.05)。其中,冷冻对照组采用相同的冷冻-解冻方式处理、但注射空质粒,新鲜对照组不进行冷冻-解冻、但注射空质粒。其他表格中的冷冻对照组和新鲜对照组处理方式相同。
[0118]
表7调控maoa对玻璃化冷冻牛卵母细胞ivf胚胎发育能力的影响
[0119]
[0120]
在igf2r调控实验中,如表8所示,40ng/μl igf2r sgrna2组的卵裂率、囊胚率(61.18
±
5.36%、22.58
±
2.12%)显著高于其他调控组(50.00
±
4.05%-54.62
±
4.62%,13.75
±
1.53%-14.75
±
0.98%)和冷冻对照组(50.93
±
4.53%,13.25
±
1.19%)无显著性差异(p》0.05),但显著低于新鲜组(84.8
±
7.32%,40.57
±
3.28%;p<0.05)。
[0121]
表8调控igf2r对玻璃化冷冻牛卵母细胞ivf胚胎发育能力的影响
[0122][0123]
同时如表9所示,40ng/μl igf2r sgrna2组igf2r启动子区域的甲基化水平(14.33
±
1.19%.vs.9.33
±
0.56%,p<0.05),与新鲜组无显著差异(15.67
±
1.23%,p》0.05)。
[0124]
表9 40ng/μl sgrna2对玻璃化冷冻牛卵母细胞ivf囊胚中igf2r甲基化的影响
[0125][0126]
从以上实验结果可以看出,maoa甲基化调控对玻璃化冷冻牛卵母细胞iv f胚胎发育能力没有显著影响,而igf2r甲基化调控可以使得玻璃化冷冻牛卵母细胞ivf中igf2r甲基化水平提高到和新鲜细胞相近的水平。
[0127]
实施例3 nmn和igf2r调控联合处理对玻璃化冷冻牛ivf胚胎发育能力的影响
[0128]
1、本实施例结合实施例1中的nmn处理和实施例2中的igf2r甲基化调控,研究其对于玻璃化冷冻牛ivf胚胎发育能力的影响,即采用实施例2中所述方法对玻璃化冷冻牛卵母细胞ivf胚胎进行igf2r甲基化调控(40ng/μl sgrna2),同时在卵母细胞ivm液、胚胎ivc培养液中添加不同浓度的nmn进行调控,如表10所示,ivm ivc 20μm nmn igf2r甲基化调控组的囊胚率、囊胚细胞数(51.05
±
4.38%,125.21
±
11.24%)显著高于冷冻对照组(14.08
±
1.17%,93.28
±
9.34;p《0.05)和新鲜对照组(42.46
±
3.18%,103.21
±
8.09;p《0.05)。该结果表明,20μm nmn和40ng/μl sgrna2联合处理组玻璃化冷冻牛卵母细胞ivf胚胎发育能力和质量都要高于新鲜对照组。
[0129]
表10 igf2r调控和nmn联合处理对玻璃化冷冻牛ivf胚胎发育的影响
[0130][0131]
2、本实施例进一步研究nmn和igf2r调控联合处理对玻璃化冷冻牛ivf胚胎质量的影响,采用荧光实时定量pcr进行检测,具体流程如下:
[0132]
采用bio-rad(美国)cfx96tm实时荧光定量pcr仪进行定量分析。采用oligo7软件进行引物设计,引物序列如下表所示。实验采用15μl反应体系,包括:上游引物、下游引物各0.5μl,cdna模板2μl,tb green premix ex taq ii(2i)7.5μl,rnase free dd h2o 4.5μl。反应程序:先95℃预变性30s;95℃5s,60℃30s,共计39个循环。每个样品重复三次,以牛gap dh为内参基因,采用2
‑△△
ct
法计算基因的相对表达量。
[0133]
表11实时荧光定量pcr
[0134][0135][0136]
结果也表示(图2),20μm nmn和igf2r甲基化调控联合处理组囊胚中igf2r基因表达量与新鲜对照组无显著性差异,妊娠信号基因(ifn-tau)、囊胚形成基因(ctnnbl1)、内细胞团标记基因(oct-4)mrna表达量显著高于冷冻对照组、新鲜对照组、其他联合处理组(p《0.05)。该结果表明,20μm nmn和40ng/μl sgrna2联合处理组的囊胚质量要高于新鲜对照组和冷冻对照组、其他联合处理组。
[0137]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。