1.本发明属于生物技术领域,具体涉及一种核酸构建物以及制备方法。
背景技术:
2.目前,精确的肽链n端表达呈现,一直都是小分子功能性肽链(小分子短链多肽)的应用的硬伤,特别是临床应用硬伤,而其中原因来自目前学术上无法确实的模拟细胞体内蛋白的切割修饰,所以小分子短链多肽的肽链切割仍然仅止于体外实验的预测阶段,即使成功预测,细胞内的各种不同的蛋白酶仍然会为肽链的二级结构添上许多变数,这使得异源蛋白的表达仍然只停留在胞内表达并萃取加工,这样的情况将会让人们对于各式蛋白的生产或使用造成局限和门坎。
技术实现要素:
3.本发明提供一种核酸构建物、载体、细胞、菌株、培养剩余物以及生物生产方法,以能适应小型多肽胞外分泌表达,并能实践不破坏肽链n端功能性且能精确切割,维持高度切割阳性率。
4.为此,本发明提供了以下的技术方案:
5.本发明提供一种核酸构建物,其包括以下式一所示的结构:式一:a-b-c,其中,a是编码启动元件的第一核苷酸序列;b是编码信号肽的第二核苷酸序列,b与c的n端连接;c是编码小分子短肽的第三核苷酸序列。
6.本发明提供的核酸构建体,还具有这样的特征:其中,第二核苷酸序列通过具有第四核苷酸序列的连接段d与第三核苷酸序列连接,第四核苷酸序列含有如seq id no:4所示或具有与seq id no:4至少50%、60%、70%、80%或90%相似性的核苷酸序列;或第四核苷酸序列含有如seq id no:33所示或具有与seq id no:33至少50%、60%、70%、80%或90%;或第四核苷酸序列含有如seq id no:34所示或具有与seq id no:34至少50%、60%、70%、80%或90%;或第四核苷酸序列含有如seq id no:35所示或具有与seq id no:34至少50%、60%、70%、80%或90%。
7.本发明提供的核酸构建体,还具有这样的特征:其中,第一核苷酸序列含有如seq id no:1所示或具有与seq id no:1至少50%、60%、70%、80%或90%相似性的核苷酸序列,和/或第二核苷酸序列含有如seq id no:2所示或具有与seq id no:2的至少50%、60%、70%、80%或90%似性的核苷酸序列。
8.本发明提供的核酸构建体,还具有这样的特征:其中,小分子短肽的大小范围为小于等于15kda、1kda至15kda,5kda-10kda以及2kda至7kda中的任意一个。
9.本发明提供的核酸构建体,还具有这样的特征:其中,小分子短肽为具有广域抗菌抗病毒活性的肽,优选地,具有抗革兰兰氏阴性菌,更优选地,革兰氏阳性菌的为大肠杆菌、绿脓杆菌、变形杆菌、痢疾杆菌、肺炎杆菌、布氏杆菌、流感(嗜血)杆菌、副流感(嗜血)杆菌、卡他(摩拉)菌、不动杆菌属、耶尔森菌属、嗜肺军团菌、百日咳杆菌、副百日咳杆菌、志贺菌
no:1至少50%相似性的核苷酸序列,能够提高小分子短链多肽的产量,并且能让小分子短链多肽在前期相比其他产物得到强势表达,后期表达又能劣于部分其他产物;
24.(4)通过编码信号肽的第二核苷酸序列含有如第二核苷酸序列含有如seq id no:2所示或具有与seq id no:2的至少50%相似性的核苷酸序列,能够提高对小分子短链多肽的阳性切割,从而提高小型多肽的胞外分泌表达。
25.由此,一方面,本发明提供的核酸构建物,能适应大小为15kda、1kda至15kda、5kda-10kda或2kda至7kda的小型多肽胞外分泌表达,并能实践不破坏肽链n端功能性且能精确地切割,并维持高度切割阳性率,使得通过细胞表达的小分子短链多肽的培养体系无须萃取或额外加工,就能对小分子短链多肽的高产量和高精度生产,降低各式蛋白的生产或使用造成局限和门坎,加大小分子短链多肽的临床应用;更进一步地,当采用具有该核酸构建体的酵母细胞进行小分子短链多肽的表达,可以避免大肠杆菌系统产生的毒素增加的去除工艺,并且基因表达和改造难度能满足现今对于各种不同的蛋白表达需求更加快速的市场;
26.另一方面,在本发明提供的上述的核酸构建体用于无细胞体外蛋白合成的生物制品的制备过程中,可以在培养菌株得到用于获得进行体外蛋白合成的细胞提取物的细胞的阶段,通过这种核酸构建体大量和精确表达的小分子短链抗菌肽,并能在前期强势表达,使得培养的菌株能快速获得优势生长,而后期不争夺细胞整体资源,并能使得细胞生长表达的整体资源被更好的利用,同时由于产生较高产量的小分子短链多肽,从而能将培养剩余物用于得到小分子短链产物。
附图说明
27.图1为实施例1中对大肠杆菌的抑菌测试结果;
28.图2为实施例1中对嗜酸性乳杆菌的抑菌测试结果。
具体实施方式
29.以下结合附图来说明本发明的具体实施方式。对于实施例中所用到的具体方法或材料,本领域技术人员可以在本发明技术思路的基础上,根据已有的技术进行常规的替换选择,而不仅限于本发明实施例的具体记载。
30.实施例中所使用的方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径获得。
31.本发明的核酸构建物指具有式一所示的结构,具体如下:
32.式一:a-b-c
33.其中,a是编码启动元件的第一核苷酸序列;
34.b是编码信号肽的第二核苷酸序列,b与c的n端连接;
35.c是编码小分子短链肽的第三核苷酸序列。
36.在本发明中,还提供了一种载体,包括式一所示的核酸构建体。
37.而本发明基因组中整合有上述的核酸构建物、或者含有上述载体的细胞,其中的细胞来自原核细胞或真核细胞。
38.在本发明中,体外外源蛋白合成体系是一种基于原核或真核细胞的转录-翻译偶
联的体系,是指在包含生物提取物和/或确定的试剂的反应混合物中多肽或其他大分子的合成。反应混合物将包含用于生产大分子的模板,例如dna,mrna等;用于合成的大分子的单体,例如氨基酸,核苷酸等;以及合成所需的辅因子,酶和其他试剂,例如核糖体,不带电荷的trna,带天然或非天然氨基酸的trna,聚合酶,转录因子等。
39.上述的原核细胞包括大肠杆菌细胞。
40.上述的真核细胞包括酵母细胞、兔网织红细胞、麦胚细胞、昆虫细胞、人源细胞等。真核体外生物合成体系具有能够合成具有复杂结构的rna或者蛋白质,以及蛋白质翻译后修饰等优点。
41.在本发明中,体外外源蛋白合成体系没有特别限制,一种优选的体外外源蛋白合成体系包括酵母体外生物合成体系,作为优选,为酵母体外蛋白合成体系,较佳地为克鲁维酵母表达系统,更佳地为乳酸克鲁维酵母表达系统。
42.本发明所指的“培养基”,指用来培养得到上述原核或真核细胞的物质,而“培养剩余物”,指通过培养基培养菌株得到相应细胞后得到的:基本去除沉淀物后的剩余物,这里的沉淀物包括上述的细胞。
43.小分子短肽又被称为纳米胶原,寡肽、微肽、短肽也指的是小分子肽。小分子肽一般由2~3个氨基酸结合而成,平均分子量较小,在300道尔顿左右。本发明表达的小分子短肽的大小范围为小于等于15kda、1kda至15kda,5kda-10kda以及2kda至7kda中的任意一个。
44.本发明表达的小分子短肽为具有广域抗菌抗病毒活性的肽,也即能抗菌和使病毒失去活性。
45.优选地,本发明表达的小分子肽具有抗革兰氏阴性菌,更优选地,革兰氏阳性菌的为大肠杆菌、绿脓杆菌、变形杆菌、痢疾杆菌、肺炎杆菌、布氏杆菌、流感(嗜血)杆菌、副流感(嗜血)杆菌、卡他(摩拉)菌、不动杆菌属、耶尔森菌属、嗜肺军团菌、百日咳杆菌、副百日咳杆菌、志贺菌属、巴斯德菌属、霍乱弧菌、副溶血性杆菌或类志贺吡邻单胞菌;再一优选地,具有抗革兰氏阳性菌,更优选地,革兰氏阳性菌为葡萄球菌(staphylococcus)、金黄色葡萄球菌、链球菌(streptococcus)、肺炎双球菌、炭疽杆菌、白喉杆菌、破伤风杆菌等;常见的革兰氏阴性菌有痢疾杆菌、伤寒杆菌、变形杆菌或霍乱弧菌;另一优选地,小分子短肽为具有抗病毒活性的肽。
46.本发明的生物制品,指一切采用生物相关为原料生产制备得到的产物或产品。
47.实施例1
48.本实施例,以对抗菌小分子短链肽进行表达为例进行说明。
49.本次实验所使用的用来表达得到小分子短链多肽的菌株(实验菌株)为kluyveromyces lactis(strain nrrl y-1140)的一种球型念珠菌的酵母,并为crabtree negative型的酵母。
50.本实验以编码序列为seq id no:4的广域抗菌肽(小分子短链多肽)作为报告基因,通过对革兰氏阴性菌株(测试菌株)和革兰氏阳性菌株(测试菌株)的抑菌肉汤测试来检测其被表达的强度。
51.本实验所使用的测试菌株:革兰氏阳性菌株为嗜酸乳杆菌(lactobacillus acidophilus),革兰氏阴性菌株为大肠杆菌(escherichia coli)。
52.(1)目的核酸构建体的构建:
53.利用crispr-cas9技术进行基因编辑。
54.通过基因序列比对,得出在k.lactis基因组中,插入位點位于d染色体,基因编号是klla0d11660g(基因名称:cta1),编码序列参考seq id no:5。对klla0d11660g的敲除,选取了三条grnas切割造成strand break。
55.三条grnas序列分别是grna1:agtattagtaggatggccca(seq id no:6)、grna2:cttgagagtttgtgaccaca(seq id no:7)和grna3:cgtgtggtcacaaactctca(seq id no:8)。
56.我们在pcas9pkmcas9质粒上分别构建了grna1,grna2,grna3和,所用引物如下(pf:5
’‑3’
,pr:3
’‑5’
):
57.grna1的引物对:
58.pf,seq id no:9:
59.cagtattagtaggatggcccagttttagagctagaaatagcaagttaaaataaggc;
60.pr,seq id no:10:
61.ctgggccatcctactaatactgattcgaactgccgagaaagtaacttttttttatttg。
62.grna2的引物对:
63.pf,seq id no:11:
64.ccttgagagtttgtgaccacagttttagagctagaaatagcaagttaaaataaggc;
65.pr,seq id no:12:
66.ctgtggtcacaaactctcaaggattcgaactgccgagaaagtaacttttttttatttg。
67.grna3的引物对:
68.pf,seq id no:13:
69.ccgtgtggtcacaaactctcagttttagagctagaaatagcaagttaaaataaggc;
70.pr,seq id no:14:
71.ctgagagtttgtgaccacacggattcgaactgccgagaaagtaacttttttttatttg。
72.同时在pkmd1质粒上构建了所用的供体dna(donor dna),供体dna包含左右两个同源臂hr1和hr2、promoter(启动元件a)、signal peptide(信号肽b)、linker(连接段d)、reporter gene(报告基因,小分子短链肽c)以及terminator。hr1和hr2从k.lactis基因组上扩增得到,pkmd1载体片段(供体dna)其他部分也通过引物扩增得到,具体引物序列如下:
73.promoter-pf,seq id no:15:
74.gcaaaatttttttctaacctgtctttttctttttttgcggtcacccccatgtg;
75.promoter-pr,seq id no:16:
76.gaaagacaacaagaacaagaaaatatagaaaatattcatttttgataagtatttaagcg。
77.signal peptide-pf,seq id no:17:
78.gcttaaatacttatcaaaaatgaatattttctatattttcttgttcttgttgtctttcg;
79.signal peptide-pr,seq id no:18:
80.ctcttctatgagtatgttccaaaccttgaacgaaagacaacaagaacaagaaaatatag。
81.linker-pf,seq id no:19:
82.cttgttcttgttgtctttcgttcaaggtttggaacatactcatagaagaggttctttgg;
83.linker-pr,seq id no:20:
84.cttcttgaaaaccttccactttcttttatccaaagaacctcttctatgagtatgttcc。
85.reporter gene-pf,seq id no:21:
86.ctcatagaagaggttctttggataaaagaaagtggaaggttttcaagaagattgaaaag;
87.reporter gene-pr,seq id no:22:
88.gattaaaatagaacaactacaatataaaaaaattaagacaaaatagccttagcttcgcc。
89.terminator-pf,seq id no:23:
90.ctattttgtcttaatttttttatattgtagttgttctattttaatcaaatgttagcgtg;
91.terminator-pr,seq id no:24:
92.gagagagagaaagaaagcacagctaattctctcagtatagcgaccagcattcacatac。
93.得到的各部位具体序列分别对应为:
94.promoter(启动元件,第一核苷酸序列):seq id no:1;
95.signal peptide(信号肽,第二核苷酸序列):seq id no:2;
96.reporter gene(报告基因,小分子短链肽c,第三核苷酸序列:):seq id no:3;
97.linker(连接段d,第四核苷酸序列):seq id no:4;
98.terminator:seq id no:25;
99.同源臂hr1:seq id no:26;
100.同源臂hr2:seq id no:27。
101.然后使用transgene公司的gibson master mix将各部位进行无缝拼接。测序正确的片段扩增得到线性的donor片段(目的核酸构建体1,seq id no:28),与grna1和grna2共同电转化到酵母感受态细胞,利用g418抗性筛选,然后利用p1(seq id no:29)和p2(seq id no:30)进行pcr鉴定,再用p3(seq id no:31)和p4(seq id no:32)扩增该位点的全长序列进行测序,测序正确的克隆再进行后续实验。
102.p1:cgagtcgtattctcccattattgtctgc
103.p2:cacaggtttaagggtacagggtacg
104.p3:gcggccatttccttttgatattggagattac
105.p4:cttcgcatctgggcagatgatg。
106.参照上述构建过程,另外构建得到目的核酸构建体2:与目的核酸构建体1区别在于:表达的报告基因为不具功能的肽链。
107.(2)肉汤抑菌测试
108.培养并得到培养剩余物:本测试选用对应处理过具有上述目的核酸构建体的菌株、使用ypd培养40小时后,当菌液od600到达13以上,将得到的菌液以4000g、30分钟离心取得上清,再通过0.22微米滤膜过滤去除沉淀物,得到无菌上清液,即为培养剩余物;
109.采用以下组,分别加入15毫升离心管分别对嗜酸乳杆菌(30℃)和大肠杆菌(37℃)进行24小时处理:
110.第一组,用84表示:使用本次实验菌株所加装目的核酸构建体1;
111.第二组,用86表示:使用本次实验菌株所加装目的核酸构建体2;
112.第三组,对照nc:本次不包含任何改造的野生型实验菌株;
113.第四组,ypd:单纯的ypd培养基。
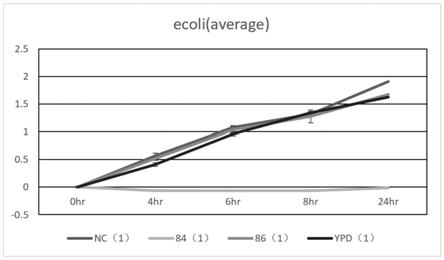
114.图1为实施例1中对大肠杆菌的抑菌测试结果;
115.图2为实施例1中对嗜酸性乳杆菌的抑菌测试结果。
116.结果如图1和图2所示。
117.从图1和图2中可以看出:
118.(1)抑菌24小时过程中,86组、对照nc组以及ypd组,随时间变化,革兰氏阴性和阳性均有大幅增加趋势,而84组对阴性和阳性革兰氏菌的抑菌随时间保持在一个稳定水平,效果分别达到100%和近80%;
119.(2)通过84和ypd结果对比,排除了培养基存在的抑菌影响;
120.(3)通过84和86组结果对比,排除了由于误表达造成的结果,从而也说明加装本发明的核酸构建体,也即目的核酸构建体1后,能将小分子短链肽准确表达出来;
121.(4)通过84和野生型nc对照的结果对比,排除了未改造存在的抑菌影响;
122.(5)本测试84组结果说明能前述的核酸构建体1能实现对小分子短链多肽n端的精确切割和位置的准确输送。
123.可见,本发明提供的具有式一的核酸构建体,对阴性和阳性革兰氏抑菌效果好,分别高达100%和80%,说明本发明提供的具有式一的核酸构建体能够对目的小分子短链多肽进行长时间大量且准确的表达和位置运送。
124.实施例2
125.本实施例,采用培养基通过k lactis菌株培养细胞,对培养不同时间段的菌株细胞进行rna含量检测并进行测序求得基因的转录强度,结果如表1,表1中,civtt2118为康码的一个世代菌株编号。
[0126][0127]
表1中,序号1是对应到本发明的启动元件a进行启动的转录。从表1中可以看出,在24小时内,具有如下的趋势:在12个小时内,相比其他基因的转录之下,可以看出序号1的基因被强势转录,说明该基因对应的启动子(也即本发明实施例中涉及的启动元件a)在初期能够对相应基因进行强势转录,而序号1在24小时对基因的转录强度相比12小时所示的转录强度,变化较少,这不同于如序号2所示的24小时转录强度相比12小时有大幅度地提高,并且序号1的转录强度在24小时相比序号2已经变成劣势转录。
[0128]
上述这样的表现趋势,会带来一些优势:
[0129]
(1)启动元件a能在最初(12小时内)对目的产物的转录,可以实现菌株的群体生长优势:例如当通过本发明的启动元件a表达分泌的小分子短链多肽是抗菌肽(目的产物),并且是能广谱抗菌但又对培养的菌株无害时,在培养初期,对这个抗菌肽的强势转录可以使得该抗菌肽被强势表达而充满整个培养基,从而能让培养的菌株快速生长而获得群体生长优势;
[0130]
(2)启动元件a在后期(12小时以后)对目的产物的转录相比其他的转录,不再是特别强势,在主要目标是上述目的产物外的生物制品的制备过程中,能既保证主要目标又能避免让细胞中的整体资源被浪费:例如当目的产物是上述的抗菌肽时,一方面,由于培养的菌株已经获得群体生长优势,已经不需要这种抗菌肽的分泌,如果继续保持优势生长,对上述整体资源就是一种浪费;另一方面,如果继续保持优势生长,将会与主要目标产物争夺上述整体资源,所以会影响主要目标产物的生产。
[0131]
(3)这样,对于以用于生产无细胞蛋白合成需要的表达系统细胞为主要目标时,采用启动元件a这样的启动子进行对上述抗菌肽的表达,既能保证好表达系统细胞的生产,又能获得高产量的抗菌肽,从而更有利于让培养剩余物被用于获得这种抗菌肽。
[0132]
本文前述提及的序列,汇总如表1所示。
[0133]
[0134]
[0135]
[0136]
[0137]
[0138]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。