1.本发明涉及水凝胶技术领域,具体涉及一种海藻多糖基水凝胶及其制备方法与应用。
背景技术:
2.随着社会经济的发展,人们对伤口敷料的要求越来越高。传统的伤口敷料如纱布和棉球等,具有成本低、吸收能力强等优点。但是,它们只能简单地隔离伤口,仍存在着附着性强、容易造成伤口脱水等缺点,会给患者带来不适和疼痛,并延迟伤口愈合。水凝胶是一种具有网络结构的聚合物材料,其内部有一个亲水基团。因此,它可以吸收大量的水,也能与水牢固结合。与传统敷料相比,水凝胶敷料具有亲水性,在保持伤口适度湿润的同时能够吸收伤口渗出液,易于移除,在更换敷料时不会对伤口造成二次伤害,因此有促进伤口愈合、减轻疼痛的效果,另外,选用生物活性物质制备水凝胶敷料还具有抑制细菌生长、改善伤口微环境等优点。
3.根据原料来源,水凝胶可以粗略分为天然水凝胶和化学合成水凝胶两大类。其中,天然水凝胶一般由可从自然界中直接获取的天然高分子材料如多糖、蛋白质或者其衍生物等进行合成加工得到,这些天然高分子聚合物具有良好的生物相容性和生理可降解性,应用在生物医学方面对人体及环境均没有危害。其缺点在于,天然材料制成的水凝胶通常具有机械性能较差等缺陷,使得其应用受到了限制。而人工化学合成水凝胶填补了这一空缺,化工材料的添加能够增强水凝胶的交联强度,使水凝胶的机械性能显著提高,同时能够增加水凝胶的应用特性。近年来,同时应用天然高分子材料和化学合成高分子材料共同进行水凝胶的制备已经逐渐成为研究热点,所得到的水凝胶同时具有二者的优点,在保持良好机械性能的同时,还具有良好的生物相容性和降解性。海藻多糖是一种天然生物大分子物质,同时存在于海藻细胞内与细胞间,具有价格较为低廉、原材料来源广泛、易于被工业提取、生物活性较好等诸多优点,且是海藻中最重要的生物活性成分之一。海藻多糖具有多种生理活性,包括抗病毒、抗氧化、抗炎、抗肿瘤、降血糖、降血脂、防辐射和排毒等等诸多良好活性,在生物医药方面具有广阔应用前景。
4.现有技术中,cn105251045a公开了一种含有岩藻多糖的生物医用水凝胶的制备方法,该水凝胶仅用岩藻多糖和含钙藻酸盐进行制备,具有良好的生物相容性和生物可降解性,但是该方法得到的水凝胶敷料是一种无定型水凝胶,机械性能较差,结构不稳定,极大地限制了水凝胶的工业生产和在生物医药方面的应用。cn113599579a公开了一种由聚丙烯酰胺和壳聚糖衍生物制备而成的双网络水凝胶,机械性能有了极大的提升。但是,该水凝胶敷料促进伤口附近的细胞增殖的效果尚不明确。
技术实现要素:
5.本发明的目的是为了解决天然多糖制备的水凝胶机械性能较差、现有水凝胶敷料促伤口愈合效果不显著等技术难题,提供一种具有显著促伤口愈合活性的海藻多糖基水凝
胶及其制备方法与应用。
6.本发明以海藻多糖、壳聚糖和聚乙烯醇为原料,用一种简单、温和的方法制备水凝胶敷料。该制备方法操作简单、经济环保,能够制备具有良好的生物相容性和优异的机械性能的水凝胶,显著提升其促进伤口附近的细胞增殖的效果。
7.本发明的目的通过以下技术方案实现。
8.一种海藻多糖基水凝胶的制备方法,包括以下步骤:
9.向海藻多糖溶液中加入壳聚糖溶液,然后在水浴条件下滴入聚乙烯醇溶液中,搅拌均匀后反复冻融,洗涤后得到海藻多糖基水凝胶。
10.优选的,所述海藻多糖为羊栖菜多糖、龙须菜多糖和海带多糖中的一种或多种。
11.优选的,所述海藻多糖中总糖含量为43-59wt%,糖醛酸含量为11-32wt%。
12.优选的,所述海藻多糖中,羊栖菜多糖的分子量为140kda-180kda,龙须菜多糖的分子量为700kda-900kda,海带多糖的分子量为340kda-510kda。
13.优选的,所述壳聚糖溶液是在壳聚糖中先加入水,再加入hcl调节壳聚糖溶液的ph值为2.5-3.0得到;其中,壳聚糖的浓度为0.5-1.5wt%。
14.优选的,所述聚乙烯醇溶液是在聚乙烯醇中先加入水,再70-90℃的条件下加热溶解得到;其中,聚乙烯醇的浓度为5-10wt%。
15.优选的,所述海藻多糖溶液是海藻多糖用蒸馏水配置成,所述海藻多糖是海藻原料经过水提或酸提或酶提等制备方法得到。
16.优选的,所述壳聚糖与海藻多糖的质量比为1:1-3:1;所述壳聚糖与聚乙烯醇的质量比为3:20-1:10。
17.优选的,所述水浴的温度为30-50℃;所述反复冻融是在-20℃以下冷冻,在常温下解冻,反复冻融4次以上。
18.由以上任一项所述的制备方法制得的一种海藻多糖基水凝胶。
19.以上所述的一种海藻多糖基水凝胶在制备伤口敷料中的应用。
20.本发明的海藻多糖基水凝胶是海藻多糖中游离的羟基和羧基与壳聚糖的酰胺基团通过相互作用紧密结合,并与聚乙烯醇形成物理交联。
21.与现有技术相比,本发明具有如下优点:
22.(1)本发明制备水凝胶的方法操作简单、条件温和,无需在高温高压条件下进行,节约了能源,且没有引入有机试剂或金属离子等可能产生细胞毒性的物质。此外,海藻多糖和壳聚糖具有良好的生物相容性,同时来源广泛,制备成本较低。
23.(2)本发明的海藻多糖基水凝胶具有优异的机械性能,拉伸强度为52kpa-66kpa,断裂增长率为210%-253%。该水凝胶还具有优异的吸水性能,可以吸收超过水凝胶质量11-17倍的水分,有利于维持伤口湿润,吸收伤口渗出液。
24.(3)本发明的海藻多糖基水凝胶对皮肤细胞无毒性,使用水凝胶处理24小时后皮肤细胞存活率高达95%以上。该水凝胶还可以促进伤口周围皮肤细胞的增殖,经过24小时的处理后愈合率最高可达95%以上。
附图说明
25.图1为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的微
观表面形貌图。
26.图2a为实施例1制得的水凝胶a的差示量热曲线图。
27.图2b为实施例2制得的水凝胶b的差示量热曲线图。
28.图2c为实施例3制得的水凝胶c的差示量热曲线图。
29.图3为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的溶胀度图。
30.图4a为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的拉伸曲线图。
31.图4b为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的拉伸强度图。与传统水凝胶相比,*p<0.05,**p<0.01,***p<0.001。其中,
32.图4c为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的断裂增长率图。与传统水凝胶相比,*p<0.05,**p<0.01,***p<0.001。其中,
33.图4d为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的杨氏模量图。与传统水凝胶相比,*p<0.05,**p<0.01,***p<0.001。其中,
34.图5为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶的细胞存活率图。与传统水凝胶相比,*p<0.05,**p<0.01,***p<0.001。
35.图6为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶、对比例2中制得的海藻多糖的伤口愈合图。
36.图7为实施例1-3中制得的海藻多糖基水凝胶及对比例1中制得的传统水凝胶、对比例2中制得的海藻多糖的伤口愈合率图。与传统水凝胶相比,*p<0.05,**p<0.01,***p<0.001。
具体实施方式
37.以下结合实例对本发明的具体实施作进一步说明,但本发明的实施和保护不限于此。需指出的是,以下若有未特别详细说明之过程,均是本领域技术人员可参照现有技术实现或理解的。所用试剂或仪器未注明生产厂商者,视为可以通过市售购买得到的常规产品。
38.以下的w/v为g/ml。
39.实施例1
40.一种羊栖菜多糖基水凝胶,其制备方法如下:
41.(1)羊栖菜粗多糖的提取:采用中草药粉碎机将洗净、烘干后的羊栖菜粉碎并过40目筛,随后超微粉碎10s,温度设置为0℃,得到羊栖菜超微粉,过80目筛;称取羊栖菜超微粉,先以料液比1:30(w/v)的比例加入去离子水,再往羊栖菜水溶液中加入最终溶液质量0.1%的纤维素酶,搅拌均匀,将其置于50℃水浴下反应4h。再加入去离子水,使最终料液比达到1:50(w/v),将其置于100℃水浴灭酶并继续提取4h。提取完成后将溶液以8000r/min的转速离心15min,收集上清液,真空旋蒸、浓缩至原体积的1/4,加入无水乙醇至浓度为80wt%置于4℃冰箱醇沉12h,8000r/min离心10min,收集沉淀,待乙醇挥发,加水复溶,得到纤维素酶助辅水提羊栖菜多糖。
42.(2)羊栖菜多糖基水凝胶的制备:分别配置0.5wt%壳聚糖溶液(先加入蒸馏水,再用hcl调节ph值为3左右才开始溶解)、0.5wt%羊栖菜多糖溶液、5wt%聚乙烯醇溶液(水浴
70℃溶解)。取10ml步骤(1)中制得的羊栖菜粗多糖溶液置于锥形瓶中,在搅拌下缓慢滴加等体积的壳聚糖溶液,滴加完毕后搅拌5min。将10ml聚乙烯醇溶液置于锥形瓶中,水浴50℃,搅拌下缓慢滴加羊栖菜粗多糖-壳聚糖溶液,搅拌均匀后将溶液倒入模具中,放入-20℃冰箱冷冻4小时,再置于常温下融化1.5小时,反复冻融4次。最后一次融化后,用蒸馏水清洗水凝胶3次,即得羊栖菜多糖基水凝胶(记为水凝胶a)。
43.实施例2
44.一种龙须菜多糖基水凝胶,其制备方法如下:
45.(1)龙须菜粗多糖的提取:将龙须菜藻粉与无水乙醇按1:4(w/v)的比例混合,振荡,于4℃静置过夜。次日过滤后,再用无水乙醇清洗残渣,重复2-3次,回收残渣,于烘箱中60℃烘干。
46.将处理后藻粉和柠檬酸溶液(ph 2.0)按1:50(w/v)的比例混合,在100℃条件下加热提取3h,过滤,用1m naoh溶液将滤液ph调至7.0,然后在60℃下减压浓缩至原溶液体积的1/5。向浓缩液中加入无水乙醇,使其终浓度为80wt%,振荡摇匀,于4℃冰箱内静置过夜。去除上清液,将沉淀物用无水乙醇清洗2-3遍后,加水复溶,用分子截留量为1000da透析袋透析3-4天,除去无机盐等其他小分子物质。收集透析袋中的溶液,真空浓缩、冷冻干燥后得到龙须菜多糖。
47.(2)龙须菜多糖基水凝胶的制备:分别配置1wt%壳聚糖溶液(先加入蒸馏水,再用hcl调节ph值为3左右才开始溶解)、0.5wt%龙须菜多糖溶液、7.5wt%聚乙烯醇溶液(水浴80℃溶解)。取10ml步骤(1)中制得的龙须菜粗多糖溶液置于锥形瓶中,在搅拌下缓慢滴加等体积的壳聚糖溶液,滴加完毕后搅拌5min。将10ml聚乙烯醇溶液置于锥形瓶中,水浴40℃,搅拌下缓慢滴加龙须菜粗多糖-壳聚糖溶液,搅拌均匀后将溶液倒入模具中,放入-20℃冰箱冷冻4小时,再置于常温下融化1.5小时,反复冻融4次。最后一次融化后,用蒸馏水清洗水凝胶3次,即得龙须菜多糖基水凝胶(记为水凝胶b)。
48.实施例3
49.一种海带多糖基水凝胶,其制备方法如下:
50.(1)海带粗多糖的提取:采用中草药粉碎机将洗净、烘干后的海带粉碎并过40目筛,随后超微粉碎10s,温度设置为0℃,得到海带超微粉,过80目筛;称取100g海带超微粉,加入400ml体积分数为95%乙醇,微沸状态下回流3次,共5h,收集沉淀,烘干,得到预处理的海带粉末。将所述海带粉末按照质量体积比1:50g/ml加入纯水中,得到海带水溶液;采用热水浸提法提取海带粗多糖,提取温度为100℃,提取时间为4h,提取液过滤、抽滤去渣,取滤液蒸发浓缩至原体积的1/10,缓慢加入95%乙醇至乙醇终体积浓度为75%,搅拌混匀,置于4℃下静置12h,离心弃上清液,所得沉淀于室温下放置,待乙醇挥发后,加入纯水复溶,真空冷冻干燥,得到海带粗多糖。
51.(2)海带多糖基水凝胶的制备:分别配置1.5wt%壳聚糖溶液(先加入蒸馏水,再用hcl调节ph值为3左右才开始溶解)、0.5wt%海带多糖溶液、10wt%聚乙烯醇溶液(水浴90℃溶解)。取10ml步骤(1)中制得的海带粗多糖溶液置于锥形瓶中,在搅拌下缓慢滴加等体积的壳聚糖溶液,滴加完毕后搅拌5min。将10ml聚乙烯醇溶液置于锥形瓶中,水浴30℃,搅拌下缓慢滴加海带粗多糖-壳聚糖溶液,搅拌均匀后将溶液倒入模具中,放入-20℃冰箱冷冻4小时,再置于常温下融化1.5小时,反复冻融4次。最后一次融化后,用蒸馏水清洗水凝胶3
次,即得海带多糖基水凝胶(记为水凝胶c)。
52.对比例1
53.一种传统水凝胶(即壳聚糖-聚乙烯醇水凝胶),其制备方法如下:
54.分别配置1wt%壳聚糖溶液(先加入蒸馏水,再用hcl调节ph值为3左右才开始溶解)、5wt%聚乙烯醇溶液(水浴70℃溶解)。取10ml蒸馏水置于锥形瓶中,在搅拌下缓慢滴加等体积的壳聚糖溶液,滴加完毕后搅拌5min,得到空白-壳聚糖溶液。将10ml聚乙烯醇溶液置于锥形瓶中,水浴50℃,搅拌下缓慢滴加上述的空白-壳聚糖溶液,搅拌均匀后将溶液倒入模具中,放入-20℃冰箱冷冻4小时,再置于常温下融化1.5小时,反复冻融4次。最后一次融化后,用蒸馏水清洗水凝胶3次,即得壳聚糖-聚乙烯醇水凝胶(标记为传统水凝胶)。
55.对比例2
56.一种海藻多糖(实施例1的羊栖菜多糖),其制备方法如下:
57.采用中草药粉碎机将洗净、烘干后的羊栖菜粉碎并过40目筛,随后超微粉碎10s,温度设置为0℃,得到羊栖菜超微粉,过80目筛;称取羊栖菜超微粉,先以料液比1:30(w/v)的比例加入去离子水,再往羊栖菜水溶液中加入最终溶液质量0.1%的纤维素酶,搅拌均匀,将其置于50℃水浴下反应4h。再加入去离子水,使最终料液比达到1:50(w/v),将其置于100℃水浴灭酶并继续提取4h。提取完成后将溶液以8000r/min的转速离心15min,收集上清液,真空旋蒸、浓缩至原体积的1/4,加入无水乙醇至浓度为80wt%置于4℃冰箱醇沉12h,8000r/min离心10min,收集沉淀,待乙醇挥发,加水复溶,得到纤维素酶助辅水提羊栖菜多糖。
58.效果验证
59.本发明选择实施例1中制得的羊栖菜多糖、实施例2中制得的龙须菜多糖、实施例3中制得的海带多糖进行多糖分子量和单糖组成的测定,并选取实施例1中制得的羊栖菜多糖基水凝胶、实施例2中制得的龙须菜多糖基水凝胶、实施例3中制得的海带多糖基水凝胶对比了对比例1中的传统水凝胶的微观结构、热稳定性、溶胀性能、机械性能,对比了对比例1中的传统水凝胶和对比例2中的海藻多糖的促伤口愈合活性(人永生化表皮细胞hacat细胞存活率、伤口愈合率)。具体实验步骤如下:
60.实验一、多糖中总糖含量的测定
61.总糖含量的测定采用苯酚-硫酸法,具体方法如下:
62.苯酚溶液的配置:按照1:7的比例稀释将质量分数为40%的苯酚稀释到5%。
63.标曲的配置:测定羊栖菜多糖和海带多糖的总糖含量时,以不同浓度的岩藻糖溶液作为标准液,测定龙须菜多糖的总糖含量时,以半乳糖溶液作为标准液。将标准液的浓度设置为:0,10,20,40,60,80,100μg/ml。
64.实验二、多糖中糖醛酸含量的测定
65.糖醛酸含量的测定采用硫酸-咔唑法,具体步骤如下:
66.咔唑溶液的配置:用无水乙醇配置质量分数为0.15%的咔唑溶液。
67.四硼酸钠-硫酸溶液的配置:称取0.478g四硼酸钠,用浓硫酸溶解并定容至100ml。
68.标曲的绘制:半乳糖醛酸烘干至恒重,分别稀释成0,0.01,0.02,0.03,0.05,0.06,0.07,0.1mg/ml。在试管中加入1ml标准液,冰水浴条件下加入5ml四硼酸钠-硫酸溶液,混匀后加热煮沸20min,取出后立即冷水浴至室温,加入0.2ml咔唑溶液,室温下反应2h后于
523nm处测量吸光值。
69.样品的测定:羊栖菜多糖和海带多糖配置成0.1mg/ml的浓度,龙须菜多糖配置成0.5mg/ml的浓度,按照上述步骤进行操作。
70.样品浓度为100μg/ml,分别在试管中加入0.5ml样品溶液、0.5ml苯酚溶液和2.5ml浓硫酸,震荡均匀后避光反应30分钟,在490nm处读取吸光值,与标准曲线进行对比。
71.实验三、多糖分子量的测定
72.采用高效凝胶渗透色谱法对多糖分子量进行测定。分别以分子量为4320、12600、126000、289000、496000da的葡聚糖作为标准品,绘制标准曲线。色谱条件:检测器:岛津rid-10a示差检测器;色谱柱:tskgel g-3000 pwxl(7.8
×
300mm)和tskgel g-6000 pwxl(7.8
×
300mm)及tskgel保护柱(6.0
×
40mm)串联使用;流动相:0.02m kh2po4缓冲液;柱温:40
±
1℃;流速:0.5ml/min;进样量:30μl。以洗脱体积(v)为横坐标,标品分子量的对数值(logmw)为纵坐标,采用仪器自带的软件进行拟合,得到标准曲线。多糖样品用0.02m的kh2po4溶液溶解,配置浓度为2mg/ml。过0.22μm的水相滤膜,进样分析。多糖的分子量根据标准曲线计算得出。
73.表1为实施例1-3制得的海藻多糖的总糖含量、糖醛酸含量及分子量结果。总糖含量的结果显示,海藻多糖中总糖含量为43-59wt%,糖醛酸含量11-32wt%。
74.表1三种海藻多糖的总糖含量、糖醛酸含量及平均分子量
[0075][0076]
实验四、微观结构测试
[0077]
将2-10mg冻干后的水凝胶样品切成1
×5×
5mm的小片,在载物台上粘贴导电胶,抽真空置于场发射扫描电镜下,在3kv加速电压下观察表面形貌。
[0078]
图1为实施例1-3制得的海藻多糖基水凝胶的微观结构。该测试结果揭示了水凝胶的成胶过程:海藻多糖与壳聚糖形成高交联密度的网络结构。聚乙烯醇经过反复的冻融过程,也形成了柔软、低交联、致密的网络结构。所制备的海藻多糖基水凝胶是一种具有能量耗散机制的双网水凝胶,有助于提高水凝胶的机械强度。
[0079]
实验五、热稳定性测试
[0080]
称取冻干后的水凝胶样品2mg左右,放入微量称量皿中压片,采用差示量热扫描仪进行测试。在氮气保护下进行实验,试验温度在50~350℃之间,升温速率5k/min。
[0081]
图2a、图2b、图2c为实施例1-3制得的海藻多糖基水凝胶的热稳定曲线。水凝胶a,水凝胶b,水凝胶c的玻璃化转变温度均出现在200℃以后,表面海藻多糖基水凝胶具有良好的热稳定性,能够广泛运用于工业生产。
[0082]
实验六、溶胀性能测试
[0083]
称取20mg的干燥水凝胶,在室温下浸泡于40-50ml去离子水中,每间隔半个小时,用镊子将水凝胶夹出,用滤纸吸去表面多余的水分,记录水凝胶的重量。每个样品做三个平行。根据公式进行计算。
[0084]
水凝胶的吸水能力是维持伤口湿润环境的重要因素之一。图3为实施例1-3制得的海藻多糖基水凝胶和对比例1制得的传统水凝胶的溶胀度。实施例1-3的平衡溶胀度分别达到水凝胶初始重量的12.21、11.16和16.53倍,而对比例1的平衡溶胀度仅为初始重量的9.75倍。说明海藻多糖基水凝胶比普通的水凝胶具有更强的吸水能力,更有利于在伤口敷料中的应用。
[0085]
实验七、机械性能测试
[0086]
采用万能材料试验机进行水凝胶拉伸性能测定。将水凝胶切成10
×
40mm长条状,厚度约为2-4mm。设置拉伸速率为50mm/min,夹持截距40mm,进行拉伸实验,每个样品做三个平行。以应力(stress/mpa)为纵坐标,应变(strain/%)为横坐标,绘制应力-应变曲线。水凝胶的机械性能可用拉伸强度、断裂增长率和杨氏模量进行表征。
[0087]
拉伸强度:拉伸强度表示为水凝胶每初始横截面积的最大断裂力。根据公式进行计算。其中,fmax表示刚好使水凝胶断裂的最大的应力,a表示样品水凝胶的初始横截面积。
[0088]
断裂增长率:断裂增长率表示为断裂时水凝胶长度与原始长度的百分比。根据公式进行计算。其中,l表示水凝胶的最大长度,l0表示水凝胶的初始长度。
[0089]
杨氏模量:杨氏模量,表示弹性模量,是表征在弹性限度内物质材料抗拉或抗压的物理量。对于线弹性材料有公式σ=eε成立。式中,σ为正应力,ε为正应变,e为弹性模量,是与材料本身有关的常数。根据应力-应变曲线,选取拉伸应变分别为100%和200%的数据点进行计算,得出杨氏模量:进行计算,得出杨氏模量:
[0090]
如图4a、图4b、图4c、图4d所示,实施例1-3中的海藻多糖基水凝胶的拉伸强度和杨氏模量比对比例1中的传统水凝胶更高,说明海藻多糖基水凝胶形成的具有能量耗散机制的双网络结构会使水凝胶结构更稳定,机械性能更强。在双网络水凝胶中,刚性的海藻多糖-壳聚糖网络优先断裂,断裂导致能量损失,从而提高了水凝胶的力学性能,而第二层柔性的聚乙烯醇网络则为水凝胶提供弹性。
[0091]
实验八、细胞存活率测试
[0092]
用胰酶消化hacat细胞并计数、稀释成浓度为105个/ml的细胞悬液,每孔加入100μl细胞悬液,将96孔板置于培养箱(37℃,co2浓度为5%)中培养24小时待细胞贴壁后,迅速倒出孔板中原有的培养基,并用pbs溶液清洗一遍,加入用培养基溶解的样品溶液继续培养24小时。24小时后,迅速倒出样品溶液,用pbs溶液清洗残留的培养基,每孔加入50μl稀释好的mtt溶液,该操作需避光进行。将96孔板置于培养箱中培养4小时后,吸出mtt溶液,加入150μl二甲基亚砜溶液终止。避光震荡15分钟后,于540nm下测量吸光值并计算细胞存活率。
[0093]
样品的处理:水凝胶样品称取2mg左右,先用pbs溶液溶胀30min,随后吸出pbs溶液,改用75%酒精溶液浸泡杀菌30min,并进行紫外照射杀菌。吸出75%酒精溶液,用pbs浸
泡30min后吸出并加入新的pbs,如此反复清洗5次。加样时用镊子将水凝胶夹入96孔板中,与细胞直接接触。
[0094]
如图5所示,三种海藻多糖基水凝胶直接接触hacat细胞24小时后,细胞存活率分别达到95.69%、97.26%和99.14%,接近100%,表现为无细胞毒性,应用在接触性伤口敷料中安全性较高。
[0095]
实验九、细胞划痕实验
[0096]
用胰酶消化hacat细胞并计数、稀释成浓度为105个/ml的细胞悬液,在十二孔板中每孔加入1ml细胞悬液,置于培养箱中培养至细胞生长到80%-90%后,将培养基吸出,用200μl枪头在孔中心划十字划痕并选取5-6个视野拍照。随后加入样品培养,分别在样品处理6小时、24小时后选取5-6个视野拍照。
[0097]
样品的处理:水凝胶样品称取2mg左右,先用pbs溶液溶胀30min,随后吸出pbs溶液,改用75%酒精溶液浸泡杀菌30min,并进行紫外照射杀菌。吸出75%酒精溶液,用pbs浸泡30min后吸出并加入新的pbs,如此反复清洗5次。加样时用镊子将水凝胶夹入96孔板中,与细胞直接接触。
[0098]
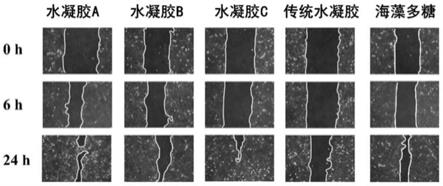
如图6、图7所示,实施例1-3中的海藻多糖基水凝胶的伤口愈合率对比对比例1中的传统水凝胶提升了1.3-2.6倍,对比对比例2中的海藻多糖提升了14%-66%,均具有显著的促伤口愈合活性。尤其是实施例3中的海带多糖基水凝胶,处理24小时后的伤口愈合率高达95%以上。
[0099]
以上实施例仅为本发明较优的实施方式,仅用于解释本发明,而非限制本发明,本领域技术人员在未脱离本发明精神实质下所作的改变、替换、修饰等均应属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。