一种解脲脲原体pcr检测试剂盒
技术领域
1.本发明涉及临床体外检测技术领域,具体涉及一种解脲脲原体pcr检测试剂盒。
背景技术:
2.在我国,脲原体导致的泌尿生殖道感染病例占据了40%,其中解脲脲原体生物群占比20%。已有研究总结报道,我国泌尿生殖道脲原体感染的患者在地区、性别以及年龄等存在显著差异,解脲脲原体血清型4、血清型8和血清型10是目前国内医疗机构解脲脲原体dna检出率前三的血清型别。
3.脲原体种属因存在微小脲原体一群和解脲脲原体二群两大生物群以及14种标准血清型菌株的特点,且每种血清型靶基因的同源序列较短,市面仍未有全面的基因分型试剂盒,医疗机构经常出现试剂盒结果误诊误判,存在准确性不高的问题,因此脲原体导致的泌尿生殖道感染如何快速准确检测已成为公共卫生健康领域的重大问题。
技术实现要素:
4.本发明提供了一种解脲脲原体pcr检测试剂盒。本发明针对解脲脲原体常见的uu4,uu8,uu10血清型设计引体与探针,提高检测的准确性,同时添加apta taq聚合酶,降低反应的启动温度,增加反应的效率;具有准确快速等优点。
5.为实现上述目的,本发明是通过以下技术方案实现的:
6.本发明提供一种解脲脲原体pcr检测试剂盒,由pcr反应液、酶混合液、内标、阴性对照和阳性对照组成;所述pcr反应液的组成成分为:
[0007][0008][0009]
所述探针序列:
[0010]5’‑
ttggtgtaggttggttgtgg-3’;
[0011]
所述正向引物序列:
[0012]5’‑
tgttcaaacagtgcgcgaag-3’;
[0013]
所述反向引物序列:
[0014]5’‑
agtttcagggcgtgaagtgg-3’;
[0015]
所述酶混合液由浓度为1-5u/μl的apta taq聚合酶与浓度为0.1-2u/μl的ung酶组成。
[0016]
进一步的,所述内标选择人基因组β-act i n设计,是不含解脲脲原体dna靶序列的重组质粒,浓度为0.01-0.2μmo l/l。
[0017]
进一步的,所述阴性对照采用解脲脲原体临床阴性样本;所述阳性对照采用解脲脲原体临床阳性样本。
[0018]
本发明的使用方法:
[0019]
①
样本处理:向样本收集管中加入1ml无菌生理盐水,充分震荡混匀,然后把全部液体(样本洗脱液)倒入1.5ml灭菌离心管中(棉拭子靠离心管壁挤干后丢弃),作为待测样本备用。
[0020]
②
试剂准备:根据待测样本、阴性对照、阳性对照的数量,按照体积(pcr反应液38μl/人份 酶混合液2μl/人份 内标1μl/人份)取相应量的pcr反应液、酶混合液以及内标,充分混匀成pcr混合液,瞬时离心后备用。
[0021]
③
加样(阴性对照、阳性对照与待测样本同步处理):每个pcr反应管中加入待测样本、阴性对照、阳性对照各5μl,再分别加入等体积的核酸释放试剂(如样本释放剂)进行样本核酸的裂解释放,10分钟的充分释放作用后,每管加入pcr混合液40μl,混匀成预混液,并进行荧光定量检测,程序如下。
[0022]
荧光定量pcr反应程序:
[0023][0024]
与现有技术相比,本发明具有以下有益效果:
[0025]
1)本发明优选了解脲脲原体常见的uu4,uu8,uu10血清型,并对此设计正向引物与反向引物与探针,特异性更好,结果更加准确。
[0026]
2)采用的apta taq聚合酶,降低了反应的启动温度,缩短了扩增的时间,加快了反应效率。
附图说明
[0027]
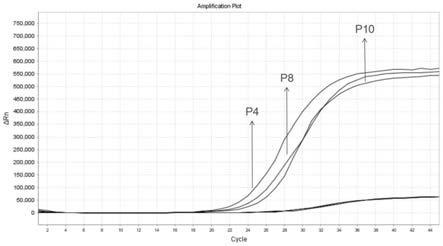
图1本发明实施例1检测三个国家标准阳性参考品的扩增曲线。
[0028]
图2本发明实施例2检测三个国家标准阳性参考品的扩增曲线。
具体实施方式
[0029]
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面将结合具体实施例和附图进行详细描述。
[0030]
实施例1:
[0031]
本实施例的试剂盒主要体现在apta taq聚合酶,且在反应程序的时间优化,具体如下:
[0032][0033][0034]
选取的探针、正向引物与反向引物的序列为:
[0035]
探针序列:
[0036]5’‑
ttggtgtaggttggttgtgg-3’;
[0037]
正向引物序列:
[0038]5’‑
tgttcaaacagtgcgcgaag-3’;
[0039]
反向引物序列:
[0040]5’‑
agtttcagggcgtgaagtgg-3’;
[0041]
本发明的使用方法:
[0042]
①
样本处理:向样本收集管中加入1ml无菌生理盐水,充分震荡混匀,然后把全部液体(样本洗脱液)倒入1.5ml灭菌离心管中(棉拭子靠离心管壁挤干后丢弃),作为待测样本备用。
[0043]
②
试剂准备:根据待测样本、阴性对照、阳性对照的数量,按照体积(pcr反应液38μl/人份 酶混合液2μl/人份 内标1μl/人份)取相应量的pcr反应液、酶混合液以及内标,充分混匀成pcr混合液,瞬时离心后备用。
[0044]
③
加样(阴性对照、阳性对照与待测样本同步处理):每个pcr反应管中加入待测样本、阴性对照、阳性对照各5μl,再分别加入等体积的核酸释放试剂(如样本释放剂)进行样本核酸的裂解释放,10分钟的充分释放作用后,每管加入pcr混合液40μl,混匀成预混液,并进行荧光定量检测,程序如下。
[0045]
荧光定量pcr反应程序:
[0046][0047]
待测样本分别使用解脲脲原体国家阳性参考品p4(uu4)、p8(uu8)、p10(uu10)三种独立的血清型,观察设计的正向引物与反向引物扩增曲线及ct值。实验中使用到的参考品采自人脲原体核酸检测国家参考品(批号360009-201301)。
[0048]
实施例2:
[0049]
本实施例的试剂盒主要体现在apta taq聚合酶,且在反应程序的时间优化,具体如下:
[0050][0051]
选取的探针、正向引物与反向引物的序列为:
[0052]
探针序列:
[0053]5’‑
ttggtgtaggttggttgtgg-3’;
[0054]
正向引物序列:
[0055]5’‑
tgttcaaacagtgcgcgaag-3’;
[0056]
反向引物序列:
[0057]5’‑
agtttcagggcgtgaagtgg-3’;
[0058]
具体检测方法同实施例1,观察apta taq聚合酶在优化确定后的反应程序中对三种血清型国家阳性参考品的扩增效果。
[0059]
对比例1:
[0060]
选取市场常见的两款其他厂家试剂盒同时验证弱阳性样本,与按照实施例1和实施例2的成分配置的试剂盒比对检出率来评价试剂盒的准确性。
[0061]
将待测的解脲脲原体国家阳性参考品p4(1
×
106ccu/ml)稀释至1
×
102ccu/ml的
低浓度样本,具体检测方法同实施例1,试剂盒分别检测上述稀释的低浓度样本各30次,通过分析30次检测结果观察试剂盒弱阳性样本的检出率。
[0062]
总结:
[0063]
实施例1和实施例2的结果如表1和表2所示,实施例1中解脲脲原体国家阳性参考品p4、p8、p10的核酸扩增ct值分别为22.56、23.19、22.30,三种血清型ct值均≤38.5,且根据图1可见,扩增曲线成明显s型,报告为解脲脲原体dna为阳性;实施例2中解脲脲原体国家阳性参考品p4、p8、p10的核酸扩增ct值分别为23.42、23.06、23.17,三种血清型ct值均≤38.5,且根据图2可见,扩增曲线成明显s型,报告为解脲脲原体dna为阳性;说明apta taq聚合酶在活化温度降低、缩短了活化用时与反应的循环数的情况下能达到现有技术的准确度标准,表明本发明在保证达到现有技术的准确度效果的情况下,成功降低了活化温度,缩短了反应时间。
[0064]
表1实施例1检测阳性国家参考品对应ct值
[0065][0066]
表2实施例2检测阳性国家参考品对应ct值
[0067][0068]
对比例1结果如表3所示,对比例1中实施例1的试剂盒与实施例2的试剂盒在低浓度样本的检测中均检出,且ct均值在理论浓度对应的ct值区间(36~37),而对比厂家1与对比厂家2均有未检出的样本例(ct值>38.5),ct均值较理论值偏大,本发明可准确检出解脲脲原体(uu4\uu8\uu10)弱阳性样本,表明本发明的正向引物与反向引物特异性高,可以在低浓度下更加精准识别目标,达到更好的准确性的检测效果。
[0069]
表3弱阳性样本检测结果
[0070][0071]
通过验证,结合图1与图2可以发现本发明针对三种解脲脲原体血清型(uu4、uu8、uu10)设计的正向引物与反向引物特异性高,结果准确;同时apta taq聚合酶的使用将传统的90分钟的解脲脲原体核酸扩增周期缩短了20分钟,且核酸检测结果一致,能够达到市场对产品的应用要求。
[0072]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。