一种光诱导nhpi酯脱羧偶联合成烷基化富电子杂环芳烃方法
技术领域
1.本发明属于有机化学合成技术领域,具体涉及一种光诱导nhpi酯脱羧偶联合成烷基化富电子杂环芳烃方法。
背景技术:
2.芳杂环化合物具有多种生物学特性,是一类功能强大的骨架化合物,普遍存在于天然产物、药物分子中,被广泛应用在医药、材料等领域。对芳杂环化合物的结构进行修饰在药物发现和药物结构改良中具有重要的意义。
3.羧酸是自然界中含量丰富的一类化学物质,价格便宜,性质稳定。近年来,脱羧偶联反应备受关注。羧酸在过渡金属催化下,脱掉二氧化碳后可产生碳负离子中间体。羧酸也能通过单电子氧化,脱掉二氧化碳,产生自由基中间体。其中,n-羟基邻苯二甲酰亚胺(nhpi)酯作为羧酸的衍生物,具有氧化还原活性,通过单电子转移可以得到自由基阴离子中间体,脱除二氧化碳后得到一个碳自由基和氮负离子中心,成为脱羧偶联反应中的一类重要底物。
4.当前,已有研究通过过渡金属催化的nhpi酯脱羧偶联反应构建c(sp3)-c(sp3)/c(sp2)/c(sp)/x,该研究首次利用过渡金属,完成对氧化还原活性酯的活化。在该反应体系中,二级羧酸和n-羟基邻苯二甲酰亚胺反应生成的氧化还原活性酯作为烷基化试剂,在ni催化下和芳基锌试剂实现了烷基-芳基偶联。
5.相比于传统的过渡金属催化的脱羧偶联反应,光催化脱羧偶联反应的条件更温和,不需要高温条件,且反应高效,官能团兼容性更好。可见光是一种绿色无污染的能源,将其引入到脱羧偶联的化学反应中,使光能转化为化学能,为脱羧偶联反应的发展提供了新的思路。
6.然而,目前为止,尚未有利用nhpi酯脱羧与富电子杂环芳烃反应生成烷基取代富电子杂环芳烃的报道。
技术实现要素:
7.为了克服上述现有技术的不足,本发明的目的是提供一种光诱导nhpi酯脱羧偶联合成烷基化富电子杂环芳烃方法。填补了通过nhpi酯脱羧与富电子杂环芳烃反应制备烷基化的富电子杂环芳烃的技术空白,且反应条件温和,过程简单,生成的烷基取代的富电子杂环芳烃在药物中应用广泛。
8.为实现上述目的,本发明所采用的技术方案为:
9.一种光诱导nhpi酯脱羧偶联合成烷基化富电子杂环芳烃方法,即将式1所示的nhpi酯、式2所示的富电子杂环芳烃和光催化剂溶解在反应溶剂中,在可见光下进行烷基化反应,得到式3所示的烷基化的富电子杂环芳烃:
[0010][0011]
式中,x为o或s;
[0012]
r1为c1~c
20
的烷基,或五元、六元或多元的环烷基;所述烷基,五元、六元或多元的环烷基上允许带有取代基;
[0013]r2-r6独自为h或卤素或c1~c6的烷基或五元、六元的杂环芳基或苯基或杂环芳基或苯基中两个以上的芳香环稠合形成的稠环芳基;所述烷基、杂环芳基、苯基、稠环芳基上允许带有取代基。
[0014]
优选地,所述烷基、杂环芳基、苯基、稠环芳基上允许带有的取代基为c1~c6的烷基或c1~c6的烷氧基或苯基或苄氧基或硝基或卤素或氰基或酯基或三氟甲基或c1~c4的烷基硫基或磺酰基。
[0015]
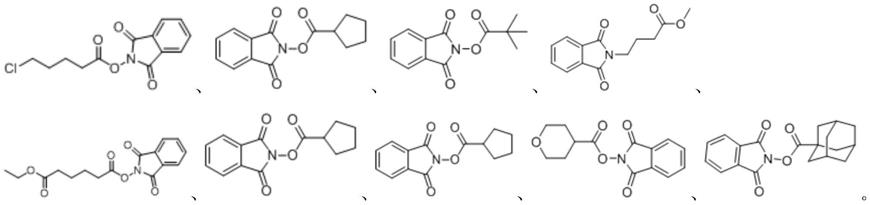
优选地,所述nhpi酯选自下列结构式中的任意一种:
[0016][0017]
优选地,所述富电子杂环芳烃选自下列结构式中的任意一种:
[0018][0019]
优选地,式1所示的nhpi酯、式2所示的富电子杂环芳烃的摩尔比为1:1-20,所述富电子杂环芳烃在反应溶剂中的摩尔浓度为0.5-2mol/l,所述光催化剂的使用量为nhpi酯和富电子杂环芳烃总摩尔量的0.5-3mol%。
[0020]
进一步地,式1所示的nhpi酯、式2所示的富电子杂环芳烃的摩尔比为1:10-15。
[0021]
优选地,所述可见光包括白光、蓝光、绿光。具体地,所述可见光为白光。
[0022]
优选地,反应的温度为0-50℃,时间为2-24小时。进一步地,反应的温度为室温(25℃),时间为12-24小时。
[0023]
优选地,所述光催化剂包括ir(ppy)3和eosin y na2。具体地,所述光催化剂为ir(ppy)3。
[0024]
优选地,所述反应溶剂包括二甲基亚砜、乙腈、n,n-二甲基甲酰胺和四氢呋喃。具体地,所述反应溶剂为二甲基亚砜。
[0025]
优选地,所述可见光的光源功率为12w-24w;所述光源包括白色led灯、蓝色led灯、绿色led灯。具体地,所述可见光的光源功率为24w。
[0026]
需要说明的是,在烷基化反应过程中,还可以添加助剂,所述助剂包括但不限于三氟乙酸、醋酸钠、磷酸钾。但添加助剂会在一定程度上阻碍反应的进行,导致产率降低。同时,还可以添加有机碱,所述有机碱包括但不限于dipea(n,n-二异丙基乙胺),dabco(三亚乙基二胺)。同样地,添加有机碱会在一定程度上阻碍反应的进行,导致产率降低。
[0027]
与现有技术相比,本发明的有益效果是:
[0028]
本发明公开了一种光诱导nhpi酯脱羧偶联合成烷基化富电子杂环芳烃方法,将nhpi酯和富电子杂环芳烃化合物在光催化剂和可见光照射下发生脱羧偶联,得到烷基化的富电子杂环芳烃。本发明首次实现了可见光诱导nhpi酯脱羧偶联构建烷基化的富电子芳烃,填补了现有技术的空白;本发明方法工艺条件温和,流程短,步骤简单,底物适用性广,满足工业生产要求;本发明由nhpi酯脱羧偶联富电子杂环芳烃生产相应的烷基化富电子杂环芳烃,产物收率高,经研究发现,产物的收率可高达72%,且生成的烷基取代的富电子杂环芳烃在药物中应用广泛,可见,本发明具有重要的应用价值。
附图说明
[0029]
图1为产物2-(4-氯丁基)苯并呋喃的1hnmr谱图;
[0030]
图2为产物2-(4-氯丁基)苯并呋喃的
13
cnmr谱图;
[0031]
图3为产物2-环戊基苯并呋喃的1hnmr谱图;
[0032]
图4为产物2-环戊基苯并呋喃的
13
cnmr谱图;
[0033]
图5为产物2-(叔丁基)苯并呋喃的1hnmr谱图;
[0034]
图6为产物2-(叔丁基)苯并呋喃的
13
cnmr谱图。
具体实施方式
[0035]
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
[0036]
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
[0037]
实施例1 2-(4-氯丁基)苯并呋喃的合成与分离纯化
[0038]
在4ml透明玻璃反应瓶中,加入4-cl正丁基nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测,待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得淡黄色液体,即终产物:2-(4-氯丁基)苯并呋喃,产率为58%。
[0039]
产物的图谱信息为(图1和图2);
[0040]1h nmr(400mhz,cdcl3)δ7.59
–
7.48(m,1h),7.47
–
7.41(m,1h),7.30
–
7.17(m,2h),3.59(t,j=6.2hz,2h),2.83(t,j=6.8hz,2h),2.18
–
1.60(m,4h).
13
c nmr(100mhz,cdcl3)δ158.6,154.7,128.9,123.3,122.5,120.3,110.8,102.3,44.6,31.9,27.7,25.0。
[0041]
实施例2 2-环戊基苯并呋喃的合成与分离纯化
[0042]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测,待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得淡黄色液体,即终产物:2-环戊基苯并呋喃,产率为54%。
[0043]
产物的图谱信息为(图3和图4);
[0044]1h nmr(400mhz,cdcl3)δ7.49
–
7.45(m,1h),7.43
–
7.38(m,1h),7.23
–
7.14(m,2h),6.37(d,j=0.9hz,1h),3.27
–
3.17(m,1h),2.14-2.03(m,2h),1.86
–
1.75(m,4h),1.74
–
1.63(m,2h).
13
c nmr(100mhz,cdcl3)δ163.4,154.8,129.0,123.1,122.4,120.3,110.8,100.4,39.1,31.8,25.5。
[0045]
实施例3 2-(叔丁基)苯并呋喃的合成与分离纯化
[0046]
在4ml透明玻璃反应瓶中,加入叔丁基nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测,待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得无色透明液体,即最终产物:2-(叔丁基)苯并呋喃,产率为51%。
[0047]
产物的图谱信息为(图5和图6);
[0048]1h nmr(400mhz,cdcl3)δ7.51
–
7.48(m,1h),7.42(d,j=8.1hz,1h),7.23
–
7.13(m,2h),6.35(s,1h),1.38(s,9h).
13
c nmr(100mhz,cdcl3)δ167.5,154.7,129.0,123.2,122.4,120.4,110.9,99.0,33.1,29.0。
[0049]
实施例4 4-(5-溴苯并呋喃-2-基)丁酸甲酯的合成与分离纯化
[0050]
在4ml透明玻璃反应瓶中,加入丁酸甲酯nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),5-溴苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测,待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃
取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得黄色液体,即终产物:4-(5-溴苯并呋喃-2-基)丁酸甲酯,产率为36%。
[0051]
产物的图谱信息为;
[0052]1h nmr(400mhz,cdcl3)δ7.60(d,j=1.7hz,1h),7.32
–
7.25(m,3h),6.36(d,j=0.7hz,1h),3.67(s,4h),2.82(t,j=7.4hz,2h),2.41(t,j=7.4hz,3h),2.08(p,j=7.4hz,2h).
13
c nmr(100mhz,cdcl3)δ173.6,159.8,153.6,130.9,126.3,123.1,115.7,112.3,102.2,51.7,33.2,27.8,22.9。
[0053]
实施例5 5-(3-甲基苯并呋喃-2-基)戊酸乙酯的合成与分离纯化
[0054]
在4ml透明玻璃反应瓶中,加入戊酸乙酯nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),3-甲基苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测,待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得无色透明液体,即终产物:5-(3-甲基苯并呋喃-2-基)戊酸乙酯为,产率为52%。
[0055]
产物的图谱信息为;
[0056]1h nmr(400mhz,cdcl3)δ7.44
–
7.40(m,1h),7.39
–
7.35(m,1h),7.24
–
7.16(m,2h),4.12(q,j=7.1hz,2h),2.75(t,j=7.0hz,2h),2.33(t,j=7.2hz,2h),1.80
–
1.66(m,4h),1.24(t,j=7.1hz,3h).
13
c nmr(100mhz,cdcl3)δ173.5,153.8,153.7,130.3,123.1,121.9,118.6,110.5,109.8,60.2,34.0,27.6,25.9,24.5,14.2,7.9。
[0057]
实施例6 1-(5-环戊基呋喃-2-基)乙烷-1-酮的合成与分离纯化
[0058]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),1-(呋喃-2-基)乙烷-1-酮(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测,待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得无色透明液体,即终产物:1-(5-环戊基呋喃-2-基)乙烷-1-酮为,产率为68%。
[0059]
产物的图谱信息为;
[0060]
.1h nmr(400mhz,cdcl3)δ7.09(d,j=3.5hz,1h),6.14(dd,j=3.6,0.8hz,1h),3.18
–
3.09(m,1h),2.41(s,3h),2.10
–
1.99(m,2h),1.78
–
1.63(m,6h).
13
c nmr(100mhz,
cdcl3)δ186.1,165.7,151.3,119.0,106.6,38.9,31.8,25.7,25.2。
[0061]
实施例7 1-(2-环戊基噻吩-3-基)乙烷-1-酮的合成与分离纯化
[0062]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),1-(噻吩-3-基)乙烷-1-酮(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测。待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,无色透明液体,即得终产物:1-(2-环戊基噻吩-3-基)乙烷-1-酮,产率为40%。
[0063]
产物的图谱信息为;
[0064]1h nmr(400mhz,cdcl3)δ7.33(d,j=5.4hz,1h),7.03(d,j=5.4hz,1h),4.16-4.05(m,1h),2.51(s,3h),2.26
–
2.17(m,2h),1.86
–
1.75(m,2h),1.74
–
1.65(m,2h),1.59
–
1.49(m,2h).
13
c nmr(100mhz,cdcl3)δ194.0,160.7,135.4,129.1,120.7,40.6,35.6,30.2,25.4。
[0065]
实施例8 2-(四氢-2h-吡喃-4-基)苯并呋喃的合成与分离纯化
[0066]
在4ml透明玻璃反应瓶中,加入四氢吡喃nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(两个灯分别位于反应瓶的相对两侧,反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测。待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得淡黄色固体,即终产物:2-(四氢-2h-吡喃-4-基)苯并呋喃,产率为55%。
[0067]
产物的图谱信息为;
[0068]1h nmr(400mhz,cdcl3)δ7.52
–
7.47(m,1h),7.44
–
7.39(m,1h),7.24
–
7.15(m,2h),6.38(s,1h),4.09
–
4.02(m,2h),3.54(td,j=11.6,2.2hz,2h),3.05-2.95(m,1h),2.04
–
1.96(m,2h),1.91
–
1.79(m,2h).
13
c nmr(100mhz,cdcl3)δ161.9,154.5,128.6,123.4,122.5,120.5,110.8,100.4,67.5,34.8,31.0。
[0069]
实施例9 2-(金刚烷-1-基)苯并呋喃的合成与分离纯化
[0070]
在4ml透明玻璃反应瓶中,加入金刚烷nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),并加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(反应瓶距离光源1.5cm)光照反应过夜(12-24h)。反应进程通过薄层色谱层析(tlc)监测。待反应结束后,用乙酸乙酯和水萃取反应液3次(加入8ml水后,连续用10ml乙酸乙酯萃取3次)后用饱和食盐水洗涤,然后用无水mg2so4干燥有机相,并使用水循环真空泵抽滤,最后经减压旋蒸后得到粗产品,粗产品通过
硅胶层析柱进行分离、纯化【硅胶层析使用的洗脱剂体系为石油醚/乙酸乙酯(石油醚/乙酸乙酯=9/1)和石油醚/二氯甲烷(石油醚/二氯甲烷=3/1)】,得白色固体,即最终产物:2-(金刚烷-1-基)苯并呋喃,产率为47%。
[0071]
产物的图谱信息为;
[0072]1h nmr(400mhz,cdcl3)δ7.52
–
7.48(m,1h),7.43(d,j=7.9hz,1h),7.24
–
7.14(m,2h),6.32(d,j=0.6hz,1h),2.11(s,3h),2.03(d,j=2.8hz,6h),1.81(s,6h).
13
c nmr(100mhz,cdcl3)δ167.7,154.4,128.9,123.1,122.3,120.4,110.9,98.6,41.0,36.9,35.0,28.3。
[0073]
综上,实施例1至9的nhpi酯、富电子杂环芳烃和的产物结构式,以及产率如表1所示。
[0074]
表1实施例1至9的底物、产物以及收率
[0075]
[0076][0077]
实施例10富电子芳烃投加当量对2-(4-氯丁基)苯并呋喃合成的影响
[0078]
和实施例1相比,区别主要在于,式2的富电子芳烃化合物投加当量(式2化合物与nhpi酯的摩尔比)不同,即苯并呋喃(结构式见表1)的投加当量分别为1eq,5eq,15eq,产率分别为10%,32%,46%。实验结果表明,加入10.0eq.的式2化合物的产率最优。
[0079]
具体操作如下:
[0080]
在4ml透明玻璃反应瓶中,加入4-cl正丁基nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),并分别加入1eq,5eq,15eq苯并呋喃(结构式见表1),最后加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(反应瓶距离光源1.5cm)光照反应过夜(12-24h),产率分别为10%,32%,46%。实验结果表明,加入10.0eq.的式2化合物的产率最优。
[0081]
实施例11添加助剂对2-环戊基苯并呋喃合成的影响
[0082]
和实施例2相比,区别主要在于,反应中还添加了不同的助剂,即还分别在反应中加入三氟乙酸(0.2mmol,1.0eq.)、醋酸钠(0.2mmol,1.0eq.)、磷酸钾(0.2mmol,1.0eq.),产率分别为39%,7%,5%。实验结果表明,添加其他反应试剂会阻碍反应进行,导致产率降低。
[0083]
具体操作如下:
[0084]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),分别加入三氟乙酸(0.2mmol,1.0eq.)、醋酸钠(0.2mmol,1.0eq.)、磷酸钾(0.2mmol,1.0eq.)最后加入2ml反应溶剂二甲基亚砜,在室温下用两个25w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)。产率分别为39%,7%,5%。实验结果表明,添加其他反应试剂会阻碍反应进行,导致产率降低。
[0085]
实施例12光源对2-环戊基苯并呋喃合成的影响
[0086]
和实施例2相比,区别主要在于,改变光源,即在室温下分别用两个25w的蓝色led灯、绿色led灯(反应瓶距离光源1.5cm)光照反应过夜(12-24h),产率分别为35%和6%。实验结果表明,改变光源后产率低于实施例2。
[0087]
具体操作如下:
[0088]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),最后加入2ml反应溶剂二甲基亚砜,在室温下分别用两个25w的蓝色led灯、绿色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)。产率分别为35%和6%。实验结果表明,改变光源后产率低于实施例2。
[0089]
实施例13反应温度对2-环戊基苯并呋喃合成的影响
[0090]
和实施例2相比,区别主要在于,改变反应温度,即在70摄氏度下分别用两个25w的白色led灯(反应瓶距离光源1.5cm)光照反应过夜(12-24h)。实验结果表明,在该温度下没有获得目标产物。
[0091]
同时,在0摄氏度下分别用两个25w的白色led灯(反应瓶距离光源1.5cm)光照反应过夜(12-24h),产率为7%。实验结果表明,该温度下反应产率远远低于实施例2。
[0092]
具体操作如下:
[0093]
在4ml明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),最后加入2ml应溶剂二甲基亚砜,在70摄氏度和0摄氏度下分别用两个25w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)。实验结果表明,在70摄氏度下没有获得目标产物;0摄氏度下的产率为7%。
[0094]
实施例14光源功率对2-环戊基苯并呋喃合成的影响
[0095]
和实施例2相比,区别主要在于,改变光源功率,即在室温下分别用两个12w的白色led灯(反应瓶距离光源1.5cm)光照反应过夜(12-24h),产率为20%。实验结果表明,改变光源功率后产率低于实施例2。
[0096]
具体操作如下:
[0097]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),最后加入2ml反应溶剂二甲基亚砜,在室温下分别用两个12w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h),产率为20%。实验结果表明,改变光源功率后产率低于实施例2。
[0098]
实施例15光催化剂种类对2-环戊基苯并呋喃合成的影响
[0099]
和实施例2相比,区别主要在于光催化剂的种类不同,即分别加入光催化剂ru(bpy)3cl2(0.5mol%),eosinyna2(0.5mol%),产率分别为0和29%。实验结果表明,改变光催化剂的种类后产率低于实施例2。
[0100]
具体操作如下:
[0101]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),分别加入光催化剂ru(bpy)3cl2(0.5mol%),eosinyna2(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),最后加入2ml反应溶剂二甲基亚砜,在室温下分别用两个25w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)。产率分别为0和29%。实验结果
表明,改变光催化剂的种类后产率低于实施例2。
[0102]
实施例16反应溶剂对2-环戊基苯并呋喃合成的影响
[0103]
和实施例2相比,区别在于改变反应溶剂,即分别加入2ml乙酸乙酯、二氯甲烷、四氢呋喃作为反应溶剂,产率分别为0%,0%和8%。实验结果表明,改变反应溶剂后产率远远低于实施例2。
[0104]
具体操作如下:
[0105]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),分别加入2ml乙酸乙酯、二氯甲烷、四氢呋喃作为反应溶剂,在室温下用两个25w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h),产率分别为0%,0%和8%。实验结果表明,改变反应溶剂后产率远远低于实施例2。
[0106]
实施例17光催化剂使用量对2-环戊基苯并呋喃合成的影响
[0107]
和实施例2相比,区别在于改变光催化剂ir(ppy)3的使用量,即加入光催化剂ir(ppy)3(3mol%),产率为46%。实验结果表明,增加光催化剂ir(ppy)3的使用量后产率低于实施例2。
[0108]
具体操作如下:
[0109]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(3mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),最后加入2ml反应溶剂二甲基亚砜,在室温下分别用两个25w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h)l产率为46%。实验结果表明,增加光催化剂ir(ppy)3的使用量后产率低于实施例2。
[0110]
实施例18添加有机碱对2-环戊基苯并呋喃合成的影响
[0111]
和实施例2相比,区别主要在于,还添加有机碱,即反应中还分别加入了dipea(0.2mmol,1.0eq.),dabco(0.2mmol,1.0eq.),产率分别为5%和7%。实验结果表明,添加有机碱反应后产率远远低于实施例2。
[0112]
具体操作如下:
[0113]
在4ml透明玻璃反应瓶中,加入环戊己nhpi酯(结构式见表1;0.2mmol,1.0eq.),光催化剂ir(ppy)3(0.5mol%),苯并呋喃(结构式见表1;2.0mmol,10.0eq.),分别加入dipea(0.2mmol,1.0eq.),dabco(0.2mmol,1.0eq.)最后加入2ml反应溶剂二甲基亚砜,在室温下分别用两个25w的白色led灯(反应瓶距离光源1.5cm)进行光照反应并过夜(12-24h),产率分别为5%和7%。实验结果表明,添加有机碱反应产率远远低于实施例2。
[0114]
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。