1.本发明涉及环境微生物领域。具体地,本发明涉及一种具有聚氨酯降解活力的真菌菌株,特别涉及一种能够有效降解聚氨酯的真菌菌株及其分离方法和用途。
背景技术:
2.微塑料是目前大洋环境污染新形势,去除水体中的微塑料在大洋环境保护方面起到关键作用。微塑料作为一种难降解的高分子化合物,长期在海洋环境中累积,严重威胁到海洋生态系统的健康。一方面,微塑料易被海洋动物所摄食,进而对海洋动物产生机械损伤,如堵塞食道,产生假的饱腹感等,影响海洋动物的生长与健康。其中浮游动物等低营养级海洋生物更易摄取微塑料,并通过食物网的传递与放大,引起生物累积效应。另一方面,微塑料还可向海洋环境释放增塑剂等有毒物质,具有内分泌干扰毒性,影响海洋生物的生殖与发育。此外,微塑料还能富集高浓度的持久性有机污染物和重金属,成为海水中有毒化学物质的载体,并产生生物放大作用,对海洋生物产生生态毒理学效应。总而言之,微塑料是目前大洋环境污染的新形势,去除水体中的微塑料在海洋生态保护方面可起到关键作用。
3.聚氨酯是微塑料中最为常见的一种,聚氨酯的生物降解是去除水体中聚氨酯的非常有效且备受关注的方法。因此,期望一种能够高效、无二次污染地降解聚氨酯微塑料的真菌,基于其开发设计一种能够高效处理大洋环境中的聚氨酯类微塑料污染物的技术方案,进而实现生物降解聚氨酯新的方法和工艺。
技术实现要素:
4.本发明的目的在于提供一种具有聚氨酯降解活性的真菌菌株。更具体地,本发明提供一种可用于处理水体环境、特别是含有聚氨酯的水体环境如海洋环境的真菌菌株。
5.本发明人通过将向阳红03号中国大洋50航次科学考察取得的东太平洋深海沉积物在以聚氨酯为唯一碳源的富集培养基中培育,随后进行分离、纯化和鉴定,得到耐盐枝孢(cladosporium halotolerans ch)菌株,并且发现该菌株具有聚氨酯降解活性,可以降解水体环境中包含聚氨酯类微塑料。在降解过程中,溶解由浑浊变澄清。由此,完成了本发明。
6.因此,在第一方面,本发明提供了一种真菌菌株,所述真菌为耐盐枝孢(cladosporium halotolerans ch),所述菌株于2021年08月02日保藏在湖北省武汉市洪山区八一路武汉大学的中国典型培养物保藏中心,保藏登记号为cctcc no:m 2021967。
7.在第二方面,本发明提供了真菌菌株用于降解聚氨酯的用途。
8.在第三方面,本发明提供了一种降解聚氨酯的方法,所述方法包括:使根据本发明第一方面的真菌菌株在适合与水体环境中的聚氨酯反应的反应条件下与水体环境中的聚氨酯接触。
9.在第四方面,本发明提供了一种获得具有聚氨酯降解活性的耐盐枝孢(cladosporium halotolerans ch)真菌菌株的方法,其包括:在以聚氨酯为唯一碳源的富
kh2po4;1g/l(nh4)2so4;0.1g/l mgso4·
7h2o;0.001g/lznso4·
7h2o;0.0001g/l cuso4·
5h2o;0.01g/l feso4·
7h2o;0.002g/lmnso4·
7h2o;0.3%聚氨酯;以及余量为蒸馏水。
40.在一个优选实施方案中,经配制的富集培养基还经历灭菌步骤,所述灭菌是本领域技术人员熟知的,例如通过高温高压灭菌。更优选地,经配制的富集培养基在经历灭菌、冷却后加入抗生素以抑制富集过程的细菌生长。所述抗生素优选地为氨苄青霉素、氯霉素或其组合。在富集培养基中,所添加的抗生素的浓度100μg/ml。
41.在一个实施方案中,所述方法还包括:在适合用于分离耐盐枝孢的分离培养基中培养富集得到的真菌;以及将在分离培养基中分离得到的菌落在纯化培养基中培养。
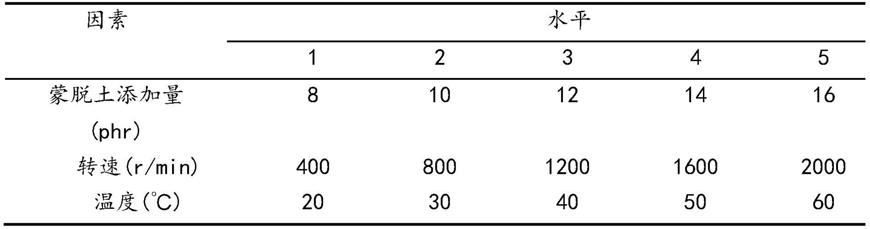
42.所述分离培养基为寡营养的真菌培养基,所述真菌培养基可以为例如马铃薯葡萄糖琼脂培养基(pda)、察氏培养基(cda)、麦芽浸出液琼脂培养基(mea)、酵母麦芽糖琼脂培养基(ym)或沙氏葡萄糖琼脂培养基(sda)。各真菌培养基的全营养成分可以如下表1所示。
43.表1.真菌培养基的全营养成分
[0044][0045]
在一个优选实施方案中,所述分离培养基为寡营养的pda培养基或sda培养基。
[0046]
在本文中,所谓“全营养”是指本领域惯用的培养基所包含的全部营养成分,例如从thermo fisher scientific公司商购得到的oxoid品牌的 cma干粉制剂,根据该商品的说明书中所示比例配制得到的cma培养基所包含的营养成分。所谓“寡营养”是相对于本领域惯用的培养基所包含的全部营养成分而言,例如通过稀释等手段使得培养基中营养成分的浓度低于全营养的真菌培养基的浓度。
[0047]
在一个优选实施方案中,分离培养基含有全营养培养基10%至50%、优选为15%至40%,例如20%、25%、30%或35%,更优选为20%的营养。这是为了模拟海洋环境,刺激长期在寡营养环境中生存的真菌的生长。
[0048]
在一个实施方案中,所述在分离培养基中培养的条件可以包括:在聚氨酯为唯一碳源的条件下,温度为24℃至28℃,所述分离培养基的 ph为6.0至6.5,培养20天至25天。
[0049]
在一个优选实施方案中,所述在分离培养基中培养的条件可以包括:在聚氨酯为唯一碳源的条件下,温度为28℃,所述分离培养基的ph为 6.0,培养20天至25天。
[0050]
在一个优选实施方案中,所述在分离培养基中培养可以重复一次或者多次,例如
重复2、3、4或5次,优选重复2至3次,直到有明显的菌丝生长出来。所述在分离培养基中培养优选地重复2次。
[0051]
在一个实施方案中,所述方法还将在分离培养基中分离得到的菌落在纯化培养基中培养。
[0052]
在一个具体实施方案中,所述纯化培养基是选自例如pda、cda、 mea、ym或sda的全营养的真菌培养基。
[0053]
在一个优选实施方案中,所述纯化培养基是全营养的pda培养基。
[0054]
在一个优选实施方案中,所述纯化步骤可以重复一次或多次,例如重复2、3、4或5次,优选重复2至3次,直到得到含有绒毛状菌株的菌落。
[0055]
经富集、分离、然后纯化,得到1株对聚氨酯降解效果较好的耐盐枝孢菌株。该耐盐枝孢菌株在固体平板培养基上呈现的菌落形态特征如图1所示:早期菌落为圆形,质地疏松,白色绒状,中期菌落中心部分为绿色,边缘白色,绒毛状,后期菌落中心部分为绿色,中圈为深绿色且较宽,外圈为绿色且较窄。图2显示出了该菌株在显微镜下的菌体形态特征,从该图中可以看出:该菌株的菌丝(图2的上图)发达,有分枝,无色;分生孢子(图2的下图)梗较短或稍弯曲。
[0056]
在第五方面,本发明提供了一种用于鉴定真菌菌株的方法,所述方法包括:
[0057]-提取待鉴定真菌菌株的dna;
[0058]-采用引物its4(seq id no:2)和its5(seq id no:3)并用 pcr技术扩增,将得到扩增序列进行测序;以及
[0059]-将所述测序序列与权利要求1所述的真菌菌株耐盐枝孢(cladosporium halotolerans ch)的its序列(seq id no:1)进行序列比对,以确定所述真菌菌株是否为权利要求1所述的真菌菌株耐盐枝孢;所述序列比对以相似度为100%为标准。
[0060]
综上,本发明提供了水体环境中日益严重的聚氨酯类废弃微塑料的污染问题提供新的解决方案,即,使用生长增殖速度快、易于培养、生产成本低、并且具有生物降解聚氨酯活性的耐盐枝孢真菌菌株。该真菌菌株能够持续地降解含有聚氨酯的水体环境如海洋环境、工业废水中含有的聚氨酯微塑料,由此提供一种高降解效率、环保、无二次污染、低成本、易操作的聚氨酯污染物的处理方法。
[0061]
下文中,结合示例性的实施方案会更详细地描述本发明。然而,本文公开的示例性的实施方案仅出于示例的目的,而不应该被认为旨在解释本发明的范围。
[0062]
实施例1.菌株分离和纯化
[0063]
配制富集培养液(以聚氨酯为唯一碳源)。1l经配制的富集培养基包括:7g k2hpo4;2g kh2po4;1g(nh4)2so4;0.1mgso4·
7h2o;0.001gznso4·
7h2o;0.0001g cuso4·
5h2o;0.01g feso4·
7h2o;0.002g mnso4·
7h2o; 0.3%聚氨酯。用蒸馏水补至1l。ph值调节至6.0。在将配制得到的培养液灭菌,并在冷却之后加入终浓度为100μg/ml氨苄青霉素和氯霉素(用于抑制样品中的细菌的生长),混合均匀制得富集培养液。
[0064]
富集培养。把东太平洋深海沉积物样品稀释10-1
,然后吸取稀释后的样品1ml,打入到上述富集培养液中,并在28℃、氧气充足的条件下震荡培养。待有明显的菌丝成长时,在抽取有菌丝的培养液1ml,打入到新的富集培养基中,再次以相同的条件进行二次富集培养。富集培养总共需要大概20至25天,此时有明显的菌丝生长出来,即为富集完成。
[0065]
分离与纯化。准备20%营养的pda分离培养基(马铃薯葡萄糖琼脂培养基),其包含马铃薯200.0g、葡萄糖20.0g和琼脂粉15.0g。该分离培养基中还含有100μg/ml氨苄青霉素和氯霉素。吸取二次富集培养的含no
3-的富集培养液涂布在20%营养的培养基平板上,然后把平板上的液体涂布均匀,25℃下培养待有明显的菌落长出时,挑取个菌落菌丝接种在pda培养基中,得到纯种的真菌。
[0066]
实施例2.真菌的生物学鉴定
[0067]
真菌的生物学鉴定主要是对其真菌的菌丝的显微结构进行鉴定,具体步骤如下:首先配制玉米粉琼脂培养基(cma,见上表1),并用配制好的该培养基倒板,在倒平板时尽量薄一点。用接种环挑取一环菌落,并在培养基上“之”字型划线。在划过线的培养基中用手术刀切出两个长方形培养基,并把它取出来,放上盖玻片后在25℃的恒温箱里培养7 天。将培养皿放在倒置显微镜(olympus ix51),找出有代表性的菌落,并拍摄照片。
[0068]
图1示出了本发明的耐盐枝孢菌株在固体平板培养基上呈现的菌落特征:早期菌落为圆形,质地疏松,白色绒状,中期菌落中心部分为绿色,边缘白色,绒毛状,后期菌落中心部分为绿色,中圈为深绿色且较宽,外圈为绿色且较窄。图2进一步显示出了该菌株在显微镜下的菌体形态特征,从该图中可以看出:该菌株的菌丝(图2的上图)发达,有分枝,无色;分生孢子(图2的下图)梗较短或稍弯曲。
[0069]
实施例3.基因序列分析
[0070]
对已经得到纯种的真菌,刮去菌丝,利用fastdna
tm spin kit forsoil试剂盒提取菌种的dna。提取的dna在热循环仪上通过its4(seqid no:2:5
′‑
tccgtaggtgaacctgcgg-3
′
)和its5(seq id no:3:5
′‑
tcctccgcttattgatagc-3
′
)的引物扩增基因组的its序列,其序列的长度大约是600bp。扩增好的its序列(seq id no:1)的pcr 产物委托上海美吉测序公司公司进行26s rdna-its区基因序列分析,测序成功后对真菌的its序列用bioedit软件去除多余序列,保留波峰较整齐部分的序列,然后对真菌的its序列进行blast分析比对,根据序列相似度98%至100%为标准来确定真菌种属地位。结合下述实施例 2中观察到的形态和显微菌丝结构,鉴定该菌株为耐盐枝孢属的耐盐枝孢(cladosporium halotolerans)。
[0071]
seq id no:1的序列如下:ggaagtaaaaagtcgtaacaagg tctccgtaggtgaacctgcggagggatcattacaagttgacccc ggccctcgggccgggatgttcacaaccctttgttgtccgactctg ttgcctccggggcgaccctgcctccgggcgggggccccgggtgg acatttcaaactcttgcgtaactttgcagtctgagtaaatttaatt aataaattaaaactttcaacaacggatctcttggttctggcatcga tgaagaacgcagcgaaatgcgataagtaatgtgaattgcagaatt cagtgaatcatcgaatctttgaacgcacattgcgccccctggtatt ccggggggcatgcctgttcgagcgtcatttcaccactcaagcctc gcttggtattgggcgacgcggtccgccgcgcgcctcaaatcgacc ggctgggtctttcgtcccctcagcgttgtggaaactattcgctaa agggtgccgcgggaggccacgccgtaaaacaaccccatttctaa ggttgacctcggatcaggtagggatacccgctgaacttaagcata tcaataa
[0072]
实施例4.不同温度下耐盐枝孢对聚氨酯降解能力的检测
[0073]
配制以聚氨酯为唯一碳源的培养基:每1l蒸馏水中含有7g k2hpo4、 2g kh2po4、1g(nh4)2so4;0.1g mgso4·
7h2o、0.001g znso4·
7h2o、0.0001g cuso4·
5h2o、0.01g feso4·
7h2o、0.002g mnso4·
7h2o、0.3%聚氨酯,用50%的盐酸调节ph为6.0。上述培养液装于三角瓶中,每瓶分装100ml培养液,分装完毕后灭菌(在培养基中加入抗生素以防止细菌生长)。
[0074]
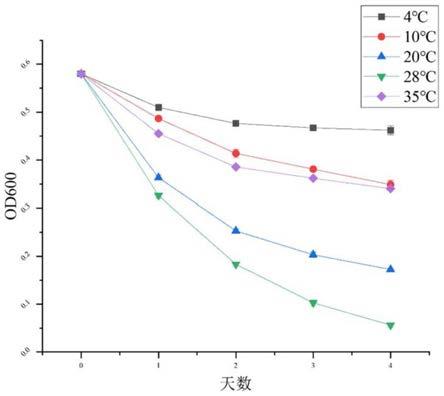
然后在灭菌之后的培养基中接种真菌,之后对三角瓶进行密封。分别放入4℃、10℃、20℃、28℃、35℃的环境中(每个温度梯度设置三个摇瓶)以120r/min震荡培养4天,在第0天至第4天,每天从三角瓶中取出1ml混匀的菌液在ep管中,通过酶标仪对其进行od600吸光度的测量,结果见下表2。根据其od600值的变化作变化曲线,并将其与空白培养基(第0天)的od600值进行对比,由此判断菌种对聚氨酯的降解能力,结果参见图3。从表2和图3可以看出,本发明菌株能够在聚氨酯为唯一碳源的条件下有效地将聚氨酯降解且具有较强的聚氨酯降解能力,其中在20℃和28℃的培养条件下,聚氨酯的降解效果高于较低温的4℃和10℃以及高温的35℃的培养组,并且发现在 28℃的培养条件下降解效果最好。
[0075]
表2.不同温度下耐盐枝孢的聚氨酯降解曲线
[0076][0077]
实施例5.不同ph下耐盐枝孢对聚氨酯降解能力的检测
[0078]
配制以聚氨酯为唯一碳源的培养基:每1l h2o中含有7g k2hpo4;2gkh2po4;1g(nh4)2so4;0.1mgso4·
7h2o;0.001g znso4·
7h2o;0.0001gcuso4·
5h2o;0.01g feso4·
7h2o;0.002g mnso4·
7h2o;0.3%聚氨酯,用50%的盐酸和1m的naoh将培养基的ph分别调节至5.5、6.0、6.5、7.0、7.5 (每个ph梯度三个摇瓶)。上述培养液装于三角瓶中,每瓶分装100ml培养液,分装完毕后灭菌,并加入抗生素以防止细菌生长。
[0079]
然后,在灭菌之后的培养基中接种真菌,之后对三角瓶进行密封,放入28℃的环境中以120r/min震荡培养4天,在第0天至第4天,每天从三角瓶中取出1ml混匀的菌液在ep管中,通过酶标仪对其进行 od600吸光度的测量,结果见下表3。根据其od600值的变化作曲线,并将其与空白培养基(第0天)的od600值进行对比,由此判断菌种对聚氨酯的降解能力,结果见图4。从表3和图4可以看出,本发明菌株能够在聚氨酯为唯一碳源的条件下有效地将聚氨酯降解且具有较强的聚氨酯降解能力,其中在ph为6.0和6.5的培养条件下,聚氨酯降解效果较其它组好,又以ph为6.0的条件下降解效果最好。
[0080]
表3不同ph下cladosporium halotolerans聚氨酯降解曲线
[0081]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。