1.本发明涉及中药提取、分离领域,尤其涉及从马齿苋药材中提取、分离和鉴别出的三种生物碱类化合物及其提取分离方法。
背景技术:
2.马齿苋是一年生植物,有黑色小种子和黄色或白色花朵,广泛分布于世界各地,特别是热带和亚热带地区。它被认为是最常用的天然药物之一,被称为“万能药”。同时,作为药食同源植物,马齿苋经常被添加到沙拉或汤中,略带咸酸味。马齿苋收载于2020版《中华人民共和国药典》,具有清热解毒、凉血止血、止痢等功效,它可以治疗各种疾病,如呼吸系统疾病,皮肤病,胃肠病,肝,肾病等。
3.现代药理学研究表明,马齿苋具有许多生物活性,如抗炎,神经保护,保肝,抗氧化,抗菌,抗糖尿病,抗肿瘤,抗胆碱酯酶,和免疫调节等作用。近年来,从该植物中分离出生物碱、黄酮类、有机酸、萜烯、木脂素等化学成分,其中生物碱为马齿苋的主要成分,目前已知的生物碱类成分主要包括去甲肾上腺素、尿囊素、多巴胺、金莲花碱、胸腺嘧啶、尿嘧啶、腺嘌呤腺苷和酰胺类生物碱等。
4.目前从马齿苋中分离出的化学成分大多数是已知的,且结构新颖性较低,因此,对马齿苋中新化合物的开发和分离是亟待需要的。
技术实现要素:
5.针对上述问题,本发明提供从马齿苋中提取的三种生物碱类化合物,经研究发现本发明的三种生物碱类化合物具有抗炎作用,同时提供一种针对本发明三种生物碱类化合物的简便、快速、环保、纯度高的提取分离方法。
6.为了实现上述目的,本发明提供了如下技术方案。
7.本发明提供三种从马齿苋药材中分离出的生物碱类化合物,其特征在于,分子式为:c
24h27
no
12
,c
25h29
no
13
,c
31h39
no
18
,并且根据结构命名为oleracrylamide a,oleracrylamide b和oleracrylamide c,其化学结构式如下:
。
8.本发明还提供了上述三种生物碱类化合物的提取分离方法,具体步骤为:步骤1、取马齿苋干燥药材,用乙醇提取,捞出后用水煎煮提取,水提物用乙酸乙酯萃取,得到水层提取物,减压浓缩至干,得粗提物;步骤2、将步骤1中粗提物用热水溶解,经聚酰胺柱分离,采用乙醇∶水梯度洗脱,将20%乙醇洗脱部分合并蒸干,得浓缩物备用;步骤3、将步骤2中所得物经预处理的ods柱层析分离,用甲醇∶水梯度洗脱,经薄层色谱进行检测,显色,合并显色部位,经减压浓缩至干,备用;步骤4、将步骤3中所得物再经预处理的ods柱层析分离,用甲醇∶水梯度洗脱,得到若干洗脱部位,经薄层色谱进行检测,显色,将显色部位减压浓缩至干,得到浓缩物备用;步骤5、将步骤4中所得浓缩物经预处理的sephadex lh-20层析分离,用甲醇等度洗脱,经薄层色谱进行检测,显色,将显色的洗脱部位分别减压浓缩至干,得浓缩物备用;步骤6、将步骤5中所得浓缩物通过hplc分离制备,以甲醇∶0.1%甲酸水为流动相进行等度洗脱,最终得到本发明所述的三种新化合物。
9.进一步地,所述步骤1中水煎煮提取两次,每次煎煮2小时,水用量为药材的10倍。
10.进一步地,所述步骤2中聚酰胺柱分离采用体积比为20∶80、70∶30的乙醇∶水梯度洗脱。
11.进一步地,所述步骤3中ods柱层析分离采用体积比为30∶70、50∶50、70∶30、100∶0的甲醇∶水梯度洗脱。
12.进一步地,所述步骤4中采用体积比为20∶80、40∶60、60∶40、80∶20甲醇∶水梯度洗脱。
13.进一步地,所述步骤6中所用甲醇∶0.1%甲酸等度洗脱中甲醇和水的体积比为30∶70,三种化合物的保留时间分别为9.858min,11.870min和6.775min。
14.进一步地,所述步骤3和步骤4中的ods柱和步骤5中的sephadex lh-20凝胶的预处
理过程为甲醇浸泡过24小时,上柱,以初始流动相平衡。
15.本发明还提供了三种如上所述的生物碱类化合物的用途,其特征在于,所述用途可用于制备抗炎的药物或保健品。
16.与现有技术相比本发明的有益效果。
17.本发明中所述马齿苋中三种生物碱类化合物的分离和药理活性研究未被发现有论文期刊所报道;本发明提供来源于马齿苋的三种生物碱类化合物及一种针对本发明新化合物的提取分离方法,依次采用乙醇提取,水煎煮提取、聚酰胺柱分离、ods中压柱、sephadex lh-20及hplc进行分离纯化与制备,成功提取分离出三种新的生物碱类化合物,该方法操作步骤仅为六步,操作方法简便及快速,提取分离过程主要采用水提取,工艺方法环保,且经该方法分离得到的化合物纯度较高均大于90%,此外经研究表明以上化合物具有抗炎作用,因此本发明三种生物碱化合物及其盐和衍生物可以作为其他化合物合成先导物,以及新药开发和药理活性研究的原料,亦可用于制备抗炎药物。
附图说明
18.图1为本发明新生物碱化合物oleracrylamide a的紫外光谱图。
19.图2为本发明新生物碱化合物oleracrylamide a的红外光谱图。
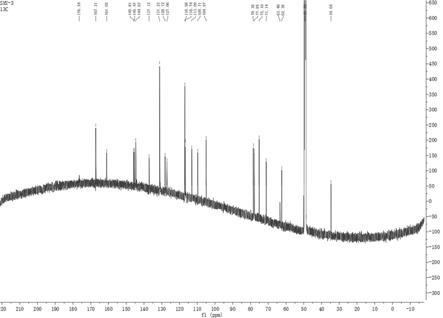
20.图3为本发明新生物碱类化合物oleracrylamide a的1h-nmr光谱图。
21.图4为本发明新生物碱类化合物oleracrylamide a的
13
c-nmr光谱图。
22.图5为本发明新生物碱类化合物oleracrylamide a的dept 135光谱图。
23.图6为本发明新生物碱类化合物oleracrylamide a的1h-1
hcosy光谱图。
24.图7为本发明新生物碱类化合物oleracrylamide a的hsqc光谱图。
25.图8为本发明新生物碱类化合物oleracrylamide a的hmbc光谱图。
26.图9为本发明新生物碱类化合物oleracrylamide a的roesy光谱图。
27.图10为本发明新生物碱类化合物oleracrylamide a和oleracone c的cd对比图。
28.图11为本发明新生物碱类化合物oleracrylamide a的高分辨质谱图。
29.图12为本发明新生物碱类化合物oleracrylamide b的紫外光谱图。
30.图13为本发明新生物碱化合物oleracrylamide b的红外光谱图。
31.图14为本发明新生物碱类化合物oleracrylamide b的1h-nmr光谱图。
32.图15为本发明新生物碱类化合物oleracrylamide b的
13
c-nmr光谱图。
33.图16为本发明新生物碱类化合物oleracrylamide b的dept 135光谱图。
34.图17为本发明新生物碱类化合物oleracrylamide b的1h-1h cosy光谱图。
35.图18为本发明新生物碱类化合物oleracrylamide b的hsqc光谱图。
36.图19为本发明新生物碱类化合物oleracrylamide b的hmbc光谱图。
37.图20为本发明新生物碱类化合物oleracrylamide b的roesy光谱图。
38.图21为本发明新生物碱类化合物oleracrylamide b和oleracone c的cd对比图。。
39.图22为本发明新生物碱类化合物oleracrylamide a的高分辨质谱图。
40.图23为本发明新生物碱化合物oleracrylamide c的紫外光谱图。
41.图24为本发明新生物碱化合物oleracrylamide c的红外光谱图。
42.图25为本发明新生物碱类化合物oleracrylamide c的1h-nmr光谱图。
43.图26为本发明新生物碱类化合物oleracrylamide c的13c-nmr光谱图。
44.图27为本发明新生物碱类化合物oleracrylamide c的dept 135光谱图。
45.图28为本发明新生物碱类化合物oleracrylamide c的1h-1h cosy光谱图。
46.图29为本发明新生物碱类化合物oleracrylamide c的hsqc光谱图。
47.图30为本发明新生物碱类化合物oleracrylamide c的hmbc光谱图。
48.图31为本发明新生物碱类化合物oleracrylamide c的roesy光谱图。
49.图32为本发明新生物碱类化合物oleracrylamide c和oleracone c的cd对比图。
50.图33为本发明新生物碱类化合物oleracrylamide c的高分辨质谱图。
具体实施方式
51.下面结合具体实施例对本发明做详细的说明。
52.本发明提供三种生物碱类化合物,分子式分别为c
24h27
no
12
,c
25h29
no
13
,c
31h39
no
18
,命名为oleracrylamide a,oleracrylamide b和oleracrylamide c,化学结构式为:。
53.所述三种生物碱类化合物根据结构命名为oleracrylamide a,oleracrylamide b和oleracrylamide c,表1为该三种生物碱类化合物的核磁数据:1h-nmr与
13
c-nmr在meod-d4中。
54.表1:本发明三种生物碱类化合物oleracrylamide a,oleracrylamide b和oleracrylamide c的核磁数据
。
55.本发明生物碱类化合物oleracrylamide a结构鉴定与推导。
56.oleracrylamide a为黄色粉末,易溶于甲醇,不溶、微溶于水。点样于硅胶薄层板后,喷稀碘化铋钾试液斑点显橘黄色,提示该化合物为生物碱成分。uv(meoh)λ
max
:336 nm,ir(kbr)v
max
:3591,3467,2956,2921,1735,1654,1637,1247,1074 cm-1
,uhplc-esi-qtof/ms谱给出m/z:504.1501[m
ꢀ‑ꢀ
oh]
的准分子离子峰,分子量为521.1533。结合1h-nmr,
13
c-nmr以及dept数据,推测该化合物可能的分子式为为c
24h27
no
12
,不饱和度为12。
13
c-nmr谱和dept 135谱显示化合物1中存在24个碳信号,包括2个ch2(δc34.64、62.38),14个ch(6个脂肪族碳δc63.40、71.14、75.10、77.85、78.38、104.97;8个烯烃碳δc109.71、113.09、116.74、116.98、131.23、144.67,其中116.98和131.23为重叠峰),8个季碳(2个羰基碳δc167.21、176.54;6个烯烃碳δc128.12、161.02、127.06、137.12、145.47、145.81)。
[0057]1h-nmr信号δh7.47(d,j=8.4hz,h-2,h-6),δh6.81(d,j=8.4hz,h-3,h-5)以及
13
c-nmr信号δc131.23(c-3,c-5,重叠),δc116.98(c-2,c-6,重叠)显示一个aa'bb'系统,
13
c-nmr信号δc161.02(c-4)位于低场区,表明c-4与羟基相连。此外,δh6.70(d,j=15.2hz,h-2')和δh7.63(d,j=15.2hz,h-3')处的信号提示该结构存在反式取代的双键,hmbc相关性显示h-2'与c-1相关,h-3'与c-2、c-6相关,提示c-3'与c-1直接相连。
13
c-nmr信号δc167.21(c-1')为酰胺羰基信号,hmbc 相关性显示h-3'与c-1'相关,提示反式双键与酰胺羰基相连,从而推测该结构存在丙烯酰胺基团。此外,1h-nmr信号δh8.21(s,h-3'''')和δh6.75(s,h-6'''')结合hmbc相关性显示h-3'''与c-1'''、c-5'''相关和从h-6'''与c-2'''、c-4'''相关,可以推断出化合物1中存在典型的四取代芳环。低场区的δc137.12(c-2''')和δc145.81(c-5''')的
13
c-nmr信号表明c-2'''和c-5'''都与羟基相连。此外,1h-nmr信号δh4.80(d,j=7.0hz,h-2''''')的一个半缩醛、δh3.47到3.51的四个次甲基和一个亚甲基(δh3.96, d,j=12.1 hz,h-7''''a;δh3.82,dd,j=12.2,4.1 hz,h-7''''b)以及
13
c-nmr信号δc104.97(c-2''''')、δc75.10(c-3'''')、77.85, (c-4''''')、78.38(c-5')、71.14(c-6''''')、δc62.38(c-7''''')提示存在一个β-吡喃葡萄糖基团,hmbc相关性表明h-2''''与c-4'''相关,提示β-d-吡喃葡萄糖与c-4'''相连。此外,hmbc相关性表明h-4''与c-2''(δc176.54)相关,h-3''与c-1'''相关以及1h-1
hcosy谱图显示h-3''与h-4''相关,表示该结构中存在2-羟基丙酰基基团并连接到c-1'''。roesy谱图显示h-2'与h-3''相关,这表明2-羟基丙酰基与丙烯酰胺基团相连。此外,将化合物1的cd光谱与我们实验室先前分离的oleracone c进行比较,在298nm处表现出一个负最大值,与oleracone c的cd光谱相反,表明oleracrylamide a的绝对构型是3''r。根据以上信息,可确定化合物1为上述结构。
[0058]
本发明生物碱类化合物oleracrylamide b结构鉴定与推导。
[0059]
oleracrylamide b为黄色粉末,易溶于甲醇,不溶、微溶于水。点样于硅胶薄层板后,喷稀碘化铋钾试液斑点显橘黄色,提示该化合物为生物碱成分。uv(meoh)λ
max
:347nm,ir(kbr)v
max
:3587,3469,2942,2925,1727,1654,1635,1250,1074cm-1
,uhplc-esi-qtof/ms谱给出m/z:534.1607[m
ꢀ‑ꢀ
oh]
的准分子离子峰,分子量为551.1639。结合1h-nmr,
13
c-nmr以及dept数据,推测该化合物可能的分子式为为c
25h29
no
13
,不饱和度为12。根据 13c nmr 和 dept 135 光谱,化合物2中存在25个碳信号,包括1个och3(δc56.64)、2个ch2(δc34.40、62.42)、13个ch(6个脂肪族碳δc62.81、71.15、75.14、77.90、78.45、105.09;7个烯烃碳δc109.77、112.06、113.10、116.69、116.89、123.96、145.07),9个季碳(2个羰基碳δc167.14、175.50;7个烯烃碳δc126.1、126.2、136.1、143.2、143.6、159.1)。
[0060]
化合物2的1h-nmr和
13
c-nmr光谱以及结构与化合物1都高度相似,只多一个och3单元。δc56.64/δh3.90(s,3h)处的信号是典型的och3信号,hmbc的相关性显示och3的氢与c-3相关,确定-och3应与c-3相连。1h-nmr信号δh7.19(d,j=7.7hz,h-2),δh6.81(d,j=8.1hz,h-5)和δh7.08(dd,j=7.7,8.1hz,h-6),对应
13
c-nmr谱信号δc112.06,δc116.69,δc123.96,提示该结构中存在典型的abx自旋系统。其他信号与化合物1完全相同。此外,化合物2的手性碳位置与化合物1相同,因此化合物2的圆二色光谱也与oleracone c 的圆二色光谱进行了比较,在293nm处表现出一个负最大值,表明oleracrylamide b的绝对构型为3''r。根据以上信息,可确定化合物2为上述结构。
[0061]
本发明生物碱类化合物oleracrylamide c结构鉴定与推导。
[0062]
oleracrylamide c为黄色粉末,易溶于水,微溶于甲醇。点样于硅胶薄层板后,喷稀碘化铋钾试液斑点显橘黄色,提示该化合物为生物碱成分。uv(meoh)λ
max
:345nm,ir(kbr)v
max
:3565,3478,2985,2923,1724,1654,1637,1280,1072cm-1
,uhplc-esi-qtof/ms谱给出m/z:696.2136[m
ꢀ‑ꢀ
oh]
的准分子离子峰,分子量为713.2167。结合1h-nmr,
13
c-nmr以及dept数据,推测该化合物可能的分子式为c
31h39
no
18
,不饱和度为13。根据
13
c-nmr 和dept 135光谱,化合物3中存在31个碳信号,包括1个och3(δc56.64)、3个ch2(δc34.40、62.99、69.93)、18个ch(11个脂肪族碳δc63.07、77.94、75.02、71.89、78.15、77.59、75.32、71.71、77.64、104.71、105.25;7个烯烃碳δc112.55、116.62、123.79、116.73、145.47、109.65、113.00),9个季碳(2个羰基碳δc167.35、176.23;7个烯烃碳δc128.81、149.44、150.35、127.15、137.06、145.76、145.80)。
[0063]
化合物3的1h-nmr和
13
c-nmr光谱以及结构与化合物2都高度相似,只多了一个β-d-吡喃葡萄糖基团。一组1h-nmr信号δh3.40-4.40,两个异头质子信号δh4.77(d,j=6.8 hz,h-2'''')和δh4.40(d,j=7.5 hz,h-2''''')以及
13
c-nmr信号δc62.38、69.93、71.71、71.89、75.02、75.32、77.59、77.64、77.94、78.15、104.71、105.25,提示存在两个β-d-吡喃葡萄糖基团。在较低磁场下观察到c-7'''''处的亚甲基碳信号,以及从h-2''''''到c-7'''''的 hmbc相关性,表明两个β-d-吡喃葡萄糖基团在c-7'''''相连。化合物3的圆二色光谱在290nm处显示出一个负最大值,这与oleracone c的cd光谱相反,表明oleracrylamide c的绝对构型为3''r。
[0064]
根据以上信息,可确定三种新生物碱为上述结构。
[0065]
本发明还提供上述此三种生物碱类化合物的提取分离方法,具体步骤为:步骤1:称取马齿苋干燥药材150kg,采用乙醇提取,捞出后采用水煎煮提取,水用量为药材的10倍,煎煮提取两次,每次煎煮2h,水提液滤过,合并滤液,用乙酸乙酯萃取,得到水层提取物,减压浓缩至干,得粗提物;步骤2:将步骤1中所得粗提物热水溶解,经聚酰胺柱分离,采用乙醇∶水(20∶80、70∶30,v/v)的梯度洗脱,将20%(体积百分数)乙醇洗脱部分合并蒸干,得浓缩物备用;步骤3:将步骤2中浓缩物经预处理的ods中压柱层析分离,其中填料粒度为40μm~70μm,采用甲醇∶水(30∶70、50∶50、70∶30、100∶0,v/v)梯度洗脱(加压,使流速为1ml/min,温度为室温),得到4个部位(即梯度洗脱得4个瓶,每瓶200ml),显色,留下显色的第1个部位,并于室温以上,50℃以下减压浓缩至干,备用;步骤4:将步骤3中所得物再经预处理的ods中压柱层析分离,其中填料粒度为40μm
~70μm,用甲醇∶水(20∶80、40∶60、60∶40、80∶20、100∶0,v/v)梯度洗脱(加压,使流速为1ml/min,温度为室温),得到10个部位(即梯度洗脱得10个瓶,每瓶100ml),经薄层色谱进行检测,显色,留下显色的第2~5个部位,50℃以下减压浓缩至干,备用;步骤5:将步骤4中所得显色部位经预处理的sephadex lh-20柱层析,以甲醇等度洗脱,得到5个部位(即等度洗脱得5个瓶,每瓶20ml),经薄层色谱进行检测,显色,留下显色的第1~2部位,50℃以下减压浓缩至干,备用;步骤6:将步骤5中所得显色部位经hplc分离制备,以甲醇和0.1%甲酸(30∶70,v/v)作为流动相,检测波长为210nm和280nm,分离制备得到本发明三种生物碱类化合物,归一法测定纯度均为90%~99%。
[0066]
所述ods和sephadex lh-20凝胶的预处理过甲醇浸泡过24h,上柱,初始流动相平衡。
[0067]
本发明生物碱类化合物的抗炎作用1主要材料1.1、药品和试剂:实验所用新化合物由上述方法制备,纯度为90%~99%,精密称取,用dmso稀释至下述各剂量组所需溶液。dmem高糖培养基、胎牛血清(美国hyclone公司);青霉素、链霉素(杭州四季青公司);lps(美国sigma公司);il-1β、tnf-α的elisa试剂盒(美国cayman公司);细胞裂解液。
[0068]
1.2 细胞株:raw264.7巨噬细胞(美国atcc细胞库)1.3 分组:对照组、lps组和实验组,各一组。
[0069]
2 实验方法2.1 细胞培养,dmem高糖培养基,加入10%的胎牛血清,l%抗菌素(100u/ml青霉素和100μg/ml链霉素),置于37℃,5%co2培养箱中培养。
[0070]
2.2 cck8法测定细胞活力,上述三组分别取对数生长期raw264.7巨噬细胞接种于96孔培养板中,细胞密度为1
×
104个/ml,每孔100μl,温度37℃,5%co2条件下培养过夜后,实验组加入不同浓度的本发明三种生物碱类化合物oleracrylamide a,oleracrylamide b和oleracrylamide c(1μm~20μm),孵育1h后向lps组和实验组分别加入浓度为1μg/ml的lps,另设调零组(含dmso溶媒的培养液),每组设3个复孔,考察加入药物后对细胞的影响。上述各组细胞培养24h后,在各孔细胞中加入10μl的cck8,温度37℃,5%co2条件下继续孵育4h后,酶标仪450nm波长处测定各孔吸光值。
[0071]
2.3 elisa法测定炎症因子il-1β和tnf-α:将对数生长期raw264.7巨噬细胞接种于24孔培养板中,细胞密度为1
×
105个/ml,每孔1ml,温度37℃,5%co2条件下培养过夜,实验组加入本发明生物碱类化合物oleracrylamide a,oleracrylamide b和oleracrylamide c(1μm~20μm),培育1h后,在每孔加入lps(终浓度为1μg/ml),共孵育24h,每组处理重复3孔。elisa法测定马齿苋来源新化合物处理后的raw264.7巨噬细胞分泌的il-1β和tnf-α的含量。
[0072]
3实验结果实验结果表明本发明新生物碱化合物对lps诱导的巨噬细胞raw264.7的增殖无影响,安全无毒;并可有效抑制lps诱导的巨噬细胞raw264.7所产生过量炎症细胞因子il-1β和tnf-α炎症介质,且呈浓度依赖。
[0073]
细胞相对存活率实验结果如表2所示。
[0074]
表2:本发明对raw264.7巨噬细胞相对存活率的影响。
[0075]
注:*p《0.05与对照组比较(高浓度组有显著性差异)。
[0076]
elisa法测定炎症因子il-1β和tnf-α炎症介质结果如表3所示。
[0077]
表3:本发明对lps诱导的raw264.7细胞分泌的il-1β和tnf-α含量的影响注:
#
p《0.05与对照组比较,
*
p《0.05与lps组比较,均数
±
sd,n=3。
[0078]
综上所述,本发明提供特殊化合物及其提取分离方法,依次采用水回流提取、聚酰
胺柱层析、ods中压柱、葡聚糖凝胶柱层析及hplc分离纯化,成功的分离得到三种新化合物,该方法简便,快速,环保,且经该方法分离得到的化合物纯度较高,由于所得化合物化学结构独特,从常用中药马齿苋中提取出来,其具有抗炎作用,因此本发明特殊化合物及其盐和衍生物可以作为天然产物开发中药新药,具有广阔的前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。