1.本发明涉及一种使用叔丁基异腈作为氰基化试剂,在镍的作用下合成芳基腈类物质的方法。
背景技术:
2.腈类化合物广泛应用于医药、杀虫剂、香料、染料、电致发光材料、聚丙烯腈和丁腈橡胶等的合成;同时,腈也是有机合成中一种非常重要的中间体,能够很容易的转化为其它非常有用的目标化合物,如酰胺、羧酸、胺、醛酮等等。因此,腈类化合物的制备和应用在工业生产与理论研究中有着极其重要的意义。
3.合成腈类化合物的方法有许多种,其中部分方法是通过引入氰源(氰基离子)来实现的。近年来,过渡金属催化(例如pd、ni、cu、zn、rh等)碳-碳键的构筑反应取得了长足的发展,这便为过渡金属催化c-cn键的形成奠定了基础。与此同时氰基试剂源也从最初的剧毒和易挥发的hcn、tmscn,发展到稳定的剧毒金属氰源nacn、kcn、zn(cn)2等,同时低毒的金属氰盐k4[fe(cn)6]也被开发应用,但是k4[fe(cn)6]具有易溶于水,难溶于低极性有机溶剂的特点,其作为氰源往往需要使用高沸点、高极性有机溶剂,难于后处理。如今,氰源发展到了毒性很小的非金属氰源(乙腈、n-氰基-n-苯基对甲苯磺酰胺(ncts)、ddq、n-氰基苯并咪唑、叔丁基异腈、苯乙腈等)。值得指出的是过渡金属ni催化剂相较于pd,rh等催化剂具有储量丰富,价格低廉等优点。使用叔丁基异腈作为氰源,廉价金属ni催化生成芳基腈类化合物未见有人报道。
技术实现要素:
[0004]
为了解决上述问题,本发明提供一种通过廉价金属镍催化剂实现使用叔丁基异腈作为氰源合成芳基腈类物质的反应,从而为合成腈类物质提供了一种低毒,廉价的方法。
[0005]
为达到上述目的,本发明采用如下技术方案:
[0006][0007]
以上式所示的碘代苯类化合物和叔丁基异腈为反应原料,在氮气保护下(提供无水无氧环境,其他类似方法也可以)加入镍催化剂,碱性物质,膦配体,在有机溶剂中,反应得到对应芳基腈类产物。
[0008]
具体来说,本发明提供一种叔丁基异腈合成芳基腈类化合物的方法,所述方法为:保护气氛(氮气或者惰性气体气氛,优选氮气)下以式i所示的碘代苯类化合物和叔丁基异腈为反应原料,加入镍催化剂、碱性物质和膦配体,在有机溶剂中,60-180℃下搅拌反应8-24h(优选150℃反应12h),所得反应液经后处理,得到式iii所示的芳基腈类化合物;
[0009][0010]
其中,ar为苯基、萘基、噻吩或者被c
1-c3酯基、c
1-c5羰基、c
1-c5烷氧基、苯基、c
1-c4烷基或硝基取代的苯基;
[0011]
所述的式ⅰ所示的碘代苯类化合物、叔丁基异腈、镍催化剂、膦配体与碱性物质的物质的量之比为1:1-2:1-2:0.1-0.3:0.5-2(优选1:1.5:1:0.2:1);所述镍催化剂为ni(dme)br2、nibr2、ni(dppp)cl2中一种或两种以上的混合物;所述的膦配体为1,3-双(二苯基膦)丙烷(dppp)、1,3-双(二苯基膦)丁烷(dppb)、1,3-双(二苯基膦)乙烷(dppe)、三苯基膦、4,5-双(二苯基膦)-9,9-二甲基氧杂蒽中的一种;所述碱性物质为叔丁醇钠、叔丁醇钾、碳酸铯中一种或两种以上的混合物。
[0012]
进一步,所述有机溶剂为甲苯,所述有机溶剂的体积以所述式ⅰ所示的碘代苯类化合物计为5ml/mmol。
[0013]
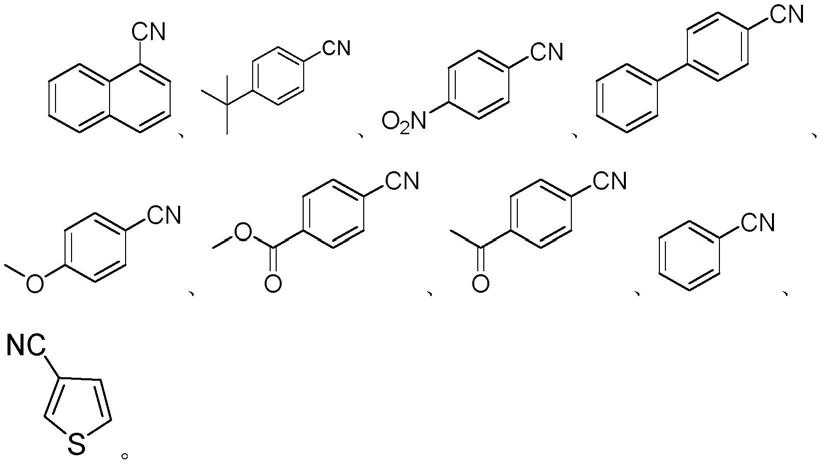
优选地,所述式iii所示的芳基腈类化合物为下列之一:
[0014][0015]
优选地,所述镍催化剂为nibr2。
[0016]
优选地,所述碱性物质为叔丁醇钠。
[0017]
优选的,所述膦配体为1,3-双(二苯基膦)丙烷(dppp)。
[0018]
进一步,所述后处理为:将所述反应液冷却至室温,加入与所述反应液等体积的乙酸乙酯,加入硅胶(硅胶的质量以式ⅰ所示的碘代苯类化合物的物质的量计为1.25g/mmol),混匀后旋蒸除去溶剂,以体积比为(15-80):1的正己烷和乙酸乙酯的混合溶液或体积比为20:1的正己烷和乙醚作为洗脱剂进行柱层析,收集含目标化合物的洗脱液(产物沸点较低时,采用洗脱剂体积比为20:1的正己烷和乙醚作为洗脱剂),真空减压浓缩,得到所述芳基腈类化合物。
[0019]
与现有技术相比,本发明的有益效果在于:不同于已知报道的文献方法中使用剧毒的氰基化试剂,或使用贵金属作为催化剂。本发明所述的镍催化剂相对的储量丰富、价格低廉,降低了反应成本,本发明使用的氰基化试剂叔丁基异腈毒性较低,给生产操作降低了
难度。为合成芳基腈类化合物提供了一种成本较低,安全生产的新途径,h谱证明所得产物的纯度都达到了95%以上。
具体实施方式
[0020]
下面结合具体实施例对本发明作进一步详细说明,但本发明的保护范围不限于此:
[0021]
本发明所述其他试剂均为商品化试剂。
[0022]
实施例1
[0023][0024]
在氮气保护下,将0.4mmol(61.2mg)1-碘萘,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶混匀后旋转蒸发,使用正己烷:乙酸乙酯=50:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品39.78mg,产率为65%。
[0025]
表征数据:1h nmr(500mhz,cdcl3)δ8.24(dq,j=8.3,0.9hz,1h),8.08(dd,j=8.3,1.2hz,1h),7.92(td,j=7.7,7.2,1.0hz,2h),7.70(ddd,j=8.3,6.9,1.3hz,1h),7.63(ddd,j=8.2,6.9,1.2hz,1h),7.53(dd,j=8.4,7.2hz,1h).
[0026]
实施例2
[0027][0028]
在氮气保护下,将0.4mmol(240mg)4-叔丁基碘苯,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶混匀后旋转蒸发,使用正己烷:乙酸乙酯=80:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品43.9mg,产率为69%。
[0029]
表征数据:1h nmr(500mhz,cdcl3)δ7.62
–
7.57(m,2h),7.52
–
7.47(m,2h),1.34(s,9h).
[0030]
实施例3
[0031][0032]
在氮气保护下,将0.4mmol(99.6mg)对硝基碘苯,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯
作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶,混匀后旋转蒸发,使用正己烷:乙酸乙酯=50:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品18.4mg,产率为31%。
[0033]
表征数据:1h nmr(500mhz,cdcl3)δ8.41
–
8.35(m,2h),7.96
–
7.88(m,2h).
[0034]
实施例4
[0035][0036]
在氮气保护下,将0.4mmol(112mg)4-碘联苯,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶,混匀后旋转蒸发,使用正己烷:乙酸乙酯=50:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品58.7mg,产率为82%。
[0037]
表征数据:1h nmr(500mhz,cdcl3)δ7.76
–
7.68(m,4h),7.63
–
7.59(m,2h),7.53
–
7.48(m,2h),7.47
–
7.43(m,1h).
[0038]
实施例5
[0039][0040]
在氮气保护下,将0.4mmol(93.6mg)4-碘苯甲醚,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶,混匀后旋转蒸发,使用正己烷:乙酸乙酯=15:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品47.9mg,产率为90%。
[0041]
表征数据:1h nmr(500mhz,cdcl3)δ7.61(d,j=8.4hz,2h),6.97(d,j=8.4hz,2h),3.88(s,3h).
[0042]
实施例6
[0043][0044]
在氮气保护下,将0.4mmol(104.8mg)4-碘苯甲酸甲酯,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入
500mg硅胶,混匀后旋转蒸发,使用正己烷:乙酸乙酯=20:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品52.8mg,产率为82%。
[0045]
表征数据:1h nmr(500mhz,cdcl3)δ8.15(d,j=7.9hz,2h),7.76(d,j=7.5hz,2h),3.97(s,3h).
[0046]
实施例7
[0047][0048]
在氮气保护下,将0.4mmol(98.4mg)4-碘苯乙酮,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶,混匀后旋转蒸发,使用正己烷:乙酸乙酯=30:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩并干燥得到纯品49.3mg,产率为85%。
[0049]
表征数据:1h nmr(500mhz,cdcl3)δ8.04(d,j=7.9hz,2h),7.78(d,j=7.9hz,2h),2.64(s,3h).
[0050]
实施例8
[0051][0052]
在氮气保护下,将0.4mmol(81.6mg)碘苯,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶,混匀后旋转蒸发,使用正己烷:乙酸乙酯=80:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品21.4mg,产率为21.4%。
[0053]
表征数据:1h nmr(500mhz,cdcl3)δ7.67(d,j=7.7hz,2h),7.62(t,j=7.6hz,1h),7.52
–
7.45(m,2h).
[0054]
实施例9
[0055][0056]
在氮气保护下,将0.4mmol(84mg)3-碘噻吩,nibr2(1equiv,87.4mg),叔丁醇钠(1equiv,38.4mg),膦配体dppp(20mol%,33mg)加入到25ml schlenk管中,加入2ml甲苯作溶剂,紧接着加入0.6mmol(49.9mg)叔丁基异腈。接着,将反应置于150℃油浴中搅拌12小时。反应结束后,将反应液冷却至室温,用2ml乙酸乙酯稀释反应液,再在反应液中加入500mg硅胶,混匀后旋转蒸发,使用正己烷:乙醚=20:1经硅胶柱进行洗脱,获得目标产物后经真空减压浓缩得到纯品27mg,产率为62%。
[0057]
表征数据:1h nmr(500mhz,cdcl3)δ7.96(dd,j=3.0,1.2hz,1h),7.44(dd,j=5.1,3.0hz,1h),7.31(dd,j=5.1,1.2hz,1h).
[0058]
实施例10
[0059]
操作同实施例5相同,只是将nibr2换成了ni(dme)br2(1equiv,123.44mg),得到产物26.6mg,产率为50%。
[0060]
实施例11
[0061]
操作同实施例5相同,只是将nibr2换成了ni(dppp)cl2(1equiv,216.8mg),得到产物34.6mg,产率为65%。
[0062]
实施例12
[0063]
操作同实施例5相同,只是将叔丁醇钠换成了碳酸钠(1equiv,42.4mg),得到产物38.3mg,产率为72%。
[0064]
实施例13
[0065]
操作同实施例5相同,只是将叔丁醇钠换成了碳酸铯(1equiv,130.3mg),得到产物41.5mg,产率为72%。
[0066]
实施例14
[0067]
操作同实施例5相同,只是将叔丁醇钠换成了叔丁醇钾(1equiv,44.8mg),得到产物42mg,产率为79%。
[0068]
实施例15
[0069]
操作同实施例5相同,只是将膦配体1,3-双(二苯基膦)丙烷换成了1,3-双(二苯基膦)丁烷(20mol%,34.1mg),得到产物18.62mg,产率为35%。
[0070]
实施例16
[0071]
操作同实施例5相同,只是将膦配体1,3-双(二苯基膦)丙烷换成了1,3-双(二苯基膦)乙烷(20mol%,31.8mg),得到产物39.4mg,产率为74%。
[0072]
实施例17
[0073]
操作同实施例5相同,只是将膦配体1,3-双(二苯基膦)丙烷换成了三苯基膦(20mol%,20.96mg),得到产物40.43mg,产率为76%。
[0074]
实施例18
[0075]
操作同实施例5相同,只是将膦配体1,3-双(二苯基膦)丙烷换成了4,5-双(二苯基膦)-9,9-二甲基氧杂蒽(20mol%,46.3mg),得到产物38.8mg,产率为73%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。