1.本发明涉及骨科内植物与高强度生物医用材料、先进制造和智能制造技术领域,具体而言,涉及硬材料与细胞一体化三维生物打印方法、骨修复功能模块和骨类器官的制备方法与应用。
背景技术:
2.因创伤、炎症、肿瘤切除等原因造成每年有大量人群发生骨缺损,但人体自身无法再生修复大段临界骨缺损,大多数情况下需要外部手术干预来恢复正常。目前临床上的常用的骨移植物材料有以下几种:自体骨,即材料取之于病人本人身体,是最理想的修复物,却存在二次伤害,多术区及供区并发症、来源不足等问题;异体骨,多来自尸体捐献或是动物,存在免疫反应、潜在感染风险及医学伦理等问题。因此,开发适合替换或修复骨缺损的新型骨移植材料及相应的制备工艺具有重要意义。
3.人体正常的骨组织存在两种不同结构:松质骨和皮质骨,松质骨为多孔结构,具有45%~90%的孔隙率;皮质骨则更为致密,分布在骨干和骨组织表面,孔隙率5%-20%。但是,无论松质骨还是皮质骨,为了促进骨组织的连续向内生长,相互连通的孔隙结构都是非常重要的。这是因为,相互连通的孔隙能够允许营养物质和氧气传输到支架的内部,促进细胞和组织向支架内部结构生长,促进支架血管化的形成以及代谢产物的去除。
4.目前,多孔骨修复支架可以通过多种方法制造,例如化学/气体发泡,溶剂浇铸,颗粒沥滤法,冷冻干燥等,但这些三维支架制备工艺对于孔隙的形状、大小、结构的控制以及连通性的控制欠佳。而使用三维打印方法设计和制造这种支架,可有效解决上述问题;同时,三维打印方法还能够根据病人特定的缺损部位、形状及临床需求进行个性化订制。
5.近年来,三维打印方法的改进使得活细胞3d生物打印技术越来越成熟,应用生物材料比如水凝胶包裹细胞,可以解决细胞的存活以及功能化问题。但是这种水凝胶生物材料的机械强度很低,远未达到骨科内植物的强度要求。采用3d生物打印的方法将多孔骨修复支架的制备与活细胞打印相结合,成为人们优先解决的重点,以兴起新一代骨组织工程,成为研究热点。
6.目前,组织工程对于多孔材料的机械性能要求较高,使得用于制备多孔骨支架的材料选择受到限制,而具有高机械强度的材料往往熔点较高,很难实现与活细胞同步打印。因此,现有的搭载活细胞的多孔支架材料中,活细胞与多孔支架材料之前是相互独立的,活细胞仅仅是依附在多孔支架材料表面,并未实现真正意义上的仿生骨组织工程材料的制备。
7.故此,中国科技部“增材制造与激光制造”重点专项2018年度项目申报指南中的项目1.6多细胞精准3d打印技术与装备(重大共性关键技术类)的设立的考核指标之一“保证85%以上细胞存活不小于10天”。先解决细胞存活,才有可能发挥细胞的生物学功能,完成临床治疗重任。
8.因此,发现和构建体内成骨生物微环境,是赋予生物材料和细胞一体化3d生物打印复合结构成为骨修复功能模块的前提,高质量开展其被移植到体内后骨形成和骨重建工程,完美完成骨组织再生修复,建立临床应用的行业标准。
9.此外,骨组织是经多种骨类细胞与骨基质经生物矿化形成的,其形成过程复杂,与多种骨类细胞的生理活动有关,而现有负载活细胞的骨组织材料中选用的仅包含单一种类细胞,其成骨分化能力欠佳,不利于早期骨整合。
10.鉴于此,特提出本发明。
技术实现要素:
11.本发明的目的在于,提供一种新型生物材料与细胞一体化三维生物打印方法,及应用该方法制备得到骨缺损修复材料。所述三维生物打印方法用多喷头协同打印方式,通过控制不同喷头的打印温度,实现生物材料和细胞的交替平行打印、逐层排列,仿生构建具有孔道连通结构的类骨硬组织模块。
12.本发明的另一个目的在于,提供一种活体细胞嵌合于多孔类骨硬组织模块中的骨缺损修复材料,通过负载的细胞营造适宜生物微环境,实现结构、组成和功能上的仿生骨组织的目的。
13.本发明还有一个目的在于,提供上述类骨硬组织模块和骨缺损修复材料在制备硬组织替换和/或修复材料的产品中的应用。
14.为了解决上述技术问题,实现上述目的,本发明提供以下技术方案:
15.第一方面,本发明提供一种硬材料与细胞一体化三维打印方法,包括高强度生物医用材料与细胞一体化同步三维打印制备类骨硬组织模块的方法;
16.所述高强度生物医用材料是指压缩强度在2mpa及以上的硬材料;
17.所述高强度生物医用材料以硬材料束的形式进行打印,所述细胞以细胞束的形式进行打印;
18.所述一体化三维打印方法包括,利用多喷头交替打印硬材料束和细胞束,使硬材料束和细胞束平行排列成层,再逐层打印成具有孔道的立体结构,相邻两层之间硬材料束和细胞束相互垂直,得到立体的类骨硬组织模块;
19.所述多喷头包括至少两个喷头,即材料打印喷头和细胞打印喷头;
20.所述细胞包括营造成骨微环境的细胞。
21.所述营造成骨微环境的细胞是指,某一种细胞通过激活或抑制某一个或多个细胞信号通路,实现一种或多种成骨因子的过表达或抑制表达,从而对修复组织区域内其他与成骨有关细胞的增殖、分化或代谢过程产生正向影响,最终使得多种细胞与其表达产物共同构成有利于成骨的组织微观环境。
22.在可选实施方式中,所述营造成骨微环境的细胞包括与骨组织形成有关的细胞;
23.优选地,所述营造成骨微环境的细胞包括骨髓基质细胞、骨祖细胞、前成骨细胞、成骨细胞、骨衬细胞、骨细胞或破骨细胞中至少一种细胞或两种以上细胞组合;
24.优选地,所述营造成骨微环境的细胞为骨髓基质细胞或者骨细胞或者两者的组合;
25.优选地,所述骨细胞为wnt信号激活骨细胞,用于营造成骨微环境,促进骨髓基质
细胞的增殖、成骨分化以及生物矿化,促进破骨细胞的分化,促进骨的再生修复;
26.优选地,所述wnt信号激活的方法,包括生物医用材料、小分子药物、蛋白质、多肽中的一种或两种及以上成分激活经典wnt/β-catenin信号;
27.优选地,所述wnt信号激活骨细胞与骨髓基质细胞数量比为1:(2~8);
28.优选地,所述wnt信号激活骨细胞与骨髓基质细胞的数量比为1:4;
29.优选地,所述骨细胞过表达至少一种成骨生物微环境因子;
30.优选地,所述成骨生物微环境因子包括notch配体delta-like 4。
31.在可选的实施方式中,所述硬材料束的打印方法包括,高强度生物医用材料依次经熔融和螺杆挤出得到硬材料束;和/或所述细胞束的打印方法包括,包裹细胞的水凝胶或生物墨水经气压驱动挤出得到细胞束。
32.优选地,所述硬材料熔融温度为30~200℃,所述硬材料束打印温度为30~200℃。
33.优选地,所述细胞束的打印温度为4~37℃。
34.所述的一体化三维打印是指,在三维打印过程中,随着片层的堆叠,高强度生物医用材料和细胞的增材过程是同步进行的。本发明通过对三维打印的温度在4℃~100℃之间进行梯度调节,使得在同一三维打印空间内能够实现不同高温(>60℃)硬材料束或者低温(<60℃)的材料束和低温(<37℃)细胞束的协同打印,因此,细胞能够按照程序设定嵌合于生物材料内。
35.所述三维打印的打印速度为2~10mm/s。
36.所述的打印速度根据硬材料束和细胞束的性能确定,一般硬材料束的打印速度为2~5mm/s,细胞束的打印速度为5~10mm/s。
37.第二方面,本发明提供前述实施方式任一项所述打印方法得到的类骨硬组织模块,所述类骨硬组织模块包括力学支架用的材料单元、成骨功能用的细胞单元和孔道;所述材料单元与细胞单元在类骨硬组织模块中的体积比为1:0.5~2,所述类骨硬组织模块的孔隙率为20%~80%。
38.所述类骨硬组织模块中细胞不仅粘附于类骨硬组织模块表面,嵌合于类骨硬组织模块内部,同时以仿生正常骨组织为目的,还能够实现针对不同的骨组织,构建不同的类骨硬组织模块和细胞单元的分布方式,以及类骨硬组织模块的孔隙率。
39.优选地,所述孔道包括通孔、埋孔或盲孔中的一种或两种以上组合。
40.优选地,所述孔道的打印方法包括,相邻的硬材料束和细胞束分隔形成,或者,打印孔道形成材料,打印完成后,去除孔道形成材料形成孔道。
41.优选地,所述孔道形成材料包括牺牲材料。
42.优选地,所述牺牲材料包括f127。
43.所述孔道可以直接控制打印平台,精准打印材料束和细胞束后自然形成立体的孔道结构,也可以使用孔道形成材料,比如将牺牲材料f127(聚氧乙烯聚氧丙烯醚嵌段共聚物)打印成束,打印结束后,在溶液中洗去,其原本占据的空间位置则为功能模块中的孔道结构。
44.所述孔道作为营养组分运输和代谢产物去除通道,以及成骨细胞分泌的胶原蛋白和移植到体内后自然和诱导形成的血管之间的空间,其分布方式也以仿生骨组织结构为目的均匀地设置在类骨硬组织模块中。
45.在可选的实施方式中,所述材料单元包括含有羟基磷灰石的复合高分子。
46.优选地,所述羟基磷灰石的颗粒尺寸为纳米级。
47.羟基磷灰石是骨组织中重要的矿物组分,也是生物材料中应用最广的、具有良好生物活性及生物相容性的无机材料。复合高分子支架中加入羟基磷灰石能够显著提升支架的生物学性能,还能够提高支架的硬度、抗压强度和耐磨性能等机械性能,且提升效果随着羟基磷灰石颗粒尺寸减小而增强。
48.优选地,所述复合高分子采用的高分子材料包括聚己内酯及其衍生的共聚高分子中的一种或两种以上组合。
49.优选地,纳米羟基磷灰石与高分子材料的质量比为1:(4~9)。
50.优选地,纳米羟基磷灰石与高分子材料的质量比为1:9。
51.本发明提供的复合高分子支架材料熔点低,能够满足与细胞同时打印的需求,同时,羟基磷灰石的加入,还使得其具有比强度高的特点,能够弥补细胞单元嵌合对骨修复功能模块力学强度的弱化作用。
52.在可选的实施方式中,所述细胞单元包括包裹细胞的水凝胶或生物墨水,所述细胞在生物墨水或水凝胶中的密度为1
×
105~1
×
107个/毫升,优选为1
×
106个/毫升。
53.优选地,所述生物墨水或水凝胶含有固型分子。
54.优选地,所述固型分子包括甲基丙烯酰化明胶。
55.骨细胞占正常骨组织细胞的90%以上,在骨发育和维持骨稳态中发挥重要的调节作用。与野生的骨细胞相比,激活wnt信号后的骨细胞,不仅扩增干细胞,还能促进成骨分化,并激活破骨细胞的功能。因此,采用wnt激活骨细胞结合生物墨水能够达到构建生物微环境的目的,从而能够促进骨髓基质细胞的增殖、成骨分化,激活缺损部位破骨细胞功能,促进骨再生修复骨缺损。
56.所述的水凝胶或生物墨水包括,含有青霉素-链霉素和/或胎牛血清的细胞完全培养基,可选的完全培养基包括α-mem培养基。例如,按照体积百分比,含有10%胎牛血清的α-mem培养基,按照质量百分比,含有50~100u/ml青霉素和50~100μg/ml链霉素。胎牛血清可为8%~20%。可选地,所述生物墨水或水凝胶还含有固型分子,可选地,所述固型分子包括甲基丙烯酰化明胶。
57.本发明提供的水凝胶或生物墨水在交联成型后能在体外稳定形态达到28天以上;保持细胞的存活率高于89%,并维持细胞的高增殖活性。
58.本发明提供的生物墨水既包含细胞增殖和分化所需要的营养成分,同时,在三维打印制备过程中对细胞活性起到保护作用,避免细胞因受剪切力或受热而活力降低,甚至失活。
59.第三方面,本发明提供一种骨缺损修复材料,包括骨修复功能模块和骨类器官,所述骨缺损修复材料的制备方法包括,采用前述实施方式任一项所述一体化三维打印方法制备得到的类骨硬组织模块,或者前述实施方式任一项所述的类骨硬组织模块,经体外培养后得到骨缺损修复材料。
60.优选地,所述体外培养的条件包括,类骨硬组织模块在体积比为5%二氧化碳、温度为37℃培养箱或生物反应器中采用细胞培养基培养7~30天。
61.优选地,所述细胞培养基为细胞完全培养基,培养后得到的骨缺损修复材料为骨
修复功能模块。
62.优选地,所述骨修复功能模块经过成骨分化培养基培养,得到的骨缺损修复材料为矿化的骨类器官。
63.优选地,所述成骨分化培养基含有地塞米松、维生素c和β甘油磷酸钠。
64.在可选的实施方式中,所述骨缺损修复材料包括骨细胞过表达成骨生物微环境因子的骨修复功能模块,所述骨细胞过表达成骨生物微环境因子骨修复功能模块中的骨细胞过表达至少一种成骨生物微环境因子。
65.优选地,所述成骨生物微环境因子包括notch配体delta-like 4(dll4)。
66.在可选的实施方式中,所述delta-like 4作为notch信号配体,激活靶细胞的经典notch信号通路。
67.优选地,所述靶细胞包括骨祖细胞、前成骨细胞、成骨细胞、骨衬细胞或骨髓基质细胞中的至少一种。
68.骨细胞过表达的dll4为notch信号配体,为notch信号提供方,通过靶细胞上的notch信号受体,激活靶细胞里依赖于notch信号转录因子rbpjκ的经典notch信号,促进靶细胞体外存活、增殖、成骨分化、矿化。含有notch信号受体的靶细胞包括骨祖细胞、前成骨细胞、成骨细胞、骨衬细胞和骨髓基质细胞等。靶细胞被激活后,产生notch信号传递者notch受体胞内片段nicd,nicd进入细胞核,从而激活notch信号转录因子rbpjκ,启动notch信号hes/hey家族等靶基因的转录和表达,从而促进靶细胞细胞增殖、分化并快速形成骨,同时促进内皮细胞形成血管。
69.常规notch信号的激活方法,包括使用生物医用材料、小分子药物、蛋白质、多肽中的一种或两种及以上的成分激活靶细胞的经典notch信号。
70.第四方面,本发明提供采用前述实施方式任一项所述的硬材料与细胞一体化三维打印方法制备得到的类骨硬组织模块、前述实施方式任一项所述的类骨硬组织模块、前述实施方式任一项所述的骨缺损修复材料在制备组织替换和/或修复材料的产品中的应用;
71.所述组织替换和/或修复材料的产品在体外培养时,细胞在组织替换和/或修复材料的产品表面具有高存活率和增殖活性,可成功实现成骨分化和生物矿化;植入动物体内后,具有骨形成和骨吸收双重代谢功能、促血管和神经生成功能;
72.所述组织包括硬组织结构或软组织中的骨架结构。
73.本发明具有以下有益效果:
74.本发明提供硬材料与细胞一体化三维打印方法,该方法通过多喷头交替打印硬材料束和细胞束,实现了硬材料和细胞的一体化三维交替、逐层打印,从而完成了真正意义上的仿生骨组织构建类骨硬组织模块,能够根据病人特定缺陷和特定临床需求进行订制。
75.通过培养上述制备方法得到的类骨硬组织模块得到的骨修复功能模块或者类骨器官中,实现了细胞与生物材料的初步整合,并形成了初步的成骨分化和生物矿化,具有一定的生物功能,同时降低了骨缺损修复材料植入后存在的早期应力屏蔽作用,与直接植入类骨硬组织模块相比,进一步促进了早期骨整合,特别适用于制备硬组织替换或修复材料产品。
76.与现有技术相比,本发明的特殊性在于,本发明提供的类骨硬组织模块,能够形成骨修复功能模块、骨类器官,具有骨形成(成骨细胞的功能)和骨吸收(破骨细胞的功能)的
基本代谢功能,同时也能够形成大量血管,以保证器官养分供给和代谢物质的有效运送。此外,经过体外培养,上述的类骨硬组织模块可实现体外成骨分化、矿化为骨类器官,直接用于特殊条件下的骨缺损修复。
附图说明
77.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
78.图1为本发明具体实施方式中提供的打印机的外观图和内部结构示意图;
79.图2为本发明提供的打印方法能够用于打印的硬组织修复材料示例;
80.图3为实施例1实验流程示意图;
81.图4为实施例1、对比例1和对比例2碱性磷酸酶活性定性检测结果;
82.图5为实施例4、对比例4和对比例6碱性磷酸酶活性定性检测结果;
83.图6为实施例1、对比例1和对比例2碱性磷酸酶活性定量检测结果;
84.图7为实施例4、对比例4和对比例6碱性磷酸酶活性定量检测结果;
85.图8为实施例1、对比例1和对比例2成骨相关基因表达结果对比;
86.图9为实施例4、对比例4和对比例6成骨相关基因表达结果对比;
87.图10为实施例1体外培养得到的骨修复功能模块性能对比;
88.图11为实施例1~3细胞增殖活性对比;
89.图12为实施例1、对比例1和对比例2细胞增殖活性对比;
90.图13为实施例1和实施例5细胞存活效果与成骨分化程度对比;
91.图14为小鼠模型实施例1与对比例1和2植入前、后对比;
92.图15为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的micro-ct检测结果;
93.图16为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的骨组织形态学对比;
94.图17为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的骨基质分析对比;
95.图18为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的骨形成能力对比;
96.图19为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的破骨细胞染色对比;
97.图20为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的血管形成能力对比;
98.图21为小鼠模型植入后实施例1与对比例1和2顶骨缺损修复的外周神经形成能力对比;
99.图22为实施例1与对比例1和2体外生物矿化检测结果对比;
100.图23为实施例4与对比例4和6体外生物矿化检测结果对比;
101.图24为实施例4与对比例4和6的成骨分化功能与药物抑制bmsc的notch信号的关系测定结果对比;
102.图25为rbpjκ
f/f
小鼠bmsc原代细胞的rbpjκ基因敲除前后对notch信号与成骨分化关系的测定结果对比;
103.图26为实施例4与对比例6对rbpjκ
f/f
小鼠bmsc原代细胞的rbpjκ基因敲除前后的notch信号与成骨分化关系的测定结果对比;
104.图27为实施例4与对比例4和6的促进血管生成功能的测定结果对比。
具体实施方式
105.为使本发明实施例的目的、技术方案和优点更加清楚,下面结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部实施例。此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
106.因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
107.应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
108.在一次具体实施方式中,本发明提供了图1所示的硬材料与细胞一体化三维生物打印机,图1中a为打印机的外观图,b为程序控制的内部结构图,其中b1为三轴工作台,b2为螺杆挤出单元,连接的硬材料束打印喷头中设有螺杆挤出装置,螺杆挤出装置外设有加热单元,用以打印硬材料束(d),b3为气压驱动单元,连接的细胞束打印喷头用来打印细胞束(a和b)或牺牲材料(c)。b4为光源,包括照明光源、杀菌光源或者其他功能性光源。b5为温控系统,在打印平台下方,用来调节打印不同材料时打印平台的温度。图1中c为硬材料束(d)、细胞束(a和b)和牺牲材料束(c)打印完的示意图,其中牺牲材料束(c)经过溶液洗除得到的对应孔道。
109.上述打印机能够实现多种硬组织修复材料的打印,适用于长骨包括股骨、胫骨、肱骨、尺骨、桡骨以及半月板、顶骨等的制备,举例如图2所示,其中a为使用上述打印机打印得到的股骨头材料,其中a1为股骨头的三维建模示例,a2为使用上述打印机打印得到的股骨头材料实物照片,a3为a2的横断面示意图,可见均匀打印的材料束。b为使用上述打印机打印得到的半月板实物照片。c为打印的表达gfp的细胞在荧光显微镜下的检测结果,可以看出活细胞在水凝胶里均匀分布、生长良好。说明采用上述打印机打印得到的活细胞能够实现正常生长。
110.下面结合附图,对本发明的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
111.实施例1
112.本实施例针对野生型c57bl-6小鼠顶骨直径4.5毫米临界骨缺损模型,提供了一种高强度生物医用材料与细胞通过一体化三维打印制备得到的类骨硬组织模块,所述一体化三维打印方法使用的设备如图1所示,打印方法包括以下步骤:
113.1.1硬材料物料的制备
114.称取18g聚己内酯和2g纳米羟基磷灰石混匀装入螺杆挤出装置,首先加热至95℃,使得聚己内酯和羟基磷灰石变为流动相,得到硬材料物料。
115.1.2水凝胶的配置
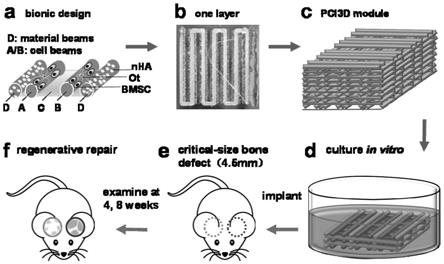
116.无菌条件下,向含有体积分数为10%的胎牛血清和终浓度为50u/ml青霉素和50μg/ml链霉素的α-mem培养基中添加甲基丙烯酰化明胶(gelatin methacryloyl,gelma)浓度为20%(w/v),加入蓝光交联剂(lap)浓度为20%(v/v),于37℃下搅拌至无沉淀,使用0.22μm滤膜过滤除菌后,添加甘油浓度为10%(v/v),并于37℃下搅拌1h。所述甲基丙烯酰化明胶加入等体积的细胞悬液后的终浓度为100mg/ml。
117.1.3细胞悬液的配置
118.(1)将培养状态良好的原代骨髓基质细胞和wnt信号激活骨细胞分别去除上清液,用pbs液洗涤2次。
119.(2)分别加入1ml 0.25%胰酶,在37℃细胞培养箱中,消化5min。
120.(3)轻轻吹打细胞,收集细胞悬液、850rpm离心5min。
121.(4)去上清,加入适量细胞培养基重悬,计数备用。
122.(5)按照wnt激活骨细胞与骨髓基质细胞细胞数量比1:4的比例混匀,制备成细胞密度为2.0
×
106个/ml的细胞悬液备用。
123.1.4细胞打印液的制备
124.取1ml水凝胶与1ml细胞悬液均匀混合得到细胞密度为1
×
106个/ml的细胞打印液,37℃保存,打印前4℃预冷10分钟。
125.1.5类骨硬组织模块的三维打印
126.(1)采用micro-ct扫描小鼠骨缺损区域,并用mimics软件处理ct扫描结果,建立骨缺损区域的三维模型,并保存为.stl格式文件。
127.(2)将上述文件导入一体化三维生物打印机,一体化生物打印机的结构示意图如图1所示,根据材料强度要求设计,实验需要构建具有机械力学支撑功能的支架,提供细胞生长的空间,构建功能模块模型,保存为gcode的程序文件。
128.(3)设置打印相关参数,包括温度、速度和高度。打开gcode文件,开始打印,硬材料束的打印温度为80℃,细胞束的打印温度为27℃。
129.(4)细胞打印后,将图1中的光源(b4)调节为蓝光灯,对得到的类骨硬组织模块内水凝胶进行蓝光交联。交联结果,如图3中b所示,可以看出,本实施例打印得到的一个层面显示硬材料成束排列均匀,且细胞束内细胞生长良好、分布均匀(如图2中c所示)。
130.(5)将类骨硬组织模块置于37℃、5%co2培养箱中,使用完全培养基培养14天,得到骨修复功能模块(如图3中d的所示)。
131.(6)将步骤(5)得到的骨修复功能模块植入构建的顶骨直径4.5毫米临界骨缺损野生型c57bl/6小鼠模型中,并在植入后4周和8周进行系列检测。
132.本实施例的实验过程如图3所示,图中a为硬材料束和细胞束交替打印设计,b为三维打印得到的硬材料束和细胞束的一层实物图,c为层间累积打印得到的类骨硬组织模块示意图。打印得到的类骨硬组织模块在细胞培养板内培养(图3中d)后,得到的骨修复功能模块植入小鼠顶骨临界骨缺损(>4mm)处,植入后第四周和第八周评定其修复功能(图3中e和f)。
133.实施例2
134.本对比例与实施例1的区别在于,本对比例中细胞密度为1
×
105ml。
135.实施例3
136.本对比例与实施例1的区别在于,本对比例中细胞密度为1
×
107ml。
137.实施例4
138.本实施例与实施例1的区别在于,将wnt激活骨细胞替换为过表达dll4的骨细胞。未使用牺牲材料。
139.实施例5
140.本实施例与实施例1的区别在于,水凝胶中未加入甲基丙烯酰化明胶。
141.对比例1
142.本对比例与实施例1的区别在于,本对比例中仅选用了单一的骨髓基质细胞,记为对照组。
143.对比例2
144.本对比例与实施例1的区别在于,本对比例中选用了骨髓基质细胞和未激活wnt信号的野生骨细胞,记为野生组。
145.对比例3
146.本对比例与实施例1的区别在于,材料单元前驱液中未加入羟基磷灰石。
147.对比例4
148.本对比例与实施例4的区别在于,将wnt激活的骨细胞替换为过表达dll1的骨细胞。
149.对比例5
150.本对比例与实施例4的区别在于,将wnt激活的骨细胞替换为过表达dll3的骨细胞。
151.对比例6
152.本对比例与对比例4的区别在于,所属骨细胞还转染了gfp基因过表达的重组慢病毒。
153.过表达dll1、dll3、dll4或gfp基因过表达的骨细胞的构建方法如下:
154.将含有dll1、dll3、dll4或gfp基因的重组慢病毒以100的感染复数(moi)与7μg/ml聚凝胺分别转染到mlo-y4细胞中。每种慢病毒感染的效率由培养72小时后gfp荧光的强度决定。然后使用含有0.5μg/ml嘌呤霉素的培养基筛选,消除未转染成功的细胞。
155.实验例
156.采用以下检测方法对上述实施例和对比例得到的类骨硬组织模块、骨修复功能模块或骨类器官进行检测。
157.1、碱性磷酸酶活性定性检测
158.实施例和对比例得到的类骨硬组织模块在培养箱中培养7天和14天后,采用染色法对培养得到的骨修复功能模块中的细胞的碱性磷酸酶活性进行定性检测,具体的检测方法参考文献“tu x et al(2007)noncanonical wnt signaling through g protein-linked pkcδactivation promotes bone formation.dev cell 12(1):113
–
27”。
159.实施例1、对比例1和对比例2进行了碱性磷酸酶活性定性检测,结果如图4所示,由
appl mater interfaces.10(6):5240-54”。
179.(1)麻醉:用3.6%水合氯醛(sigma-aldrich),腹膜内注射(8μl/g),麻醉小鼠;
180.(2)定位:使用立体定位装置(stoelting,wood dale,il,usa)固定;
181.(3)消毒:使用剃须刀剃掉毛发,碘伏消毒皮肤;
182.(4)切口:使用11swann手术刀行中线头皮切口,依次切开皮肤、筋膜、露出顶骨;
183.(5)钻孔:用电动牙科环钻(4.5mm)钻取骨块,待要完全取下时,用注器针头轻轻挑开骨块、取出。
184.(6)植入:将外形尺寸一致的骨修复功能模块移植到缺损处;
185.(7)固定:用手术缝合线固定模块与周围骨组织。小鼠模型植入前后对比图如14所示。图14中a为术前植入位置、骨修复功能模块与其直径大小为(4.5mm);b为植入4周和8周后植入物实物图对比;
186.(8)消毒缝合:用手术缝合线缝合皮肤,消毒切口;
187.(9)观察:待老鼠苏醒后,放回笼中,隔天观察。
188.(10)术后4周和8周后,对骨愈合情况进行如下检测:
189.a.骨缺损修复功能评定-micro-ct检测
190.对术后4周和8周的小鼠进行micro-ct检测,并依据扫描结果进行骨量分析。结果如图15所示,图中绿色虚线圈代表对比例1;黄色虚线圈代表对比例2;红色虚线圈代表实施例1。可以看出术后4周和8周,本发明实施例1提供的骨修复功能模块中生成的骨量均为最多,第8周。对比例1,新骨生成量最少,4周时几乎没有生成骨。说明骨修复功能模块具有很好的体内成骨功能,修复不能仅依靠自身就能修复的临界骨缺损。
191.b.骨缺损修复功能评定-骨组织形态学分析
192.骨组织经固定、脱钙、石蜡包埋后,进行组织切片、h.e.染色。h.e.染色可以对染色质、细胞质和胞外基质、软骨基质进行颜色区分,从而开展新生骨组织形态学、骨量和骨的细胞数量等统计学分析,结果如图16所示。图16中a~c和e~g为顶骨缺损处纵切面h.e.染色图,虚线部分为硬材料区域,绿色和蓝色线框分别是术后4周和8周时生成的新骨,及其放大的材料来源的新骨,放大后可见成骨细胞(绿色箭头所指)。图16中的d和h为测定结果,显示出骨量(bv/tv)以及成骨细胞数量的分析结果,看到具有wnt激活骨细胞的骨修复功能模块植入后无论在4周或者8周,成骨细胞数量和骨量均显著高于对比例1和对比例2。
193.c.骨缺损修复功能评定-骨基质胶原蛋白分析
194.获取培养4周和8周后小鼠的顶骨缺损处纵切片,采用免疫组化法对纵切片中的ⅰ型胶原蛋白进行检测,并采用天狼星红染色法在偏振光显微镜检测ⅰ型胶原蛋白。结果如图17所示。图17中的a为免疫组化检测结果(褐黄色),b为偏振光下检测结果(红黄色)。可以看出,植入本发明实施例1提供的骨修复功能模块的ⅰ型胶原分泌量最多,远高于对比例1和高于对比例2。
195.d.骨缺损修复功能评定-骨形成原位检测
196.采用新骨标记物钙黄绿素和茜素红分别标记小鼠7天和5天后,获取不脱钙的植入后4周和8周的小鼠顶骨缺损处纵切片,用各自敏感的荧光成像,如图18所示。实施例1无论在荧光强度还是标记的长度上以及红黄标记线间距上均远高于对比例1和2。说明实施例1的骨形成速度加快。
197.e.骨缺损修复功能评定-破骨细胞染色
198.trap染色将骨组织切片中的破骨细胞染为紫红色,背景染色为青或绿色,并依据染色结果进行统计学分析,结果如图19所示。可以看出实施例1的骨细胞wnt激活后,第4周形成了一定量的破骨细胞,显著多于对比例2,而此时的对比例1几乎没有出现破骨细胞;到了第8周,则形成了大量的破骨细胞,密度相似于正常骨表面的破骨细胞密度,多于对比例2达1.4倍,多于对比例1高达3.9倍。此时,对比例1骨中仅现少量破骨细胞,其密度低于正常的骨表面。说明骨细胞wnt激活后,促进了成破骨细胞分化,使得人工骨具有代谢功能。具有代谢功能的骨不但有利于骨再生,更有利于骨的健康。
199.f.骨缺损修复功能评定-血管形成分析
200.在对小鼠模型的顶骨纵切片进行染色后发现实施例1的血管长入增多,而后用骨形态分析显微镜获取图片,根据图片结果对血管数量和面积进行分析,结果如图20所示。可以看出实施例1的血管数量和面积均远远高于对比例1和2。
201.g.骨缺损修复功能评定-外周神经形成分析
202.在对小鼠模型的顶骨纵切片进行外周神经标志物β3-tubulin免疫染色后,发现实施例1的外周神经长入增多,结果如图21所示。
203.7、骨形成钙结节检测
204.使用0.1%茜素红-tris-hcl染液对10%中性福尔马林固定后的术后4周的切片样本进行染色,茜素红与钙发生显色反应,生成深红色化合物,并结合冰冻切片检测,样本的矿化情况,以表征骨结节的形成。具体实验步骤参见文献“tu x et al(2007)noncanonical wntsignaling through g protein-linked pkcδactivation promotes bone formation.dev cell 12(1):113
–
27”和“venugopal,jr et al(2011)osteoblast mineralization with composite nanofibrous substrate for bone tissue regeneration.cell biol int 35(1):73-80”。
205.对实施例1、对比例1和2进行上述检测,结果如图21所示,可以看出本发明实施例1的骨修复功能模块在培养7天后,改由成骨诱导培养基培养至第21天,已经形成了骨结节,明显多于对比例1和2。
206.对实施例4、对比例4和6进行上述检测,骨细胞dll4功能模块里骨结节形成实验结果也显示出矿化程度高于这两个对照组(如图22所示)。
207.8、骨细胞过表达dll4的类骨硬组织模块的成骨功能与机制探究
208.a.骨细胞过表达dll4类骨硬组织模块的成骨功能检测
209.骨细胞mlo-y4过表达notch配体dll4与骨髓基质细胞st2共培养时,显著促进其成骨分化。无论是碱性磷酸酶染色(图5)、生化活性测定(图7),还是成骨细胞基因表达(图9)均显著增加,并促进骨结节形成(图23)。表明实施例4骨修复功能模块矿化程度增加。
210.b.骨细胞dll4激活的notch信号对类骨硬组织模块的成骨功能的关系测定。
211.向实施例4、对比例4~6中加入notch信号抑制剂dapt抑制类骨硬组织模块的notch信号时,测得dapt抑制成骨分化及降低notch信号的情况,检测结果如图24所示。其中a和b分别为碱性磷酸酶活性定性和定量测定结果,c为与成骨细胞标志基因表达变化情况,d为notch信号通路靶基因表达变化情况,由图中可以看出,dapt显著抑制了对比例4~6无dapt时细胞本底碱性磷酸酶活性,部分抑制了骨细胞dll4增强的碱性磷酸酶活性(图24中
a-b),完全抑制了骨细胞dll4增强的成骨细胞标志基因的表达(图24中的c),同时notch信号受到完全的抑制。表明骨细胞dll4通过notch信号促进成骨分化。
212.c.骨细胞dll4是通过靶细胞rbpjκ介导的经典notch信号促进成骨分化
213.将notch信号转录因子rbpjκ的基因修饰小鼠(rbpjκ
f/f
)的c57bl/6品系原代bmsc提取出来,使用由ad-easy系统构建的两株重组腺病毒ad-cre和ad-gfp(对照)分别转染原代bmsc细胞,实现了体外敲除rbpjκ基因,从而终止notch信号的传递。转染的ad-gfp为ad-cre的对照组。检测结果如图25所示,图中a为荧光显微镜检测结果,证明两株重组腺病毒成功转染bmsc细胞,且转染程度相当;b为notch信号通路靶基因表达情况,可以看出敲除rbpjκ基因后,notch信号通路靶基因表达量显著降低;c为碱性磷酸酶活性定性检测结果,敲除rbpjκ基因后,bmsc的碱性磷酸酶活性显著降低;d为与成骨细胞标志基因的表达情况,可以看出敲除rbpjκ基因后,成骨细胞标志基因的表达水平显著降低,从而证明了没有rbpjκ介导的经典notch信号,bmsc失去了成骨分化的功能。
214.而后,将上述转染后的原代bmsc与过表达dll4的骨细胞系进行共培养,设置ad-cre mlo-y4-gfp、ad-cre mlo-y4-dll4和ad-gfp mlo-y4-dll4三个实验组,判断其成骨效果以及notch信号激活情况。结果如图26所示,图中a为三个实验组的notch信号靶基因表达水平检测,可以看出骨细胞dll4不能提升rbpjκ敲除后的bmsc的notch信号强度;b为碱性磷酸酶活性定性检测结果,看到骨细胞dll4不能提升rbpjκ敲除后的bmsc的碱性磷酸酶活性;图中c为成骨细胞标志基因的表达情况对比,可以看出骨细胞dll4不能提升rbpjκ敲除后的bmsc的成骨分化。
215.从以上实验结果可以看出,无论是dapt药物还是rbpjκ敲除,均大大降低了notch信号,同时也把成骨分化降低到很低的水平,证明了骨细胞dll4作为独立的骨细胞成骨微环境因子通过激活靶细胞的notch转录因子rbpjκ介导的经典notch信号而促进成骨。
216.d.骨细胞过表达dll4促进成血管分析
217.将人脐静脉内皮细胞(huvec)和实施例4、对比例6中提供的转染后的骨细胞进行混合接种,而后对成血管能力进行考察,具体的实验步骤参见文献“zhang q et al(2019)ace2inhibits breast cancer angiogenesis via suppressing the vegfa/vegfr2/erk pathway.jexp clin cancer res 38:173”。实验结果如图27所示,图中a为huvec成血管试验,b为成血管方式分析。结果表明,没有骨细胞参与,仅仅是huvec细胞,成血管能力很差。野生型骨细胞有一定能力的成血管能力,但不如骨细胞过表达dll4的成血管能力强。
218.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。