rnai-smiaa14,并将重组质粒通过电击转化的方式转化入根癌农杆菌gv3101;构建smiaa14的pmdc83过表达及rnai的重组载体的方法为:
12.通过spe i、asc i双酶切构建smiaa14过表达载体,通过asci、bamh i及kpn i、xba i两组双酶切构建smiaa14 rnai载体,所述的构建smiaa14过表达和rnai载体所用的引物序列为seq id no.3和seq id no.4。
13.步骤四:所述含有重组载体的根癌农杆菌gv3101转化丹参组培苗,获得转基因再生植株;通过ctab法提取转基因植株dna并通过载体特异性的引物筛选转基因阳性植株,鉴定引物的上下游核苷酸序列如seq id no.5和seq id no.6所示。
14.步骤五:通过测定丹参根系形态相关指标揭示smiaa14过表达和rnai对丹参根系形态的影响,揭示smiaa14过表达和rnai对丹参根系发育的影响;
15.步骤六:通过hplc对smiaa14过表达和rnai植株根部丹参酮含量进行测定,揭示smiaa14过表达和rnai对丹参根系丹参酮含量及丹参酮类成分合成积累相关基因表达的影响;
16.步骤七:通过荧光定量pcr对smiaa14过表达和rnai植株生长素信号转导途径上根系发育相关基因及丹参酮类成分合成积累相关基因进行定量分析,揭示smiaa14过表达和rnai对丹参生长素信号转导途径上根系发育相关基因表达的影响。
17.丹参smiaa14基因,该基因的cds核苷酸序列如seq id no.1所示。
18.上述丹参smiaa14基因编码的蛋白质,其氨基酸序列如seq id no.2所示。
19.含有上述smiaa14基因的质粒在本发明的保护范围之内。
20.上述丹参smiaa14基因在调控丹参根系形态中的应用在本发明的保护范围之内。
21.进一步地,所述的调控丹参根系形态是使丹参的根系变长、根系生物量变大。
22.进一步地,所述的丹参smiaa14基因在提升丹参酮含量中的应用在本发明的保护范围之内。
23.进一步地,所述的丹参smiaa14基因在调控丹参根系形态和提升丹参酮含量中的应用在本发明的保护范围之内。
24.本发明通过基因沉默的方法使smiaa14基因在丹参中不表达,从而达到调控丹参根系形态和提升丹参酮含量的目的。
25.具体方法如下:
26.(1)以seq id no.:10和seq id no.:11为引物、smiaa14基因为模板,pcr扩增得到smiaa14短片段序列,将smiaa14短片段序列连接至peasy-blunt质粒,得到peasy-smiaa14-rnai质粒;
27.(2)以xba i、bamh i分别酶切peasy-smiaa14-rnai质粒及pmdc83-rnai质粒,胶回收smiaa14片段和线性化pmdc83-rnai质粒,连接,得到重组质粒pmdc83-smiaa14-1-rnai;
28.(3)以kpn i、nco i分别酶切peasy-smiaa14-rnai质粒及重组质粒pmdc83-smiaa14-1-rnai,胶回收smiaa14片段及线性化重组质粒pmdc83-smiaa14-1-rnai,连接,得到smiaa14基因沉默载体pmdc83-smiaa14-rnai;
29.(4)将pmdc83-smiaa14-rnai质粒转化至农杆菌感受态gv3101,得到重组农杆菌;
30.(5)用步骤(4)得到的重组农杆菌转化丹参组织并诱导愈伤分化,得到smiaa14基因沉默的丹参株系。
31.有益效果:
32.(1)本发明从丹参中克隆出了丹参smiaa14基因,对其cds序列进行生物信息学分析,并获得了其过表达及rnai转基因植株。
33.(2)经一系列实验证明,通过对丹参中的smiaa14进行rna沉默表达,能够促进丹参根系伸长和地下部分生物量的增加。与野生型丹参相比,smiaa14rnai株系中的地下部分鲜重和地下部分干重明显(p<0.05)增加,一级侧根数和二级侧根数明显(p<0.05)减小而根长(p<0.05)明显增加。
34.(3)经一系列实验证明,通过对丹参中的smiaa14进行rna沉默表达,能够促进丹参酮的积累。与野生型丹参相比,smiaa14 rnai株系中丹参酮i、丹参酮iia及二氢丹参酮i的含量均显著(p<0.05)上升,说明在丹参中smiaa14对丹参酮类成分的合成起负调控作用,rnai沉默smiaa14能够促进丹参酮的积累。
35.这一系列发现表明,smiaa14在丹参根系发育和丹参酮合成中发挥着重要作用,也为后续探究丹参根系形态和有效成分的相关性提供思路。
附图说明
36.图1:smiaa14氨基酸序列多重比较。
37.图2:smiaa14与其他植物中iaa14蛋白的进化树分析。
38.图3:smiaa14蛋白的亚细胞定位。
39.图4:smiaa14过表达和rnai载体示意图。
40.图5:smiaa14基因在转基因丹参株系中的表达量。
41.图6:转基因丹参株系地上部分和根系形态外观图片。
42.图7:转基因丹参株系根系形态指标。
43.图8:转基因丹参株系丹参酮含量。
具体实施方式
44.以下结合附图和实施例,对本发明进行进一步详细说明。根据以下描述和这些实施例,本领域技术人员可以确定本发明的基本特征,并在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用于不同的用途和条件。
45.实施例1:smiaa14基因cds区的克隆与分析方法。
46.(1)smiaa14 cdna序列的克隆方法
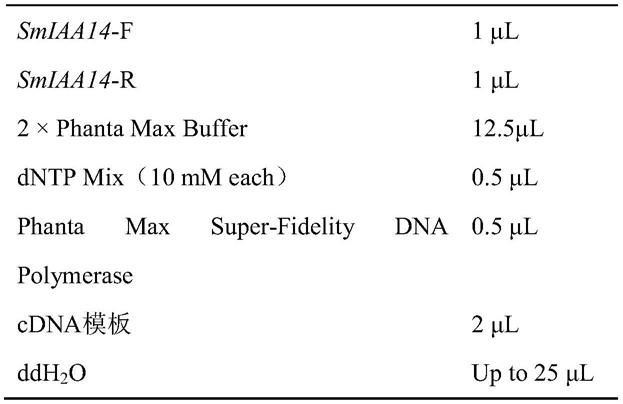
47.以丹参的cdna为模板,pcr扩增smiaa14 cdna片段,扩增pcr反应体系如下:
[0048][0049]
smiaa14 orf扩增引物如下:
[0050]
smactin-f:ggtgccctgaggtcctgtt(seq id no:3)
[0051]
smactin-r:aggaaccaccgatccagaca(seq id no:4)
[0052]
smiaa14 orf扩增pcr反应程序如下:95℃5min,(95℃30s,58℃30s,72℃45s)34个循环,72℃5min。
[0053]
pcr产物利用1%的琼脂糖凝胶进行胶回收,寄送南京擎科生物科技有限公司进行测序。
[0054]
(2)smiaa14 cds区的分析方法
[0055]
利用dnaman软件对丹参在内的多个植物物种的smiaa14氨基酸序列进行比对(附图1),并构建系统发育树(附图2)。结果显示smiaa14与芝麻(sesamum indicum)、紫花风铃木(handroanthus impetiginosus)亲缘关系较近,与可可树(theobroma cacao)、圆果种黄麻(corchorus capsularis)、榴莲(durio zibethinus)、胡杨、麻风树(jatropha curcas)等亲缘关系较远。
[0056]
利用npsa-prabi.ibcp.fr网站对smiaa14二级结构进行预测,结果显示pb1(phox和bem1)结构域分布于109-209位置,aux/iaa结构域集中在9-218区间,几乎覆盖了整个蛋白序列。pb1结构域是植物生长素应答中的多功能蛋白相互作用模块,与smiaa14的预期功能一致。对smiaa14蛋白使用swiss-model对其三级结构进行预测,其三级结构呈现出aux/iaa蛋白家族典型构象,与预期结果一致。
[0057]
实施例2:smiaa14蛋白的亚细胞定位分析的方法。
[0058]
分别将含有pmdc83-smiaa14-gfp和pmdc83-gfp的根癌农杆菌gv3101通过1ml无菌注射器(去除针头)注射进入新鲜烟草叶片的下表皮,黑暗培养48h。在荧光显微镜下观察smiaa14蛋白的表达情况。
[0059]
结果如附图3所示,在注射含有pmdc83-gfp的农杆菌的烟草表皮细胞中,绿色荧光信号遍布于整个细胞;在注射含有pmdc83-smiaa14-gfp的农杆菌的烟草表皮细胞中,绿色荧光信号只出现在细胞核中。结果说明,smiaa14定位于细胞核中,这与拟南芥中iaa14的表达情况一致。
[0060]
实施例3:smiaa14过表达和rnai丹参植株的获取方法。
[0061]
(1)pmdc83-smiaa14过表达载体的构建
[0062]
本发明中使用的载体为pmdc83-x-gfp(附图4)。
[0063]
以两年生紫花丹参的cdna为模板,用高保真pcr扩增smiaa14 cdna片段,引物如下:
[0064]
pmdc83-smiaa14-f:ctagactagtatggaagtcggcctgaatct(seq id no.:5)
[0065]
pmdc83-smiaa14-r:ttggcgcgccagcatctgctcttgcatt(seq id no.:6)
[0066]
反应体系如下:
[0067][0068]
扩增条件为95℃5min,(95℃30s,58℃30s,72℃45s)34个循环,72℃5min。
[0069]
将smiaa14片段连接peasy-blunt,连接产物转化至大肠杆菌dh5α,菌液鉴定体系及程序,pcr阳性鉴定引物序列如下:
[0070]
pmdc83-smiaa14-f:ctagactagtatggaagtcggcctgaatct(seq id no.:7)
[0071]
pmdc83-smiaa14-r:ttggcgcgccagcatctgctcttgcatt(seq id no.:8)
[0072]
菌液鉴定体系如下:
[0073][0074]
扩增条件为95℃3min,(95℃30s,58℃30s,72℃45s)30个循环,72℃5min。
[0075]
选取阳性菌液测序,测序结果正确菌液提取质粒,使用vazyme biotec公司plasmid mini kit说明书进行提取。将提取的质粒及pmdc83空载体分别进行双酶切,体系如下:
[0076][0077]
将酶切产物进行胶回收后进行连接,连接时间1h,体系如下:
[0078][0079]
将连接产物转化至大肠杆菌dh5α,菌液鉴定体系及程序同上,pcr阳性鉴定引物序列如下:
[0080]
pmdc83-smiaa14-f:ctagactagtatggaagtcggcctgaatct(seq id no.:7)
[0081]
pmdc83-gfp(载体引物):tcagggtaacgggagaagc(seq id no:9)
[0082]
选取阳性菌液测序,将测序结果正确的菌液提取质粒。
[0083]
smiaa14 rnai载体的构建:
[0084]
本发明中使用的rnai载体为pmdc83-rnai-x(附图4)。
[0085]
扩增smiaa14 300bp短片段序列,并将短片段以正、反向分别连接至载体pmdc83-rnai-x,引物如下:
[0086]
smiaa14-(asc i、bamh i)-f:cggggtacctctagagaagtcggcctgaatctgaa(seq id no.:10)
[0087]
smiaa14-(kpn i、xba i)-r:ttggcgcgccggatcctctgctggctcatgatgttc(seq id no.:11)
[0088]
以上一步中smiaa14过表达载体为模板,用高保真pcr扩增rnai-smiaa14,反应体系如下:
[0089][0090]
扩增条件为:95℃5min,(95℃30s,58℃30s,72℃30s)34个循环,72℃5min。
[0091]
pcr产物进行凝胶电泳检测,将目的片段进行胶回收,并连接peasy-blunt。
[0092]
将连接好的peasy-smiaa14-rnai转化至感受态dh5α,进行菌液pcr阳性鉴定,反应体系及反应程序同过表达载体的构建。
[0093]
将阳性菌液测序,结果正确的菌液提取质粒。peasy-smiaa14-rnai及pmdc83-rnai空载体质粒进行第一次双酶切,酶切体系同下:
[0094][0095][0096]
酶切产物胶回收,产物连接体系如下:
[0097][0098]
将已经连入正向片段的终载体转化至大肠杆菌感受态dh5α,过夜培养。挑选单个菌落进行扩摇,然后进行菌液pcr鉴定,鉴定引物如下:
[0099]
smiaa14-(asc i、bamh i)-f:cggggtacctctagagaagtcggcctgaatctgaa(seq id no.:10)
[0100]
pdk-r cttcttcgtcttacacatcacttg(seq id no.:12)
[0101]
选取阳性菌液,提取质粒。将重组质粒和peasy-rnai-smiaa14进行第二次双酶切,酶切体系如下:
[0102][0103]
将酶切产物进行凝胶电泳,并进行胶回收。将回收产物进行连接,连接体系如下:
[0104][0105][0106]
产物转化至大肠杆菌感受态dh5α,过夜培养,挑选单菌落进行菌液pcr鉴定,鉴定引物如下:
[0107]
smiaa14-(asc i、bamh i)-f:cggggtacctctagagaagtcggcctgaatctgaa(seq id no.:10)
[0108]
pdk-f:gctaatataacaaagcgcaagatc(seq id no.:13)
[0109]
鉴定为阳性的菌液进一步测序验证,验证正确的菌液提取质粒。
[0110]
(2)pmdc83-smiaa14过表达及rnai载体转化至农杆感受态gv3101
[0111]
采用电击转化法,调整电转仪参数,电压2.5kv,时间为5ms,pmdc83过表达及rnai空载也一并转入gv3101农杆感受态细胞中,作为对照。
[0112]
(3)农杆菌gv3101介导的丹参遗传转化
[0113]
a.预培养:于超净工作台中,选取长势状态良好、颜色鲜绿的丹参组培苗叶片,酒精灯外焰灼烧组剪刀及镊子60s。将无菌苗叶片的叶片边缘去除,增加叶片伤口,随后裁剪为1cm
×
1cm大小的叶片组织,将离体的叶片置于ms固体培养基中(注意镊子不要将离体叶片划伤),用镊子轻轻按压叶片于培养基使叶片边缘充分接触培养基,使叶片适应培养基环境,25℃,暗培养2d。
[0114]
b.重组质粒转化至农杆菌gv3101:在丹参叶片预培养的过程中,将已鉴定成功含有pmdc83-smiaa14-gfp重组质粒的gv3101阳性克隆,包含空载体质粒pmdc83-gfp的gv3101阳性克隆,pmdc83-smiaa14-rnai的gv3101农杆菌,含空载体质粒pmdc83-rnai的gv3101阳
性克隆,分别进行菌种活化及大摇扩繁,大摇后使od600至0.6左右不得超过0.8。准备50ml离心管、滤纸、培养皿、培养基、ddh2o进行灭菌。
[0115]
c.菌液活化:将步骤b中培养好的农杆菌菌液,离心5000rpm,5min,弃上清,1/2ms液体培养基重悬沉淀菌落,使od600为0.6不得超过0.8,28℃,100rpm振荡培养1h。
[0116]
d.侵染及共培养:灭菌培养皿中加入灭菌ddh2o或1/2ms液体培养基中随后迅速加入步骤a中预培养两天的叶片,防止叶片枯萎。在所有预培养的叶片置入培养皿后,将灭菌ddh2o倒掉。将步骤c中的农杆菌菌液倒入培养皿中,菌液侵染20min不得超过30min,期间不停晃动培养皿。倒掉菌液,使用ddh2o将丹参叶片冲洗两次,随后在灭菌滤纸上吸干侵染后的丹参叶片残留的ddh2o,吹干2min。将农杆菌侵染叶片放置于1/2ms固体培养基中,叶面朝下,25℃暗培养3d。
[0117]
e.除菌培养:将步骤d中暗培养丹参叶片转至含特美汀300mg/l的1/2ms培养基,组培间暗培养5d,观察外植体附近菌斑大小及厚度,除菌培养时间可以适当延长至两周。
[0118]
f.筛选培养:将丹参叶片放入ms筛选培养基(特美汀300mg/l、6-ba、naa、潮霉素500mg/l,1/2ms,ph=5.8)的固体培养基,25℃,湿度30%,昼夜时间16/8h,培养间中培养,每隔15d更换培养基,直至叶片边缘长出嫩芽。将同一叶片上长出的嫩芽使用剪刀裁剪下来,移至1/2ms培养基中,25℃,湿度20%,昼夜时间12/12h,每隔10d打开培养罐,在超净工作台中将水汽吹干,防止丹参外植体玻璃化,将同一叶片上的愈伤组织进行标记,防止混乱。待丹参外植体在1/2ms培养基中生长3周后进行阳性鉴定,保留阳性植株。
[0119]
g.炼苗及移栽:将生长于培养罐的基因转化丹参阳性植株转移至培养钵中,移栽过程中确保丹参根系不被破坏,随后将其放置于育苗盆内,附上保鲜膜,期间保持育苗盆湿度,7d后将保鲜膜撕下,待其适应外界环境后,进行二次移栽。
[0120]
实施例4:基因转化丹参植株中相关基因表达量测定方法。
[0121]
以基因转化丹参植株样品中cdna为模板,设计定量引物,进行qrt-pcr,并分析基因转化丹参植株中smiaa14的表达量,结果如附图5所示。选取的三个过表达株系中smiaa14的表达量分别是wt对照植株的7.91倍、1.1.62倍和1.61倍。选取的三个rnai株系中smiaa14的表达量分别是wt对照植株的4.67%、6%和30.85%。说明转基因操作显著改变了丹参中smiaa14的转录水平。
[0122]
qrt-pcr引物序列如下:
[0123]
smiaa14-yg-f:gaagtcggcctgaatctgaa(seq id no:14)
[0124]
smiaa14-yg-r:tctgctggctcatgatgttc(seq id no:15)
[0125]
smactin-f:ggtgccctgaggtcctgtt(seq id no:16)
[0126]
smactin-r:aggaaccaccgatccagaca(seq id no:17)
[0127]
qrt-pcr反应体系如下:
[0128][0129]
qrt-pcr反应条件为:95℃5min,(95℃10s,60℃30s)40个循环,95℃15s,60℃60s,95℃15s。
[0130]
实施例5:基因转化丹参植株根系形态指标测定的方法。
[0131]
选取过表达基因转化丹参植株中3个高表达株系,rnai基因转化丹参植株中3个抑制表达株系,以及空载体基因转化植株(oe-vc、rnai-vc)和非基因转化植株(wt)各3个株系,每个株系各三棵苗。置于植物房内,25℃,昼夜时间比18/6h培养至生根。以上组培苗生根后,对丹参组培苗进行炼苗,确保丹参植株在室外能存活后,移栽至扬州大学实验田。种植5个月后进行收样,对植物地上部分和地上部分进行拍照,测定株高、冠幅、叶片数、根长、芦头直径、侧根数、一级侧根数、二级侧根数、一级侧根直径、二级侧根直径、地上部分鲜重、地下部分鲜重、地上部分干重和地下部分干重,结果如附图6和附图7所示。与wt对照植株相比,smiaa14过表达株系的侧根数目显著增加,根生物量显著降低。如oe-6中一级侧根数和二级侧根数分别是wt对照植株的2.13倍和1.37倍,oe-14中根鲜重和根干重分别是wt对照植株的62.05%和56.10%。与wt对照植株相比,smiaa14 rnai株系的侧根数目显著降低,根长和根生物量显著增加。如rnai-10中一级侧根数和二级侧根数分别是wt对照中的47.37%和71.13,根长、根鲜重和根干重分别是wt对照植株的1.26倍、1.31倍和1.45倍。
[0132]
实施例6基因转化丹参植株中丹参酮类成分提取及测定的方法。
[0133]
(1)将在实验田中生长5个月的基因转化丹参植株挖出,确保根系不被破坏,观察植物根系形态进行拍照并进行数据统计。
[0134]
(2)将新鲜的丹参根部材料置于45℃烘箱中烘干至恒重。
[0135]
(3)研磨烘干后的丹参根部材料,过40目筛,称取50mg样品至15ml离心管中。加入10ml 70%甲醇,使用超声波进行清洗45min。
[0136]
(4)4℃,12000rpm,离心10min,然后使用0.22μm有机过滤膜进行过滤。
[0137]
hplc色谱条件
[0138]
色谱条件:c-18反相硅胶柱,采用二元梯度洗脱;
[0139]
流动相:a,乙腈;b,0.01%磷酸水溶液。流动相提前超声30min;
[0140]
柱温:30℃;
[0141]
流速:1.0ml/min;
[0142]
检测波长:270nm/280nm
[0143]
流动相梯度洗脱条件见表如下:
[0144][0145][0146]
结果如附图8所示。smiaa14过表达株系中丹参酮类成分含量显著降低,如oe-6中丹参酮iia、二氢丹参酮i和丹参酮i的含量分别为wt对照的80.00%、60.81%和66.67%。smiaa14 rnai株系中丹参酮类成分含量显著增加,如rnai-36中丹参酮iia、二氢丹参酮i和丹参酮i的含量分别为wt对照的1.70倍、2.43倍和1.50倍。
[0147]
本发明从丹参中克隆获得一条生长素早期响应基因smiaa14,系统探究了其表达特性及对丹参根系发育和丹参酮类成分积累的调控作用。为进一步阐明生长素在丹参根系发育和次生代谢中的调控机制提供理论基础,同时也能为丹参道地药材的品质提升提供参考依据,具有广阔的应用前景。
[0148]
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。