结直肠癌类器官培养基及无支架3d培养方法
技术领域
1.本发明涉及生物技术领域,特别涉及一种结直肠癌类器官培养基及无支架3d培养方法。
背景技术:
2.结直肠癌是常见的消化道恶性肿瘤之一,在我国恶性肿瘤发病率中已位居第三位,仅次于肺癌和胃癌,死亡率居第五位,已高于发展中国家以及世界平均水平。结直肠癌发病最多的年龄段是40~49岁,结直肠癌早期常无特殊症状,所以,通常发现时患者已经是中晚期。目前结直肠癌的治疗方式主要还是依靠手术和放、化疗,虽然生物制剂、免疫治疗等辅助治疗正在不断出现,但疗效依然较为有限。以往结直肠癌的研究主要依靠细胞模型和动物模型,但这些模型都存在一定的局限性。而近年来出现的类器官模型使得我们可以在体外更加高效且真实地模拟肿瘤在体内的各方面特性,为基础研究及其向临床应用的转化提供了更加可靠的工具和桥梁。
3.与单一因素驱动的肿瘤相比,结直肠癌的突出特点是患者间的遗传和表型异质性,其发病机制呈多样化。肿瘤类器官作为一种新的实验模型,在结直肠癌机制研究、基因组学研究、抗肿瘤药物筛选、肿瘤动物模型建立等方面发挥重要作用。2007年,荷兰克莱弗斯实验室的barker n等人研究发现携带有lgr5受体的细胞产生小鼠肠道的所有细胞,wnt信号通路中的分子指引这些细胞分裂。2009年,荷兰sate t等利用小鼠肠道上皮隐窝底部lgr5
柱状细胞,在基质胶中培养出类器官;2011年jung等人用相同的方法将人结直肠黏膜中ephb2高表达的细胞培养成结直肠类器官,同年sato t等人成功培养了源自患者肿瘤组织的结直肠肿瘤类器官。体外构建患者来源的结直肠癌肿瘤类器官,可在体外模拟体内3d生长环境,与传统的2d培养体系相比,3d培养体系能够更加真实反映肠道功能及体内的信号传导及形态,并且与原发肿瘤具有高度的组织一致性。因此,肿瘤类器官成为目前科学家们的关注热点,用于结直肠癌的发生发展病理机制研究及抗肿瘤药物的体外筛选。但是目前常规的结直肠癌肿瘤类器官培养体系基本延续了sato t等人建立的方法,借助基质胶、水凝胶等外源基质材料进行3d细胞培养,但是这种培养体系具有一定的局限性,由于外源基质的存在限制了类器官与外界的气体交换和物质代谢,当类器官形成较大的组织后,循环系统的缺乏和氧气养分交换的局限性严重影响了类器官所需营养物质的吸收以及代谢废物的清除;并且因3d细胞球周围有外源基质而无法进行原位光学检测,而去除外基质的过程不仅繁琐,一定程度上还会对细胞活性造成影响,干扰实验结果的真实性。
4.中国专利申请(申请号为202110109040.x)公开了一种用于结直肠癌类器官培养的培养液及其制备方法,该技术发明所涉及的培养液包含多种细胞因子、信号通路调控因子、氨基酸和无血清添加剂等,由17种原料组成;基于该培养液所构建的类器官采用的是培养液和基质胶按体积比为3∶4接种细胞,每个胶滴40-60μl,然后置于37℃,5%co2条件下培养,获得结直肠癌类器官。
5.中国专利申请(申请号为202011052642.8)公开了一种人结直肠癌肿瘤类器官的
培养方法及其应用,该技术发明公布的类器官培养方法涉及培养液包含细胞因子、信号通路调控因子、抗生素和无血清添加剂等十多种原料。该专利技术所涉及的类器官构建方法是将获得细胞团与水凝胶混合,固化后加入人结直肠癌类器官培养液进行培养,获得人结直肠癌类器官。
6.中国专利申请(申请号为202011211090.0)公开了一种结直肠癌类器官的培养方法和培养液,该技术发明所涉及的培养基用自产wnt-3a、r-spondin1和noggin的细胞系替代三种昂贵细胞因子加入,节约了类器官的培养成分。但该专利技术所涉及的类器官构建方法仍需引入基质胶,将细胞混悬液和基质胶按照体积比为1∶1.5-3混合,所得混合物接种后进行培养,获得类器官。
7.上述三个专利所涉及的类器官构建培养方法仍采用的是常规基于基质胶或水凝胶等引入外源基质的培养体系。
8.针对上述类器官培养中需要引入外源支架材料,导致细胞生长不良、支架材料去除困难等缺陷,以及获得的类器官模型大小不均匀,可能存在不同药物相应等问题。
技术实现要素:
9.发明目的在于提供一种结直肠癌类器官培养基。
10.所涉及培养基组成简单,配方合理,营养丰富,能满足结肠癌类器官细胞球的稳定生长;本发明所建立的无支架类器官构建方法,可快速形成类器官,且大小均一,细胞球紧密聚集,表面光滑圆润,边界清晰,遗传及生物学性状稳定。本发明所建立的结直肠癌患者体外瘤类器官模型,可用于体外药物敏感性评价,为患者的个体化治疗方案的制定提供有效的实验数据参考。
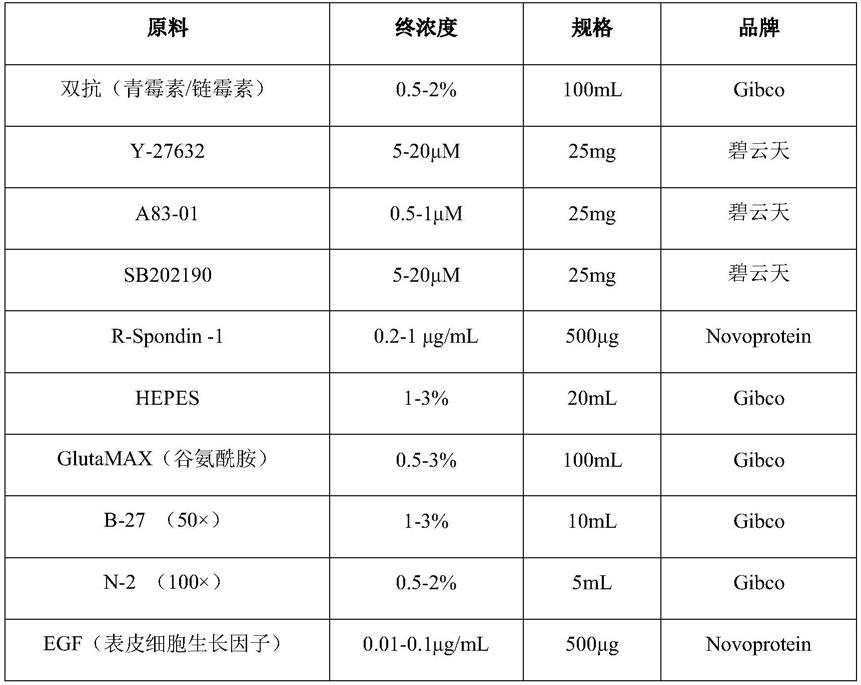
11.本发明的上述技术目的是通过以下技术方案得以实现的:一种结直肠癌类器官培养基,培养基成分包括:青霉素、链霉素、rock1抑制剂、mapk抑制剂、alk-5抑制剂、r-spondin-1、hepes、glutamax、b-27、n-2、egf、noggin、胃泌素(gastrin i)和advanced dmem/f12基础培养基。
12.优选的,上述的结直肠癌类器官培养基中基础培养基是advanced dmem/f12培养基。
13.优选的,上述的结直肠癌类器官培养基中rock1抑制剂为y-27632。
14.优选的,上述的结直肠癌类器官培养基中mapk抑制剂为sb202190。
15.优选的,上述的结直肠癌类器官培养基中alk-5抑制剂为a83-01。
16.进一步的,上述结直肠癌类器官培养基,具体为用于结直肠癌无支架类器官3d细胞球培养的培养基,由以下浓度或体积百分比的成分组成:表1结直肠癌无支架类器官培养基组成
本专利所发明的结直肠癌类器官培养基成分的主要作用如下:双抗(青霉素/链霉素)抑制细菌生长,降低肿瘤细胞培养过程中染菌的可能;y-27632为rock抑制剂,具有防止细胞凋亡的作用;a83-01为tgf-β1受体抑制剂,加入培养基发挥维持细胞干性,抑制细胞分化的作用;sb202190是一种有效的p38 mapk抑制剂;r-spondin-1通过激活并协同wn/β-catenin信号通路参与调控细胞增殖和分化;hepes是一种缓冲液,用于维持培养基稳定的ph值;glutamax是一种高级细胞培养添加剂,可直接替代细胞培养基中的l-谷氨酰胺,可以防止在长期培养过程中谷氨酰胺的降解和最大限度减少毒性氨成分的蓄积,改善细胞活性;b-27和n-2是无细胞血清培养添加剂,维持细胞活性;noggin是一种重要的胚胎蛋白,在胚胎背腹轴模式形成、神经管发育及神经诱导方面有重要功能;egf是人体内分泌的一种重要细胞生长因子,具有很强的生理活性,如能促进上皮细胞、成纤维细胞的增值;gastrin i对原代培养结直肠癌细胞具有促增殖作用。advanced dmem/f12是一种细胞培养的基础培养基。
17.上述培养基成分组成为实验获取的结直肠癌无支架类器官培养最佳组成,减少一种或几种成分后,结直肠癌肿瘤原代细胞培养成3d细胞球的成功率降低,甚至出现难以成球,并且组成类器官细胞球后的增长速度减慢,甚至出现细胞坏死和球体崩解,难以实现长
期稳定培养。
18.本发明的培养基适用于结直肠癌类器官细胞球的培养,特别是无支架类器官的培养,同时也适用于基于外源基质构建的类器官。
19.该方法所得到的结直肠癌类器官培养基为无血清培养基。
20.发明另一目的在于提供一种结直肠癌类器官无支架3d培养方法。
21.本发明的上述技术目的是通过以下技术方案得以实现的:一种结直肠癌类器官培养基无支架3d培养方法,至少包括以下方法步骤:s01、将经消化分离的原代肿瘤细胞直接接种至超低吸附的细胞培养孔板中;s02、加入上述的结直肠癌类器官培养基;s03、每隔2~3天更换一次培养基,培养至形成类器官。
22.可选或优选的,所述步骤s01中,原代肿瘤细胞的分离消化方法是取肿瘤组织冲洗干净,剪成块,加入单细胞悬液制备仪酶解肿瘤组织,分离获取原代细胞;其中,单细胞悬液制备仪的设定水浴温度为38.5℃,仪器转速为150rpm,顺时针、逆时针分别运转5min;可选或优选的,所述单细胞悬液制备仪的消化液由以下体积含量的成分组成:0.1-0.5%的i型胶原酶,0.1-0.5%iv型胶原酶,余量为hank
′
s溶液(无ca
2
、mg
2
)。
23.胶原酶是在细胞原代培养取材的时候用于降解细胞外基质成分,分离细胞。不同的组织类型需要不同的胶原酶。本技术发明所选用的组合为发明人根据原代细胞肿瘤的性质探索设定的,消化速度快,20分钟即可完成结直肠癌肿瘤组织消化,极大减轻肿瘤组织消化过程对肿瘤原代细胞造成的损伤。
24.可选或优选的,所述步骤s01中,原代肿瘤细胞来源于未接受过任何抗肿瘤治疗的肿瘤患者手术切除或活检获取的肿瘤组织;其中,肿瘤患者手术切除或活检获取的肿瘤组织获取方法至少包括以下步骤:s10、新鲜肿瘤组织置于4℃预冷的组织洗涤液中,剔除组织标本上的血块、坏死组织、脂肪以及结缔组织,保留活性好的肿瘤组织;s11、用组织洗涤液清洗至上清无浑浊,在离心管内用灭菌眼科剪将组织剪成大小为1mm3左右的小块,加入组织保存液,0-4℃条件下转移至实验室进行后续肿瘤原代细胞的分离提取。
25.可选或优选的,所述组织洗涤液为:含有500u/ml青霉素/链霉素,或含5-20μg/ml两性霉素b和1-5μg/ml甲硝唑中的一种或者两种的pbs溶液。
26.可选或优选的,本专利优选含500u/ml青霉素、500μg/ml链霉素和12.5mg/l两性霉素b的pbs溶液。
27.可选或优选的,分离获取的结直肠癌原代肿瘤细胞经计数后,按照1000-10000cells/well的密度将原代细胞接种至超低吸附孔板内,补充100-150μl类器官培养基,1000rpm离心3min促进细胞聚集,更快组装形成类器官细胞球,每隔2-3天更换一次培养基。
28.可选或优选的,所述细胞接种密度为2000-6000cells/well。
29.初始细胞量太小不利于细胞聚集形成球体,而过大会影响细胞球的成球及生长,超过10000cells/well的细胞密度接种时,易出现细胞球中心坏死,导致类器官成球失败。
30.可选或优选的,该方法培养获得的类器官细胞球直径大于300μm时,需对类器官细胞球进行步骤s04:消化传代;具体方法为:s41:将孔内培养基连同类器官一并收集至离心管内,300g离心3min收集细胞沉淀,加入1~2ml酶解液,37℃孵育10~15min,轻轻吹打分散类器官细胞球;s42:酶解完成后,加入适量类器官培养基轻轻吹打混匀,300g离心3min收集沉淀,按照1∶3的比例进行传代。
31.可选或优选的,所述酶解液为tryple。
32.本发明提供的结直肠癌类器官培养基也适用于有基质的肿瘤类器官培养方法,也就是说本发明的培养基也可适用有支架的类器官培养方式。
33.发明另一目的在于提供另一种结直肠癌类器官培养基的培养方法,至少包括以下方法步骤:s01、将分离获取的结直肠癌原代肿瘤细胞计数后,离心收集细胞沉淀;s02、用基质胶重悬细胞,调整细胞密度为5000-10000个/10μl,按照每孔10μl的体积接种至细胞培养孔板中,将细胞孔板倒扣,固化30分钟;s03、加入上述的结直肠癌类器官培养基,置于37℃,5%co2条件下培养;s04、每隔2~3天更换一次培养基,培养至形成类器官。
34.可选或优选的,所述基质胶为低生长因子matrigel。与现有技术相比,本发明具有以下有益效果:1.本发明采用含有高浓度抗生素的pbs溶液冲洗采集的结直肠癌肿瘤组织,并采用保存液进行肿瘤组织的转运,降低后续细胞培养出现细菌污染的可能,并最大程度维持细胞活性,提高后续肿瘤组织原代细胞分离活力及类器官构建培养的成功率。
35.2.本发明提供了一种结直肠癌无支架类器官培养基及培养方法,可实现无载体支持下细胞自主聚集形成肿瘤类器官细胞球,且生成快速,24h之内即可形成球体,72h内即可自组装成肿瘤类器官3d细胞球,并且可以长期稳定培养。
36.3.相较于传统的2d培养,类器官3d细胞球能在体外很好地保留患者肿瘤组织的异质性,可更真实的反映患者体内结直肠癌对治疗药物的敏感性,基于该模型的药敏筛选数据对于来源患者个体化治疗方案的制定具有更高的参考价值。
37.4.类器官细胞球的大小可能影响细胞对药物的响应时间及效果,从而影响药敏测试结果的判断,本发明提供的结直肠癌无支架类器官3d培养方法可以精准控制培养类器官球的生成,形成的肿瘤类器官细胞球球形规则,且大小均一可控,很好的避免了类器官细胞球大小不匀对药敏测试产生的影响,是体外药敏筛选的理想模型,可作为一种结直肠癌患者治疗药物体外个体化敏感性检测的测试平台。
附图说明
38.图1是基于无支架方法构建的结直肠癌肿瘤类器官(10
×
)示意图;图2是基于基质胶构建的结直肠癌肿瘤类器官(20
×
)示意图;图3是不同成分培养基条件下无支架肿瘤类器官构建3天时的成球率;图4是给药前后结肠癌类器官模型示意图。
具体实施方式
39.以下结合附图对本发明作进一步详细说明。
40.实施例1:结直肠癌类器官培养基配制y-2763210μm,a 83-01 500nm,sb20219010μm,fbs 20%,双抗(青霉素/链霉素)1%,advanced dmem/f12补充至所需体积。
41.实施例2:新鲜肿瘤组织预处理组织洗涤液:含有500u/ml青霉素/链霉素,12.5mg/l两性霉素b的pbs溶液,过滤除菌。
42.组织保存液:组织保存及运输培养基(无血清化学培养基,life science production公司)新鲜结直肠癌肿瘤组织处理过程:(1)将结直肠癌患者手术或者肠镜获得的新鲜肿瘤组织置于4℃预冷的组织洗涤液中,将组织标本上的血块、坏死组织、脂肪以及结缔组织剔除.(2)用组织洗涤液清洗肿瘤组织,由于肿瘤组织的采集位置,很容易出现污染,需至少清洗3-5次。
43.(3)肿瘤组织清洗干净后在离心管内用灭菌眼科剪将组织剪成小块,组织块大小为1mm3左右。
44.(4)如果组织获取地具备后续肿瘤细胞分离提取条件,在上述剪碎后的组织块中加入组织保存液,快速转移至实验室进行后续肿瘤细胞的分离提取,防止组织内细胞发生自溶或凋亡。如组织获取地不具备后续处理条件,请按步骤(5)进行操作。
45.(5)在剪碎的组织块中加入至少6倍体积的组织保存液,放入4℃冰箱中暂存,采用生物冷藏箱进行快递运输,需在72小时内将样本运输至开展后续处理操作的实验室。
46.实施例3:结直肠癌原代肿瘤细胞的分离组织消化液:含有i型胶原0.1%(质量百分含量),iv型胶原0.1%(质量百分含量)的hank
′
s溶液(无ca
2
、mg
2
)。
47.结直肠癌原代肿瘤细胞的分离操作步骤:(1)样本冲洗:使用冲洗液洗涤组织样本2-3次至溶液澄清,200g离心3min收集样本沉淀;(2)组织消化:加入3ml消化液重悬样本,并将其转移至单细胞悬液制备仪配套的离心管内(无菌),随后将离心管倒置安装至单细胞悬液制备仪上,设定水浴锅温度为38.5℃,仪器转速为150rpm,顺时针、逆时针分别运转5min后停止;(3)细胞分离:取下装有样本的离心管,将其消化液过70μm细胞网筛,并用础培养基冲洗离心管壁及管盖,使细胞尽量收集完全;管内剩余样本及网筛上未滤过的样本需收集后进行第二次消化,按操作步骤(2)进行;(4)细胞计数:合并两次消化收集细胞滤液,1000rpm离心5分钟,移弃上清,收集细胞沉淀,加入1ml类器官培养基重悬细胞;取10μl细胞悬液,加入10μl台盼蓝染料,混匀均匀后用细胞计数仪进行计数并测定细胞活力,计算活细胞比例。
48.实施例4:结直肠癌肿瘤类器官的构建本发明技术提供的培养基特别适用于结直肠癌无支架类器官的构建,同时也适用
于结直肠癌有支架肿瘤类器官的构建。
49.(1)结直肠癌无支架肿瘤类器官的构建分离获取的结直肠癌原代肿瘤细胞经计数后,按照2500cells/well的密度将原代细胞接种至类器官专用96孔板内(超低吸附细胞培养u型或v型孔板),补充100μl类器官培养基,1000rpm离心3min促进细胞聚集,置于37℃,5%co2条件下培养,每隔2-3天更换一次培养基,可根据细胞增殖情况更换1/2的培养液。培养3天后,即可观察到原代细胞自组装为肿瘤类器官3d细胞球,如图1所示,并且在一定时间内,随着培养时间的增加,细胞球体积增加。相较于引入基质胶有支架的类器官构建方法,无支架类器官构建方法建立的类器官细胞球大小均一,细胞球紧密聚集,表面相对光滑圆润。
50.(2)结直肠癌有支架肿瘤类器官的构建分离获取的结直肠癌原代肿瘤细胞经计数后,离心收集细胞沉淀,用低生长因子matrigel(基质胶)重悬,调整细胞密度为5000-10000个/10μl,按照每孔10μl的体积接种至24孔板中,将孔板倒扣置于培养箱中孵育30min使胶体凝固,随后每孔补充1ml完全培养基;置于37℃,5%c02条件下培养,每隔2-3天更换一次培养基,可根据细胞增殖情况更换1/2的培养液。培养5天后,即可观察到肿瘤类器官3d细胞球,如图2所示。
51.实施例5:肿瘤类器官的传代无支架类器官生长至直径超过300μm,有支架类器官在基质胶内密度过大时,需对其进行传代以保持类器官良好的状态及较快的增殖速率。
52.对于有支架类器官,将孔板内的培养基连同matrigel转移至15ml离心管中,加入8ml pbs,轻轻吹打混匀,至胶体散开,无大块胶体存在,300g离心3min收集细胞沉淀。而对于无支架类器官,直接将孔内培养基连同类器官一并收集至离心管内,300g离心3min收集细胞沉淀。相比于有支架的类器官收集过程,无支架类器官无需去除胶质,从而很好的避免了吹打去胶质过程对类器官细胞球产生的损伤,维持细胞特性。
53.对于收集的类器官沉淀,加入1~2ml酶解液(tryple)轻轻吹打分散类器官细胞球,37℃孵育同时保持镜下观察,直至类器官分散成3~5个细胞的小细胞团状态,酶解过程约需10~15min;酶解完成后,加入5ml类器官培养基轻轻吹打混匀,300g离心3min收集沉淀,按照1∶2~1∶3的比例进行传代。
54.实施例6:肿瘤类器官的冻存按照实施例5肿瘤类器官的传代中的方法收集无支架、有支架类器官细胞球沉淀,然后用冻存液重悬(90%fbs 10%dmso),分装至冻存管中,随后将冻存管转移至程序降温冻存盒,放入-80℃冰箱过夜后,将冻存管转移至液氮罐中长期保存。
55.实施例7:细胞因子在类器官3d细胞球构建中的作用实验设置7个实验组:
①
类器官完全培养基组、
②
缺y-27632培养基组、
③
缺a83-01培养基组、
④
缺sb202190培养基组、
⑤
缺r-spondin-1培养基组、
⑥
缺noggin培养基组和
⑦
缺gastrin i培养基组,缺成分培养基组仅缺少一种成分,其余成分组成于类器官完全培养基成分完全一致。按实施例3分离获取肿瘤原代细胞,实施例4中无支架类器官的构建方法进行类器官的构建和培养,每个实验组设置9个重复。
56.按照本发明专用完全培养基所培养的类器官细胞球形态圆润完整、边界线分明,透光性好;缺少成分组类器官的成球率均出现了不同程度的降低,并且随着培养时间的增
加,类器官球出现生长缓慢、停滞甚至崩解凋亡。各实验组无支架肿瘤类器官构建3天时的成球率如图3所示。
57.实施例8:基于肿瘤原代细胞2d培养和3d类器官模型的体外药敏筛选采用本发明技术对结肠癌患者来源的肿瘤细胞分别进行2d培养及无支架类器官模型3d培养,基于2d培养细胞及3d肿瘤类器官模型进行化疗药物体外药敏检测,比较不同模型对药物的敏感性反映的差异。选择4种单药及3种联合给药共7种给药方案进行测试。5-氟尿嘧啶的血浆峰值浓度(ppc)为4.0μm(2.08μg/ml);奥沙利铂ppc为1.0μg/ml;卡培他滨ppc为5.0μg/ml;伊利替康ppc为7.7μg/ml;卡培他滨 奥沙利铂,两者按照1∶1比例联合给药;卡培他滨 伊利替康:两者按照1∶1比例联合给药;5-氟尿嘧啶 奥沙利铂:两者按照1∶1比例联合给药。
58.无支架肿瘤类器官细胞球按2500个/孔的密度接种,培养3天后对其进行给药。肿瘤2d培养原代细胞按同样的细胞密度接种于96孔细胞培养板中,培养3天后对其进行给药。给药浓度设置为12.5%、25%、50%、100%及200%ppc,另设正常对照组,不给药正常培养,每个浓度6个重复。给药后分别于第3、5、7天采用atp生物荧光法检测2d培养细胞及类器官3d细胞球atp活性的变化,根据体外药物敏感性评价标准判定药物的敏感性,结果如表2所示。敏感性评价标准:强敏感(ss):ic50<25%及ic90<100%ppc;中度敏感(is):ic50<25%及ic90>100%ppc;轻度敏感(ms):ic50>25%及ic90<100%ppc;耐药(r):ic50>25%及ic90>100%ppc;ic90表示抑制90%肿瘤细胞生长的血浆峰值浓度百分比;ic50表示抑制半数肿瘤细胞生长的血浆峰值浓度百分比;ppc表示一定临床用药剂量对应的血浆峰值浓度。出现敏感性的给药方案组类器官3d细胞球在给药后出现一定的崩解和凋亡,如图4所示。
59.表2:结肠癌体外肿瘤细胞模型药敏检测结果从表2中可以看出,来源于结肠癌患者肿瘤组织的2d培养肿瘤原代细胞和类器官3d细胞球模型都对卡培他滨、卡培他滨 奥沙利铂反应为耐药;对5-氟尿嘧啶、奥沙利铂和5-氟尿嘧啶 奥沙利铂这三种给药方案两种肿瘤细胞模型表现出不同的敏感度,2d培养肿
瘤细胞表现出不同程度的敏感性,而类器官3d细胞球则表现出耐药,说明相较于2d培养细胞,肿瘤原代细胞自组装为3d细胞球后,对药物的耐受程度增强;对伊利替康和卡培他滨 伊利替康给药方案,两种模型在给药7天时均表现出强敏感,说明这两种给药方案有可能对该肿瘤患者敏感。对两种体外肿瘤细胞模型的药敏结果进行整体比较,可以看出相较于2d培养肿瘤原代细胞而言,由于其自组装为类器官结构,更接近体内肿瘤组织结构,类器官3d细胞球药物的耐受性更高,其结果更具有合理性及临床参考价值。
60.本文中应用了具体个例对发明构思进行了详细阐述,以上实施例的说明只是用于帮助理解本发明的核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离该发明构思的前提下,所做的任何显而易见的修改、等同替换或其他改进,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。