一种氧糖剥夺共pm2.5染毒模型的构建方法及应用
技术领域
1.本发明属于大气颗粒物毒性评价领域,涉及一种用于评估pm2.5暴露对缺血性脑卒中康复影响的细胞模型构建方法,通过建立一种新的细胞模型,基于分子生物学的方法用于评估pm2.5暴露对缺血性脑卒中康复的影响。
背景技术:
2.空气污染是一种复杂的混合物,随着相关科研项目的展开,揭示了其所含的主要成分:颗粒物、臭氧、一氧化碳、氧化硫、氮、金、甲烷等,其中大气颗粒物(particulate matter,pm)特别是直径小于2.5微米的颗粒物越来越被人们所熟知,根据空气动力学尺寸、气道解剖结构以及通气模式,吸入的颗粒物可以不同程度的在上呼吸道、导气管和肺泡等区域堆积,随着呼吸系统进入肺、心、嗅球等部位,引起机体各部位产生不同程度的炎症反应,还可随着血液循环破坏血脑屏障,作用于全身多个器官,目前认为其不仅对呼吸系统产生影响,对中枢神经系统也有不良影响,与脑卒中、帕金森、抑郁症等神经性疾病的发生息息相关。
3.近些年,脑卒中已经成为一种高度流行的疾病,是世界范围内第二大常见的死亡原因。此外,脑卒中也是导致成人长期神经功能障碍的主要原因。世界卒中组织最新疾病负担数据分析显示,全球范围内中风风险已上升至每4人中就有1 人可能患脑中风。为了探究大气污染颗粒物对缺血性脑卒中的影响,本实验建立了细胞氧糖剥夺共pm2.5染毒模型,从细胞活性、凋亡等方面研究pm2.5对氧糖剥夺损伤的神经细胞的影响,为探究颗粒物暴露缺血性卒中的发病风险和死亡率之间的关联提供有利的理论依据。
技术实现要素:
4.本发明的目的是针对现有技术的不足,提供一种用于评估pm2.5暴露对缺血性脑卒中康复影响的细胞模型构建方法,在细胞层面建立一种新的模型,评估 pm2.5暴露下对缺血性脑卒中康复的影响。首先采用自制的氧糖剥夺装置对神经细胞进行氧糖剥夺造模,其次用不同剂量的pm2.5对氧糖剥夺的细胞进行染毒建立氧糖剥夺共pm2.5染毒模型,用于评估外源污染物暴露对缺氧缺糖损伤的神经细胞毒性的影响,从而反应对缺血性脑卒中的影响。该方法具有价格低廉、操作简单、重复性好、造模成功率高等优点。
5.为了实现上述目的,本发明采用的技术方案为:
6.步骤(1):用th-150c型智能颗粒物中流量采样器采集待检测环境的 pm2.5颗粒一定时间;
7.步骤(2):制备pm2.5悬浊液;
8.步骤(3):神经细胞pc12的培养
9.神经细胞pc12接种于培养瓶中,然后加入培养基进行重悬细胞,培养基体积为3ml,接种密度为1
×
104个/瓶,在恒温co2培养箱中培养,待细胞覆盖培养瓶80%后得到培养好的神经细胞pc12;恒温co2培养箱的培养条件为37℃、 5%co2,培养时间为24h;
10.步骤(4):利用氧糖剥夺装置对步骤(3)培养好的神经细胞pc12进行氧糖剥夺,同时加入步骤(2)不同浓度的pm2.5悬浊液进行染毒,建立细胞氧糖剥夺共pm2.5染毒模型;
11.步骤(5):步骤4所得细胞样品,利用酶标仪,测定细胞毒性。
12.步骤(2)中制备pm2.5悬浊液的过程具体分为两步:
13.2-1将步骤(1)采集得到的粘附有pm2.5颗粒的滤膜浸入超纯水中,放在20-25℃下超声振荡处理60-80min,刮取滤膜表面的pm2.5颗粒,过滤,得到过滤后的悬浮液。
14.2-2将过滤后的悬浮液分装至离心管中,锡箔纸封瓶,用针扎小口,置于4℃冰箱过夜;隔天对其进行冷冻干燥处理24小时,得到灰黑色颗粒物,即pm2.5 颗粒物;将上述pm2.5颗粒物与培养基混合,配制成不同终浓度的悬浊液,置于4℃冰箱保存备用。
15.步骤(4)的具体操作步骤为:
16.将步骤(3)培养好的神经细胞pc12,用胰酶消化,加培养基终止消化并离心,离心后加入培养基多次吹打均匀,得到细胞悬浮液;然后将上述细胞悬浮液接种到96孔板中,接种密度为8
×
103个/孔,待细胞贴壁长满孔板的80%左右(约培养时间为24h),吸弃原培养基,用pbs洗涤2次,用无糖的dmem培养基洗涤1次,得到洗涤后的贴壁细胞;在上述保有洗涤后贴壁细胞的96孔板中每孔加入无糖的dmem培养基和步骤(2)pm2.5悬浊液,然后置于氧糖剥夺装置中,在95%氮气和5%二氧化碳的混合气体通气环境中,ogd和pm2.5染毒联合处理4-8h;最后将96孔板中无糖的dmem培养基吸弃,pbs清洗一次,再加入培养基和步骤(2)pm2.5,放入co2恒温培养箱继续培养2-6h;恒温co2培养箱的培养条件为37℃、5%co2;
17.所述的培养基为神经细胞提供正常的营养物质,其成分主要有:高糖培养基 dmem 88wt%、胎牛血清10wt%、抗生素2wt%。
18.所述抗生素包括青霉素和链霉素。
19.所述氧糖剥夺装置包括容器本体、与容器本体可拆卸连接的盖子;容器本体为上端开放的容器,其上端与盖子配合实现密封;在盖子的顶部开有两个通孔,分别作为出气口和进气口;所述出气口通过管路接装有超纯水的容器,管路置于液面下方;所述进气口通过管路接通气。
20.所述容器本体和盖子的材质为玻璃透明材质。
21.本发明的另一个目的是提供一种用于评估pm2.5暴露对缺血性脑卒中影响的细胞模型,采用上述方法制备得到的氧糖剥夺共pm2.5染毒模型。
22.本发明的有益效果如下:
23.(1)本发明通过建立氧糖剥夺共pm2.5染毒模型,比其它方法更能真实的模拟环境污染物对缺血性脑卒中的影响,同时用不同剂量的污染物暴露能更加真实的反应环境本身具有的特点。
24.(2)本发明利用神经细胞氧糖剥夺体外模拟缺血性脑卒中来研究大气污染物的毒性作用。选取的细胞与中脑多巴胺神经元在结构和功能上有很多相似之处,在排除体内其它干扰因素的条件下,能更直接、准确地了解pm2.5暴露对缺血性脑卒中的影响,用来探究污染物的毒性机制具有深远意义。
25.(3)本发明体外模型操作简便、建模成功率高,所需样本量小,基于酶标仪的数据获得方便快速,具有重复性好等优点。
附图说明
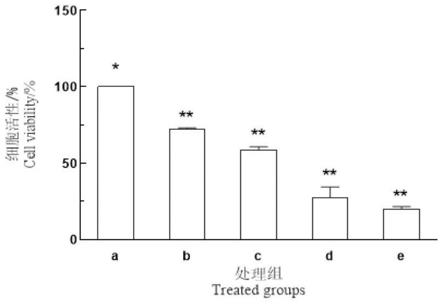
26.图1为氧糖剥夺共pm2.5染毒模型的细胞活力,其中与正常对照组比较, **p《0.01。
27.图2为氧糖剥夺共pm2.5染毒模型的细胞凋亡,(a)、(b)、(c)分别为正常对照组、ogd组、ogd pm2.5 50μg/ml模型组。
具体实施方式
28.以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
29.以下实施例所采用的氧糖剥夺装置包括容器本体、与容器本体可拆卸连接的盖子;容器本体为上端开放的容器,其上端与盖子配合实现密封;在盖子的顶部开有两个通孔,分别作为出气口和进气口;所述出气口通过管路接装有超纯水的容器,管路置于液面下方;所述进气口通过管路接通气。培养基为神经细胞提供正常的营养物质,其成分主要有:dmem培养基88wt%、胎牛血清10wt%、抗生素2wt%,其中抗生素包括青霉素和链霉素。
30.实施例1:建立细胞氧糖剥夺共pm2.5染毒模型
31.(1)pm2.5颗粒的采集:pm2.5颗粒用th-150c型智能颗粒物中流量采样器采集,含14个通道,分别测量16nm-10μm尺寸范围内的空气传播颗粒尺寸分布。采样地点为浙江大学紫金港校区环境学院顶楼,对2020年七月至八月进行pm2.5颗粒物采集,每天采样24h,连续采集一个月。周围没有大型的工业或热电厂,大气污染的主要来源是车辆交通。
32.(2)pm2.5悬浊液的制备:采集完后,取粘附有pm2.5颗粒的滤膜剪成1cm
ꢀ×
1cm小块,浸入装有100ml超纯水的烧杯中,超声仪振荡处理80min(温度 20℃),用干净的玻璃棒来回刮取滤膜表面直到滤膜颜色变浅,振荡结束用五层纱布过滤至离心管中,用冷冻干燥机处理,使水分完全蒸发,收集灰黑色絮状物,根据实验所需,配制不同浓度的pm2.5悬浊液,贴好标签,置于4℃冰箱保存。
33.(3)首先对神经细胞进行培养,步骤如下:
34.将细胞悬液接种到培养瓶中,并加入3ml培养基,做好标记,置于co2培养箱中孵育。待pc12细胞生长到70%-80%贴壁率时,培养瓶弃去原有的培养基,取2ml pbs液清洗一次,加入0.25%胰酶消化细胞,当细胞收缩变圆,细胞间隙增大并脱离瓶壁后,加入2ml培养基终止消化,将上述液体转至离心管中,以 1000r/min离心5min,弃去上清液,加入3ml培养基,均匀吹打分散细胞制成细胞悬液,将细胞悬液以每孔6
×
103个细胞接种到96孔板中,每组设6个复孔,做好标记,置于co2培养箱中培养24h。
35.(4)氧糖剥夺共pm2.5染毒造模,步骤如下:
36.本实验中,一共分为5组:正常对照组、氧糖剥夺(ogd)组、ogd pm2.5 (25μg/ml、50μg/ml、100μg/ml)模型组,每组设6个复孔。实验期间,对照组在常规培养箱中培养,ogd组只进行氧糖剥夺,不加pm2.5染毒,ogd pm2.5 模型组具体操作如下:待上述(3)中的细胞贴壁长满培养板的80%左右,用pbs 清洗2次,用无糖的dmem培养基洗涤1次,同时加入无糖的dmem培养基和不同浓度的pm2.5,置于氧糖剥夺装置,通入95%氮气和5%二氧化碳的混合气体,ogd和pm2.5染毒联合处理4h后,将孔板里的无糖培养基吸弃,pbs 清洗一次,加入培养基和不同浓度的pm2.5,放入co2恒温培养箱培养2h。
37.实施例2:pm2.5暴露对氧糖剥夺后神经细胞活性的影响
38.(1)建立氧糖剥夺共pm2.5染毒模型,待细胞贴壁长满96孔板的80%左右,用pbs清洗2次,用无糖的dmem培养基洗涤1次,加入无糖的dmem 培养基和不同浓度的pm2.5悬浊液,置于氧糖剥夺装置中,在95%氮气和5%二氧化碳的混合气体通气环境中,ogd和pm2.5染毒联合处理4h后,将孔板里无糖的dmem培养基吸弃,pbs清洗一次,加入培养基和不同浓度的pm2.5,放入co2恒温培养箱培养2h;恒温co2培养箱的培养条件为37℃、5%co2。
39.(2)本实验中,设置空白对照组、正常对照组、ogd组、ogd pm2.5模型组,每组设6个复孔。实验期间,对照组在常规培养箱中培养;ogd组只进行氧糖剥夺,不加pm2.5染毒;ogd pm2.5模型组按上述(1)操作。
40.(3)其中空白对照组(无细胞),等各组处理后的细胞到检测时间时,吸弃上清液,在避光的环境中向各孔加入20μl cck-8溶液和80μl培养基,培养箱孵育1h后,用酶标仪在450nm波长处检测各孔吸光度值,计算细胞活力,细胞存活率%=(od值
实验组-od值
空白组
)/(od
对照组-od值
空白组
)*100。
41.结果如图1所示,与对照组比较(细胞存活率为100%),ogd组的细胞存活率降低,差异极显著(p《0.01),表明ogd处理后能对细胞造成一定程度的损伤,而ogd pm2.5模型组细胞存活率更低,其中低、中、高3个剂量组细胞存活率有不同程度的降低,差异极显著(p《0.01)。结果表明,随着pm2.5浓度的增加,细胞存活率依赖性降低。
42.实施例3:pm2.5暴露对氧糖剥夺后神经细胞凋亡的影响
43.(1)建立氧糖剥夺共pm2.5染毒模型,待细胞贴壁长满培养板的80%左右,用pbs清洗2次,用无糖的dmem培养基洗涤1次,加入无糖的dmem培养基和不同浓度的pm2.5悬浊液,置于氧糖剥夺装置中,在95%氮气和5%二氧化碳的混合气体通气环境中,ogd和pm2.5染毒联合处理4h后,将孔板里无糖的dmem培养基吸弃,pbs清洗一次,加入培养基和不同浓度的pm2.5,放入 co2恒温培养箱培养2h;恒温co2培养箱的培养条件为37℃、5%co2。
44.(2)本实验中,设置正常对照组、ogd组、ogd pm2.5 50μg/ml模型组。实验期间,对照组在常规培养箱中培养;ogd组只进行氧糖剥夺,不加pm2.5 染毒;ogd pm2.5模型组按上述步骤(1)操作。
45.(3)等各组处理后的细胞到检测时间时,吸弃上清液,用pbs清洗两次,每孔加入10ulao/eb工作液,轻轻吹打混匀,室温避光孵育5min,染色结束后,吸弃工作液,pbs清洗1次,将96孔板倒扣有利于显微镜聚焦且无气泡产生,做好标记置于荧光显微镜下观察。
46.结果如图2显示,在荧光显微镜下可以观察到4种不同状态的细胞:核染色质显绿色同时呈现出完整的结构是正常活细胞;核染色质显橘红色且呈现出完整的结构是非凋亡的死亡细胞;核染色质显绿色但呈现出的结构似固缩状的是早期凋亡的细胞;核染色质显橘红色且呈现出的结构似固缩状的是晚期凋亡的细胞。如下图所示,在荧光显微镜下观察到,经ao/eb染色后,对照组细胞大部分状态比较好,呈正常结构,显绿色荧光,一小部分细胞出现凋亡印迹,细胞显橘红色荧光。与对照组相比,ogd pm2.5 50μg/ml模型组橘红色荧光的细胞数明显升高。这表明,暴露于pm2.5会使细胞凋亡越严重。
47.实施例4:pm2.5暴露对氧糖剥夺后神经细胞内乳酸脱氢酶的影响
48.(1)建立氧糖剥夺共pm2.5染毒模型,待细胞贴壁长满培养板的80%左右,用pbs清洗2次,用无糖的dmem培养基洗涤1次,加入无糖的dmem培养基和不同浓度的pm2.5悬浊液,
置于氧糖剥夺装置中,在95%氮气和5%二氧化碳的混合气体通气环境中,ogd和pm2.5染毒联合处理4h后,将孔板里无糖的dmem培养基吸弃,pbs清洗一次,加入培养基和不同浓度的pm2.5,放入 co2恒温培养箱培养2h;恒温co2培养箱的培养条件为37℃、5%co2。
49.(2)本实验中,设置样品最大酶活性组、正常对照组、ogd组、ogd pm2.5模型组,每组设6个复孔。实验期间,对照组在常规培养箱中培养; ogd组只进行氧糖剥夺,不加pm2.5染毒;ogd pm2.5模型组按上述步骤(1) 操作。
50.(3)将各组处理后的细胞,做好标记,到预定的检测时间前1h,在避光的环境中向样品最大酶活性组中加入ldh释放试剂后,反复吹打多次混匀,培养箱继续孵育。到检测时间点,各孔取120μl上清液并加入至新的96孔板相对应的孔中,用酶标仪在490nm处检测各孔吸光度值。
51.(4)细胞释放的乳酸脱氢酶(ldh)活性作为细胞膜完整性丧失的一个重要指标,其原理是当细胞凋亡时会引起细胞膜结构的破坏导致胞浆内的酶释放,其中包括乳酸脱氢这种酶活性相对稳定的酶。结果如表1,与对照组相比,ogd 组中的ldh释放率升高(p《0.05),ogd pm2.5模型组中ldh释放率和pm2.5 浓度呈依赖性关系具有显著性差异(p《0.01),结果表明当pm2.5浓度升高时对膜结构破坏会越大,释放出的ldh就越多。
52.表1为氧糖剥夺共pm2.5染毒模型的细胞中乳酸脱氢酶(ldh)的释放率
[0053][0054]
其中,与正常对照组比较,**p《0.01。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。