用于偶联的多肽复合物及其应用
发明领域
1.本发明一般涉及免疫、细胞生物学、分子生物学和医药领域。更具体地说,本发明涉及用于偶联的多肽复合物及其应用。
背景技术:
2.抗体是多功能的免疫球蛋白,具有对靶抗原的独特结合特异性以及一系列非抗原依赖性免疫相互作用,由此使它们在免疫系统中发挥着重要作用。许多当前使用的治疗用生物药物、诊断试剂和研究试剂是针对感兴趣的病理、免疫或生物学机制相关抗原的抗体。
3.近年来,人们为开发带有药物负载的抗体偶联物做出了大量的努力。就抗体药物偶联物(adc)而言,adc包含用于靶向的抗体,用于药物附接的接头和作为效应物的高效的药物负载。抗体或其相关形式通过抗体-抗原相互作用将细胞毒性药物带入表达抗原的细胞或其他靶细胞。同时,药物与抗体偶联后毒性显著下降。因此,adc通过降低最小有效剂量(med)和提高最大耐受剂量(mtd)扩大了治疗窗口。已获得fda批准的adc类药物的例子有mylotarg、adcetris、kadcyla、besponsa、polivy、padcev、enhertu和trodelvy。
4.adc研发成功取决于抗体的选择、接头-药物负载的选择、接头-药物负载的偶联的方式以及偶联过程的研发。抗体中的半胱氨酸硫醇作为强亲核试剂是理想的偶联反应基团。抗体的天然形式中,半胱氨酸残基以二硫键形式存在,因此,抗体轻链与重链以及重链与重链之间的二硫键还原为偶联提供了理想的游离半胱氨酸巯基。在本领域中已经开发出许多偶联方法来应对获取优选负载-抗体比(par)和偶联位置所提出的机遇与挑战。理想情况下,应将中等数量的负载连接到抗体,由此得到的是异质性的adc产品。低par的偶联产品缺乏足够的疗效,高par的产品则毒性高且不稳定性。所以,adc的异质性阻碍了治疗窗口的扩大。因此,人们致力于采用如抗体的工程改造等方法来提高adc产品的均质性。
5.一种方法采用对抗体的点突变来诱导产生具有高反应性残基的氨基酸供偶联之用。thiomab
tm
技术是由genentech开发的,可引入抗体的半胱氨酸突变(jagath rjunutula等,“细胞毒性药物与抗体的位点特异性偶联可改善治疗指数(site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index)”,nature biotechnology,2008,26(8):925-932)。thiomab偶联发生在还原后的工程化半胱氨酸残基上,由此得到高均质的偶联产物。非天然氨基酸(nnaa)技术也被用于生产均质性的偶联物。例如,在抗体中引入带有酮基或叠氮基的非天然氨基酸作为偶联位点(jun y.axup等,“用非天然氨基酸合成位点特异性抗体-药物偶联物(synthesis of site-specific antibody-drug conjugates using unnatural amino acids)”,pnas,2012,109(40):16101-16106;michael p.vanbrunt等,“哺乳动物细胞中基因编码的含叠氮氨基酸可通过点击环加成化学形成位点特异性抗体-药物偶联物(genetically encoded azide containing amino acid in mammalian cells enables site-specific antibody
–
drug conjugates using click cycloaddition chemistry)”,bioconjugate chem.,2015,26(11):2249-2260),此种方法的偶联由于特异性的反应也获得了高均质性的产物。
6.基于定点诱变的方法有缺点。首先,需要仔细选择突变位点,否则抗体的稳定性和结合效率都会受到影响。其次,点突变抗体的表达水平通常很低,这在化工、制造与控制(cmc)阶段可能成为问题。
7.另一种方法是引入短的多肽标签作为酶可识别的偶联位点。谷氨酰胺标签(llqg)作为mtg识别基序(pavel strop等,“位点的重要性:结合位点调节抗体药物偶联物的稳定性和药代动力学(location matters:site of conjugation modulates stability and pharmacokinetics of antibody drug conjugates)”,chemistry&biology,2013,20(2):161-167)、lpetg作为分选酶a识别基序(roger r.beerli等,“分选酶介导形成体外体内高效力的位点特异性抗体药物偶联物(sortase enzyme-mediated generation of site-specifically conjugated antibody drug conjugates with high in vitro and in vivo potency)”,plos one,2015,10(7):e0131177)、以及lcxp xr作为甲酰基甘氨酸生成酶(fge)识别基序(peng wu等,“用遗传编码醛标签在哺乳动物细胞中产生的定点化学修饰的重组蛋白(site-specific chemical modification of recombinant proteins produced in mammalian cells by using the genetically encoded aldehyde tag)”,pnas,2009,106(9):3000-3005)用于偶联获得了高度均质的产物,其中,药物连接于多肽标签。
8.短多肽标签的缺点类似于基于定点诱变的方法。需要筛选多肽标签的插入位点,通常多肽标签可用的位点是有限的。并且,使用该策略时带标签抗体的表达滴度也是个难点。
9.产生抗体偶联物最直接的方法是利用抗体重链和轻链多肽中天然半胱氨酸的巯基。巯基作为强亲核试剂能在水相中发生快速有效的偶联反应。在fda批准的adc药物adcetris和polivy中,通过半胱氨酸残基上的巯基与用于单甲基澳瑞他汀e(mmae)的接头中的马来酰亚胺基团反应将mmae偶联在部分还原链间二硫键产生的半胱氨酸残基上。这里,优选部分还原而不是全部还原,因为药物的疏水性和所有半胱氨酸残基都连接药物时的位阻会导致adc药物在血浆中不稳定。但是,部分还原产物的均质性很差。据报道,优选igg1型抗体部分还原后平均有四个游离巯基,因为adc的药物-抗体比率(dar)为4时在体内具有最佳的治疗指数。
10.igg亚类igg1、igg2、igg3和igg4之间在二硫键结构方面有许多相似之处和不同之处。以最常用作治疗用生物药的igg1和igg4为例,igg1和igg4的两条重链都通过两个二硫键连接并且总共有12个链内二硫键;然而,igg1的轻链通过其最后一个残基与重链第五个半胱氨酸残基之间的二硫键与重链相连,而igg4的轻链通过其最后一个半胱氨酸残基与重链第三个半胱氨酸残基之间二硫键与重链相连(见图1)。通常,链内二硫键和链间二硫键的溶剂暴露水平是不同的。链内二硫键都埋在各结构域的二级结构之间,不暴露在溶剂中。位于铰链区的链间二硫键都高度暴露在溶剂中,包括igg1和igg4的重链-重链间二硫键和igg1的重链-轻链间二硫键。igg4重链-轻链间二硫键位于比较不易触及的vh和ch1结构域界面之间,因此与溶剂的接触度不高。不同二硫键之间溶剂暴露程度差异对抗体的生物偶联具有重要意义,因为暴露的半胱氨酸残基被认为比不暴露的半胱氨酸残基更具反应性(hongcheng liu和kimberly may,“igg分子的二硫键结构:结构变化、化学修饰以及对稳定性和生物学功能可能的影响(disulfide bond structures of igg molecules:
structural variations,chemical modifications and possible impacts to stability and biological function)”,mabs,2012,4(1):17-23)。有实验表明,igg1的重链-轻链间二硫键和重链-重链间二硫键均为高反应性。
11.铰链区是抗体fab与fc之间的柔性接头。在igg亚类igg1、igg2、igg3和igg4之间,铰链区的长度和柔性差异很大。以最常用作治疗用生物药的igg1和igg4为例,igg1的铰链区有15个氨基酸且非常柔性,而igg4的铰链区较短,只有12个氨基酸(“igg亚类和同种异型:从结构到效应着功能(igg subclasses and allotypes from structure to effector functions)”,gestur vidarsson等,frontiers in immunology,2014年十月20日,5:520)。野生型igg1和igg4在核心铰链区(eu编号226-229)相差一个氨基酸:igg1中为cys-pro-pro-cys而igg4中为cys-pro-ser-cys。天然igg4在核心铰链区存在链间半胱氨酸与链内半胱氨酸二硫键之间的平衡,因此可以观察到重链臂交换和分泌后igg4半抗体分子的存在。业已证实,igg4的s228p突变可通过防止自然臂交换来显著稳定igg4重链之间的共价相互作用(s.angal等,“单个氨基酸取代消除了嵌合小鼠/人(igg4)抗体的异质性(a single amino acid substitution abolishes the heterogeneity of chimeric mouse/human(igg4)antibody)”,molecular immunology,1993,30(1):105-108;john-paul silva等,“新型定量免疫测定法联合生理基质制备证明s228p突变可防止体内和体外igg4 fab臂交换(the s228p mutation prevents in vivo and in vitro igg4 fab-arm exchange as demonstrated using a combination of novel quantitative immunoassays and physiological matrix preparation)”,journal of biological chemistry,2015,290(9):5462-5469),因此已广泛用于igg4抗体的开发和生产。s228p突变在igg4铰链中形成多脯氨酸螺旋(下铰链区中的5个pro),配合较短的igg4铰链长度,与igg1铰链(下铰链区中有3个pro)相比进一步限制了其柔性。不同铰链之间的柔性差异对抗体的生物偶联具有重要意义,因为位于柔性铰链片段中的半胱氨酸残基被认为比位于刚性铰链中的半胱氨酸残基更具反应性。有实验表明,s228p igg4的重链-轻链间二硫键和重链-重链间二硫键均为弱反应性。
12.利用天然半胱氨酸进行抗体偶联的缺点是igg1和igg4中四个链间二硫键之间的反应性相似,导致偶联产物高度异质。而如前所述,这种异质性缩小了偶联药物临床应用的治疗窗口。例如,通过部分还原igg1抗体中天然链间二硫键产生的adc产生具有正态分布的产物混合物。具有最佳治疗指数的种类即偶联数为4(par4)的种类仅占总混合物的40%。低偶联数的种类(par0和par2)缺乏治疗功效,而高偶联数的种类(par6和par8)则表现出高毒性和不稳定性(kevin j.hamblett等,“载药量对单克隆抗体偶联物抗肿瘤活性的影响(effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate)”,clinical cancer research,2004,10(20):7063-7070;yilma t.adem等,“澳瑞他汀抗体药物偶联物理不稳定性和药物载量的作用(auristatin antibody drug conjugate physical instability and the role of drug payload)”,bioconjugate chem.,2014,25(4):656-664)。igg4抗体部分还原产物的异质性甚至更高,当完全还原的抗体的水平已经很高时仍有许多未还原的抗体(图1)。
13.因此,仍然需要改善抗体生物偶联的par,特别是对于治疗应用而言,从而尽量消除上述一些或全部缺点。
技术实现要素:
14.本文提供用于偶联的多肽复合物及其应用。
15.第一个方面,本文提供多肽复合物,所述多肽复合物从n末端至c末端包含fab结构域和与之操作性连接的铰链区,其中,所述fab结构域或其部分和所述铰链区或其部分源自不同的igg亚型或其部分。
16.某些实施方式中,多肽复合物是或包含免疫球蛋白。某些实施方式中,多肽复合物是或包含抗体。
17.某些实施方式中,铰链区或其部分是人igg1、igg2、igg3或igg4型铰链区或其部分。
18.某些实施方式中,铰链区或其部分是人igg1或igg4型铰链区或其部分。
19.某些实施方式中,铰链区或其部分是人igg1型铰链区或其部分。某些实施方式中,铰链区或其部分为igg1型而fab结构域为igg4型。
20.某些实施方式中,铰链区或其部分包含:(a):dkthtcppcp(seq id no:1)中所示序列或其片段;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个突变,所述突变选自插入、缺失和取代,或者所述变体包含一个或多个非天然氨基酸残基。
21.某些实施方式中,铰链区或其部分包含:(a):epksdkthtcppcp(seq id no:2)或epkdkthtcppcp(seq id no:3)中所示的序列;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个突变,所述突变选自插入、缺失和取代,或者所述变体包含一个或多个非天然氨基酸残基。
22.某些实施方式中,铰链区或其部分包含:(a):seq id no:12至14中任一所示的序列或其片段;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个突变,所述突变选自插入、缺失和取代,或者所述变体包含一个或多个非天然氨基酸残基。
23.某些实施方式中,铰链区或其部分是人igg4型铰链区或其部分。某些实施方式中,铰链区或其部分为igg4型而fab结构域为igg1型。
24.某些实施方式中,铰链区或其部分包含:(a):epksceskygppcppcp(seq id no:4)中所示序列或其片段;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个突变,所述突变选自插入、缺失和取代,或者所述变体包含一个或多个非天然氨基酸残基。
25.某些实施方式中,铰链区或其部分包含:(a):epkscskygppcppcp(seq id no.5)或epksckygppcppcp(seq id no.6)或epkscygppcppcp(seq id no.7)或epkceskygppcppcp(seq id no.11)中所示序列;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个选自插入、缺失和取代的突变,或者所述变体包含一个或多个非天然氨基酸残基。
26.某些实施方式中,铰链区或其部分包含:(a):epkscskyghtcppcp(seq id no.8)或epkscskyghpcppcp(seq id no.9)或epkscskygptcppcp(seq id no.10)中所示序列;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个选自插入、缺失和取代的突变,或者所述变体包含一个或多个非天然氨基酸残基。
27.某些实施方式中,铰链区或其部分包含:(a):seq id no:15至17中任一所示的序列或其片段;或者(b):与(a)至少85%相同的序列;或者(c):(a)或(b)的变体,所述变体具有一个或多个突变,所述突变选自插入、缺失和取代,或者所述变体包含一个或多个非天然氨基酸残基。
28.另一方面,本文还包括还含有与铰链区操作性连接的fc多肽的多肽复合物或者还含有与铰链区操作性连接的其他多肽的多肽复合物。
29.某些实施方式中,所述fc多肽是人igg1、igg2、igg3或igg4型fc多肽。
30.某些实施方式中,fc多肽是人igg1或igg4型fc多肽。
31.另一相关方面中,本文包括抗体药物偶联物,其中包含本文所述的多肽复合物。
32.一相关方面中,本文包括药物组合物,其中包含本文所述的药物抗体偶联物和药学上可接受的运载体或赋形剂。
33.另一相关方面中,本文包括试剂盒,其中包含本文所述的多肽复合物、或本文所述抗体药物偶联物、或本文所述药物组合物。这样的试剂盒可用于科研目的,或者用作治疗或诊断药剂或用作预防性治疗药。
34.另一方面,本文包括制备本文所述抗体药物偶联物的方法,包括:
35.提供本文所述多肽复合物中任一种;
36.马来酰亚胺基或卤代乙酰基部分与链间二硫键还原产生的半胱氨酸残基上的游离巯基进行迈克尔加成反应(michael addition reaction)。
37.某些实施方式中,所述游离巯基是用温和还原剂例如tcep或dtt部分还原链间二硫键产生的;较好的是,所述部分还原反应在ph约4.0至8.0的缓冲液中进行,还原剂(例如tcep)/mab之比约3至10,反应温度约4℃至37℃,反应时间约1至24小时。
38.某些实施方式中,可以用温和还原剂例如tcep或dtt部分还原链间二硫键来产生游离巯基。某些实施方式中,部分还原在ph约4.0至8.0(例如ph 5.0至7.0、ph 5.0至6.0、ph 5.5或ph 6.0)的缓冲液中进行,还原剂/mab之比约1至20、1至15、1至10、1至5、3至20、3至16、3至6或4至8,反应温度约4℃至37℃、4℃至20℃、4℃至15℃、4℃至10℃或15℃至37℃,和/或还原时间约1小时至24小时、2至16小时、2至5小时或3至5小时。
39.某些实施方式中,部分还原的温度约15℃至37℃,和/或还原剂/mab之比约3至6,其中,多肽复合物的铰链区或其部分源自igg1型铰链区或igg4型铰链区,可选地,所述多肽复合物还具有igg1或igg4型fc多肽。某些实施方式中,多肽复合物的铰链区具有seq id no:1至3和12至14中任一项所示的序列。某些实施方式中,多肽复合物的铰链区具有seq id no:15至17中任一项所示的序列。
40.某些实施方式中,部分还原的温度约4℃至25℃,优选约4℃至20℃、4℃至15℃或4℃至10℃,和/或还原剂/mab之比约1至20,优选约1至15、3至16、3至8、1至6或3至5,其中,多肽复合物的铰链区或其部分源自具有后文结构式ii的铰链区,可选地,所述多肽复合物还具有igg1或igg4 fc多肽。某些实施方式中,多肽复合物的铰链区具有seq id no:4至11中任一项所示的序列。
41.某些实施方式中,偶联反应在ph约4.0至8.0的缓冲液中进行,有机添加剂(例如有机溶剂或有机助溶剂)约0.0%至20.0%(重量百分比),药物/mab之比约7至20,反应温度约4℃至37℃,反应时间约1至4小时。
42.另一方面,本文包括所述多肽复合物用于制造抗体药物偶联物的应用。
43.另一方面,本文包括为有需要的对象治疗疾患的方法,包括给予所述对象治疗有效量的本文所述抗体药物偶联物。
44.通过以下详细说明,本发明的其他目的、特征和优点将显而易见。然而,应当明白,详细说明和具体实施例虽然提示某些优选实施方式但仅仅是举例说明,本领域普通技术人员通过阅读详细说明可以容易地得出本发明精神和范围之内的各种变换形式。
45.附图简要说明
46.以下所述附图属于说明书的一部分,包括于此用以进一步说明本文某些方面的内容。参照这些附图中的一幅或者多幅并结合具体实施方式的详细描述可更好地理解本发明。
47.图1显示igg1和igg4的结构,以及用igg1和igg4抗体经部分还原并经游离巯基与mc-vc-pab-mmae偶联反应所得偶联抗体药物偶联物的hic-hplc结果。
48.图2显示抗体886-5的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc结果。通过对铰链区的工程改造,用基于igg4的该抗体制得的adc其均质性显著改进。
49.图3显示抗体886-8的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc结果。通过对铰链区的工程改造并将igg1-fab与igg4-fc组合,用该抗体制得的adc均质性显著改善。
50.图4显示抗体886-13的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc结果。通过对铰链区的工程改造,用基于igg1的该抗体制得的adc其均质性显著改进。
51.图5显示抗体886-29的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc结果。通过对铰链区的工程改造,用基于igg4的该抗体制得的adc其均质性显著改进。
52.图6显示抗体886-34的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc结果。通过对铰链区的工程改造,用该抗体制得的adc均质性显著改进。
53.图7显示抗体886-16的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc和plrp-hplc结果。对886-16-mmae的特征鉴定显示886-16-mmae能够用于体外(in vitro)和体内(in vivo)研究。
54.图8显示抗体886-19的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc和plrp-hplc结果。对886-19-mmae的特征鉴定显示886-19-mmae能够用于体外(in vitro)和体内(in vivo)研究。
55.图9显示抗体886-17的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc和plrp-hplc结果。对886-17-mmae的特征鉴定显示886-17-mmae能够用于体外(in vitro)和体内(in vivo)研究。
56.图10显示抗体886-20的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc和plrp-hplc结果。对886-20-mmae的特征鉴定显示886-20-mmae能够用于体外(in vitro)和体内(in vivo)研究。
57.图11显示抗体886-18的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc和plrp-hplc结果。对886-18-mmae的特征鉴定显示886-18-mmae能够用于体外(in vitro)和体内(in vivo)研究。
58.图12显示抗体886-21的结构,以及与mc-vc-pab-mmae偶联后的hic-hplc和plrp-hplc结果。对886-21-mmae的特征鉴定显示886-21-mmae能够用于体外(in vitro)和体内
terminus)而将多肽序列的右端称为羧基末端(c末端)。本文中,“多肽复合物”指复合物包含一个或相互联合以行使特定功能的一个以上多肽的复合物。某些实施方式中,多肽是免疫相关多肽。
68.本文中,术语“抗体”涵盖任何与特定抗原结合的免疫球蛋白、单克隆抗体、多克隆抗体、多特异性抗体或双特异性(二价)抗体。天然全抗体包含两条重链和两条轻链。每条重链由可变区(“hcvr”)和第一、第二和第三恒定区(ch1、ch2和ch3)组成,每条轻链由可变区(“lcvr”)和恒定区(cl)组成。哺乳动物的重链被分类为α、δ、ε、γ和μ,哺乳动物轻链被分类为λ或κ。抗体呈“y”形,y的干部由两条重链的第二和第三恒定区组成,它们通过二硫键相互结合。y的臂各自包括与一条轻链的可变区和恒定区结合的一条重链的可变区和第一恒定区。轻链和重链的可变区负责抗原结合。两条链的可变区通常均包含三个高度可变的环,称为互补决定区(cdr)(包括lcdr1、lcdr2和lcdr3的轻(l)链cdr,包括hcdr1、hcdr2、hcdr3的重(h)链cdr)。可根据kabat、chothia或al-lazikani约定定义或识别抗体的cdr边界(al-lazikani,b.,chothia,c.,lesk,a.m.,j.mol.biol.,273(4),927(1997);chothia,c.等,j mol.biol.dec 5;186(3):651-63(1985);chothia,c.和lesk,a.m.,j.mol.biol.,196,901(1987);chothia,c.等,nature.dec 21-28;342(6252):877-83(1989);kabat e.a.等,national institutes of health,bethesda,md.(1991))。三个cdr插在称为框架区(fr)的侧翼序列之间,框架区与cdr相比高度保守并形成了支撑高变环的支架。每一vh和vl通常包括三个cdr和四个fr,其从氨基端到羧基端按照以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。重链和轻链的恒定区不参与抗原结合,但是表现出各种效应功能。根据抗体重链恒定区的氨基酸序列将抗体分类。抗体的五个大类或同种型是iga、igd、ige、igg和igm,其特征分别是具有α、δ、ε、γ和μ重链。有几个大类的抗体又分为亚类,例如igg1(γ1重链),igg2(γ2重链),igg3(γ3重链),igg4(γ4重链),iga1(α1重链)或iga2(α2重链)。据此,本发明中,某特定igg亚型例如“igg1”或“igg1(亚)型”表示属于该指定亚类的igg同种型,不同的igg亚型则表示不同亚类的igg同种型。
69.本文中,就抗体而言的“可变结构域”指包含一个或多个cdr的抗体可变区或其片段。尽管可变结构域可以包含完整可变区(例如hcvr或lcvr),但也可以包含非完整可变区但保留与抗原结合或形成抗原结合位点的能力。
70.本文中,术语“抗原结合部分”指由包含一个或多个cdr的抗体部分形成的抗体片段,或与抗原结合但不包含完整天然抗体结构的任何其他抗体片段。抗原结合部分的例子包括但不限于可变域、可变区、双抗体、fab、fab'、f(ab')2、fv片段、二硫化物稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫化物稳定的双抗体(ds双抗体)、多特异性抗体、驼源化单域抗体、纳米抗体、结构域抗体和二价结构域抗体。抗原结合部分能够与亲本抗体结合相同的抗原。某些实施方式中,抗原结合部分可包含来自特定人抗体的一个或多个cdr,与来自一种或多种非人抗体的框架区嫁接。有关抗原结合部分的更多具体形式,可参见spiess等,2015年(同上)和brinkman等,mabs,9(2),第182-212页(2017年),在此通过引用全文纳入本文。
[0071]“fab”指免疫球蛋白(如抗体)中由一条轻链(可变区和恒定区)通过二硫键与一条重链的可变区和第一恒定区结合而成的部分。某些实施方案中,轻链和重链的恒定区均被tcr恒定区代替。fab部分负责抗原结合。
[0072]“fab'”指包括抗体轻链与由可变区(vh)和第一恒定区(ch1)构成的重链部分共价结合的片段和部分铰链区。
[0073]“fc”指免疫球蛋白(如抗体)中由第一重链的第二(ch2)和第三(ch3)或者还有第四(ch4,例如在igm中)恒定区与第二重链的第二和第三或者还有第四恒定区结合构成的部分,或者指免疫球蛋白(如抗体)中由第一重链的部分铰链区、第二(ch2)和第三(ch3)或者还有第四(ch4,例如在igm中)恒定区与第二重链的部分铰链区、第二和第三或者还有第四恒定区结合构成的部分。抗体的fc部分负责各种效应功能,例如adcc和cdc,但在抗原结合中不起作用。
[0074]
本文中,术语抗体的“绞链区”包括连接ch1结构域与ch2结构域的重链分子部分。铰链区包含约12至62个氨基酸并且是柔性的,因此允许两个n末端抗原结合区独立地移动。
[0075]
本文中,术语“ch2结构域”包括这样的重链分子的部分,即按照常规编号方案igg抗体约第244位氨基酸至第360位氨基酸(氨基酸244至360,kabat编号系统;氨基酸231至340,eu编号系统;参见kabat ea等,美国卫生与公共服务部(u.s.department of health and human services)(1983))。
[0076]“ch3结构域”从igg分子的ch2结构域延伸至c末端,包含大约108个氨基酸。某些免疫球蛋白类别,例如igm,还有ch4区。
[0077]
抗体的“fv”指带有完整抗原结合位点的最小抗体片段。fv片段由与单条重链的可变域结合单条轻链的可变域构成。已经有许多fv设计,包括dsfv,其中通过引入二硫键增强两个结构域之间的联合;可用肽接头将两个结构域连成单个多肽而形成scfv。已经生产出了含有与相应免疫球蛋白重链或轻链可变区和恒定区相关联的重免疫球蛋白链或轻免疫球蛋白链可变区的fvs构建体。并且,已有人将fv多聚化成双抗体和三抗体(maynard等,annu rev biomed eng 2 339-376(2000))。
[0078]
氨基酸序列(或核酸序列)的“百分比(%)序列同一性”定义为将序列对齐并根据需要引入空位以实现相同氨基酸(或核酸)数量最大化后,候选序列中与参考序列中氨基酸(或核酸)相同的氨基酸(或核酸)残基的百分比。氨基酸残基的保守取代可以认为或不认为是相同的残基。为了确定氨基酸(或核酸)序列同一性百分比定的比对可以采用公开的工具如blastn、blastp(可在美国国家生物技术信息中心(ncbi)的网站上获得),另见altschul sf等,j.mol.biol.,215:403
–
410(1990);stephen f.等,nucleic acids res.,25:3389-3402(1997)),clustalw2(可在欧洲生物信息学研究所网站上找到),另见higgins dg等,methods in enzymology,266:383-402(1996);larkin ma等,bioinformatics(英国,牛津),23(21):2947-8(2007)),以及align或megalign(dnastar)软件。本领域技术人员可使用工具的默认参数,或者可以定制适合比对的参数,例如通过选择合适的算法。
[0079]
本文中,“抗原”或“ag”指能刺激细胞培养物或动物产生抗体或t细胞应答的化合物、组合物、肽、多肽、蛋白质或物质,包括加入细胞培养物中(例如杂交瘤)或注射至或吸收至动物体内的组合物(例如包含癌特异性蛋白的组合物)。抗原与特定体液免疫或细胞免疫产物(例如抗体)—包括由异源抗原诱导的产物—反应。
[0080]“表位”或“抗原决定簇”指结合剂(例如抗体)结合的抗原区域。表位既可以由连续氨基酸形成(亦称线性表位或连续表位),也可以通过蛋白质三级折叠并置的非连续氨基酸形成(亦称构型或构象表位)。由连续氨基酸形成的表位通常沿蛋白质的一级氨基酸残基线
性排列,这些连续氨基酸小片段可以从与主组织相容性复合物(mhc)分子结合的抗原中消化出来或在暴露于变性溶剂中时得以保留,但是由三级折叠形成的表位通常因变性溶剂处理而丢失。表位通常包含呈现独特空间构象的至少3个、更通常至少5个、约7个或约8-10个氨基酸。
[0081]
本文至,术语“特异性结合”指两个分子之间的非随机结合反应,例如抗体和抗原之间。某些实施方案中,本文中的多肽复合物和双特异性多肽复合物特异性结合抗原的结合亲和力(kd)≤10-6
m(例如≤5x10-7
m、≤2x10-7
m、≤10-7
m、≤5x10-8
m、≤2x10-8
m、≤10-8
m、≤5x10-9
m、≤2x10-9
m、≤10-9
m或≤10-10
m)。本文中,kd指解离速率与结合速率之比(k
off
/k
on
),可以用表面等离子共振法例如用biacore等仪器来测定。
[0082]
本文中,术语“操作性连接”或“可操作地连接”指两个或更多个目标生物序列的并置,有或没有间隔子或接头,并置的方式使得它们处于允许各自以预期方式起作用的关系中。用于多肽时表示多肽序列以允许连接产物具有预期生物功能的方式连接。例如,抗体可变区可以操作性连接恒定区以提供具有抗原结合活性的稳定产物。该术语也可以用于多核苷酸。例如,当编码多肽的多核苷酸操作性连接调控序列(例如启动子、增强子、沉默子序列等)时,指多核苷酸以允许调控多核苷酸的多肽表达的方式连接。
[0083]
铰链区是连接免疫球蛋白ch1的c末端与ch2结构域n末端的连续氨基酸残基区域。人igg1中,铰链区按照eu编号为残基216至230。人igg4中,铰链区按照eu编号为残基219至230。。
[0084]
本文中,氨基酸残基“取代”指在肽、多肽或蛋白质中自然发生或诱导的一个或多个氨基酸被另一个或多个氨基酸取代。多肽内的取代可能会导致多肽功能的减弱、增强或消除。
[0085]
氨基酸序列中的取代也可以是“保守取代”,指用侧链理化性质相似的不同氨基酸残基进行取代,或取代那些对多肽的活性而言不重要的氨基酸。例如,可以在具有非极性侧链的氨基酸残基(例如met、ala、val、leu与ile、pro、phe、trp)之间,在具有不带电极性侧链的残基(例如cys、ser、thr、asn、gly和gln)之间,具有酸性侧链的残基(例如asp、glu)之间,具有碱性侧链的氨基酸(例如his、lys和arg)之间,具有β支链的氨基酸(例如thr、val和ile)之间,具有含硫侧链的氨基酸(例如cys和met)之间,或是具有芳族侧链的残基(例如trp、tyr、his和phe)之间制造保守取代。某些实施方案中,取代、缺失或添加也可以被认为是“保守取代”。插入或缺失的氨基酸数目可以在约1至5的范围内。保守取代通常不会引起蛋白质构象结构的显著变化,因此能够保持蛋白质的生物学活性。
[0086]
本文中,氨基酸残基“突变”指氨基酸残基的取代、插入、缺失或添加。
[0087]
本文中,“同源序列”指与另一序列进行选择性比对时同一性至少80%(例如至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的多核苷酸序列(或其互补链)或氨基酸序列。
[0088]
本文中,术语“对象”或“个体”或“动物”或“患者”指需要疾病或紊乱的诊断、预后、改善、预防和/或治疗的人类或非人类动物,包括哺乳动物或灵长类动物。哺乳动物对象包括人、家养动物、家畜和动物园动物、竞技动物或宠物,如犬、猫、豚鼠、兔、大鼠、小鼠、马、猪、奶牛、熊等。
[0089]
发明详述
allotypes from structure to effector functions)”,gestur vidarsson等,frontiers in immunology,2014年十月20日,5:520)。野生型igg1和igg4在核心铰链区(eu编号226-229)相差一个氨基酸:igg1中为cys-pro-pro-cys而igg4中为cys-pro-ser-cys。天然igg4在核心铰链区存在链间半胱氨酸与链内半胱氨酸二硫键之间的平衡,因此可以观察到重链臂交换和分泌后igg4半抗体分子的存在。业已证实,igg4的s228p突变eskygppcppcp(seq id no:19)可通过防止自然臂交换来显著稳定igg4重链之间的共价相互作用,因此已广泛用于igg4抗体的开发和生产。s228p突变在igg4铰链中形成多脯氨酸螺旋(ppcppcp),配合较短的igg4铰链长度,与igg1铰链相比进一步限制了其柔性。不同铰链之间的柔性差异对抗体的生物偶联具有重要意义,因为位于柔性铰链片段中的半胱氨酸残基被认为比位于刚性铰链中的半胱氨酸残基更具反应性。有实验表明,s228p igg4的重链-轻链间二硫键和重链-重链间二硫键均为弱反应性。
[0099]
一些实施方式中,fab结构域与铰链区操作性连接,其中,铰链区或其部分衍生自igg1或其部分,所述fab结构域衍生自igg4。通过对igg1和igg4免疫球蛋白的fab c端铰链区在天然结构位置上的互换,这种不同在生物偶联反应中由于还原剂对链间键(例如二硫键)可及性差异改善了药物负载-抗体之比(par)。
[0100]
一些实施方式中,修饰铰链区包含具有以下结构式(i)的序列:
[0101]
x
1 x
2 x
3 x
4 x
5 x
6 x
7 x
8 x
9 x
10 cppcp
ꢀꢀꢀꢀꢀꢀꢀꢀ(i)[0102]
其中,x1=缺省或e;x2=缺省或p;x3=缺省或k;x4=缺省或s或e;x5=缺省或c或s,优选缺省;x6=d或k;x7=k或y;x8=t或g;和/或,x9x
10
=ht、hp、pt或pp,优选pt或pp。
[0103]
一些实施方式中,修饰铰链区包含具有以下结构式(ii)的序列:
[0104]
epkx1c x
2 x
3 x
4 x
5 x
6 x
7 x
8 cppcp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(ii)
[0105]
其中,x1=缺省或s;x2=缺省或e或s,优选缺省;x3=缺省或s或c;x4=缺省或k或d;x5=y或k;x6=g或t;和/或x7x8=pp、pt、hp或ht。
[0106]
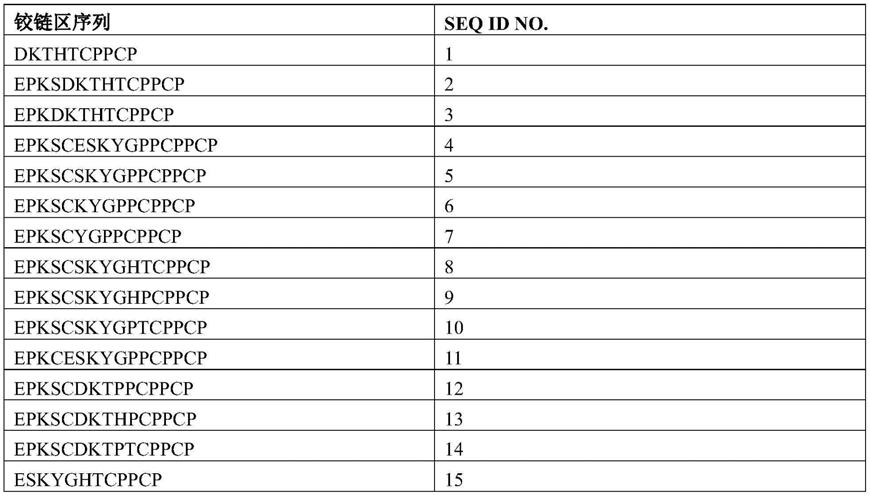
一个或多个实施方式中,示例性修饰铰链区序列如表1中所示。
[0107]
表1:本文公开的修饰铰链区序列示例
[0108]
[0109][0110]
可以在重链恒定区中包含上述修饰铰链区,重链恒定区通常包括ch2和ch3结构域,并且可以在指定区域之侧具有另外的铰链区段(例如上铰链),还有ch1区域。这些另外的恒定区区段如果存在则通常是同型的,优选人同种型,虽然也可以是不同亚型的杂合。所述另外的人恒定区区段的同种型优选人igg1型,但也可以是人igg2、igg3或igg4型或其杂合即包含不同亚型的结构域。
[0111]
本文中,“铰链区(或其部分)”与“修饰铰链区(或其部分)”指本发明的铰链区时可互换使用,都指具有0或1、2、3、4、5、6、7、8、9和10处取代、缺失或内部插入的铰链区。如果铰链区与某指定亚型野生型的差异在于0或1、2、3、4、5、6、7、8、9或10处取代,缺失或内部插入,则将该铰链区认为是该指定亚型的。本文中,当铰链区、fab、fc片段或多肽复合物的任何其他组分跟在一指定亚型之后时,例如“igg1铰链区”,表示铰链区、fab、fc片段或多肽复合物的任意其他组分属于该指定亚型,但不一定是野生型。
[0112]
链间键形成于铰链区一条单链上的一个氨基酸残基与铰链区另一单链上的另一氨基酸残基之间。某些实施方式中,非天然链间键可以是能够将铰链区两条单链缔合成二聚体的任何键或相互作用。非天然链间键合适的例子有二硫键、氢键、静电相互作用、盐桥或疏水-亲水相互作用、球入穴(knobs-into-holes)或它们的组合。
[0113]
本文中,“二聚体”指两个分子例如多肽或蛋白质通过共价或非共价相互作用形成的缔合结构。均二聚体或均二聚化由两个相同的分子形成,异二聚体或异二聚化由两个不同的分子形成。
[0114]“二硫键”指具有r-s-s-r'结构的共价键。半胱氨酸具有巯基,能与另一巯基例如另一半胱氨酸残基的巯基形成二硫键。分别位于两条多肽链上的两个半胱氨酸巯基之间可以形成二硫键,由此形成链间桥或链间键。
[0115]
静电相互作用是非共价相互作用,对于蛋白质折叠、稳定性、柔性和功能很重要,包括离子相互作用、氢键和卤素键。多肽内会形成静电相互作用,例如lys与asp之间、lys与glu之间、glu与arg之间,或是一条链上的glu、trp与另一条链上的arg、val或thr之间。
[0116]
盐桥是一种近距离静电相互作用,主要发生在asp或glu的阴离子羧酸根和lys的阳离子铵或arg的胍盐,是天然蛋白质结构中相反电荷残基的空间近距离配对。疏水性为主界面中的带电残基和极性残基可成为结合热点。其中,带有可电离侧链的残基(例如his、tyr和ser)也会参与盐桥的形成。
[0117]
疏水相互作用可形成于一条链的一个或多个val、tyr和ala与另一条链的一个或多个val、leu和trp之间或一条链的his和ala与另一条链的thr和phe之间(参见brinkmann等,2017,同上)。
[0118]
当氢原子与高负电性原子(例如氮、氧或氟)共价结合时,两个极性基团之间的静电吸引形成氢键。氢键可分别形成于多肽内两个残基的主链氧(例如硫属元素基团)与酰胺氢(氮基团)之间,例如asn的氮基团和his的氧基团,或asn的氧基团和lys氮基团。氢键强于范德华力,但弱于共价键或离子键,对于维持二级结构和三级结构至关重要。例如,氨基酸残基间距为规则的i位到i 4位时形成α螺旋,而β折叠则是两条肽由至少两个或三个主链氢键相连、形成扭转、波纹状的片层时形成的3-10个氨基酸长的肽段。
[0119]
本文中,杵臼结构“(knobs-into-holes)”指两条多肽之间这样的相互作用:其中一条多肽由于存在大侧链氨基酸残基(例如酪氨酸或色氨酸)而具有突起(即“杵”),另一条多肽具有小侧链氨基酸残基(例如丙氨酸或苏氨酸)所在的一个腔穴(即“臼”),所述的突起可定位到所述腔穴中,由此促进两条多肽之间的相互作用从而形成异二聚体或复合物。形成具有杵臼结构多肽的方法是已知的,例如美国专利u.s.pat.no.5,731,168中所述。
[0120]
某些实施方式中,铰链区具有1、2、3、4、5、6、7、8、9或10个链间键。可选地,1、2、3、4、5、6、7、8、9或10个链间键中至少一个是二硫键、氢键、静电相互作用、盐桥或疏水-亲水相互作用、或其任意组合。
[0121]
链间二硫键的形成可以通过本领域所知合适的方法来测定。例如,可以分别对表达的蛋白质产物进行还原和非还原sds-page,然后比较所得条带以鉴定可能的差异,由可能的差异指示链间二硫键存在与否。
[0122]
某些实施方式中,多肽复合物包含人igg1型的抗原结合片段fab,其后是人igg4型且具有s228p突变以防臂交换的修饰铰链区,其后是包含igg(例如igg1、igg2、igg3、igg4,或其组合)的ch2-ch3结构域的恒定区,其中fab和铰链区的igg1与igg4亚类互换改变了还原剂对重链-重链间二硫键相对于重链-轻链间二硫键的天然可及性,引导还原反应和药物负载偶联反应优先发生于重链-轻链间巯基。
[0123]
一个或多个实施方式中,示例性铰链区序列及其技术效果如表2中所示。
[0124]
表2:本文示例性铰链区序列及其技术效果
[0125]
[0126][0127]
抗体药物偶联物
[0128]
i.抗体
[0129]
本文提供新型抗体,所述抗体从n末端至c末端包含fab结构域和与之操作性连接的铰链区,其中,所述fab结构域或其部分和所述铰链区或其部分源自不同的igg亚型。抗体包含至少两条重链和两条轻链,两条重链通过铰链区或其部分中的两个二硫键相连,所述铰链区或其部分是人igg1、igg2、igg3或igg4型铰链区或其部分。
[0130]
另一方面内容中,抗体还包含与铰链区操作性相连的fc多肽,或者还包含与铰链
区操作性相连的其他多肽。
[0131]
某些实施方式中,所述fc多肽是人igg1、igg2、igg3或igg4型fc多肽。
[0132]
某些实施方式中,fc多肽是人igg1或igg4型fc多肽。
[0133]
另一相关方面中,本文包括抗体药物偶联物,其中包含本文所述的多肽复合物。
[0134]
就本发明而言,所述fab结构域可以源自任意抗体,尤其是那些具有临床意义的抗体。一些实施方式中,所述fab结构域源自特异性结合肿瘤抗原(ta)例如肿瘤特异性抗原(tsa)和肿瘤相关抗原(taa)的抗体。其中,肿瘤抗原的例子包括但不限于:cd20、cd38、cd123;ror1、ror2、bcma;psma;sstr2;sstr5、cd19、flt3、cd33、psca、adam17、cea、her2、egfr、egfr-viii、cd30、folr1、gd-2、ca-ix、trop-2、cd70、cd38、间皮素、epha2、cd22、cd79b、gpnmb、cd56、cd138、cd52、cd74、cd30、cd123、ron和erbb2。ta-特异性抗体的例子包括但不限于:曲妥珠单抗(trastuzumab)(例如后文实施例9和10中所述)、利妥昔单克(rituximab)(例如后文实施例11和12中所述)、西妥昔单抗(cetuximab)(例如后文实施例13和14中所述)、贝伐单抗(bevacizumab)、帕尼单抗(panitumumab)、阿仑单抗(alemtuzumab)、马妥珠单抗(matuzuma)、吉妥单抗(gemtuzumab)、波拉妥珠单抗(polatuzumab)、英妥珠单抗(inotuzumab)等。
[0135]
ii.药物
[0136]
用于本发明的药物(亦称“药物负载”)没有特别限制。用于本发明的药物包括细胞毒性药物,尤其是用于癌症治疗的那些。这些药物一般包括但不限于dna破坏剂,dna结合剂,抗代谢剂,酶抑制剂(如胸苷酸合酶抑制剂和拓扑异构酶抑制剂),微管蛋白抑制剂和毒素(例如细菌、真菌、植物或动物来源的毒素)。例如,具体例子包括紫杉醇,氨甲蝶呤,甲氨喋呤,二氯氨甲蝶呤,5-氟尿嘧啶,6-巯基嘌呤,阿糖胞苷,美法仑,环氧长春碱,长春西定,放线菌素,柔红霉素,多柔比星,丝裂霉素c,丝裂霉素a,洋红霉素,氨基蝶呤,他利霉素,鬼臼及鬼臼衍生物如足叶乙甙或磷酸足叶乙甙,长春花碱,长春新碱,长春地辛,紫杉烷包括紫杉醇,多西他赛视黄酸,丁酸,n8-乙酰基亚精胺,喜树碱,卡奇霉素,埃斯培拉霉素,烯-二炔,多卡霉素a,多卡霉素sa,卡奇霉素,喜树碱,哈米特林,美登木素(包括dm1,dm2,dm3,dm4)和澳瑞他汀类(包括单甲基澳瑞他汀e(mmae)、单甲基澳瑞他汀f(mmaf)、单甲基澳瑞他汀d(mmad))。一些实施方式中,优选澳瑞他汀类,例如mmae。可用任意合适的本领域所知方法将药物与接头连接。一些实施方式中,用于偶联时药物的提供方式为接头-药物中间体,例如“mc-vc-pab-mmae”。
[0137]
iii.接头
[0138]
本发明中所用药物可以通过接头与抗体连接。本领域已知有多种用于adc的接头。可用于本发明的接头没有特别限制,只要它具有能够与抗体提供的巯基反应的部分从而与抗体连接。本发明中特别有用的是马来酰亚胺或卤代乙酰基官能化的接头。例子包括但不限于-mc-vc-pab-(mc:马来酰亚胺-己酰基;vc:缬氨酸-瓜氨酸(val-cit)二肽;pab:对氨基苄基),-mc-vc-,-mc-和-smcc-(琥珀酰亚胺基-4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯)。
[0139]
一相关方面中,本文包括药物组合物,其中包含本文所述的药物抗体偶联物和药学上可接受的运载体或赋形剂。
[0140]
另一相关方面中,本文包括试剂盒,其中包含本文所述的多肽复合物、或本文所述抗体药物偶联物、或本文所述药物组合物。
[0141]
另一方面,本文包括制备本文所述抗体药物偶联物的方法,包括:
[0142]
提供本文所述多肽复合物中任一种;
[0143]
使马来酰亚胺基或卤代乙酰基部分与链间二硫键还原产生的半胱氨酸残基上的游离巯基进行迈克尔加成反应(michael addition reaction)。
[0144]
某些实施方式中,所述游离巯基是用温和还原剂例如tcep或dtt部分还原链间二硫键产生的;较好的是,所述部分还原反应在ph约4.0至8.0的缓冲液中进行,还原剂(例如tcep)/mab之比约3至10,反应温度约4℃至37℃,反应时间约1至24小时。
[0145]
某些实施方式中,偶联反应在ph约4.0至8.0的缓冲液中进行,有机添加剂(例如有机溶剂或有机助溶剂)约0.0%至20.0%(重量百分比),药物/mab之比约7至20,反应温度约4℃至37℃,反应时间约1至4小时。
[0146]
另一方面,本文包括所述多肽复合物用于制造抗体药物偶联物的应用。
[0147]
另一方面,本文包括为有需要的对象治疗疾患的方法,包括给予所述对象治疗有效量的本文所述抗体药物偶联物。治疗的疾患包括但不限于癌症,包括实体瘤和造血系统恶性肿瘤。这些癌症的例子包括但不限于乳腺癌、胃癌、肺癌(如nsclc)、头颈癌、结直肠癌、b细胞淋巴瘤(如非霍奇金淋巴瘤(nhl))和白血病等。
[0148]
本发明至少部分基于对两种免疫球蛋白重链铰链区序列的应用。通过对igg1和igg4免疫球蛋白的fab c端的铰链区在天然结构位置上的互换,这种不同在生物偶联反应中改善了药物负载-抗体之比(par),因为它造成了还原剂对链间二硫键可及性的差异。
[0149]
本发明描述了用工程化铰链区、fab结构域和fc结构域构建的抗体类型。工程化铰链区肽用天然氨基酸构建,包括用于在两条重链之间形成两个二硫键的半胱氨酸残基。具体而言,将igg1和igg4中的铰链区序列截短、组合,由此获得保留了两个二硫键的工程抗体铰链区。该工程抗体的fab结构域可以是igg1型或igg4型的,可对fab结构域进行任意突变,所述突变包括但不限于半胱氨酸突变、非天然氨基酸或肽延伸或插入。并且,fc结构域可以是igg1型或igg4型的,有或没有突变。
[0150]
本发明的工程抗体可在用温和还原剂还原二硫键后用于半胱氨酸残基处的生物偶联。工程改造的肽改变了铰链区中二硫键的还原特性,造成用温和还原剂(如tcep或dtt)部分还原时二硫键的选择性还原。如此部分还原的抗体用于偶联使得具有四个接在特定位点的接头-药物负载的偶联物成为主要产物。本发明中,根据fab结构域、铰链区和fc结构域的不同组合,接头-药物接在fab区或者铰链区。某些选定实施例中,具有接在特定位置的四个接头-药物负载的偶联物在产物混合物中占比超过90%。
[0151]
本文还描述了将所述工程抗体应用于生物偶联反应的方法。总体偶联反应包括两个步骤:部分还原和偶联。还原剂类型、还原剂/mab之比、缓冲液成分和ph值、反应温度和时间会对部分还原和特定位置还原有影响。偶联条件与目前常用的常规条件基本相同,取决于待要接到抗体上的接头-药物负载的性质。理想地,在还原缓冲液中以有机溶剂作为添加剂进行偶联,以帮助溶解接头-药物负载。
[0152]
在一个方面,提供了一种抗原结合性免疫球蛋白g,从n末端至c末端包含人igg4型的抗原结合片段fab,其后是人igg1型的修饰铰链区,其后是包含igg(例如igg1、igg2、igg3、igg4,或其组合)的ch2-ch3结构域的恒定区;其中fab和铰链区的igg1与igg4亚类互换改变了还原剂对重链-重链间二硫键相对于重链-轻链间二硫键的天然可及性,引导还原
反应和药物加载偶联反应优先发生于重链间巯基。
[0153]
在另一个方面,提供了一种抗原结合性免疫球蛋白g,从n末端至c末端包含人igg1型的抗原结合片段fab,其后是人igg4型且具有s228p突变以防臂交换的修饰铰链区,其后是包含igg(例如igg1、igg2、igg3、igg4,或其组合)的ch2-ch3结构域的恒定区;其中fab和铰链的igg1与igg4亚类互换改变了还原剂对重链-重链间二硫键相对于重链-轻链间二硫键的天然可及性,引导还原反应和药物加载偶联反应优先发生于重链-轻链间巯基。
[0154]
实施方式之一中,互换铰链的ch1-铰链接头在上铰链区(例如eu编号216-223)有1、2或3-氨基酸的缺失。一些具体实施方式中,铰链区片段选自seq id no:1-17。
[0155]
本文还描述了用马来酰亚胺基或卤代乙酰基部分实现的偶联方法,马来酰亚胺基或卤代乙酰基部分能够与链间二硫键还原产生的半胱氨酸残基的巯基进行迈克尔加成反应。
[0156]
一些实施方式中,可以用温和还原剂例如tcep或dtt部分还原链间二硫键来产生游离巯基。二硫键部分还原可在ph约4.0至8.0的缓冲液中进行,还原剂(例如tcep)/mab之比约3至10,反应温度约4℃至37℃,反应时间约1至24小时。
[0157]
某些实施方式中,部分还原的抗体与马来酰亚胺官能化的接头-药物负载之间的偶联可以在ph范围约4.0至8.0的缓冲液中进行,其中,有机添加剂(例如有机溶剂或有机助溶剂)约0.0%至20.0%,药物/mab之比约7至20,反应温度约4℃至37℃,偶联时间约1至4小时。
[0158]
缩写
[0159]
adc:抗体药物偶联物
[0160]
ch:重链恒定区
[0161]
cmc:化工、制造与控制
[0162]
dar:药物-抗体之比
[0163]
dma:n,n
’‑
二甲基乙酰胺
[0164]
dtt:1,4-二硫苏糖醇
[0165]
egfr:表皮生长因子受体
[0166]
fab:抗原结合片段
[0167]
fc:可结晶片段
[0168]
fda:食品药物监管局
[0169]
fge:甲酰甘氨酸生成酶
[0170]
hic:疏水作用色谱
[0171]
hplc:高效液相色谱
[0172]
ic50:半数最大抑制浓度
[0173]
igg:免疫球蛋白g
[0174]
mc:马来酰亚胺-己酰基
[0175]
med:最小有效剂量
[0176]
mmae:单甲基澳瑞他汀e
[0177]
mtd:最大耐受剂量
[0178]
mwco:截留分子量
[0179]
nacl:氯化钠
[0180]
nnaa:非天然氨基酸
[0181]
mtg:微生物转谷氨酰胺酶
[0182]
pab:对氨基苄基
[0183]
par:药物负载-抗体之比
[0184]
rp:反相
[0185]
sec:排阻色谱
[0186]
tcep:三(2-羧基乙基)膦
[0187]
ch:重链可变区
[0188]
eq:还原剂/mab摩尔比
[0189]
方法
[0190]
抗体的制备
[0191]
本文中全部抗体分子均进行了灰仓鼠(cricetulus griseus)密码子优化,按照标准分子生物学方法合成并克隆到自有生产载体中,然后由top10大肠杆菌中质粒大抽制得。
[0192]
转染前72小时,将cho k1宿主细胞按2-4e5个细胞/ml接种在cd cho培养基中。用vi-cell计点宿主细胞计算细胞密度,290g离心7分钟,然后在转染前重悬于预热的新鲜cd cho培养基中。重悬的宿主细胞在kuhner摇床中孵育(36.5℃,75%湿度,6%co2,120rpm),直至使用。
[0193]
将总共4mg编码目标抗体的质粒加入重悬的宿主细胞,然后加12mg聚醚酰亚胺。经转染的培养物在kuhner摇床中于36.5℃、75%湿度、6%co2、120rpm培养4小时。加入自有补充物后,转染后的培养物在kuhner摇床中于31℃、75%湿度、6%co2、120rpm培养9-10天。
[0194]
在收获日,经转染的培养物先1,000g离心10分钟再10,000g离心40分钟澄清化,然后通过0.22μm过滤器无菌过滤。取上清液用proa色谱纯化并测定滴度。proa洗脱物通过加入1-2%中和缓冲液(1m tris-hcl,ph 9.0)中和,然后配制在ph 5.5的20mm组氨酸-乙酸盐缓冲液中。
[0195]
偶联之前所有蛋白质均经过质量控制检测,包括还原和非还原sds-page、sec-hplc、通过lal凝块法(lal gel clot assay)检测内毒素水平,并通过质谱进行分子鉴定。
[0196]
hic-hplc
[0197][0198]
sec-hplc
[0199][0200]
rp-hplc测药物加载
[0201]
过程:将20ul的adc样品与75ul 8m盐酸胍和5ul tris-hcl、ph 8.0混合。向混合物中加入1ul的0.5m tcep溶液。37℃反应30分钟(min),然后用rp-hplc测定抗体上的药物加载。
[0202]
[0203][0204]
rp-hlpc测定游离药物
[0205]
过程:85ul adc溶液与15ul dma混合,然后用100ul沉淀缓冲液(nacl饱和的37.5%v/v甲醇/乙腈溶液)沉淀蛋白质,22℃以1400rpm漩涡搅拌10分钟(min)。
[0206]
样品以16000rpf离心10分钟。取上清液与标准样品一起进行rp-hplc检测以测定游离药物。
[0207]
实施例
[0208]
以下通过实施例来说明本发明。
[0209]
实施例1
[0210]
一般偶联方法
[0211]
向ph 4.0-8.0缓冲液例如组氨酸-乙酸盐储液中浓度为1mg/ml至20mg/ml的抗体溶液加入1至20eq(例如,有些实施方式中是3-10eq)的还原剂例如tcep或dtt。在4-37℃温和振荡或搅拌反应0.5至24小时。不纯化,将有机助溶剂(例如dma)添加到部分还原的抗体中至浓度为0%至20%,马来酰亚胺或卤代乙酰基官能化的接头-药物负载当量为7-20eq。
在4-37℃伴随温和振荡或搅拌进行偶联反应0.5至4小时。最终的偶联产物鉴定包括uv-vis测浓度,hic-hplc测偶联物分布和dar,rp-hplc测轻链上和重链上的药物加载以及游离药物残留,sec-hplc测凝聚和纯度,动力学比浊法测内毒素水平。
[0212]
本文中全部抗体分子均进行了灰仓鼠(cricetulus griseus)密码子优化,按照标准分子生物学方法合成并克隆到自有生产载体中,然后由top10大肠杆菌中质粒大抽制得。
[0213]
转染前72小时,将cho k1宿主细胞按2-4e5个细胞/ml接种在cd cho培养基中。用vi-cell计点宿主细胞计算细胞密度,290g离心7分钟,然后在转染前重悬于预热的新鲜cd cho培养基中。重悬的宿主细胞在kuhner摇床中孵育(36.5℃,75%湿度,6%co2,120rpm),直至使用。
[0214]
将总共4mg编码目标抗体的质粒加入重悬的宿主细胞,然后加12mg聚醚酰亚胺。经转染的培养物在kuhner摇床中于36.5℃、75%湿度、6%co2、120rpm培养4小时。加入自有补充物后,经转染的培养物在kuhner摇床中于31℃、75%湿度、6%co2、120rpm培养9-10天。
[0215]
在收获日,经转染的培养物先1,000g离心10分钟再10,000g离心40分钟澄清化,然后通过0.22μm过滤器无菌过滤。取上清液用proa色谱纯化并测定滴度。proa洗脱物通过加入1-2%中和缓冲液(1m tris-hcl,ph 9.0)中和,然后配制在ph 5.5的20mm组氨酸-乙酸盐缓冲液中。
[0216]
偶联之前所有蛋白质均经过质量控制检测,包括还原和非还原sds-page、sec-hplc、通过lal凝块法(lal gel clot assay)检测内毒素水平,并通过质谱进行分子鉴定。
[0217]
如前所述制备无亚型互换的igg1抗体和igg4抗体。所述igg1抗体具有序列为epkscdkthtcppcp(seq id no:18)的铰链区序列,所述igg4抗体具有序列为eskygppcppcp(seq id no:19)的铰链区序列。将两抗体各自溶于含50mm nacl、2mm edta、ph7.0的50mm磷酸缓冲液(pb)和含50mm nacl、2mm edta、ph 6.5的50mm pb缓冲液,抗体浓度均为8.0mg/ml。对于igg1抗体,加入2.7eq的tcep,混合物在37℃孵育2小时。对于igg4抗体,加入4.1eq的tcep,混合物在37℃孵育24小时。
[0218]
然后,在各混合物中,向还原抗体中加入dma至浓度为10%,然后分别加入7eq(对igg 1)和9eq(对igg4)的mc-vc-pab-mmae。偶联反应在4℃进行1小时。用40kd mwco脱盐柱纯化偶联产物,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分别的hic-hplc进行终产物特征鉴定(图1)。
[0219]
实施例2
[0220]
将抗体886-5(igg4-fab,igg4-fc,铰链区序列为dkthtcppcp(seq id no:1))溶于含150mm nacl、ph 6.0的20mm组氨酸-乙酸盐缓冲液,抗体浓度为7.0mg/ml。向抗体溶液中加入3.5eq的tcep,混合物于15℃孵育18小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用hic-hplc测定dar和药物分布来进行最终产物特征鉴定(图2)。
[0221]
实施例3
[0222]
将抗体886-5(igg4-fab,igg4-fc,铰链区序列为dkthtcppcp(seq id no:1))溶于ph 6.0的20mm组氨酸-乙酸盐缓冲液,抗体浓度为7.0mg/ml。向抗体溶液中加入3.3eq的tcep,混合物于15℃孵育18小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq
的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分布的hic-hplc进行最终产物特征鉴定。结果如下所示:
[0223]
mabtcep比/td0d2d4d6d8dar886-53.3/15℃6.918.657.63.513.44.0
[0224]
实施例4
[0225]
将抗体886-5(igg4-fab,igg4-fc,铰链区序列为dkthtcppcp(seq id no:1))溶于ph 8.0的hepes,抗体浓度为5.7mg/ml。向抗体溶液中加入2.6eq的tcep,混合物于15℃孵育16小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分布的hic-hplc进行最终产物特征鉴定。结果如下所示:
[0226]
mabtcep比/td0d2d4d6d8dar886-52.6/15℃7.519.257.81.214.33.9
[0227]
实施例5
[0228]
将抗体886-8(igg1-fab,igg4-fc,铰链区序列为epkscskygppcppcp(seq id no:5))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为4mg/ml。向抗体溶液中加入7eq的tcep,混合物于4℃孵育3小时。然后,向还原抗体中加入dma至浓度为10%,然后加入12eq的mc-vc-pab-mmae。偶联反应在22℃进行0.5小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用hic-hplc测定dar和药物分布来进行最终产物特征鉴定(图3)。
[0229]
实施例6
[0230]
将抗体886-13(igg1-fab,igg1-fc,铰链区序列为epkscskygppcppcp(seq id no:5))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为4.0mg/ml。向抗体溶液中加入4.4eq的tcep,混合物于10℃孵育3小时。然后,向还原抗体中加入dma至浓度为10%,然后加入10eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用hic-hplc测定dar和药物分布来进行最终产物特征鉴定(图4)。
[0231]
实施例7
[0232]
将抗体886-29(igg4-fab,igg4-fc,铰链区序列为epkdkthtcppcp(seq id no:3))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为7.8mg/ml。向抗体溶液中加入6.0eq的tcep,混合物于37℃孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用hic-hplc测定dar和药物分布来进行最终产物特征鉴定(图5)。
[0233]
实施例8
[0234]
将抗体886-34(igg1-fab,igg4-fc,铰链区序列为epkscskygptcppcp(seq id no:10))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为6.2mg/ml。向抗体溶液中加入5.0eq的tcep,混合物于4℃孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于
ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用hic-hplc测定dar和药物分布来进行最终产物特征鉴定(图6)。
[0235]
实施例9
[0236]
将抗her2抗体886-16(igg1-fab,igg4-fc;铰链区序列为epkscskygppcppcp(seq id no:5);轻链(lc)序列:seq id no:20,重链(hc)序列:seq id no:21)溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为9.2mg/ml。向抗体溶液中加入5eq的tcep,混合物于4℃孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。进行最终产物特征鉴定,包括hic-hplc测定dar和药物分布,sec-hplc测定纯度和凝聚物水平,rp-hplc测定药物加载,rp-hplc测定游离药物残留和动态比浊法测定内毒素水平(图7)。
[0237]
实施例10
[0238]
将抗her2抗体886-19(igg1-fab,igg1-fc;铰链区序列为epkscskygppcppcp(seq id no:5);lc序列:seq id no:26,hc序列:seq id no:27)溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为7.7mg/ml。向抗体溶液中加入3eq的tcep,混合物于4℃孵育3小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。进行最终产物特征鉴定,包括hic-hplc测定dar和药物分布,sec-hplc测定纯度和凝聚物水平,rp-hplc测定药物加载,rp-hplc测定游离药物残留和动态比浊法测定内毒素水平(图8)。
[0239]
实施例11
[0240]
将抗cd20抗体886-17(igg1-fab,igg4-fc;铰链区序列为epkscskygppcppcp(seq id no:5);lc序列:seq id no:22,hc序列:seq id no:23)溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为8.9mg/ml。向抗体溶液中加入5eq的tcep,混合物于4℃孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。进行最终产物特征鉴定,包括hic-hplc测定dar和药物分布,sec-hplc测定纯度和凝聚物水平,rp-hplc测定药物加载,rp-hplc测定游离药物残留和动态比浊法测定内毒素水平(图9)。
[0241]
实施例12
[0242]
将抗cd20抗体886-20(igg1-fab,igg1-fc,铰链区序列为epkscskygppcppcp(seq id no:5),lc序列:seq id no:28,hc序列:seq id no:29)溶于ph 5.5的20mm组氨酸-乙酸盐,抗体浓度为7.2mg/ml。向抗体溶液中加入3eq的tcep,混合物于4℃孵育3小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。进行最终产物特征鉴定,包括hic-hplc测定dar和药物分布,sec-hplc测定纯度和凝聚物水平,rp-hplc测定药物加载,rp-hplc测定游离药物残留和动态比浊法测定内毒素水平(图10)。
[0243]
实施例13
[0244]
将抗egfr抗体886-18(igg1-fab,igg4-fc;铰链区序列为epkscskygppcppcp(seq id no:5);lc序列:seq id no:24,hc序列:seq id no:25)溶于ph 5.5的20mm组氨酸-乙酸盐,抗体浓度为7.5mg/ml。向抗体溶液中加入5eq的tcep,混合物于4℃孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。进行最终产物特征鉴定,包括hic-hplc测定dar和药物分布,sec-hplc测定纯度和凝聚物水平,rp-hplc测定药物加载,rp-hplc测定游离药物残留和动态比浊法测定内毒素水平(图11)。
[0245]
实施例14
[0246]
将抗egfr抗体886-21(igg1-fab,igg1-fc;铰链区序列为epkscskygppcppcp(seq id no:5);lc序列:seq id no:30,hc序列:seq id no:31)溶于ph 5.5的20mm组氨酸-乙酸盐,抗体浓度为7.0mg/ml。向抗体溶液中加入3eq的tcep,混合物于4℃孵育3小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。进行最终产物特征鉴定,包括hic-hplc测定dar和药物分布,sec-hplc测定纯度和凝聚物水平,rp-hplc测定药物加载,rp-hplc测定游离药物残留和动态比浊法测定内毒素水平(图12)。
[0247]
实施例15
[0248]
将抗体886-28(igg4-fab,igg4-fc,铰链区序列为epksdkthtcppcp(seq id no:2))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度为7.2mg/ml。向抗体溶液中加入6.0eq的tcep,混合物于37℃孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分布的hic-hplc进行最终产物特征鉴定。结果如下所示:
[0249]
mabtcep比/td0d2d4d6d8dar886-286/37℃6.810.675.10.07.43.8
[0250]
实施例16
[0251]
将抗体886-22(igg1-fab,igg1-fc,铰链区序列为epkscdktppcppcp(seq id no:12))、抗体886-23(igg1-fab,igg1-fc,铰链区序列为epkscdkthpcppcp(seq id no:13))和抗体886-24(igg1-fab,igg1-fc,铰链区序列为epkscdktptcppcp(seq id no:14))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度分别为6.9mg/ml,7.8mg/ml和7.8mg/ml。向各抗体溶液中加入tcep,tcep/抗体之比分别为5.2、3.2和4.6。混合物在下表所示温度(t)孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分布的hic-hplc进行最终产物特征鉴定。结果如下所示:
[0252]
mabtcep比/td0d2d4d6d8dar886-225.2/37℃2.120.856.915.25.04.0886-233.2/37℃4.220.644.424.16.74.2886-244.6/37℃3.624.149.914.87.64.0
[0253]
实施例17
[0254]
将抗体886-25(igg4-fab,igg4-fc,铰链区序列为eskyghtcppcp(seq id no:15))、抗体886-26(igg4-fab,igg4-fc,铰链区序列为eskyghpcppcp(seq id no:16))和抗体886-27(igg4-fab,igg4-fc,铰链区序列为eskygptcppcp(seq id no:17))溶于ph5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度分别为4.8mg/ml,7.2mg/ml和7.5mg/ml。向各抗体溶液中加入tcep,tcep/抗体之比分别为3.5、4.0和5.5。混合物在下表所示温度(t)孵育16小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分布的hic-hplc进行最终产物特征鉴定。结果如下所示:
[0255]
mabtcep比/td0d2d4d6d8dar886-253.5/37℃8.418.457.23.212.83.9886-264.0/37℃7.514.759.83.114.94.1886-275.5/37℃11.015.752.02.419.14.1
[0256]
实施例18
[0257]
将抗体886-32(igg1-fab,igg4-fc铰链区序列为epkscskyghtcppcp(seq id no:8))和抗体886-33(igg1-fab,igg4-fc,铰链区序列为epkscskyghpcppcp(seq id no:9))溶于ph 5.5的20mm组氨酸-乙酸盐缓冲液,抗体浓度分别为9.5mg/ml和7.5mg/ml。向各抗体溶液中加入tcep,tcep/抗体之比分别为1.5和2.0。混合物在下表所示温度(t)孵育2小时。然后,向还原抗体中加入dma至浓度为10%,然后加入7eq的mc-vc-pab-mmae。偶联反应在4℃进行1小时。偶联产物用40kd mwco脱盐柱纯化,于ph5.5的20mm组氨酸-乙酸盐缓冲液中保存。用测定dar和药物分布的hic-hplc进行最终产物特征鉴定。结果如下所示:
[0258][0259][0260]
实施例19
[0261]
体外(in vitro)细胞毒性实验:测试了靶向her2、cd20和egfr的抗体药物偶联物分别对hcc1954细胞,raji细胞和hcc827细胞的细胞毒性。三种细胞系均培养在补充了10%胎牛血清的rpmi-1640培养基中。将hcc1954细胞按4000个细胞/孔接种在96孔板中,raji细胞按10000个细胞/孔接种在96孔板中,hcc827细胞按3000个细胞/孔接种在96孔板中。细胞铺板结束后即用adc处理raji细胞,铺板结束后24小时用adc处理hcc1954和hcc827细胞。37℃下adc处理4天后分析raji细胞的活力,37℃下adc处理5天后分析hcc1954细胞和hcc827细胞的活力。计算抑制百分比和最大抑制百分比(图13)。
[0262]
实施例20
[0263]
雄性sd大鼠笼养至给药时体重约330g。单次静脉内给予10mg/kg曲妥珠单抗(trastuzumab)-mmae、886-16-mmae和886-19-mmae,设重复组,然后分别在5分钟、6小时、24小时、48小时、72小时、144小时和312小时采集大鼠血浆。
[0264]
用elisa法测定不同时间点采集的血浆中的总抗体浓度:将96孔板用1ug/ml浓度的重组人erbb2(her2)包被,4℃,24小时。然后37℃下用ph7.2、含2%bsa的pbs封闭1小时。
用清洗缓冲液(含0.05%吐温20的pbs,ph7.2)洗板3次,然后将不同稀释度的样品与经包被的96孔板孵育,将血浆浓度归一化至0.1%。用0.1%血浆稀释的adc制做浓度范围1ng/ml至1500ng/ml的标准曲线。37℃孵育1小时后用清洗缓冲液清洗3次,然后加入山羊抗人igg(fc特异性)抗体-过氧化物酶,37℃反应1小时。清洗3次后,向各孔加入tmb,孵育5分钟后用0.5m h2so4终止反应。测定450nm吸光度,并用标准曲线计算总抗体的浓度。
[0265]
用elisa法测定不同时间点采集的血浆中的(adc)偶联抗体浓度:将96孔板用1ug/ml浓度的重组人erbb2(her2)包被,4℃,24小时。然后37℃下用ph7.2、含2%bsa的pbs封闭1小时。用清洗缓冲液(含0.05%吐温20的pbs,ph7.2)洗板3次,然后将不同稀释度的样品与经包被的96孔板孵育,将血浆浓度归一化至0.1%。用0.1%血浆稀释的adc制做浓度范围0.05ng/ml至200ng/ml的标准曲线。37℃孵育1小时后用清洗缓冲液清洗3次,然后加入小鼠抗vc-pab-mmae抗体,37℃孵育1小时。用清洗缓冲液清洗3次,加入抗小鼠igg(fc特异性)抗体-过氧化物酶,然后37℃反应1小时。洗板3次后向各孔加入tmb,孵育5分钟后用0.5m h2so4终止反应。测定450nm吸光度,并用标准曲线计算偶联抗体的浓度。
[0266]
图14中,分别用虚线和实线表示总抗体和(adc)偶联抗体的清除情况。虚线显示,总抗体血浆浓度随时间降低。实线显示,(adc)偶联抗体血浆浓度随时间降低。虚线显示,三个adc的总抗体清除率相近。实线显示,与曲妥珠单抗-mmae相比,886-16-mmae和886-19-mmae的清除较慢。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。