1.本发明涉及基因工程技术领域,具体而言,涉及免疫肽(mactide)及其制备方法。
背景技术:
2.免疫肽是一类具有抗菌活性的生物短肽,氨基酸数目小于100,常带正电荷,并具广谱抗菌性的一类小肽,是生物体免疫防御系统产生的一类对抗外源性病原体致病作用的防御性多肽活性物质,是生物体先天免疫的重要组成成分,与干扰素、补体等组成了宿主的免疫防御系统,这类生物活性小分子是非专一性的免疫应答产物,具有广谱抗菌作用,它对革兰阳性菌、革兰阴性菌、真菌均有抑杀作用,却不破坏动物体内的正常细胞。
3.免疫肽具有杀菌快速、抗菌谱广、毒副作用小、无免疫原性等优点。并且,由于其特殊的杀菌机理,被抑制或杀灭的病原性微生物不会产生抗性菌株,不会由于耐药性而减弱杀灭细菌的作用。
4.诸多研究显示天然多肽生产工艺存在瓶颈,产品的抗菌活性及稳定性不理想。因此,需要对天然多肽进行改造,保持其已有的抗菌活性,并大程度地减小毒性,增强稳定性,同时通过缩短肽链长度以实现成本低化。
5.鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种免疫肽及其制备方法。本发明提供的 免疫肽(mactide)是一种新型抗菌类多肽,具有更好的抗菌活性、更低的溶血性、稳定性强,另外该免疫肽的肽链长度短,生产成本低,此外,本发明提供的制备方法收率高,所制备的免疫肽纯度高。
7.本发明是这样实现的:第一方面,本发明提供一种免疫肽(mactide),其氨基酸序列选自seq id no.1-5中的任意一种:序号编码氨基酸序列1seqidno.1mrkrkrkrkkykpiivpiirk2seqidno.2mrkekrkrkkyepiivpiirk3seqidno.3rkekrkrkkyepiivpiirk4seqidno.4gkekrkrkkyepiivpiirk5seqidno.5mgrkekrkrkkyepiivpiirk本发明提供的seq id no.1-5所示的 免疫肽(mactide)不属于任何传统多肽,属于新型免疫肽,是在传统的哺乳动物来源基础上,进行了优化改造,并采用基因工程重组技术异源表达系统来生产的新型免疫肽,其具有更好的抗菌活性、更低的溶血性,更低的毒性低、更强的稳定性。
8.一方面,本发明提供一种分离的核酸分子,其编码如上所述的 免疫肽(mactide)。
9.进一步地,在本发明的一些实施方案中,其核苷酸序列如seq id no.6所示,如下:atgcggaaagagaagcgtaagcgtaagaagtacgagccgatcatcgtcccgatcatccggaaatga。
10.seq id no.6所示核苷酸序列可以编码seq id no.2所示的免疫肽(mactide),其他免疫肽(mactide)的核苷酸序列本领域技术人员可以在此基础上,根据氨基酸的密码子合理变化得到。
11.seq id no.6所示的核苷酸序列是经过了密码子优化后的序列,采用该核苷酸序列在大肠杆菌中重组表达上述免疫肽(mactide),其表达效率更高,更能提高免疫肽(mactide)的得率。
12.进一步地,在本发明的一些实施方案中,所述免疫肽(mactide)的氨基酸序列如seq id no.2所示。
13.另一方面,本发明提供一种载体,含有如上所述的核酸分子。
14.进一步地,在本发明的一些实施方案中,所述载体含有驱动所述核酸分子表达的启动子。
15.进一步地,在本发明的一些实施方案中,所述载体的骨架为pet-28a。
16.进一步地,在本发明的一些实施方案中,所述核酸分子位于所述载体的ncoi酶切位点和xhoi酶切位点之间。
17.另一方面,本发明提供一种重组细胞,其含有如上任一项所述的载体。
18.进一步地,在本发明的一些实施方案中,所述重组细胞选自大肠杆菌bl21(de3)。
19.另一方面,本发明提供一种制备如上所述的 免疫肽(mactide)的方法,其包括:培养如上所述的重组细胞。
20.进一步地,在本发明的一些实施方案中,所述方法包括:在培养所述重组细胞的培养液的od600达到0.5-1.5时,加入诱导剂进行诱导培养。
21.进一步地,在本发明的一些实施方案中,诱导培养的温度为28-32℃,诱导培养的时间6-8h。
22.进一步地,在本发明的一些实施方案中,诱导剂为iptg。
23.进一步地,在本发明的一些实施方案中,诱导剂在培养液中的浓度控制为0.1-1mm。
24.进一步地,在本发明的一些实施方案中,当重组细胞为大肠杆菌时,所述方法包括:在培养结束后,收集菌体对其进行离心并收集菌体、纯化水重悬、超声破碎、再离心,收集上清液。
25.进一步地,在本发明的一些实施方案中,所述方法还包括:将所上清液进行阳离子层析,用洗脱溶液洗脱后,收集洗脱液。
26.进一步地,在本发明的一些实施方案中,阳离子层析所用的层析介质为sp-sepharose fast flow介质。
27.进一步地,在本发明的一些实施方案中,所述洗脱溶液是含2m nacl的tris-hcl溶液。
28.进一步地,上述洗脱液进行制备型hplc制备,收集纯度高的洗脱峰;进一步地,所述高压层析所需溶液为乙腈和三氟乙酸溶液;进一步地,在本发明的一些实施方案中,所述方法还包括:采用截留分子量为1kd
的透析膜对所述流穿液进行透析脱盐、换液,得到所述 免疫肽(mactide)。
29.本发明的有益效果在于:本发明公开的免疫肽(mactide)具有更好的抗菌活性、更低的溶血性,同时其具有毒性低、稳定性强的特点,同时该免疫肽的肽链长度短,生产成本低,此外,本发明提供的制备方法收率高,所制备的免疫肽纯度高。
附图说明
30.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
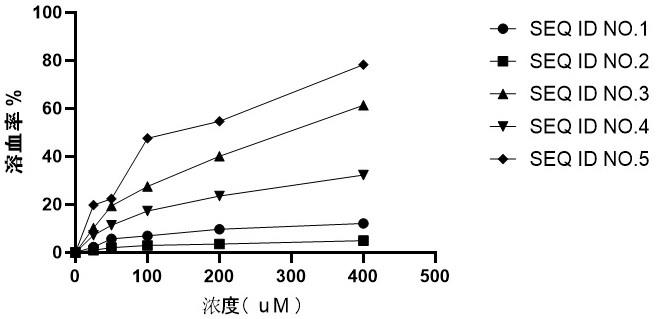
31.图1为实施例2中候选多肽的溶血检测结果。
32.图2为实验例3中的不同bamp21(既上文中的seq id no.2氨基酸序列)核酸序列的表达效率检测结果;泳道1为marker、泳道2为实施例2的诱导表达量、泳道3为对照组1的诱导表达量、泳道4为对照组2的诱导表达,泳道5为 《请补充》。
33.图3为实施例6中的bamp21 免疫肽(mactide)的tricine-sds-page电泳图;泳道1 marker、泳道2纯化后的免疫肽。
34.图4 制备型hplc制备色谱。
具体实施方式
35.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
36.以下结合实施例对本发明的特征和性能作进一步的详细描述。
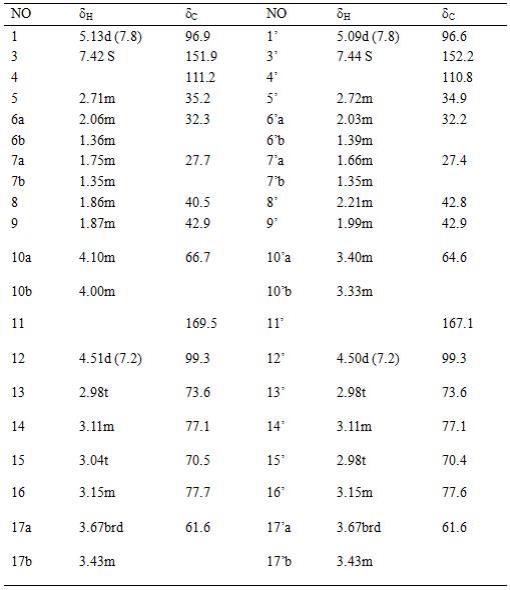
37.实施例1采用化学固相合成的方式,合成seq id no.1至seq id no.5中的候选氨基酸序列;采用高压层析检测合成的多肽纯度,确定合成的多肽纯度大于98%;其中高压层析检测条件为a:含有0.05%(v/v)的三氟乙酸,b:含有0.05%的乙腈,检测波长为210nm,在40分钟内,b从0线性提高至90%(v/v)。取得合格的合成候选序列的多肽后,采用最低抑菌浓度(mic)作为评价指标,优选了一株革兰氏阳性细菌枯草芽孢杆菌和一株革兰氏阴性细菌大肠杆菌作为指示菌进行抑菌活性评价。mic检查:(1)采用lb培养基倍比稀释不同浓度的抗菌药物溶液;(2)分别添加到96孔聚苯乙烯板中,在第1至11孔加药液,每孔100ul,药物浓度分别640、320、160、80、40、20、10、5、2.5、1.25、0.625ug/ml,第12孔添加100ul lb培养基作为生长对照;(3)将菌悬液采用lb培养基稀释制备成约2 106cfu/ml的悬液;(4)将100ul菌悬液添加至96孔板中,在37℃条件下,培养约20小时,测定吸光值,判定最小抑菌浓度。实验结果如下表:
从mic分析可以得出,seq id no.1-seq id no.5的多肽均具有良好的抑菌能力,其中seq id no.2具有较优的抑菌能力,因此作为候选序列进行进一步开发。
38.实施例2将实施例1中合成的5条候选氨基酸序列,采用溶血性作为评价指标挑选优选开发对象,其具体溶血检测数据如图1所示,其中seq id no.2序列具有较低的溶血性作为后续优选开发对象,后文中,将seq id no.2的多肽命名为bamp21。溶血性检测,采用新鲜的人红细胞进行,(1)采用ph=7.4的pbs溶液将人红细胞1000g离心力离心7分钟,洗涤2-3次;(2)将候选多肽溶解至同样的pbs溶液中,按照0、100um、200um、400um与洗涤后的人红细胞同等比例加入;(3)37℃条件下,孵育1小时;(4)1000g离心力离心5分钟;(5)在405nm的波长下,检测离心后的上清。计算公式如下:实施例31 构建含有bamp21基因表达载体,方法如下:采用全基因合成技术合成含bamp21基因片段:ccatggatgcggaaagagaagcgtaagcgtaagaagtacgagccgatcatcgtcccgatcatccggaaatgatgactcgag。
39.其中,下划线处字母为bamp21基因序列(seq id no.6,该序列是根据大肠杆菌密码子偏好性进行设计,编码的氨基酸序列为mrkek rkrkk yepii vpiir k (seq id no.2);5’端和3’端分别具有限制性内切酶ncoi和xhoi。
40.2 构建含有pet28a( )-bamp21表达载体的重组大肠杆菌方法:将测序正确的重组载体pet-28a( )-bamp21用热激法转化bl21(de3)大肠杆菌,并用lb(含硫酸卡那霉素,100μg/ml)平皿进行筛选。热激法采用42℃热激1.5分钟,冰上静置2分钟;然后加入无抗性的lb肉汤培养基37℃、120rpm培养约1小时;最后将其均匀涂布在含有硫酸卡那霉素的lb抗性平板上,37℃倒置培养过夜,进行阳性克隆筛选。
41.得到的重组大肠杆菌命名为bl21(de3)-bamp21。
42.实验例1检测实施例3得到的重组大肠杆菌中的bamp21的表达情况检测方法:取实施例3的重组大肠杆菌bl21(de3)-bamp21,采用lb基础培养基在37
℃、220rpm培养重组bl21(de3)-bamp21,当菌体密度od600达到0.5-1.5时,降温至30℃,添加1mm iptg诱导6-8小时;取0.1ml菌液离心收集菌体,加入4
×
loading buffer 20μl、纯化水60μl,100℃煮10min,12000rpm离心后取上清进行全菌电泳,用于检测诱导表达情况,结果见图2。
43.此外,设置对照组,比较不同bamp21编码序列对表达水平的影响,对照组的bamp21编码序列如下:对照组1:5’atgcgaaaagagaagcgaaagcgaaagaagtacgagccgatcatcgtcccgatcatccgaaaatga3’;对照组2:5’atgcgaaaggagaaacgaaaacgaaaaaaatacgagccgatcatcgtcccgatcatccgaaaatga 3’。
44.按实施例3基本相同的方法,用对照组1或2的bamp21编码序列(该序列也是根据大肠杆菌密码子偏好性进行设计)代替实施例3中的bamp21编码序列,制备重组大肠杆菌,并进行表达测试,结果见图2。
45.图2中,第5泳道为未诱导的空白对照,第3泳道为对照组1的诱导表达量,第4泳道为对照组2的诱导表达量,泳道2为实施例2的诱导表达量;可以看出,泳道2的条带颜色更深,说明实施例3的重组大肠杆菌中的bamp21表达水平比对照组高了近1倍,表明实施例3中的bamp21编码序列(seq id no.6)其表达效率更高,高于对照组的bamp21编码序列。
46.实施例4为了获得bamp21多肽,需要进行发酵表达培养,条件如下:取实施例3得到的重组大肠杆菌bl21(de3)-bamp21,用种子培养基进行扩培,待大肠杆菌到达一定数量后接种于发酵培养基中,进行iptg诱导表达。
47.其中发酵培养基均lb培养基;诱导的时机为菌体生长od600在0.5-1.5范围内,诱导剂iptg的浓度为1mm,诱导时长为6-8h;发酵液中bamp21表达方法如下:诱导结束后,取10ml的培养液,10000rpm离心10min,pbs洗涤一次后等体积重悬,将重悬液进行超声破碎,破碎液9000rpm离心20min后取上清,采用实施例1中hplc的检测方法检测免疫肽的含量。
48.结果显示,在摇瓶培养条件下,bamp21的表达水平可以达到20mg/l以上。
49.实施例5重组bamp21的纯化(1)将实施例4培养的bl21(de3)-bamp21菌液,使用低温高速离心机离心后,收集菌体;(2)将收集的菌体加入纯化水进行重悬,重悬后进行超声破碎,将充分破碎的溶液在10000rpm,4℃条件下离心15min,取上清;(3)采用tris干粉调节上清液ph至7-8,在10000rpm,4℃条件下离心25min,取上清液;;
(4)上述澄清液进行阳离子层析,阳离子层析所用的层析介质为sp-sepharose fast flow介质,用含1.5m nacl的0.02mtris-hcl溶液洗去杂蛋白,用含2m nacl的0.02mtris-hcl溶液洗脱,收集洗脱峰;(5)上述洗脱峰通过制备型hplc制备,a液为0.05%三氟乙酸,b液为0.05%乙腈,2分钟内使b液浓度达到20%并且维持20min,30min内将b液浓度由20%提高至100%,收集此阶段的洗脱峰,图谱见图4;(6)上述洗脱峰经过1kd的透析膜透析换液、脱盐后,得到具有抗菌活性的bamp21即纯度高的免疫肽(mactide)。
50.bamp21免疫肽(mactide)样品采用tricine-sds-page进行检测,并分析bamp21免疫肽(mactide)纯度。
51.结果见图3,图3显示单体的纯化大于98%,分子量大小与bamp21的理论分子量一致;此外,经过hplc检测bamp21免疫肽(mactide)单体的纯度大于98%。
52.实施例6bamp21免疫肽(mactide)单体生物学活性检测-mic实验(1)将指示菌大肠杆菌接种于tsb培养基中,33℃,180-220rpm培养24小时后,调整od600为0.8-0.9左右作为待用菌悬液,用mh肉汤培养基稀释500倍后备用;(2)取一支样品吸取样品50μl,2倍法逐级,稀释液为无菌超纯水,共稀释11级;(3)吸取50μl的样品或者硫酸卡那霉素标品加入到96孔板,再吸取50μl待测菌加入96孔板中,第12孔为不含待测样品的生长对照。同时设置稀释液与mh肉汤的阴性对照组,每组两个平行。35℃,孵育17h,观测记录结果,结果见表1。
53.从实施例7中,可以得出,本发明实施例提供的bamp21免疫肽(mactide)单体对革兰氏阴性菌、革兰氏阳性菌及白色念珠菌等真菌具有良好的抑菌效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。