治疗癌症的方法和用途
1.相关申请的交叉引用
2.本技术要求2019年5月29日提交的美国临时专利申请号62/853,842的权益,它们中的每一篇的整个内容特此通过引用并入本文。
发明领域
3.本公开内容包括在有此需要的受试者中治疗或改善癌症或癌症的影响的方法或用途,包括给所述受试者施用有效量的hedgehog抑制剂(hhi)或其药学上可接受的盐和化学治疗剂(cta)。
背景技术:
4.胰腺癌特有的特征之一是其间质,它通常是非常致密的和纤维状。对间质的关注正在成为治疗胰腺癌的新策略,目前正在测试不同的方案。例如,nab-p的临床前和临床研究指示,该药物发挥其作用的机制之一是通过消除胰腺癌的肿瘤间质。该消除伴有肿瘤血管形成的改善和药物向癌细胞中的更大渗透,这可能增强抗肿瘤效力。随后在用nab-p治疗的患者中的临床研究已经观察到类似的发现,同时还表明,当通过弹性成像测量其弹性时,用gem和nab-p的组合治疗的肿瘤变得更有弹性。其它针对胰腺癌间质的药剂正在开发中,包括pegph20,即一种在具有高透明质酸含量的肿瘤的患者中显示出有趣结果的聚乙二醇化的透明质酸酶。
5.在胰腺癌中研究的一种治疗靶标是hedgehog(hh)途径。在临床前研究中,环杷明类似物(cyclopamine analog)(ipi-926)对smo的抑制导致选择性间质消除、更好的肿瘤血管形成和gem化学疗法在这些模型中的更大作用。基于这些研究,开始了使用与gem组合的smo抑制剂的一系列临床试验,假设间质消除和更好的血管形成可能与更好的药物分布和更大的活性有关。尽管存在有前途的临床前数据,但是这些研究没有显示出更好的结果。
6.随后其中将smo遗传除去(通过基因缺失)或用smo抑制剂长期治疗的临床前研究显示的结果可以解释来自临床试验的负面数据。在这些研究中,间质的慢性消除导致肿瘤的血管形成的显著增加和恶性细胞的增殖,其以持续方式导致在治疗的动物中更大数目的转移灶和更低的存活率。
7.hedgehog(hh)途径是脊椎动物胚胎发育中的许多基本过程的主要调节器,所述基本过程包括干细胞维持、细胞分化、组织极性和细胞增殖。hh信号传递途径通过信号传递级联发挥其生物学效应,最终导致神经胶质瘤相关的癌基因(gli)转录因子的活化物和阻遏物形式之间的平衡的变化。参与向gli转录因子的信号传递转移的hh信号传递途径的组分包括hedgehog配体(sonic hh[shh]、indian hh[ihh]和desert hh[dhh])、修补的受体(ptch1、ptch2)、光滑化的受体(smo)、融合同系物抑制剂(sufu)、驱动蛋白kif7、蛋白激酶a(pka)和环磷酸腺苷(camp)。gli的活化剂形式进入细胞核并通过结合其启动子来刺激靶基因的转录。hh信号传递途径的主要靶基因是ptch1、ptch2和gli1。
[0008]
导致肿瘤发生的hh途径的组成性活化可见于基底细胞癌和髓母细胞瘤中。多种其
它的人类癌症也证明了该途径的不当活化。hh信号传递途径的失调与发育异常和癌症有关,包括戈兰综合征和散发性癌症,诸如胰腺癌、乳腺癌、结肠癌、卵巢癌和小细胞肺癌。hh信号传递途径的异常活化是由相关基因中的突变(不依赖配体的信号传递)或由hh信号传递分子的过度表达(配体依赖性的信号传递-自分泌或旁分泌)造成。从肿瘤到周围间质的旁分泌hh信号传递最近被证明促进肿瘤发生。该途径也已被证明调节癌症干细胞的增殖和增加肿瘤侵袭力。hh信号传递的靶向抑制可能有效治疗和预防多种类型的人类癌症。
[0009]
几种hh信号传递途径抑制剂,诸如维莫德吉和索尼德吉,已被开发用于癌症疗法。这些药物被视作有前途的癌症疗法,尤其是对于具有难治性/晚期癌症的患者。其它hedgehog抑制剂包括tak 441、taladegib、索尼德吉、saridegib(patidegib)bms833923和leq506。
[0010]
正如ohashi等人所述,由于基于增加的溶解度而改善的pk曲线,吡咯并[3,2-c]吡啶衍生物tak-441在小鼠髓母细胞瘤同种异体移植物模型中遏制肿瘤相关的间质组织中的转录因子gli1 mrna表达并抑制肿瘤生长(治疗/对照比,3%)。参见,ohashi等人,discovery of the investigational drug tak-441,a pyrrolo[3,2-c]pyridine derivative,as a highly potent and orally active hedgehog signaling inhibitor:modification of the core skeleton for improved solubility,bioorganic&medicinal chemistry,第20卷,第18期,2012年9月15日,关于这样的背景教导通过引用并入本文。
[0011]
tak-441是6-乙基-n-[1-(羟基乙酰基)哌啶-4-基]-1-甲基-4-氧代-5-(2-氧代-2-苯基乙基)-3-(2,2,2-三氟乙氧基)-4,5-二氢-1h-吡咯并[3,2-c]吡啶-2-甲酰胺,式(i):
[0012][0013]
合成tak-441的方法公开在美国专利号8,217,176和8,399,449中,它们中的每一篇通过引用整体并入本文。另外,国际申请号pct/jp2017/003453,wo 2017/135259,公开了tak-441与l-苹果酸或l-酒石酸的某些共晶型,其也通过引用整体并入本文。这样的共晶型可以用在本公开内容的方法中。
[0014]
需要使用hedgehog抑制剂的改进的癌症疗法。
技术实现要素:
[0015]
本公开内容的一个实施方案包括一种用于治疗具有癌性肿瘤(cancerous tumor)的受试者的方法,所述方法包括与一种或多种另外的癌症疗法联合地给所述受试者短暂施用hedgehog抑制剂(hhi)。本公开内容的一个实施方案包括与一种或多种另外的癌症疗法联合地给癌症患者短暂施用hedgehog抑制剂(hhi)的方法,其中在开始临床上有意义的(significant)有害成纤维细胞耗竭之前中断hhi的施用。
[0016]
在一个方面,在施用至少一种另外的癌症疗法之前施用hhi。在一个方面,在中断至少一种另外的癌症疗法之前中断hhi的施用。在一个方面,至少一种另外的癌症疗法是全身性地递送的疗法。在一个方面,全身性地递送的疗法是化学疗法、靶向疗法或免疫疗法。在一个方面,另外的癌症疗法是化学治疗剂(cta)的施用,且在施用cta之前施用hhi。在一个方面,在中断cta之前中断hhi的施用。在一个方面,所述肿瘤是纤维化肿瘤。在一个方面,所述肿瘤是实体瘤。在一个方面,所述肿瘤具有高间质含量(stromal content)。在一个方面,所述hhi降低间质含量。在一个方面,所述hhi在肿瘤内部或周围诱导血管生成。在一个方面,所述hhi改善随后施用的cta的肿瘤摄取。在一个方面,中断hhi的施用,使得间质的进一步减少被停止或在临床上无意义(insignificant)。在一个方面,中断hhi的施用,使得肿瘤成纤维细胞的进一步耗竭被停止或在临床上无意义。在一个方面,hhi的施用改善另外的癌症疗法的效果,但是在促进临床上有意义的肿瘤生长之前中断。在一个方面,中断hhi的施用,使得hhi的施用不会随后开始临床上有意义的、hhi诱导的转移。在一个方面,中断hhi的施用,使得hhi的施用不会显著增加随后肿瘤转移的可能性。在一个方面,hhi的施用改善随后施用的癌症疗法的效力。在一个方面,所述改善通过以下一种或多种进行证实:代谢应答、正电子发射断层摄影术、根据标准的客观应答、无进展存活、总存活、基于肿瘤标志物的水平的应答、毒性和肿瘤的弹性。在一个方面,所述改善通过延长的存活或延长的到疾病进展的时间进行证实。在一个方面,所述改善通过无进展存活进行证实。在一个方面,所述癌症是胰腺癌、食管癌、鳞状细胞癌、前列腺癌、结肠癌、乳腺癌、肝细胞癌、肾癌或胆管癌。在一个方面,所述癌症是胰腺导管腺癌(pdac)。在一个方面,所述癌症是肝细胞癌。在一个方面,所述hhi是smo拮抗剂。在一个方面,所述smo拮抗剂选自tak 441、格拉吉布(glasdegib)、taladegib、索尼德吉(sonidegib)、saridegib、patidegib、bms833923、leq506和它们的组合。在一个方面,所述hhi是tak 441。在一个方面,所述cta选自吉西他滨、白蛋白结合型紫杉醇(nab-paclitaxel)、泰素(taxol)、伊立替康、替莫唑胺、卡培他滨、托泊替康、顺铂、奥沙利铂、卡铂、喜树碱、阿糖胞苷、氟尿嘧啶、环磷酰胺、磷酸依托泊苷、替尼泊苷、多柔比星、柔红霉素和培美曲塞。在一个方面,所述cta是白蛋白结合型紫杉醇、吉西他滨和顺铂中的一种或多种。在一个方面,所述cta是白蛋白结合型紫杉醇和吉西他滨中的一种或多种。在一个方面,所述hhi的施用途径选自静脉内、口服和局部(topical)。在一个方面,所述另外的癌症疗法的施用途径选自静脉内、口服和局部。在一个方面,在生物有效剂量和最大耐受剂量之间施用所述hhi和另外的癌症疗法的剂量。在一个方面,所述患者接受治疗周期,且另外的癌症疗法是在所有的或基本上所有的治疗周期中施用的cta。在一个方面,所述患者接受另外的癌症疗法的治疗周期,且在少于所有的治疗周期中施用hhi。在一个方面,所述患者在多个周期中接受另外的癌症疗法的治疗,并且hhi的一个或多个剂量仅在较早治疗周期之前和过程中施用。在一个方面,hhi的一个或多个剂量仅在化学疗法
之前1-10天施用1-5个周期。在一个方面,施用的hhi的一个或多个剂量不晚于第三周期。在一个方面,每个周期是28天,且在周期1-3的每个周期的第-4天至-1天和第10至13天施用hhi和每28天在第1、8和15天施用cta。在一个方面,所述hhi是800mg剂量的tak 441。在一个方面,所述cta选自一个或多个的1000mg/m2的吉西他滨和125mg/m2白蛋白结合型紫杉醇。在一个方面,另外的癌症疗法的一个或多个剂量以后是检验点抑制剂(ci)的一个或多个剂量。在一个方面,所述cta是在一个或多个剂量中施用的检验点抑制剂(ci)。在一个方面,所述ci的施用途径选自静脉内、口服或局部。在一个方面,在生物有效剂量和最大耐受剂量之间施用所述ci的一个或多个剂量。在一个方面,所述ci是ctla 4抑制剂、pd1抑制剂或pdl1抑制剂。在一个方面,所述ci是曲美木单抗(tremelimumab)、伊匹木单抗、度伐单抗(durvalumab)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、阿特朱单抗(atezolizumab)、西米普利单抗(cemiplimab)、agen1884、agen2034或agen1181。在一个方面,所述ci是伊匹木单抗。在一个方面,所述患者在多个周期中接受治疗,且ci的一个或多个剂量仅在治疗周期结束或开始附近施用。在一个方面,ci的一个或多个剂量仅在治疗周期结束的7天内施用。在一个方面,ci的一个或多个剂量仅在至少1、2或3个治疗周期以后施用。在一个方面,所述周期是28天,且从第4周期开始在每个周期的第1和21天施用ci。在一个方面,所述ci剂量是伊匹木单抗的3mg/kg静脉内剂量。
[0017]
本公开内容的一个实施方案包括在有此需要的受试者中治疗或改善癌症或癌症的影响的方法,包括给所述受试者施用有效量的hedgehog抑制剂(hhi)或其药学上可接受的盐和化学治疗剂(cta)。
[0018]
在一个方面,所述hhi是tak 441。在一个方面,所述cta是白蛋白结合型紫杉醇。在一个方面,所述cta是检验点抑制剂(ci)。在一个方面,所述方法进一步包括施用检验点抑制剂(ci)。在一个方面,所述癌症具有纤维化间质。在一个方面,所述癌症是胰腺癌、食管癌、鳞状细胞癌、前列腺癌、结肠癌、乳腺癌、肝细胞癌、肾癌或胆管癌。在一个方面,所述癌症是胰腺腺癌(pancreatic adenocarcinoma)(pdac)。在一个方面,所述癌症是肝细胞癌。在一个方面,通过肿瘤消退测量治疗效果。在一个方面,通过肿瘤生长抑制模型中的肿瘤生长抑制因子测量治疗效果,所述肿瘤生长抑制模型选自以下一个或多个:如通过氟脱氧葡萄糖(fdg)所测量的代谢应答,根据eortc标准的pet,根据recist(在实体瘤中的应答评价标准)标准的客观应答,无进展存活,总存活,基于肿瘤标志物(例如ca 19.9)的水平的应答,毒性(例如根据common toxicity criteria for adverse events terminology,国立癌症研究所,4.03版(nci ctcae v4.03)),和肿瘤的弹性。
[0019]
本公开内容的一个实施方案包括本文描述的方法,作为列举的药剂用于治疗列举的疾病或障碍的用途。
[0020]
本公开内容的一个实施方案包括本文描述的方法,作为列举的药剂在药物制备中的用途,所述药物用于治疗列举的疾病或障碍。
[0021]
本公开内容的一个实施方案包括列举的药剂用于治疗列举的疾病或障碍的用途。
[0022]
本公开内容的一个实施方案包括列举的药剂作为用于治疗列举的疾病或障碍的药物的用途。
[0023]
本公开内容的一个实施方案包括用于治疗列举的疾病或障碍的包含列举的药剂的药物组合物。
[0024]
本公开内容的一个实施方案包括列举的药剂,其适合用于治疗列举的疾病或障碍。
[0025]
尽管没有具体描述,但是一个或多个方面和实施方案可以结合在不同的实施方案中。也就是说,所有方面和实施方案可以以任何方式或组合进行组合。
[0026]
附图简述
[0027]
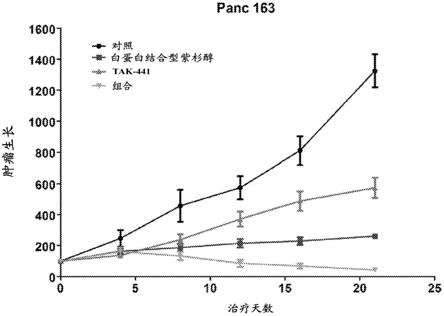
图1显示了用指示的方案治疗的panc163模型的肿瘤生长(相对于肿瘤初始体积的百分比)。皮下植入肿瘤。
[0028]
图2显示了用指示的方案治疗的jh051模型的肿瘤生长(相对于肿瘤初始体积的百分比)。皮下植入肿瘤。
[0029]
图3.显示了指示的方案治疗的panc025模型的肿瘤生长(相对于肿瘤初始体积的百分比)。皮下植入肿瘤。
[0030]
图4.从所有实验组(arm)得到的panc 163肿瘤样品的masson氏染色的代表性图像。
[0031]
图5.从所有实验组得到的panc 025肿瘤样品的masson氏染色的代表性图像。在第一列中,显示了在治疗开始日的染色模式。
[0032]
发明详述
[0033]
定义
[0034]
本文中使用的“治疗”(也称为“处理”)表示,部分地或完全地减轻、改善、缓解、抑制特定疾病、障碍或病症的一种或多种症状、特征或原因,延迟其发作,降低其严重程度,或降低其发生率的任何医学干预或物质施用。
[0035]
本文中使用的“药剂的短暂施用”表示永久地或在设定的时间段内中断的施用,使得施用不会贯穿在治疗的所有周期中持续。
[0036]
本文中使用的“癌症”、“恶性肿瘤”、“赘生物”、“肿瘤”和“癌”可以互换使用,且表示表现出异常的、不受控制的或自主的生长的细胞。
[0037]
本文中使用的“化学治疗剂”表示促细胞凋亡剂、细胞生长抑制剂或细胞毒性剂中的一种或多种。
[0038]
本文中使用的“临床上有意义的”是指、但不限于在临床决策中值得考虑的或具有影响的。
[0039]
本文中使用的术语“临床”表示与患者的实际观察和治疗有关的或以此为基础的信息,其有别于理论或基础科学。
[0040]
本文中使用的短语“施用方案”或可替换地“治疗方案”表示一组单位剂量,通常超过一个,其可以单独施用于受试者,通常间隔一段时间。
[0041]
本文中使用的“到疾病进展的时间”(“ttp”)表示从初始治疗时间到癌症进展或恶化的时间,通常以周或月为单位测量。这样的进展可以通过测试或观察来确定,诸如由熟练的临床医师评价。
[0042]
本文中使用的“延长ttp”表示,相对于未治疗的患者,在治疗的患者中增加在疾病进展之前的时间。
[0043]
本文中使用的“存活”表示患者保持存活,并且包括总存活以及无进展存活。
[0044]
本文中使用的“总存活”表示患者从诊断或治疗之时起在限定的时间段(诸如1年、
5年或更长)内保持存活。
[0045]
本文中使用的“无进展存活”表示患者保持存活,癌症没有进展或恶化。这样的进展可以通过测试或观察来确定,诸如由熟练的临床医生评价。
[0046]
本文中使用的“延长存活”表示,相对于未治疗的患者在治疗的患者中增加总存活或无进展存活。
[0047]
本文中使用的治疗成就的相对术语,诸如“改善”、“增加”或“减少”或其语法等效词指示,与基线测量或条件相比的值或条件,诸如在本文描述的治疗开始之前在同一个体中的测量,或在没有本文描述的治疗存在下在一个对照个体(或多个对照个体)中的测量。
[0048]
本文中使用的“生物有效剂量”表示到达体内靶标或作用位点以造成生物学效应的吸收的化合物的量。
[0049]
本文中使用的“最大耐受剂量”(或mtd)表示不引起不可接受的副作用的药物或治疗的最高剂量。
[0050]
本文中使用的“周期”表示在一段时间内施用的治疗方案。
[0051]
本文中使用的“对恶性肿瘤的纤维化应答”表示在肿瘤中纤维瘤(fibroid)进展和/或持续性的增加或减少。
[0052]
本文中使用的“肿瘤消退”表示肿瘤体或组织的生长的停止或大小、质量或数目的减少。
[0053]
如上所述,tak-441是一种被口服施用并抑制smo的研究性小分子。在体外模型中,tak-441抑制环杷明(一种人smo抑制剂)的结合,至8.6nm的50%抑制浓度(ic
50
)。在去势抵抗性的前列腺癌的鼠模型中,证实tak-441抑制hh配体的旁分泌信号传递,且从而抑制肿瘤进展。
[0054]
在参与的西班牙站点的i期试验中研究了tak-441。这项最近公开的试验研究了单剂量和多剂量的tak-441的安全性、耐受性、药代动力学和初步临床活性。包括共34名具有晚期实体瘤(结肠直肠癌(26%)、基底细胞癌(21%)和胰腺癌(9%))的患者(中位年龄:59岁,范围:28-82岁)。患者接受在50-1600mg范围内的口服tak-441(po)的每日剂量。随后在每个同期组群中将每日剂量加倍,直到达到最大耐受剂量(mtd)。收集血液样品以评价施用后tak-441的血浆浓度,以及皮肤活组织检查以确定gli1基因表达的抑制。
[0055]
根据片剂的大小及其效能,在1600mg/天建立mtd。剂量限制性毒性包括肌肉痉挛和疲劳。口服吸收是相当快的,平均最大时间(t
max
)为施用单剂量后1.8-4.2小时,和多剂量施用后2.4-4.0小时。中位消除半衰期为12.9-18.3小时。基于血浆浓度-时间的曲线下面积(auc)的tak-441的药代动力学在整个剂量范围内呈线性。在分析的所有剂量下均观察到皮肤活组织检查中gli1基因表达的抑制。
[0056]
如指出的,本公开内容包括一种用于治疗具有癌性肿瘤的受试者的方法。所述方法包括与一种或多种另外的癌症疗法联合地给所述受试者短暂施用hedgehog抑制剂(hhi)。所述另外的癌症疗法可以选自、但不限于化学疗法、免疫疗法和靶向疗法。本公开内容进一步包括与一种或多种另外的癌症疗法联合地给癌症患者短暂施用hhi的方法,其中在下述之前中断hhi的施用:开始临床上有意义的有害成纤维细胞耗竭,包括、但不限于全身性副作用诸如发生恶病质、贫血和其它副肿瘤综合征以及免疫抑制的诱导和癌症的加速。
[0057]
在这点上,间质的减少和血管形成的诱导可以被认为是积极的,因为它们允许更好地递送化疗剂。纤维化肿瘤具有低血管密度并且是血管不足的(hypo vascular)。由于这些原因,药物不能穿透纤维化肿瘤。因此,血管形成的诱导将改善药物的摄取。但是,在这种影响的积极性和然后变得有害之间有一个细微平衡。当纤维化被消除或过度限制时,肿瘤就会变得过度血管化,并且其导致更高的转移和更短的患者生存。
[0058]
正在开发tak-441用于口服使用以治疗晚期血液学和非血液学恶性肿瘤。临床前研究已确定,tak-441在多个物种中是口服地可生物利用的。以细胞/gli-luc nih3t3,在萤光素酶-gli-敏感的(gli-luc)启动子测定中产生4.4nm的50%抑制(ic
50
)的浓度,tak-441抑制gli转录活性。在mrc5人胚胎成纤维细胞中产生1.9nm的ic
50
的浓度,tak-441还抑制gli1 mrna的表达。此外,tak-441在过表达hsmo的293t细胞中抑制环杷明与人smo(hsmo)的结合,具有8.6nm的ic
50
。这些数据提示,tak-441通过其与smo的结合来抑制hh信号传递途径。
[0059]
tak-441在具有ptch1( /-)(ptch1杂合子)和p53(-/-)(无(null)p53)中的突变的髓母细胞瘤的同种异体移植物模型或小鼠异种移植物模型pan-04原代人胰腺中的施用分别导致与gli1 mrna体内的表达有关的小鼠或间质瘤的剂量依赖性抑制。tak-441在这些模型中表现出显著的剂量依赖性的肿瘤活性(p《0.025)。另外,tak-441和雷帕霉素(一种mtor(哺乳动物雷帕霉素靶标)的抑制剂)的组合在胰腺癌的pan-04小鼠模型中显示出比单独的任何药剂的活性更好的联合抗肿瘤活性。
[0060]
体内药代动力学
[0061]
tak-441的特征在于低cl(161.3和397.9ml/h/kg)、在稳态血浆中的中等分布容积(vss)(681.6和2181.3ml/kg)、以及中等的t1/2(1.7和9.8小时),在大鼠和狗中的口服生物利用度分别为31.7%和90.3%。在大鼠或狗中,两性之间的血浆暴露没有差异。关于食物的影响,在狗中,当将tak-441施用给喂食的狗时(与禁食的狗相比),观察到吸收程度的约2倍增加,导致c
max
和0-24小时血浆浓度相对于时间曲线下面积(auc0-24h)的增加。
[0062]
在1.73mm的浓度,tak-441在小鼠(99.7%)和大鼠(96.2%)中具有对血浆蛋白的高结合,和在狗(79.6%)和人类(87.7%)中的低结合。在口服施用给大鼠和狗后tak-441通过细胞色素p450(cyp)同工酶cyp3a4/5代谢为未鉴定的代谢物。当进行肝微粒体的温育时,未检测到人类特有的代谢物。tak-441是cyp2c8的弱抑制剂,并对其它cyp同工酶没有抑制作用。tak-441不是人肝微粒体中cyp同工酶的时间依赖性抑制剂。因此,tak-441影响伴随地施用的其它cyp3a4/5底物的药代动力学的可能性较低。但是,cyp3a抑制剂和/或诱导物的伴随施用可能影响tak-441的药代动力学。tak-441在caco-2细胞中具有高渗透性(papp,a-至-b 19.6'10-6cm/秒;papp,b-至-un 37.8'10-6cm/秒),是p-糖蛋白(p-gp)流动泵的不良底物,以及p-gp的弱抑制剂(ic
50
为6.59mm)。
[0063]
安全性药理学
[0064]
在共126个试验中进行tak-441(浓度为10mm)的生化活性。在tak-441测定中包含的酶、受体和转运蛋白中,它将一种酶即人pde4磷酸二酯酶、以及一种转运蛋白即人神经递质多巴胺抑制了超过50%(分别为67%和75%)。
[0065]
毒理学研究
[0066]
在根据良好实验室规范(glp)的毒理学研究中,将tak-441以超过预期浓度的暴露
量施用于大鼠和狗以达到与多种变化有关的效力,所述变化可归因于hh信号传递途径的药理学抑制。这些变化包括:体重减轻;肋骨和毛囊中的生长板萎缩;胃粘膜的糜烂或溃疡形成;贫血;骨髓的坏死和血细胞减少以及肺部的炎症和出血。在狗中观察到的剂量限制毒性包括:体重减轻;食物消耗减少;胃肠道损伤(呕吐、腹泻、厌食、重量减轻、溃疡形成和出血)。这些影响中的每一种都被认为易于进行临床和通过实验室试验的随访。
[0067]
用tak-441进行的研究结果指示,观察到的临床上有关的变化,包括血液学参数的变化、胃肠道障碍、食欲下降和体重减轻,是可逆的。可逆性未被证实的分离变化包括毛囊和骨骼中生长板的萎缩以及切牙的变化。在将tak-441临床施用给具有癌症的成年患者的情况下,生长板的萎缩和切牙的改变均不视为有关毒理学发现,因为在成年患者中,生长板已经闭合,且门切牙已经成熟。另一方面,在大鼠中观察到的步态改变和震颤与人类的相关性未知,并且易于进行临床随访。
[0068]
tak-441 1期试验
[0069]
如上所述,已在晚期癌症患者的1期研究中评价了tak-441。包括共34名具有晚期实体瘤(结肠直肠癌(26%)、基底细胞癌(21%)和胰腺癌(9%))的患者(中位年龄:59岁,范围:28-82岁)。患者接受在50-1600mg范围内的tak-441口服(po)的每日剂量。随后在每个同期组群中将每日剂量加倍,直到达到最大耐受剂量(mtd)。收集血液样品以评价施用后tak-441的血浆浓度,以及皮肤活组织检查以确定gli1基因表达的抑制。在1,600mg/天建立mtd(根据片剂的大小及其效能)。观察到的不良作用详列于表2中。剂量限制性毒性包括肌肉痉挛和疲劳。口服吸收是相当快的;平均t
max
为施用单剂量后1.8-4.2小时,和多剂量施用后2.4-4.0小时。中位消除半衰期为12.9-18.3小时。基于血浆浓度-时间auc的tak-441的药代动力学在整个剂量范围内呈线性。在分析的所有剂量下均观察到皮肤活组织检查中gli1基因表达的抑制。
[0070]
在1名具有基底细胞癌的患者中观察到部分应答,以及在7名具有多种实体瘤的患者中观察到疾病稳定。tak-441是良好耐受的,呈现出1600mg/天的mtd,具有抗肿瘤活性的证据。
[0071]
化疗剂(cta)
[0072]
两种示例性的cta包括细胞抑制剂,具体地,吉西他滨(“gem”)和白蛋白结合型紫杉醇(“nab-p”)gem具有用于患有局部晚期或转移性胰腺腺癌的患者的营销授权。nab-p是一种结合至白蛋白的紫杉醇的纳米颗粒制剂,与其它紫杉醇制剂相比,其性能可能大不相同。nab-p被欧洲药品管理局(european medicines agency,ema)批准与gem联合商品化用于治疗晚期胰腺癌患者。
[0073]
两种细胞毒素均由药房服务机构制备,并根据其各自技术数据表中所述的规格静脉内施用。在可能的情况下,应在白天在医院(以使患者能够走动)和在家施用治疗。nab-p可以作为30-分钟静脉内输注施用,然后是gem的30-分钟静脉内输注。
[0074]
一种典型的剂量和施用计划是nab-p 125mg/m2静脉内(iv),然后在28天周期的第1、8和15天施用gem 1,000mg/m2静脉内(iv)。
[0075]
其它cta包括、但不限于泰素、伊立替康、替莫唑胺、卡培他滨、托泊替康、顺铂、奥沙利铂、卡铂、喜树碱、阿糖胞苷、氟尿嘧啶、环磷酰胺、磷酸依托泊苷、替尼泊苷、多柔比星、柔红霉素和培美曲塞。
实施例:
[0076]
实施例1用tak441靶向胰腺癌间质
[0077]
为了确定tak441和白蛋白结合型紫杉醇的组合是否会产生抗肿瘤协同作用并评估血管形成作用的相继促进和抑制作用,将来自pancxenobank的三(3)种不同的胰腺导管腺癌(pdac)肿瘤(panc163、jh051和panc025)用白蛋白结合型紫杉醇(abi)和tak-441(一种hedgehog抑制剂)的组合处理。
[0078]
在确定白蛋白结合型紫杉醇的最可行剂量的几个剂量发现研究之后,使用了50mg/kg 1dq4 x 3的剂量。选择tak-441并以推荐剂量(每日口服25mg/kg)每日施用。进行研究21天。
[0079]
如在图1-3中所示,与单独的任一药剂相比,两种药剂的组合在所有分析的模型中导致协同的肿瘤消退。
[0080]
基于在实验第21天的肿瘤体积值,估计了如表1所示的肿瘤生长抑制(tgi)因子。在所有三种胰腺癌模型中,当用白蛋白紫杉醇和抗间质剂tak-441的组合治疗小鼠时,观察到最大抑制。
[0081]
表1
[0082][0083]
为了评价治疗后间质的组织学状态,分析了来自panc 163和panc 025模型的masson氏三色染液载玻片(masson’s trichrome stained slides)。
[0084]
如图4和5所示,来自abi处理组的样品显示出更多的肿瘤缩小和增加的纤维化存在(根据胶原染色)。
[0085]
实施例2(预示性的)
[0086]
i/ii期临床试验(其可以是开放、多中心和非随机化中的一个或多个)包括具有晚期胰腺癌的患者,其数量被选择为具有足够效力,例如二十五(25)名,所述患者符合方案规定的纳入标准(不被排除的),或根据相关的标准和/或方案随后撤回。
[0087]
根据常规治疗方案,患者在每个周期(每28天)的第1、8和15天接受吉西他滨(1000mg/m
2 iv)(g)和nab-p(125mg/m
2 iv)(a)的常规化学疗法。在周期1-3中,在第1天和第15天治疗之前,将tak-441(也被称作nlm-001)以800mg/天口服(po)的剂量施用4天,然后在用化学疗法治疗前休息一天。最初,包括一个子集,诸如六(6)名患者,并观察一个治疗周期的毒性。如果发生超过两个与tak-441相关的≥3级毒性事件,则将药物剂量减少至400mg/天。
[0088]
通过内窥镜超声和弹性成像在基线和周期1的第-1天和第13天测量肿瘤弹性。在基线和周期1第13天同时进行原发肿瘤的活组织检查。在第一个周期后,患者继续治疗直至
疾病进展或不可接受的毒性。
[0089]
方案1
[0090][0091]
治疗患者四(4)个周期,即四天治疗,四天停止。
[0092]
治疗的患者被认为表现出优于对照患者的改善,包括、但不限于以下一项或多项的改善:
[0093]
代谢应答,通过fgd pet(根据eortc标准)。
[0094]
根据recist标准的客观应答。
[0095]
通过实体瘤中的应答和评价标准(recist)v 1.1确定的客观应答。这些标准是一组已发布的标准,其定义癌症患者在治疗期间何时改善、稳定或恶化。根据不同的应答类别,将结果制成表格。
[0096]
无进展存活、总存活:在3个月和6个月的无进展存活率(pfs)(%pfs-3m;%pfs-6m)定义为从随机化开始记录的招募3或6个月后没有癌症进展(生长或扩散)的患者的百分比。通过使用kaplan-meier方法构建存活表来进行估计。为了统计分析的目的,对应于疾病进展的日期是:
[0097]
i.当通过ct和/或体格检查记录进展时的计划的应答审查。
[0098]
ii.在没有先前记录的进展存在下因任何原因的死亡。
[0099]
iii.在决定因任何原因暂停方案治疗后开始二线治疗,无论是出于毒性还是耐受性的原因。
[0100]
iv.当方案治疗暂停后没有进行二线治疗时的进展记录。
[0101]
v.从治疗开始到患者因任何原因死亡确定总存活。通过使用kaplan-meier方法构建存活表来估计它。
[0102]
基于肿瘤标志物ca 19.9的水平的应答
[0103]
将ca 19.9应答计算为其基线高于每个中心的当地实验室的正常上限1.25倍的那些患者中相对于基线的最大变化百分比。此外,根据分类应答者和无应答者将结果制表,为其使用三种不同的应答标准:分别减少超过50%、超过75%和超过90%。
[0104]
根据ctcaenciv4.03的毒性
[0105]
通过将所有观察到的不良作用制成表格来描述治疗的安全性,所述不良作用包括临床事件和实验室数据。将它们分类,并根据不良事件通用术语标准(common terminology criteria for adverse events,national cancer institute)4.3版(ctcae-nci v.4.3)量化它们的严重程度。疾病进展被认为是疾病自然病程的结果,因此它被收集在患者crf中,且在本研究中不被视为不良事件。因此,疾病进展不根据药物警戒程序进行交流,但必须按照方案中规定的措施记录在应答类别中。
[0106]
肿瘤弹性
[0107]
该研究的第二个变量是通过弹性成像测量肿瘤弹性,弹性定义为如前面描述的肿瘤组织和正常组织之间的“商应变比(quotient strain ratio)”。pentax线性回声内窥镜和hitachi eub900装置将用于其测量。将选择代表肿瘤和正常周围组织的区域。通过肿瘤组织与正常组织之间的
¨
商应变比
¨
来表示弹性成像的结果。在以前的研究中,该指数的平均值为32。我们希望通过tak-441治疗,减少至少50%。
[0108]
生物标志物
[0109]
gli-1mrna、平滑肌肌动蛋白阳性癌症相关的成纤维细胞(sma caf)、胶原结构和淋巴细胞浸润(cd3、cd4和cd8)的表达。
[0110]
实施例3(预示性的)
[0111]
i/ii期临床试验(其可以是如实施例2中的开放、多中心和非随机化中的一个或多个),其另外添加施用检验点抑制剂,诸如pd1或ctla4抑制剂。一个例子是伊匹木单抗。
[0112]
作为一个例子,从第4周期开始,在每个周期的第1和21天施用伊匹木单抗的3mg/kg静脉内剂量,如在方案2中所示。否则,剂量和改善终点保持如实施例2中所述。
[0113][0114]
作为另一个例子,治疗方案可以包括:nlm-001:周期1-3的每个周期的第-4天至-1天和第10至13天,800mg/天口服;吉西他滨(g):每28天在第1、8和15天,1,000mg/m2静脉内;
abraxane(a):每28天在第1、8和15天,125mg/m2静脉内;和ctla-4抑制剂(ctla-4):在周期1的第15天以及随后周期的第1和15天,1mg/kg。方案3是示例性的。
[0115]
方案3
[0116][0117]
如上面实施例2中,在基线和在周期1的第-1天和第13天,通过内窥镜超声和弹性成像测量肿瘤弹性。在基线和周期1第13天同时进行原发肿瘤的活组织检查。在第一个周期后,患者继续治疗直至疾病进展或不可接受的毒性。此外,改善终点仍然如实施例2中所述。
[0118]
预示性的实施例2和3一起提供了方向,以证明tak 441的短暂的、所谓的“休克”施用,在晚期胰腺癌患者中短暂地减少了胰腺癌的间质,从而有利于化学疗法治疗的作用。
[0119]
实施例4(预示性的)
[0120]
肝细胞癌(hcc)是一种致死的肿瘤,其在美国的发病率正在增加,主要是由于丙型肝炎感染的流行。hcc是最常见的原发性肝癌,也是全球癌症死亡的第二大原因。参见,ferlay j,soerjomataram i,dikshit r,eser s,mathers c,rebelo m,等人.cancer incidence and mortality worldwide:sources,methods and major patterns in globocan 2012.int j cancer.2015;136(5):e359-e386.doi:10.1002/ijc.29210。尽管在hcc的诊断和治疗中取得了重大进展,其预后仍然极差,5年总存活(os)率为12%,所有阶段加在一起(上文出处)。大多数hcc(80-90%)发展为潜在的慢性肝病(有或没有肝硬化);主要原因包括慢性乙型肝炎病毒(hbv)或丙型肝炎病毒(hcv)感染、饮酒、非酒精性脂肪性肝炎或其它不太常见的病因,诸如血色素沉着症、烟草和黄曲霉毒素b1。在东南亚和中非观察到hcc的最高发病率,其中慢性hbv感染的地方流行占病例的70%。参见,例如,pawlotsky jm.pathophysiology of hepatitis c virus infection and related liver disease.trends microbiol.2004;12(2):96-102;trepo c,等人,hepatitis b virus infection.lancet.2014;384(9959):2053-2063;morgan tr,等人,alcohol and hepatocellular carcinoma.gastroenterology,2004;127(5suppl 1):s87-s96;zhang dy,等人,fibrosis-dependent mechanisms of hepatocarcinogenesis.hepatology.2012;56(2):769-775;bugianesi e,等人,nash and the risk of cirrhosis and hepatocellular carcinoma in type 2diabetes.curr diab rep.2007;7(3):175-180;forner a,等人,hepatocellular carcinoma.lancet.2012;379(9822):1245-1255;和llovet jm,zucman-rossi j,pikarsky e,sangro b,schwartz m,sherman m,等人.hepatocellular carcinoma.nat rev dis prime.2016,每一篇关于hcc的背景通过引用
并入。
[0121]
目前推荐“巴塞罗那临床肝癌”(bclc)分类来评估预后并为hcc患者选择最合适的治疗方法(可在https://www.esmo.org/guidelines/gastrointestinal-cancers/hepatocell ular-carcinoma在线得到)。有五个bclc等级(0、a、b、c和d),它们既考虑了通过child-pugh评分评估的潜在肝功能,又考虑了根据东部肿瘤协作组表现状态(eastern collaborative oncology group performance status,ecog ps)的患者一般状况。保留给具有早期hcc(bclc 0期,a期)的患者的对hcc的唯一治愈性治疗方法是外科手术切除术、热消融、放射疗法和/或肝移植。尚未验证hcc的辅助治疗。
[0122]
hedgehog信号传递促进肿瘤相关的巨噬细胞极化以抑制肿瘤内的cd8 t细胞募集。参见,petty等人,journal of clinical investigation(2019),关于这样的试验方案通过引用并入本文。本公开内容的化合物tak-441可以与pd-1阻断联合施用以提供协同效力。也可参考文章:科学家发现靶向免疫肿瘤药物有时失败的原因(scientists discover reasons why targeted immuno-oncology drugs sometimes fail)(2019年10月23日),来自https://medicalxpress.com/news/2019-10-scientistsimmuno-oncology-drugs.html,关于这样的试验方案通过引用并入本文。这种协同作用可能特别适合治疗hcc。
[0123]
pd-1是t细胞上的检验点蛋白,t细胞是一类帮助身体识别体内的异常细胞和疾病的免疫细胞。pd-1通常充当“关闭开关”,其帮助防止t细胞攻击其它细胞。pd-1抑制剂用于选择性阻断这种蛋白并增强免疫应答以攻击癌细胞。此前报道的数据已经表明,一些癌症患者对pd-1疗法没有应答的一个主要原因是,战斗t细胞(称为cd8 t细胞)不能侵入肿瘤微环境,这种状态也称为“冷肿瘤”。在他们的研究中,yang等人报告的数据显示了限制cd8 t细胞浸润肿瘤微环境的能力的具体细胞机制。他们表明,hedgehog信号传递关闭了肿瘤相关的巨噬细胞的趋化因子分泌—这对cd8 t-细胞浸润是至关重要的。通过阻断(抑制)hedgehog途径,研究人员能够逆转该过程并促进cd8 t细胞浸润到肿瘤微环境中。数据表明,在包括肝癌和肺癌在内的临床前模型中,与pd-1阻断联合施用的hedgehog抑制剂在杀死癌细胞方面比单独的单一药剂更有效。
[0124]
hedgehog(hh)途径参与肝脏的胚胎发育,且其再活化在维持肝细胞癌(hcc)中的癌细胞生长和进展中起着重要作用。在肝癌形成中,肝胚胎细胞的分化、增殖和极性需要hh信号传导。hh组分在hcc组织中的高表达水平与间充质特性相关并维持癌症干细胞的增殖,这是hcc进展中恶性细胞的动态来源。临床前模型中hh抑制的目前数据进一步证实了hh的作用,并值得未来在临床环境中研究。参见,例如,implication of the hedgehog pathway in hepatocellular carcinoma,della corte,等人,world j gastroenterol.2017年6月28日;23(24):4330-4340。2017年6月28日在线公开。
[0125]
检验点抑制剂的例子可以包括以下一种或多种:pd-1抑制剂诸如派姆单抗纳武单抗和西米普利单抗pd-l1抑制剂诸如阿特朱单抗阿维鲁单抗和度伐单抗和ctla-4抑制剂诸如伊匹木单抗另外的检验点抑制剂包括曲美木单抗、agen1884、agen2034或agen1181。
[0126]
研究描述
[0127]
i/ii期临床试验(其为如实施例2中的开放、多中心和非随机化中的一个或多个),另外增加了施用检验点抑制剂,诸如pd1或ctla4抑制剂,如本文指出的。
[0128]
hedgehog抑制剂tak-441(其也可以被称作nlm001)可以以800mg/天的剂量(低于先前施用的最大值的一个剂量)施用4个周期,持续5天。在每个周期结束时,施用之后是检验点抑制剂的施用。据信,该组合表现出的效果高于单独的任一单一药剂所表现出的效果。
[0129]
在本文提供的实施例的一个方面,对患者的改善由以下一项或多项证明:
[0130]
代谢应答,
[0131]
正电子发射断层摄影术,
[0132]
根据标准的客观应答,
[0133]
无进展存活,
[0134]
总存活,
[0135]
基于肿瘤标志物的水平的应答,
[0136]
毒性,和
[0137]
肿瘤的弹性。
[0138]
在这点上,可以通过氟脱氧葡萄糖(fdg)测量代谢应答,可以根据eortc标准评价pet,可以根据recist(在实体瘤中的应答评价标准)标准评价客观应答,无进展存活如本文中定义,总存活如本文中定义,可以针对例如ca 19.9评价基于肿瘤标志物的水平的应答,可以根据例如common toxicity criteria for adverse events terminology(国立癌症研究所)4.03版(nci ctcae v4.03))评价毒性,并且可以通过弹性成像评价肿瘤的弹性,弹性定义为肿瘤组织和正常组织之间的商应变比。
[0139]
所有受试者将根据“意向性治疗(by treatment intention)”的原则被包括在效力分析中。已经至少接受第一个治疗周期的第一剂的所有受试者将被包括在毒性分析中。
[0140]
将针对每个受试者和测量时间以图形方式表示弹性指数。对于每个患者,将针对每个测量点计算该参数的变化。将借助于配对样品的非参数检验来对比不同点的值。将以相同的方式分析ca 19.9中的变化。
[0141]
将根据recist标准分析通过ct和/或mri得到的客观应答,将应答归因于每个受试者。将使用描述性统计总结研究的总体数据。也将使用eortc标准分析通过pet得到的应答。
[0142]
将以图形方式呈现每个受试者的生物标志物分析。将使用每个收集点的描述性统计汇总数据,包括治疗之前和之后比例变化的计算以及配对样品的非参数方法的对比。总体上,我们将使用先前发表在ga研究中的方法。
[0143]
同样地,药代动力学参数将以图形方式表示和可视化,并使用描述性统计进行总结。
[0144]
将使用描述性统计描述通过类型、频率、严重程度(按照美国国家癌症研究所不良事件通用术语标准(nci ctcae)4.03版分级)、时机、严重性和与研究治疗的关系表征的不良事件。
[0145]
总存活定义为在纳入日期与死亡日期之间逝去的时间。无进展存活定义为在纳入日期与进展日期(即开始二线治疗且没有记录下的进展或死亡)之间逝去的时间。将根据kaplan-meier方法用存活曲线研究两个变量。
[0146]
考虑到研究设计的探索性质,认为没有必要对所用试验的多样性进行修正。
[0147]
在所有统计检验中使用的显著性水平将是p=0.05的值,双边。
[0148]
分析的细节将反映在统计分析计划中,其将在研究数据库关闭前准备。
[0149]
在本说明书中引用的所有出版物、专利和专利申请通过引用并入本文,以用于使用此类引用的教导。
[0150]
以游离或盐形式使用用于本文所述实验的试验化合物。
[0151]
所观察到的具体应答可能根据并取决于所选择的特定活性化合物或是否存在载体以及所用制剂的类型和施用模式而变化,并且这样的预期的结果变化或差异是根据本发明的实践所涵盖的。
[0152]
尽管在本文中详细说明和描述了本发明的具体实施方案,但本发明不限于此。以上详细描述作为本发明的示例而提供,并且不应解释为构成本发明的任何限制。修改对于本领域技术人员将是显而易见的,并且不背离本发明的精神的所有修改都意图被包括在所附权利要求的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。