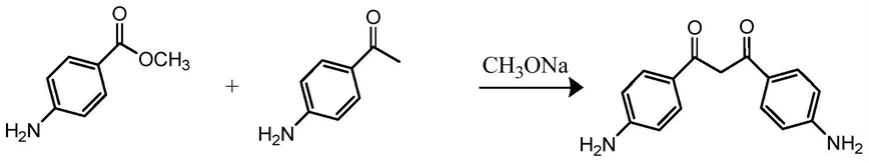
1.本发明涉及荧光分子探针技术领域,具体涉及一种新型近红外二区聚集诱导发光材料及制备方法、应用。
背景技术:
2.聚集诱导发光分子(aiegens)作为后起之秀已被广泛用作诊疗一体化试剂,这主要得益于可以通过简单的设计实现能量退激过程中辐射跃迁和非辐射跃迁之间的平衡。众所周知,螺旋桨状的aiegens在生理环境下更容易以无序的方式堆积,从而有效抑制分子内/分子间π-π堆积,从而提高荧光成像(fli)能力。另一方面,扭动的转子基元即使在具体状态下仍可以保持局部转动/振动,从而有利于通过非辐射途径消散激发态能量,可用于进行光热成像(pti)、光声成像(pai)和光热治疗(ptt)。
3.如今,aiegens在用于手术导航的第二个近红外生物窗口(nir-ii,1000-1700nm)中具有可接受的荧光量子产率(qy)和用于ptt的出色光热转换效率(pce)由于更高的组织结构而具有吸引力。与扩大骨架共轭程度以延长吸收/发射不同,含有强富电子供体(d)和强拉电子受体的d
–
π
–a–
π
–
d类型结构的nir-ii aiegens由于其光稳定性好,因而备受关注。尽管如此,与已被广泛研究的可见光和nir-i(700-900nm)aiegens相比,由于可供选择的发光分子给体选择有限使得nir-ii aiegens的设计与合成仍然是个挑战。
4.因此,现有技术还有待于进一步的提高。
技术实现要素:
5.本发明要解决的技术问题在于,针对现有构建近红外二区聚集诱导发光分子给体选择较少的局限、最大吸收波长很难突破800nm的问题,旨在丰富现有近红外二区聚集诱导发光分子材料储备库。
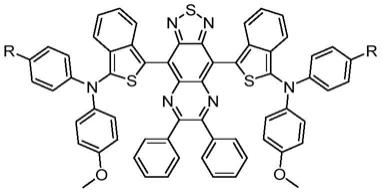
6.本发明解决该技术问题所采用的技术方案是:首次引入苯并[c]噻吩衍生物作为富电子给体基元,构筑新型近红外二区聚集诱导发光材料,其化学结构通式为:
[0007]
其中,所述的近红外二区聚集诱导发光材料,r独立地选自中的一种。
[0008]
基于苯并[c]噻吩电子给体衍生物的新型近红外二区聚集诱导发光材料的制备方法,其步骤包括:
[0009]
将化合物a、4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉、四三苯基膦钯依次加入超干甲苯溶剂中,在惰性气体保护下进行搅拌回流过夜,得到反应溶液;其中,所述化合物a的化学结构通式为:r独立地选自中的一种。
[0010]
反应结束后,向所述反应溶液中加入饱和氟化钾溶液并搅拌2~4h,然后使用乙酸乙酯进行萃取并合并有机相、干燥并减压浓缩处理,得到粗产物;
[0011]
以石油醚/四氢呋喃作为洗脱剂,通过硅胶柱色谱法对所述粗产物进行纯化,得到新型近红外二区聚集诱导发光材料。
[0012]
可选地,所述新型近红外二区聚集诱导发光材料的制备方法,其中,所述搅拌回流的温度为115~125℃,所述搅拌回流的时间为10~14h。
[0013]
可选地,所述的新型近红外二区聚集诱导发光材料的制备方法,其中,化合物a与4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉的物质的量比为2.5~3.5:1。
[0014]
可选地,所述的新型近红外二区聚集诱导发光材料的制备方法,其中,反应溶液中4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉的浓度为1~2m。
[0015]
可选地,所述的新型近红外二区聚集诱导发光材料的制备方法,其中,4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉与四三苯基膦钯的物质的量比为10~20:1。
[0016]
可选地,所述的新型近红外二区聚集诱导发光材料的制备方法,其中,所述对所述反应溶液进行淬灭后,萃取并合并有机相后,进行干燥及减压浓缩处理,得到粗产物的步骤包括:
[0017]
向所述反应溶液中加入饱和氟化钾溶液对反应进行淬灭,室温下搅拌2~4h;
[0018]
利用乙酸乙酯对反应溶液进行萃取,并对萃取后的反应溶液中的有机相进行合并;
[0019]
使用无水硫酸钠对合并有机相后的反应溶液进行干燥,并对干燥后的反应溶液进行减压浓缩处理,得到粗产物。
[0020]
一种如上所述的新型近红外二区聚集诱导发光材料在制备光热协同免疫诊疗一体化试剂中的应用。
[0021]
有益效果:本发明的近红外二区聚集诱导发光分子为具有新型d-π-a-π-d结构的聚集诱导发光材料,该类材料以不同取代的二苯胺结构单元作为分子体系中的第一个电子给体,以苯并[c]噻吩作为分子体系中的第二个电子给体或者π-桥,以6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉结构单元作为电子受体来构建具有近红外二区聚集诱导发光性质的新型光热材料;聚集诱导发光材料在808nm激光照射下可以引起肿瘤细胞的免疫原性死亡,其与pd-l1抗体相结合的免疫-光热协同治疗,可有效的抑制原位乳腺癌的转移和复发。
附图说明
[0022]
图1是本发明实施例提供的新型近红外二区聚集诱导发光分子的合成路线图;
[0023]
图2是本发明实施例1中制备的近红外二区聚集诱导发光分子alkoxy-bt-dptq在四氢呋喃中的核磁共振氢谱图;
[0024]
图3是本发明实施例1中制备的近红外二区聚集诱导发光分子alkoxy-bt-dptq在四氢呋喃中的核磁共振碳谱图;
[0025]
图4是本发明实施例2中制备的近红外二区聚集诱导发光分子tpe-bt-dptq在四氢呋喃中的核磁共振氢谱图;
[0026]
图5是本发明实施例2中制备的近红外二区聚集诱导发光分子tpe-bt-dptq在四氢呋喃中的核磁共振碳谱图;
[0027]
图6是本发明实施例3中制备的近红外二区聚集诱导发光分子tpa-bt-dptq在四氢呋喃中的核磁共振氢谱图;
[0028]
图7是本发明实施例3中制备的近红外二区聚集诱导发光分子tpa-bt-dptq在四氢呋喃中的核磁共振碳谱图;
[0029]
图8是本发明实施例1,2和3中制备的近红外二区聚集诱导发光分子在四氢呋喃中的紫外吸收光谱图;
[0030]
图9是本发明实施例1,2和3中制备的近红外二区聚集诱导发光分子在四氢呋喃中的荧光发射光谱图;
[0031]
图10是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps对4t1细胞的暗毒性和光热杀伤效果实验图;
[0032]
图11是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps对4t1细胞的光热引起免疫原性死亡验证图;
[0033]
图12是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps引起的光热对远端乳腺癌的免疫抑制实验图;
[0034]
图13是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps用于光热联合免疫治疗效果的实验图;
[0035]
图14是是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps用于近红外二区/光声/光热三模态成像导航的光热治疗示意图。
具体实施方式
[0036]
本发明提供的基于苯并[c]噻吩电子给体衍生物的新型近红外二区聚集诱导发光材料制备方法及其生物应用,为使本发明的目的、技术方案及优点更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
[0037]
多模式光诊疗一体化平台由于组成简单、可重复性强等因而表现出明显的优势,因而备受关注。聚集诱导发光分子(aiegens)可以通过简单的设计实现能量退激过程中辐射跃迁(提供荧光成像)和非辐射跃迁(提供光热治疗、光声/光热治疗)之间的平衡,此外还能通过单线态与氧气间发生能量交换产生单线态氧用于光动力治疗。
[0038]
光热治疗(ptt)可以将吸收的光转换为热量,使得肿瘤组织部位局部高温,从而实现肿瘤的高效消融。然而,单一模式的ptt对光源依赖性强,光源照射范围之外的微小肿瘤很容易发生转移和复发。此外,热休克蛋白(hsp)的上调表达可以增强癌细胞的耐热性,从
而降低ptt的效率。近年来,越来越多的研究发现光热试剂可以诱发细胞免疫原性死亡(icd),因此,通过联合光热治疗和免疫治疗,可以有效的实现肿瘤治疗并抑制肿瘤的转移和复发。
[0039]
aiegens除了其优异的成像能力(用于手术导航)之外,其聚集状态下局部转子的有效转动还能产生热量用于光热治疗/成像和光声成像。众所周知,具有较大二面角的扭曲分子结构,是赋予荧光分子发光体aie特性的关键因素。目前报道的基于aiegens的多模态光诊疗试剂存在穿透深度不足,发射波长较短等问题。鉴于a的选择相对有限,开发新型具有大位阻的d/π-桥是构建aiegens的另一可行选择。三苯胺及其衍生物经常用作d,然而其固有性质限制了吸收/发射波长的进一步延长。使用富电子的噻吩衍生物,例如3,4-乙二甲苯二氧噻吩(edot)和邻位烷基化噻吩作为d或者π-桥,不仅可以延长吸收/发射波长,还可以扭曲分子骨架以抑制π-π堆积形成聚集体。尽管已经取得了实质性进展,但开发新型d/π-桥以区分和丰富nir-ii aie治疗诊断试剂仍值得进一步研究。
[0040]
为了解决上述问题,本发明实施例提供了一种新型近红外二区聚集诱导发光分子材料,其中,化学结构通式为:其中,所述的近红外二区聚集诱导发光材料,r独立地选自导发光材料,r独立地选自中的一种。
[0041]
在本实施例中,所述新型近红外二区聚集诱导发光材料为具有新型d-π-a-π-d结构的聚集诱导发光材料,其分子结构中的6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉作为强电子受体,苯并[c]噻吩一方面作为富电子给体和π-桥,另一方面同时作为大位阻基团增加与受体基元间的二面夹角,使得整体分子骨架更加扭曲,保证其聚集诱导发光特性,强d-a作用可以延长吸收、发射波长。
[0042]
基于相同的发明构思,本发明还提供了一种上述新型近红外二区聚集诱导发光分子的制备方法,包括步骤:
[0043]
s1、将化合物a、4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉、四三苯基膦钯依次加入到超干甲苯溶剂中,在惰性气体保护下进行搅拌回流过夜,得到反应溶液;其中,所述化合物a的化学结构通式为:
[0044]
如图1所示,为本发明实施例中新型近红外二区聚集诱导发光分子的合成路线图,将化合物a、4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉、四三苯基膦钯依次加入到超干甲苯溶剂中,在惰性气体保护下进行搅拌回流过夜,得到反应溶液;其中,所述反应溶液中含有近红外二区聚集诱导发光材料。
[0045]
在一具体实施方式中,所述搅拌回流的温度为115~125℃,所述搅拌回流的时间为10~14h,化合物a与4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉的物质的量比为2.5~3.5:1;反应溶液中4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉的浓度为1~2m;4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉与四三苯基膦钯的物质的量比为10~20:1;在此反应条件和反应物比例下能够制备出性能稳定的近红外二区聚集诱导发光材料。
[0046]
s2、对所述反应溶液加入饱和氟化钾溶液并搅拌2~4h,然后使用乙酸乙酯进行萃取并合并有机相、干燥并减压浓缩处理,得到粗产物;
[0047]
在本实施例中,反应完成后,首先采用饱和氟化钾溶液对反应溶液进行淬灭,然后使用乙酸乙酯进行萃取,以去除部分杂质,并对萃取后的反应溶液中的有机相进行合并,然后使用无水硫酸钠对合并有机相后的反应溶液进行干燥,并对干燥后的反应溶液进行减压浓缩处理,得到粗产物。
[0048]
s3、以石油醚/四氢呋喃作为洗脱剂,通过硅胶柱色谱法对所述粗产物进行纯化,得到新型近红外二区聚集诱导发光材料。
[0049]
本实施例中,在获得粗产物后,以石油醚/四氢呋喃作为洗脱剂,通过硅胶柱色谱法对所述粗产物进行纯化,得到纯净的新型近红外二区聚集诱导发光材料。其中,石油醚与四氢呋喃的体积比为100:1~10:1。通过采用石油醚/四氢呋喃作为洗脱剂对得到的粗产物进行洗脱,去除有萃取无法去除的杂质物如反应原料等。
[0050]
基于相同的发明构思,本发明还提供一种上述所述新型近红外二区聚集诱导发光材料在光热协同免疫诊疗一体化试剂中的应用。新型近红外二区聚集诱导发光材料具备良好的光热转换效率,对4t1细胞进行光热杀伤时可以引起细胞的免疫原性死亡,释放肿瘤相关抗原(taa)和损伤相关分子模式(damp),进而刺激4t1细胞发生免疫应激,提高治疗效果,最终通过与pd-l1抗体相结合的免疫-光热协同治疗,可有效的抑制原位乳腺癌的转移和复发。对提高乳腺癌治疗效果具有非常重要的研究意义。
[0051]
下面通过具体实施例对本发明进行进一步的解释说明。
[0052]
实施例1
[0053]
如图1所示,在n2的保护下,将360mg化合物a(其中r为)、100mg 4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉与23mg四三苯基膦钯依次加入无水甲苯溶液中,在110℃下搅拌回流12h,待反应完全后加入饱和氟化钾溶液对反应溶液进行淬灭,然后使用乙酸乙酯进行萃取,并对萃取后的反应溶液中的有机相进行合并,然后使用无水硫酸钠对合并有机相后的反应溶液进行干燥,并对干燥后的反应溶液进行减压浓缩处理,以石油醚/四氢呋喃(100:1)作为洗脱剂得到133mg褐色粉末状固体产物,即新型近红外二区聚集诱导发光分子(alkoxy-bt-dptq),其中,alkoxy-bt-dptq的产率为65%。alkoxy-bt-dptq在四氢呋喃中的核磁共振氢谱图和核磁共振碳谱图如图2和图3所示。其在四氢呋喃中的紫外吸收光谱图如图8中所示。
[0054]
实施例2
[0055]
如图1所示,在n2的保护下,将437mg化合物a(其中r为)、100mg 4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉与23mg四三苯基膦钯依次加入无水甲苯溶液中,在110℃下搅拌回流12h,待反应完全后加入饱和氟化钾溶液对反应溶液进行淬灭,然后使用乙酸乙酯进行萃取,并对萃取后的反应溶液中的有机相进行合并,然后使用无水硫酸钠对合并有机相后的反应溶液进行干燥,并对干燥后的反应溶液进行减压浓缩处理,以石油醚/四氢呋喃(50:1)作为洗脱剂得到153mg褐色粉末状固体产物,即新型近红外二区聚集诱导发光分子(tpe-bt-dptq),其中,tpe-bt-dptq的产率为54%。tpe-bt-dptq在四氢呋喃中的核磁共振氢谱图和核磁共振碳谱图如图4和图5所示。其在四氢呋喃中的紫外吸收光谱图如图8中所示。
[0056]
实施例3
[0057]
如图1所示,在n2的保护下,将394mg化合物a(其中r为)、100mg 4,9-二溴-6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉与23mg四三苯基膦钯依次加入无水甲苯溶液中,在110℃下搅拌回流12h,待反应完全后加入饱和氟化钾溶液对反应溶液进行淬灭,然后使用乙酸乙酯进行萃取,并对萃取后的反应溶液中的有机相进行合并,然后使用无水硫酸钠对合并有机相后的反应溶液进行干燥,并对干燥后的反应溶液进行减压浓缩处理,以石油醚/四氢呋喃(10:1)作为洗脱剂得到145mg褐色粉末状固体产物,即新型近红外二区聚集诱导发光分子(tpa-bt-dptq),其中,tpa-bt-dptq的产率为43%。tpa-bt-dptq在四氢呋喃中的核磁共振氢谱图和核磁共振碳谱图如图6和图7所示。其在四氢呋喃中的紫外吸收光谱图如图8中所示。
[0058]
如图9所示,图9为实施例1-3中制备的新型近红外二区聚集诱导发光分子在四氢呋喃/水混合溶剂中的荧光发射光谱图,从图9中可以看出所合成的分子都具备聚集诱导发光的性质。
[0059]
如图10所示,图10是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子对4t1细胞的暗毒性和光热杀伤效果实验图;从图10可以看出,tpa-bt-dptq nps在20um范围内仍具有较低的细胞暗毒性,并具有优良的光热杀伤4t1细胞的能力。
[0060]
如图11所示,图11是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps对4t1细胞的光热引起免疫原性死亡验证图。从图11可以看出tpa-bt-dptq nps引起的过热杀伤4t1细胞的同时可以引起钙网蛋白的过表达。
[0061]
如图12所示,图12是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps引起的光热对远端乳腺癌的免疫抑制实验图;从图12可以看出tpa-bt-dptq nps引起的过热可以通过激活免疫系统同时实现对远端肿瘤的有效抑制。
[0062]
如图13至图14所示,图13是本发明实施例3中制备的近红外二区聚集诱导发光分子制备成的纳米粒子tpa-bt-dptq nps用于光热联合免疫治疗效果的实验图;从图13可以看出tpa-bt-dptq nps介导的光热治疗与pd-l1抗体介导的免疫治疗可以更好地实现对原
位乳腺癌的治疗,同时可以有效的抑制癌细胞的转移与复发。
[0063]
综上所述,本发明公开了一种基于苯并[c]噻吩电子给体衍生物的新型近红外二区聚集诱导发光材料制备方法及其生物应用,新型近红外二区聚集诱导发光分子的化学结构通式为:其中,所述的近红外二区聚集诱导发光材料,r独立地选自中的一种。本发明实施例提供的新型近红外二区为具有新型d-π-a-π-d结构的聚集诱导发光材料,其分子结构中的6,7-二苯基-[1,2,5]噻二唑[3,4-g]喹喔啉作为强电子受体,苯并[c]噻吩一方面作为富电子给体和π-桥,另一方面同时作为大位阻基团增加与受体基元间的二面夹角,使得整体分子骨架更加扭曲,保证其聚集诱导发光特性,强d-a作用可以延长吸收、发射波长。此外,所制备的tpa-bt-dptq nps具有优良光热转化效率,在808nm激光照射下可以引起细胞的免疫原性死亡,引起免疫应激反应,进一步联合pd-l1抗体介导的免疫治疗可以有效的抑制原位乳腺癌的转移与复发。
[0064]
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。